Oxígeno, Oxidos y Agua Oxigenada
Anuncio
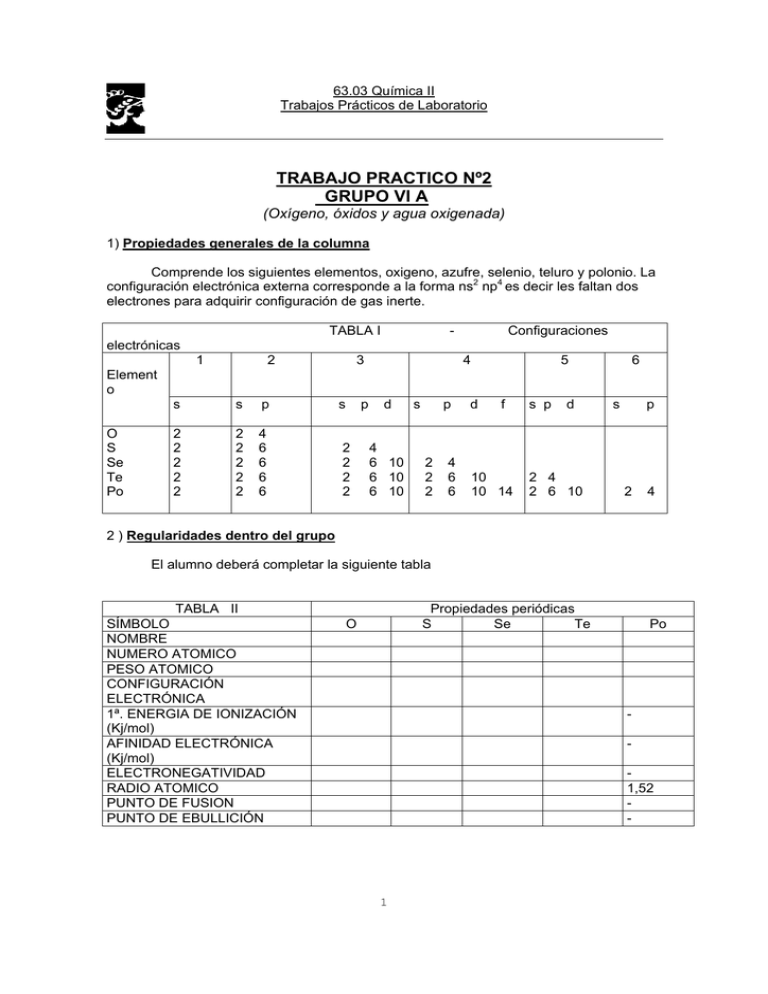
63.03 Química II Trabajos Prácticos de Laboratorio TRABAJO PRACTICO Nº2 GRUPO VI A (Oxígeno, óxidos y agua oxigenada) 1) Propiedades generales de la columna Comprende los siguientes elementos, oxigeno, azufre, selenio, teluro y polonio. La configuración electrónica externa corresponde a la forma ns2 np4 es decir les faltan dos electrones para adquirir configuración de gas inerte. TABLA I - Configuraciones electrónicas 1 2 3 4 5 6 Element o O S Se Te Po s s p s p 2 2 2 2 2 2 2 2 2 2 4 6 6 6 6 2 2 2 2 d 4 6 10 6 10 6 10 s p 2 2 2 4 6 6 d f 10 10 14 s p d 2 4 2 6 10 s p 2 4 2 ) Regularidades dentro del grupo El alumno deberá completar la siguiente tabla TABLA II SÍMBOLO NOMBRE NUMERO ATOMICO PESO ATOMICO CONFIGURACIÓN ELECTRÓNICA 1ª. ENERGIA DE IONIZACIÓN (Kj/mol) AFINIDAD ELECTRÓNICA (Kj/mol) ELECTRONEGATIVIDAD RADIO ATOMICO PUNTO DE FUSION PUNTO DE EBULLICIÓN Propiedades periódicas S Se Te O Po 1,52 - 1 63.03 Química II Trabajos Prácticos de Laboratorio Los elementos oxígeno y azufre son relativamente abundantes (46,6% y 0,052%) en las rocas ígneas; Los otros miembros de la familia son relativamente raros. Muestran una variación sistemática de sus propiedades, a medida que aumenta el número atómico. Así, el O y el S son no- metales, el Se y el Te son semiconductores mientras que el Po que es radioactivo presenta características metálicas. Comparando las electronegatividades de estos elementos con la de los correspondientes halógenos, se comprueba una marcada disminución en su capacidad para ganar electrones y formar aniones. A causa de sus electronegatividades más reducidas, comparadas con los de los halógenos, los elementos de este grupo presentan más frecuentemente estados de oxidación positivos; con excepción del oxigeno, cuando se pasa del S al Te los estados de oxidación más frecuentes son: +4 y +6, donde los enlaces son covalentes y donde usualmente se encuentran combinados con oxigeno. En este grupo, igual que en los demás grupos, el elemento más liviano, el oxigeno, tienen propiedades que difieren notoriamente de las de los elementos más pesados. Así el oxigeno es un gas diatómico y en su química presenta estados de oxidación negativos casi exclusivamente. Su tamaño pequeño le confiere gran poder oxidante y gran reactividad frente a una gran variedad de sustancias y desde un punto de vista químico, se asemeja más a los halógenos que al S, Se y Te. 3) Oxígeno a ) Estado natural El oxigeno es el elemento más abundante de la corteza terrestre; constituye el 49,5% de la masa de la corteza terrestre. El silicio, que le sigue en abundancia, alcanza solo la mitad de ese valor. Libre se encuentra en la atmósfera formando moléculas O2 . El aire contiene un 20% de oxigeno en volumen es decir de cada 100 1,20 l son de oxigeno. En masa constituye el 21% de la del aire. El oxigeno presenta el fenómeno de alotropía. Cuando se suministra energía al oxigeno, se forma el ozono: O3 . 3 O2 (g) + Energía eléctrica 2 O3 . b ) Preparación industrial I. A partir del aire: se lo extrae por licuefacción y destilación fraccionada del aire. Por repetición cíclica de este proceso se puede obtener oxigeno de 99,5% de pureza. II. A partir del agua: Se obtiene un oxigeno muy puro por electrólisis, como subproducto en la preparación del hidrógeno. III. En el laboratorio: Se suele preparar por descomposición térmica del KClO3 en presencia de un catalizador como el MnO2, o por calentamiento de distintos óxidos como HgO, BaO2 , H2O2 o sales como NaNO3 ó KMnO4 . 4 ) Estados de Oxidación Excepto en los fluoruros de oxigeno, este elemento presenta un estado de oxidación negativo en todos sus compuestos. (ver tabla III) 5 ) Óxidos: Clasificación: 2 63.03 Química II Trabajos Prácticos de Laboratorio Todos los elementos, con excepción de los gases inertes, forman óxidos. Pueden clasificarse en seis grupos principales, de acuerdo con su comportamiento químico. a ) Óxidos neutros No presentan tendencia a formar sales, ni con ácidos, ni con bases. Ej. NO, CO. b ) Óxidos básicos Son de carácter iónico y corresponden a elementos situados a la izquierda de la tabla periódica. Así, el óxido de bario ( BaO ) contiene iones Ba2+ y O2- y, al igual que todas las sustancias iónicas, es sólido a temperatura ordinaria. Con el agua, el anión óxido reacciona dando soluciones básicas: O2-(s) + H2O(l) 2OH-(aq) Por esta razón se da el nombre de óxidos básicos a los óxidos iónicos. Na2 O (s) + H2O (L) NaOH (aq) Cuando los óxidos básicos se tratan con ácidos forman sales y agua. Ej.: CuO(s) + 2HNO3(aq) Cu(NO3)2(aq)+ H2O(l) -2 -1 TABLA III - Estados de Oxidación del Oxígeno Es el estado de oxidación más frecuente. Se incluyen los óxidos, algunos iónicos y otros covalentes; los oxoácidos, las bases y las sales. Ej.: BaO, H2O, P2O5 , NaOH, CaSO4, , H2SO4, H3PO4, etc. Los compuestos cuyo oxígeno posee este número de oxidación, se denominan peróxidos y se caracterizan por el enlace o-o. Ej.: Na2O2, SrO2, BaO2, H2O2 +1 Se forman con el K, Rb y Cs. Son sólidos iónicos del tipo MO2 y se denominan superóxidos. El anión O2-, hiperóxido, existe únicamente en el estado sólido. Ej.: KO2, RbO2 . O2 y O3. El O2F2 difluoruro de dioxígeno se obtiene haciendo pasar una descarga eléctrica a través de una mezcla de fluor y oxigeno a –100ºC +2 El difluoruro de oxígeno, OF2, se obtiene haciendo pasar F2 a través de una solución diluida de NaOH. -1/2 0 2 F2(g) + 2OH-(aq) 2F-(aq) + OF2 (g) + H2O(l) c ) Óxidos ácidos Los elementos de la derecha de la tabla periódica comparten electrones con el oxígeno, dando compuestos covalentes. Muchos son gases a temperatura ambiente. Se disuelven en agua dando soluciones ácidas: SO2(g) + H2O (l) H2SO3 (aq) Con las bases dan sales: 3 63.03 Química II Trabajos Prácticos de Laboratorio CO2(g) + 2 NaOH (aq) Na2CO3(aq) + H2O(l) d ) Óxidos anfóteros: Los elementos situados hacia el centro de la tabla dan óxidos anfóteros. Se caracterizan por ser capaces de neutralizar a los ácidos y a las bases. ZnO(s) + 2 HCl (aq) ZnCl2 (aq) + H2O(l) ZnO(s) + 2 NaOH(aq) + H2O(l) Na2 Zn(OH)4 (tetrahidroxozincato (II) de sodio) Ej.: PbO, As2O3, Sb2O3, SnO, Al2O3. e ) Polióxidos ( actúan como oxidantes) Son óxidos de metales, donde este se encuentra con su mayor número de oxidación. Se caracterizan por desprender O2 por calentamiento; con ácidos diluidos desprenden O2 y dan los cationes de menor estado de oxidación; con solución de halogenuros desprenden el halógeno correspondiente. Ej.: PbO2, MnO2 I) PbO2 (s) + 4 HCl ( conc. y frío) PbCl4 (aq) II ) PbO2 ∅ ∅ PbCl4 (aq) + 2 H2O (l) Cl2 (g) + PbCl2 (aq) PbO (s) + ½ O2 (g) f ) Peróxidos En estos compuestos el oxígeno posee estado de oxidación –1 . Se caracteriza por formar H2O2 al ser tratados con un ácido diluido. BaO2 (s) + H2SO4 (aq) H2O2 (aq) + BaSO4 (s) g ) Óxidos compuestos o salinos Se comportan como si estuvieran formados por dos óxidos. Ej.: Pb3O4, Fe3O4 y Mn3O4 Ej. : Pb3O4 (s) + 4 HNO3 (aq) 2Pb(NO3)2(aq) + PbO2(s) + 2 H2O(l) El Pb3O4, minio, se comporta como si fuera la sal de Pb del ácido débil correspondiente al es decir: Pb2 PbO4 o tetraoxoplumbato (IV) de plomo (II) 6 ) Agua oxigenada a ) Preparación industrial I ) Electrólisis de H2SO4 II) Métodos químicos 4 63.03 Química II Trabajos Prácticos de Laboratorio I)Método electrolitico Electrolito H2SO4 60% δ= 1,35 a 1,45 g/cm3 Electrodos inertes (Pt) Temperatura 0º i ) Reacciones correspondientes a la electrolisis cátodo ánodo 2 H+(aq) + 2e 2 SO42- (aq) H2 (g) S2O82-(g) + 2e H+ + 2 SO42- S2O8 + H2 ión hexaoxoperoxodisulfato. i ’) Destilación a presión reducida H2S2O8 (aq) + 2 H2O (l) 2 H2SO4 (l) + H2O2 (aq) II ) Métodos químicos – i ) A partir de BaO2 El peroxido de Ba se obtiene calentando Ba sólido con oxigeno gaseoso a una presión de 3 atmósferas. Tratando el peróxido sólido con solución de ácido sulfúrico se obtiene H2O2 BaO2 (s) + H2SO4 (aq) BaSO4 (s) + H2O2 (l) i ’) Método orgánico – A partir de derivados de la quinona Se basa en la siguiente reacción: OH R R H2 O OH O2 O O R O b ) Preparación en el laboratorio Tratando los peróxidos sólidos con soluciones ácidas se forma peróxido de hidrogeno, H2O2 : BaO2 (s) + 2 H+ (aq) Ba2+(aq) + H2O2 (aq) Las soluciones de peróxido de hidrogeno son inestables y se descomponen: 2 H2O2 (aq) 2 H2O (l) + O2 (g) 5 63.03 Química II Trabajos Prácticos de Laboratorio Esta descomposición es lenta, pero se acelera por impurezas y la presencia de luz; por estas razones, es necesario, guardar las soluciones en frascos oscuros, a temperatura baja y con algún agregado para inhibir la descomposición. Se llama titulo, de una solución de peróxido de hidrógeno al volumen de O2, medido en C.N. que se desprende por unidad de volumen de solución. Así el agua oxigenada al 3% se lo denomina de “10 volúmenes” pues produce 10 cm3 de O2 por cada cm3 de solución. En solución acuosa actúa como un ácido débil H+ (aq) + HO2- (aq) ; Kif = 1,55 x 10-12 ion hidrogenoperoxido Debido a que el oxigeno también presenta los estados de oxidación 0 y –2, el H2O2 , donde el oxigeno actúa con numero de oxidación –1, puede oxidarse o reducirse ya sea en medio ácido o en medio básico. H2O2 (aq) Acción Oxidante H2O2 + 2 H+ + 2 e HO2- + H2O + 2 e Ion hidrogenoperoxo Acción Reductora H2O2 O2 + 2 H+ + 2e ; Eº = -0,68 V(medio ácido) HO2 + OH O2 + H2O + 2e ; Eº = 0,076 V (medio básico) Ion hidrogenoperoxo 2 H2O ; Eº = 1,77 V (medio ácido ) 3 OH- ; Eº = 0,87 V (medio básico) 7 ) Formulas electrónicas y configuración espacial de algunas sustancias. Esta formula esta de acuerdo con el paramagnetismo que presenta, pero no cumple con la regla del octeto, ni explica que el enlace o-o le corresponda una energía de unión, mayor que la correspondiente a un enlace simple. Molécula de oxigeno. Molécula de ozono H H 105º 0.96A H H 0.96A 6 63.03 Química II Trabajos Prácticos de Laboratorio Agua H 97º 94º 97º H Peróxido de hidrógeno 2- Ión óxido 2- ión peróxido E. Parte experimental 1) Preparación de oxigeno: 1. a) Tomar tres tubos de ensayos (Pyrex). Introducir en cada uno (tomar una punta de espátula: Tubo 1: peróxido de bario Tubo 2: nitrato de sodio Tubo 3: clorato de potasio Calentarlos a fuego directo. Probar en cada caso la presencia del oxigeno, acercando una astilla en ignición a la boca del tubo. Nota : en el caso del nitrato de potasio y el clorato de potasio seguir calentando luego de la fusión de las sustancias un poco más. Observaciones: Tubo 1: Tubo 2: Tubo 3: Ecuaciones: Tubo 1: Tubo 2: Tubo 3: 7 63.03 Química II Trabajos Prácticos de Laboratorio 1b) Reacción catalítica del dióxido de manganeso Ensayar la influencia del Dióxido de manganeso en la descomposición del Clorato de potasio de la siguiente manera: Fundir alrededor de 1 g de KClO3 en tubo de ensayo, retirar de la llama y añadir inmediatamente con una espátula, alrededor de ¼ g de MnO2. Observaciones: Ecuaciones: 2 ) Estudio de las propiedades del oxigeno 2. a ) Montar el aparato de acuerdo al esquema, verificar su cierre. Llenar dos frascos de 250cm3 con agua. Taparlos con una placa de vidrio. Agregar en el matraz unos 100 cm3 de agua oxigenada (de 10 volúmenes) y luego, alrededor de 2 g de MnO2 desleídos en 10 cm3 de agua por el tubo de seguridad. Desperdiciar las primeras burbujas de O2 producido. Posteriormente, llenar los dos tubos con oxigeno. Cuando dentro de cada tubo quede todavía un poco de agua, retirar el tubo de salida, poner sobre la boca del tubo un tapón y colocarlo sobre la gradilla. Observaciones: 8 63.03 Química II Trabajos Prácticos de Laboratorio Ecuaciones: 2b ) Tomar con la espátula una cantidad de fósforo rojo igual a la cabeza una cerilla. Quemar en el mechero e introducirla en un tubo con oxigeno. Comparar el brillo del fósforo que quema en oxigeno con el que quema en aire. Terminada la reacción agregar agua, agitar y tomar reacción al tornasol. Observaciones: Ecuaciones: 2. c )Tomar con la pinza de crisol un trozo de cinta de Mg y ponerlo en contacto con la llama hasta que comience la asignación. Arrojarlo rápidamente dentro del recipiente con oxigeno. Observaciones: Ecuaciones: 2) Ensayos con diversos tipos de óxidos. Disponer de los óxidos siguientes: CaO, solución de SO2, ZnO, PbO, PbO2, ,MnO2 y BaO2. Los óxidos deben dividirse en cantidades muy pequeñas para su ensayo con los diversos reactivos. Recordar que además de las características ácido-base hay que considerar la solubilidad de los mismos (Kps). 3 a) Acción de la solución acuosa sobre el papel de tornasol. Añada una punta de espátula del óxido a 1cm³ de H2O y agite bien (en el caso de la solución de SO2, colocar 1cm³ de esta en un tubo de ensayo). En caso de ser el óxido soluble, observar el comportamiento del papel tornasol: Vira al azul Óxido básico o anfótero o peróxido Vira al rojo Óxido ácido (anhidrido) 3 b) Acción del NaOH Caliente en un tubo de ensayo una punta de espátula del óxido con solución de NaOH. El óxido se disuelve Óxido ácido o anfótero 9 63.03 Química II Trabajos Prácticos de Laboratorio 3 c) Acción del HNO3 (aq) Caliente lentamente una punta de espátula del óxido en un tubo de ensayo después de adicionar HNO3 dil. El óxido se disuelve Óxido básico o anfótero 3 d) Acción del HCl concentrado. Caliente aproximadamente una punta de espátula del óxido con 1-2 cm³ de HCl en un tubo. Verifique la presencia de cloro en el gas producido por su acción sobre el papel tornasol seco. El gas decolora el papel peróxido o polióxido El óxido se disuelve sin liberación de cloro óxido básico o anfótero 3 e) Acción de solución de KI. En un tubo de ensayo introduzca una punta de espátula del óxido y 2 cm³ de solución de KI acidulada con un volumen igual de HCl diluído. Agregue a continuación unas cuantas gotas de solución de almidón. La solución se pone marrón Peróxido o polióxido y el almidón origina color azul 1) Completar el cuadro siguiente indicando si el óxido es o no soluble, color al tornasol en caso de que sea soluble, si produce cloro, etc. CaO SO2(ag) ZnO PbO PbO2 MnO2 BaO2 Óxidos Reactivos Agua y tornasol Solución de NaOH HNO3 diluído HCl concentrado Sol. KI y luego sol almidón Clasificación 2) Escriba las ecuaciones moleculares e iónicas. En los procesos redox iguale por el método ión electrón. 10 63.03 Química II Trabajos Prácticos de Laboratorio 4) Preparación de peróxido de hidrógeno 4 a) Disolver alrededor de 1 g de peróxido de sodio en 50 cm3 de agua agregando el sólido en pequeñas cantidades y enfriando la solución bajo una corriente de agua fría. Agregar ácido sulfúrico diluido hasta que la solución sea ácida al papel de tornasol. Reservar la solución para ensayos de reconocimiento y estudio de las propiedades. Ecuaciones: 4b ) Ensayo de reconocimiento Colocar en un tubo de ensayos 5 cm3 de la solución y añadir 5 gotas de K2Cr2O7 acidulado. Añadir inmediatamente 2 cm3 de éter, agitar la mezcla. PRECAUCION: EL ETER ES MUY INFLAMABLE; NO ACERCAR A LOS MECHEROS Observaciones: Ecuaciones: 4c ) Agregar alrededor de 1 g de peróxido de bario a 50 cm3 de agua y agitar bien la suspensión. Agregar H2SO4 dil. hasta que la solución sea ácida en papel de tornasol. Filtrar una porción de la solución sea ácida al papel de tornasol. Filtrar una porción de la solución y ensayar en el filtrado la presencia del peróxido. Observaciones: Ecuaciones: 5) Estudio de las propiedades del peróxido de hidrógeno 5a ) Acidificar 5cm3 de una solución diluida de KI con aproximadamente 1 cm3 de HCl diluido. A esta solución agregar primero alrededor de 5 cm3 de solución de peróxido de hidrógeno y luego de unas gotas de solución de almidón. Observaciones: Que ocurre en esté caso con el peróxido de hidrogeno? Ecuaciones: 11 63.03 Química II Trabajos Prácticos de Laboratorio 5b ) Preparar una capa de sulfuro de sodio de sobre una tira de papel de filtro. Para ello sumergir el papel de filtro en una solución de acetato de plomo y luego dejar caer unas gotas de una solución de sulfuro de sodio sobre el papel. Sumergir la tira de papel. Sumergir la tira de papel en un tubo de ensayo que contenga 5 cm3 de solución de H2O2 y permitir que se estacione. Nota: dado que la reacción no es instantánea se deberá reservar el tubo de la gradilla unos 15 minutos antes de observar algunos variación Observaciones: Ecuaciones: 5c) Añadir a una solución de NaOH otra de AgNO3 hasta que se forme un precipitado pardo de oxido de plata. luego añadir la solución de peróxido de hidrógeno Observaciones Que ocurre en esté caso con el peróxido de hidrogeno? Ecuaciones 5d)Colocar en un tubo de ensayos 5 cm3 de solución de KMnO4, acidificar el medio agregando unos pocos cm3 de H2SO4 diluido Y luego verter suficiente cantidad de solución de H2O2 para reaccionar con el KMnO4. Dejar el tubo en observación. Observaciones: Ecuaciones: 5. e) Titulación de una solución de H2O2 Soluciones necesarias KMnO4 (0,1 N) H2SO4 (1 + 4) Material necesario Bureta Erlenmeyer 12 63.03 Química II Trabajos Prácticos de Laboratorio H2O2 (Solución problema) En base a la reacción estudiada en 4 c ) se puede determinar la concentración de una solución de H2O2. a ) Colocar en un erlenmeyer de 250 cm3, 10 cm3 de solución problema de H2O2(medidos con bureta), agregar 50 cm3 de agua destilada y 15 cm3 de solución de ácido sulfúrico (1+4 ), agitar. b ) Llenar una bureta con solución de permanganato de potasio (0,1 N), leer Vo (Volumen Inicial). c ) Agregar gota a gota solución de KMnO4 a la solución del erlenmeyer, agitando después de cada adición, hasta que una gota en exceso produzca un color rosado tenue persistente durante mas de un minuto. Leer en la bureta Vf (Volumen final) d ) Repetir la operación con otra muestra Muestra N° 1 Vf KMnO4 = Vi KMnO4 = V total KMnO4 Muestra N°2 cm3 cm3 Vf KMnO4= Vi KMnO4= cm3 V total KMnO4 Cálculos En base a la ecuación estequiométrica balanceada calcular 1 ) N° de moles de H2O2 en la muestra 2)% P/V de H2O2 en la muestra 3) Titulo de la solución de agua oxigenada 4) Calcular el error cometido en la determinación. 13 cm3 cm3 cm3





