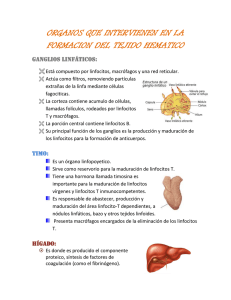
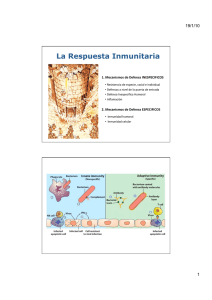
TABLA 1.1. Múltiples tejidos, células y moléculas
Anuncio

TABLA 1.1. Múltiples tejidos, células y moléculas intervienen de manera coordinada en la respuesta inmune. Nótese que la inmunidad innata es mucho más efectiva cuando actúa en colaboración con la adaptativa (fig. 1.1) Inmunidad innata Inmediata (sg) Moléculas Células Inducida (horas/días) Inmunidad adaptativa (semanas) Complemento Citocinas Citocinas Lisozima Mediadores de la inflamación Anticuerpos Proteínas de fase aguda (SAP, CRP, MBL, LBP) Interferones Defensinas Citolisinas Moléculas HLA Macrófagos Linfocitos NK Linfocitos T Mastocitos Eosinófilos Basófilos Endoteliocitos Neutrófilos Células dendríticas (T) Linfocitos B FDC (B) Órganos y tejidos de interacción Zonas infectadas, barreras físicas Bazo Ganglios MALT Órganos y tejidos de producción Hígado (complemento, fase aguda, citocinas) Médula ósea (leucocitos) Timo (T) Médula ósea (B) Sistemas de circulación Sangre Linfa Sangre FDC: Follicular dendritic cell (célula dendrítica folicular); SAP: Serum amyloid protein (proteína amiloide del suero); MBL: Manose-binding lectin (lectina que se une a la manosa); LBP: Lypopolysaccharide-binding protein (proteína que se une al lipopolisacárido); MALT: Tejidos linfoides asociados a mucosas. TABLA 1.2. Mecanismos generadores de enfermedad por fallo de la inmunidad. El exceso de respuesta frente a antígenos inocuos, propios o ajenos, y el exceso o la falta de respuesta a los patógenos producen múltiples enfermedades. El mejor conocimiento de los mecanismos implicados en cada caso puede ayudar a prevenirlas o curarlas. INMUNIDAD Errónea ANTÍGENO Inocuo Excesiva Dañino Defectuosa ENFERMEDAD Propio Autoantígeno Autoinmunidad Ajeno Aloantígeno Rechazo Alergeno Alergia Patógeno Hipersensibilidad Inmunodeficiencia TABLA 2.1. Algunas sustancias secretadas por macrófagos y granulocitos. MACRÓFAGOS/ NEUTRÓFILOS MASTOCITOS/ BASÓFILOS EOSINÓFILOS Enzimas hidrolíticos (digieren bacterias o tejidos) Lisozima Colagenasa, Gelatinasa Elastasa, Catepsina G Hidrolasas ácidas Triptasa Quimasa Hidrolasas ácidas Colagenasa Arilsulfatasa Hidrolasas ácidas Metabolitos del oxígeno y otras enzimas asociadas (matan bacterias) Mieloperoxidasa Óxido nítrico Peróxido de hidrógeno Superóxido Radicales hidroxilo Metabolitos del ácido araquidónico (inflamación) Leucotrienos Prostaglandinas Leucotrienos Prostaglandinas Tromboxanos SRS Citocinas y quimiocinas (inflamación y quimiotaxis) IL1,6,8,12 TNFα IFNα,β IL3,4,5,6 TNFα GM-CSF Factores quimiotácticos de neutrófilos y eosinófilos Otras Complemento Factor agregador de plaquetas Histamina (inflamación) Heparina Peróxido de hidrógeno Superóxido Leucotrienos Prostaglandinas Tromboxanos Proteína básica (lisis) Proteína catiónica y proteína X (neurotóxicas) TABLA 2.2. La gestión celular de los antígenos. Las células de la inmunidad innata son capaces de unirse a los patógenos mediante receptores innatos que reconocen componentes, generalmente azúcares de su membrana o pared celular (MR-receptor de manosa; SR-scavenger receptor o receptor de detritos; LPSR-receptor de lipopolisacáridos). Pero lo hacen mejor si están opsonizados con complemento (CR-receptor de complemento), Igs (FcR-receptor para las Igs) o PCR (proteina C-reactiva). Los linfocitos NK, Tγδ y Tc, reconocen y lisan células infectadas por virus, los primeros de manera innata, los demás de manera adaptativa. Los fagocitos mononucleares y los dendrocitos aprovechan lo que engullen para procesarlo y presentarlo sobre sus moléculas MHC a los linfocitos Th, a los que activan. Los linfocitos B, en cambio, se activan con el antígeno nativo o retenido en los ganglios por las FDC (células dentríticas foliculares). MR SR LPSR Inmunidad Célula Receptor Antígeno/Patógeno Receptor Célula Innata Fagocito MR Nativo/Polisacáridos – – (patógeno) Dendrocito SR Nativo/Pared Nucleada FcR Inflamocito LPSR Nativo LPS FcR Opsonizado (Ig) CR Opsonizado (C) NKRP1 Azúcares varios KIR Péptido propio MHC-I FcR Opsonizado (Ig) – Linfocito T γδ TCR γδ Micobacterias Herpesvirus ? Linfocito Tc CD8 TCRαβ Peptidos cortos (citoplasma) MHC-I Linfocito Th CD4 TCRαβ Peptidos largos (endosoma) MHC-II Dendrocito Macrófago Linfocito B Linfocito B BCR Nativo – – (patógeno) FcR Opsonizado (Ig) FcR CR Opsonizado (C) CR Dendrítica folicular (FDC) CR Linfocito NK NKRP1 KIR TCR CD8 CD4 TCR BCR Adaptativa TABLA 3.1. Isotipos de anticuerpos humanos y sus funciones. Anticuerpo Subtipo Nicho IgA IgA1 IgA2 1 1 IgD – IgE IgG IgM Concentración Estructura Función principal 2 0,5 Mono-, di-, trímero 2 < 0,5 Monómero sérica (mg/ml) Actividad biológica C N FcR Inmunidad mucosal + ++ + _ _ Desconocida _ _ _ _ _ – 2 < 0,1 Monómero Respuesta a parásitos _ _ _ _ ++ IgG1 IgG2 IgG3 IgG4 2 2 2 2 9 3 1 0,5 Monómero Monómero Monómero Monómero Respuesta secundaria a los patógenos Inmunidad neonatal ++ ++ ++ ++ + _ 3 1,5 Pentámero Respuesta 1.ª a patógenos ++ + _ _ _ NK Mast (1) Mucosas. (2) Tejidos y sangre. (3) Sangre y tejidos inflamados. Fagocitos C: Activación del complemento. N: Neutralización de patógenos. FcR: Unión a receptores para Fc que inducen endocitosis (en fagocitos) y/o exocitosis (en NK, mastocitos, eosinófilos). TABLA 3-2. Receptores para las moléculas de inmunoglobulina (FcR). Nombre CD Isotipo reconocido IgG1 IgG2 IgG3 IgG4 + +++ ++ FcγRI* 64 ++ FcγRII A,B 32 + FcγRIII A,B 16 ++ IgE IgA IgM IgD ++ + ++ + FcεRI* +++ FcεRII 23 FcαR 89 + + FcμR + FcδR FcRn* poli IgR (SC)* SC - componente secretor * - unen Ig libre + ++ + ++ + ++ + Distribución celular Función Fagocitos, dendrocitos Endocitosis/exocitosis (ADCC) Fagocitos, mastocitos, basófilos, dendrocitos, linfocitos B y plaquetas Inhibición Fagocitos, mastocitos, linfocitos NK Exocitosis/endocitosis Mastocitos, basófilos, eosinófilos Exocitosis/endocitosis Linfocitos, monocitos, eosinófilos Exocitosis/endocitosis Fagocitos Endocitosis/exocitosis (ADCC) Linfocitos activados ? Linfocitos activados ? Epitelio intestinal neonatal y placenta Transcitosis de IgG materna Epitelio mucosal adulto Transcitosis/estabilización de IgA (y M) polimérica TABLA 4.1. Las proteínas del complemento. Componente Producto de activación Función Vía clásica C1 (C1qr2s2) Inicia la vía clásica. Une complejos antígeno-anticuerpo C1q Une la porción Fc de la IgG o la IgM unida a antígeno C1r C1r Serina-proteasa que rompe C1s C1s C1s Serina-proteasa que rompe C4 y C2 C4 C4a C4b C4a es una anafilotoxina C4b se une covalentemente a superficies activadoras, donde forma parte de la convertasa C3. También actúa como opsonina C2 C2a y C2b C3 C3a C3b C2a es una serina proteasa que forma parte de las convertasas de C3 y de C5 C3a es una anafilotoxina C3b se une covalentemente a superficies activadoras, donde forma parte de la convertasa de C3 y de C5 También actúa como opsonina Vía de las lectinas MBL o MBP MASP Une manosa y fucosa MASP Serina-proteasa que rompe C4 y C2 C3 C3b Se une covalentemente a patógenos Factor B Ba y Bb Factor D D Vía alternativa Factor P (Properdina) Bb es una serina-proteasa que forma parte de las convrtasas de C3 y C5 Proteasa que circula en forma activa y rompe al factor B Estabiliza la convertasa de C3 de la vía alternativa, a la que se une Fase lítica (complejo de ataque a la membrana o MAC) C5 C5a C5b C5a es una anafilotoxina C5b inicia el ensamblaje del MAC C6 Componente del MAC C7 Componente del MAC C8 Componente del MAC C9 Polimeriza para formar poros en la membrana Componente del MAC Abreviaturas: MAC, complejo de ataque a la membrana; Ig, inmunoglobulina. TABLA 4.2. Las proteínas reguladoras del complemento. Proteína Componente regulado Función Proteínas reguladoras solubles C1 inhibidor C1r, C1s C4bp (proteína que une C4) C4 Acelera la destrucción de la convertasa de C3 (C4b2a) de la vía clásica Actúa como cofactor para la proteólisis de C4b por el factor I Factor H C3b Acelera la destrucción de la convertasa de C3 (C3bBb) de la vía alternativa Actúa como cofactor para la proteólisis de C3b por el factor I Factor I C4b, C3b Proteína S (vitronectina) C5b-C7 Se une al complejo C5b-C7 e impide la inserción del MAC en la membrana C5b-C7 inhibitor) Similar a la anterior. También llamada clusterina o CLI (complement lysis SP-40,40 (clusterina) Inhibidor de serina-proteasas que se une covalentemente a C1r y C1s bloqueando su capacidad de participar en la vía clásica Rompe o inactiva proteolíticamente C4b y C3b, usando C4bp, factor H, CR1 ó MCP como cofactores Proteínas reguladoras de membrana CR1(CD35) C3b, C4b Acelera la disociación de las convertasas de C3 de la vía clásica y alternati- va (receptor del complemento tipo 1) Actúa como cofactor de la proteólisis de C4b y C3b por el factor I (fig. 16.1). Amplia distribución tisular MCP(CD46) (proteína cofactor de membrana) C4b C3b Actúa como cofactor de la proteólisis de C4b y C3b por el factor I. Amplia distribución tisular. Inhibe la lisis de células propias. DAF(CD55) (factor acelerador del decaimiento) C4b2a C3bBb Acelera la disociación de las convertasas de C3 de la vía alternativa y clásica. Amplia distribución tisular. Inhibe la lisis de células propias. CD59 (protectina) y HRF (factor C8, C9 Inhiben la lisis de células propias. Amplia distribución tisular Bloquean la unión de C8 a C9, impidiendo la inserción del MAC en bicapas lipídicas autólogas y su posterior lisis TABLA 4.3. Los receptores del complemento. Receptores de complemento Ligandos principales Función Distribución tisular principal CR1 (CD35) C3b,C4b Transporta inmunocomplejos para su eliminación. Estimula la fagocitosis Todas las células de la sangre (incluso eritrocitos) salvo plaquetas CR2 (CD21) C3dg, iC3b C3d Activación de linfocitos B por inmunocomplejos Linfocitos B Células dendríticas foliculares CR3 (CD11b/CD18) iC3b, LPS, fibrinógeno Estimula la fagocitosis Fagocitos CR4 (CD11c/CD18) iC3b Estimula la fagocitosis Fagocitos C1qR C1q Estimula la fagocitosis y la eliminación de inmunocomplejos Monocitos, macrófagos, plaquetas, endoteliocitos C5aR (C4aR, C3aR) C5a (C4a, C3a) Activación y quimiotaxis Fagocitos, mastocitos, basófilos Tabla 7.1. Nombre Cadenas de las moléculas de histocompatibilidad. Clase Distribución celular Función (=) α β I I Prácticamente ubicua α β II II Linfocitos B Presentación de Macrófagos péptidos a los Monocitos linfocitos Tαβ CD4+ Dendrocitos Epiteliocitos tímicos (*) (+) (=) Presentación de péptidos a los linfocitos Tαβ CD8+ EC: Extracelular. TM: Transmembrana. CT: Citoplasmático. Poli/monomórficas. Aumentable o inducible con ciertas citocinas. Puentes disulfuro intracatenarios Cromosoma 44 12 2 1 6 15 32-34 29-32 1 2 6 6 Peso molecular (kD) Regiones (+) Glicosilación Fosforilación Poli Mono α1α2 α3 – β α1 β1 α2 β2 N.º aproximado de aminoácidos (*) EC TM CT Sí No Sí No 270 25 30 100 0 0 Sí Sí No No 180 25 10 180 25 10 Tabla 7.2. Moléculas de histocompatibilidad en humanos (HLA). Este es un listado parcial del polimorfismo posible, ya que sólo recoge las moléculas para las que existen reactivos (normalmente anticuerpos) que las identifican. El polimorfismo posible, atendiendo a la secuencia genética, es mucho mayor (fig. 7.3). Algunas moléculas antes se agrupaban bajo un mismo nombre (Ej: DQ5 y 6 bajo DQ1). A A1 B7 B B5103 (5) C Cw1 DR DR1 DQ DQ2* DP DPw1 A2* B703 B52 (5) Cw2 DR103 DQ4 DPw2* A203 B8 B53 Cw4 DR4 DQ5 (1) DPw3* A210 B13 B54 (22) Cw5* DR7* DQ6 (1) DPw4 A3 B18 B55 (22) Cw6 DR8 DQ7* (3) DPw5 A11* B27 B56 (22) Cw7* DR9 DQ8 (3) DPw6 A23 (9) B35 B57 (17) Cw8 DR10 DQ9 (3) A24 (9) B37 B58 (17) Cw9 DR11* (5) A2403 (9) B38 (16) B59 Cw10 DR12 (5) A25 (10) B39 (16) B4005 (40) DR13 (6) A26 (10) B3901 (16) B60 (40) DR14 (6) A34 (10) B3902 (16) B61 (40) DR1403 A66 (10) B41 B62 (15) DR1404 A29 (19) B42 B63 (15) DR15 (2) A30 (19) B44* (12) B64 (14) DR16 (2) A31 (19) B45 (12) B65 (14) DR17 (3) A32 (19) B46 B67 DR18 (3) A33 (19) B47 B71 DR51 A74 (19) B48 B72 DR52* A36 B49 (21) B73 DR53* A43 B50 (21) B75 A68 (29) B51* (5) B76 A69 (29) B5102 (5) B77 B7801 * Moléculas expresadas por las células del individuo de la figura 7.2. Tabla 8.1. Residuos de anclaje en las distintas posiciones (P1-9) de los péptidos unidos a las moléculas HLA de clase I. Los aminoácidos se indican en el código de una sola letra. HLA P1 P2 P3 P4 P5 P6 P7 P8 P9 A2 L V/L A68 T/V R A3 I/L A11 I/L A1 F K/Y K E/D Y A24 Y F/L B35 P Y B53 P F/W B27 R B8 B7 K/R K A P B22 P Cw4 Y/P R K I L/V Cw6 L Cw3 L Tabla 10.1. Cadenas de los complejos TCR Nombre Complejo TCRα TCRβ TCRγ αβ αβ γδ TCRδ γδ CD3γ CD3δ CD3ε ζ αβ αβ αβ αβ o o o o Función Correconocimiento de fragmentos de antígenos presentados por moléculas de histocompatibilidad γδ γδ γδ γδ + EC: Extracelular, TM: Transmembrana, CT: Citoplasmático. | Intra: Intracatenarios, Inter: Intercatenarios. Transducción de señales Peso molecular (KD) Puentes disulfuro (|) Intra Inter 45-60 40-50 45-60 2 2 2 40-60 2 25-28 20 20 16 1 1 1 0 1 con β 1 con α 0o1 con δ 0o1 con γ 0 0 0 1 con ζ oζ Cromosoma Regiones Glicosi- Fosforilación lación N.ºde aminoácidos (+) EC TM CT 14 7 7 VJC VDJC VJC Sí Sí Sí No No No 227 220 218 27 23 25 4 3 4 14 VDJC Sí No 223 27 5 11 11 11 1 – – – – Sí Sí No No Sí Sí Sí Sí 89 79 104 9 27 27 26 21 44 44 55 112 Tabla 10.2. Moléculas accesorias de los linfocitos T. Ligando Transducciónde señales +/– Principal distribución celular Superfamilia proteica Cromosoma Glicosilación Fosforilación CD4 HLA clase II sí + 55 Monómero Linfocitos Tαß, macrófagos Inmunoglobulinas 12 sí sí CD8 HLA clase I sí + 34 + 30 Dímero αß (a veces αα) Linfocitos Tαß, linfocitos NK Inmunoglobulinas 2 sí no CD2 CD58, CD59 sí + 50 Monómero Linfocitos T, linfocitos NK Inmunoglobulinas 1 sí + no CD5 CD72 sí + 69 Monómero Linfocitos T Limpiadoras 11 sí + sí CD11aCD18 (LFA-1) CD54, CD102 sí + 180 + 95 Dímero αß Leucocitos Integrinas 16/21 sí sí CD28 CD80, B70 sí + 44 + 44 Dímero αα Linfocitos T, células plasmáticas Inmunoglobulinas 2 sí sí CD43 CD54 sí – 100 Monómero Leucocitos Mucinas 16 sí + sí CD45 CD22? sí + 180-240 Monómero Leucocitos Mucinas 1 sí + sí CD49dCD29 (VLA-4) CD106 sí + 150+130 Dímero αß Leucocitos Integrinas 2/10 sí no Nombres Peso molecular Características bioquímicas Tabla 10.3. Cinasas y fosfatasas importantes en la activación de los linfocitos T. Nombre Tipo (*) Peso molecular (KD) Asociaciones relevantes Posibles sustratos relevantes Fyn PTK 59 ζ, CD3 ζ Zap70 (ζ-associated protein) PTK 70 ζ fosforilada CD28 Lck PTK 56 CD4, CD8, IL-2Rβ ζ, CD3, CD5, PLC, PI3K, MAPK PKC (protein kinase C) PSK Ca2+, DAG, fosfatidilserina, ésteres de forbol Ras, Raf, MAPK, CD3γ, CD18 PI3K (phosphatidyl inositol 3-kinase) LK Fyn, Lck, CD28 Fosfatidilinosítidos MAPK (mitogen activated protein kinase) PSK 42-60 - Raf, Rsk, AP-1, Myc CD45 PTP 180-240 TCR, CD2, CD4 Lck, Fyn Calcineurina PSP 60 Ciclosporina NF-AT PAC1 PTP (+) 32 - MAPK 85+110 * PTK: Protein-tyrosine kinase, cinasa de proteínas con especificidad por tirosinas. PSK: Protein-serine/threonine kinase, cinasa de proteínas con especificidad por serinas o treoninas. PTP: Protein-tyrosine phosphatase, fosfatasa de proteínas con especificidad por tirosinas. PSP: Protein-serine/threonine phosphatase, fosfatasa de proteinas con especificidad por serinas o treoninas. LK: Lipid-kinase, cinasa de lípidos. + Tiene, también, actividad PSP. TABLA 13.1. Propiedades de las distintas clases de antígenos TIMO DEPENDIENTES TI-1 TI-2 PRODUCCIÓN DE ANTICUERPOS EN: Individuos normales sí sí sí Individuos sin células T no sí sí Cambio de isotipo sí no no Maduración de afinidad sí no no Respuesta secundaria sí no no ACTIVACIÓN B POLICLONAL no sí no EPÍTOPOS REPETITIVOS no no sí proteínas LPS polisacáridos CARACTERÍSTICAS DE LA RESPUESTA: EJEMPLOS TABLA 14.1a. Citocinas involucradas en la respuesta inmune innata. CITOCINA ESTRUCTURA CÉLULA ORIGEN CÉLULA DIANA FUNCIÓN IL1α IL1β Monómero, 18kD Macrófagos Epiteliocitos Linfocitos T Macrófagos Hipotálamo – Inducción de fiebre – Activación de linfocitos T – Activación de macrófagos IL6 Monómero, 26kD Linfocitos T Macrófagos Linfocitos T Linfocitos B Hepatocitos – Activación de células T – Activación de células B – Activación de la fase aguda IL12 Heterodímero, 75kD Macrófagos, Linfocitos T, NK Neutrófilos Células dendríticas – Diferenciación de linfocitos Th1 – Activación de linfocitos NK y Tc IL16 Homotrímero, 13kD Linfocitos Tc Leucocitos Epiteliocitos Linfocitos Th Monocitos CD4+ Eosinófilos CD4+ – Quimioatrayente – Inducción del receptor de IL-2 – Inducción del HLA-DR TNFα Homotrímero, 17kD Macrófagos Linfocito Th1, NK Mastocitos Hepatocitos Fagocitos Endoteliocitos Linfocitos T, B y NK – – – – IFNα Monómero, 18kD Leucocitos Múltiples – Inducción de MHC-I IFNβ Monómero, 20kD Fibroblastos, otras células Múltiples – Activación de la presentación de antígenos – Activación de células NK – Inhibición de la replicación viral IFNγ Homodímero, 34kD Linfocitos Th1, NK, Tc Macrófagos Linfocitos Tc – Formación granuloma – Eliminación de micobacterias por los macrófagos – Inducción de MHC-I Inflamación local Activación del endotelio/linfocitos Inducción de fiebre Activación de fase aguda TABLA 14.1b. Quimiocinas. QUIMIOCINA ESTRUCTURA CÉLULA ORIGEN CÉLULA DIANA FUNCIÓN FAMILIA CXC (α) IL-8 PF4 GROα GROβ GROγ NAP-2 ENA 78 GCP-2 IP10 Mig SDF-1 FAMILIA CC (β) RANTES MIP-1α MIP-1β MCP-1 MCP-2 MCP-3 MCP-4 MCP-5 Eotaxina DC-CK1 FAMILIA C (γ) Linfotactina Neutrófilos (Linfocitos) Monomeros o dimeros de 7 - 15 kD, solubles o unidos a proteoglicanos de los endotelios Leucocitos Endoteliocitos (Dendrocitos) Monocitos Linfocitos Eosinófilos (Basófilos) FAMILIA CXXXC (δ) Fractalcina Neurotactina MIP: macrophage inhibitory protein; MCP: macrophage chemoattractant protein; DC-CK: dentritic cell chemokine. – Quimiotaxis – Inducción de moléculas de adhesión – Activación TABLA 14.2. Citocinas involucradas en la respuesta inmune específica. CITOCINA ESTRUCTURA CÉLULA ORIGEN CÉLULA DIANA FUNCIÓN IL2 Monómero, 17kD Linfocitos Th1 Linfocito T, B, NK Monocito – Activación y crecimiento de linfocitos T, B, NK y macrófagos IL4 Monómero, 20kD Linfocitos Th2 Mastocito Linfocito T Linfocito B – Activación y diferenciación de células B, cambio de isotipo a IgE – Actividad antitumoral Macrófago IL5 Homodímero, 50kD Linfocitos Th2 Eosinófilo Linfocito B – Activación, crecimiento y/o diferenciación de linfocitos B, y precursores hematopoyéticos IL9 Monómero, 35kD Linfocitos T Linfocito T Precursor hematopoyético – Activación de subtipos de linfocitos T – Crecimiento de precursores – Activación de mastocitos IL10 Homodímero, 19kD Linfocitos Th2 Macrófagos Linfocito B Linfocito NK Macrófago – Inhibición de macrófagos y de la producción de citocinas de células T – Activación y diferenciación de linfocitos B IL13 Monómero, 17kD Linfocitos Th2 Linfocito B Monocítomacrófago – Proliferación y diferenciación de células B – Inhibición de macrófagos IL14 Monómero, 53kD Linfocitos T Linfocitos B – Inducción proliferación de linfocitos B – Inhibición secreción Ig IL15 Monómero, 14kD Monocitos Fibroblastos, Otras Linfocitos T, B, NK Monocitos – Activación y crecimiento de T, B, NK y Macrófagos – Proliferación mastocitos. IL17 Homodímero, 17kD Linfocitos T Linfocito T, Fibroblastos, Macrófagos – Inducción de IL6, IL8 y adhesión (ICAM-1) – Proliferación de linfocitos T TGFβ Dímero, 14kD Linfocitos Th2 Macrófagos Linfocito Th1 Macrófago – Inhibición de la activación de linfocito T y macrófago – Inducción de síntesis de moléculas de adhesión TNFβ Trímero, 25kD Linfocitos Th1 Linfocitos B Linfocitos NK Macrófago Endotelio – Inflamación – Activación – Citolisis TABLA 14.3. Citocinas involucradas en la regulación de la hematopoyesis. CITOCINA ESTRUCTURA CÉLULA ORIGEN CÉLULA DIANA FUNCIÓN Stem cell factor Monómero, 24kD (Membrana 27kD) Célula estromal de médula ósea Progenitores pluripotenciales – Proliferación y diferenciación de progenitores IL3 Monómero, 26kD Linfocito T y NK Mastocito Progenitores pluripotenciales – Proliferación y diferenciación de progenitores IL7 Monómero, 25kD Célula estromal de timo y médula ósea Timocitos Linfocito T Célula inmadura – Proliferación y diferenciación de linfocitos T y B inmaduros – Activación de macrófagos GM-CSF Monómero, 26kD Linfocito T y NK Macrófago Célula endotelial Macrófago Progenitores mielomonocíticos y pluripotenciales – Diferenciación de progenitores mielomonocíticos – Activación de fagocitos G-CSF Monómero, 19kD Macrófago Célula endotelial Progenitor mieloide comprometido – Diferenciación de progenitores mieloides M-CSF Dímero, 40kD Macrófago Célula endotelial Progenitor monocítico comprometido – Diferenciación de progenitores de monocitos/macrófagos Epo Monómero, 34kD Células peritubulares Progenitor eritroide – Diferenciación y proliferación eritroide TABLA 14.4. Los receptores de las citocinas, agrupados por su estructura. FAMILIA DE RECEPTORES De hemopoyetinas Los receptores de G-CSF y Epo son monómeros de esta familia. α β α β γ De IFN α β CD o NOMBRE α β γ 123 125 116 124 127 IL9R IL15R 25 126 LIFBP α IL13R βc βc βc 118 118 119 IFNαRβ IFNβRβ IFNγRβ 122 130 130 130 γc γc γc γc γc LIFBP CITOCINAS RECONOCIDAS OTRAS CARACTERISTICAS Y JAK/STAT USADOS IL3 IL5 GM-CSF IL4 IL7 IL9 IL15 IL2 IL6 LIF CNTF IL13 JAK2/STAT5 JAK2/STAT5 JAK2/STAT5 JAK1, 3/STAT5 JAK1, 3/STAT5 JAK1, 3/STAT5 JAK1, 3/STAT5 JAK1, 3/STAT5 JAK1, 2, TYK2/STAT3 JAK1, 2, TYK2/STAT3 JAK1, 2, TYK2/STAT3 JAK1, 2, TYK2/STAT3 IFNα IFNβ IFNγ JAK1, TYK2/STAT1, 2 JAK1, TYK2/STAT1, 2 JAK1, 2/STAT1 TGFα TGFβ1,2,3,4,5 De TGF De TNF 120a 120b TNFα TNFβ Tipo Ig 121a, b c-kit 4 IL-1α, IL-1β Stem cell factor IL16 De quimiocinas CXCR1 CXCR2 IL-8 IL-8, GROα, β, γ, NAP-2, ENA78 IP10, Mig SDF-1, (HIV) CXCR3 CXCR4 (fusina) CCR1 CCR2a/b CCR3 CCR4 CCR5 RANTES, MIP-1α, MCP-2,-3 MCP-1,-2,-3,-4 Eotaxina, RANTES, MCP-3,-4, (HIV) RANTES, MIP-1α, MCP-1 RANTES, MIP-1α, -1β, (HIV) CD27, CD30, CD40 y CD95 pertenecen a esta familia, aunque no son receptores de citocinas Reconocen quimiocinas α Reconocen quimiocinas β TABLA 15.1 (continuación). Algunas moléculas de adhesión y sus ligandos más probables. FAMILIA Diriginas vasculares FUNCIÓN Ligandos de selectinas. Inician la adhesión endotelio/leucocito ESTRUCTURA Monómeros muy glicosilados NOMBRE CD DISTRIBUCIÓN CELULAR RELEVANTE LIGANDOS — 34 Endotelio, precursores GlyCAM-1 — Endotelio venoso alto (de órganos linfoides) MadCAM-1 — Endotelio venoso de órganos linfoides de mucosas CD62L LPAM-2 VLA-4 Ly24, Hermes 44 Leucocitos Ácido hialurónico Asentamiento en órganos linfoides GlyCAM (glycan cell adhesion molecule, molécula de adhesión celular que contiene glicano). LFA (Lymphocyte function-associated antigen, antígeno asociado a la función linfocitaria). Mac-1 (Receptor del complemento tipo 1). VLA (very late appearing antigens, Moléculas de activación muy tardía). CD62L DISTRIBUCIÓN DE LIGANDOS Leucocitos Matriz extracelular, estroma ICAM (intercellular adhesion molecule, molécula de adhesión intercelular). MadCAM (mucosal addressin cell adhesion molecule, molécula de adhesión celular dirigina mucosal). VCAM (vascular cell adhesion molecule, molécula de adhesión vascular). TABLA 15.1. Algunas moléculas de adhesión y sus ligandos más probables. FAMILIA Selectinas Integrinas FUNCIÓN ESTRUCTURA Inician la adhesión leucocito/endotelio (ligandos glicosilados) Monómero con dominio distal tipo lectina Adhesión entre leucocitos y a la matriz extracelular Heterodímero αiβ1 Selectina E 62E Selectina P 62P Selectina L DISTRIBUCIÓN CELULAR RELEVANTE LIGANDOS DISTRIBUCIÓN DE LIGANDOS CD15s 62L Leucocitos CD34, GlyCAM-1, MadCAM-1 Endotelio VLA-1 α1β1 49a/29 Ubicua Colágeno, laminina Matriz extracelular, endotelio VLA-4 α4β1 49d/29 Leucocitos Fibronectina CD106 MadCAM-1 VLA-5 α5β1 49e/29 Ubicua Fibronectina Matriz extracelular LFA-1 αLβ2 11a/18 Leucocitos CD50, 54, 102 Mac-1, CR3 αMβ2 11b/18 CD54, iC3b, fibrinógeno Endotelio, leucocitos, tejido inflamado p150, 95, CR4 αxβ2 11c/18 Fibrinógeno, iC3b Heterodímero αvβ3 Receptor de vitronectina 51/61 Neutrófilos, plaquetas Vitronectina fibrinógeno Matriz extracelular Heterodímero α4β7 αEβ7 LPAM-2 103 Leucocitos IEL MadCAM-1 Endotelio Monómero con dominios Ig LFA-2 2 Linfocitos T, NK CD58, CD59 Células presentadoras, linfocitos ICAM-3 50 Células presentadoras CD11a/18 Leucocitos ICAM-1 54 Endotelio activado, linfocitos LFA-3 58 Células presentadoras, linfocitos CD2 Linfocitos T ICAM-2 102 Endotelio CD11a/18 Leucocitos VCAM-1 106 Endotelio activado CD49d/29 Leucocitos Heterodímero αiβ2 Ligandos de integrinas. Adhesión entre leucocitos y al endotelio CD Endotelio activado, plaquetas Asentamiento en los órganos linfoides, como el timo (VLA-4) o el GALT (αEβ7) Inmunoglobulinas NOMBRE Neutrófilos Linfocitos Th1 Tabla 16.1. Jerarquía funcional del sistema inmune. Se indican los mecanismos de defensa más importantes en cada nicho extracelular o intracelular. Como es natural, los patógenos intracelulares son también alguna vez extracelulares (como el virus del dibujo), y por tanto diana de los mecanismos que operan en ese nicho. De igual manera, los patógenos que se reproducen en el medio interno tienen que atravesar antes los epitelios y superar, por tanto, sus barreras. Tipos de patógenos: Extracelulares Nichos: Ejemplos Bacterias Hongos Parásitos/protozoos Parásitos/helmintos Epitelios Intracelulares Medio interno E. coli Streptococcus Staphylococcus Neisseria Vibrio E. coli Streptococcus Staphylococcus Neisseria Candida Microsporium Tricophyton Aspergillus Giardia Trichomonas Cryptosporidium Taenia Enterobius Candida Aspergillus Histoplasma Coccidioides Entamoeba Virus Schistosoma Echinococcus Trichinella, Filarias Vacuolas Citoplasma Chlamydia Listeria Salmonella Brucella Mycobacterium Legionella Yersinia Rickettsia Leishmania Trypanosoma Toxoplasma Plasmodium Trypanosoma Rotavirus, Adenovirus Respiratorio sincitial Hepatitis, Herpesvirus Gripe MECANISMOS DE DEFENSA EN CADA NICHO Inmunidad innata Defensinas + Eosinófilos/mastocitos Complemento (alternativa/lectinas) Fagocitosis/citolisis Inflamación/fase aguda Interferones α, β Linfocitos NK Inmunidad adaptativa IgA + IgM, G Linfocitos Th2 (IgE) Linfocitos Th1 (macrófagos) Linfocitos Tγδ Linfocitos Tc + + + + + + + + + + + + +? +/– + +? + + Inmunidad innata dependiente de anticuerpo Inflamación (IgE) Complemento (clásica) Fagocitosis Citolisis (NK, fagocitos) + + + + + + + + Tabla 16.2. Mediadores de la inflamación. MEDIADOR ORIGEN EFECTOS Histamina Mastocitos, basófilos Aumento de la permeabilidad vascular, contracción del músculo liso, quimiocinesis 5’-hidroxitriptamina (5HT) o serotonina Plaquetas Aumento de la permeabilidad vascular, contracción del músculo liso Factor activador de las plaquetas (PAF) Basófilos, neutrófilos, macrófagos Liberación de mediadores plaquetarios, aumento de la permeabilidad vascular, contracción del músculo liso, activación de neutrófilos Factor quimiotáctico neutrofílico (NCF) Mastocitos Quimiotaxis de neutrófilos IL-8 y otras α quimiocinas Monocitos y macrófagos Localización de neutrófilos y linfocitos C3a, C4a Complemento C3, C4 Desgranulación de mastocitos, contracción del músculo liso C5a Complemento C5 Desgranulación de mastocitos, contracción del músculo liso, aumento de la permeabilidad capilar, quimiotaxis de neutrófilos y macrófagos, activación de neutrófilos Bradicinina Sistema de la cinina (cininógeno) Vasodilatación, dolor, contracción del músculo liso, aumento de la permeabilidad vascular Fibrinopéptidos y productos de degradación de la fibrina Sistema de la coagulación Aumento de la permeabilidad vascular, quimiotaxis de neutrófilos y macrófagos Prostaglandinas E2 (PGE2) Vía ciclooxigenasa Leucocitos La vasodilatación potencia el aumento de la permeabilidad vascular producido por la histamina y la bradicinina Leucotrieno B4 (LTB4) Vía lipooxigenasa Leucocitos Quimiotaxis de neutrófilos en sinergia con PGE2 para aumentar la permeabilidad vascular Leucotrieno D4 (LTD4) Vía lipooxigenasa (leucocitos) Aumento de la permeabilidad vascular, contracción del músculo liso TNFα Macrófagos, linfocitos NK, mastocitos Inflamación, activación endotelio β quimiocinas Leucocitos Localización de monocitos, eosinófilos, basófilos y linfocitos Tabla 16.3. Ejemplo de calendario de vacunaciones Vacuna/patógeno Tipo1 Bacterias Difteria (Corynebacterium diphtheriae) Tétanos (Clostridium tetani) Tosferina (Bordetella pertussis) Meses 0 Toxoide Toxoide Inactivada Años 2 4 6 X X X X X X X X X X X 15 18 6 X X X X X X X 11 14 X X Virus Polio oral Sarampión Rubéola Parotiditis Hepatitis B Atenuada Atenuada Atenuada Atenuada Recombinante X X X X X X X X X X La vacuna puede contener toxinas inactivadas pero inmunogénicas (toxoide), o el propio patógeno muerto (inactivado) o variantes atenuadas (no patogénicas para humanos, pero vivas) del patógeno, o simples fragmentos inmunogénicos del patógeno, a veces producidos por biología molecular (péptidos recombinantes) o purificados del mismo (polisacárido de Haemophilus, o de Neisseria, a menudo conjugado con proteínas para mejorar la respuesta B T-dependiente). 1 TABLA 18.1. Inmunodeficiencias congénitas. ENFERMEDAD DEFECTO PRIMARIO FUNCIÓN INMUNE ALTERADA FAGOCITOS O LINFOCITOS NK Deficiencia de adhesión leucocitaria (LAD) Mutación en el gen que codifica para CD18 (tabla 15.1) – Disminución de la adherencia a endotelios – Disminución de fagocitosis y quimiotaxis – Disminución de actividad citolítica Tc y NK Enfermedad granulomatosa crónica (CGD) Mutaciones en los genes que codifican para la enzima NADPH-oxidasa – Aparición de granulomas – Ausencia de función oxidativa/bactericida en neutrófilos Deficiencia de glucosa-6-fosfato deshidrogenasa Mutaciones en el gen que codifica para esta enzima – Aparición de granulomas – Ausencia de función oxidativa/bactericida en neutrófilos Deficiencia de mieloperoxidasa Mutaciones – Ausencia de función oxidativa de neutrófilos Deficiencia de la cadena α del receptor de IFN-γ Mutaciones – Ausencia de granulomas – Susceptibilidad a micobacterias Síndrome de Chediak-Higashi (deficiencia de Lyst) Mutaciones en LYST (fosfoproteína – Reducción de la actividad citolítica/ implicada en el tráfico de orgánulos) bactericida de neutrófilos, NK y Tc Deficiencia de linfocitos NK Desconocido – Ausencia de linfocitos NK – Susceptibilidad a virus Herpes Deficiencias de la vía de las lectinas (MBL) Mutaciones en los genes correspondientes (tabla 4.1) – Pobre opsonización de bacterias Deficiencias de la vía alternativa (factor B y D) Mutaciones en los genes correspondientes (tabla 4.1) – Pobre eliminación de Neisseria Deficiencias de la vía clásica (C1, 2, 3, 4) Mutaciones en los genes correspondientes (tabla 4.1) – Pobre eliminación de inmunocomplejos y bacterias piógenas Deficiencias de la fase lítica (C5, 6, 7, 8, 9) o de regulación (factor H, I, P, CD35/CR1) Mutaciones en los genes correspondientes (tablas 4.1 y 4.2) – Pobre eliminación de Neisseria e e inmunocomplejos Deficiencias de regulación (C1 inhibidor, C4bp, CD55/DAF, CD59, HRF) Mutaciones en los genes correspondientes (tabla 4.2) – Activación excesiva del complemento (edema, anemia) Agammaglobulinemia ligada al Mutaciones en la proteína btk – Ausencia de células B y plasmáticas cromosoma X (XLA), Bruton (fig. 5.2) – Ausencia de Igs Deficiencia de IgA Desconocido; fallo en la diferenciación terminal de células B – Ausencia de síntesis de IgA Deficiencia de cadenas κ Mutaciones en el gen κ (fig. 6.1) – Ausencia de anticuerpos con κ Deficiencia selectiva de IgG o sus subclases Deleciones en los genes constantes de IgG (fig. 6.1) Desconocido a menudo – Pérdida de uno o más isotipos de IgG Hipogammaglobulinemia transitoria de la infancia Desconocido – Reducción de los niveles de IgG e IgA en suero COMPLEMENTO LINFOCITOS B TABLA 18.1 (continuación). Inmunodeficiencias congénitas. ENFERMEDAD DEFECTO PRIMARIO FUNCIÓN INMUNE ALTERADA Inmunodeficiencia común variable (CVID) Desconocido – Producción reducida de anticuerpos – Hipogammaglobulinemia Hiper-IgM autosómica Desconocido - CD40? – IgM e IgD altas, IgG, IgE e IgA bajas – No hay cambio de isotipo LINFOCITOS T Y COMBINADAS Moléculas HLA (células presentadoras de antígeno) Deficiencia de HLA de clase I (SCID) Mutaciones en el gen TAP2 (fig. 8.1) – Disminución de células Tc y NK – Ausencia de HLA-I Deficiencia de HLA de clase II (SCID) Mutaciones en proteínas reguladoras de la expresión de los genes HLA de clase II (fig. 18.1) – Disminución de células Th – Disminución de los niveles de Igs – Disminución de HLA-II Deficiencia de CD3 (SCID) Mutaciones en genes CD3γ o CD3ε (fig. 10.1) – Disminución del número y función de los linfocitos T – Baja expresión de TCR/CD3 Deficiencia de Zap70 (SCID) Mutaciones en el gen Zap70 (fig. 10.3) – Disminución del número de células Tc – Disfunción de las Th Deficiencia de Jak3 (fig. 14.2) Mutaciones en Jak 3, una cinasa asociada a receptores de citocinas – Disminución de células T y NK – Disminución de los niveles de Igs Inmunodeficiencia combinada severa ligada al cromosoma X (SCID-X) Mutaciones en el gen que codifica para la cadena γ común a los receptores de la IL2, IL4, IL7, IL9 e IL15 (tablas 14.2 y 14.3) – Disminución del numero y función de las células T y NK – Disminución de los niveles de Igs Hiper-IgM ligada al cromosoma X (HIGM-1) (SCID) Mutaciones en CD40L(CD154) (fig. 13.4) – IgM e IgD altas, IgG, IgE e IgA bajas – No hay cambio de isotipo Deficiencia de CD95 (Apo-1 o Fas) Mutaciones en el gen que codifica para CD95 (fig. 12.4) – Ausencia de apoptosis linfoide – Autoinmunidad – Linfoproliferación Síndrome de Di George (aplasia tímica) Desconocido. Defecto en el desarrollo de las 3ª y 4ª bolsas faríngeas – Ausencia de células T – Niveles de Igs normales o disminuidas Síndrome de Wiskott-Aldrich (WAS) Mutaciones en la proteína WAS (WASP) – Descenso progresivo de T y plaquetas – Niveles de IgM disminuidos Disgenesia reticular (SCID) Defecto en la maduración de los precursores hematopoyéticos – Células T y B ausentes – Niveles de Igs disminuidos Deficiencia de adenosín desaminasa (ADA) (SCID) Mutaciones en el gen que codifica para la enzima ADA – Disminución del número y función de las células T y B Deficiencia de purín nucleósido fosforilasa (PNP) (SCID) Mutaciones en el gen que codifica para la enzima PNP – Disminución del número y función de las células T Deficiencia de DNA ligasa I (SCID) Mutaciones en el gen que codifica para la enzima DNA ligasa I – Ausencia de inmunidad celular – Disminución de IgG e IgA Activación/diferenciación Metabolismo del ADN TABLA 18.1 (continuación). Inmunodeficiencias congénitas. ENFERMEDAD DEFECTO PRIMARIO FUNCIÓN INMUNE ALTERADA Deficiencia del gen de activación de la recombinación (RAG) (SCID) Mutaciones de RAG-1 o RAG-2, genes necesarios para la recombinación somática – Ausencia de células B – Ausencia de Igs en suero (G y A) – Disminución de células T Ataxia-telangiectasia Mutaciones en ATM – Disminución de células Th – Reducción de los niveles de Igs Tabla 18.2. Infecciones asociadas a las inmunodeficiencias Defecto Patógenos más asociados Bacterias Protozoos Virus Hongos Otras características clínicas Inmunidad innata Fagocitos Bacterias y hongos (más que virus y protozoos) Staphylococcus Proteus Klebsiella Serratia – – Candida Nocardia Aspergillus Granulomas Complemento Bacterias piógenas y hongos (más que virus y protozoos) Neisseria Haemophilus – – Aspergillus Lupus Angioedema (inhibidor de C1) Linfocitos NK Herpesvirus – – Herpes* – – – Inmunidad específica Linfocitos B Bacterias piógenas y protozoos extracelulares Staphylococcus Haemophilus Streptococcus Giardia Cryptosporidium Enterovirus* (polio, echo) – Linfocitos T o combinadas Patógenos intracelulares Mycobacterium* Listeria* Streptococcus Toxoplasma Citomegalovirus* Vacuna* Herpes* Parotiditis* Candida Diarrea Aspergillus Retraso del crecimiento Pneumocystis Autoinmunidad (CD95) * Intracelulares. Tabla 18.3. Sistema de clasificación de la infección por HIV. CATEGORIAS CLÍNICAS CATEGORÍAS INMUNOLÓGICAS POR LINFOCITOS T CD4+ Número/μl Porcentaje (A) Asintomáticos Infección aguda o primaria por HIV Linfoadenopatía generalizada (LPG) (B) Sintomáticos no (A) ni (C) (C) Condiciones indicadoras de SIDA (infecciones oportunistas, tumores) (1) > 500 > 29 A1 B1 C1 (2) 200-499 14-28 A2 B2 C2 (3) < 200 < 14 A3 B3 C3 Tabla 19-1. Alergias mediadas por IgE. Enfermedad Tipo de alergeno Ruta de entrada Respuesta Anafilaxis sistémica Medicamentos, venenos de avispas (penicilina) y abejas, contraste radiológico Intravenosa Edema, vasodilatación, oclusión traqueal, colapso circulatorio, muerte Inflamación local Picaduras de insectos, pruebas cutáneas de alergia Subcutánea Vasodilatación local, edema local Rinitis alérgica, asma bronquial Polen, restos de insectos o animales de compañía Respiratoria Edema e irritación de la mucosa nasal o branquial Alergia alimentaria Leche, huevos, pescado, etc. Digestiva Vómitos, diarrea, prurito, urticaria Tabla 19.2. Alergias mediadas por inmunocomplejos. Enfermedad Ruta de entrada Deposición de inmunocomplejo Vasculitis Intravenosa En los vasos sanguíneos Nefritis Intravenosa En el riñón Artritis Intravenosa En las articulaciones Reacción de Arthus Subcutánea En el area perivascular Pulmón de granjero Respiratoria En los alveolos Tabla 19-3. Ejemplos de enfermedades causadas por reacciones de hipersensibilidad frente a distintas categorías de antígenos, que se indican entre paréntesis. Mecanismos de hipersensibilidad Alergenos Patógenos Tipo I (IgE/mastocitos, inmediata) Rinitis alérgica (polen) Tipo II (IgG) Anemia hemolítica (penicilina) Tipo III (inmunocomplejos) Pulmón de granjero (hongo de la paja) Glomerulonefritis (post-estreptococos) Tipo IV (linfocitos T, retardada) Dermatitis por contacto (níquel) Lepra tuberculoide (micobacterias) Aloantígenos Autoantígenos Reacción transfusional (ABO, Rh) Miastenia grave (receptor de acetilcolina) Lupus (DNA) Rechazo agudo (HLA) Diabetes insulinodependiente (células β) TABLA 20.1. Asociación entre infección y enfermedad autoinmune. Algunas enfermedades autoinmunes ocurren después de infecciones específicas, que presumiblemente son el origen de las patologías. La mayoría de las enfermedades autoinmunes posinfecciosas también muestran susceptibilidad asociada con el MHC (tabla 20.2). INFECCIÓN ENFERMEDAD Streptococcus grupo A Fiebre reumática (miocarditis, poliartritis) Chlamydia trachomatis Síndrome de Reiter (artritis) Shigella flexneri Salmonella typhimurium Salmonella enteritidis Yersinia enterocolitica Campylobacter jejuni Klebsiella pneumoniae Artritis reactiva Espondilitis anquilosante Borrelia burgdorferi Artritis crónica en la enfermedad de Lyme EBV, HTLV-1 Artritis reumatoide HTLV-1, HIV-1 Lupus eritematoso sistémico HTLV-1 Síndrome de Sjögren Esclerosis múltiple Cocksackie Paperas Rubéola Retrovirus Diabetes mellitus insulino dependiente TABLA 20.2. Asociación del fenotipo HLA y el sexo con la susceptibilidad a padecer ciertas enfermedades autoinmunes. El riesgo relativo indica la probabilidad de desarrollar la enfermedad que tienen los portadores del alelo que se indica, referida a la de los que no lo tienen (por ejemplo, los individuos con HLA-B27 tienen 90 veces más probabilidades de desarrollar espondilitis anquilosante que los que carecen de esa molécula). Esta enfermedad, además, es mucho más frecuente (3,3 veces) en varones que en hembras. ENFERMEDAD ALELO HLA RIESGO RELATIVO Espondilitis anquilosante B27 90 0,3 Uveítis anterior aguda B27 10 0,4 Esclerosis múltiple DR2 5 10 Enfermedad de Graves DR3 4 8 Miastenia grave DR3 3 2 Lupus eritematoso sistémico DR3 6 15 Diabetes mellitus insulinodependiente DR3 y DR4 10 5 Artritis reumatoide DR1 y DR4 5 3 DR4 15 ? Pénfigo vulgar INCIDENCIA / TABLA 20.3. Algunas enfermedades autoinmunes clasificadas por el mecanismo mediante el cual dañan los tejidos. ENFERMEDAD AUTOANTÍGENO CONSECUENCIA MEDIADAS POR ANTICUERPO (tipo II) Anemia hemolítica autoinmune Grupo sanguíneo Rh Destrucción de eritrocitos por el complemento y fagocitos, anemia Púrpura trombopénica autoinmune Integrina de plaquetas gpIIb:IIIa (CD41a) Coagulación anómala, plaquetopenia Síndrome de Goodpasture Fibras de colágeno tipo IV (membranas basales) Vasculitis, fallo renal y pulmonar Pénfigo vulgar Cadherina epidérmica Ampollas epidérmicas Fiebre reumática aguda postinfección estreptocócica Músculo cardíaco, por reacción cruzada Poliartritis, miocarditis, deterioro de las válvulas cardíacas Enfermedad de Graves Receptor de TSH Hipertiroidismo Miastenia grave Receptor de acetilcolina Fatiga muscular MEDIADAS POR INMUNOCOMPLEJOS (tipo III) Lupus eritematoso sistémico DNA, histonas, ribosomas, snRPN, scRNP, ATPasa Glomerulonefritis, vasculitis, artritis MEDIADAS POR CÉLULAS T (tipo IV) Diabetes mellitus insulinodependiente Antígeno de las células β pancreáticas (desconocido: ¿ácido glutámico descarboxilasa?) Destrucción de células β Artritis reumatoide Antígeno sinovial (desconocido: ¿proteína de choque térmico?) Inflamación y destrucción de articulaciones Esclerosis múltiple Proteína básica de la mielina, proteína proteolipídica Invasión cerebral por células T CD4, parálisis TABLA 20.4. Las enfermedades autoinmunes pueden clasificarse en organo-específicas y no organo-específicas, dependiendo del autoantígeno primario (localizado en cierto órgano o ubicuo, respectivamente). ORGANO-ESPECÍFICAS Sistema endocrino Tiroiditis de Hashimoto Atrofia tiroidea Tiroides Enfermedad de Graves Enfermedad de Addison (suprarrenales) Menopausia prematura (gónadas) Hipoglucemia autoinmune (páncreas) Diabetes mellitus insulinodependiente (páncreas) Orquitis autoinmune (gónadas) Sistema hematopoyético Anemia perniciosa Anemia hemolítica autoinmune Púrpura trombopénica autoinmune Neutropenia idiopática Sistema neuromuscular Miastenia grave Esclerosis múltiple Piel Pénfigo vulgar Penfigoide Sistema cardiopulmonar Síndrome de Goodpasture (riñón/pulmón) NO ORGANO-ESPECÍFICAS Síndrome de Sjögren (artritis/parotiditis/queratitis) Artritis rumatoide Dermatomiositis Esclerodermia Enfermedad mixta del tejido conjuntivo Lupus eritematoso discoide Lupus eritematoso sistémico