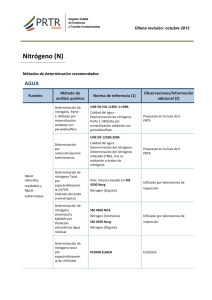
Trichodesmium spp
Anuncio

Trichodesmium spp. y fijación de N2 en el océano Atlántico tropical y subtropical Trichodesmium spp. y fijación de N2 en el océano Atlántico tropical y subtropical Ana Fernández Carrera Memoria presentada para optar al título de Doctora por la Universidade de Vigo Vigo, febrero 2013 D. Emilio Marañón Sainz, profesor titular del Departamento de Ecoloxía e Bioloxía Animal de la Universidade de Vigo, y D. Antonio Bode Riestra, investigador titular del Centro Oceanográfico de A Coruña del Instituto Español de Oceanografía, HACEN CONSTAR que la presente memoria, titulada “Trichodesmium spp. y fijación de N2 en el océano Atlántico tropical y subtropical”, presentada por la licenciada en Ciencias del Mar Dña. Ana Fernández Carrera para optar al grado de doctora, ha sido realizada bajo nuestra dirección, cumpliendo con las condiciones exigidas para su presentación, la cual autorizamos. Para que así conste y surta los efectos oportunos, firmamos la presente en Vigo, a 25 de febrero de 2013. Fdo. Antonio Bode Riestra Fdo. Emilio Marañón Sainz Los trabajos que se recogen en esta memoria se desarrollaron en el marco del proyecto “TRichodesmium spp. Y fijación de NItrógeno en el Atlántico Tropical (TRYNITOP)”, financiado por el Ministerio de Educación y Ciencia (CTM2004-05174-C02). La tesis se realizó durante el disfrute de un contrato financiado por la Xunta de Galicia (PGIDIT05PXIC31201PN) como apoyo al proyecto TRYNITROP. Además, se hizo una estancia de dos meses en el Plymouth Marine Laboratory (Reino Unido). “Tell me, and I will forget. Show me, and I may remember. Involve me, and I will understand.” Confucius (ca. 450 BC) Índice TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO ÍNDICE 1. Introducción................................................................................................. 17 1.1. LA FIJACIÓN DE NITRÓGENO MOLECULAR ............................... 20 1.2. LOS FIJADORES DE NITRÓGENO ................................................... 22 1.3. LAS CIANOBACTERIAS DIAZÓTROFAS........................................ 24 1.3.1. Trichodesmium ............................................................................... 24 1.3.2. Cianobacterias heterocísticas.......................................................... 28 1.3.3. Cianobacterias unicelulares libres .................................................. 28 1.4. REGULACIÓN DE LA FIJACIÓN DE N2 ........................................... 29 1.5. LA FIJACIÓN DE NITRÓGENO: MEDIDAS DIRECTAS Y ESTIMACIONES ......................................................................................... 33 1.6. FIJACIÓN DE N2 EN EL OCÉANO ATLÁNTICO............................. 38 1.7. HIPÓTESIS Y OBJETIVOS ................................................................. 41 1.8. ESTRUCTURA DE LA TESIS ............................................................. 43 2. Community N2 fixation and Trichodesmium spp. abundance along longitudinal gradients in the eastern subtropical North Atlantic ............... 45 ABSTRACT.................................................................................................. 47 2.1. INTRODUCTION ................................................................................. 49 2.2. MATERIAL AND METHODS ............................................................. 51 2.2.1. Sampling, hydrography and nutrients............................................. 51 2.2.2. Satellite-derived estimates of dust concentration ........................... 52 2.2.3. Chlorophyll a.................................................................................. 53 2.2.4. Trichodesmium abundance ............................................................. 53 2.2.5. Dinitrogen (N2) fixation.................................................................. 54 2.3. RESULTS .............................................................................................. 55 2.3.1. Hydrography, nutrients and atmospheric dust concentration ......... 55 2.3.2. Chlorophyll a.................................................................................. 58 2.3.3. Trichodesmium abundance and community N2 fixation................. 59 13 ÍNDICE 2.4. DISCUSSION ........................................................................................ 61 2.4.1. Trichodesmium distribution ............................................................ 61 2.4.2. Nitrogen fixation............................................................................. 62 2.4.3. Conclusions..................................................................................... 65 3. Latitudinal distribution of Trichodesmium and N2 fixation in the Atlantic Ocean ................................................................................................................ 67 ABSTRACT.................................................................................................. 69 3.1. INTRODUCTION.................................................................................. 71 3.2. MATERIAL AND METHODS ............................................................. 72 3.2.1. Sampling, hydrography and irradiance ........................................... 72 3.2.2. Satellite inference of dust presence in the atmosphere ................... 74 3.2.3. Chlorophyll a concentration ........................................................... 74 3.2.4. Trichodesmium abundance ............................................................. 74 3.2.5. Dinitrogen (N2) fixation.................................................................. 75 3.3. RESULTS .............................................................................................. 75 3.3.1. Hydrography, nutrients and estimated dust presence in the atmosphere................................................................................................ 75 3.3.2. Chlorophyll a concentration ........................................................... 79 3.3.3. Trichodesmium abundance and N2 fixation .................................... 79 3.3.4. Relative contribution of Trichodesmium to community N2 fixation .................................................................................................................. 84 3.4. DISCUSSION ........................................................................................ 84 3.4.1. Latitudinal distribution of Trichodesmium ..................................... 84 3.4.2. Latitudinal distribution of N2 fixation............................................. 87 3.4.3. N2 fixation in the South Atlantic..................................................... 88 3.4.4. Biogeochemical significance of N2 fixation ................................... 89 4. Large-scale meridional and zonal variability in the nitrogen isotopic composition of plankton in the Atlantic Ocean............................................. 93 ABSTRACT.................................................................................................. 95 4.1. INTRODUCTION.................................................................................. 97 14 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 4.2. MATERIAL AND METHODS ............................................................. 99 4.2.1. Sampling, hydrography and chlorophyll a ..................................... 99 4.2.2. Natural abundance of nitrogen isotopes in suspended particles ... 100 4.2.3. Natural abundance of nitrogen isotopes in plankton .................... 101 4.3. RESULTS ............................................................................................ 102 4.3.1. Hydrography and fluorescence ..................................................... 102 4.3.2. Stable nitrogen isotopes in suspended particles (δ15Nsp) and particulate organic nitrogen (PON) ........................................................ 104 4.3.3. Nitrogen isotopic signature in the euphotic layer ......................... 107 4.3.4. Diazotroph nitrogen contribution to δ15N in the euphotic layer ... 110 4.4. DISCUSSION ...................................................................................... 110 4.4.1. Zonal and meridional variations in δ15N in the North gyre .......... 112 4.4.2. Meridional variations in δ15N in the equatorial region ................. 115 4.4.3. Meridional variations in δ15N in the South gyre region................ 117 4.4.5. Conclusions .................................................................................. 118 5. Síntesis y conclusiones............................................................................... 121 5.1. SÍNTESIS ............................................................................................ 123 5.1.1. Variabilidad zonal en el Atlántico norte....................................... 123 5.1.2. Variabilidad latitudinal en el océano Atlántico ............................ 124 5.1.3. Abundancia natural de isótopos de nitrógeno en la capa eufótica 125 5.1.4. Los problemas de la adición de 15N2 como burbuja de gas........... 126 5.1.5. Futuros estudios............................................................................ 128 5.2. CONCLUSIONES ............................................................................... 129 6. Resumen .................................................................................................... 131 6.1. INTRODUCCIÓN ............................................................................... 133 6.2. MÉTODOS .......................................................................................... 134 6.2.1. Muestreo, hidrografía, nutrientes y clorofila a ............................. 134 6.2.2. Inferencia mediante detección por satélite de polvo atmosférico. 136 6.2.3. Abundancia de Trichodesmium .................................................... 136 6.2.4. Fijación de nitrógeno (N2) ............................................................ 136 15 ÍNDICE 6.2.5. Abundancia natural de isótopos de nitrógeno en plancton ........... 137 6.3. RESULTADOS.................................................................................... 138 6.3.1. Hidrografía, nutrientes y polvo atmósferico ................................. 138 6.3.2. Abundancia de Trichodesmium y fijación de nitrógeno ............... 140 6.3.3. Isótopos de nitrógeno en la capa eufótica ..................................... 141 6.4. DISCUSIÓN ........................................................................................ 143 6.4.1. Trichodesmium ............................................................................. 143 6.4.2. Fijación de nitrógeno .................................................................... 144 6.4.3. Isótopos de nitrógeno.................................................................... 145 Referencias ...................................................................................................... 147 Agradecimientos .............................................................................................. 167 16 Introducción TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO La disponibilidad de nutrientes es uno de los factores que controlan estrechamente el funcionamiento de la bomba biológica de carbono en los océanos. El nitrógeno es el principal macronutriente limitante de la producción primaria en la mayoría de sistemas marinos (Vitousek y Howarth, 1991). En agua de mar, el nitrógeno inorgánico se encuentra en una amplia variedad de formas químicas y estados de oxidación, incluyendo: nitrato, NO3−; nitrito, NO2−; óxido nitroso, N2O; nitrógeno molecular, N2; o amonio, NH4+ (Gruber, 2008). Esta flexibilidad favorece que participe en una amplia variedad de reacciones redox, la mayoría de las cuales están asociadas a procesos de asimilación y desasimilación por parte de los organismos (Figura 1.1). El nitrógeno molecular representa el compartimento más abundante en el medio marino. Sin embargo, a priori es poco reactivo, ya que romper el triple enlace que une los átomos de nitrógeno requiere un suministro elevado de energía y poder reductor (Paerl y Zehr, 2000). Sólo un reducido número de organismos procariotas es capaz de aprovechar este reservorio, mediante un proceso denominado fijación de nitrógeno. Figura 1.1. Reacciones de asimilación y desasimilación de las principales formas de nitrógeno en el medio marino. Adaptada de la Figura 1.2. de Gruber (2008). 19 1. INTRODUCCIÓN 1.1. LA FIJACIÓN DE NITRÓGENO MOLECULAR De todos los procesos implicados en la circulación biológica del nitrógeno (Figura 1.1), la fijación de nitrógeno molecular, es decir, la conversión biológica de N2 en amonio, constituye una de las entradas más importantes de nitrógeno nuevo en las regiones oligotróficas de los océanos (Karl et al., 2002; Mahaffey et al., 2005). Su papel en el secuestro de dióxido de carbono atmosférico (CO2) y, por lo tanto, en el ciclo del carbono, es directo (Karl et al., 2002). El nitrógeno transportado desde capas profundas del océano va acompañado de carbono inorgánico disuelto, parte del cual puede ser de nuevo liberado a la atmósfera, lo que reduce la captación neta de CO2. Por el contrario, el nitrógeno introducido a través de la fijación de N2 estimula directamente la fijación fotosintética de carbono inorgánico disuelto en aguas superficiales y, por lo tanto, facilita la retirada de CO2 atmosférico hacia aguas profundas por parte de la bomba biológica (Michaels et al., 2001). La enzima responsable de la fijación de N2, la nitrogenasa, es de origen antiguo. Se cree que apareció hace más de 3.000 millones de años, cuando aún dominaban las condiciones reductoras en la atmósfera (Falkowski, 1997). Así, en la actualidad, sólo está presente en procariotas y se inactiva irreversiblemente en presencia de oxígeno. Es un complejo enzimático de baja especificidad por sustrato, capaz de catalizar la reducción de numerosas moléculas que posean un triple enlace. Por esta razón, se ha sugerido que originariamente su función habría sido de detoxificación celular (Paerl y Zehr, 2000). Dicho complejo está constituido por dos metaloproteínas: la dinitrogenasa y la dinitrogenasa reductasa (Figura 1.2). La dinitrogenasa reductasa se encarga de reducir la nitrogenasa que, a su vez, cataliza la reducción del nitrógeno. El cofactor metálico de la dinitrogenasa reductasa es el hierro (Fe) y su estructura se encuentra muy conservada, por lo que existe poca variabilidad entre las distintas especies que la sintetizan. Por ello, el gen que codifica esta proteína, el nifH, es una herramienta útil en estudios moleculares de la identificación de especies fijadoras de N2 en el medio marino (Paerl y Zehr, 2000). 20 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Figura 1.2. Estructura molecular de la enzima nitrogenasa: A) enzima completa según Dixon y Kahn (2004), la “Fe protein” representa la dinitrogenasa reductasa, la “MoFe protein” es la dinitrogenasa, el “Bound nucleotide” representa al ATP/ADP; B) representación de la dinitrogenasa, fuente: http://www.scripps.edu/news/scientificreports/sr2004/mb04noodleman.html Por el contrario, la estructura de la dinitrogenasa es mucho más variable. Los cofactores que se encuentran con más frecuencia en esta proteína son molibdeno (Mo) y hierro (Fe), pero algunos grupos usan alternativamente vanadio (V) o wolframio (W) sustituyendo al molibdeno (Bishop et al., 1980; Fallik et al., 1991). En condiciones óptimas, la reducción biológica de N2 sigue la siguiente estequiometría: N2 + 8H+ + 8e− + 16 MgATP → 2 NH3 + H2 + 16 MgADP + 16 Pi En la figura 1.3 se muestra la reacción con más detalle, desglosando las funciones de cada metaloproteína del complejo enzimático. Es evidente que se trata de un proceso muy costoso desde el punto de vista energético. Se necesita mucha energía y poder reductor para catalizar la ruptura del triple enlace del N2. Por esta razón, la actividad de la nitrogenasa está muy regulada y son numerosas las variables que determinan su síntesis y expresión como, por 21 1. INTRODUCCIÓN ejemplo, la disponibilidad de nutrientes o la presencia de oxígeno (Karl et al., 2002). Figura 1.3. Esquema de la fijación de nitrógeno con la función de cada componente de la enzima nitrogenasa detallado, el círculo marcado como DR-Fe representa a la dinitrogenasa reductasa. Traducida de NIIR Board (2004) Plant Biotechnology Handbook. ISBN: 8186623833. http://www.niir.org/books/book/plant-biotechnology-handbook-niirboard/isbn-8186623833/zb,,75,a,d,0,a/index.html 1.2. LOS FIJADORES DE NITRÓGENO Los organismos con la capacidad para reducir N2, también denominados diazótrofos, son todos procariotas pertenecientes a los dominios Bacteria y Archaea. En la revisión de Karl et al. (2002) se detallan los siguientes grupos en el medio marino: i) 22 cianobacterias de vida libre, unicelulares o coloniales, con o sin heterocistos, tanto fotoautótrofas como fotoheterótrofas, que incluyen representantes en los géneros Synechococcus, TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Synechocystis, Oscillatoria, Trichodesmium; Nodularia, Aphanizomenen y ii) bacterias anoxigénicas fotoautótrofas y fotoheterótrofas; iii) bacterias de vida libre, quimioheterótrofas facultativas anaerobias como, por ejemplo, Vibrio diazotrophicus; iv) bacterias quimioautótrofas, incluidas en los géneros Thiobacillus y Beggiatoa; v) bacterias y archaeas anaerobias Desulfovibrio desulfuricans y respectivamente; obligadas, por ejemplo Methanosarcina spp., vi) cianobacterias epífitas de macroalgas; vii) bacterias quimioheterótrofas endosimbiontes de otras especies de microalgas como, por ejemplo, Richelia intracellularis; viii) bacterias ecto- y endosimbiontes de invertebrados marinos; Como vemos hay una amplia variedad de fijadores documentados en el medio marino. Sin embargo, la mayoría de los estudios hechos en las últimas décadas se han centrado casi exclusivamente en los representantes del género Trichodesmium. Entre las múltiples razones que explican el interés que ha suscitado este grupo podemos destacar: su ubicuidad en las regiones oligotróficas, lo cual junto con sus tasas relativamente altas de fijación de N2, sugieren que tienen potencial para influir de manera notable en el ciclo del nitrógeno; la capacidad para generar extensas proliferaciones (con abundancias superiores a 2.000-3.000 filamentos por litro y extensiones de miles de km2), visibles incluso desde el espacio (Figura 1.4) y la facilidad para identificarlas y trabajar con ellas, ya que se ven a simple vista, por lo que la manipulación de las colonias es sencilla (Figura 1.5). Los datos disponibles señalan a las cianobacterias como el grupo más relevante de diazótrofos marinos, por lo cual las describimos con más detalle en el siguiente apartado. 23 1. INTRODUCCIÓN Figura 1.4. Fotografía tomada desde un transbordador espacial mostrando una proliferación de Trichodesmium en el Canal de Capricornio, cerca de la Gran Barrera de Coral en Australia. Fuente: http://www.soes.soton.ac.uk/staff/tt/nf/structure/ 1.3. LAS CIANOBACTERIAS DIAZÓTROFAS Los tres grupos principales de cianobacterias fijadoras de N2 en las regiones oligotróficas son (Zehr, 2011): a) el género Trichodesmium; b) los simbiontes formadores de heterocistos (e.g. Richelia y Calothrix) y c) las cianobacterias unicelulares. 1.3.1. Trichodesmium Los representantes del género Trichodesmium son cianobacterias filamentosas (Figura 1.6), no heterocísticas, con capacidad para formar colonias y que aparecen con frecuencia en mares tropicales y subtropicales con temperaturas por encima de 20ºC (Capone et al., 1997). Los filamentos reciben el nombre de tricomas y cada uno de ellos contiene una media de 100 células (Carpenter y Capone, 1992). Las colonias presentan dos morfologías típicas: forma esférica, 24 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO denominada puff, y forma de haz, llamada tuft (Figura 1.6). Como media se pueden encontrar unos 200 tricomas por colonia (Carpenter, 1983). En el medio marino aparecen tanto tricomas libres como colonias. Contra lo que se pensaba tradicionalmente, estudios recientes sugieren que la abundancia de tricomas libres en la columna de agua puede superar a la abundancia de filamentos en colonias (Carpenter et al., 2004; González Taboada et al., 2010). Figura 1.5. Detalle de colonia esférica de Trichodesmium dentro de una botella Corning de 70 mL. Foto: A. Bode (Trynitrop 2008). Se conocen 5 especies de Trichodesmium (T. erythraeum, T. thiebauthii, T. tenue, T. hildebrandtii y T. contortum), que pueden diferenciarse según características morfológicas y suelen coexistir en el medio natural (Karl et al., 2002). Sin embargo, diversos estudios genéticos señalan la existencia de sólo dos grupos principales: T. erythraeum y las demás especies (Zehr, 2011). Desde principios de los años 80, se han podido aislar y mantener en cultivo tres cepas: a) la NIBB1067 aislada en aguas de Kuroshio (Ohki y Fujita, 1982); b) la IMS101, de aguas costeras del Atlántico norte (Prufet-Bebout et al., 1993); y c) 25 1. INTRODUCCIÓN la MACC0993, de la zona costera de Qingdao en China (Haxo et al., 1987). Las dos primeras están próximas a T. erythraeum y, de ellas, la cepa IMS101 es la que ha sido objeto de más estudios. Figura 1.6. Tricoma libre (A) y estructuras típicas de colonias de Trichodesmium: puff (B) y tuft (C). Es interesante señalar que Trichodesmium posee una vacuola gaseosa relativamente grande en el interior de la célula. Se ha sugerido que estas cianobacterias son capaces de realizar migraciones en la columna de agua gracias a este orgánulo. Se cree que la flotabilidad positiva que proporciona la vacuola, combinada con la capacidad para almacenar carbohidratos, que actuarían como lastre, les daría un cierto control sobre la flotabilidad, permitiendo dichas migraciones para aprovisionamiento de nutrientes (Karl et al., 1992; Villareal y Carpenter, 2003). La característica más intrigante de este grupo es el hecho de que realizan la fijación de N2 durante el día. La fijación de Trichodesmium describe un ritmo circadiano similar al de la fotosíntesis, también relacionado con la luz. Sin embargo, este grupo carece de heterocistos en los que puedan proteger a la 26 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO nitrogenasa del oxígeno. Además, se sabe que la nitrogenasa de Trichodesmium no difiere sustancialmente de la del resto de diazótrofos (Sroga et al., 1996; Zehr et al., 1997). Entonces, ¿cuáles son los mecanismos de protección de la enzima en estas especies? Inicialmente se sugirió que, en las zonas centrales de las colonias, el consumo de oxígeno se vería favorecido por la disposición de los tricomas y la fijación de N2 sería posible. Pero se sabe que los tricomas libres también tienen capacidad para fijar N2, por lo que este mecanismo no sería aplicable en su caso (Karl et al., 2002). Por otra parte, parece que puede existir una ligera separación temporal de ambos procesos: en las horas centrales del día la fijación de nitrógeno es máxima y la fotosíntesis disminuye lo suficiente para generar regiones anóxicas (Berman-Frank et al., 2001b). Actualmente se debate la existencia de células especializadas, denominadas diazocitos, que se distribuyen en baja cantidad a lo largo de los tricomas, tienen una estructura celular ligeramente modificada y son ricas en nitrogenasa (Frederiksson y Bergman, 1997). Diversos estudios han detectado que la nitrogenasa aparece sólo en el 10-15% de las células de un tricoma (Lin et al., 1998; Berman-Frank et al., 2001b; El-Shehawy et al., 2003) y, por tanto, confirmarían la existencia de los diazocitos. Sin embargo, también existen publicaciones que demuestran una distribución equitativa de la nitrogenasa en los filamentos de Trichodesmium (Paerl et al., 1989; Ohki, 2008; Ohki y Taniuchi, 2009). Por ello todavía no están claros los mecanismos de protección in vivo que permiten a esta cianobacteria realizar simultáneamente la fijación de N2 y la fotosíntesis. La mayoría de grupos de zooplancton pelágico no consume a los representantes de Trichodesmium (O’Neil y Roman, 1992), debido a su toxicidad (Hawser et al., 1992), y sólo algunos copépodos harpaticoides parecen ser capaces de depredar a esta cianobacteria (O’Neil, 1997). Por lo tanto, la exudación directa de nitrógeno orgánico disuelto, que puede representar hasta un 50% del total de N2 recién fijado (Glibert y Bronk, 1994), sería la vía principal de transmisión del nitrógeno recién fijado por Trichodesmium a la red. También se ha definido una vía de liberación por lisis celular, que puede ser mediada por virus (Hewson et al., 2004) o por un proceso autocatalítico de muerte celular desencadenado 27 1. INTRODUCCIÓN por la limitación por hierro y/o fósforo, altas irradiancias o estrés oxidativo (Berman-Frank et al., 2004). 1.3.2. Cianobacterias heterocísticas En el medio marino, las cianobacterias formadoras de heterocistos son típicas de zonas costeras, sobre todo de estuarios y el mar Báltico, donde es frecuente que proliferen (Zehr, 2011). Sin embargo, en las regiones oligotróficas son poco abundantes. La razón que explicaría esta baja abundancia se relaciona con la baja solubilidad de los gases (O2, N2) al aumentar la temperatura. En estas condiciones, el flujo de N2 al interior del heterocisto podría llegar a ser limitante, debido la baja difusividad de la pared lipídica del heterocisto, que no sólo limitaría la entrada de O2. Cuando está limitada por sustrato, la nitrogenasa deriva el flujo electrónico hacia la producción de H2, lo que implica un desperdicio de energía metabólica y poder reductor que puede llevar a la muerte celular (Staal et al., 2003; Stal, 2009). Así, las cianobacterias heterocísticas se verían excluidas de estos ambientes por otras cianobacterias más competitivas a temperaturas altas, como, por ejemplo, las del género Trichodesmium. En océano abierto, encontramos a especies representantes de Richelia y Calothrix, habitualmente endosimbiontes de diversos géneros de diatomeas como Rhizosolenia y Hemiaulus (Zehr, 2011). 1.3.3. Cianobacterias unicelulares libres Las cianobacterias unicelulares de vida libre se han descubierto recientemente (Zehr et al., 1998). En base a estudios de diversidad genética de nifH se han identificado, en diversos océanos y mares, tres grupos denominados: a) el grupo A o UCYN-A (abreviatura inglesa de unicellular cyanobacteria); b) el grupo b o UCYN-B y c) el grupo C o UCYN-C, que se relaciona con un género de cianobacterias bentónicas, Cyanothece. Los tres grupos son integrantes del nano- y picofitoplancton. 28 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Los representantes del grupo A tienen un diámetro inferior a 1 µm y carecen de ficoeritrina, el pigmento fotosintético típico en cianobacterias, por lo que ni las técnicas de microscopia tradicionales ni las de epifluorescencia de la ficoeritrina permitieron identificarlos (Zehr, 2011). Han sido necesarios estudios genéticos hechos a partir de células separadas por fluorescence-activated cell sorting (FACS), un tipo especial de citometría de flujo, para caracterizarlos. Los resultados obtenidos sugieren que los UCYN-A son similares al grupo bentónico Cyanothece y carecen de fotosistema II (Zehr et al., 2008). Además, tampoco presentan otras características enzimáticas, como la presencia de la RuBisCO o el ciclo de Krebs (Tripp et al., 2010), lo que indica que los representantes de este grupo son fotoheterótrofos y, según se ha sugerido, posiblemente también simbiontes, dado que necesitan una fuente externa de carbono orgánico (Zehr, 2011). Sin embargo, hasta la fecha, no se han encontrado evidencias claras de asociación de los UCYN-A con otros grupos del fitoplancton (Zehr, 2011). Las cianobacterias del grupo B son las únicas que se han aislado y cultivado satisfactoriamente. Actualmente, se dispone de 10 cepas del UCYN-B, provenientes de los océanos Atlántico y Pacífico, que se incluirían todas en el género Crocosphaera (Webb et al., 2009). Son fotoautótrofos, poseen ficoeritrina y realizan la fijación de N2 durante la noche. Su tamaño es ligeramente superior al de los UCYN-A, 3-8 µm. 1.4. REGULACIÓN DE LA FIJACIÓN DE N2 La reducción de un mol de nitrato para dar lugar a amonio sólo requiere de 2 moles de ATP, por lo cual es lógico esperar que la disponibilidad de nitrógeno combinado sea una variable importante en la regulación de la nitrogenasa. Diversos estudios con cultivos de la cianobacteria Trichodesmium, muestran que la disponibilidad de nitrógeno combinado, inorgánico u orgánico, hace que la fijación de N2 se reduzca o incluso se inhiba por completo (Ohki et al., 1991; Mulholland et al., 1999; Mulholland et al., 2001; Holl y Montoya, 2005). 29 1. INTRODUCCIÓN Como el nitrógeno molecular es el componente más abundante de la atmósfera (78%), los fijadores de N2 tienen una fuente casi ilimitada de nitrógeno a su disposición. En este contexto, el fósforo se convertiría en su principal limitante. Tanto en poblaciones naturales como en cultivos de fijadores, la baja disponibilidad de fósforo tiene un papel limitador directo sobre la fijación de N2 (Mulholland y Bernhardt, 2005; Mills et al., 2004; Sañudo-Wilhelmy et al., 2004). En el caso particular de Trichodesmium, se ha sugerido el desarrollo de múltiples estrategias para cubrir su demanda celular, como: a) la capacidad para consumir fósforo orgánico disuelto mediada por la enzima alcalina fosfatasa (Mulholland et al., 2002; Dyhrman et al., 2006); b) el luxury uptake de fósforo inorgánico, que le permitiría mantener una reserva intracelular de nutriente en exceso de sus requerimientos inmediatos (Fu et al., 2005); o c) la capacidad para sustituir los fosfolípidos de la membrana por lípidos no fosfatados en condiciones de limitación por fósforo (Van Mooy et al., 2009). Por otro lado, los cofactores metálicos que necesita el complejo enzimático también son limitadores potenciales de la fijación de N2. El molibdeno es consumido como molibdato (MoO4−2), un análogo estructural del sulfato (SO4−2). Este último se encuentra en concentraciones milimolares en agua de mar. Se ha demostrado la existencia de antagonismo entre ambos iones a altas concentraciones de sulfato (Cole et al., 1993). Sin embargo, el efecto sobre el consumo de molibdato es parcial, no llegando a inhibirse completamente. Dado que la demanda celular de molibdeno es relativamente baja, parece probable que el consumo y almacenamiento de este cofactor, a las tasas medidas en el medio marino, sean suficientes para cubrir las cuotas celulares (Karl et al., 2002). Además, como hemos visto, existen proteínas que usan otros cofactores, lo que evitaría la limitación por molibdeno. Por todo ello, es improbable que el molibdeno sea un factor de control principal de la fijación de N2 en el medio marino. Muchos de los fijadores de N2 son también fotoautótrofos, por lo que su demanda celular de hierro debería ser relativamente alta en comparación con los fotoautótrofos estrictos, debido a los requerimientos de la nitrogenasa. Según sugieren los estudios de Berman-Frank et al. (2001b) y Kustka et al. (2003b), 30 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO dicha demanda sería entre 5 y 10 veces superior a la de otros fotoautótrofos no fijadores de N2. Si, además, tenemos en cuenta que la cantidad de hierro disponible en las regiones oligotróficas, donde se localizan la mayoría de los diazótrofos, es extremadamente baja (<1 nM), que en su mayor parte se encuentra complejado con una amplia variedad de ligandos orgánicos (Wu et al., 2000) y que su suministro es principalmente atmosférico (Duce y Tindale, 1991), el hierro se presenta como un factor crítico en la regulación de la fijación de N2. Por ello, los fijadores parecen haber adoptado distintas estrategias que les permitan cubrir sus necesidades de este metal. Experimentos con cultivos de distintas cianobacterias señalan que las especies de mayor tamaño y coloniales, como Trichodesmium y Anabaena, tienden a estar más limitadas por hierro que las especies unicelulares, como Cyanothece, cuyos requerimientos serían menores y su eficiencia de uso del hierro mayor, gracias a que confinan la fijación de N2 a la noche, separándola temporalmente de la fotosíntesis (Berman-Frank et al., 2007). También se ha sugerido que las colonias de Trichodesmium han desarrollado la capacidad de hacer uso directo de las partículas de polvo atmosférico depositadas (Rueter et al., 1992; Rubin et al., 2011; Langlois et al., 2012), facilitando así la disolución del hierro, además de su disponibilidad y permitiéndole un luxury uptake de hierro que mantenga una reserva intracelular del mismo (Chen et al., 2011). El oxígeno es otro regulador importante de la fijación de N2, ya que, como hemos visto, tiene un efecto negativo directo sobre la nitrogenasa. En un medio rico en oxígeno y siendo muchos de ellos fotoautótrofos, los fijadores han tenido que adoptar diversas estrategias de protección de la enzima entre las que destacan (Paerl y Zehr, 2000): i) el desarrollo de células diferenciadas, denominadas heterocistos, en las que la estructura de su pared reduce notablemente la difusión de oxígeno al interior, donde sólo se realiza la fijación de N2; ii) separación espacial de la fotosíntesis y la fijación de N2, como sucede en algunas especies coloniales que carecen de heterocistos, por ejemplo, Trichodesmium (Berman-Frank et al., 2001b); 31 1. INTRODUCCIÓN iii) separación temporal de los procesos, de manera que la fotosíntesis se realizaría durante el día y la fijación de N2 durante la noche; iv) asociaciones mutualistas y simbiosis con otros organismos planctónicos, en las que el fijador suministra el nitrógeno combinado y el otro proporciona la protección frente al oxígeno ambiental. Por ejemplo, las asociaciones de los fijadores del género Richelia con diatomeas de los géneros Rhizosolenia o Hemiaulus (Karl et al., 2002); v) modificaciones del complejo enzimático para que el oxígeno lo inactive sólo temporalmente, en lugar de hacerlo irreversiblemente; vi) capacidad de autoprotección del propio complejo enzimático, mediante la reducción del oxígeno catalizada por la nitrogenasa reductasa (Bergman et al., 1997). Por último, la temperatura parece ser un factor clave en el control de la fijación de N2 (Carpenter y Capone, 2008). Sin embargo, concluir que existe un efecto directo sobre la actividad de la nitrogenasa no es inmediato, ya que en el medio marino temperatura y concentración de nitrato están correlacionados inversamente (Karl et al., 2002). Mediante una aproximación teórica, Stal (2009) muestra que el efecto de la temperatura sobre los fijadores no heterocísticos es indirecto. A medida que desciende la temperatura del agua aumenta la solubilidad del oxígeno y también disminuye la capacidad respiratoria de los organismos. Por debajo de un límite teórico de temperatura, estimado a partir del coeficiente de temperatura (Q10), los procesos respiratorios de los fijadores son de menor magnitud que la tasa de difusión de oxígeno al interior celular y no podrían mantener la anoxia intracelular que garantiza el funcionamiento de la nitrogenasa. En el caso particular de Trichodesmium, Stal (2009) calcula que este mínimo es 16,9ºC, que coincide con el mínimo experimental de crecimiento del organismo en cultivos de 17ºC determinado por Breitbarth et al. (2007). 32 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 1.5. LA FIJACIÓN ESTIMACIONES DE NITRÓGENO: MEDIDAS DIRECTAS Y Las determinaciones experimentales de fijación de N2 se hacen principalmente mediante dos técnicas: el ensayo de reducción de acetileno (acetylene reduction assay, ARA) y la técnica de incorporación de N2 enriquecido en 15N, un isótopo estable del nitrógeno muy escaso en el N2 atmosférico. El ensayo de reducción de acetileno en etileno aprovecha la baja especificidad de la enzima nitrogenasa por sustrato y usa el acetileno como un análogo del N2. Tiene la ventaja de que es muy sensible, permite obtener señal con tiempos de incubación de segundos a minutos, y su medición, mediante cromatografía de gases, es relativamente sencilla (Stewart et al., 1967). Por eso se ha empleado tradicionalmente y se sigue empleando, tanto en laboratorio como en campo, para estimar las tasas de fijación de N2. Se trata de una medida indirecta cuya transformación en tasas de fijación se hace mediante un factor de conversión, que tiene un valor teórico de 3:1 (C2H2:N2), y que se calcula por la diferencia en el número de electrones necesarios para reducir ambas moléculas. En la mayoría de ecosistemas, este factor suele permanecer constante; sin embargo, la intercalibración con el método del 15N2 ha mostrado que existen excepciones que presentan cierta variabilidad en el rango de 3:1 a 9:1. Esto hace recomendable convertir esa calibración en rutinaria para facilitar las comparaciones de los datos de ambos métodos (Montoya et al., 1996). Por último, es importante señalar que la medida de la reducción de acetileno nos da información sobre la tasa bruta de fijación de N2, ya que no tiene en cuenta la liberación extracelular de nitrógeno recién fijado. La variabilidad en la importancia de esta liberación extracelular puede contribuir a explicar los cambios en el factor de conversión del ensayo de reducción de acetileno. La mejora de la sensibilidad y simplificación de uso de la espectrometría de masas en los últimos 20 años ha permitido la generalización de la técnica del 15 N2, que en los años 1960 era un método complejo y tedioso. Montoya et al. (1996) presentan un método relativamente sencillo basado en la adición de una burbuja de N2 enriquecido en 15N en un 98-99% para la medida directa de la tasa neta de fijación de N2, produciendo una menor perturbación en las 33 1. INTRODUCCIÓN poblaciones. Las ventajas que señalan los autores sobre la reducción de acetileno son: a) es una medida directa de la conversión de N2 en biomasa; b) el volumen final de gas dentro de la botella es mucho menor, por lo tanto la agitación será menos agresiva y no contribuirá tanto al efecto botella; c) aunque la sensibilidad de las dos técnicas en sistemas eutróficos es similar, en sistemas oligotróficos la técnica del 15N2 es más sensible; d) además, permite seguir el movimiento del N2 en la red trófica; e) por último, la incubación de 15N2 junto con 13C-HCO3− posibilita los estudios conjuntos de diazotrofía y producción primaria. Sin embargo, el método tradicional de inyección de N2 en burbuja podría estar subestimando las tasas de fijación de N2, como consecuencia del tiempo de incubación y/o la composición de la comunidad de diazótrofos (Mohr et al., 2010; Grosskopf et al., 2012). Se ha visto que, en incubaciones cortas, el gas inyectado no alcanza el equilibrio con el agua de la botella, por lo que la disponibilidad del mismo será menor de la esperada y, en consecuencia, las tasas relativas medidas también serán menores (Mohr et al., 2010). Por otro lado, el grado de aprovechamiento de esa menor cantidad de gas parece depender de la composición específica de la comunidad. Por ejemplo, si el diazótrofo dominante fuese Trichodesmium, la subestimación llegaría, en promedio, a la mitad (Grosskopf et al., 2012). Ambos estudios proponen un método de disolución previa del 15N2 añadido a las botellas, que evitaría los problemas de equilibrio y aprovechamiento y, además, simplificaría el trabajo de campo. La resolución espacial y vertical que se obtiene mediante las técnicas de medida directa por incubación está claramente limitada por factores como el número de réplicas, el tiempo de incubación, el número de estaciones diarias posible, etc. Además, sólo obtenemos medidas puntuales en el tiempo, por lo que la integración de la fijación de nitrógeno tanto a escalas espaciales como temporales amplias es difícil y puede no representar adecuadamente la variabilidad de este flujo. Por ello, el uso de estimaciones indirectas es inevitable, ya que permiten obtener datos más representativos en regiones más amplias durante periodos de tiempo más largos. Las aproximaciones empleadas 34 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO con mayor frecuencia son el análisis de la señal isotópica de nitrógeno en partículas y zooplancton o las estimaciones geoquímicas que reflejan las variaciones de las concentraciones de nitrato y fosfato, debidas al balance y estequiometría de la fijación de N2 y desnitrificación y expresadas mediante un trazador biogeoquímico conocido como N* (Gruber y Sarmiento, 1997). El análisis de la señal isotópica se basa en la diferente relación de isótopos de nitrógeno (15N y 14N) que presentan las distintas fuentes de nitrógeno combinado. El N2 de la atmósfera está empobrecido de manera natural en 15N, en una proporción 15N/14N = 0,003676 (Montoya et al., 1996). Mientras, el nitrato profundo que entra por difusión vertical está enriquecido en 15N, con una proporción media de 15N/14N = 0,003693 (Montoya et al., 2002). La magnitud de estas proporciones es tan baja, que resulta más sencillo cuantificar las diferencias en la proporción 15N/14N que los valores absolutos en sí. Así, por convención, se emplea un indicador de la abundancia natural de 15N, el δ15N, respecto a un valor de referencia, que por convenio es la abundancia del N2 atmosférico (Coplen et al., 1992), y que se expresa como: 15 N:14N muestra 15 N:14N referencia 15 δ N = ( -1 ) x 1000 (‰) En el medio marino, este indicador toma valores en un rango de −2 a 30‰ en la materia particulada o los nutrientes inorgánicos. La aproximación más sencilla en este análisis sería asumir que el δ15N de la biomasa de los productores primarios refleja directamente la relación isotópica de la fuente de nitrógeno empleada. Así, valores próximos a cero o negativos del δ15N de la comunidad microbiana identifican zonas en las que la fijación de N2 es un proceso preferente de entrada de nitrógeno. Sin embargo, la diferencia de peso de los isótopos provoca una discriminación negativa contra el isótopo pesado (15N) en la mayoría de reacciones. Es lo que se conoce como fraccionamiento cinético isotópico, que es una medida de las diferentes tasas de reacción de las moléculas 35 1. INTRODUCCIÓN según contengan uno u otro isótopo de nitrógeno (Montoya, 2008). Dicho fraccionamiento sólo se produce mientras la reacción no consuma completamente los sustratos. Así, una comunidad de fitoplancton creciendo con nitrato proveniente de un pulso de afloramiento, al principio tendrá una señal menor, es decir, más ligera, que la del propio nitrato y acabará igualándola cuando se consuma completamente el nitrato aflorado. Las distintas reacciones metabólicas del ciclo del nitrógeno tienen sus propias tasas de fraccionamiento, que no son universales; por lo tanto, el grado de enriquecimiento o empobrecimiento en 15N que provocan en los sustratos y productos será diferente (Figura 1.7). Figura 1.7. Valores típicos del factor de enriquecimiento isotópico en las reacciones de asimilación y desamilación del nitrógeno en el medio marino. Figura adaptada de Gruber (2008), valores de Montoya (2008). A este primer nivel de incertidumbre generado por la propia naturaleza de las reacciones mediadas por la comunidad microbiana debemos añadir lo que se denomina como efecto trófico (Montoya, 2008), que consiste en un enriquecimiento sistemático en 15N de la biomasa del zooplancton al subir niveles en la red trófica. Todavía no se ha definido el mecanismo exacto que lo origina, pero se ha observado que la excreción del zooplancton resulta en la 36 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO liberación de amonio ligero, muy pobre en 15N, mientras que los tejidos se enriquecen en dicho isótopo (Bada et al., 1989, Gannes et al., 1997). El primer efecto evidente es la existencia de una reserva de amonio ligero que, una vez incorporado en la biomasa del fitoplancton, daría lugar a una señal isotópica similar a la de la incorporación de N2 atmosférico. Un tercer factor de incertidumbre que conviene señalar es el efecto de la deposición atmosférica de nitrógeno reactivo ligero, producido en muchos casos por actividades humanas, como el uso de combustibles fósiles o la producción de fertilizantes. En latitudes altas y medias, se ha detectado un descenso en el δ15N del nitrógeno depositado en lagos a lo largo del último siglo (Hastings et al., 2009; Holtgrieve et al., 2011). En el Atlántico Norte tropical, Baker et al. (2007) detectaron un valor medio de δ15N en el nitrato de aerosoles de −3‰, con una disminución clara de la señal hacia la zona este de la cuenca, más influenciada por los aportes antropogénicos de nitrógeno (Duce et al., 2008). Según todo esto, los procesos que determinan la señal isotópica final tanto en las partículas en suspensión como en el zooplancton son muy variados y, por tanto, su análisis resulta relativamente complicado. El trazador N*, definido por Michaels et al. (1996) y modificado posteriormente por Gruber y Sarmiento (1997), es un indicador biogeoquímico del exceso o defecto de nitrato respecto a la estequiometría de Redfield. Se calcula, por tanto, en base a las concentraciones de nutrientes (nitrato y fosfato) en la columna de agua. En su expresión se añade una constante que fuerza a que la media global de N*, calculada en función las bases de datos del GEOSECS, sea cero y se mantenga en un estado conservativo. Por lo tanto cualquier desviación de ese estado conservativo global será debida al balance de los procesos de desnitrificación y fijación de N2 (Gruber y Sarmiento, 1997). La ecuación modificada del N* es la siguiente: N* = 0,87 × [NO3−] – 16 × [PO4−3] + 2,9 (µmol kg−1) 37 1. INTRODUCCIÓN En general, el análisis de este indicador considera que un gradiente positivo no conservativo de N* por encima de 2,5 µmol kg−1 implica un proceso neto de fijación de N2, siempre que no existan procesos de mezcla importantes (Mahaffey et al., 2005). 1.6. FIJACIÓN DE N2 EN EL OCÉANO ATLÁNTICO Como vimos en apartados anteriores, la fijación de N2 es un proceso relevante de entrada de nitrógeno nuevo en la capa fótica cuyo efecto sobre la captación biológica de CO2 atmosférico es directo y más eficaz que el debido al flujo ascensional de nitrato (Michael et al., 2001). Los exigentes requerimientos de este proceso enzimático hacen que los diazótrofos sean menos aptos competitivamente en ambientes ricos en nutrientes, como pueden ser las zonas costeras o las regiones oceánicas sujetas a afloramientos regulares. Sin embargo, la diazotrofía se convierte en una ventaja clara en ambientes oligotróficos. Dado que las regiones oligotróficas representan más del 70% de la superficie total de los océanos (Longhurst, 1998), podemos suponer que la fijación de N2 será un proceso significativo de entrada de nitrógeno nuevo en la capa eufótica. En el océano Atlántico, muchos de los factores de regulación de la nitrogenasa, que hemos visto en apartados anteriores, están sujetos a importantes gradientes espaciales, tanto en latitud como en longitud. Por ejemplo, los aportes atmosféricos de nutrientes tales como hierro o nitrógeno exhiben un claro desequilibrio norte-sur, en frecuencia y en intensidad (Gao et al., 2001; Duce et al., 2008), siendo mayores en el norte y en las proximidades de los continentes. El forzamiento físico al que están sujetas las comunidades oceánicas cambia notablemente hacia el interior de los giros, donde la termoclina se hace más profunda y aumenta la estabilidad de la columna de agua, debilitando así la entrada difusiva de nutrientes a la capa fótica. Estos gradientes deberían influir sobre los patrones de distribución de los fijadores y su actividad. Sin embargo, como veremos, los estudios de estas variables en escalas espaciales amplias, que ayuden a esclarecer qué factores determinan los patrones observados en los 38 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO distintos océanos, son bastante escasos (Moore et al., 2009; Kitajima et al., 2009; Moisander et al., 2010). La información disponible muestra que, en el océano Atlántico, Trichodesmium se distribuye preferentemente entre 0º y 20ºN (Tyrrell et al., 2003; Westberry y Siegel, 2006; Moore et al., 2009) y de manera asimétrica; así, es más abundante, e incluso llega a generar proliferaciones extensas, en el lado oeste (Carpenter et al., 2004; Montoya et al., 2007). Los estudios de abundancia de copias de nifH indican que Trichodesmium domina la comunidad de diazótrofos, especialmente en aguas superficiales (Langlois et al., 2005; Langlois et al., 2008; Luo et al., 2012). Entre los diversos factores que se señalan como controladores de la distribución de Trichodesmium en los distintos océanos tenemos: a) alta estabilidad de la columna de agua, con capas de mezcla profundas (100 m) y gran penetración de la luz, además de bajas concentraciones de nutrientes (Capone et al., 1997); b) temperaturas por encima de 20ºC, que favorecen tanto la actividad de la nitrogenasa como los procesos de consumo de oxígeno (Breitbarth et al., 2007; Stal, 2009); c) la disponibilidad de hierro y/o fósforo (Berman-Frank et al., 2001a; Sañudo-Wilhelmy et al., 2001; Kustka et al., 2003a; Mills et al., 2004; Mulholland y Bernhardt, 2005). La mayoría de estudios de distribución y abundancia de cianobacterias unicelulares se han restringido al Atlántico Norte. Todos ellos coinciden en que, después de Trichodesmium, el grupo A es el más abundante en las muestras superficiales (Langlois et al., 2005; Langlois et al., 2008; Foster et al., 2008; Goebel et al., 2010). Sin embargo, al contrario de lo que ocurre con Trichodesmium, siempre se ha detectado algún grupo de cianobacterias unicelulares en todas las localizaciones estudiadas hasta la fecha, siendo más abundantes y frecuentes los UCYN-A y mucho más raros los UCYN-C. También se ha descrito un patrón longitudinal de abundancias inverso al de Trichodesmium; así, el grupo A aparece en mayor cantidad en la cuenca este y se le han asociado tasas de fijación de N2 similares o incluso superiores a las de Trichodesmium en las proximidades de Cabo Verde (Goebel et al., 2010). Los datos sugieren que esta distribución está controlada principalmente por la temperatura. Los UCYN-A tienen preferencia por aguas más frías que los 39 1. INTRODUCCIÓN UCYN-B o Trichodesmium (Langlois et al., 2005; Langlois et al., 2008; Goebel et al., 2010), lo cual está apoyado por el modelo teórico de Stal (2009), que calcula un mínimo teórico de temperatura para la fijación de N2 inferior al de Trichodesmium. Esta tendencia se ve también confirmada por el estudio de Moisander et al. (2010) en el Pacífico, que sugiere que la temperatura es el principal factor determinante de la distribución de las cianobacterias unicelulares, produciéndose, además, una segregación de los grupos A y B en profundidad. Mientras el grupo B se localiza en aguas superficiales más cálidas, el grupo A aparece asociado a aguas profundas y más frías. Estos autores sugieren que esta distribución se debería a las diferentes adaptaciones de estos grupos a la temperatura, las condiciones de luz y los requerimientos de nutrientes. De todas formas, todavía hay muchos interrogantes abiertos respecto a estos grupos de cianobacterias libres. Así, si los patrones descritos en el Pacífico se repitiesen en otras zonas del mundo, la distribución potencial de los fijadores de N2 y, por lo tanto, la importancia de la fijación de N2 en el ciclo marino del nitrógeno sería mayor de lo que se ha considerado hasta ahora, dado que la mayoría de modelos y estimaciones restringen la fijación de N2 sólo a las áreas de distribución de Trichodesmium y a sus tasas de diazotrofía. Las medidas directas de fijación de N2 hechas en estudios a escala de cuenca en el Atlántico son también escasas (Voss et al., 2004; Staal et al., 2007; Moore et al., 2009). Además, la mayoría de las medidas se han realizado en el hemisferio norte y en el oeste (Capone et al., 2005; Mulholland et al., 2006; Montoya et al., 2007), donde Trichodesmium es más abundante. No obstante, como se mencionaba anteriormente, también se han medido tasas de fijación de N2 asociadas a cianobacterias unicelulares, relativamente importantes, en la región de Cabo Verde (Goebel et al., 2010), la plataforma este de Estados Unidos entre 36º-39ºN (Mulholland et al., 2012) o, incluso, en el canal de Mancha (Rees et al., 2009), lo que ilustra la necesidad de ampliar las zonas de estudio de este proceso. Estas medidas de fijación de N2 describen una tendencia longitudinal creciente hacia el oeste en el hemisferio norte (Montoya et al., 2007), que parece confirmarse con los datos del δ15N en distintas fracciones de zooplancton (Montoya et al., 2002; Landrum et al., 2011). Sin embargo, en los patrones 40 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO latitudinales existen discrepancias claras entre medidas directas y estimaciones. Las medidas experimentales indican la existencia de un máximo de diazotrofía en la zona comprendida entre 0º-15ºN (Moore et al., 2009), que es confirmado sólo por el análisis de δ15N de partículas en suspensión de Mino et al. (2002). La mayoría de estudios posteriores de δ15N sugieren que la zona de máxima fijación estaría más al norte, en una región comprendida aproximadamente entre 15º y 30ºN (Mahaffey et al., 2003; Mahaffey et al., 2004; Reynolds et al., 2007). En esta región (15º-25ºN), también se han detectado gradientes positivos no conservativos de N* que sugieren que la fijación de N2 es un proceso relevante de suministro de nitrógeno (Gruber y Sarmiento, 1997; Hansell et al., 2004). 1.7. HIPÓTESIS Y OBJETIVOS La presente tesis aborda el estudio de la fijación de nitrógeno y los diazótrofos, en particular los representantes del género Trichodesmium, mediante una doble aproximación ecológica y biogeoquímica. Se pretende, por un lado, determinar qué factores regulan los patrones de distribución observados a gran escala y, por otro, el impacto relativo de los diazótrofos en la circulación de nitrógeno en la capa superficial del Atlántico tropical y subtropical. Las hipótesis particulares de las que parte este estudio son las siguientes. 1 − La distribución de Trichodesmium depende tanto de la disponibilidad de hierro o fósforo como de la profundidad de la capa de mezcla. Los aportes atmosféricos de hierro son más intensos en el norte, mientras que la disponibilidad de fósforo aumenta hacia el sur. Por ello esperamos un cambio en el nutriente limitante con la latitud; así, el fósforo sería más limitante en el hemisferio norte y el hierro en el hemisferio sur. 2 − Otros grupos de cianobacterias contribuyen de manera significativa a la fijación de N2, por lo que este proceso no tiene por qué restringirse sólo a las áreas de distribución de Trichodesmium. 41 1. INTRODUCCIÓN 3 − La fijación de N2 es un proceso importante de entrada de nitrógeno nuevo en la capa fótica de las regiones tropicales y subtropicales del océano Atlántico. 4 − Como consecuencia de la hipótesis anterior, la fijación de nitrógeno contribuye de manera relevante al suministro de nitrógeno de niveles tróficos superiores en las regiones tropicales y subtropicales del océano Atlántico. Los objetivos específicos planteados para dar respuesta a estas hipótesis son: 1. Determinar la distribución zonal, en un gradiente este-oeste, de la abundancia de Trichodesmium y la fijación de nitrógeno de la comunidad diazótrofa en el borde oriental del giro subtropical del Atlántico norte. 2. Determinar la distribución meridional, a escala de cuenca, de la abundancia de Trichodesmium y la fijación de nitrógeno de la comunidad en el océano Atlántico tropical y subtropical. 42 3. Relacionar las distribuciones de Trichodesmium y de la fijación de nitrógeno con los posibles factores de control, tales como: profundidad de la capa de mezcla, temperatura y disponibilidad de hierro y/o fósforo. 4. Establecer la importancia relativa de la diazotrofía en el suministro de nitrógeno hacia la capa eufótica a escala de cuenca en dos épocas contrastadas. 5. Determinar la contribución de la diazotrofía al suministro de nitrógeno de los consumidores en niveles tróficos superiores: micro- y mesozooplancton. TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 1.8. ESTRUCTURA DE LA TESIS Los datos de la presente tesis se recogieron durante las dos campañas del proyecto “TRichodesmium spp. Y fijación de NItrógeno en el Atlántico TROPical” (TRYNITROP) en el océano Atlántico, a bordo del B/O Hepérides, del 17 noviembre al 8 de diciembre de 2007 y del 13 de abril al 2 de mayo de 2008. En ambas campañas se siguieron dos transectos diferenciados: uno zonal en el Atlántico norte, para estudiar la variabilidad este-oeste, y uno meridional a lo largo del Atlántico tropical y subtropical, para estudiar la variabilidad nortesur. Los muestreos principales se efectuaron cada 24 horas, en las horas previas al amanecer. Durante la estación diaria se tomaron la mayoría de las medidas para la caracterización de la capa superficial del océano (0-300m). La distancia media entre estaciones fue de unos 400 km. En 2007 se hicieron un total de 22 estaciones, mientras en 2008 se llegó a 20 estaciones. Las variables medidas en cada estación diaria incluyeron: temperatura, salinidad, concentración de nutrientes inorgánicos, clorofila a total, fijación de nitrógeno de la comunidad de diazótrofos, abundancia de Trichodesmium en la columna de agua y abundancia natural de isótopos en partículas en suspensión y en pescas de plancton en dos clases de tamaño (40-200µm y >200µm). Para la caracterización de la abundancia superficial de Trichodesmium se tomaron muestras con más frecuencia, cada 3-8 horas, aprovechando el suministro de agua en continuo del barco. Así, la resolución espacial de esta variable aumentó notablemente, al obtenerse medidas separadas 55-70 km a lo largo de los transectos. También se han empleado bases de datos satélite disponibles on-line para estimar la concentración de polvo en la atmósfera en cada estación diaria. El análisis de los datos se divide en tres capítulos. El estudio de la variabilidad en la abundancia de Trichodesmium y de la fijación de nitrógeno se presenta dividido según la variabilidad espacial estudiada: zonal o meridional. Por otro lado, la abundancia natural de isótopos de nitrógeno se analiza en un único capítulo. 43 1. INTRODUCCIÓN El primer capítulo analiza la variabilidad zonal de las medidas directas de abundancias de Trichodesmium y fijación de nitrógeno a lo largo de un gradiente este-oeste en el Atlántico norte y los posibles factores de control que explicarían las distribuciones observadas en dos épocas contrastadas. El segundo capítulo aborda el estudio de la variabilidad meridional en la abundancia de Trichodesmium y la fijación de nitrógeno. Intentaremos determinar cuáles son los factores de control que explican los patrones a escala de cuenca, que se repiten de manera consistente en diferentes épocas del año, además de la relevancia biogeoquímica de la fijación de nitrógeno en el océano Atlántico. En el tercer capítulo estudiamos el posible efecto de la fijación de nitrógeno en el balance de isótopos de nitrógeno de las partículas en suspensión, usadas como un indicador de la dinámica en fitoplancton, y su transferencia a niveles tróficos superiores. Además, se comparan los patrones inferidos a través del estudio de isótopos con los observados en los dos capítulos anteriores. 44 Community N2 fixation and Trichodesmium spp. abundance along longitudinal gradients in the eastern subtropical North Atlantic ABSTRACT We have determined planktonic community N2 fixation, Trichodesmium abundance, the concentration and vertical diffusive flux of phosphate, and satellite-derived estimates of atmospheric concentration of dust along two longitudinal transects in the eastern subtropical North Atlantic during November 2007 and April-May 2008. Trichodesmium abundance was particularly low (< 3 trichome l−1) during the spring 2008 cruise, when lower sea surface temperatures were recorded and vertical stratification was less marked. However, community N2 fixation was always measurable, albeit low compared with other regions of the tropical Atlantic. The average vertically integrated N2 fixation rate was 1.20±0.48µmol N m−2 d−1 in autumn 2007 and 8.31±3.31 µmol N m−2 d−1 in spring 2008. The comparison of these rates of diazotrophy with the observed Trichodesmium abundances suggests that other, presumably unicellular, diazotrophs must have contributed significantly to community N2 fixation, at least during the spring 2008 cruise. Satellite data of atmospheric dust concentration suggested similar rates of atmospheric deposition during the two surveys. In contrast, vertical diffusive fluxes of phosphate were 5-fold higher in spring than in autumn (14.2±12.1 µmol P m−2 d−1 and 2.8±2.6 µmol P m−2 d−1, respectively), which may have stimulated N2 fixation. These findings agree with the growing view that N2 fixation is a more widespread process that the sole distribution of Trichodesmium may suggest. Our data also suggest a role for phosphorus supply in controlling the local variability of diazotrophic activity in a region subject to relatively high atmospheric inputs of iron. TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 2.1. INTRODUCTION Nitrogen is the primary limiting nutrient for productivity in the world open ocean and biological di-nitrogen (N2) fixation represents an important supply of new nitrogen to the euphotic layer in tropical and subtropical regions (Karl et al., 2002). N2 fixation can be more effective in sustaining net biological CO2 drawdown than the vertical flux of nitrate, since the latter is also coupled with an upward flux of CO2 from deeper waters (Michaels et al., 2001). In the oceans, N2 fixation is carried out by cyanobacteria and, within this group, the most studied species belong to the genus Trichodesmium (Capone et al., 1997; Galloway et al., 2004). Their ability to form large blooms, widespread distribution and high diazotrophic activity confer them a relevant role in the global nitrogen cycle (Capone, 2001; Mahaffey et al., 2005). Trichodesmium has been estimated to account for the fixation of 1.6 × 1012 mol N yr−1 in the tropical Atlantic Ocean (Capone et al., 2005). However, recent studies point out that other organisms, mainly unicellular groups, may also be relevant (Zehr et al., 2001; Montoya et al., 2004; Moisander et al., 2010). Some of these diazotrophic unicells distribute more uniformly in the water column (Langlois et al., 2008) and their temperature optima for nitrogen fixation seem to be lower than that of Trichodesmium (Langlois et al., 2005; Stal, 2009). Measured rates of N2 fixation attributable to unicellular fixers in those regions where they dominate the diazotrophic community are similar to those of regions with moderate or low abundance of Trichodesmium (Montoya et al., 2004; Montoya et al., 2007). Relatively few studies have addressed the distribution and abundance of diazotrophs as well as their rates of N2 fixation over large spatial scales (Moore et al., 2009; Goebel et al., 2010; Sohm et al., 2011). This fact makes it difficult to define the physical, chemical and/or biological constraints that control diazotrophs distribution and activity and, therefore, hinders our understanding of these organisms and their impact in the nitrogen cycle. Predictive models are becoming useful tools to establish large scale distributional patterns (Hood et al., 2004; Monteiro et al., 2010), but an extensive set of observations is still needed to validate these models. 49 2. ZONAL VARIABILITY The available studies suggest a westward increase in the abundance and N2 fixation activity of Trichodesmium in the subtropical North Atlantic (Carpenter et al., 2004; Montoya et al., 2007; Goebel et al. 2010). Longitudinal changes in temperature, water column stability, upward diffusive fluxes of nutrients, and atmospheric deposition of dust confer to the subtropical eastern North Atlantic a high interest to gain insight into the factors affecting the distribution and activity of diazotrophs. This zonal variability has been scarcely studied in the eastern North Atlantic, in contrast to the thoroughly characterized western North Atlantic. To our knowledge, only the works of McCarthy and Carpenter (1979) and Benavides et al. (2011) provide a coupled study of the longitudinal variability of nitrogen fixation and Trichodesmium in this area of the ocean, complemented with González Taboada et al. (2010) which gives a description of the variability of Trichodesmium in the water column. The present work focuses on the eastern subtropical North Atlantic, starting from the hypothesis that longitudinal gradients in potential control constraints (i.e., temperature, water column stratification, and nutrient availability) can determine Trichodesmium abundance and distribution, as well as their importance for community N2 fixation relative to that of unicellular fixers. Our main goal is to study the zonal variability in those controls during two contrasting seasons in the eastern subtropical North Atlantic and determine their possible role in controlling N2 fixation in this region. The data presented in this chapter have been published in ICES Journal of Marine Science. Citation: Fernández A, Graña R, Mouriño-Carballido B, Bode A, Varela M, Domínguez-Yanes JF, Escánez J, de Armas D, Marañón E (2013) Community N2 fixation and Trichodesmium spp. abundance along longitudinal gradients in the eastern subtropical North Atlantic. ICES Journal of Marine Science 70: 223–231. 50 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 2.2. MATERIAL AND METHODS 2.2.1. Sampling, hydrography and nutrients Sampling took place during 17-22 November, 2007 and 29 April-2 May, 2008 on board BIO ‘Hespérides’ in the eastern North Atlantic Ocean (Fig. 2.1), as part of the TRYNITROP (Trichodesmium and nitrogen fixation in the Atlantic Ocean) cruises. In both seasons, the ship’s track followed a longitudinal transect, along 26ºN from 17º to 38ºW in 2007 and along 29ºN from 15º to 29ºW in 2008, comprising a total of 10 stations separated every ca. 400 km. Water sampling was carried out before dawn using 12-l Niskin bottles in a rosette which was cast to 300m depth. Vertical distribution of temperature and salinity was measured by a SBE 911plus CTD attached to the rosette. Samples to determine the vertical variability in nutrient concentration, chlorophyll a (chla) concentration, particulate primary production and community 15N2 fixation were taken at each station. 2007 2008 Figure 2.1. Map showing the stations of autumn 2007 (white circles) and spring 2008 (grey triangles) longitudinal cruises, which took place during 17-22 November, 2007 and 29 April-2 May, 2008. Samples for inorganic phosphate from 10-14 depths (0-300m) were stored frozen at −20ºC until analysed at the on-shore laboratory, following standard colorimetric methods (Grasshof, 1976). The detection limit for the analysis of 51 2. ZONAL VARIABILITY phosphate concentration was 0.02 µmol l−1. The concentrations of nitrate, nitrite and ammonium were determined on board on fresh samples using a Technicon segmented-flow auto-analyser and a modified colorimetric protocol which allows a detection limit of 2 nmol l-1 (Raimbault et al., 1990; Kerouel and Aminot, 1997). During the spring 2008 cruise, measurements of microstructure velocity shear were conducted down to 200m using a microstructure profiler (Prandke and Stips, 1998) as described in Mouriño-Carballido et al. (2011). In this previous study the authors estimated the vertical diffusive fluxes of nitrate to the euphotic layer using the data retrieved by the microstructure profiler. Here, we use these data to calculate the vertical fluxes of phosphate into the euphotic layer as the product of the estimated diffusion coefficients (kz) and the gradients of phosphate concentration, computed across 10m depth steps by linear interpolation. Vertical diffusivity (kz) was estimated as in Osborn (1980): kz = e ε N2 Where e is a mixing efficiency (e = 0.2), ε is the dissipation rate of turbulent kinetic energy and N is the Brunt-Väisälä frequency averaged over depth intervals of 10m length for each station. Along the longitudinal section in spring 2008, the values of the measured dissipation rate of turbulent kinetic energy showed small variability between stations (−8.5 to −7.5 m2 s−3). Thus, we used the averaged vertical profile of ε values measured along 15º-25ºW in 2008 to compute the vertical diffusivity of phosphate both in autumn 2007 and spring 2008 cruises. 2.2.2. Satellite-derived estimates of dust concentration We used data available from the Giovanni online data system, developed and maintained by the NASA Goddard Earth Sciences (GES) Data and Information 52 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC Services Center (DISC). In particular, we used Aqua-MODIS Aerosol Optical Depth at 550nm and Aerosol Small Mode Fraction retrieved from a grid of 1º resolution and centred at the closest location of each station. These data, in combination with the wind speed modulus derived from AVISO-LAS (http://las.aviso.oceanobs.com/las/getUI.do) and the equations of Kaufman et al. (2005), were used to estimate the 15-day average atmospheric dust column concentration (g m−2) at each station. 2.2.3. Chlorophyll a For the measurement of chl-a concentration, 6-7 depths were chosen using the fluorescence profile provided by the CTD in each station. 250-ml samples from each depth were filtered, using low vacuum pressure, through 0.2 μm pore-size polycarbonate filters. Extraction was made in 90% acetone overnight and fluorescence was measured afterwards on board with a Turner Designs 700 fluorometer, previously calibrated with pure chlorophyll a (Fluka). 2.2.4. Trichodesmium abundance The ship’s non-toxic water supply was used to determine the surface abundance of Trichodesmium trichomes. Given that the ship stopped for work station only once every day, the distance between consecutive stations was > 400 km. However, the use of the continuous water supply allowed us to obtain samples for Trichodesmium abundance at intervals of 55-70 km, thus highly improving the spatial resolution of our measurements. Water was collected from ca. 5m depth by a Teflon pump and carried to the laboratories through epoxide free silicone pipes. At each sampling point, from 60 to 115 litres of seawater were filtered through a 40-μm nylon mesh (15cm in diameter). Particles were transferred by gentle rinsing of the mesh with filtered seawater (0.22µm) to a 100-ml glass bottle, preserved in Lugol’s solution and kept in the darkness until counted. In order to evaluate the cellular integrity of the trichomes, samples collected both with the underway water supply and with Niskin bottles were regularly examined under the optical microscope. There were no differences in 53 2. ZONAL VARIABILITY shape and length between bottle and non-toxic water supply samples. Besides, no broken or damaged filaments were found in any of the samples. These observations suggested that our sampling method resulted in reliable estimates of Trichodesmium filament abundance. This was later confirmed when we compared our results with those reported by other studies in the same region. For the determination of the mean abundance of Trichodesmium in the euphotic layer, samples were collected by vertical tows of a 40-µm net of 30cm in diameter through the upper 200m of the water column at each pre-dawn station. A flow meter was used to estimate the sampled volume. Then, samples were also transferred to 100-ml glass bottles and preserved in the same way as surface samples. Trichomes were counted under a Nikon Diaphot TMD microscope following the Utermöhl technique (Utermöhl, 1958). 2.2.5. Dinitrogen (N2) fixation N2 fixation of the whole planktonic community was estimated following the N2 technique of Montoya et al. (1996), as modified by Rees et al. (2009). At each station, 3 depths were sampled: surface (5m), intermediate (30-80m) and the deep chlorophyll maximum, DCM (50-150m). An initial 2-l sample for the determination of 15N levels at time zero was taken from each depth and immediately filtered through a 25-mm diameter GF/F filter (Whatman). For the measurement of 15N fixation, triplicate 2-l, acid-cleaned (10% diluted HCl), clear polycarbonate bottles (Nalgene) were filled from each depth, directly from the CTD-rosette. After removing all air bubbles, 2 ml of 15N2 (98 atom%, SerCon) were injected to each bottle. The incubation was carried out on-deck in a system of re-circulating water simulating both in situ photosynthetic active radiation (PAR) levels, using a combination of blue and neutral density screens (061 Mist blue and 210 neutral density Lee filters, respectively), and in situ temperature, within a range of 2ºC, using running surface water for the samples from the upper mixed layer, and a system of re-circulating water connected to a refrigerator for the samples collected near the base of the euphotic layer. After 24 hours, incubation was terminated by filtration of the entire sample through a 15 54 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 25-mm GF/F filter (Whatman). Afterwards all filters were dried at 40ºC during 24h and then stored until pelletization in tin capsules. Measurement of particulate organic nitrogen and 15N atom% was carried out with an elemental analyzer combined with a continuous-flow stable isotope mass-spectrometer (FlashEA112 + Deltaplus, ThermoFinnigan) and using an acetanilide standard as reference. The equations of Weiss (1970) and Montoya et al. (1996) were used to calculate the initial N2 concentration (assuming equilibrium with atmosphere) and N2 fixation rates, respectively. The limit of detection for our rates was also estimated following the recommendations of Montoya et al. (1996). Using the time of incubation (1 day), the limit of detection of the analyser (0.20 µg N) and assuming that 4‰ is the minimum acceptable change in δ15N of particulate organic nitrogen during the incubation, we found that the limit of detection was 0.001 µmol N m−3 d−1. 2.3. RESULTS 2.3.1. Hydrography, nutrients and atmospheric dust concentration The hydrographic setting was markedly different in each cruise. In autumn 2007, upper layer temperatures were higher, reaching surface values >24ºC during most of the transect (Fig. 2.2a). This translated into a strong vertical stratification, as indicated by the vertical gradient in density between 5 and 200m (Table 2.1), and the Brunt-Väisälä frequency vertical distribution in the euphotic layer (Fig. 2.2c). In contrast, during spring 2008, surface waters were cooler (<20ºC) (Fig. 2.2b) and vertical stratification was weaker (Table 2.1, Fig. 2.2d). Besides, during this last cruise the rise of the isotherms towards the East was more marked, reflecting a stronger influence of the North African upwelling. In particular, the 16ºC isotherm rose from 290m in the westernmost station to 220m in the easternmost. This influence was also evident from the eastward rise of the nitracline depth (Table 2.1). Similar values of phosphate concentration in the euphotic layer were measured in both cruises (Fig. 2.3a, b). Mean concentrations of phosphate in the euphotic layer ranged from 0.02 to 0.04 µM and no apparent zonal trend was found in 55 2. ZONAL VARIABILITY either cruise (Table 2.1). However, nitrate concentrations found in the euphotic layer were slightly higher in autumn 2007 than in spring 2008 (Fig. 2.3c, d; Table 2.1). Also, no apparent trend was seen in the longitudinal distribution of mean nitrate in the euphotic layer during our surveys. By contrast, concentrations of both nutrients below the euphotic layer were higher and depicted a stronger gradient with depth in spring 2008. 0 0 50 50 100 100 150 150 200 200 250 250 300 -40 -35 -30 -25 -20 -15 -30 -25 -20 Depth (m) Depth (m) a) 2007 Temperature (ºC) 300 -15 Longitude Longitude 0 0 50 50 100 100 150 150 200 200 250 250 300 -40 -35 -30 -25 Longitude -20 -15 -30 -25 -20 2.0E-004 Depth (m) Depth (m) c) 2007 Brunt-Väisälä frequency (s-2) 300 -15 1.5E-004 1.0E-004 5.0E-005 0.0E+000 Longitude Figure 2.2. Longitudinal and vertical distribution of temperature (ºC) and Brunt-Väisälä frequency (s−2) during the autumn 2007 (left panels) and spring 2008 (right panels) surveys. Dashed lines represent the depth of the base of the euphotic layer (m). The estimated vertical diffusive fluxes of phosphate were markedly higher in 2008 (Fig. 2.3e, f). The mean diffusive phosphate flux in a 50m layer centred in the depth of the base of the euphotic layer was 5-fold higher in the spring 2008 cruise than in the autumn 2007 cruise (14.2±12.1 µmol P m−2 d−1 and 2.8±2.6 µmol P m−2 d−1, respectively). 56 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 0 0 50 50 100 100 150 150 200 200 250 250 300 -40 -35 -30 -25 -20 -15 -30 Longitude -25 -20 Depth (m) Depth (m) b) 2008 Phosphate (µM) 300 -15 Longitude 0 0 50 50 100 100 150 150 200 200 250 250 300 -40 -35 -30 -25 -20 -15 -30 Longitude -25 -20 Depth (m) Depth (m) c) 2007 Nitrate (nM) 300 -15 Longitude 0 0 50 50 100 100 150 150 200 200 250 250 300 -40 -35 -30 -25 Longitude -20 -15 -30 -25 -20 150 Depth (m) Depth (m) e) 2007 Phosphate flux (µmol P m -2 d-1) 300 -15 120 90 60 30 0 Longitude Figure 2.3. Longitudinal and vertical distribution of phosphate (µM), nitrate (nM) and vertical diffusive fluxes of phosphate (µmol P m−2 d−1) computed across 10m depth steps during autumn 2007 (left panels) and spring 2008 (right panels) cruises. Dashed lines represent the depth of the base of the euphotic zone (m). The average satellite-derived dust concentration in the atmosphere during both cruises increased to the East when approaching the coast of Africa and the 57 2. ZONAL VARIABILITY Saharan desert. The estimated concentrations ranged between 0.13 and 0.80 g m−2 (Table 2.1). However, these values were relatively low in comparison with levels found during dust storm events. Table 2.1. Physical, chemical and biological variables measured at each station during autumn 2007 and spring 2008 cruises on board B/O Hespérides in the eastern North Atlantic along 26ºN and 29ºN, respectively. Date Long σt grad a x10−3 (kg m 4) Nitrac. depth b (m) Phosphoc. depth c (m) NO3 d (nM) PO4 d (µM) Atm. dust (g m−2) Chl-a e mg m−2 Surface Tricho (tric l-1) − 17/11/07 −17.49 6.16 109 150 84 0.04 0.61 26.9 0.5 18/11/07 −21.38 6.42 117 130 104 0.02 0.80 28.3 0.5 19/11/07 −25.73 7.18 86 150 118 0.02 0.68 29.1 0.4 20/11/07 −29.83 6.35 116 200 102 0.02 0.22 22.6 2.6 21/11/07 −34.12 5.32 99 150 61 0.02 0.13 23.8 7.4 22/11/07 −38.26 7.40 96 150 63 0.03 0.23 23.6 6.9 02/05/08 −15.45 1.89 100 100 57 0.03 0.70 23.3 1.6 01/05/08 −19.87 2.10 136 180 43 0.04 0.70 19.2 1.6 30/04/08 −24.41 2.25 154 180 60 0.03 0.37 21.3 0.6 29/04/08 −28.94 2.65 230 180 28 0.02 0.27 23.2 1.1 a σt gradient is the density gradient between 5 to 200 m. Nitracline depth was estimated by interpolation and defined as the depth in which the concentration of nitrate reached 500 nM. c Phosphocline depth was defined as the depth in which the concentration changed an order of magnitude from 0.0x to 0.x. d NO3 and PO4 represent the mean concentration of nitrate and phosphate respectively in the euphotic zone. e Chl-a is the vertically integrated total chlorophyll a from surface to the DCM depth. b 2.3.2. Chlorophyll a A similar distribution of chlorophyll a (chl-a) concentration was found in both cruises (Fig. 2.4). Chl-a concentration was low in the upper mixed layer (<0.3 mg m−3) and a distinct deep chlorophyll maximum (DCM) was present at 100120m. The vertically integrated chl-a from surface down to the DCM depth 58 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC ranged from 19 to 29 mg m−2 and showed little difference between cruises (25.7±0.3 mg m−2 in 2007 vs. 21.9±0.4 mg m−2 in 2008). a) 2007 Chlorophyll a (mg m -3) Figure 2.4. Longitudinal and vertical distribution of total chlorophyll a concentration (mg m−3) in autumn 2007 (left panel) and spring 2008 (right panel) cruises. Crosses represent the sampled depths at each station. 2.3.3. Trichodesmium abundance and community N2 fixation Only free trichomes were found in both transects. Less than 10 trichomes l−1 were measured, both in surface and euphotic layer samples, throughout the two transects with the exception of a slight increase at the surface to the west of 34°W during the 2007 survey (Fig. 2.5a, b). Average surface abundances of Trichodesmium were 6.6±13.5 and 0.8±1.0 trichomes l−1 in the autumn 2007 and spring 2008 surveys, respectively. During 2007, the rates of surface community N2 fixation were very low but always above the limit of detection (Fig. 2.5c). Measured rates in 2008 were up to 10-fold higher (Fig. 2.5d) although always below 0.3 µmol N m−3 d−1. No clear longitudinal trend was detected in surface diazotrophs activity throughout the transects (Fig. 2.5c, d). However, when considering N2 fixation rates in the water column down to the DCM, a clear eastward trend in rates at intermediate depth and DCM was present in spring 2008 (Fig. 2.6a), with an increasing contribution of intermediate depth communities to the overall activity in the euphotic layer. Besides, in the easternmost station of this cruise 59 2. ZONAL VARIABILITY (15.45ºW), the rates measured at 50 and 90m clearly exceeded that of surface waters. 100 100 10 10 1 1 0.1 0.1 -40 -35 -30 -25 -20 -15 -10 -40 -35 Longitude -30 -25 -20 -15 -10 Longitude c) 2007 Surface nitrogen fixation. d) 2008 Surface nitrogen fixation. 1 Surface N2 fixation (μmol N m-3 d-1) Trichodesmium abundances (trichomes l-1) b) 2008 Trichodesmium abundance. 1 0.1 0.1 0.01 0.01 0.001 Surface N2 fixation (µmol N m-3 d-1) Trichodesmium abundances (trichomes l-1) a) 2007 Trichodesmium abundance. 0.001 -40 -35 -30 -25 -20 Longitude -15 -10 -40 -35 -30 -25 -20 -15 -10 Longitude Figure 2.5. Longitudinal distribution of Trichodesmium abundance (trichomes l−1) and mean surface community N2 fixation (µmol N m−3 d−1) during autumn 2007 (left panels, white symbols) and spring 2008 (right panels, grey symbols). In the upper panels, crosses represent the abundance of Trichodesmium as estimated from the net tows (0-200m) and circles represent surface (ca. 5m depth) abundance. Bars in the N2 fixation plots represent the standard deviation of the mean (n=3). The vertically integrated diazotrophic activity measured during autumn 2007 was always low (< 2.3 µmol N m−2 d−1), with no apparent longitudinal trend along the transect (Fig 2.6b). The average areal rate in this cruise was 1.2±0.5 µmol N m−2 d−1. In contrast, spring 2008 areal nitrogen fixation depicted a clear increasing trend towards the East (Fig. 2.6b) reaching a maximum of 20 µmol N m−2 d−1 at the easternmost station, where high concentrations of atmospheric 60 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC dust were also derived from satellite data (Table 2.1.). The average, vertically integrated N2 fixation rate in this cruise was 8.3±3.3 µmol N m−2 d−1, a value 7fold higher than that of autumn 2007. b) Vertically integrated N2 fixation 1 25 0.1 20 15 0.01 10 0.001 5 0.0001 0 -40 -35 -30 -25 -20 -15 -10 Longitude -40 -35 -30 -25 -20 -15 N2 fixation (µmol N m-2 d-1) N2 fixation (µmol N m-3 d-1) a) Volumetric N2 fixation -10 Longitude Surface Intermediate DCM Autumn 2007 Spring 2008 Figure 2.6. Longitudinal distribution of volumetric N2 fixation (µmol N m−3 d−1) at each depth sampled (a) and vertically integrated N2 fixation (µmol N m−2 d−1) at each station (b) in autumn 2007 (white symbols) and spring 2008 (grey symbols) cruises. Bars in the vertically integrated N2 fixation plot represent the standard deviation of the mean (n=3). 2.4. DISCUSSION 2.4.1. Trichodesmium distribution The zonal distribution of Trichodesmium in the North Atlantic Ocean has been reported to be asymmetric with higher abundances and more frequent bloom occurrence in the western side (Carpenter et al., 2004; Montoya et al., 2007). Our results agree with these findings, as Trichodesmium were almost absent in surface waters during our cruises in the eastern North Atlantic in two contrasting seasons and only a moderate westward increase of Trichodesmium was found in autumn 2007 cruise. However, the environmental control factors involved in this zonal distribution remain unclear (Montoya et al., 2007). 61 2. ZONAL VARIABILITY Temperature is an important constraint for Trichodesmium distribution (Karl et al., 2002). Studies with cultures have shown that it grows in a range between 20ºC and 34ºC but the optimum for N2 fixation and growth lies between 24ºC and 30ºC (Breitbarth et al., 2007). In addition, Stal (2009) suggested that at temperatures below 20ºC non-heterocystous diazotrophic cyanobacteria such as Trichodesmium cannot maintain the local anoxic conditions required by nitrogenase to remain active and therefore they tend to be excluded from waters below that temperature. Therefore, temperature would explain the near absence of trichomes in the water column during the spring 2008 cruise, when temperatures below 20º-21ºC were recorded. Other physical factors that may favour Trichodesmium include the presence of a shallow upper mixed layer and a high stability of the water column (LaRoche and Breitbarth, 2005). In autumn 2007, the upper mixed layer was relatively shallow, with the beginning of the thermocline located at ca. 75m (Fig. 2.2a), and the water column was more stable than in spring 2008, as indicated by the higher values of both the gradient of σt and the Brunt-Väisälä frequency (Table 2.1, Fig. 2.2c). Thus, the combination of all these factors together with the westward increasing trend in water temperature would explain the higher Trichodesmium abundances observed during autumn 2007. 2.4.2. Nitrogen fixation In contrast to the intensively studied and thoroughly characterised, in terms of diazotrophy, western North Atlantic, available data on the longitudinal variability of N2 fixation rates in the subtropical eastern North Atlantic are still scarce. In our area of study, McCarthy and Carpenter (1979) investigated the longitudinal variability in N2 fixation by Trichodesmium colonies collected with nets in surface waters during May-June 1975. Their measurements were done by the acetylene reduction assay in 2-h incubations at midday. Thus, in order to compare the results, we transformed these rates using their measured abundances of cells and assuming an average of 150 cells per trichome and 10 h per day of N2 fixation by Trichodesmium (Mulholland et al., 2006). In addition, the work of Benavides et al. (2011) provide an evaluation of community 62 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC diazotrophic activity in surface waters from results of both the acetylene reduction assay and the 15N2 technique and also the activity due only to Trichodesmium in the euphotic layer as measured by the acetylene reduction assay. However, it is important to remember when comparing all these measurements that the acetylene reduction assay is an indicator of gross nitrogen fixation whereas the 15N2 technique is a measure of net nitrogen fixation (Montoya et al., 1996). The gross vertically integrated activities measured by McCarthy and Carpenter (1979) were always below 2 µmol N m−2 d−1, whereas Benavides et al. (2011) Trichodesmium gross nitrogen fixation rates were even lower (< 0.1 µmol N m−2 d−1), albeit similar to our rates of autumn 2007, when the water column temperature was more suitable for Trichodesmium. Even though the abundances of this cyanobacterium in these previous two studies and our work were very low (< 10 trichomes l−1), it seems that Trichodesmium can sustain modest but significant rates of N2 fixation in this region of the North Atlantic Ocean. No statistical correlation was found between the surface distribution of Trichodesmium and the measured N2 fixation at 5m. With the purpose of assessing if Trichodesmium could sustain the measured surface community N2 fixation in our two cruises, we used the large dataset of in situ measurements collected by Mulholland et al. (2006) to calculate the 25th and 75th percentiles of the distribution of N2 fixation rate per trichome (0.007 and 0.030 nmol N trichome−1 d−1, respectively). These, in combination with our measured Trichodesmium surface abundances, were used to estimate a likely upper and lower limit for Trichodesmium-based N2 fixation in each station. The upper limit would represent the maximum N2 fixation rate by Trichodesmium in favourable conditions, whereas the lower limit would be the minimum fixation rate expected in each station. In autumn 2007, all measured surface community N2 fixation rates were below the corresponding upper limit, which would suggest that Trichodesmium could account for the observed diazotrophic activity. However, the surface rates measured in spring 2008 (0.03-0.27 µmol N m−3 d−1) were always higher than the upper estimated limit in each station, which ranged between 0.02-0.05 µmol N m−3 d−1. Therefore, surface community 63 2. ZONAL VARIABILITY N2 fixation during the spring 2008 cruise was unlikely to be fully sustained by Trichodesmium. The same pattern is depicted when applying this approach to the comparison of the vertically integrated N2 fixation and the abundance of Trichodesmium collected by nets (Fig. 2.5a, b) and integrated to the DCM depth, with the single exception of the most western station in spring 2008 cruise, where, as happened in autumn 2007 surface waters, the N2 fixation in the euphotic layer could be explained by Trichodesmium. Lower water column temperatures observed in the 2008 survey may have favoured the presence of unicellular diazotrophs (e.g. unicellular group A or group B), which can occur at lower temperatures than Trichodesmium and tend to be distributed throughout the water column rather than concentrate near the surface (Langlois et al., 2005). Diazotrophic activity in intermediate waters in spring 2008 was similar to that measured in surface and the maximum rate was found at 50m in the eastern most station of this cruise. Thus, the vertical distribution of N2 fixation rates observed in spring 2008 would be consistent with the view that unicellular species dominated the diazotrophic activity during this cruise. Besides, the magnitude of the highest rates in this cruise is similar to those previously reported in other oceanic regions where unicellular diazotrophs dominated the community (Goebel et al., 2010; Moisander et al., 2010). These observations, together with our previous measurements in the South Atlantic subtropical gyre (see next chapter), support the growing view that other diazotrophs in addition to Trichodesmium are important players in the nitrogen cycle in surface oceanic waters (Moisander et al., 2010). Nitrogen fixation can be limited by the availability of both iron and phosphorous (Capone, 2001; Karl et al., 2002). Recent studies suggest that iron supply through atmospheric deposition is the key factor controlling the large scale distribution of diazotrophy in the Atlantic Ocean (Moore et al., 2009). The experimental addition of Saharan dust has been shown to stimulate N2 fixation in the tropical and subtropical Atlantic (Mills et al., 2004; Marañón et al., 2010). Our region of study is subject to high atmospheric dust deposition due to its proximity to the Saharan desert, and shows relatively high dissolved iron concentrations (Moore et al., 2009). In this regard, Sañudo-Wilhelmy et al. 64 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC (2001) showed that during a cruise to the central Atlantic Ocean, where background iron concentrations were relatively high, N2 fixation by Trichodesmium was independent of iron concentration and, instead, strongly correlated with the phosphorus content of the colonies. We thus consider the possibility that differences in phosphorus supply may have contributed to explain the inter-cruise differences in N2 fixation observed during our study. Atmospheric dust is the main source of iron to the surface ocean, but may supply phosphorus as well (Ridame and Guieu, 2002; Mills et al., 2004). The atmospheric concentration of dust was similar and described the same eastward trend during the two cruises (Table 2.1). Therefore, we would expect a similar amount of atmospheric deposition of both iron and phosphorus in autumn 2007 and spring 2008 cruises. On the other hand, phosphorus is also supplied to the euphotic layer through vertical diffusive fluxes from below the thermocline. The estimated vertical diffusive fluxes of phosphate in spring 2008 clearly exceeded those found in autumn 2007; this difference may explain the higher rates of diazotrophy observed in the former cruise. In addition, the exclusion of Trichodesmium by cooler water temperatures would have reduced the competition for phosphate among diazotrophs, thus allowing the small unicellular cyanobacterial groups to actively fix N2. Whether or not phosphorus supply plays a role in controlling the zonal variability of N2 fixation in the North-East subtropical Atlantic will only be unequivocally ascertained with data of the intracellular content of phosphorous in diazotrophs, so further studies are still required. 2.4.3. Conclusions Our study contributes to and further expands the relatively small data set of available measurements of N2 fixation and Trichodesmium abundance in the eastern subtropical North Atlantic. Temperature and vertical stability conditions appeared as key factors explaining the distribution of Trichodesmium, which showed particularly low abundances during spring 2008, when the water column was colder and less strongly stratified. Our results indicate that N2 fixation is always measurable in the region even when Trichodesmium is 65 2. ZONAL VARIABILITY present in very low abundances. Moreover, the comparison of measured N2 fixation rates with the concurrent Trichodesmium abundances points to the role of other diazotrophs, particularly when sea temperatures are less warm. Finally, the contrasting magnitude of the vertical diffusive flux of phosphate in each cruise suggests a role for phosphorus as a controlling factor of the local distribution of N2 fixation (Sañudo-Wilhelmy et al., 2001) in a region that receives relatively high amounts of iron through atmospheric deposition (Moore et al., 2009). 66 Latitudinal distribution of Trichodesmium and N2 fixation in the Atlantic Ocean ABSTRACT We have determined the latitudinal distribution of Trichodesmium abundance and community N2 fixation in the Atlantic Ocean along a meridional transect from ca. 30º N to 30º S in November-December 2007 and April-May 2008. The observations from both cruises were highly consistent in terms of absolute magnitude and latitudinal distribution, showing a strong association between Trichodesmium abundance and community N2 fixation. The highest Trichodesmium abundances (mean = 220 trichomes l−1) and community N2 fixation rates (mean = 60 µmol m−2 d−1) occurred in the equatorial region between 5º S-15º N. In the South Atlantic gyre, Trichodesmium abundance was very low (ca. 1 trichome l−1) but N2 fixation was always measurable, averaging 3 and 10 µmol m−2 d−1 in 2007 and 2008, respectively. We suggest that N2 fixation in the South Atlantic was sustained by other, presumably unicellular, diazotrophs. The comparison of these distributions with the geographical pattern in atmospheric dust deposition points to iron supply as the main factor determining the large scale latitudinal variability of Trichodesmium abundance and N2 fixation in the Atlantic Ocean. We observed a marked South to North decrease in surface phosphate concentration, which argues against a role for phosphorus availability in controlling the large scale distribution of N2 fixation. Scaling up from all our measurements (42 stations) results in conservative estimates for total N2 fixation of ~6 TgN yr−1 in the North Atlantic (0-40º N) and ~1.2 TgN yr−1 in the South Atlantic (0-40º S). TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 3.1. INTRODUCTION Biological N2 fixation represents a major process of new nitrogen supply to the euphotic layer in tropical and subtropical regions of the open ocean (Karl et al., 2002; Mahaffey et al., 2005). In the Atlantic Ocean, recent studies based on both direct measurements of N2 fixation (Capone et al., 2005) and geochemical approaches (Gruber and Sarmiento, 1997) have resulted in basin-scale estimates of this flux that significantly exceed previously available estimates. The global biogeochemical significance of N2 fixation stems from the fact that, in conjunction with denitrification, it is a critical flux in the control of the ocean’s bioavailable nitrogen inventory. In addition, new production based on N2 fixation is more effective in atmospheric CO2 sequestration than that based on nitrate input from deep waters, because the latter is also coupled to the upward transport of CO2 through Redfield stoichiometry (Michaels et al., 2001). The non-heterocystous, bloom-forming, filamentous cyanobacterium Trichodesmium is regarded as the dominant planktonic N2 fixer (Capone et al., 1997) and, as a result, considerable effort has been invested in determining its distribution, abundance and metabolic activity in the sea, together with the factors that control them. Trichodesmium is mostly restricted to tropical regions characterised by warm (>22ºC) surface waters and strong vertical stability (Capone et al., 1997; Tyrrell et al., 2003). Due to the very high iron quotas characteristic of Trichodesmium (Rueter et al., 1992; Kustka et al., 2003), iron supply has been considered as the most limiting factor for the distribution and metabolic activity of this genus and, by extension, N2 fixation rates in the ocean (Falkowski, 1997; Berman-Frank et al., 2001). Recently, Moore et al. (2009) demonstrated a close association between dissolved iron concentration, in turn related to increased atmospheric deposition of Saharan dust, and N2 fixation rates in the Atlantic Ocean. In addition, a role for phosphorus availability in the control of both Trichodesmium (Sañudo-Wilhelmy et al., 2001) and community N2 fixation rates (Mills et al., 2004) has also been demonstrated. As a result of the highly variable distribution of Trichodesmium abundance, over both space and time, most studies have so far focused on regions which tend to show higher abundances of this genus (Carpenter et al., 2004; Capone et 71 3. LATITUDINAL VARIABILITY al., 2005; Mulholland et al., 2006), or have been conducted during blooms (Karl et al., 1992; Capone et al., 1998). There have been few basin-scale surveys of Trichodesmium abundance (Tyrrell et al., 2003; Davis and McGillicuddy, 2006) or N2 fixation (Voss et al., 2004; Staal et al., 2007) and, to the best of our knowledge, only two studies have reported on both Trichodesmium abundance and community N2 fixation over large spatial scales in the open ocean (Kitajima et al., 2009; Moore et al., 2009). Yet, basin-scale studies are essential because they provide estimates of Trichodesmium abundance and activity that are representative of ‘background’ conditions in the open ocean, as opposed to those found during local events of increased abundance and/or growth. In addition, large-scale surveys cross marked environmental gradients and therefore are ideally suited to assess the effect of different controlling factors on distribution patterns and N2 fixation rates. Here we report on Trichodesmium abundance and community N2 fixation measured along a meridional transect in the Atlantic Ocean during two contrasting seasons. We describe the latitudinal patterns in Trichodesmium abundance and community N2 fixation in the tropical Atlantic from ca. 30º N to 30º S and show that they are persistent in contrasting seasons. Furthermore, we use the observed latitudinal distributions to assess the relative importance of different environmental factors, such as dust deposition, phosphorus availability and water column structure, in determining the large-scale variability of Trichodesmium abundance and community N2 fixation. The data presented in this chapter have been published in Biogeosciences. Citation: Fernández A, Mouriño-Carballido B, Bode A, Varela M, Marañón E (2010) Latitudinal distribution of Trichodesmium spp. and N2 fixation in the Atlantic Ocean. Biogeosciences 7: 3167-3176. 3.2. MATERIAL AND METHODS 3.2.1. Sampling, hydrography and irradiance Two oceanographic cruises were conducted on board BIO ‘Hespérides’ in the Atlantic Ocean during 16 November-16 December 2007 and 8 April-6 May 72 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 2008 (Fig. 3.1), as part of the project TRYNITROP (Trichodesmium and N2 fixation in the Atlantic Ocean). The transects took place along 28º-29ºW from 26ºN to 33ºS in 2007 and from 29ºN to 31ºS in 2008. At each sampling station, seawater samples were collected from 0-300m, just before dawn, using a rosette equipped with 12-l Niskin bottles. The vertical distribution (0-300m) of temperature, salinity and fluorescence was determined with a CTD SBE 911plus probe attached to the rosette. 2007 2008 Figure 3.1. Map showing the 2007 (white circles) and 2008 (grey triangles) cruise tracks. The cruises took place during 16 November - 16 December 2007 and 8 April - 6 May 2008. The concentrations of nitrate and phosphate were determined following colorimetric methods (Raimbault et al., 1990; Grasshof, 1976), as described in the previous chapter, section 2.2.1. The detection limit for the analysis of nitrate concentration was 2 nmol l−1, whereas for phosphate was 0.02 µmol l−1. 73 3. LATITUDINAL VARIABILITY On 16 occasions, vertical profiles of photosynthetically active irradiance (PAR) were obtained at noon with a Satlantic OCP-100FF radiometer. The vertical distribution of fluorescence was also determined at the same locations using the CTD SBE911 plus probe. We found a highly significant relationship between the depth of the 1% PAR level (Zeu) and the depth of the DCM (ZDCM): Zeu = 9.3 + 0.98 × ZDCM r2 = 0.87, p < 0.001, n = 16 3.2.2. Satellite inference of dust presence in the atmosphere The average concentration of dust (g m−2) in the atmosphere in a period of 15 days prior to sampling in each station was estimated by Kaufman et al. (2005) equations. Data were retrieved online from the AVISO-LAS server and the Giovanni online data system of the NASA Goddard Earth Sciences Data and Information Services Center in a grid of 1º of resolution: Aqua-MODIS Aerosol Optical Depth at 550 nm, Aerosol Small Mode Fraction and wind speed (see previous chapter, section 2.2.2). 3.2.3. Chlorophyll a concentration Chlorophyll a concentration was measured of board with a Turner Designs 700 fluorometer and following the procedure described in the previous chapter, section 2.2.3. 3.2.4. Trichodesmium abundance The surface abundance of Trichodesmium was estimated with samples taken by the ship’s non-toxic water supply from ca. 5m at intervals of 55-70km, as described in the previous chapter, section 2.2.4. The mean abundance of Trichodesmium in the euphotic layer was determined with samples taken by 74 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC vertical tows of a 40-µm net of 30 cm in diameter through the upper 200m of the water column at each pre-dawn station (previous chapter, section 2.2.4). The integrity of trichomes after sampling was determined comparing the shape and length of filaments in fresh samples collected both with the underway water supply system and with Niskin bottles at station. We did not detect the presence of broken or damaged filaments in the samples from the continuous water supply system, suggesting that our method resulted in reliable estimates of Trichodesmium filament abundance. This was later confirmed when we compared our results with those reported by other studies in the same region (see section 3.4.1 of the discussion). 3.2.5. Dinitrogen (N2) fixation Rates of N2 fixation by the whole planktonic community in a 24-hour incubation period were determined in each station at the surface (5m), an intermediate depth (30-80m) and the depth of the deep chlorophyll maximum (DCM). We used the 15N2-uptake technique of Montoya et al. (1996) with the modifications described in Rees et al. (2009), see previous chapter, section 2.2.5, for a detailed description of the protocol. The equations of Weiss (1970) and Montoya et al. (1996) were used to calculate the initial N2 concentration (assuming equilibrium with atmosphere) and N2 fixation rates, respectively. The limit of detection, estimated following Montoya et al. (1996), was 0.001 µmol N m−3 d−1. 3.3. RESULTS 3.3.1. Hydrography, nutrients and estimated dust presence in the atmosphere The vertical distribution of temperature, in particular the depth of the 16ºC isotherm, allowed us to identify the area affected by the Equatorial upwelling (Fig. 3.2a, b). Using the location of the 16ºC isotherm above 200m as a criterion, we divided the latitudinal transects in three different regions: North gyre (29º-15ºN), equatorial region (15ºN-10ºS) and South gyre (10º-33ºS). The 75 3. LATITUDINAL VARIABILITY rising of isotherms defined the equatorial upwelling in both cruises over roughly the same latitudinal range. A seasonal change in upper mixed layer (UML) temperatures was found: warmer UML waters occurred in the North gyre in 2007 and in the South gyre in 2008, although warm waters (>26ºC) were always present in the equatorial region. The latitudinal distribution of salinity also illustrated the effect of the equatorial upwelling, which was associated with lower salinity in subsurface waters (Fig. 3.2c, d). Both subtropical gyres were characterised by higher salinities, particularly in the upper 150m. -30 -20 -10 0 10 20 30 Depth (m) Latitude c) 2007 Salinity 0 50 100 150 200 250 300 350 -30 -20 -10 0 Latitude -30 -20 -10 0 10 20 0 50 100 150 200 250 300 350 30 20 0 50 100 150 200 250 300 350 30 Depth (m) b) 2008 Temperature (ºC) 0 50 100 150 200 250 300 350 Latitude 10 20 30 -30 -20 -10 0 10 Depth (m) Depth (m) a) 2007 Temperature (ºC) Latitude Figure 3.2. Latitudinal and vertical distribution of temperature (a, b) and salinity (c, d). Left-hand and right-hand plots correspond to the 2007 and 2008 cruises, respectively. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. The Brunt-Väisäla frequency, averaged over the upper 125m, exhibited approximately the same distribution on each cruise (Fig. 3.3). The highest 76 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC Mean Brunt-Väisäla frequency (s-2) values were measured in the Equatorial region, where a relatively shallow and steep thermocline led to enhanced stability in the upper water column. 3.5e-4 2007 2008 3.0e-4 2.5e-4 2.0e-4 1.5e-4 1.0e-4 5.0e-5 0.0 -40 -30 -20 -10 0 10 20 30 Latitude Figure 3.3. Mean Brunt-Väisäla frequency (s−2) over the upper 125m of the water column during the 2007 (white circles) and 2008 (grey triangles) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. Nitrate concentration in the UML ranged between 30-150 nM without any clear latitudinal pattern (data not shown). In contrast, phosphate concentration showed a consistent decreasing trend from South to North in both cruises: values around or higher than 0.1 µM were measured in the Southern gyre, whereas values <0.04 µM were measured in the North gyre (Fig. 3.4). As a result, the nitrate to phosphate ratio increased markedly from South to North in both cruises. The 15-days average atmospheric dust concentration on each station was higher between the Equator and 20ºN (Fig. 3.5), on both cruises. The increased dust presence in this region was particularly marked during the 2008 cruise, conducted in April–May. 77 Mean phosphate in the UML (μM) 3. LATITUDINAL VARIABILITY 0.20 2007 2008 0.16 0.12 0.08 0.04 0.00 -40 -30 -20 -10 0 10 20 30 Latitude Figure 3.4. Latitudinal distribution of mean phosphate concentration (µM) in the upper mixed layer during the 2007 (white circles) and 2008 (grey triangles) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. Atmospheric dust column concentration (g m-2) 1.8 2007 2008 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 -40 -30 -20 -10 0 10 20 30 Latitude Figure 3.5. Latitudinal distribution of 15-days averaged atmospheric dust concentration (g m−2) derived from Aqua-MODIS satellite and produced by the Giovanni on line data system during the 2007 (white circles) and 2008 (grey triangles) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. 78 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 3.3.2. Chlorophyll a concentration Surface chlorophyll a concentration was low in both transects (<0.2 mg m−3) and its vertical distribution was characterized by a deep chlorophyll maximum (DCM), associated with the thermocline, with concentrations above 0.3-0.4 mg m−3 (Fig. 3.6). The DCM was shallower and more intense in the region affected by the equatorial upwelling. The euphotic layer-integrated chlorophyll a concentration ranged between 19-31 mg m−2 (data not shown) across the latitudinal range and did not show any marked differences between cruises. b) 2008 Chlorophyll a (mg m-3) 0 0 50 50 100 100 150 150 -30 -20 -10 0 10 20 30 -30 -20 -10 Latitude 0 10 20 Depth (m) Depth (m) a) 2007 Chlorophyll a (mg m-3) 30 Latitude Figure 3.6. Latitudinal and vertical distribution of chlorophyll a (mg m−3) concentration during the 2007 (a) and 2008 (b) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. 3.3.3. Trichodesmium abundance and N2 fixation In the surface, Trichodesmium was particularly abundant in the equatorial region, whereas it was rare or absent in the South gyre (Fig. 3.7a, b). The region of highest surface abundance (>100-200 trichomes l−1) extended from 15ºN to the Equator in 2007 and from 15ºN to 10ºS in 2008. The maximum abundances were measured near 7ºN in 2007 (1600 trichomes l−1) and near 3ºS in 2008 (800 trichomes l−1). Although there was some inter-cruise variability, the regional differences in surface Trichodesmium were consistent (Table 3.1). Cruiseaveraged abundances in surface were ca. 220 trichomes l−1 in the equatorial region, compared with 8-31 trichomes l−1 in the North gyre and 0.5-1 trichomes l−1 in the South gyre. 79 3. LATITUDINAL VARIABILITY 1600 2007 2008 1400 800 1200 600 1000 800 400 600 400 200 200 0 0 -40 -30 -20 -10 0 10 20 30 -40 -30 -20 0 10 20 30 Latitude Latitude c) 2007 Surface nitrogen fixation N2 fixation (μmol N m-3 d-1) -10 Trichodesmium (trichomes L-1) b) 2008 Trichodesmium surface abundances d) 2008 Surface nitrogen fixation 14 2.0 2007 2008 12 1.5 10 8 1.0 6 4 0.5 2 0 N2 fixation (μmol N m-3 d-1) Trichodesmium (trichomes L-1) a) 2007 Trichodesmium surface abundances 0.0 -40 -30 -20 -10 0 Latitude 10 20 30 -40 -30 -20 -10 0 10 20 30 Latitude Figure 3.7. Latitudinal distribution of surface N2 fixation (µmol N m−3 d−1) and Trichodesmium abundance (trichome l−1) during the 2007 (lefthand plots, circles) and 2008 (right-hand plots, triangles) cruises. Bars in the N2 fixation plots represent the standard deviation of the mean (n=3). Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. The latitudinal distribution of N2 fixation rates at the surface closely resembled that of Trichodesmium abundance (Fig. 3.7c, d). These two variables were highly correlated in our study (Pearson’s r = 0.74, p < 0.01, Table 3.2). The highest N2 fixation rates were measured in the equatorial region. In this region, the mean surface N2 fixation during the 2007 cruise was more than 3-fold higher than during 2008 (2.94 vs. 0.80 µmol N m−3 d−1). Diazotrophic activity 80 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC was mostly restricted to the North Atlantic during 2007, whereas it extended all over the equatorial region in 2008. Table 3.1. Mean Trichodesmium surface abundance and integrated N2 fixation rate on each region during the 2007 and 2008 cruises. Standard deviation is indicated in brackets. N2 fixation (μmol N m−2 d−1) Trichodesmium spp. (trichomes l−1) 2007 2008 2007 2008 44 [58] 11 [13] 25 [6] 11 [4] Equator 222 [351] 222 [174] 66 [15] 55 [21] South Gyre 0.5 [0.5] 1 [1] 3 [1] 10 [2] North Gyre b) Equatorial region c) South gyre region 0 0 0 40 40 40 80 120 Depth (m) a) North gyre region Depth (m) Depth (m) The latitudinal distribution of Trichodesmium abundance in the water column was similar to that observed at the surface, although the abundances were somewhat lower (Fig. 3.9). The highest abundances, also found in the equatorial region, were in the range 100-300 trichomes l−1 in both cruises. 80 120 160 160 0.0 0.5 1.0 1.5 N2 fixation (μmol N m-3 d-1) 80 120 2007 2008 0 2 4 6 8 10 12 14 N2 fixation (μmol N m-3 d-1) 160 0.0 0.5 1.0 1.5 N2 fixation (μmol N m-3 d-1) Figure 3.8. Vertical distribution of N2 fixation (µmol N m−3 d−1) during the 2007 (white circles) and 2008 (grey triangles) cruises in each latitudinal region identified by the depth of 16ºC isotherm. 81 3. LATITUDINAL VARIABILITY a) 2007 Water column nitrogen fixation and Trichodesmium 300 Vert. integrated N2 fixation Trichodesmium water column 250 250 200 200 150 150 100 100 50 50 0 Water column Trichodesmium (trichomes l-1) N2 fixation (μmol N m-2 d-1) 300 0 -40 -30 -20 -10 0 10 20 30 Latitude 300 300 250 250 200 200 150 150 100 100 50 50 0 Water column Trichodesmium (trichomes l-1) N2 fixation (μmol N m-2 d-1) b) 2008 Water column nitrogen fixation and Trichodesmium 0 -40 -30 -20 -10 0 10 20 30 Latitude Figure 3.9. Latitudinal distribution of vertically integrated N2 fixation (µmol N m−2 d−1) and abundances of Trichodesmium (trichome l−1) in the euphotic layer in the 2007 (A) and 2008 (B) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. N2 fixation was detectable in all stations, although not at all depths and the highest rates were commonly measured in the upper 50m of the water column (Fig. 3.8). The vertical distribution of N2 fixation rates in the North gyre and in the equatorial region was characterized by a clear tendency to decrease with depth. In the South gyre, however, N2 fixation was distributed more uniformly over the euphotic layer. There was a strong correlation, on the one hand, 82 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC between the euphotic layer-integrated N2 fixation and surface N2 fixation (Pearson’s r = 0.91, p < 0.01, Table 3.2), and, on the other hand, between the euphotic layer-integrated N2 fixation and the euphotic layer abundance of Trichodesmium (Pearson’s r = 0.77, p < 0.01, Table 3.2). Table 3.2. Correlation coefficients (Pearson’s r) between euphotic-layer integrated N2 fixation, surface and euphotic layer Trichodesmium abundance and selected variables computed for all the stations sampled during the 2007 and 2008 cruises. Euphotic-layer integrate N2 fixation Surface Trichodesmium Euphotic-layer Trichodesmium Euphotic-layer integrate N2 fixation − 0.75** 0.77** Surface N2 fixation 0.91** 0.74** 0.70** Brunt-Väisäla frequency (0-125m) 0.58** 0.74** 0.72** Surface temperature 0.36* 0.45** 0.39** 15-day average atmospheric dust 0.35* n.s. 0.44** * p < 0.05; ** p < 0.01 In both cruises, the highest integrated rates (ca. 250 and 150 µmol N m−2 d−1 in 2007 and 2008, respectively) were measured at stations located within the equatorial region (Fig. 3.9). The mean N2 fixation rate in the equatorial region was 66 and 55 µmol N m−2 d−1 in 2007 and 2008, respectively (Table 3.1). The North gyre, with mean rates of 25 and 11 µmol N m−2 d−1 in 2007 and 2008, respectively, showed higher diazotrophy than the South gyre (3.4 and 9.7 µmol N m−2 d−1). While N2 fixation south of the Equator was almost undetectable during the 2007 cruise, substantial rates were measured in the Southern Hemisphere in 2008. 83 3. LATITUDINAL VARIABILITY 3.3.4. Relative contribution of Trichodesmium to community N2 fixation As in the previous chapter, we applied an indirect approach to assess whether Trichodesmium could account for the measured surface N2 fixation rates. We used the large dataset collected by Mulholland et al. (2006), which provides in situ measurements of the filament-specific rate of N2 fixation by Trichodesmium. We determined the 25th and 75th percentiles of this dataset in order to estimate a lower and an upper limit for the filament-specific rate of N2 fixation by Trichodesmium. Multiplying these rates by the measured filament abundances, we obtained an upper and a lower estimate for the surface rate of N2 fixation that could be attributed to Trichodesmium, which we then compared with the measured surface community diazotrophy rates (Fig. 3.10a,b). We found that Trichodesmium abundance was sufficient to explain the measured rates of N2 fixation in the North gyre and equatorial regions. However, the measured rates in most of the Southern Hemisphere stations clearly exceeded the maximal rates that, according to our estimates, could be sustained by Trichodesmium. A similar trend is depicted in the comparison of the euphotic-layer integrated N2 fixation and the abundances of Trichodesmium in the water column (Fig. 3.10c, d). This low contribution of Trichodesmium to the community N2 fixation is even more evident in the two stations around 20ºS in autumn 2007 (Fig. 3.10c), where no trichomes were found in the net samples. 3.4. DISCUSSION 3.4.1. Latitudinal distribution of Trichodesmium Our measurements, obtained with high spatial resolution in surface waters, indicate that Trichodesmium is most abundant (>200 trichomes l−1) in the Equatorial Atlantic region between 5ºS-15ºN, has modest abundances in the North Atlantic subtropical gyre and is virtually absent from the South Atlantic gyre. These patterns agree with those identified by Tyrrell et al. (2003) and Moore et al. (2009), who reported on surface abundances obtained at longer distance intervals, and are also suggested by the analysis of ocean colour data by Westberry and Siegel (2006). The mean abundances we measured between 84 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 5ºS-15ºN are similar to the highest abundances reported by Moore et al. (2009) for the same region. These authors found a close association between iron concentration and both Trichodesmium abundance and community N2 fixation along a transect conducted in the Atlantic Ocean in October-November 2005. Our own observations, carried out during contrasting seasons, support this association and suggest that the observed latitudinal patterns are persistent over seasonal scales. 100 100 10 10 1 1 0.1 0.1 0.01 0.01 0.001 0.001 -40 -30 -20 -10 0 10 20 30 -40 -30 -20 -10 0 10 20 30 Latitude Latitude c) 2007 Water column N2 fixation (μmol N m-2 d-1) N2 fixation (μmol N m-3 d-1) b) 2008 Surface d) 2008 Water column 10000 10000 1000 1000 100 100 10 10 1 1 0.1 0.1 N2 fixation (μmol N m-2 d-1) N2 fixation (μmol N m-3 d-1) a) 2007 Surface 0.01 0.01 -40 -30 -20 -10 0 Latitude 10 20 30 -40 -30 Trichodesmium lower limit Trichodesmium upper limit Measured N2 fixation -20 -10 0 10 20 30 Latitude Figure 3.10. Comparison of the latitudinal distribution of measured surface N2 fixation (black crosses) with lower limit (grey triangles) and upper limit (white diamonds) of N2 fixation due to surface Trichodesmium spp. estimated by literature rates (a, b), and euphoticlayer integrated N2 fixation with the lower and upper limits of N2 fixation due to net-sampled Trichodesmium (c, d). Left-hand and right-hand plots correspond to the 2007 and 2008 cruises, respectively. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. 85 3. LATITUDINAL VARIABILITY Although iron concentration data are not available in the present study, the 15days average dust concentration in the atmosphere obtained during the time period of our surveys does suggest enhanced rates of atmospheric dust deposition between the Equator and 20ºN, where the highest Trichodesmium abundances were found. We found a significant correlation between the estimated atmospheric dust concentration and the abundance of Trichodesmium in the euphotic layer (Pearson’s r = 0.44, p < 0.01, Table 3.2). The available climatologies of dust and iron deposition in the central Atlantic show a region of persistent, albeit varying seasonally, high deposition rates between roughly 10ºS-30ºN (Gao et al., 2001; Mahowald et al., 2005), coinciding with the region of increased Trichodesmium abundances. Given the very high iron requirements of Trichodesmium (Kutska et al., 2003) and the demonstrated relationship between iron availability and Trichodesmium growth rate (Berman-Frank et al., 2007), it is likely that atmospheric deposition of dust is the main process controlling the distribution of this genus in the central Atlantic Ocean. Additional factors which may have also favoured the presence of Trichodesmium in the equatorial region include the shallowing of the upper mixed layer and the increase in water column stability, which in our study was reflected in the higher values of the Brunt-Väisäla frequency encountered between 10ºS-20ºN. In fact, we found a highly significant correlation between the Brunt-Väisäla frequency and Trichodesmium abundance in surface and in the euphotic layer (Pearson’s r = 0.74, p < 0.01, and r = 0.72, p < 0.01, respectively, Table 3.2). The shallowing of the upper mixed layer may result in a reduction in the energetic expenditure involved in the vertical migrations carried out by Trichodesmium, which allow them to take up nutrients, phosphate in particular, from below the nutricline (Karl et al., 1992). The latitudinal range of distribution of Trichodesmium extended further south during the 2008 cruise, conducted in April-May, than during the 2007 cruise, conducted in November-December. Although our data are not sufficient to establish seasonal patterns, these differences are consistent with a role of atmospheric deposition in determining the abundance of Trichodesmium, given that aerosol deposition in the eastern North Atlantic is more intense and occurs 86 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC over a larger area during spring than during winter (Gao et al., 2001; Kaufman et al., 2005). In addition, the increased stability of the water column south of the Equator may have also contributed to extend further south the range of distribution of Trichodesmium during the 2008 cruise. 3.4.2. Latitudinal distribution of N2 fixation We have shown that N2 fixation rates in the central Atlantic are higher between 5ºS-15ºN during two contrasting seasons, and that Trichodesmium is likely to account for most of the N2 fixation in this region. Our observations support the results of Moore et al. (2009), who found increased N2 fixation in the same latitudinal range, where higher iron concentrations were measured, and concluded that iron rather than phosphorus supply explain the North-South differences in diazotrophy in the Atlantic Ocean. As described before for Trichodesmium abundance, we found a clear association between the region of increased N2 fixation rates and the latitudinal range of enhanced atmospheric dust presence in the eastern central Atlantic. These two variables were significantly correlated (Pearson’s r = 0.35, p < 0.05, Table 3.2). Together, these results strongly suggest that iron supply through atmospheric deposition is a major determinant of planktonic N2 fixation in the Atlantic Ocean, as has also been shown for the North Pacific (Shiozaki et al., 2009). The role of phosphorus, which has been found to limit N2 fixation in the central Atlantic (Sañudo-Wilhelmy et al., 2001; Mills et al. 2004) must also be considered. During our surveys, phosphate concentrations showed a clear decreasing trend from South to North, a recurrent pattern in the Atlantic Ocean (Mather et al., 2008; Moore et al., 2009). The highest rates of N2 fixation thus occurred in waters with low (<0.05 µM) phosphate levels, whereas little N2 fixation took place in the more phosphorus-rich waters of the South gyre. Although Trichodesmium and other phytoplankton can obtain phosphorus (P) from the pool of dissolved organic phosphorus, P availability is still very low in the North Atlantic, as evidenced in the enhanced alkaline phosphatase activity (APA) measured there (Mather et al., 2008). APA is well known to increase in 87 3. LATITUDINAL VARIABILITY response to P limitation in phytoplankton. In spite of increased P limitation in the North Atlantic, as compared with the South Atlantic, N2 fixation is higher in the North, which indicates that the large-scale latitudinal distribution of N2 fixation in the Atlantic is not controlled by P availability. Current evidence indicates that iron-mediated stimulation of N2 fixation in the Equatorial and North Atlantic draws the surface phosphate pool to very low concentrations (Mather et al., 2008; Moore et al., 2009), but nitrogen remains the proximate limiting nutrient for primary production (Mills et al., 2004; Moore et al., 2009). 3.4.3. N2 fixation in the South Atlantic The fact that filamentous diazotrophs such as Trichodesmium are rare in the South Atlantic gyre (Tyrrell et al., 2003; Moore et al., 2009; our study), together with the low or even negative values of the N* tracer observed in subsurface waters (Gruber and Sarmiento, 1997), could lead us to expect that N2 fixation does not take place in this region. However, we were able to detect N2 fixation in all the stations during our cruises. The average rates measured in the South gyre were substantial (ca. 4 and 10 µmol N m−2 d−1 in 2007 and 2008, respectively), given the extreme oligotrophy of this region, and some peak values were comparable to those measured in the equatorial region. Our estimates of the rates of N2 fixation that could be sustained by the extremely low (<1 trichome l−1) Trichodesmium abundances measured in the South gyre strongly suggest that other diazotrophs were the main contributors to N2 fixation in this region. The same conclusion was reached by Moore et al. (2009), who reported relatively constant rates of diazotrophy in the <20 µm size fraction across the Atlantic Ocean. These results suggest that the large scale geographical distribution of unicellular diazotrophs in the open ocean is more uniform than that of Trichodesmium, contributing a background of modest but persistent N2 fixation rates. Montoya et al. (2004) pointed out that the vertical distribution of unicellular diazotrophs is relatively uniform over the euphotic layer, in contrast with that of Trichodesmium, which tends to concentrate in the shallower portions of the 88 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC water column (Carpenter et al., 2005). In agreement with this observation, we found that N2 fixation rates tended to peak at or near the surface in the equatorial and North gyre regions, whereas a more uniform vertical distribution was found in the South gyre. This pattern is consistent with an increased contribution of unicellular diazotrophs to community N2 fixation in the South gyre. However, nitrogenase is a highly conserved enzyme across microbial phylogenetic groups (Zehr et al., 2000), and therefore the elevated costs of N2 fixation, both in terms of energetic expenditure and iron requirements, must also be present in unicellular diazotrophs. One can therefore ask why unicellular diazotrophs carry on fixing N2 in environments that are very impoverished in iron. It has been shown that N2 fixation in a unicellular cyanobacterium such as Cyanothece is much less depressed under low iron concentrations than it is in Trichodesmium (Berman-Frank et al., 2007). These authors concluded that the small cell size and rapid intracellular iron recycling capacity of unicellular diazotrophs make them relatively resistant to low iron concentrations, which would give them an advantage in low-iron waters. These factors can, therefore, explain the persistence of N2 fixation in a region that experiences very low atmospheric deposition such as the South Atlantic subtropical gyre. 3.4.4. Biogeochemical significance of N2 fixation The mean rates of N2 fixation we measured in the equatorial and North gyre regions (55-66 and 11-25 µmol m−2 d−1, respectively) are similar to those recently reported by Moore et al. (2009), who studied also the eastern region of the Atlantic, but lower than the mean rates observed in other studies more focused on the western tropical Atlantic (Capone et al., 2005; Montoya et al., 2007). As a rough calculation, we scaled up from all our measurements (42 stations) to the whole Atlantic Ocean (40ºN-40ºS) by multiplying the measured daily rates by 365 and using the location of the continental shelf to define the region’s longitudinal limits. We estimate an annual N2 fixation of ca. 6 Tg N yr−1 in the North Atlantic (0-40º N) and ca. 1.2 Tg N yr−1 in the South Atlantic (0-40º S). These are rather conservative estimates because they do not take into account the occurrence of Trichodesmium blooms and also because our surveys 89 3. LATITUDINAL VARIABILITY did not cover the western tropical Atlantic, where higher Trichodesmium abundances have been reported (Capone et al., 2005; Montoya et al., 2007). In addition, a substantial fraction of the N2 fixed by diazotrophs can be released as dissolved organic nitrogen (DON), whose subsequent remineralization represents an additional source of new nitrogen for the ecosystem (Glibert and Bronk, 1994). Geochemical estimates of N2 fixation, which integrate over wide spatial and temporal scales and take into account also the production of DON, are in the range 15-56 TgN yr−1 for the whole Atlantic Ocean (Knapp et al., 2008). To assess the biogeochemical significance of measured N2 fixation rates, it is particularly useful to compare them with the diffusive flux of nitrate from below the thermocline, which represents the other main input of new nitrogen into the euphotic layer. Available estimates of vertical nitrate diffusivity are subject to a large degree of uncertainty, mainly because of a lack of direct measurements of the vertical diffusivity coefficient (kz). For the tropical North Atlantic, estimates of this flux range widely between 100-1000 µmol m−2 d−1 (see review in Capone et al., 2005). These authors estimated that N2 fixation can represent between 50 to 180% of the vertical diapycnal flux of nitrate. However, given that N2 fixation and vertical nitrate diffusion exhibit large spatial and temporal variability, concurrent and direct measurements of both fluxes are needed to determine their relative importance. During the 2008 cruise, we were able to obtain direct measurements of vertical diffusivity, which we then combined with data of nitrate nanomolar concentration in order to calculate vertical fluxes of nitrate (see Mouriño-Carballido et al., 2010, Figure 3, Table1). We found that the contribution of N2 fixation to the total input of new nitrogen (the sum of N2 fixation and vertical diffusion of nitrate) in the North gyre, the equatorial region and the South gyre was 2, 22 and 44%, respectively. These contributions would be lower, at least in the equatorial region, if atmospheric nitrogen input were taken into account. In addition, it can be expected that these contributions will change seasonally, mainly because of variability in vertical diffusivity associated with changes in the vertical density gradient. Our results highlight the quantitative importance of N2 fixation and demonstrate that even in regions 90 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC of low absolute rates of diazotrophy this process may represent a major source of nitrogen to sustain new production in the upper ocean. 91 Large-scale meridional and zonal variability in the nitrogen isotopic composition of plankton in the Atlantic Ocean ABSTRACT The zonal (ca. 15º-40ºW along 26-29ºN) and meridional (ca. 30ºN-30ºS along 28º-29ºW) variability of δ15N of suspended particles and zooplankton (>40 µm) was studied to assess the influence of nitrogen fixation in the isotopic budget of the tropical and subtropical Atlantic ocean. Two cruises were conducted in October-November 2007 and April-May 2008. In the region between 30º-15ºN, the concurrently measured nitrogen fixation (Chapters 2 and 3) was insufficient to explain the consistent patch of suspended particles with δ15N < 2‰ and points to a significant contribution of atmospheric deposition of light nitrogen to the isotopic budget. The equatorial region (15ºN-10ºS) is subject to intense nitrogen fixation, which may explain 40-60% of the observed δ15N in suspended particles and 3-30% in zooplankton. In the South region between 10ºS-30ºS, low values (<4‰) were measured in suspended particles and zooplankton during 2008. The values of δ15N of suspended particles suggest that nitrogen fixation, which is usually low (<10 µmol N m−2 d−1), may represent 50-60% of phytoplankton biomass in this region. Hence, diazotrophy in the South Atlantic may be more important than previously thought. TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 4.1. INTRODUCTION In most marine ecosystems, primary production is limited by the availability of nitrogen (Vitousek and Howarth, 1991; Karl et al., 1992). Reactive nitrogen is supplied to the euphotic zone by different physical, chemical and biological processes such as advective diffusion, atmospheric deposition and biological nitrogen fixation. The latter is mediated by organisms and, in the oligotrophic regions of the oceans, is a relevant source of new nitrogen (Paerl and Zehr, 2000). The ratio of stable isotopes in phytoplankton (15N/14N expressed as δ15N in ‰) is variable, due to the contrasting preferences of the organisms for each isotope. The metabolic pathways usually discriminate against the heavy isotope (15N), a discrimination that is measured by the isotopic fractionation factor (Montoya, 2008). Besides, the different forms of inorganic nitrogen have distinct signatures of δ15N. Deep-nitrate typically ranges between 3-6‰ (Montoya, 2008), atmospheric dinitrogen is, by definition, 0‰, and ammonium lies between 6-8‰ (Miyake and Wada, 1967). Hence, a very different δ15N of organic matter is expected, according to the source of nitrogen, if this is completely consumed. The isotopic signature of phytoplankton will depend then on the signature of the source of nitrogen and the degree of fractionation during uptake. Yet, the interpretation of δ15N is not so simple. In the case of animals (i.e. upper trophic levels), a trophic effect is also observed whereby the tissues of the consumer are usually 2-4‰ heavier than the food, whereas the animal’s excreta, mainly in the form of ammonium, can be 2-4‰ lighter than the food (Montoya, 2008; and references herein). Besides, cultured cyanobacteria growing on excess nitrate showed a strong fractionation factor, yielding δ15N values similar to those produced by growth on dinitrogen (Bauersachs et al., 2009). In the Atlantic Ocean, experimental data retrieved during large-scale surveys show that Trichodesmium, the most well-studied diazotroph, is distributed preferentially between 0-20ºN (Tyrrell et al., 2003; Moore et al, 2009; Luo et al., 2012; previous chapters). In addition, nitrogen fixation is more significant between 0º-15ºN (Moore et al., 2009; Luo et al., 2012; chapter 3). The δ15N of diazotrophs usually ranges between −1‰ and −2‰ (Montoya et al., 2002). 97 4. NITROGEN ISOTOPES IN PLANKTON However, the measured isotopic signature of nitrogen in suspended particles and the biogeochemical estimates of excess nitrogen available in the literature suggest than nitrogen fixation is more relevant in a region further north, between 15º-30ºN (Gruber and Sarmiento, 1997; Mahaffey et al., 2003; Mahaffey et al., 2004; Reynolds et al., 2007; Hansell et al., 2004). The time scales reflected by these measurements are different: in situ nitrogen fixation rates generally represent instantaneous rates over a few hours to 1 day, while δ15N and excess nitrogen are indicators of the diazotrophic activity over longer periods of days to months. However, the determinants of this disagreement remain undefined. Duce et al. (2008) argued that the atmospheric deposition of reactive nitrogen in the oceans has increased due to human activities and is fast approaching the marine N2 fixation budget. Other studies have also shown an increase of the atmospheric deposition of 15N-depleted nitrogen in high and temperate latitudes (Hastings et al., 2009; Mara et al., 2009; Morin et al., 2009; Holtgrieve et al., 2011), as a result of the increasing anthropogenic production of reactive nitrogen and/or natural speciation processes. In addition, Baker et al. (2007) and Knapp et al. (2010) reported depositional fluxes of low δ15N similar to measured N2 fixation rates in the Atlantic Ocean. We have previously described the latitudinal and longitudinal distribution of measured community nitrogen fixation in the tropical and subtropical Atlantic Ocean (previous chapters) and the relative contribution of nitrogen fixation and nitrate eddy diffusion in supplying new nitrogen to the euphotic layer (MouriñoCarballido et al., 2011). Here we report on the distribution of δ15N in suspended particles and two size-fractions of plankton. We aim 1) to describe the largescale latitudinal variability of nitrogen isotopic signatures in the Atlantic Ocean and 2) to compare these inferred patterns of diazotrophy with concurrent, direct measurements of in situ N2 fixation rates. The data presented in this chapter are included in a manuscript in preparation. Citation: Fernández A, Marañón E, Bode A. Large-scale meridional and zonal variability in the nitrogen isotopic composition of plankton in the Atlantic Ocean. In prep. 98 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 4.2. MATERIAL AND METHODS 4.2.1. Sampling, hydrography and chlorophyll a Two research cruises were conducted in the tropical and subtropical Atlantic Ocean during 17 November-8 December 2007 and 13 April-2 May 2008 on board R/V ‘Hespérides’. The tracks followed by the vessel comprised a zonal (chapter 2) and a meridional (chapter 3) transect in each season (Fig. 4.1). 2007 2008 Figure 4.1. Sampling stations during the TRYNITROP cruises on board the R/V ‘Hespérides’. White circles represent the autumn 2007 cruise (17 November - 8 December 2007), and grey triangles the spring 2008 cruise (13 April - 2 May 2008). The vertical distribution of temperature, salinity, dissolved oxygen and fluorescence was measured by a SBE 911plus CTD attached to a rosette equipped with 12-l Niskin bottles which was fired to 300m depth, always before dawn. The vertical profiles of fluorescence and oxygen at each station were 99 4. NITROGEN ISOTOPES IN PLANKTON used to choose the sampling depths for the determination of inorganic nutrients concentration, chlorophyll a concentration, community 15N2 fixation and natural abundance of nitrogen isotopes in suspended particles. The concentration of chlorophyll a was measured at 6-7 depths distributed through the euphotic layer (see chapter 2, section 2.2.3). 4.2.2. Natural abundance of nitrogen isotopes in suspended particles For the determination of δ15N signature in suspended particles (δ15Nsp), 2-l samples were taken at 6 depths through the euphotic layer in each pre-dawn station and filtered through a 25-mm diameter GF/F filter (Whatman). All filters were dried at 40ºC during 24 h and then stored until pelletization in tin capsules. The measurement of particulate organic nitrogen (PON) and 15N atom% was carried out with an elemental analyzer combined with a continuous-flow stable isotope mass-spectrometer (FlashEA112 + Deltaplus, ThermoFinnigan) and using an acetanilide standard as reference. The limit of detection of the equipment was 0.20 µg N. The isotopic signature observed in the suspended particles may be affected by the presence of other types of material in addition to phytoplankton (i.e. bacteria, detritus, zooplankton). The existence of a relationship between the particulate organic nitrogen (PON) to chlorophyll a (chl-a) ratio and the δ15N of suspended particles is an indicator of such a trophic effect (Waser et al., 2000). The Pearson product-moment correlation coefficient of PON:chl-a and δ15Nsp was calculated to test this possibility. The weighted mean of δ15N of suspended particles in the euphotic layer was used as an integral of the signature of phytoplankton in the euphotic zone to simplify the comparison with the δ15N of plankton. It was calculated, following Landrum et al. (2011), as: Weighted mean δ15Nsp = 100 Σi ([PN]i × Δzi × δ15Nsp) Σi ([PN]i × Δzi) TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC Where [PN]i is the concentration (µM) of particulate nitrogen, δ15Nsp is the nitrogen isotopic composition of suspended particles (15N/14N, ‰), and Δzi is the depth interval (m). The relative contribution of diazotroph nitrogen to the bulk suspended particles defined by Montoya et al. (2002) was also calculated assuming a constant value of δ15N deep nitrate (δ15NO3−) of 4.5‰ (Liu and Kaplan, 1989; Sigman et al., 1997) and δ15N of diazotrophs (δ15Ndiazotroph) of −2‰ (Montoya et al., 2002) as: % diazotroph N = 100 × δ 15Nsp – δ 15NO3− δ Ndiazotroph – δ 15NO3− 15 This two-end-member model was assumed to depend only on the contribution of deep-nitrate and diazotrophs. 4.2.3. Natural abundance of nitrogen isotopes in plankton At each pre-dawn station, zooplankton were collected by vertical tows of a 40µm net of 30cm in diameter through the upper 200m of the water column at a constant towing speed of 60 m min−1. The content of the collector was suspended in 500 ml of 20 µm-filtered seawater. Two 60 ml sub-samples were preserved, one in Lugol’s solution and the other in formaldehyde, for the determination of Trichodesmium and other phytoplankters abundances. The rest of the sample was separated into two size fractions by passage through nylon sieves of 40 and 200µm. Each fraction was then re-suspended in 200 ml of 20µm-filtered seawater and subsequently filtered in pre-weighted 45-mm diameter GF/F filters by low vacuum pressure. All filters were dried during 24 h at 40ºC and stored until measurement of particulate organic nitrogen and 15N atom% as previously described. The relative contribution of diazotroph N to zooplankton biomass was estimated following Montoya et al. (2002) two end-member mixing model: 101 4. NITROGEN ISOTOPES IN PLANKTON % diazotroph N = 100 x δ 15Nplankton – δ 15Nreference pl δ 15Ndiazotroph – δ 1 5Nreference pl Where δ15Nplankton stands for the nitrogen isotopic composition of the plankton size-fraction (15N/14N, ‰), and δ15Nreference pl is the δ15N of reference. It was calculated assuming a constant value of δ15Ndiazotroph of −2‰ and using as δ15Nreference pl, in each size fraction, the mean of the 2007 cruise stations between 0-20ºS, where extremely low abundances of Trichodesmium, and the lowest N2 fixation rates, had been measured: 4.6‰ in the 40-200µm size-fraction, and 5.9‰ in the >200µm size-fraction. 4.3. RESULTS 4.3.1. Hydrography and fluorescence In the latitudinal transects, the Equatorial upwelling was clearly defined by the rising of the isolines of temperature (T) and salinity (S) in both cruises (Fig. 4.2a, b, c, d). In order to simplify the analysis of data, we use the changes in the depth of the 16ºC isotherm to delimit three main regions in these transects, i.e., North gyre (29º-15ºN), equatorial region (15ºN-10ºS) and South gyre (10º33ºS). The hydrographic settings found in these regions were similar in both legs. Surface waters in the equatorial region were always warmer (> 24ºC) and less saline (< 35 psu) than in the gyres in both seasons. In turn, the stability of the water column in the gyres was weaker than that found in the equatorial region (see chapter 3). The fluorescence profiles showed a well-defined deep chlorophyll maximum (DCM) associated with the thermocline in both transects (Fig. 4.2e, f). This DCM was shallower and better defined in the equatorial region than in the gyres. By contrast, in the longitudinal sections, waters were warmer and slightly more saline in autumn 2007 than in spring (Fig. 4.2e), leading to a stronger stability of the water column (see chapter 2). The DCM was located at ca. 100m in both zonal legs and no apparent trend in depth was observed (Fig. 4.2e, f). 102 Depth (m) 0 50 100 150 200 250 300 350 0 50 100 150 200 250 300 350 0 0 10 10 20 20 30 30 Figure 4.2. Zonal and meridional vertical distribution of temperature (ºC), salinity and fluorescence in autumn 2007 and spring 2008 cruises. Dashed lines in the temperature panels define the limits of the three major regions identified by the depth of 16ºC isotherm: North gyre, equatorial region and South gyre. Latitude -30 -20 -10 Latitude -30 -20 -10 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 103 4. NITROGEN ISOTOPES IN PLANKTON 4.3.2. Stable nitrogen isotopes in suspended particles (δ15Nsp) and particulate organic nitrogen (PON) The Pearson product-moment correlation coefficient of PON:chl-a and δ15Nsp showed no significant relationship, neither positive nor negative, in our two cruises (Fig. 4.3). Thus, we can assume that the δ15N of suspended particles in our data reflects mainly the composition of phytoplankton (Waser et al., 2000). a) 2007 PON to chlorophyll-a ratio b) 2008 PON to chlorophyll-a ratio 8 6 2 2 0 0 -2 15 Nsp (o/oo) 4 4 δ δ 15 Nsp (o/oo) 6 -2 -4 -6 -4 0 20 40 60 80 100 120 140 160 180 PON:chl-a 0 10 20 30 40 50 60 PON:chl-a Figure 4.3. Relationship between the δ15N of suspended particles (δ15Nsp) and the particulate organic nitrogen (PON) to chlorophyll a (chl-a) ratio during the autumn 2007 (a) and the spring 2008 (b) cruises. The zonal distribution of PON showed no apparent trend and the measured concentrations were similar in magnitude in both cruises (Fig. 4.4b, d), without any significant differences between cruises (t-test). The mean PON concentrations for the zonal transects were 0.22±0.12 µM in 2007 and 0.24±0.06 µM in 2008. In the latitudinal sections, PON depicted a roughly decreasing trend from North to South in autumn 2007, but no trend was found in spring 2008 (Fig. 4.4a, c). The measured concentrations in the South gyre were similar in both cruises. In the North gyre and equatorial regions, measured PON differed significantly between cruises (t-test, p < 0.01 and p < 0.05, respectively). 104 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC b) 2007 Zonal transect 1.5 1.0 0.5 0.5 0.0 -30 -20 -10 0 10 20 30 -40 -30 -20 -10 Longitude Latitude c) 2008 Meridional transect d) 2008 Zonal transect 2.0 2.0 1.5 1.5 1.0 1.0 0.5 0.5 -3 -40 -3 1.5 1.0 0.0 PON (mmol m ) 2.0 -3 z1 (DCM) z2 z3 z4 z5 z6 (5m) PON (mmol m ) -3 PON (mmol m ) 2.0 PON (mmol m ) a) 2007 Meridional transect 0.0 0.0 -40 -30 -20 -10 0 Latitude 10 20 30 -40 -30 -20 -10 Longitude Figure 4.4. Zonal and meridional distributions of particulate organic nitrogen of suspended particles (PON) during the autumn 2007 (a, b) and spring 2008 (c, d) cruises. Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm in the meridional transect: North gyre, equatorial region and South gyre. In the legend z1 to z6 represent the sampled depths from deeper depth, z1 (DCM) to shallower depth, z6 (5m). In the zonal transect of 2007 cruise, the δ15Nsp increased sharply by 4-6‰ from 80-100m to the base of the euphotic layer, probably reflecting the influence of the African upwelling in the easternmost stations (Fig. 4.5a). However, δ15Nsp distributed uniformly in the euphotic layer in 2008 cruise (Fig. 4.5b). In the latitudinal transects, the δ15Nsp was lower in 2007 than in 2008, both in the 105 Depth (m) Depth (m) δ 15N (o/oo) δ 15N (o/oo) δ 15N (o/oo) δ 15N (o/oo) 240 Depth (m) Depth (m) δ 15N (o/oo) δ 15N (o/oo) 240 200 δ 15N (o/oo) -6 -4 -2 0 2 4 6 8 δ 15N (o/oo) -6 -4 -2 0 2 4 6 8 240 200 160 29.1ºS 26.4ºS 23.6ºS 19.7ºS 15.4ºS 12.9ºS 160 80 80 120 40 40 120 0 0 12.3ºS 16.6ºS 20.7ºS 24.9ºS 29.1ºS 33.0ºS 240 200 h) 2008 South gyre region -6 -4 -2 0 2 4 6 8 -6 -4 -2 0 2 4 6 8 g) 2007 South gyre region 240 200 160 120 120 160 80 80 8.9ºS 4.9ºS 0.8ºS 2.2ºS 6.0ºS 10.0ºS 13.9ºS 40 40 14.4ºN 11.2ºN 7.4ºN 3.3ºN 0.3ºS 4.7ºS 8.6ºS 0 f) 2008 Equatorial region 0 e) 2007 Equatorial region Figure 4.5. Vertical distribution of δ15N of suspended particles (δ15Nsp) in autumn 2007 and spring 2008 cruises grouped by region: a, b) zonal transect (15º-38º W), c, d) North gyre region (30º-15ºN), e, f) equatorial region (15ºN-10ºS), and g, h) South gyre region (10º-30ºS). 240 -6 -4 -2 0 2 4 6 8 160 160 -6 -4 -2 0 2 4 6 8 120 120 200 80 80 200 40 40 17.9ºN 21.9ºN 25.6ºN 29ºN / 28.9ºW 0 0 26ºN / 38.3ºW 23.4ºN 20.9ºN 18.4ºN 240 d) 2008 North gyre region -6 -4 -2 0 2 4 6 8 c) 2007 North gyre region 240 -6 -4 -2 0 2 4 6 8 160 160 200 120 120 200 80 80 28.9ºW / 29ºN 24.4ºW 19.9ºW 15.4ºW 40 40 17.5ºW 21.4ºW 25.7ºW 29.8ºW 34.1ºW 38.3ºW / 26ºN 0 0 b) 2008 Longitudinal transect along 29ºN Depth (m) Depth (m) 106 Depth (m) Depth (m) a) 2007 Longitudinal transect along 26ºN 4. NITROGEN ISOTOPES IN PLANKTON North gyre (Fig 4.5c, d) and equatorial region (Fig 4.5e, f). By contrast, in the South gyre region, the vertical distribution of δ15Nsp differed between stations in each cruises (Fig 4.5g, h), with a wide range of values between −4 and 4‰. The difference between cruises were significant in the zonal transect, the North gyre and the equatorial region (t-test, p < 0.01), but not in the South gyre region. TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC The correlations of δ15N of suspended particles with ammonium concentration and with nitrate concentration are shown in Table 4.1. Considering all the stations in each cruise, δ15Nsp correlated with ammonium concentration in 2007 (p < 0.05) and with nitrate in 2008 (p < 0.05). Table 4.1. Pearson product-moment correlation coefficient between δ15N of suspended particles (δ15Nsp) and nutrient concentration: ammonium (NH4) and nitrate (NO3), in 2007 and 2008 cruises. Numbers in brackets represent the total number of samples used for the analysis. All stations 2007 cruise North Equatorial a gyre region South gyre All stations 2008 cruise North Equatorial a gyre region South gyre NH4 0.22* [128] 0.55* [54] 0.43** [38] n.s. n.s. n.s. 0.47** [42] −0.38* [36] NO3 n.s. 0.30* [54] n.s. n.s. 0.21* [120] n.s. n.s. 0.51** [36] ** a p < 0.01, * p < 0.05, n.s. no significative includes the zonal and meridional leg in the North gyre. 4.3.3. Nitrogen isotopic signature in the euphotic layer In order to compare the δ15N of suspended particles and plankton net tows, we calculated the weighted mean of δ15N of suspended particles to obtain an integrative δ15Nsp signature for the whole euphotic layer. The patterns described by the δ15N of the planktonic 40-200 µm (δ15N40) and >200 µm (δ15N200) sizefractions were very similar in all stations, with a few exceptions in the equatorial region and the zonal legs, and closely matched that of δ15Nsp (Fig. 4.6). The average differences between δ15Nsp and the two plankton size fractions were in the range previously described (Minagawa and Wada, 1984). For δ15N40−δ15Nsp was 3.2‰ in 2007 and 2.6‰ in 2008, and for δ15N200−δ15Nsp was 4.3‰ in 2007 and 1.9‰ in 2008. 107 4. NITROGEN ISOTOPES IN PLANKTON a) 2007 Meridional transect b) 2007 Zonal transect 12 10 6 4 4 2 2 0 0 -2 -2 -4 -40 -30 -20 -10 0 10 20 30 -40 Latitude -30 -20 -10 Longitude c) 2008 Meridional transect d) 2008 Zonal transect 12 12 10 10 8 8 6 6 4 4 2 2 0 0 -2 15 N (o/oo) 15 N (o/oo) 8 6 -4 δ 10 δ δ 15 N (o/oo) 8 15 N (o/oo) >200µm 40-200µm suspended particles δ 12 -2 -40 -30 -20 -10 0 Latitude 10 20 30 -40 -30 -20 -10 Longitude Figure 4.6. Zonal and meridional distributions of the weighted mean of δ15N of suspended particles (δ15Nsp), the δ15N of 40-200µm plankton sizefraction (δ15N40), and the δ15N of >200µm plankton size-fraction (δ15N200) in autumn 2007 (a, b) and spring 2008 (c, d). Dashed lines define the limits of the three major regions identified by the depth of 16ºC isotherm in the meridional transect: North gyre, equatorial region and South gyre. In the autumn 2007 meridional transect, the isotopic signature of suspended particles roughly rose to the South (Fig. 4.6). The δ15N40 followed this pattern but not the δ15N200, which showed higher values in the equatorial region. By contrast, the distributions were dome-shaped in spring 2008, reaching peak 108 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC values in the equatorial region. In both cruises, the gyres presented low δ15N values in most of the stations. Besides, a positive statistical correlation between δ15N in the three fractions suggests a relatively efficient transference of nitrogen between trophic levels (Table 4.2). Table 4.2. Pearson product-moment correlation coefficient between δ15N of suspended particles (δ15Nsp), δ15N of 40-200µm plankton size-fraction (δ15N40), and δ15N of >200µm plankton size-fraction (δ15N200) in the latitudinal transects of 2007 and 2008 cruises. ** p< 0.01, n=17. δ15Nsp δ15N40 15 δ N200 δ15N40 2007 2008 2007 2008 0.66 ** 0.82 ** − − ** ** 0.66 0.74 0.90 ** 0.78 ** A two-way factorial ANOVA indicated significant differences between regions and cruises, and for δ15N40 and δ15N200, a significant interaction region-cruise, which enhances the difference (Table 4.3). The post-hoc Tukey HSD suggested that the differences are only significant for the pairs North gyre-equatorial regions. Table 4.3. Two-way factorial ANOVA (region, cruise) of δ15N of suspended particles (δ15Nsp), δ15N of 40-200µm plankton size-fraction (δ15N40), and δ15N of >200µm plankton size-fraction (δ15N200) in the 2007 and 2008 cruises. DF, degrees of freedom; SS, sums of squares; MS, mean of squares; F, F statistic; p, probability. δ15Nsp δ15N40 δ15N200 DF SS MS F p SS MS F p SS MS F p region 2 23.6 11.8 6.3 0.004 26.6 13.3 11.5 0.000 25.7 12.8 15.4 0.000 cruise 1 16.0 16.0 8.6 0.006 4.8 4.8 4.2 0.048 15.9 15.9 19.2 0.000 region vs.cruise 2 6.0 3.0 1.6 0.213 20.9 10.5 9.0 0.000 21.7 10.9 13.1 0.000 109 4. NITROGEN ISOTOPES IN PLANKTON We tried to estimate if Trichodesmium could be the major influence on the patterns observed but no significant correlation (Table 4.4) was found between the measured filament abundance (previous chapters) and the δ15N of suspended particles, the 40-200 µm or the >200 µm plankton size-fractions. Table 4.4. Results of the Pearson's product-moment correlation coefficient between δ15N of suspended particles (δ15Nsp), the 40-200µm (δ15N40) or the >200µm (δ15N200) plankton size-fractions and Trichodesmium abundances (Tricho). Trichoδ15Nsp Trichoδ15N40 Trichoδ15N200 Pearson' s r 0.19 0.10 p 0.22 0.53 0.99 n 42 41 42 0.00 4.3.4. Diazotroph nitrogen contribution to δ15N in the euphotic layer The contribution of diazotrophs to the observed δ15N of suspended particles, 40200µm and >200 µm plankton size-fractions decreased to the South in 2007 cruise (Table 4.5). In 2008, the minimum was observed in the equatorial region (Table 4.5). The importance of this contribution is higher in 2007, except in the South gyre, where the contribution of diazotroph nitrogen was higher in all sizefractions. In both cruises, diazotrophy explains, on average, the 61% of the observed δ15Nsp; the 27% of δ15N40, and the 30% of δ15N200. 4.4. DISCUSSION Our data contributes to the existing studies in the Atlantic Ocean (Waser et al., 2000; Mino et al., 2002; Montoya et al., 2002; Mahaffey et al., 2003; Mahaffey et al., 2004; Reynolds et al., 2007; Landrum et al., 2011) providing basin-scale distribution of δ15N in suspended particles and two plankton size-fractions during two contrasting seasons. We found a consistent 15N-depleted signal (<4‰) in suspended particles (δ15Nsp) in the euphotic layer in most of the 110 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC stations (Fig. 4.5; Fig. 4.6). This implies that nitrogen fixation and/or atmospheric deposition were supplying an important fraction of new nitrogen in most of the tropical and subtropical Atlantic Ocean in our cruises. The trends in the δ15N of the two plankton size-fractions closely matched that of suspended particles, suggesting a relatively high efficiency in the transference of nitrogen to upper trophic levels in certain regions(Fig. 4.6, Table 4.2). Table 4.5. Mean contribution of diazotroph nitrogen to δ15N of suspended particles, 40-200µm plankton size-fraction and >200µm plankton size-fraction according to the two-end-member mixing model proposed by Montoya et al. (2002). The reference zooplankton used in each fraction corresponded to the average of the stations sampled in the South gyre during 2007, where Trichodesmium abundance was < 1 trichome l−1, δ15N40 = 4.6‰, δ15N200 = 5.9‰. The values above 100% and below 0% were discarded in the calculation of the regions average. Standard deviation of the mean is indicated in parentheses. Region Suspended particles 40-200µm zooplankton >200µm zooplankton 2007 2008 2007 2008 2007 2008 Longitudinal transect 81 (29) 59 (3) 52 (14) 16 (9) 43 (4) 31 (6) North gyre region 85 (14) 61 (10) 48 (22) 21 (11) 41 (12) 36 (8) Equatorial region 62 (27) 39 (8) 25 (18) 3 (2) 11 (3) 29 (12) South gyre region 49 (12) 58 (18) 15 (20) 36 (16) 13 (15) 40 (17) In the meridional transect of 2008, the δ15N signal in the >200µm size-fraction (δ15N200) was lower than that in the 40-200 µm size-fraction (δ15N40) in most of the stations (Fig. 4.6), contrary to the usual observed enrichment in 15N of upper trophic levels (Montoya, 2008). The longer turnover times of mesozooplankton relative to phytoplankton and microplankton could result in the uncoupling of 111 4. NITROGEN ISOTOPES IN PLANKTON different size-fractions, resulting in this inversion of the expected increasing pattern (Landrum et al., 2011; Mompeán et al., in press). 4.4.1. Zonal and meridional variations in δ15N in the North gyre In the North gyre, the difference in δ15Nsp between stations was higher in autumn 2007 than in spring 2008 (6‰ and 2‰, respectively). However, the vertical change in δ15Nsp at each station was small in both cruises (Fig. 4.5), and the measured values of δ15Nsp were always <2‰. Our data are in agreement with previous reports in the subtropical North Atlantic which show a range of variation between −2 and 4‰ in the signature of suspended particles (Montoya et al., 2002; Mahaffey et al., 2003; Reynolds et al., 2007; Landrum et al., 2011). These authors described a consistently depleted signal between 7º and 32ºN, which is also confirmed by geochemical tracers (Gruber and Sarmiento, 1997; Hansell et al., 2004) and points to a persistent excess nitrate in this area. These light nitrogen signatures have been associated with a large impact of diazotrophic nitrogen in the isotopic budget of this area, discarding the influence of other sources of new light nitrogen because of their weak strength or unlikely occurrence (Reynolds et al., 2007; Landrum et al., 2011). However, later studies provided new insights that suggest a more relevant influence of alternative sources such as the atmospheric deposition of 15N-depleted nitrogen. The δ15N of deep-water nitrate typically ranges between 3-6‰ with a global average of 4.8‰ (Montoya, 2008). Thus, in the presence of excess nitrate, the isotopic fractionation during its uptake could result in values of δ15Nsp lower than 3‰. A recent study showed that cyanobacteria, especially Trichodesmium, growing on nitrate could express a nitrogen isotopic signal similar to that of nitrogen fixation depending on the isotopic composition of the nitrogen source, the degree of fractionation, and the type of cyanobacterium (Bauersachs et al., 2009). However, no excess dissolved inorganic nitrogen was found in surface waters in our zonal or meridional legs, where the concentration of nitrate in the euphotic layer was always lower than 130 nM (Mouriño-Carballido et al., 2011; see also chapters 2 and 3). We also recorded measurable but low abundances of 112 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC Trichodesmium (<60 trichomes l−1) in the euphotic layer (see chapters 2 and 3), which is an indication of potential diazotrophy in the area. But, no significant correlation appeared between Trichodesmium abundances and the δ15Nsp (Pearson’s r). Hence, we would not expect that a strong isotopic fractionation associated with cyanobacteria or other phytoplankters was responsible for the observed δ15Nsp during our cruises. The lack of data on atmospheric deposition of nitrogen during our study limits any direct comparison with the measured nitrogen fixation and the distribution of the δ15N signature, but we can attempt to use an indirect analysis instead. The two-end-member model proposed by Montoya et al. (2002) yields a contribution of N2 fixation to δ15Nsp in the range 81-85% in 2007 and 59-61% in 2008 (Table 4.5), which is close to the previous estimation of 74% by Reynolds et al. (2007). However, experimental measurements of community nitrogen fixation in this region indicate modest rates of diazotrophy (<60 µmol N m−2 d−1) throughout the year (Moore et al., 2009; Benavides et al., 2011; chapters 2 and 3). During the spring 2008 cruise, Mouriño-Carballido et al. (2011) calculated the relative importance of nitrate eddy diffusion and measured rates of nitrogen fixation as sources of new nitrogen to the euphotic layer in the North gyre. They estimated that the average contribution of nitrogen fixation in this cruise was only 2% over daily time-scales. We acknowledge that the comparison of these two fluxes is difficult as they represent different timescales, i.e., the δ15Nsp represents time-scales of days to weeks, while the measured nitrogen fixation time-scale is one day. But the difference between the fluxes is 30-fold in 2008. This suggests that other sources than diazotrophy may be contributing to our observed δ15Nsp, and that the low values are not only a consequence of intense nitrogen fixation. The importance of the atmospheric deposition of low δ15N nitrogen, natural or anthropogenic, is increasing in high and temperate latitudes (Hastings et al., 2009; Morin et al., 2009; Mara et al., 2009; Holtgrieve et al., 2011). According to the model of Duce et al. (2008), the atmospheric supply of anthropogenic reactive nitrogen in the central North Atlantic is usually higher in the latitudinal range between 5º and 25ºN. The δ15N of this anthropogenic N depends on its origin and is extremely variable (Fang et 113 4. NITROGEN ISOTOPES IN PLANKTON al., 2011). For instance, the δ15N of fuel NOx produced by power plants ranges between 5 and 13‰ (Heaton, 1990; Kiga et al., 2000), but that of thermal NOx produced by vehicle exhausts ranges between −13 and −2‰ (Heaton, 1990). Besides, in the Atlantic Ocean between 45ºN-45ºS, Morin et al. (2009) found a δ15N of atmospheric nitrate that ranged between −7 and −1.6‰ and was mainly representing natural sources. In the Mediterranean Sea (Crete Island), Mara et al. (2009) described a consistent source of low δ15N nitrate throughout the year with a potential impact on the isotopic budget of intermediate and deep waters, which could lead to an overestimation of N2 fixation if atmospheric nitrate is neglected. In spite of that, previous studies discarded the effect of this process in the analysis of the nitrogen isotopic budget, based on the assumption that the flux is small compared to nitrogen fixation (Landrum et al., 2011) or to the export flux of nitrogen out of the euphotic layer (Reynolds et al., 2007). By contrast, Baker et al. (2007) and Knapp et al. (2010) measured atmospheric depositional fluxes of 15N-depleted nitrogen similar to those of N2 fixation in the North Atlantic Ocean. Considering this information, we suggest that the observed δ15Nsp in the North gyre region during our cruises could be the result of the supply of light nitrogen through both nitrogen fixation and atmospheric deposition. Therefore, discarding the effect of this atmospheric supply in the analysis of δ15Nsp would result in the overestimation of nitrogen fixation. The signature of light nitrogen found in suspended particles seems to be efficiently transferred to upper trophic levels. Firstly, the δ15N distributions of the two zooplankton size-fractions and the suspended particles are significantly correlated (Fig. 4.6, Table 4.2). Secondly, the observed difference between plankton and particles at each station (2-4‰) is in agreement with previous studies reporting that zooplankton nitrogen is typically 3‰ heavier than phytoplankton (Minagawa and Wada, 1984), due to the enrichment of zooplankton tissues by the isotopic fractionation associated with metabolic and excretory processes (Montoya, 2008). Thirdly, both plankton size-fractions showed relatively low values of δ15N throughout the transects (<4‰). Again, the data provided by the two-end-member model proposed by Montoya et al. (2002) point out that the contribution of nitrogen fixation to upper trophic levels 114 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC in 2007 represents 48-52% in the 40-200µm size-fraction and 41-43% in the >200 µm size-fraction (Table 4.5). In 2008, it represented roughly 16-21% of the 40-200 µm fraction signal and the 31-36% of the >200 µm size-fraction (Table 4.5). However, we would expect an overestimation of this contribution due to the combined effect of atmospheric deposition of 15N-depleted nitrogen and nitrogen fixation in the isotopic budget of this region. The δ15N measured in suspended particles and zooplankton suggests a consistent supply of light nitrogen in this region of the Atlantic Ocean throughout the year, which coincides with previous studies (Montoya et al., 2002; Mahaffey et al., 2003; Reynolds et al., 2007; Landrum et al., 2011). However, we did not measure the isotopic composition of the depositional fluxes, which could be compared with measured community nitrogen fixation in our cruises to determine the actual contribution of each flux (Baker et al., 2007; Knapp et al., 2010). Further studies, characterizing the strength, frequency and δ15N of the atmospheric sources of nitrogen relative to in situ measured nitrogen fixation, will help to unequivocally ascertain the relative importance of each process in determining the δ15N signatures in the North Atlantic. 4.4.2. Meridional variations in δ15N in the equatorial region In the equatorial region, the meridional trends of the δ15N of suspended particles coincided with those previously described by Mahaffey et al. (2004). However, our absolute values are lower than theirs, in the range −2 to 4‰, and closer to those measured by Reynolds et al. (2007) in the water column and by Mino et al. (2002) in surface waters. The upwelling in this region allows a persistent diffusion of deep nitrate to surface waters, which was reflected in the increase of nitrate concentration during our cruises (Mouriño-Carballido et al., 2011, chapters 2 and 3), and is likely to support a substantial fraction of primary production. Therefore, heavy deep-nitrate is probably determining part of the δ15N of suspended particles in the equatorial region. In autumn 2007, the difference between the δ15N of 40-200 µm and >200 µm plankton size-fractions (2‰) suggests either a different time scale in the 115 4. NITROGEN ISOTOPES IN PLANKTON integration of the signal or a low efficiency in the transference of nitrogen to upper trophic levels. The latter could be attributed to the loss of isotopically light ammonium through excretory processes, which was suggested as a major source of light nitrogen in oligotrophic regions (Checkley and Miller, 1989; Montoya, 2008). However, the positive correlation between δ15N of suspended particles and ammonium concentration in our cruises (Table 4.1) suggests that the increase in ammonium is increasing the δ15Nsp and may not be related to the excretion of plankton. The cyanobacterium Trichodesmium exudates up to 50% of recent fixed N2 as dissolved organic nitrogen, which can be easily assimilated by other phytoplankters and/or bacteria (Glibert and Bronk, 1994). Furthermore, both nitrogen fixation and Trichodesmium abundances typically reach high values in this region (Tyrrell et al., 2003; Moore et al., 2009; chapters 2 and 3). Thus, the supply of light ammonium linked to diazotrophs is probably determining an important fraction of the nitrogen isotopic budget in the equatorial region. The two-end-member mixing model (Montoya et al., 2002) yields an average contribution of this diazotroph nitrogen to δ15Nsp of 62±27% in autumn 2007 and 39±8% in spring 2008 (Table 4.5). On the other hand, Mouriño-Carballido et al. (2011) estimated that the daily contribution of N2 fixation to total (N2 fixation + vertical diffusion of nitrate) input of new nitrogen was 22% in the 2008 cruise. Again, these fluxes represent different time scales, but both suggest that nitrogen fixation account for a relevant fraction of the supply of nitrogen to the euphotic layer in this region, and are consistent with previous experimental measurements. The diazotroph nitrogen was inefficiently transferred to upper trophic levels, as it accounted for 25±18% in the 40-200 µm size-fraction and 11±3% in the >200 µm size-fraction in 2007 cruise, and for 3±2% in the 40-200µm size-fraction and 29±12% in the >200 µm size-fraction in 2008 cruise (Table 4.5). Trichodesmium, the dominant diazotroph in this region, is toxic to many species of zooplankton (Hawser et al., 1992) and only a few groups of copepods are known to graze it (O’Neil and Roman, 1994). Besides, these groups seem to excrete a major fraction of the ingested nitrogen (O’Neil et al., 1996, Wannicke 116 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC et al., 2010). Thus, diazotroph nitrogen is preferentially transferred through dissolved pools when Trichodesmium dominates the community (Mulholland, 2007). 4.4.3. Meridional variations in δ15N in the South gyre region The distribution of δ15N of suspended particles and zooplankton in the South gyre region depicted contrasting trends in 2007 and 2008 (Fig. 4.6). Even though the vertical distribution of δ15Nsp varied within a range of 6‰, data were <4‰ in all stations (Fig. 4.5) suggesting that a 15N-depleted source of nitrogen is significantly contributing to the signals. In autumn 2007, the general meridional pattern largely coincided with that described by Mino et al. (2002) in surface waters, but not with those given by Mahaffey et al. (2004) and Reynolds et al. (2007), who found a general increasing trend to the South with values >2‰. The light patch of δ15Nsp in the range −2 to 0‰, which was found between 20º-30ºS in the 2007 cruise (Fig. 4.6), seems to be a persistent feature also described by Mino et al. (2002) with values close to −1‰, and Reynolds et al. (2007) with values close to 0‰. By contrast, this is the first time that a decreasing trend δ15N such as the one depicted in spring 2008 is described in this region. The flux of atmospheric deposition of nutrients in the South Atlantic Ocean is extremely weak (Gao et al., 2001; Duce et al., 2008), thus we may discard the effect of light atmospheric nitrogen in the isotopic budget. The proximity of the δ15N of both zooplankton size-fractions suggests a high efficiency in the transference of nitrogen between trophic levels so we also expect a weak influence of a possible zooplankton-excreted light ammonium (Checkley and Miller, 1989) on the signal of δ15Nsp. Mahaffey et al. (2004) suggested that the relatively important dissolved organic nitrogen pool of the South Atlantic could account for the high δ15N measured in their study. On the contrary, Knapp et al. (2011) found that a long-lived and poorly reactive DON pool in other regions of the Atlantic and Pacific Oceans which could be a source of light ammonium through deamination. However, we propose that the supply of diazotroph 117 4. NITROGEN ISOTOPES IN PLANKTON nitrogen is significantly determining the observed δ15Nsp. The few experimental measurements performed to date in the South Atlantic show that nitrogen fixation is persistent in this region with rates in the range 2 to 50 µmol N m−2 d−1 (Moore et al., 2009; Grosskopf et al., 2012; chapter 3), which are similar to those reported in the equatorial and North gyre region. This suggests that nitrogen fixation could be responsible of the persistent light patch of δ15Nsp in the South gyre between 10º-30ºS. The contribution of nitrogen fixation to the δ15N of suspended particles was 49±12% in 2007 and 58±18% in 2008, according to a two-end-member model based on nitrate and diazotrophy (Montoya et al., 2002). Besides, the daily contribution of nitrogen fixation to the total (N2 fixation + nitrate diffusive flux) input of nitrogen to the euphotic layer was 44% during strong stratification conditions in April 2008 (MouriñoCarballido et al., 2011). This diazotroph nitrogen is transferred to upper trophic levels with relatively high efficiency in 2008 as it represented 36±16% of the 40-200µm size-fraction and 40±17% of the >200µm size-fraction (Table 4.5). Hence, both experimental measurements and estimations seem to agree in that nitrogen fixation could be supporting an important fraction of primary production in the South gyre, even though the absolute rates are low. 4.4.5. Conclusions A persistent and consistent signature of low δ15N of suspended particles (δ15Nsp) is found in the North gyre region (30º-15ºN) throughout the year in both zonal and meridional transects, which is usually associated with a relevant input of nitrogen fixed by diazotrophs (Mahaffey et al., 2003; Reynolds et al., 2007; Landrum et al., 2011). However, the experimental measurements of nitrogen fixation show modest rates in comparison with other regions of the Atlantic Ocean and do not seem to support this argument. The atmospheric deposition of light nitrogen, which is increasing in the last years, is likely to complete the required supply that produces this depleted δ15N signal. However, few studies have addressed the depositional and diazotrophic fluxes together (Baker et al., 118 TRICHODESMIUM AND NITROGEN FIXATION IN THE ATLANTIC 2007; Knapp et al., 2011) and further studies are needed to accurately define the strength, frequency and isotopic composition of the atmospheric depositional flux against the flux of nitrogen fixation in the North Atlantic. The equatorial region (15ºN-10ºS) is subject to relatively intense nitrogen fixation throughout the year (Moore et al., 2009; Grosskopf et al., 2012; chapter 3) which may explain 40 to 60% of the observed δ15Nsp signal. However, this nitrogen of diazotrophic origin seems to be inefficiently transferred to upper trophic levels. In the South gyre, the low δ15Nsp and the daily estimated contribution of nitrogen fixation to the supply of new nitrogen (Mouriño-Carballido et al., 2011) suggest that diazotrophs can contribute up to half of the nitrogen in phytoplankton nitrogen at different time scales. Even though the measured nitrogen fixation rates are low (Moore et al., 2009; Grosskopf et al., 2012; chapter 3), their impact in the nitrogen isotopic budget of this region may be large. Hence, a re-evaluation of the importance of diazotrophy in the South Atlantic Ocean is needed through new studies that should address the annual variability in nitrogen fixation rates as well as the distribution and relative importance of the different groups of diazotrophs. 119 Síntesis y conclusiones TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 5.1. SÍNTESIS La presente tesis ha abordado el estudio de la fijación biológica de nitrógeno en el océano Atlántico tropical y subtropical desde un punto de vista ecológico y biogeoquímico. Las medidas, realizadas a bordo del B/O Hespérides en otoño de 2007 y primavera de 2008, cubrieron un amplio rango espacial, desde aproximadamente 30ºN a 30ºS. En ambas campañas se ha estudiado la variabilidad meridional de la abundancia de Trichodesmium, la fijación de N2 y la abundancia natural de isótopos de nitrógeno (15N y 14N). Además, en el giro norte subtropical hemos explorado también la variabilidad zonal de dichas variables. 5.1.1. Variabilidad zonal en el Atlántico norte El giro norte del océano Atlántico es una región sujeta a un aporte atmosférico relevante y casi continuo de micro- y macronutrientes (Gao et al., 2001; Duce et al., 2008; Mahowald et al., 2009), como se muestra en las estimaciones de concentración de polvo en la atmósfera (capítulo 2, Tabla 2.1). Esto garantiza un suministro semi-continuo de hierro, que sería suficiente para cubrir los requerimientos tanto de fijadores de N2 como de no fijadores. En este marco, la distribución zonal de Trichodesmium parece regulada principalmente por la temperatura y el grado de estabilidad vertical. El óptimo para su crecimiento se encontraría en columnas de agua con temperaturas por encima de 20ºC, que garantizan la anoxia intracelular, y un alto grado de estabilidad vertical, que permite la acumulación de los tricomas en superficie. La variación zonal de la fijación de N2 de la comunidad no parece relacionada directamente con las abundancias de Trichodesmium, que no sería capaz de explicar por sí mismo las tasas observadas. Esto sugiere la presencia de otros diazótrofos en la región que, además, están fijando N2 de manera activa, especialmente durante la campaña de 2008 (capítulo 2, Figura 2.6). La falta de medidas de identificación de nifH en nuestras campañas no nos permite definir los grupos concretos; sin embargo, dada la distribución más o menos homogénea de la fijación de N2 en la columna de agua, es probable que se trate de cianobacterias unicelulares de vida libre, 123 5. SÍNTESIS Y CONCLUSIONES que tienen una distribución más homogénea en la columna de agua (Langlois et al., 2008). Por otro lado, la distribución zonal de la fijación de N2 covaría con el flujo estimado de fosfato a través de la base de la capa fótica, lo que sugiere que la disponibilidad de fósforo puede actuar como un factor de regulación local de la diazotrofía en esta región. 5.1.2. Variabilidad latitudinal en el océano Atlántico La distribución meridional de Trichodesmium en el océano Atlántico tropical y subtropical (30ºN-30ºS) parece estar controlada principalmente por la disponibilidad de hierro, aunque la temperatura y el grado de estabilidad vertical también desempeñan un papel importante. Los aportes de hierro presentan un claro desequilibrio latitudinal, siendo muy intensos en el Atlántico norte entre el Ecuador y 20°N y de escasa importancia en el Atlántico sur (capítulo 3, Figura 3.5). Los óptimos para Trichodesmium de estos tres factores, es decir, temperaturas por encima de 20ºC, alta estabilidad vertical y suministro suficiente de hierro, se producen en la región ecuatorial (15ºN-10ºS), donde se detectan las mayores abundancias de este organismo (capítulo 3, Figura 3.7, Figura 3.9). Los datos de la presente tesis y de estudios previos (Tyrrell et al., 2003; Moore et al., 2009; Gosskopf et al., 2012) sugieren que este patrón se repite de manera consistente a lo largo del año. Asimismo, los patrones meridionales de fijación de N2 están controlados principalmente por la disponibilidad de hierro, que aparece como el factor clave en la distribución a escala de cuenca de la diazotrofía. Como hemos visto, la fijación de N2 de la comunidad correlaciona significativamente con la distribución de Trichodesmium (coeficiente de correlación de Pearson, r = 0,77; p < 0,01), lo que indica que, en muchas de las estaciones muestreadas, estos organismos son los principales responsables de las tasas observadas. Sin embargo, en el giro sur subtropical, la fijación máxima estimada atribuible a Trichodesmium no es suficiente para explicar las tasas de fijación de N2 medidas (capítulo 3, Figura 3.10). Esto sugiere la existencia de otros diazótrofos, posiblemente cianobacterias unicelulares de vida libre. La magnitud relativa de esas tasas de fijación en el giro sur es modesta en comparación con las tasas más altas, 124 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO medidas en la zona ecuatorial (capítulo 3, Figura 3.9). Sin embargo, según los cálculos de Mouriño-Carballido et al. (2011), en la campaña de 2008, este pequeño flujo podría estar contribuyendo hasta en un 44% a la entrada diaria de nitrógeno nuevo en esta región. 5.1.3. Abundancia natural de isótopos de nitrógeno en la capa eufótica La abundancia natural de isótopos tanto en fito- como en zooplancton se ha mostrado como una herramienta útil para la identificación cualitativa de las áreas en las que la fijación de N2 es un proceso relevante de suministro de nitrógeno nuevo hacia la capa eufótica. Sin embargo, la importancia de la fijación de N2 deducida a partir de los bajos valores de la señal de δ15N es relativa y no se traduciría directamente en una mayor tasa absoluta. Así, las áreas en las que la fijación de N2 suministra una fracción considerable de nitrógeno a la comunidad fitoplanctónica no son necesariamente aquellas en las que la señal de δ15N presenta los valores más bajos. Por otro lado, es necesaria una correcta caracterización de los procesos que pueden afectar al balance de isótopos de nitrógeno en cada región, como puede ser el caso del suministro atmosférico de nitrógeno en el Atlántico norte. En el giro norte subtropical encontramos una zona persistente de bajo δ15N en fito- y zooplancton, que coincide con datos de estudios previos (Mino et al., 2002; Mahaffey et al., 2004; Reynolds et al., 2007; Landrum et al., 2011) y es posiblemente consecuencia del aporte de nitrógeno ligero por deposición atmosférica, además de la fijación de N2. Asimismo, en el giro sur subtropical, el efecto de la fijación de N2 sobre el δ15N parece considerable, llegando a explicar en nuestras campañas 49-58% de la biomasa del fitoplancton. La distribución de Trichodesmium y la fijación de nitrógeno en el océano Atlántico están determinadas por las diferencias meridionales de numerosas variables (Figura 5.1.). Así, existe una asimetría clara en los aportes atmosféricos de nutrientes entre el giro norte y el giro sur del Atlántico. En general, la intensidad y frecuencia de estos aportes es mayor en el norte (Gao et al., 2001; Duce et al., 2008), garantizando un suministro semi-continuo de 125 5. SÍNTESIS Y CONCLUSIONES hierro y disminuyendo el grado de limitación de los productores primarios por este elemento. Además, las mayores intensidades tanto de diazotrofía como de producción primaria observadas en el norte provocan un consumo intenso de fosfato, cuya disponibilidad será menor. Así, existe una tendencia a la limitación por fósforo en esta región (Mather et al., 2008; Mills et al., 2004; Moore et al., 2009). Sin embargo, el consumo de fósforo en el sur es mucho menor, por lo que su disponibilidad no llega a ser limitante (Moore et al., 2009). Figura 5.1. Esquema resumen de los principales factores que determinan las diferencias latitudinales en la fijación de nitrógeno en el océano Atlántico (30ºN-30ºS). 5.1.4. Los problemas de la adición de 15N2 como burbuja de gas Estudios recientes muestran que la técnica de adición de 15N2 en forma de burbuja de gas puede subestimar las tasas reales de fijación de nitrógeno debido a una lenta e incompleta disolución del trazador en la botella de incubación (Mohr et al., 2010; Grosskopf et al., 2012). El grado de subestimación dependería del tiempo de incubación y de la composición de la comunidad diazotrófica, por lo que definir un factor de corrección universal que permita 126 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO recalcular las tasas es difícil. En principio, parece que incubaciones cortas, de unas pocas horas, o que empiecen en el periodo de máxima fijación de nitrógeno de los diazótrofos propiciarían una mayor subestimación de las tasas de fijación (Mohr et al., 2010). Por otro lado, en el océano Atlántico se ha visto que la composición de la comunidad es un factor crucial en el grado de aprovechamiento de esa limitada cantidad de gas (Grosskopf et al., 2012). La lenta disolución de la burbuja puede generar un gradiente de N2 dentro de la botella. Así, la subestimación en comunidades dominadas por fijadores con cierta capacidad de flotabilidad que puedan estar cerca de la burbujas, como Trichodesmium, es menor que en aquella en las que los diazótrofos sedimenten al fondo de la botella. Mohr et al. (2010) proponen la adición del 15N2 ya disuelto en agua de mar desgasificada para asegurar una completa disponibilidad del gas. En el trabajo de Grosskopf et al. (2012) esta subestimación varia desde un factor de 2, en comunidades dominadas por Trichodesmium, hasta un factor de 7 en comunidades dominadas por cianobacterias unicelulares. Las tasas de fijación de nitrógeno de la presente tesis se obtuvieron con incubaciones largas (24 horas). Según Mohr et al. (2010), en un periodo de 24 horas se disuelve hasta un 75% del gas inyectado. Además, el gas se añadió antes del amanecer, por lo que la cantidad disponible para aquellos diazótrofos que fijan durante la noche se aproximaría a esa disponibilidad máxima, lo que resultaría en un grado de subestimación menor. Es difícil determinar en qué grado la composición de la comunidad ha afectado a nuestras medidas, dado que sólo disponemos de medidas de abundancia de Trichodesmium. Sin embargo, hemos sido capaces de detectar los picos de actividad en el Atlántico sur que, en el trabajo de Grosskopf et al. (2012), sólo fueron evidentes con el método de disolución y no estaban asociados a la presencia de Trichodesmium. Por todo ello, consideramos que, aunque las tasas absolutas que hemos medido estén moderadamente subestimadas, los patrones observados siguen siendo válidos. 127 5. SÍNTESIS Y CONCLUSIONES 5.1.5. Futuros estudios Como hemos visto, las variables que controlan la distribución de los diazótrofos y su actividad son numerosas. Además, no todas actúan a la misma escala. Así, el fósforo parece importante a escala local mientras que el hierro lo sería a escala de cuenca. Por otro lado, el reciente descubrimiento de la sistemática subestimación de las tasas medidas obligará a la reevaluación de los patrones conocidos a gran escala de distribución de diazótrofos y su actividad (Luo et al., 2012). Los futuros estudios deberían coordinar medidas fraccionadas por tamaños de fijación de nitrógeno con la identificación genética de los grupos de fijadores presentes. Esta coordinación no ha sido una práctica común. La mayor parte de la información disponible hasta la fecha proviene de estudios sólo de distribución de fijadores o sólo de fijación de nitrógeno, lo que dificulta establecer de manera clara la contribución relativa de cada grupo. Además, en el futuro, las áreas de estudio no deberían restringirse a las de distribución de Trichodesmium ya que se ha comprobado que, a temperaturas por debajo de 20ºC, otros fijadores utilizan N2 de manera activa (Rees et al., 2009; Mulholland et al., 2012). En cuanto a los factores que controlan la fijación de nitrógeno, a las medidas anteriores, habría que añadir medidas de: 128 i) las variables físicas que puedan influir sobre los organismos, como el grado de estabilidad de la columna de agua, la temperatura o la salinidad; ii) la deposición atmosférica de nutrientes (especialmente hierro y nitrógeno inorgánico), tanto de su frecuencia e intensidad, como, en el caso del nitrógeno, de su naturaleza (δ15N); iii) el contenido intracelular de hierro y fósforo, que ayudarán a determinar la escala de actuación de cada uno (local vs. global); iv) los flujos difusivos de nutrientes hacia la capa eufótica, especialmente fósforo y nitrógeno inorgánicos; TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO v) la señal isotópica de nitrógeno en compuestos específicos (p.ej. aminoácidos) y en distintas fracciones de plancton, como indicador de la transferencia de nitrógeno diazótrofo en la cadena trófica; vi) la alteración de las relaciones nitrato/fosfato medida a través del N*, como indicador de actividad diazótrofa. Por último, estos estudios deberían tener una amplia escala espacial y temporal. Idealmente, una correcta caracterización de estas variables se haría mediante la combinación de ambas escalas, ya que hemos visto que la variabilidad a lo largo del año puede ser tan amplia como la variabilidad geográfica. Los estudios con una alta resolución temporal ayudarán a determinar tanto la variabilidad estacional en abundancia de fijadores y tasas de fijación como el grado de respuesta de los diazótrofos a los distintos factores de control (Benavides et al., 2013). 5.2. CONCLUSIONES 1. La distribución zonal de la abundancia de Trichodesmium en el Atlántico Norte parece determinada principalmente por la temperatura y el grado de estabilidad vertical de la columna de agua. Una alta estabilidad y temperaturas por encima de 20ºC son requisitos esenciales para el crecimiento de este género de cianobacterias. 2. La abundancia media de Trichodesmium en superficie en el transecto meridional fue de 31±49 tricomas l-1 en la región norte (30º-15ºN), 222±266 tricomas l-1 en la región ecuatorial (15º N-10º S) y 1±1 tricoma l-1 en la región sur (10º-30ºS). 3. La distribución latitudinal de Trichodesmium en el océano Atlántico parece controlada fundamentalmente por la disponibilidad de hierro. Las condiciones más favorables para estos organismos, un suministro suficiente de hierro junto con temperaturas por encima de 20ºC y elevada estabilidad vertical, se alcanzan en la región ecuatorial. 129 5. SÍNTESIS Y CONCLUSIONES 4. La distribución zonal de la fijación de nitrógeno de la comunidad diazótrofa en el Atlántico Norte subtropical parece regulada principalmente por el suministro de fósforo, que podría actuar como un factor de regulación local a pequeña escala. 5. La distribución latitudinal de la fijación de nitrógeno en el océano Atlántico tropical y subtropical está controlada por la disponibilidad de hierro, cuyos aportes por deposición atmosférica son máximos en el norte y mínimos en el sur. Así, el suministro de hierro es un factor regulador general a gran escala. 6. La fijación de nitrógeno integrada verticalmente en la capa eufótica fue, en promedio, 18±7 µmol m−2 d−1 en la región norte (30º-15ºN), 61±26 µmol m−2 d−1 en la región ecuatorial (15ºN-10ºS) y 7±2 µmol m−2 d−1 en la región sur (15-30ºS). 7. La fijación de nitrógeno ha sido detectable en todas las estaciones, incluso cuando Trichodesmium estaba ausente. La comparación de las tasas medidas con las esperadas si Trichodesmium fuese el diazótrofo dominante sugiere que otros fijadores contribuyen de manera significativa a la fijación de la comunidad, incluso con temperaturas por debajo de 20ºC, en un amplio rango de regiones, especialmente en el Atlántico sur. 8. La intensa fijación de nitrógeno medida en la región ecuatorial (15ºN-10ºS) podría explicar de un 40 a un 60% de la señal de δ15N observada en las partículas en suspensión, confirmando el patrón de medidas experimentales. 9. La fijación de nitrógeno es un proceso relevante de entrada de nitrógeno nuevo en el Atlántico Sur pues, aunque las tasas medidas son modestas (<10 µmol N m−2 d−1), representa hasta un 58% del nitrógeno del fitoplancton estimada a través de la señal de δ15N. 130 Resumen TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 6.1. INTRODUCCIÓN El nitrógeno es el principal limitante de la productividad en océano abierto. La fijación biológica de nitrógeno (N2) representa un suministro importante de nitrógeno nuevo en la capa eufótica en regiones tropicales y subtropicales (Karl et al., 2002). Este proceso es más efectivo apoyando la retirada biológica de CO2 que el flujo vertical de nitrato, que suele estar acoplado al flujo de CO2 de aguas profundas (Michaels et al., 2001). En los océanos, la fijación de nitrógeno se realiza a través de cianobacterias, de las que el género Trichodesmium es el más estudiado (Capone et al., 1997; Galloway et al., 2004). Son capaces de generar extensas proliferaciones, se distribuyen de manera cosmopolita y presentan actividades de fijación de N2 relevantes (Capone, 2001; Mahaffey et al., 2005). Por ello se les ha considerado los principales, sino únicos fijadores de N2 en regiones tropicales y subtropicales. Sin embargo, estudios recientes señalan la existencia de otros organismos, principalmente unicelulares de vida libre, que podrían ser igual de importantes (Zehr et al., 2001; Montoya et al., 2004; Moisander et al., 2010). Estos grupos se extienden en la columna de agua de manera más homogénea que Trichodesmium, que domina en superficie (Langlois et al., 2008). Además presentan óptimos de temperatura más bajos que Trichodesmium (Langlois et al., 2005; Stal, 2009). En el océano Atlántico, las medidas experimentales muestran que Trichodesmium se distribuye preferentemente entre 0-20ºN (Tyrrell et al., 2003; Moore et al, 2009; Luo et al., 2012; el presente estudio). Además, la fijación de nitrógeno es más intensa en la banda 0º-15ºN (Moore et al., 2009; Luo et al., 2012; capítulo 3). El δ15N de los fijadores de nitrógeno suele variar entre −1‰ y −2‰ (Montoya et al., 2002). Sin embargo, tanto la señal isotópica de nitrógeno en partículas en suspensión y en plancton, medidas en el Atlántico, como las estimaciones biogeoquímicas sugieren que la fijación de nitrógeno es más relevante en el rango 15º-30ºN (Gruber and Sarmiento, 1997; Mahaffey et al., 2003; Mahaffey et al., 2004; Reynolds et al., 2007; Hansell et al., 2004). Las escalas temporales de las medidas in situ y el δ15N son distintas (días frente a meses). Sin embargo, la razón de la discrepancia entre estas variables no se ha definido aún. Aunque existen evidencias de un aumento en la deposición de 133 6. RESUMEN nitrato con bajo δ15N en los últimos años que podrían explicar estas discrepancias (Hastings et al., 2009; Mara et al., 2009; Morin et al., 2009; Holtgrieve et al., 2011). La presente tesis representa un estudio de la variabilidad longitudinal en el Atlántico norte y la variabilidad latitudinal en el Atlántico tropical y subtropical (norte y sur) de la distribución de Trichodesmium, la fijación de nitrógeno y el δ15N en fito- y zooplancton, así como de los posibles factores de control que explican dichas distribuciones durante dos campañas en épocas contrastadas. 6.2. MÉTODOS 6.2.1. Muestreo, hidrografía, nutrientes y clorofila a El muestreo se realizó a bordo del B/O Hespérides del 17 noviembre al 8 diciembre de 2007 y del 13 abril al 2 mayo de 2008 dentro del marco del proyecto “TRichodesmium spp. Y fijación de NItrógeno en el Atlántico TROPical” (TRYNITROP). El barco siguió un transecto longitudinal y un transecto latitudinal en ambas campañas (Figura 6.1) con estaciones separadas unos 400km. Las muestras se tomaron antes de amanecer mediante botellas Niskin de 12 litros en una roseta que se largó a 300m de profundidad. La distribución vertical de temperatura, salinidad y fluorescencia se midió con un CTD SBE 911plus. En base a los perfiles de oxígeno y fluorescencia se seleccionaron las profundidades para la determinación de la concentración de clorofila a, la concentración de nitrato y fosfato, la producción primaria particulada, la fijación de nitrógeno y la abundancia de 15N en partículas en suspensión. La concentración de nitrato y fosfato se determinó mediante métodos colorimétricos (Raimbault et al., 1990; Grasshof, 1976), el límite de detección para el análisis de nitrato fue de 2 nmol l−1, el de fosfato fue 0,02 µmol l−1. Además, en 2008, se realizaron medidas de la microestructura de la velocidad de cizalla que permitieron estimar los flujos difusivos de fosfato en los transectos longitudinales a través del coeficiente de difusividad vertical y la distribución de fosfato en la columna de agua. 134 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 2007 2008 Figure 6.1. Estaciones de muestreo durante las campañas TRYNITROP a bordo del B/O Hespérides. Los círculos blancos representan la campaña de 2007 (17 noviembre - 8 diciembre 2007) y los triángulos grises la campaña de 2008 (13 abril - 2 mayo 2008). En 16 ocasiones, se obtuvieron los perfiles verticales de irradiancia fotosintéticamente activa (PAR) a mediodía mediante un radiómetro Satlantic OCP-100FF. Encontramos una relación significativa entre la profundidad del 1% de PAR (Zeu) y la profundidad del máximo profundo de clorofila (ZDCM): Zeu = 9,3 + 0,98 × ZDCM r2 = 0,87, p < 0,001, n = 16 La concentración de clorofila a se midió a bordo en 6-7 profundidades seleccionada a lo largo de la capa eufótica. Se filtraron 250ml por profundidad a través de un filtro de policarbonato (47mm diámetro) de tamaño de poro 0,2µm. La extracción se hizo mediante acetona (90%) y se midió en un fluorómetro Turner Designs 700 previamente calibrado con clorofila a pura (Fluka) 135 6. RESUMEN 6.2.2. Inferencia mediante detección por satélite de polvo atmosférico La concentración media de polvo en la atmófera (g m−2) en los 15 días anteriores al día de muestreo en cada estación se estimó mediante la ecuación de Kaufman et al. (2005) y datos de velocidad del viento, descargados del servidor AVISO-LAS y de aerosoles (Aqua-MODIS Aerosol Optical Depth at 550 nm y Aerosol Small Mode Fraction) obtenidos a través del sistema Giovanni del NASA Goddard Earth Sciences Data and Information Services Center. 6.2.3. Abundancia de Trichodesmium La abundancia superficial (ca. 5m) de Trichodesmium se estimó mediante muestras tomadas del suministro de agua en continuo del barco a intervalos de 55-70km. De 60 a 115 litros de agua de mar fueron filtrados a través de una malla de nylon con una luz de 40µm y un diámetro de 15cm. La integridad de los filamentos y colonias obtenidos mediante este método se comprobó regularmente comparando muestras del continuo con muestras de botellas Niskin. La abundancia media de Trichodesmium en la capa eufótica se determinó en muestras obtenidas por pescas verticales con una manga de 40µm de luz y 30cm de diámetro en los primeros 200m de la columna de agua. Las muestras fueron fijadas con Formol, almacenadas en oscuridad y contabilizadas en tierra siguiendo los protocolos descritos por Utermöhl (1958). 6.2.4. Fijación de nitrógeno (N2) Las tasas de fijación de nitrógeno de la comunidad planctónica en una incubación de 24 horas se determinaron en cada estación a tres profundidades: superficie (5m), profundidad intermedia variable (30-80m) y máximo profundo de clorofila (DCM). Se empleó la técnica de asimilación de 15N2 descrita por Montoya et al. (1996) y modificada por Rees et al. (2009). Las incubaciones se realizaron en cubierta simulando las condiciones de luz, mediante una combinación de filtros neutros y azules, y de temperatura, dentro de un rango de 136 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO 2ºC de la temperatura in situ. La incubación se finalizó mediante filtración del contenido de la botella a través de un filtro GF/F (Whatman) de 25mm de diámetro. Los filtros se secaron a 40ºC durante 24 horas y se peletizaron para análisis. La medida del porcentaje atómico de 15N se realizó mediante un espectómetro de masas FlashEA112 + Deltaplus, ThermoFinnigan usando un estándar de acetanilida como referencia. El límite de detección del espectómetro fue de 0,20µg de N y el de las tasas de 0,001 µmol N m−3 d−1. 6.2.5. Abundancia natural de isótopos de nitrógeno en plancton El δ15N de las partículas en suspensión se determinó en 6 profundidades distribuidas en la capa eufótica. Una muestra de 2 litros obtenida mediante botella Niskin se filtró a través de un filtro GF/F (Whatman) de 25mm de diámetro. Los filtros se procesaron y analizaron siguiendo el procedimiento de descrito para la fijación de N2. Las muestras de zooplancton se recogieron mediante pesca vertical con una manga de 40µm y 30cm de diámetro y se resuspendieron en agua de mar filtrada por 20µm. Esta se separón en dos fracciones mediante tamices de 40 y 200µm. Las submuestras se filtraron a través de filtros GF/F (Whatman) de 45mm de diámetro. El procesado posterior y medida del δ15N se hizo como en la fijación de N2. La media ponderada de Landrum et al. (2011) se empleó para representar el δ15N de las partículas en suspensión en la capa eufótica. La contribución relativa de los fijadores de N2 a las señal de partículas en suspensión y zooplancton se estimó mediante los modelos de mezcla de dos componentes propuestos por Montoya et al. (2002). 137 6. RESUMEN 6.3. RESULTADOS 6.3.1. Hidrografía, nutrientes y polvo atmósferico En los transectos longitudinales los escenarios hidrográficos fueron diferentes. En 2007encontramos una capa superficial más cálida, con temperaturas por encima de 24ºC, y con mayor estratificación vertical (capítulo 2, tabla 2.1). En 2008 la elevación de las isotermas señala la influencia del afloramiento norte africano (Figura 6.2) En los transectos latitudinales, la localización de la isoterma de 16ºC por encima de 200m nos permitió identificar la zona afectada por el afloramiento ecuatorial y, por tanto, dividir los mismos en tres regiones: giro norte (29º15ºN), región ecuatorial (15ºN-10ºS) y giro sur (10º-33ºS). La elevación de las isolíneas de temperatura y salinidad definió el afloramiento ecuatorial aproximadamente en el mismo rango latitudinal (Figura 6.2). En la región ecuatorial la temperatura estuvo siempre por encima de 26ºC, aunque la extensión latitudinal de la zona de mayor temperatura superficial varió entre campañas (Figura 6.2). En los trayectos longitudinales, el flujo difusivo de fosfato, estimado en una capa de 50m centrada en la base de la capa eufótica, fue 5 veces superior en 2008 (capítulo 2, figura 2.3). La distribución latitudinal de la concentración de fosfato presentó un claro patrón decreciente sur-norte de valores en torno a 0,1µM en el giro sur a valores <0,04µM en el giro norte (capítulo 3, figura 3.4). Por lo tanto el cociente nitrato/fosfato aumentó de sur a norte en ambas campañas. La concentración de polvo atmosférico derivada de datos de satélite mostró un incremento hacia el este en ambos transectos longitudinales (capítulo 2, tabla 2.1). En latitud, las mayores concentraciones se estimaron entre 0º y 20ºN (capítulo 3, figura 3.5) en ambas campañas. El aumento de la presencia de polvo en esta región fue superior durante 2008. 138 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO -30 -20 -10 0 10 20 30 0 50 100 150 200 250 300 350 -40 -30 -20 -10 Profundidad (m) Profundidad (m) a) 2007 Temperatura 0 50 100 150 200 250 300 350 Longitud Latitud 0 10 20 30 Profundidad (m) 0 50 100 150 200 250 300 350 -30 -20 -10 0 10 20 30 Profundidad (m) 0 50 100 150 200 250 300 350 0 Latitud 0 50 100 150 200 250 300 350 -40 -30 -20 -10 Longitud Latitud -30 -20 -10 Profundidad (m) Longitud Latitud Profundidad (m) -30 -20 -10 0 50 100 150 200 250 300 350 -40 -30 -20 -10 10 20 30 0 50 100 150 200 250 300 350 -40 -30 -20 -10 Profundidad (m) Profundidad (m) b) 2008 Temperatura 0 50 100 150 200 250 300 350 Longitud Figure 6.2. Distribución vertical zonal y meridional de la temperatura (ºC) y la salinidad en la campaña de 2007 (a, c) y la de 2008 (b, d). Las líneas punteadas delimitan las tres regiones principales identificadas por la profundidad de la isoterma de 16ºC: giro norte, región ecuatorial y giro sur. 139 6. RESUMEN 6.3.2. Abundancia de Trichodesmium y fijación de nitrógeno En los transectos longitudinales sólo se encontraron tricomas libres en las muestras, tanto de superficie como de la capa eufótica. La abundancia fue baja, <10 tricomas l−1, en todas las estaciones excepto en las más occidentales de 2007 (Figura 6.3). El promedio de abundancia superficial de Trichodesmium fue de 6,6±13,5 y 0,8±1,0 tricomas l−1 en 2007 y en 2008, respectivamente. En los transectos latitudinales, Trichodesmium fue particularmente abundante en la región ecuatorial, mientras que en el giro sur fue infrecuente (Figura 6.3). La región de mayores abundancias tanto en superficie como en la capa eufótica se extendió de 0º a 15ºN en 2007 y de 15ºN a 10ºS en 2008. Aunque con cierta variabilidad entre campañas, las diferencias regionales en la abundancia de Trichodesmium son consistentes. En promedio, la abundancia superficial de Trichodesmium fue de 8-31 tricomas l−1 en el giro norte, 220 tricomas l−1 en la región ecuatorial y 0,5-1 tricomas l−1 en el giro sur. Las tasas de fijación de nitrógeno medidas, tanto en los transectos longitudinales como en los latitudinales, fueron medibles en todas las estaciones aunque no en todas las profundidades. La actividad medida superficial en el transecto longitudinal de 2008 fue 10 veces superior a la de 2007 (Figura 6.3), aunque modesta (<0,3 µmol N m−3 d−1). La fijación integrada en la capa eufótica presentó un claro patrón de incremento hacia el este en el transecto longitudinal de 2008 (Figura 6.3), con una mayor contribución de las comunidades más profundas (capítulo 2, figura 2.5). Además, en promedio esta fijación integrada fue 7 veces superior en 2008 que en 2007 (1,2±0,5 µmol N m−2 d−1 frente a 8,3±3,3 µmol N m−2 d−1). La distribución latitudinal de la fijación de nitrógeno en superficie fue similar a la de Trichodesmium (Figura 6.3) y ambas variables correlacionan significativamente (coeficiente de correlación de Pearson, r = 0,74, p < 0,01). La tasa media de fijación de nitrógeno en la región ecuatorial, donde se encontraron las tasas más altas, fue 3 veces superior en 2007 que en 2008 (2,94 frente a 0,80 µmol N m−3 d−1). 140 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO La distribución vertical de la fijación de nitrógeno, en el giro norte y la región ecuatorial, se caracterizó por una tendencia clara a disminuir con la profundidad, siendo mayor en los primeros 50m de la columna de agua (capítulo 3, figura 3.8). Sin embargo, en el giro sur, se distribuyó de manera más uniforme en la capa eufótica (capítulo 3, figura 3.8). La fijación integrada verticalmente correlacionó significativamente con la fijación en superficie y la abundancia de Trichodesmium (r = 0,91, p < 0,01; r = 0,77, p < 0,01; respectivamente). Asimismo, las mayores fijaciones integradas se midieron en la región ecuatorial (Figura 6.3). En 2008, medimos tasas sustanciales en el giro sur. La abundancia de Trichodesmium podría justificar la fijación de nitrógeno medida en el transecto longitudinal de 2007 y en el giro norte y región ecuatorial en ambas campañas. Sin embargo, no es suficiente para explicar las tasas encontradas en el transecto longitudinal de 2008 y en el giro sur (capítulo 3, figura 3.10). 6.3.3. Isótopos de nitrógeno en la capa eufótica La señal de las partículas en suspensión se puede usar como un indicador de la actividad de fitoplancton sólo (capítulo 4, figura 4.3). En general, los patrones descritos por fitoplancton y las dos fracciones de zooplancton, tanto longitudinal como latitudinalmente, son similares (Figura 6.3) y las tres fracciones correlacionan significativamente (capítulo 4, tabla 4.2), lo que podría indicar una relativa eficiencia en la transferencia del nitrógeno fitoplanctónico a niveles superiores. 141 6. RESUMEN Fijación de nitrógeno Trichodesmium 300 15 200 10 100 5 0 Fijación N2 & Trichodesmium 20 Trichodesmium (tricomas l-1) Fijación de N2 (µmol N m-2 d-1) a) 2007 Trichodesmium y fijación de nitrógeno en la capa eufótica 0 -40 -30 -20 -10 0 10 20 30 -40 Latitud -30 -20 -10 Longitud 15 c) 2007 δ N en fito y zooplancton 12 12 >200µm 40-200µm fitoplancton δ 10 6 4 4 2 2 0 0 -2 -2 -4 N (o/oo) 8 6 15 15 N (o/oo) 8 δ 10 -4 -40 -30 -20 -10 0 10 20 30 -40 Latitud -30 -20 -10 Longitud 250 15 200 10 150 100 5 50 0 Fijación N2 & Trichodesmium 20 300 Trichodesmium (tricomas l-1) Fijación de N2 (µmol N m-2 d-1) b) 2008 Trichodesmium y fijación de nitrógeno en la capa eufótica 0 -40 -30 -20 -10 0 10 20 30 -40 Latitud -30 -20 -10 Longitud 10 8 8 6 6 4 4 2 2 0 0 -2 -2 -40 -30 -20 -10 0 Latitud 10 20 30 -40 -30 -20 N (o/oo) 12 10 15 12 δ δ 15 N (o/oo) c) 2008 δ15N en fito y zooplancton -10 Longitud Figure 6.3. Distribución zonal y meridional de la fijación de nitrógeno integrada y la abundancia de Trichodesmium en la capa eufótica, y de la media ponderada del δ15N del fitoplancton, el δ15N de la fracción de 40200µm de zooplancton y el δ15N de la fracción de >200µm de zooplancton en las campañas de 2007 (a, c) y 2008 (b, d). Las líneas de puntos definen last res regions identificadas por la profundidad de la isoterma de 16ºC: giro norte, región ecuatorial y giro sur. 142 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO En el transecto latitudinal de 2007, en general, la señal isotópica del fitoplancton aumentó hacia el sur (Figura 6.4). La fracción de 40-200µm de zooplancton siguió este patrón pero no la de >200µm, que mostró valores mayores en la región ecuatorial. En 2008, las distribuciones siguieron un patrón de domo, con valores más altos en la región ecuatorial y valores más bajos en los giros (Figura 6.4). No encontramos correlación entre la distribución de Trichodesmium y los datos de δ15N de fitoplancton o zooplancton (capítulo 4, tabla 4.4). 6.4. DISCUSIÓN 6.4.1. Distribución y abundancia de Trichodesmium La distribución longitudinal de Trichodesmium en el Atlántico norte parece controlada principalmente por la temperatura y el grado de estabilidad vertical de la columna de agua. La temperatura es un limitador importante de la distribución de este grupo (Karl et al., 2002). Estudios con cultivos muestran que el óptimo para crecimiento y fijación de nitrógeno está entre 24ºC y 30ºC (Breitbarth et al., 2007). Además, se ha sugerido que a temperaturas por debajo de 20ºC, los diazótrofos no heterocísticos no podrían mantener las condiciones locales de anoxia necesarias para el funcionamiento de la nitrogenasa (Stal, 2009). Por lo tanto, la casi ausencia de Trichodesmium en el transecto longitudinal de 2008 se podría explicar por las bajas temperaturas de agua (<20ºC). Otros factores que favorecen la presencia de Trichodesmium son capas de mezcla someras y alta estabilidad vertical (LaRoche y Breitbarth, 2005). Condiciones que se dieron en 2007, favoreciendo el ligero incremento en abundancia hacia el oeste, donde se encontró la temperatura más alta y el mayor grado de estabilidad en el transecto longitudinal (capítulo 2, tabla 2.1, figura 2.2). La distribución latitudinal de Trichodesmium estaría controlada, además de la estabilidad vertical y la temperatura, por el suministro de hierro. El rango latitudinal de distribución de Trichodesmium se extendió más hacia el sur durante 2008 (abril-mayo) que durante 2007 (noviembre-diciembre). Aunque 143 6. RESUMEN nuestros datos son insuficientes para definir patrones estacionales, estas diferencias son consistentes con un efecto de la deposición atmosférica de hierro, ya que la deposición de aerosoles en el margen este del Atlántico norte es más intensa y se extiende a una mayor área geográfica en primavera que en invierno (Gao et al., 2001; Kaufman et al., 2005). Así, la mayor estabilidad hacia el sur, junto con un suministro más elevado de hierro habría favorecido la extensión hacia el sur del rango de distribución de Trichodesmium en 2008. 6.4.2. Fijación de nitrógeno Los datos de los transectos longitudinales indican que la fijación de nitrógeno es medible en el margen este del Atlántico norte, incluso cuando Trichodesmium aparece en baja abundancia. Además, la comparación de las tasas medidas con las abundancias de este organismo señala que otros diazótrofos pueden ser relevantes en este área, especialmente cuando la temperatura es más baja (<20ºC). Por otro lado, la diferencia en los flujos difusivos de fosfato entre campañas sugiere un papel de control del fósforo en la regulación de la distribución local de la fijación de nitrógeno (Sañudo-Wilhelmy et al., 2001) en una región sujeta a un suministro semi-continuo de hierro a través de deposición atmosférica (Moore et al., 2009). La fijación de nitrógeno en el Atlántico central es mayor en el rango latitudinal comprendido entre 5ºS y 15ºN, donde Trichodesmium es también más abundante y podría ser responsable de la mayor parte de este flujo. Nuestro datos respaldan los resultados de Moore et al. (2009) que encontraron altas tasas de fijación en el mismo rango latitudinal, en la región donde se midieron las concentraciones más altas de hierro, por lo que concluyeron que el suministro de hierro y no el de fósforo explicaría las diferencias norte-sur en diazotrofía en el océano Atlántico. Como ocurría con Trichodesmium, hemos encontrado una clara asociación entre la región de tasas más altas de fijación de nitrógeno y la de mayor concentración de polvo en la atmósfera. Ambas variables correlacionaron significativamente (r = 0,35, p < 0,05). Por lo tanto, estos resultados sugieren que el suministro de hierro a través de la deposición 144 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO atmosférica es un controlador relevante de la fijación de nitrógeno en el océano Atlántico, al igual que ocurre en el Pacífico norte (Shiozaki et al., 2009). En el giro sur, las extremadamente bajas abundancias de Trichodesmium (<1 tricoma l−1) no serían suficientes para explicar la fijación de nitrógeno medida. Esto sugiere que otros diazótrofos son los principales responsables de la diazotrofía detectada en esta región. Moore et al. (2009) también llegaron a esta conclusión tras medir tasas constantes en la fracción de <20µm a lo largo del Atlántico. Estos resultados sugieren que la distribución geográfica de los diazótrofos unicelulares a escala de cuenca es más uniforme que la de Trichodesmium, por lo que podría contribuir con tasas modestas pero persistentes a lo largo del año. 6.4.3. Isótopos de nitrógeno En el giro norte del océano Atlántico, la señal de δ15N de las partículas en suspensión presentan valores bajos de manera persistente a lo largo del año, tanto en los transectos longitudinales como en los latitudinales, que se ha relacionado tradicionalmente con un suministro importante de nitrógeno a través de la fijación de nitrógeno. (Mahaffey et al., 2003; Reynolds et al., 2007; Landrum et al., 2011). Sin embargo, las medidas experimentales de diazotrofía muestran tasas relativamente modestas en comparación con las encontradas en otras regiones del Atlántico. Por lo que no parecen apoyar ese argumento derivado del análisis de isótopos. Por otro lado, la deposición atmosférica de nitrato ligero ha aumentado en los últimos años en regiones altas y medias (Hastings et al., 2009; Morin et al., 2009; Mara et al., 2009; Holtgrieve et al., 2011) y podría completar el suministro de nitrógeno pobre en 15N necesario para explicar esa baja señal. Sin embargo, los estudios que evalúan el efecto de la deposición de nitrógeno y la fijación de nitrógeno en la señal isotópica del plancton son escasos (Baker et al., 2007; Knapp et al., 2011). Futuros estudios que definan adecuadamente la intensidad, frecuencia y composición isotópica del flujo deposicional son todavía necesarios en esta región. 145 6. RESUMEN En la región ecuatorial (15ºN-10ºS) se ha medido una intense fijación de nitrógeno en diversas épocas (Moore et al., 2009; Grosskopf et al., 2012; capítulo 3). Este flujo podría explicar de un 40 a un 60% del δ15N del fitoplancton en esta región. El nitrógeno suministrado por los diazótrofos se transferiría de manera ineficiente a niveles tróficos superiores (capítulo 4, figura 4.) En el giro sur (15º-30ºS), la baja señal de δ15N en fitoplancton sugiere que los diazótrofos podrían contribuir con la mitad del suministro de nitrógeno en esta región a la comunidad fitoplanctónica. Aunque las tasas absolutas medidas son bajas (Moore et al., 2009; Grosskopf et al., 2012; capítulo 3), el impacto de los fijadores de nitrógeno en el balance isotópico de esta región podría ser importante. Por lo tanto, una reevaluación de la importancia de la diazotrofía en el Atlántico sur es necesaria a través de nuevos estudios que definan la variabilidad anual de la fijación de nitrógeno y los diazótrofos. 146 Referencias TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Bada JL, Schoeninger MJ, Schimmelmann A (1989) Isotopic fractionation during peptide bond hydrolysis. Geochim. Cosmochim. Acta 53: 3337– 3341 Baker AR, Weston K, Kelly SD, Voss M, Streu P, Cape JN (2007) Dry and wet deposition of nutrients from the tropical Atlantic atmosphere: Links to primary productivity and nitrogen fixation. Deep-Sea Research I 54: 1704–1720 Bauersachs T, Schouten S, Compaoré J, Wollenzien U, Stal LJ, Sinninghe Damsté JS (2009) Nitrogen isotopic fractionation associated with growth on dinitrogen gas and nitrate by cyanobacteria. Limnol. Oceanogr. 54(4): 1403–1411 Benavides M, Agawin NSR, Arístegui J, Ferriol P, Stal LJ (2011) Nitrogen fixation by Trichodesmium and small diazotrophs in the subtropical northeast Atlantic. Aquatic Microbial Ecology 65: 43–53 Benavides M, Arístegui J, Agawin NSR, López Cancio J, Hernández-León S (2013) Enhancement of nitrógeno fixation rates by unicellular diazotrophs vs. Trichodesmium after a dust event in the Canary Islands. Limnol. Oceanogr. 58(1): 267−275. Bergman B, Gallon JR, Rai AN, Stal LJ (1997) N2 fixation by nonheterocystous cyanobacteria. FEMS Microbiol. Rev. 19: 139–185 Berman-Frank I, Cullen JT, Shaked Y, Sherrell RM, Falkowski PG (2001a) Iron availability, cellular iron quotas, and nitrogen fixation in Trichodesmium. Limnol. Oceanogr., 46(6): 1249–126 Berman-Frank I, Quigg A, Finkel ZV, Irwin AJ, Haramaty L (2007) Nitrogenfixation strategies and Fe requirements in cyanobacteria. Limnol. Oceanogr., 52(5): 2260–2269 Berman-Frank I, Bidle KD, Haramaty L, Falkowski PG (2004) The demise of the marine cyanobacterium Trichodesmium spp. via an autocatalyzed cell death pathway. Limnol. Oceanogr. 49: 997–1005 149 REFERENCIAS Berman-Frank I, Lundgren P, Chen YB, Kupper H, Kolber Z, Bergman B, Falkowski PG (2001b) Segregation of nitrogen fixation and oxygenic photosynthesis in the marine cyanobacterium Trichodesmium. Science 294: 1534–1537 Berman-Frank I, Quigg A, Finkel ZV, Irwin AJ, Haramaty, L (2007) Nitrogenfixation strategies and Fe requirements in cyanobacteria, Limnol. Oceanogr. 52: 2260–2269 Bishop PE, Jarlenski DML, Hetherington DR (1980) Evidence for an alternative nitrogen fixation system in Azotobacter vinelandii. Proc. Natl. Acad. Sci. USA 77: 7342–7346 Breitbarth E, Oschlies A, LaRoche J (2007) Physiological constraints of the global distribution of Trichodesmium - effect of temperature on diazotrophy. Biogeosciences 4: 53-61 Capone DG, Zehr JP, Paerl HW, Bergman B, Carpenter EJ (1997) Trichodesmium a globally significant marine cyanobacterium. Science 276: 1221–1229 Capone, DG (2001) Marine nitrogen fixation: what’s the fuss? Current Opinion in Microbiology 4: 341–348. Capone DG, Burns JA, Montoya JP, Subramaniam A, Mahaffey C, Gunderson T, Michaels AF, Carpenter EJ (2005) Nitrogen fixation by Trichodesmium spp.: An important source of new nitrogen to the tropical and subtropical North Atlantic ocean. Global Biogeochem. Cycles 19: GB2024, doi:10.1029/2004gb002331 Capone DG, Subramanian A, Montoya JP, Voss M, Humborg C, Johansen AM, Siefert RL, Carpenter EJ (1998) An extensive bloom of the N2 fixing cyanobacterium Trichodesmium erythraeum in the central Arabian Sea. Mar. Ecol.-Prog. Ser. 172: 281–292 Capone DG, Zehr JP, Paerl HW, Bergman B, Carpenter EJ (1997) Trichodesmium, a globally significant marine cyanobacterium. Science 276: 1221– 1229 150 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Carpenter EJ, Capone DG (2008) Nitrogen Fixation in the Marine Environment. In “Nitrogen in the Marine Environment” Elsevier Inc.: pp 141−198 Carpenter EJ. Capone DG (1992) Nitrogen fixation in Trichodesmium blooms. In: Carpenter EJ, Capone DG, Rueter JG (eds) Marine pelagic cyanobactena. NATO ASI Senes, Vol 362. Kluwer Academic Publishers, Dordrecht: pp 211−215 Carpenter EJ (1983) Nitrogen fixation by marine Oscillatoria (Trichodesmium) in the world’s oceans. In ‘‘Nitrogen in the marine environment.’’ (Carpenter EJ, Capone DG, eds.). Academic Press, New York, pp. 65– 103 Carpenter EJ, Subramanian A, Capone DG (2004) Biomass and primary productivity of the cyanobacterium Trichodesmium spp. in the southwestern tropical N Atlantic Ocean. Deep Sea Res. I. 51: 173–203 Checkley DM, Miller CA (1989) Nitrogen isotope fractionation by oceanic zooplankton. Deep-Sea Research, 36 (10): 1449−1456 Chen Y, Tovar-Sánchez A, Siefert RL, Sañudo-Wilhelmy RA, Zhuang G (2011) Luxury uptake of aerosol iron by Trichodesmium in the western tropical North Atlantic, Geophys. Res. Lett., 38: L18602, doi:10.1029/2011GL048972 Cole JJ, Lane JM, Marino R, Howarth RW (1993) Molybdenum assimilation by cyanobacteria and phytoplankton in freshwater and salt water. Limnol. Oceanogr. 38: 25–35 Coplen TB, Krouse HR, Bohlke JK, (1992) Reporting of nitrogen isotope abundances. Pure and Applied Chemistry 64: 907-908 Davis CS, McGillicuddy DJ (2006) Transatlantic abundance of the N2 fixing colonial cyanobacterium Trichodesmium. Science 312: 517–520 Dixon R, Kahn D (2004) Genetic regulation of biological nitrogen fixation. Nature Reviews Microbiology 2: 621-631. doi:10.1038/nrmicro954. http://www.nature.com/nrmicro/journal/v2/n8/fig_tab/nrmicro954_F1.ht ml 151 REFERENCIAS Duce RA, Tindale NW (1991) Atmospheric transport of iron and its deposition in the ocean. Limnol. Oceanogr. 36(8): 1715-1726 Duce RA, LaRoche J, Altieri K, Arrigo KR, Baker AR, Capone DG, Cornell S, Dentener F, Galloway J, Ganeshram RS, Geider RJ, Jickells T, Kuypers MM, Langlois R, Liss PS, Liu SM, Middelburg JJ, Moore CM, Nickovic S, Oschlies A, Pedersen T, Prospero J, Schlitzer R, Seitzinger S, Sorensen LL, Uematsu M, Ulloa O, Voss M, Ward B, Zamora L (2008) Impacts of atmospheric anthropogenic nitrogen on the open ocean. Science 320: 893–897, doi:10.1126/science.1150369 Dyhrman ST, Chappell PD, Haley ST, Moffett JW, Orchard ED, Waterbury JB, Webb EA (2006) Phosphonate utilization by the globally important marine diazotroph Trichodesmium. Nature. 439: 68–71 El-Shehawy R, Lugomela C, Ernst A, Bergman B (2003) Diurnal expression of hetR and diazocyte development in the filamentous non-heterocystous cyanobacterium Trichodesmium erythraeum. Microbiology-SGM 149: 1139–1146 Falkowski PG (1997) Evolution of the nitrogen cycle and its influence on biological sequestration of CO2 in the oceans. Nature 387: 272–273 Fallik E, Chan Y-K, Robson RL (1991) Detection of alternative nitrogenases in aerobic gram-negative nitrogen-fixing bacteria. J Bact. 173: 365–371 Fang YT, Koba K, Wang XM, Wen DZ, Li J, Takebayashi Y, Liu XY, Yoh M (2011) Anthropogenic imprints on nitrogen and oxygen isotopic composition of precipitation nitrate in a nitrogen-polluted city in southern China Atmos. Chem. Phys. 11: 1313–1325 Foster RA, Subramaniam A, Zehr JP (2008) Distribution and activity of diazotrophs in the Eastern Equatorial Atlantic. Environmental Microbiology doi:10.1111/j.1462-2920.2008.01796.x Fredriksson C, Bergman B (1997) Ultrastructural characterization of cells specialized for nitrogen fixation in a non-heterocystous cyanobcterium, Trichodesmium. Protoplasma 197: 76–85 152 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Fu FX, Zhang Y, Bell PRF, Hutchins DA (2005) Phosphate uptake and growth kinetics of Trichodesmium (Cyanobacteria) isolates from the North Atlantic Ocean and the Great Barrier Reef, Australia. J. Phycol. 41: 62– 73 Galloway JN, Dentener FJ, Capone DG, Boyer EW, Howarth RW, Seitzinger SP, Asner GP et al. (2004) Nitrogen cycles: past, present, and future. Biogeochemistry 70: 153-226 Gannes LZ, O’Brien DM, Martínez del Río C (1997) Stable isotopes in animal ecology: Assumptions, caveats, and a call for more laboratory experiments. Ecology 78(4): 1271–1276 Gao Y, Kaufman YJ, Tanré D, Kolber D, Falkowski, PG (2001) Seasonal distributions of Aeolian Iron fluxes to the global ocean. Geophysical Res. Letters 28(1): 29−32 Glibert PM, Bronk DA (1994) Release of dissolved organic nitrogen by marine diazotrophic cyanobacteria Trichodesmium spp. Appl. Environ. Microb. 60: 3996–4000 Goebel NL, Turk KA, Achilles KM, Paerl R, Hewson I, Morrison AE, Montoya JP, Edwards CA, Zehr JP (2010) Abundance and distribution of major groups of diazotrophic cyanobacteria and their potential contribution to N2 fixation in the tropical Atlantic Ocean. Environmental Microbiology 12(12): 3272−3289 González-Taboada F, González-Gil R, Höfer J, González S, Anadón R (2010) Trichodesmium spp. population structure in the eastern North Atlantic subtropical gyre. Deep-Sea Research I 57: 65−77 Grasshoff K (1976) Methods of seawater analysis. Verlag Chemie, Winheim and New York. Grosskopf T. Mohr W, Baustian T, Schunck H, Gill D, Kuypers MMM, Lavik G, Schmitz RA, Wallace DWR, LaRoche J (2012) Doubling of marine dinitrogen-fixation rates on direct measurements. Nature 488: 361−364 153 REFERENCIAS Gruber N (2008) The Marine Nitrogen Cycle: Overview and Challenges. In Nitrogen in the Marine Environment. Elsevier Inc. doi: 10.1016/B978-012-372522-6.00001-3 Gruber N, Sarmiento JL (1997) Global patterns of marine nitrogen fixation and denitrification. Global Biogeochem. Cy. 11: 235–266 Hansell DA, Bates NR, Olson DB (2004) Excess nitrate and nitrogen fixation in the North Atlantic Ocean. Marine Chemistry 84: 243– 265 Hastings MG, Jarvis JC, Steig EJ (2009) Anthropogenic impacts on nitrogen isotopes of ice-core nitrate. Science 324: 1288 Hawser SP, O’Neil JM, Roman MR, Codd GA (1992) Toxicity of blooms of the cyanobacterium Trichodesmium to zooplankton. Journal of Applied Phycology 4: 79−86 Haxo FT, Lewin RA, Lee KW, Li M-R (1987) Fine structure and pigments of Oscillatoria (Trichodesmium) aff. thiebautii (Cyanophyta) in culture. Phycologia 26: 443–456 Heaton THE (1990) 15N/14N ratios of NOx from vehicle engines and coal-fired power stations. Tellus B 42: 304–307 Hewson I, Govil SR, Capone DG, Carpenter EJ, Fuhrman JA (2004) Evidence of Trichodesmium viral lysis and potential significance for biogeochemical cycling in the oligotrophic ocean. Aquat. Microb. Ecol. 36: 1–8 Holl C, Montoya J (2005) Interactions between nitrate uptake and nitrogen fixation in continuous cultures of the marine diazotroph Trichodesmium. J. Phycol. 41: 1178–1183 Holtgrieve GW, Schindler DE, et al. (2011) A Coherent Signature of Anthropogenic Nitrogen Deposition to Remote Watersheds of the Northern Hemisphere. Science 334: 1545−1548 154 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Hood RR, Coles VJ, Capone DG (2004) Modeling the distribution of Trichodesmium and nitrogen fixation in the Atlantic Ocean. Journal of Geophysical Research 109, doi: 10.1029/2002JC001753 Howarth RW, Butler T, Lunde K, Swaney D, Chu CR (1993) Turbulence and Planktonic Nitrogen-Fixation - a Mesocosm Experiment. Limnol. Oceanogr. 38: 1691–1711 Huete-Ortega M, Calvo-Díaz A, Mouriño-Carballido B, Graña R, Marañón E (2011) Effect of environmental forcing on the biomass, production and growth rate of size-fractionated phytoplankton in the central Atlantic Ocean. Journal of Marine Systems 88: 203−130 Karl DM, Letelier R, Hebel DV, Bird DF, Winn CD (1992) Trichodesmium blooms and new nitrogen in the north Pacific gyre. In: Carpenter EJ, Capone DG, Rueter JG (Eds) Marine Pelagic Cyanobacteria: Trichodesmium and other Diazotrophs. Kluwer Academic Publishers, The Netherlands. pp 219–237 Karl DM, Michaels A, Bergman B, Capone DG, Carpenter E, Letelier R, Lipschultz F, Paerl H, Sigman D, Stal L (2002) Dinitrogen fixation in the world’s oceans. Biogeochemistry 57: 47–98 Kaufman YJ, Koren I, Remer LA, Tanré D, Ginoux P, Fan S (2005) Dust transport and deposition observed from the Terra-Moderate Resolution Imaging Spectroradiometer (MODIS) spacecraft over the Atlantic Ocean. Journal of Geophysical Research 110, D10S12, doi:10.1029/2003JD004436 Kerouel R, Aminot A (1997) Fluorometric determination of ammonia in sea and estuarine waters by direct segmented flow analysis. Marine Chemistry 57(3-4): 265–275 Kiga T, Yoshikawa K, Tsunogai U, Okitsu S, Narukawa K (2000) Evaluation of NOx formation in pulverized coal firing by use of nitrogen isotope ratios, paper presented at International Joint Power Generation Conference, Am. Soc. of Mech. Eng., Miami Beach, Fl, USA, 23–26 July 155 REFERENCIAS Kitajima S, Furuya K, Hashihama F, Takeda S (2009) Latitudinal distribution of diazotrophs and their nitrogen fixation in the tropical and subtropical western North Pacific. Limnol. Oceanogr. 54(2): 537–547 Knapp AN, Sigman DM, Lipschultz F (2005) N isotopic composition of dissolved organic nitrogen and nitrate at the Bermuda Atlantic Timeseries Study site, Global Biogeochem. Cy., 19, GB1018, doi:10.1029/2004GB002320 Knapp AN, Hastings MG, Sigman DM, Lipschultz F, Galloway JN (2010) The flux and isotopic composition of reduced and total nitrogen in Bermuda rain. Marine Chemistry 120: 83–89 Knapp AN, Sigman DM, Lipschultz F, Kustka AB, Capone DG (2011) Interbasin isotopic correspondence between upper ocean bulk DON and subsurface nitrate and its implications for marine nitrogen cycling. Global Biogeochem. Cycles 25, GB4004, doi:10.1029/2010GB003878 Kustka A, Sañudo-Wilhelmy S, Carpenter EJ, Capone DG, Burns J, Sunda WG (2003a) Iron requirements for dinitrogen- and ammonium-supported growth in cultures of Trichodesmium (IMS 101): Comparison with nitrogen fixation rates and iron: carbon ratios of field populations. Limnol. Oceanogr. 48(5): 1869–1884 Kustka A, Sañudo-Wilhelmy S, Carpenter EJ, Capone DG, Raven JA (2003b) A revised estimate of the Fe use efficiency of nitrogen fixation, with special reference to the marine N2 fixing cyanobacterium Trichodesmium spp. (Cyanophyta). J. Phycol. 39: 12–25 Landrum JP, Altabet MA, Montoya JP (2011) Basin-scale distributions of stable nitrogen isotopes in the subtropical North Atlantic Ocean: Contribution of diazotroph nitrogen to particulate organic matter and mesozooplankton. Deep-Sea ResearchI 58: 615–625 Langlois RJ, Hümmer D, LaRoche J (2008) Abundances and Distributions of the Dominant nifH Phylotypes in the Northern Atlantic Ocean. Applied and environmental microbiology 74 (6): 1922–1931 156 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Langlois RJ, LaRoche J, Raab PA (2005) Diazotrophic diversity and distribution in the tropical and subtropical Atlantic Ocean. Applied and Environmental Microbiology 71(12): 7910–7919 Langlois RJ, Mills MM, Ridame C, Croot P, LaRoche J (2012) Diazotrophic bacteria respond to Saharan dust additions. Marine Ecology Progress Series 470: 1-14. LaRoche J, Breitbarth E (2005) Importance of the diazotrophs as a source of new nitrogen in the ocean. Journal of Sea Research 53: 67–91 Lin S, Heneze S, Lundgren P, Bergman B, Carpenter EJ (1998) Whole-cell immunolocalization of nitrogenase in marine diazotrophic cyanobacteria Trichodesmium spp. Appl. Environ. Microbiol. 64: 3052–3058 Liu KK, Kaplan IR (1989) The eastern tropical Pacific as a source of 15Nenriched nitrate in seawater off southern California. Limnol. Oceanogr. 34: 820–830 Longhurst A (1998) Ecological geography of the sea. Academic Press. San Diego Luo Y-W, Doney SC, Anderson LA, Benavides M, Berman-Frank I, Bode A, Bonnet S, Boström KH, Böttjer D, Capone DG, Carpenter EJ, Chen YL, Church MJ, Dore JE, Falcón LI, Fernández A, Foster RA, Furuya K, Gómez F, Gundersen K, Hynes AM, Karl DM, Kitajima S, Langlois RJ, LaRoche J, Letelier RM, Marañón E, McGillicuddy DJ, Moisander PH, Moore CM, Mouriño-Carballido B, Mulholland MR, Needoba JA, Orcutt KM, Poulton AJ, Rahav E, Raimbault P, Rees AP, Riemann L, Shiozaki T, Subramaniam A, Tyrrell T, Turk-Kubo KA, Varela M, Villareal TA, Webb EA, White AE, Wu J, Zehr JP (2012) Database of diazotrophs in global ocean: abundances, biomass and nitrogen fixation rates. Earth Syst. Sci. Data: 47-73. doi:10.5194/essd-4-47-2012 157 REFERENCIAS Mahaffey C, Michaels AF, Capone DG (2005) The conundrum of marine N2 fixation. American Journal of Science 305: 546–595 Mahaffey C, Williams RG, Wolff GA, Mahowald N, Anderson W, Woodward M (2003) Biogeochemical signatures of nitrogen fixation in the eastern North Atlantic, Geophys. Res. Lett., 30(6): 1300, doi:10.1029/2002GL016542. Mahaffey C, Williams RG, Wolff GA, Anderson WT (2004) Physical supply of nitrogen to phytoplankton in the Atlantic Ocean. Global Biogeochem. Cycles 18, GB1034, doi:10.1029/2003GB002129 Mahowald NM, Baker AR, Bergametti G, Brooks N, Duce RA, Jickells TD, Kubilay N, Prospero JM, Tegen,I (2005) Atmospheric global dust cycle and iron inputs to the ocean, Global Biogeochem. Cy. 19, GB4025, doi:10.1029/2004gb002402 Mahowald NM, Engelstaedter S, Luo C, Sealy A, Artaxo P, Benítez-Nelson C, Bonnet S, Chen Y, Chuang PY, Cohen DD, Dulac F, Herut B, Johansen AM, Kubilay N, Losno R, Maenhaut E, Paytan A, Prospero JM, Shank LM, Siefert RL (2009) Atmospheric Iron Deposition: Global Distribution, Variability, and Human Perturbations. Annu. Rev. Mar. Sci. 1: 245–278 Mara P, Mihalopoulos N, Gogou A, Daehnke K, Schlarbaum T, Emeis K-C, Krom M (2009) Isotopic composition of nitrate in wet and dry atmospheric deposition on Crete in the eastern Mediterranean Sea. Global Biogeochemical Cycles 23, GB4002, doi:10.1029/2008GB003395 Marañón E, Fernández A, Mouriño-Carballido B, Martínez-García S, Teira E, Cermeño P, Chouciño P, Huete-Ortega M, Fernández E, Calvo-Díaz A, Morán XAG, Bode A, Moreno-Ostos E, Varela MM, Patey MD, Achterberg EP (2010) Degree of oligotrophy controls the response of microbial plankton to Saharan dust. Limnol. Oceanogr. 55: 2339–2352 Mather RL, Reynolds SE, Wolff GA, Williams RG, Torres-Valdés S, Woodward EMS, Landolfi A, Pan X, Sanders R, Achterberg EP (2008) 158 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Phosphorous cycling in the North and South Altantic Ocean subtropical gyres. Nature Geosciences 1: 439–443 McCarthy JJ, Carpenter EJ (1979) Oscillatoria (Trichodesmium) thiebautii (Cyanophyta) in the central North-Atlantic Ocean. Journal of Phycology 15(1): 75–82 Michaels AF, Olson D, Sarmiento JL, Ammerman JW, Fanning K, Jahnke R, Knap AH, Lipschultz F, Prospero JM (1996) Inputs, losses and transformations of nitrogen and phosphorus in the pelagic North Atlantic Ocean. Biogeochemistry 35: 181–226 Michaels A, Karl DM, Capone DG (2001) Element stoichiometry, new production and nitrogen fixation. Oceanography 14: 68–77 Mills MM, Ridame C, Davey M, LaRoche J, Geider RJ (2004) Iron and phosphorus co-limit nitrogen fixation in the eastern tropical North Atlantic. Nature 429: 292–294 Minagawa M, Wada E (1984) Stepwise enrichment of 15N along food chains: Further evidence and the relation between 15N and animal age. Geochimica et Cosmochimica Acta 48: 1135–1140 Mino Y, Saino T, Suzuki K, Marañón E (2002) Isotopic composition of suspended particulate nitrogen (δ15Nsus) in surface waters of the Atlantic Ocean from 50ºN to 50ºS. Global Biogeochem. Cycles 16(4): 1059, doi:10.1029/2001GB001635 Miyake Y, Wada E (1967) The abundance ratio of environments. Rec. Oceanogr. Works Jpn. 9: 37–53 15 N/14N in marine Mohr W, Grosskopf T, Wallace DWR, LaRoche J (2010) Methodological Underestimation of Oceanic Nitrogen Fixation Rates. PLoS ONE 5(9): e12583. doi:10.1371/journal.pone.0012583 Moisander PH, Beinart RA, Hewson I, White AE, Johnson KS, Carlson CA, Montoya JP, Zehr JP (2010) Unicellular cyanobacterial distributions broaden the oceanic N2 fixation domain. Science 327: 1512–1514 159 REFERENCIAS Mompeán C, Bode A, Benítez-Barrios V, Domínguez-Yanes JF, Escánez J, Fraile-Nuez E Spatial patterns of plankton biomass and stable isotopes reflect the influence of the nitrogen-fixer Trichodesmium along the subtropical North Atlantic. Journal of Plankton Research. In press Monteiro FM, Follows MJ, Dutkiewicz S (2010) Distribution of diverse nitrogen fixers in the global ocean. Global Biogeochemical Cycles 24, doi:10.1029/2009GB003731 Montoya JP (2008) Nitrogen Stable Isotopes in Marine Environments. In Nitrogen in the Marine Environment. Elsevier Inc. DOI: 10.1016/B978-012-372522-6.00001-3 Montoya JP, Voss M, Kaehler P, Capone DG (1996) A simple, high precision tracer assay for dinitrogen fixation. Appl. Environ. Microbiol. 62: 986– 993 Montoya JP, Holl CM, Zehr JP, Hansen A, Villareal TA, Capone DG (2004) High rates of N2 fixation by unicellular diazotrophs in the oligotrophic Pacific. Nature 430: 1027–1031 Montoya JP, Voss M, Capone DG (2007) Spatial variation in N2-fixation rate and diazotroph activity in the Tropical Atlantic. Biogeosciences 4: 369– 376, doi:10.5194/bg-4-369-2007 Montoya JP, Carpenter EJ, Capone DG (2002) Nitrogen fixation and nitrogen isotope abundances in zooplankton of the oligotrophic north atlantic. Limnol. Oceanogr. 47(6): 1617–1628 Moore CM, Mills MM, Achterberg EP, Geider RJ, LaRoche J, Lucas MI, McDonagh EL, Pan X, Poulton AJ, Rijkenberg MJA, Suggett DJ, Ussher SJ, Woodward EMS (2009) Large-scale distribution of atlantic nitrogen fixation controlled by iron availability. Nat. Geosci. 2: 867–871 Moreno-Ostos E, Fernández A, Huete-Ortega M, Mouriño-Carballido M, Calvo-Díaz A, Morán XAG, Marañón E (2011) Size-fractionated phytoplankton biomass and production in the tropical Atlantic. Scientia Marina 75: 379–389 160 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Morin S, Savarino J, Frey MM, Domine F, Jacobi H-W, Kaleschke L, Martins JMF (2009) Comprehensive isotopic composition of atmospheric nitrate in the Atlantic Ocean boundary layer from 65ºS to 79ºN. J. Geophys. Res. 114, D05303, doi:10.1029/2008JD010696 Mouriño-Carballido B, Graña R, Fernández A, Bode A, Varela M, Domínguez JA, Escánez J, de Armas D, Marañón E (2011) Importance of N2 fixation vs. nitrate eddy diffusion along a latitudinal transect in the Atlantic Ocean. Limnol. Oceanogr. 56(3): 999−1007 Mulholland MR, Bernhardt PW (2005) The effect of growth rate, phosphorus concentration, and temperature on N2 fixation, carbon fixation, and nitrogen release in continuous cultures of Trichodesmium IMS101. Limnol. Oceanogr. 50(3): 839–849 Mulholland MR, Bernhardt PW, Heil CA, Bronk DA, O’Neil JM (2006) Nitrogen fixation and release of fixed nitrogen by Trichodesmium spp. in the Gulf of Mexico. Limnol. Oceanogr. 51: 2484–2484 Mulholland MR, Floge S, Carpenter EJ, Capone DG (2002) Phosphorus dynamics in cultures and natural populations of Trichodesmium spp. Mar. Ecol. Prog. Ser. 45: 45–55 Mulholland M, Ohki K, Capone DG (1999) Nitrogen utilization and metabolism relative to patterns of N2 fixation in cultures of Trichodesmium NIBB 1067. J. Phycol. 35: 977–988 Mulholland M, Ohki K, Capone DG (2001) Nutrient controls on nitrogen uptake and metabolism by natural populations and cultures of Trichodesmium (cyanobacteria). J. Phycol. 37: 1001–1009 Mulholland MR (2007) The fate of nitrogen fixed by diazotrophs in the ocean. Biogeosciences 4(1): 37−51 Mulholland MR, Bernhardt PW, Blanco-García JL, Mannino A, Hyde K, Mondragon E, Turk K, Moisander PH, Zehr JP (2012) Rates of dinitrogen fixation and the abundance of diazotrophs in North American 161 REFERENCIAS coastal waters between Cape Hatteras and Georges BankLimnol. Oceanog. 57(4): 1067−1083 O’Neil JM, Roman MR (1992) Grazers and associated organisms of Trichodesmium. In Marine Pelagic Cyanobacteria: Trichodesmium and Other Diazotrophs. Edited by CarpenterEJ, Capone DG, Rueter J. Dordrecht: Kluwer. pp 61−73 O’Neil JM (1997) The colonial cyanobacterium Trichodesmium as a physical and nutritional substrate for the harpacticoid copepod Macrosetella gracilis. J Plankton Res 20: 43−59 O’Neil JM, Metzler PM, Glibert PM (1996) Ingestion of 15N2-labelled Trichodesmium spp. and ammonium regeneration by the harpacticoid copepod Macrosetella gracilis. Mar. Biol. 125(1): 89−96 O’Neil JM, Roman MR (1994) Ingestion of the cyanobacterium Trichodesmium spp. by pelagic harpacticoid copepods Macrosetella, Miracia and Oculosetella. Hydrobiologia 292/293: 235−240 Ohki K, Taniuchi Y (2009) Detection of Nitrogenase in Individual Cells of a Natural Population of Trichodesmium Using Immunocytochemical Methods for Fluorescent Cells. Journal of Oceanography 65: 427−432 Ohki K (2008) Intercellular localization of nitrogenase in a non-heterocystous cyanobacterium (Cyanophyte) Trichodesmium sp. NIBB1067. J. Oceanogr. 64: 211–216 Ohki K, Fujita Y (1982) Laboratory culture of the pelagic blue-green alga Trichodesmium thiebautii: conditions for unialgal culture. Marine Ecology Progress Series 7(2): 185−190 Ohki K, Zehr JP, Falkowski PG, Fujita Y (1991) Regulation of nitrogenfixation by different nitrogen sources in the marine non-heterocystous cyanobacterium Trichodesmium sp. NIBB 1067. Arch. Microbiol. 156: 335–337 Osborn TR (1980) Estimates of the local rate of vertical diffusion from dissipation measurements. Journal of Physical Oceanography 10: 83−89 162 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Paerl HW, Zehr JP (2000) Marine nitrogen fixation. In: Kirchman DL (Ed) Microbial Ecology of the Oceans, Wiley-Liss. pp 387−426 Paerl HW, Priscu JC, Brawner DL (1989) Immunochemical localization of nitrogenase in marine Trichodesmium aggregates: Relationship to N2 fixation potential. Appl. Environ. Microbiol. 55: 2965–2975 Prandke H, Stips S (1998) Test measurements with an operational microstructure-turbulence profiler: Detection limit of dissipation rates. Aquatic Sciences 60: 191−209 Prufert-Bebout L, Paerl HW, Lassen C (1993) Growth, nitrogen fixation and spectral attenuation in cultivated Trichodesmium species. Appl. Environ. Microbiol. 59: 1367–1375 Raimbault P, Slawyk G, Coste B, Fry J (1990) Feasibility of using an automated colorimetric procedure for the determination of seawater nitrate in the 0 to 100 nM range – Examples from field and culture. Marine Biology 104(2): 347−351 Rees AP, Gilbert JA, Kelly-Gerreyn BA (2009) Nitrogen fixation in the western English Channel (NE Atlantic ocean). Mar. Ecol.-Prog. Ser. 374: 7–12 Reynolds SE, Mather RL, Wolff GA, Williams RG, Landolfi A, Sanders R, Woodward EMS (2007) How widespread and important is N2 fixation in the North Atlantic Ocean? Global Biogeochem. Cycles 21, GB4015, doi:10.1029/2006GB002886 Ridame C, Guieu C (2002) Saharan input of phosphate to the oligotrophic water of the open western Mediterranean Sea. Limnol. Oceanogr. 47(3): 856−869 Rubin M, Berman-Frank I, Shaked Y (2011) Dust- and mineral-iron utilization by the marine dinitrogen-fixer Trichodesmium. Nature Geoscience. DOI: 10.1038/NGEO1181 Rueter JG, Hutchins DA, Smith RW, Unsworth N (1992) Iron nutrition of Trichodesmium. In Marine Pelagic Cyanobacteria: Trichodesmium and 163 REFERENCIAS Other Diazotrophs. (Carpenter EJ, Capone DG, Rueter JG, eds.). Kluwer, Dordrecht. pp. 289–306 Sañudo-Wilhelmy SA, Kustka AB, Gobler CJ, Hutchins DA, Yang M, Lwiza K, Burns J, et al. (2001) Phosphorus limitation of nitrogen fixation by Trichodesmium in the central Atlantic Ocean. Nature 411: 66−69 Sañudo-Wilhelmy SA, Tovar-Sánchez A, Fu FX, Capone DG, Carpenter EJ, Hutchins DA (2004) The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry. Nature 432: 897–901 Shiozaki T, Furuya K, Kodama T, Takeda S (2009) Contribution of N2 fixation to new production in the western North Pacific ocean along 155 degrees E. Mar. Ecol. Prog. Ser. 377: 19–32 Sigman D, Altabet M, Michener R, McCorkle DC, Fry B, Holmes RM (1997) Natural abundance-level measurement of the nitrogen isotopic composition of oceanic nitrate: An adaptation of the ammonia diffusion method. Mar. Chem. 57: 227– 242 Sohm JA, Subramaniam A, Gunderson T, Carpenter EJ, Capone DG (2011) Nitrogen fixation by Trichodesmium spp. and unicellular diazotrophs in the North Pacific Subtropical Gyre. Journal of Geophysical Research: Biogeosciences 116, G03002, doi:10.1029/2010JG001513 Sroga GE, Landegren U, Bergman B, Lagerstrom-Fermer M (1996) Isolation of nifH and part of nifD by modified capture polymerase chain reaction from a natural population of the marine cyanobacterium Trichodesmium sp. FEMS Microbiol. Lett. 136: 137–145 Staal M, Meysman FJR, Stal LJ (2003) Temperature excludes N2-fixing heterocystous cyanobacteria in the tropical oceans. Nature 425: 504-507 Staal M, Hekkert ST, Brummer GJ, Veldhuis M, Sikkens C, Persijn S, Stal LJ (2007) Nitrogen fixation along a North- South transect in the eastern Atlantic ocean. Limnol. Oceanogr. 52: 1305–1316 Stal LJ (2009) Is the distribution of nitrogen-fixing cyanobacteria in the oceans related to temperature? Environmental Microbiology 11(7): 1632−1645 164 TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Stewart WDP, Fitzgerald GP, Burris RH (1967) In situ studies on N2 fixation, using the acetylene reduction technique. Proc. Natl. Acad. Sci. 58: 2071 Tripp HJ et al. (2010) Metabolic streamlining in an open ocean nitrogen-fixing cyanobacterium. Nature 464: 90–94 Tyrrell T, Marañón E, Poulton AJ, Bowie AR, Harbour DS, Woodward EMS (2003) Large-scale latitudinal distribution of Trichodesmium spp. in the Atlantic Ocean. J. Plankton. Res. 25: 405–416 Uthermöhl H (1958) Zur Vervolkommung der quantitativen phytoplankton methodick. Mitteilung Internationale Vereinigung fuer Theoretische unde Amgewandte Limnologie 9: 39. Van Mooy BAS, Fredericks HF, Pedler BE, Dyhrman ST, Karl DM, Koblízek M, Lomas MW, Mincer TJ, Moore LR, Moutin T, Rappé MS, Webb EA (2009) Phytoplankton in the ocean use non-phosphorus lipids in response to phosphorus scarcity. Nature 458: 69−72 Villareal TA, Carpenter EJ (2003) Buoyancy regulation and the potential for vertical migration in the oceanic cyanobacterium Trichodesmium. Microb. Ecol. 45: 1–10 Vitousek PM, Howarth RW (1991) Nitrogen Limitation on Land and in the Sea: How Can It Occur? Biogeochemistry 13(2): 87−115 Voss M, Croot P, Lochte K, Mills M, Peeken I (2004) Patterns of nitrogen fixation along 10N in the tropical Atlantic. Geophy. Res. Lett. 31, L23S09, doi:10.1029/2004gl020127 Wannicke N, Liskow I, Voss M (2010) Impact of diazotrophy on N stable isotope signatures of nitrate and particulate organic nitrogen: case studies in the north-eastern tropical Altantic Ocean. Isotopes in Environmental and Health Studies 46(3): 337−354 Waser NAD, Harrison WG, Head EJH, Nielsen B, Lutz VA, Calvert SA (2000) Geographic variations in the nitrogen isotope composition of surface particulate nitrogen and new production across the North Atlantic Ocean. Deep Sea Res. I 47: 1207–1226 165 REFERENCIAS Webb EA et al. (2009) Phenotypic and genotypic characterization of multiple strains of the diazotrophic cyanobacterium Crocosphaera watsonii isolated from the open ocean. Environ. Microbiol. 11: 338–348 Weiss RF (1970) The solubility of nitrogen, oxygen and argon in water and seawater. Deep-Sea Research 17: 721−735 Westberry TK, Siegel DA (2006) Spatial and temporal distribution of Trichodesmium blooms in the world’s oceans, Global Biogeochem. Cycles 20, GB4016, doi:10.1029/2005GB002673 Wu J, Boyle E, Sunda W, Wen LS (2000) Soluble and Colloidal Iron in the Oligotrophic North Atlantic and North Pacific. Science 293: 847−849 Zehr JP (2011) Nitrogen fixation by marine cyanobacteria. Trends in Microbiology 19(4): 162−173 Zehr JP, Bench SR, Carter BJ, Hewson I, Niazi F, Shi T, Tripp HJ, Affourtit JP (2008) Globally Distributed Uncultivated Oceanic N2-Fixing Cyanobacteria Lack Oxygenic Photosystem II. Science 322: 1110−1112 Zehr JP, Harris D, Dominic B, Salerno J (1997) Structural analysis of the Trichodesmium nitrogenase iron protein—Implications for aerobic nitrogen fixation activity. FEMS Microbiol. Lett. 153: 303–309 Zehr JP, Mellon MT, Zani S (1998) New nitrogen-fixing microorganisms detected in oligotrophic oceans by the amplification of nitrogenase (nifH) genes. Appl. Environ. Microbiol. 64: 3444–3450 Zehr JP, Waterbury JB, Turner PJ, Montoya JP, Omoregie E, Steward GF, Hansen A, Karl DM (2001) Unicellular cyanobacteria fix N2 in the subtropical North Pacific Ocean. Nature 412: 635–638 Zehr JP, Carpenter EJ, Villareal TA (2000). New perspectives on nitrogenfixing microorganisms in tropical and subtropical oceans. Trends in Microbiology 8(2): 68−73 166 Agradecimientos TRICHODESMIUM Y FIJACIÓN DE NITRÓGENO EN EL ATLÁNTICO Este viaje empezó un 28 de diciembre, hace ya más de ocho años, con una inocentada extraña orquestada entre PDI de la Universidade de Vigo y un programa de empleo de la Xunta de Galicia. Son muchas las personas que han compartido esta travesía conmigo, y no querría cometer la injusticia de olvidar a alguien, pero sería muy largo mencionarlas a todas. Además, todas saben que las palabras no son lo mío. Como mucho alguna tímida acción pero nada de palabrería. Así que empezaré agradeciéndoos a tod@s (sí, ya sabéis quienes sois) las horas compartidas, tanto de trabajo como de esparcimiento, las risas, la compresión y el apoyo, los proyectos realizables e irrealizables, los cafés de media mañana y todas las muestras de cariño y compañerismo de estos años. A mis padres, Celsa y José Luis, que me han ayudado a llegar hasta este puerto. Gracias por su apoyo incondicional, incluso sin llegar entender del todo lo que es esta locura de la ciencia, sólo porque es lo que me hace feliz. Al profesor Emilio Marañón que me ofreció realizar esta tesis en un tema que me encanta y cuando mi edad me impedía cualquier opción de empezar carrera investigadora, cual yogur caducado. Además de su indulgencia con mis "ideas felices" y sus comentarios siempre constructivos para orientarme en el buen camino. Al profesor Antonio Bode todos sus comentarios y sugerencias me han ayudado a entender los datos, especialmente los de isótopos que han sido más áridos para mí. En mi primer año sobreviví gracias a los conocimientos inagotables, buen carácter y mejores consejos de María E., Patricia P. y Valesca, que siempre sabían decirme donde, como o quien cuando tenía dudas. El trabajo duro empezó en el laboratorio y siguió en los barcos. La única diferencia entre ambos fueron los escenarios y la posibilidad de alcanzar nuevos horizontes en las cascaritas de nuez flotantes. A María A., Meri, Paloma, Jose gracias por compartir todas las horas de preparación, envíos, muestreos, mareos, incubaciones o filtraciones siempre con buen humor. A María H. y también a Meri les agradezco que aguantasen mis ronquidos con paciencia. A Elena T. 169 AGRADECIMIENTOS gracias por tu serenidad contagiosa, sentido común, buen hacer, el agua de 4mil y los chorizos de Salamanca. Por petición personal a Meri también le diré QTD. He vivido en tres mesas distintas en el laboratorio. La primera, muy pequeñita, estaba junto a la puerta y el teléfono y la cohabité con María E., que debió acabar cansada de tanta pregunta en los primeros meses pero siempre me respondió con una sonrisa. La segunda, fue un poco mayor, junto a la zona del Winkler y con María A. a mi espalda, en la otra esquina del laboratorio, con quien he compartido mucho más que trabajo. Gracias por ayudarme a soñar. Y la tercera, la de María A., así que, también le agradezco la herencia. A mis amigas del otro lado, del no científico. Mi segunda familia. Romina, Susana, Olga y Uxía vosotras sabéis que son muchas las cosas que podría enumerar, pero tendría que escribir otra tesis. Por todo lo que ya sabéis. A Suso le animo a que acabe, aunque siempre tenga una montaña de trabajo esperándolo que lo aleja de la tesis. ¡Hay luz al final del túnel! Y le agradezco esa sonrisa perenne, incluso cuando está bien fastidiado con roturas varias, con la que siempre nos recibe en su sotanito. A Susana C. y Elisa les agradezco las horas frente a una pieza de cuero a medio trabajar, en aquellas mesas incómodas de la escuela de artes y oficios en las que hablábamos de casi todo siempre con buen humor, en contra del ambiente general de mutismo y quejas varias por los achaques de la edad que allí reinaba. A Nieves todas las buenas horas durante las clases de inglés y después. Y sí, he acabado, ¡por fin! A Amelia, que me enseñó un lenguaje nuevo, leído en un pentagrama y hablado a través de las cuatros cuerdas de un violín. Aunque nunca he sido una alumna aplicada. Y, como dicen los ingleses, the last but not the least. A Rubén y Astrid gracias por soñar conmigo estos úlitmos años. 170