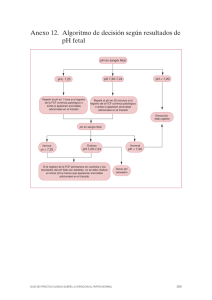
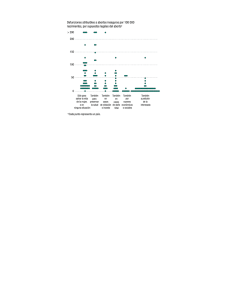
Texto guía en ecografía obstétrica
Anuncio

Texto guía en ecografía obstétrica Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Roger Perea Cuesta Diana Milena Rodríguez Merchán Universidad Nacional de Colombia Facultad de Medicina Departamento de Obstetricia y Ginecologia Especialidad en Obstetricia y Ginecologia Bogotá, D.C. 2013 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Roger Perea Cuesta Código 05598756 Diana Milena Rodríguez Merchán Código 05598762 Trabajo presentado para Optar el Título de Especialista en Obstetricia y Ginecología Director Dr jaime Arenas Gamboa Universidad Nacional de Colombia Facultad de Medicina Departamento de Obstetricia y Ginecologia Especialidad en Obstetricia y Ginecologia Bogotá, D.C. 2013 Colaboradores Agradecimientos a los siguientes Doctores por sus valiosos aportes en el diseño y evaluación del texto: Dr. Jaime Arenas Gamboa Especialista en Ginecología y Obstetricia Profesor asociado Universidad Nacional de Colombia Dr. Mario Parra Especialista en Ginecología y Obstetricia Profesor asociado Universidad Nacional de Colombia Dr. Rodrigo Alviar Especialista en Ginecología y Obstetricia Universidad Nacional de Colombia Dra. Edith Ángel Müller Especialista en Ginecología y Obstetricia Profesora titular Universidad Nacional de Colombia Dr. Jorge Andrés Rubio Especialista en Ginecología y Obstetricia Profesor asociado Universidad Nacional de Colombia Dr. Jorge Eduardo Caro Especialista en Ginecología y Obstetricia Universidad Nacional de Colombia Dr. Reinaldo Niño Especialista en Ginecología y Obstetricia Universidad Nacional de Colombia Dra. Carmen Doris Garzón Especialista en Ginecología y Obstetricia Directora de postgrado de Ginecología y Obstetricia Universidad Nacional de Colombia Dr. Alejandro Bautista Charry Especialista en Ginecología y Obstetricia Director del Departamento de Ginecología y Obstetricia Universidad Nacional de Colombia Dr. Andrés Camilo Mora Granja Médico Cirujano Universidad Nacional de Colombia Agradecimientos Agradecemos a la Universidad Nacional de Colombia, al departamento de Obstetricia y Ginecología, a nuestros docentes; por brindarnos las herramientas teórico – prácticas para el desarrollo de este proyecto; el cual esperamos sea de utilidad. A nuestras familias por darnos la fortaleza y el acompañamiento constante requerido en todo el proceso de formación como especialistas, permitiéndonos el logro de una más de nuestras metas. Resumen y Abstract IX Resumen El presente trabajo de grado tiene como objetivo crear un texto guía en ecografía obstétrica básica, el cual brinde las herramientas necesarias a nuestro personal en entrenamiento llámese residentes de ginecología y radiología u obstetras interesados en el diplomado de diagnostico prenatal, para optimizar la calidad en la atención prenatal y lograr una detección temprana de alteraciones del medio ambiente fetal que tengan impacto negativo en el resultado perinatal. Para ello, en primer lugar con la participación de nuestro docente asesor, se seleccionaron una serie de temas de gran importancia en las unidades de medicina materno fetal, en los cuales se incluyo alteraciones del sistema nervioso, patología cardiaca, anomalías de cara y cuello, displasias esqueléticas fetales, y evaluación ecográfica básica y avanzada en primer, segundo y tercer trimestre de la gestación. Estos temas posteriormente se desarrollaron a profundidad de forma clara y sencilla, usando la evidencia bibliográfica más reciente y ajustando cada capítulo a nuestra práctica obstétrica diaria. Luego se recopilaron las imágenes ecográficas, obtenidas en nuestros centros de referencia: hospital de Engativá, hospital la Victoria sede Instituto Materno Infantil, obstetricia y ginecología (O y G Ltda.), previa autorización de sus directivas y omitiendo los datos personales del paciente. Finalmente se diseñaron una serie de algoritmos de actuación para diagnostico, tratamiento y pronostico de las anomalías fetales más prevalentes. Al final del texto que desarrollamos, en forma de anexos se da una breve guía de cómo reportar un estudio X Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional ecográfico básico, observando cada estructura fetal de forma rápida pero completa y de esa forma estandarizar el diagnostico prenatal. Abstract This paper aims grade create a text guide in basic obstetric ultrasound, which provides the tools necessary to call it training our staff in gynecology and radiology residents or obstetricians graduate interested in prenatal diagnosis, to optimize the quality of prenatal care and achieve early detection of abnormal fetal environment having negative impact on newborns’ outcome. To do this, first with the participation of our faculty advisor, we selected a number of very important issues in maternal fetal medicine units, which was included in nervous system disorders, heart disease, abnormalities of the face and neck, fetal skeletal dysplasia’s, and basic and advanced ultrasound assessment first, second and third trimester. These themes were developed further depth clearly and simply, using the most recent literature evidence and adjusting each chapter to our daily obstetric practice. Then he collected the ultrasound images obtained in our reference centers: Engativá hospital, the Victoria hospital based Maternal and Child Institute, obstetrics and gynecology (O & G Ltd.), following authorization by its directives and omitting the patient's personal data. Finally we designed a series of algorithms performance for diagnosis, treatment and prognosis of fetal anomalies more prevalent. At the end of the text that we develop, as annexes is a brief guide on how to report basic ultrasound, fetal watching every structure quickly but complete and thus standardize prenatal diagnosis. Key words: obstetric ultrasound, prenatal diagnosis, fetal abnormalities, maternal fetal medicine, obstetric practice. Contenido XI Contenido Pág. Resumen y Abstrat IX Presentación 1 1. Principios biofísicos y seguridad del Ultrasonido en Obstetricia. 3 2. Ecografía Obstétrica temprana y de primer trimestre. 13 2.1 Tamizaje integrado 18 3. Ecografía Obstétrica de Segundo y tercer trimestre. 31 3.1 Marcadores Blandos 39 4. Gestación Múltiple 49 5. Valoración de la anatomía Anormal. 61 5.1 Cara y cuello. 61 5.2 Evaluación del Tórax fetal. 75 5.3 Evaluación cardiaca fetal. 87 5.4 Evaluación del sistema gastrointestinal fetal 99 5.5 Valoración y anormalidades del sistema urogenital 119 5.6 Valoración y anormalidades del sistema esquelético 133 5.7 Evaluación del Sistema Nervioso Central. 151 6. Evaluación del Medio ambiente fetal. 176 6.1 Perfil Biofísico fetal. 177 6.2 Doppler feto placentario. 181 6.3 Restricción del Crecimiento fetal 186 7. Cervicometria. 191 Anexo 197 Presentación Procedemos a presentar este nuevo libro titulado Texto guía en ecografía obstétrica básica, que surge de la inquietud e interés ante la creciente producción de material científico en pro del diagnostico prenatal basado en la ecografía y sus aplicaciones, por lo cual es necesario tener adecuadas bases que permitan el entendimiento y aprovechamiento de las nuevas tecnologías disponibles. El presente texto fue creado con el fin de brindar las herramientas necesarias para el entrenamiento en ecografía obstétrica básica, de los residentes de ginecología y radiología u obstetras interesados en el diplomado de diagnostico prenatal, para optimizar la calidad en la atención prenatal y lograr una detección temprana de alteraciones del medio ambiente fetal que tengan impacto negativo en el resultado perinatal. Prefacio Se seleccionaron una serie de temas de relevancia clínica; los cuales se desarrollaron de la siguiente manera, técnica de toma de imágenes, referencias anatómicas de los planos y patologías frecuentes; las cuales fueron descritas de manera clara y sencilla, permitiendo un abordaje práctico del diagnostico prenatal, usando la evidencia bibliográfica más reciente y ajustando cada capítulo a nuestra práctica obstétrica diaria. Luego se recopilaron las imágenes ecográficas, obtenidas en nuestros centros de referencia: hospital de Engativá, hospital la Victoria sede Instituto Materno Infantil, Sonogyn, Obstetricia y Ginecología LTDA, Fetal Clinic; previa autorización de sus directivas y omitiendo los datos personales de las pacientes. 1. Principios físicos básicos y seguridad del ultrasonido Introducción La ecografía se define como un método diagnostico basado en imágenes obtenidas, mediante el procesamiento de ecos reflejados a través estructuras corporales, gracias a la acción de pulsos de ondas ultrasónicas. Qué es el ultrasonido? Se define como una serie de ondas mecánicas, originadas por la vibración de un cuerpo elástico (cristal piezoeléctrico) y propagadas por un medio (tejidos corporales) cuya frecuencia supera la del sonido audible por el oído humano entre 20 Hz a 20,000 Hz (20kHz). Parámetros a evaluar Frecuencia Penetración a tejidos Velocidad de propagación Angulo de isonación Reflexión y refracción Atenuación Frecuencia Es usado para medir el sonido y se refiere a los cambios de presión (ecos) por unidad de tiempo. La unidad de frecuencia acústica es el Hertzio (Hz). El ultrasonido utiliza frecuencias altas (2 a 15 MHz) entre 500 a 1000 veces mayores que el sonido que podemos oír en condiciones normales. Velocidad de propagación La velocidad de propagación del sonido varia dependiendo el tejido que este atravesando, en los tejidos blandos corporales la velocidad de propagación es en promedio 1520 m/s, mientras en el hueso es mayor de 4,000 m/s y en el aire 340 m/s. 4 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Penetración a tejidos Cuando las ondas sonoras interactúan con los tejidos corporales, estas se mueven longitudinalmente transmitiendo las ondas de una molécula a otra. La distancia entre un pico de onda y otro se define como longitud de onda y se obtiene de dividir la velocidad de propagación entre la frecuencia. Cuando una onda ultrasonográfica atraviesa un tejido, parte de la energía se transmite y parte de la energía rebota hacia el transductor (fenómeno de refracción), o que se conoce como eco. Refracción y reflexión La reflexión ocurre en la interface de dos materiales y provee la evidencia de que un material es diferente a otro, esta propiedad se conoce como impedancia acústica. Sí dos materiales tienen la misma impedancia acústica se producirá un eco débil, pero a mayor diferencia de la impedancia acústica se producirá un eco fuerte, al emplear escala de grises las reflexiones más intensas o ecos reflejado dan un tono más blanco (hiperecoico), en reflexiones débiles dá tonos grises (hipoecoico) y cuando no hay reflexiones da un tono negro (anecoico). Angulo de isonación La reflexión dependerá del ángulo en que se incidan las ondas sónicas, siendo máxima cuando se incide en forma perpendicular a la interface de los tejidos. Si el haz ultrasónico se aleja unos pocos grados de la perpendicular, el sonido reflejado no volverá al centro de la fuente de emisión y será solo detectado parcialmente. Atenuación Ocurre cuando la onda sonora se propaga a través de estructuras profundas y parte de la energía se pierde por absorción o dispersión. La absorción involucra la transformación de energia mecanica en calor, mientras que la dispersión consiste en la desviación de la dirección de la energía. Transductores Los transductores contienen cristales piezoeléctricos, los cuales poseen la capacidad de transformar la energía eléctrica en sonido y viceversa, por lo tanto el transductor actúa como emisor y receptor del sonido. Las ondas reflejadas y captadas por el transductor, se visualiza como imágenes en escala de grises, por medio de elementos fotográficos (pixeles), variando en brillo, intensidad y profundidad del eco. Existen diferentes tipos de transductores que van desde 3,5 MHz hasta 10MHz. Los transductores con mayor frecuencia tienen mejor resolución axial, pero a expensas de Capítulo 1 5 una menor penetración tisular. Por el contrario los transductores de baja frecuencia permiten evaluar estructuras más profundas. Modalidades de la ecografía Modo A La imagen, obtenida de estructuras estáticas, emplea la modulación de la amplitud del pulso como información. El modo A, permite observar variaciones en la intensidad del eco retornado como una gráfica simple que mide las variaciones de la amplitud / tiempo (distancia). Modo B El bidimensional permite la visualización de una imagen anatómica por modulación de la intensidad del eco, dando información sobre las variaciones de la amplitud del pulso, que se representa en cada punto como una escala de grises. Actualmente se usan conversores digitales que permiten una imagen en tiempo real. Modo M Modo M o modo de movimiento, ya que mide los tiempos de latencia en los tejidos móviles. Esta técnica depende de la selección de un único canal de información (modo B) y lo representa en función de tiempo. Imagen 1. Observamos el Modo M para determinar la frecuencia cardiaca fetal. Cortesia Dr Alviar/SONOGYN Modo Doppler La ecografía doppler se basa en el principio físico descrito por Christian Doppler en 1842, donde definió que la frecuencia del sonido aumenta cuando la fuente sonora se acerca al receptor y disminuye cuando se aleja de él [12]. Existen diferentes tipos de doppler: Doppler continuo, Doppler pulsado (dúplex), doppler color (triplex y power angio). Doppler continuo: Se utilizan dos cristales piezoeléctricos, uno que transmite y otro que recibe la señal de ultrasonido de forma continúa [13]. Su principal ventaja es que permite medir flujo sanguíneos de alta velocidad; desventajas no permite seleccionar 6 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional la profundidad ni el volumen de la muestra y no se visualizan lo vasos simultáneamente. Doppler pulsado: En esta modalidad un solo cristal piezoeléctrico transmite recibe la señal. Se envía un pulso de onda ultrasónica y en un intervalo de tiempo determinado se recibe la señal, determinando la profundidad y la amplitud del volumen de la muestra de los vasos estudiados, antes del siguiente pulso. Además permite observar el modo B simultáneamente (dúplex). Imagen 2. y Imagen 2. Doppler pulsado en corazón fetal. Cortesía Dr. Doppler color: Esta técnica permite determinar, sí el flujo se dirige hacia la sonda o sí se aleja de ella, así como la velocidad de dicho flujo. Si el flujo se aleja del transductor puede observarse en color azul, sí se acerca al transductor puede observarse en color rojo, sí existe aceleración del flujo da una tonalidad amarilla brillante y flujo turbulento da una tonalidad verdosa. El Triplex en obstetricia es de extrema utilidad ya que juega un papel importante en el diagnostico, pronostico y seguimiento de algunas patologías fetales, por ejemplo restricción de crecimiento fetal, cardiopatías, anemia fetal, entre otras.[13] Imagen 3. Se visualiza Doppler color de arteria umbilical, doppler pulsado e imagen en Modo B, lo que se denomina triplex Cortesía Dr Arenas/universidad Nacional de Colombia/ OyG. Ecografía 3D: En exploración 3D se puede determinar el ancho, el largo y la profundidad de las imágenes. En ecografía 3D las ondas sonoras no se envían Capítulo 1 7 directamente en línea recta como en la ecografía 2D, se envían hacia diferentes ángulos. Los ecos reflejados se procesan mediante un programa informático sofisticado, que resulta en la reconstrucción de una imagen volumétrica de tres dimensiones, de la superficie del feto o de los órganos internos. Para la visualización de la superficie fetal se recomienda realizarse entre la semana 24 a 32, porque se observan mejor las características, después de semana 32, el tamaño fetal, el descenso a la pelvis y la disminución del liquido amniótico dificultad la observación. Imagen 4. A la izquierda observamos una reconstrucción tridimensional de un linfangioma en cuello fetal. A la derecha observamos una reconstrucción tridimensional de un feto con labio leporino. Cortesía de Dr. Arenas/Universidad Nacional de Colombia/ OyG Ecografía 4D: su nombre no indica una nueva dimensión, simplemente a diferencia de la eco 3D que reconstruye una imagen tridimensional estática, la tecnología 4D puede obtener una imagen tridimensional en movimiento, permitiendo de esta manera un seguimiento fetal adecuado y una evaluación orgánica en tiempo real. La ecografía 4D es una nueva herramienta para evaluación cardiovascular fetal y sus repercusiones hemodinámicas; aunque no se usa solo asociado a eco cardiografía fetal, sino en todas las áreas del conocimiento de la patología fetal. Conclusión Con los avances tecnológicos y la alta resolución de los nuevos equipos de ultrasonografía, se está evaluando al feto como paciente, permitiendo realizar diagnósticos y manejos tempranos, incluso in útero. 8 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 2. Seguridad del ultrasonido en obstetricia La ecografía obstétrica ha completado casi 55 años de uso desde que por primera vez, el Dr. Donald la aplicó para estudiar los ecos provenientes del cráneo fetal (1). El ultrasonido obstétrico en la actualidad, ha pasado de ser una simple herramienta para verificar que el feto este vivo (2) para convertirse en un instrumento fundamental en el diagnóstico prenatal temprano facilitando la terapia fetal in útero que busca disminuir las complicaciones asociadas a la patología fetal; gracias a los avances tecnológicos en las aplicaciones del ultrasonido, así como la mejoría de la resolución en sus imágenes.(2). Debido a su uso amplio y generalizado, es razonable preguntarse sobre la seguridad de este método diagnóstico. A pesar de la seguridad que se proclama, se han encontrado estudios sobre sus posibles efectos adversos en el feto creados por los llamados efectos térmicos y de cavitación, que podrían lesionar al feto (2), aunque se debe aclarar que la cantidad de estudios en seguridad del ultrasonido son limitados (3). Esto se explica porque la realización de estudios prospectivos aleatorios de bioseguridad en el ultrasonido obstétrico son difíciles debido al uso tan frecuente de la ecografía, de tal forma que casi todos los fetos escogidos para el grupo control ya han sido expuestos al menos a una exploración ecográfica (3). En el pasado, los efectos adversos investigados incluían tumores en el recién nacido, dislexia, trastornos del habla, y bajo peso al nacer (4). Pero no se encontró relación alguna con tumores, y las revisiones más recientes han descartado las otras asociaciones (3). Sin embargo, un estudio de cohorte encontró un mayor número de recién nacidos con lateralidad izquierda cuando fueron expuestos al ultrasonido prenatal (4). Aunque, esta relación solo fue hallada para los fetos masculinos, pero no se le ha encontrado asociación con alteraciones del desarrollo neuronal (4). A pesar de que el ultrasonido obstétrico ha ganado reputación en su seguridad, la posibilidad de efectos adversos biológicos en los tejidos no se puede descartar; particularmente, en las imágenes dinámicas a edades gestacionales tempranas, cuando el feto es más vulnerable y la salida acústica del equipo puede estar aumentada. Es por esto, que el ultrasonido obstétrico debe ser solicitado por razones médicas precisas, con equipos de alta resolución para disminuir el tiempo de exposición (5,6). Efecto térmico El principal efecto adverso biológico con el ultrasonido obstétrico aparece cuando se produce calentamiento de los tejidos blandos y del hueso por la absorción de energía de las ondas de ultrasonido (7). Esto se explica porque a medida que el sonido se propaga, parte de su energía mecánica absorbida es transformada en calor por la fricción con los tejidos. Capítulo 1 9 Hay muchas publicaciones acerca de las escalas del calentamiento por ultrasonido(8). Estudios en embriones y animales han encontrado lo siguiente: 1. Si el US in situ produce un incremento de la temperatura inferior a 1.5 °C por encima del nivel fisiológico, parece no producir daño con secuelas. 2. El potencial de daño tisular se incrementa en la medida que aumente el tiempo de exposición y el grado de elevación de la temperatura en los tejidos fetales o embrionarios. 3. Existe una relación inversa entre el incremento de temperatura y el tiempo de exposición necesario para crear un daño potencial con base en el efecto térmico, de tal forma que a mayor temperatura se necesita menos tiempo para producir el mismo daño (3). Indice termico: Es un estimativo del incremento máximo de temperatura que puede ocurrir en un tejido expuesto durante la exploración por US. El índice térmico puede ser usado para evaluar el potencial de daño térmico al feto. Desde 1993 los equipos de US han sido equipados para advertir en la pantalla cuando existe riesgo tanto para un efecto térmico como mecánico. Este, se hace visible si se pasa de un IT mayor a 1. Un IT de 1, significa que hay un incremento de un grado centígrado de temperatura con respecto a la temperatura inicial. (1,3). Hay 3 tipos de IT: ‐ IT de tejidos blandos ‐ IT de Hueso ‐ IT de Cráneo (TIS) (TIB) (TIC)(3) En obstetricia se tiene en cuenta el TIS, debido a que la distribución de las ondas de sonido es homogénea entre los tejidos y los fluidos. (3). Según varios estudios, para que aparezca cualquier evidencia de efecto sobre el desarrollo, el umbral debe estar entre 1.5 a 2 °C por encima de la temperatura materna. Con los equipos modernos se produce un incremento menor a 1 °C. (2) Efecto mecánico El efecto mecánico resulta de la fuerza de radiación, de la corriente y de la cavitación. Los efectos mecánicos a nivel del US obstétrico han sido valorados en tejidos con gas (pulmón, intestino) o con uso de medios de contraste con gas. 10 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional El índice mecánico es un estimado del riesgo de hemorragia capilar en el pulmón, tomando en cuenta las condiciones operativas del equipo. (3) Los efectos mecánicos son improbables en el US obstétrico debido a la ausencia de gas en las bolsas amnióticas y al no uso de medios de contraste con gas. Es por esta razón que el Índice mecánico ha perdido relevancia. Sin embargo, los efectos de la radiación mecánica han sido demostrados en estudios preliminares de modelos físicos y fetales usando el Doppler obstétrico (9). Esto se explica porque las imágenes con doppler usan mayores intensidades de sonido y producen índices térmicos más altos con respecto al modo B a pesar de que ambos poseen los mismos índices mecánicos. Por tanto, los efectos biológicos potenciales pueden ser tanto de origen térmico como mecánico. El cerebro fetal es considerado más susceptible, por lo cual la exploración con Doppler durante el embarazo temprano debe evitarse. (3) Aunque existe la posibilidad de efectos biológicos por el Doppler, hay pocas evidencias de que el US resulte teratogénico. Las principales dificultades que presentan los estudios que valoran un posible efecto deletéreo de la evaluación ecográfica diagnóstica son de tres tipos: (2) 1. Los niveles o tiempos de exposición ecográfica experimentales superan a menudo a los que se emplean normalmente con fines diagnósticos. (2) 2. Los sistemas utilizados para mostrar el efecto ecográfico (plantas, tejidos celulares, animales de laboratorio) pueden no resultar aplicables a seres humanos. (2) 3. Muchos de los estudios que han demostrado efectos adversos in vitro no han sido reproducibles. (2) Bibliografia 1. Hershkovitz R, Sheiner E, Ultrasound in obstetrics: a review of safety. Eur J Obstet Gynecol Reprod Biol, 2002. 2. Callen P, Ecografía obstetricia y ginecología, El sevier, 2009. 3. Bly S, Van de Hof M. Obstetric Ultrasound Biological effects and safety. J Obstet Gynaecol Can 2005. 4. National council on radioation protection and measurements exposure criteria for medical diagnostic ultrasound: II criteria based on all Known mechanisms. 2002. 5. Kieler H, et al. Sinistrality a side effect of prenatal sonography: a comparative study of Young men. Epidemiology. 2001. Capítulo 1 11 6. Whittingham TA. The acoustic output of diagnostic machines. Safe use of ultrasound in medical diagnosis, British Institute of Radiology. 2000. 7. National council on radiation protection and measurements: Exposure criteria for medical diagnostic ultrasound; Criteria based on thermal mechanisms. Bethesda 1992. 8. World federation for ultrasound in Medicine an biology. Symposium on Safety of Ultrasound in Medicine. Conclusions and recommendatios on thermal an non-thermal mechanisms for biological effects of ultrasound. Barnerr, Ultrasound Med Biol 24, 1998. 9. Fatemi M, et al, Fetal stimulation by pulsed diagnostic ultrasound. J Ultrasound Med 2001. 10. Angélica Vargas, Luis M Amescua, Principios Físicos Básicos Del Ultrasonido, Sonoanatomía 11. Francis O. Walker, MD Principios básicos de ecografía. Elsevier España, 2012 12. Hoskins P: Diagnostic ultrasound: physics and equipment, London, 2002, Greenwich Medical. 13. Fleischer, Ecografía obstetricia y ginecología, 2008. 2. Ecografía obstétrica temprana y de I trimestre La ecografía constituye uno de los procedimientos más importantes en la obstetricia, ya que mediante la realización de esta, se permite el diagnóstico temprano de malformaciones mayores, seguimiento del crecimiento fetal, entre otras; constituyendo una de las herramientas más importantes durante el control y seguimiento de la gestación. En algunos países entre el 90 y 100 % de las mujeres que requieren atención obstétrica, han sido sometidas, al menos a una exploración ecográfica durante la gestación. (1). El periodo de la gestación donde es de mayor importancia la realización de la ecografía constituye el primer trimestre ya que en este se valora, localización, cantidad de sacos o embriones, reacción decidual, corionicidad, además de permitir la realización de los marcadores del primer trimestre (11 – 13 6/7 sem). Siendo la ecografía transvaginal, la vía de elección por la calidad de imágenes obtenidas. (1), también puede ser realizada por sintomatología materna como dolor pélvico y hemorragia. El periodo embrionario se considera hasta la semana 8 después de la concepción o semana 10 después de la fecha de la última regla. (2) Para poder entender los hallazgos ecográficos, y clasificarlos como normal o anormal, se debe conocer los cambios secuenciales del desarrollo embrionario, tomaremos la propuesta de Sohaey y cols, donde se divide en preovulatoria, periovulatoria, cigotica, embrionaria y fetal. Ver tabla 1 (3). PERIODO DEL DESARROLLO Pre y Periovulatorio Cigoto: Mórula y Blastocisto Embrionario SEMANAS POR FUR CARACTERISTICAS 1–2 3–5 Fetal Desde 11 Madura el folículo ovárico. Fecundación. Embrión trilaminar. Embrión en forma de C Organogénesis. Crecimiento fetal. 6 – 10 14 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Fig 1. Modificada de Callen P, Ecografía en Obstetricia y Ginecología, Saunders, 2009. Autorización del autor en proceso. En los días siguientes a la ovulación, en el endometrio la capa funcional prolifera percibiéndose como un área hipoecogénica que rodea la línea ecogénica central, el diámetro AP total de este endometrio multicapa es de unos 8 mm hasta 14 mm en la fase proliferativa, siendo esta imagen Indistinguible entre la gestación temprana y la no gestación. (1,4,5) Ver Imagen 1. Imagen 1. Cortesía Instituto materno Infantil(IMI) Dr Caro La primera evidencia ecográfica de gestación es la presencia de saco gestacional, entre una decidua gruesa. Imagen 2 (2,6). Este saco representa la cavidad corionica, es visualizada como una colección anecoica pequeña rodeada por un anillo ecogénico que representa el trofoblasto y la reacción decidual. (2,6). Imagen 2. Cortesía Instituto materno Infantil, Drs Caro y Niño. Julio 2010. Al uso de la ecografía transvaginal es posible identificar un saco gestacional desde las 4 semanas 3 días, con un diámetro medio de 2 a 3 mm (2,7); usando transductores de al menos 5 MHz. El tamaño del saco gestacional se obtiene del promedio de las tres dimensiones ortogonales de la cavidad coriónica; excluyendo el halo ecogénico circundante de tejido. La posición normal es en el centro o en la parte superior del utero. Cuando el saco se implanta en el endometrio, debe encontrarse adyacente al complejo ecogénico de la cavidad una lineal central, Yen y cols describieron este signo, usándolo por visualización transabdominal indicaron una sensibilidad del 92 % y especificidad del 100 % para gestación intrauterina, se han realizado estudios para valorar estos resultados, con resultados dispares, conduciendo al valor de este signo muy limitado.(1,9) Capítulo 2. 15 El saco vitelino (Imagen 3) corresponde a la primera estructura vista dentro del saco gestacional, confirmando la gestación intrauterina; este puede ser visualizado por ecografía transvaginal cuando el saco gestacional tiene un diámetro medio de 5 a 6 mm (5 semanas), y siempre debe ser visualizado cuando el saco tiene un diámetro medio de 8 mm o más. (7,8). Imagen 3. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 Cuando se realiza la aproximación transabdominal, el saco vitelino debe visualizarse a las 7 semanas con un diámetro medio del saco de 20 mm. (1,10). El saco vitelino tiene forma esférica, con una periferia ecogénica bien definida y un centro hipoecoico (Imagen 3). Su diámetro aumenta progresivamente hasta un máximo de 5 a 6 mm, que corresponde a una longitud cráneo caudal de 30 a 45 mm. (11,12). La actividad cardiaca inmediatamente adyacente al saco vitelino indica embrión vivo pero no puede ser visualizado hasta que mide 5 mm. (8,13). El amnios (Imagen 4) es delgado y difícil de visualizar, con mejoría de la imagen cuando el haz de ultrasonido entra perpendicular. El amnios crece rápidamente durante el embarazo y se fusiona con el corión entre las 12 y 16 semanas de gestación. (6,8). Imagen 4. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 16 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional El embrión puede ser visualizado por ecografía transvaginal desde que tiene un diámetro medio de 2 mm; entre las semanas 5 – 7, tanto el embrión como el saco gestacional debe crecer 1 mm diario, parámetro medicional que permite realizar seguimiento del crecimiento embrionario.(6). Entre las semanas 5 a 6 una embriocardia inferior a 100 LPM es normal, durante las siguientes 3 semanas hay un incremento rápido hasta 180 LPM. (Imagen 5). (2,14,15). Visualizar Tabla 2. Imagen 5, Cortesia Dr Alviar Instituto Materno Iinfantil 2010 Semanas 5.0 sem 5 4/7 sem 6.0 sem Hallazgos en la ecografía TV, de desarrollo embrionario. Saco gestacional vacío (diámetro medio de 10 mm) Saco gestacional con saco vitelino visible. Saco gestacional (diámetro medio de 16 mm), saco vitelino con latido cardiaco adyacente, con embrión pequeño (3 mm). Embrión con longitud cráneo-caudal de 16 mm, saco amniótico 8.0 sem separado, movimientos fetales visibles, Embriocardia de 175 LPM Tabla 2. Modificada de Morin L, ULTRASOUND EVALUATION OF FIRST TRIMESTER PREGNANCY COMPLICATIONS, SOGC Clinial practice guidelines, June 2005. Durante la realización de la ecografía del primer trimestre, se pueden encontrar hallazgos patológicos asociados a la perdida de la gestación como: Gestación anembrionada (Imagen 6), aborto, Gestación ectópica y enfermedad trofoblástica gestacional (mola completa, incompleta, coriocarcinoma). Capítulo 2. 17 Imagen 6, Cortesia Dr Arenas, consultorio Yopal 2012. Por lo cual durante la exploración ecográfica se han de tener parámetros métricos claros para establecer hallazgos sugestivos de falla gestacional temprana. Entre ellos(2,13): ‐ ‐ ‐ Ausencia de actividad cardiaca en un embrión de más 5 mm Vía TV o 9 mm Vía TA Saco gestacional diámetro medio mayor a 8 mm sin saco vitelino o saco gestacional diámetro mayor de 16 mm sin embrión en su interior. Vía TV. Saco gestacional diámetro medio mayor de 20 mm sin saco vitelino o saco gestacional diámetro mayor de 25 mm, sin embrión en su interior. Vía TA. Dada la posibilidad de error durante la medición se recomienda adicionar 1 a 2 mm en la medición del saco gestacional antes de considerar la intervención de la misma.(2,16).Y más aun cuando hay posibilidad de error en la fecha de ultima regla, y la paciente se encuentre asintomática; se debe realizar un seguimiento ecográfico a la semana para valorar el crecimiento embrionario.(2). Hallazgos predictores de falla gestacional (2,15): ‐ Bradicardia (Frecuencia cardiaca menor a 85 LPM en gestaciones mayores a 7 semanas). ‐ Tamaño del saco gestacional relativamente pequeña para el embrión: diferencia de menos de 5 mm entre el diámetro medio del saco gestacional y la longitud cráneocaudal del embrión. ‐ Forma del saco embrionario anormal. ‐ Hematoma subcorial. 18 2.1 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Tamizaje integrado: Con el advenimiento de nuevas tecnologías y mejoramiento de las ya disponibles se ha visto un proceso de transformación en el abordaje del cuidado prenatal, enfocándose hacia el diagnostico prenatal temprano a partir de la semana 12 de gestación en pro del mejoramiento del pronostico fetal.(20) En la actualidad se cuenta con la realización de una detección selectiva prenatal como parte de un screening para aneuploidias (2), siendo estas una de las principales causas de muerte perinatal y discapacidad (19), además de ser la principal indicación de diagnostico prenatal invasivo(19) con el riesgo de pérdidas que implica, todo esto ha permitido el desarrollo del tamizaje prenatal en paciente de alto riesgo conformado por marcadores séricos junto con una serie de hallazgos ecográficos que juntos permiten una estimación real del riesgo de presentación de aneuploidias que justifica el procedimiento invasivo durante la gestación. El tamizaje integrado se realiza a partir de la medición de sustancias séricas asociado a la búsqueda de determinados hallazgos ecográficos en el I o II trimestre; en los 90 el tamizaje integrado se realizaba combinando la edad materna, junto con la translucencia nucal y medición de BhCG sérica libre y PAPP-A, durante los últimos 11 años se han encontrado más marcadores ecográficos (19) mejorando la tasa de detección de aneuploidias. (19) El uso del tamizaje del primer trimestre permite no identificar solamente las aneuplodidias sino también permite el tamizaje en pacientes con riesgos específicos para condiciones patológicas de la gestación como pérdidas, óbito, parto pretérmino, pre-Eclampsia, diabetes gestacional, restricción del crecimiento intrauterino y macrosomía. (20). El tamizaje integrado permite realizar un cálculo de riesgo que puede ser alto, intermedio o bajo; a partir de la combinación de marcadores séricos y ecográficos generando la posibilidad de un diagnostico prenatal temprano que mejore el pronóstico fetal y materno, donde las de riesgo intermedio serán reexaminadas para una reclasificación de riesgo a alto o bajo. (20). Dentro de las pérdidas gestacionales tempranas y los óbitos se ha encontrado asociación con los resultados anormales del tamizaje de primer trimestre, incluyendo traslucencia nucal incrementada, onda a reversa en el ductus venoso, niveles bajos de PAPP-A, pudiéndose detectar tempranamente las gestantes en riesgo; para realizar un seguimiento del bienestar fetal más frecuente buscando disminuir esta complicación. (21) Al realizar el tamizaje integrado con las siguientes variables se identifican 90 % de las gestaciones con trisomia 21. (19) 1. Edad materna: Constituye una variante independiente, que incrementa el riesgo de aneuploidia con el incremento de la edad materna. (19) (Adaptada de 21) Capítulo 2. 19 EDAD MATERNA 12 SEMANAS 2O SEMANAS 25 946 1147 30 626 759 35 249 302 37 152 185 39 89 108 41 51 62 El síndrome de Turner no se asocia a la edad materna y su prevalencia es de 1 en 1500 a las 12 semanas (19). Al igual que otras cromosomopatías de tipo sexual. (19) El grupo de mujeres mayores o iguales de 35 años se define como grupo de alto riesgo, ya que fue asociado con 5 % de tasas positivas durante el tamizaje (19), hasta el 20 % de las gestaciones se encuentran en mujeres mayores de 35 años, encontrándose hasta el 50 % del número total de fetos con trisomia 21. (19) 1. Marcadores séricos: Se realizan entre las 9 y 10 semanas de gestación. (20) Las gestaciones con aneuploidias fetales se asocian con concentraciones séricas alteradas de los productos placentarios como: Alfa feto proteína, BhCg libre, Inhibina A, el estradiol no conjugado (uE3) y la PAPP-A (19). Cuando se realiza el tamizaje con los marcadores séricos la medida de la concentración se realiza con múltiplos de la mediana (MOM) de las gestaciones no afectadas;(19) teniendo en cuenta condiciones maternas como raza, peso, tabaquismo y método anticonceptivo. Con puntos de corte de acuerdo al marcador realizado, ya que puede producirse aumento o disminución en el valor; por ejemplo para trisomia 21, el valor de BhCG es 2.0 MoM y 0.5 MoM para la PAPP-A, ya que ambos se van a encontrar incrementados, con estos valores se proporcionan tasas de detección del 65 % junto con la edad materna; el tamizaje debe ser realizado entre las 9 – 13 semanas pues la diferencia es mayor en gestaciones tempranas. (19). Para trisomias 13 y 18 los niveles séricos de la PAPP-A y la fracción libre de BhCG están disminuidos, en otras anormalidades cromosómicas la fracción libre de BhCG es normal, mientras que la de PAPP-A es baja. (19). 2. Marcadores Ecográficos: Han sido múltiples los que se han relacionado pero pocos los que han mostrando un LR significativo que permita tomar conductas, se debe realizar entre las 11 y 13 6/7 semanas. Dentro de estos tenemos: TN, ausencia del hueso nasal, ángulo facial, presencia de la onda a inversa en el ductus venoso y la regurgitación tricúspidea, que serán explicados dentro de la ecografía de semana 11 a 13 6/7. Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 20 3. El tamizaje del primer trimestre está compuesto por la combinación de la edad materna, marcadores bioquímicos y ecográficos, con las que se calcula el riesgo ( escalas Benacerraf, OSCAR), proporcionando tasas de detección para trisomia 21 del 95 %, y tasas de falsos positivos del 2.5 %. (19) ‐ ‐ ‐ Riesgo Bajo: Mayor a 1 en 1000 Riesgo Intermedio: Entre 1 en 51 – 1 en 1000. Riesgo alto: Menor a 1 en 50 3. Valoracion del riesgo desde la semana 11 a 13 6/7 A continuación se realiza una recopilación de los parámetros ecográficos involucrados en la ecografía de tamizaje que se realiza en el primer trimestre entre la semana 11 – 13 6/7. Esta información fue tomada de la página de la Fetal Medicine Foundation, de los cursos on line, en la página web www.fetalmedicine.com; dirigidos en su mayoría por el Dr Kypros Nicolaides. Ecografía de la semana 11 A 13 6/7 La ecografía de 11 a 13 6/7 semanas se ha convertido en una herramienta fundamental en el diagnostico prenatal pues ha permitido la visualización de marcadores ecográficos que permitan sospechar la presencia de aneuplodias, además se pueden visualizar anormalidades fetales mayores, las cuales se distribuyen en tres grupos: 1. Anormalidades que siempre son detectables como el síndrome cuerpo extremidades, anencefalia, holoprosencealia alobar, exoftalmos y gastrosquisis. (20) 2. Anormalidades indetectables porque los signos ecográficos se manifiestan solo en el segundo o tercer trimestre de gestación, incluyendo algunas alteraciones del desarrollo del sistema nervioso central como microcefalia, hipoplasia del cerebelo o del vermis del cerebelo, hidrocefalia, agenesia del cuerpo calloso, acondroplasia, lesiones ecogenicas pulmonares, muchas anormalidades renales y la obstrucción intestinal. (20) 3. Anormalidades que son potencialmente detectables dependiendo del objetivo de la ecografía, el tiempo, el equipo y la experticia del ecografista. Entre estos están los marcadores del primer trimestre como la translucencia nucal engrosada en fetos con displasias esqueléticas letales, hernia diafragmática, incremento del diámetro cerebral, con diminución de la cisterna magna en el cuadro del defecto de tubo neural abierto. (20) 1. Translucencia nucal: Descrito como signo dentro del síndrome de Down el exceso de piel dispuesto a nivel cervical el cual puede ser visualizado desde la vida intrauterina,(19) ha generado Capítulo 2. 21 investigación en los últimos 20 años, que lo han convertido en un marcador efectivo y de diagnostico temprano para trisomia 21 y para otras aneuplodias mayores. Es la medición del espacio de translucencia nucal, la cual corresponde al espacio subcutáneo normal que aparece relleno de liquido entre la zona posterior del cuello fetal y la piel situada por encima (1); en gestaciones normales este espacio es pequeño, cuando hay presencia de síndrome de Down se puede incrementar significativamente. La TN es el marcador individual más potente disponible (1), sirve como método de tamización que permite diferenciar a los embarazos euploides, puede asociarse a defectos cardiacos mayores y otras malformaciones conformando un amplio espectro de síndromes genéticos. (19), tiene una tasa de falsos positivos del 5 %, determina 75 – 80 % de fetos con trisomia 21 y otras aneuplodias mayores. (19) Las condiciones necesarias deben ser (Imagen 8): 1. Debe ser medida entre las 11 a 13 6/7 semanas. 2. LCC entre 45 y 84 mm (Imagen 7). Corte sagital del feto en posición neutral 3. Puede ser medida por vía transabdominal o transvaginal con resultados similares. 4. La imagen debe ser magnificada donde se visualice solamente la cabeza fetal y la región superior del tórax. 5. Debe medirse el máximo grosor de translucencia subcutánea entre la piel y el tejido que cubre la columna cervical. 6. Los calipers deben situarse sobre las líneas que definen el grosor de la TN – la cruz del caliper debe ser difícilmente visible a medida que surge del borde de la línea y no debe verse en el fluido nucal. 7. Durante la exploración debe tomarse más de una medida y anotar finalmente la mayor de ellas. 22 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 7. Cortesía IMI – Sonogyn Dr Alviar, 2010 Imagen 8 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 2. 23 Se debe tener especial cuidado con los lugares de toma de medición, pues lo calipers mal puestos pueden llevar a una falsa medición que sobre estime o disminuya este valor; por otro lado la inadecuada selección de la ganancia puede llevar a una falsa reducción de la TN. (19) Hay esencialmente dos formas de valorar la desviación del resultado de la media normal; puede ser valorado de acuerdo a las desviaciones de la mediana, y el otro método es dividir la TN por la mediana normal resultando un valor MoM. (19) El incremento en la translucencia nucal varia de acuerdo a la longitud cráneo caudal, en un estudio que incluyó 96127 pacientes, con la LCC de 45 mm el P95 de TN fue de 1.2 a 2.1, y con una LCC de 84 mm el P95 fue 1.9 a 2.7 mm; pero el percentil P99 no cambio con el valor de la LCC, siendo este 3.5 mm. (23) El cálculo especifico de riesgo para síndrome de Down inicia con el valor basal dado por la edad de la paciente, posteriormente es multiplicado por el LHR de la TN, (19) cambiando el riesgo basal de tal manera que justificaría un procedimiento invasivo de acuerdo al riesgo. (19). Se ha evidenciado que el riesgo para aneuploidias incrementa con valores de la TN mayores a 3.5 mm. Otros marcadores ecográficos: Tenemos la ausencia del hueso nasal, ángulo facial, onda a inversa en el ductus venoso y la regurgitación tricúspidea que pueden estar presente entre el 55 al 65 % de los fetos con trisomia 21. (19) 1. Hueso nasal: En 1866 Langdon Down observó que una característica común de los pacientes con trisomía 21 era una nariz pequeña. Estudios antropométricos en pacientes con síndrome de Down han informado que la profundidad de la raíz nasal es anormalmente pequeña en el 50% de los casos.(18) La ausencia de hueso nasal fue encontrada en el 60 % de los fetos con trisomia 21, en el 50 % de los fetos con trisomia 18, en el 30 % de fetos con trisomia 13, y en menos del 1 % de fetos normales.(23) Su valoración es cualitativa, se realiza en el mismo corte ecográfico de la translucencia nucal, con los mismos requerimientos técnicos mencionados previamente; y en la imagen de la nariz deben aparecer tres líneas distintas (18): Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 24 La línea superior representa la piel y la inferior, que es más gruesa y mas ecogénica que la piel, representa el hueso nasal, la tercera línea casi en continuidad con la piel, pero en un nivel más alto, es la punta de la nariz. (18) (Imagen 9) Imagen 9 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 2. Angulo facial (18): En la medición del ángulo facial la gestación debe estar entre las semanas 11+0-13+6, y la LCC entre 45-84 mm El tamaño de la imagen debe ser tal que la cabeza y el tórax superior ocupen toda la pantalla Se debe obtener un plano sagital-medio del perfil fetal Se debe medir el ángulo facial comprendido entre (Imagen 10): o Una línea trazada sobre la superficie superior del paladar o Una línea trazada desde la punta más anterior y superior del paladar que se extiende hasta la superficie de la frente, representada por los huesos frontales, o por una línea ecogénica bajo la piel y la sutura metópica, que está abierta normalmente en este momento gestacional Capítulo 2. 25 Imagen 10. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 En fetos euploides la media del ángulo facial disminuye con la LCC desde 84° con una LCC de 45 mm hasta 76° con una LCC de 84 mm. El ángulo facial está sobre el percentil 95 en Fetos euploides 5% y en fetos con trisomía 21 hasta un 45%. 3. Ductus venoso (18): El Ductus venoso es un vaso pequeño que conecta la vena umbilical con la vena cava inferior El ductus venoso tiene un papel crítico dirigiendo la sangre oxigenada al cerebro fetal Un 20% de la sangre oxigenada de la placenta se dirige al corazón fetal directamente a través del ductus venoso. El ductus venoso se cierra normalmente pocos minutos después del nacimiento, pero puede tardar más en el caso de los neonatos prematuros Para la valoración del ductus venoso (Imagen 11): El tamaño de la imagen debe ser tal que el tórax y abdomen fetal ocupen toda la pantalla Se debe obtener un corte sagital medio del tronco fetal con la columna en posición posterior Se debe usar el Doppler color para demostrar la vena umbilical, el ductus venoso y el corazón fetal 26 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional La ventana del Doppler pulsado debe ser pequeña (0,5-1,0 mm), para evitar la contaminación de los vasos adyacentes y debe situarse en la zona de aliasing normalmente en amarillo El ángulo de insonación debe ser menor de 30 grados El filtro debe ser de baja frecuencia (50-70 Hz), para permitir la visualización de la onda completa La velocidad de barrido debe ser alta (2-3 cm/s), para obtener una forma más ancha y poder evaluar mejor la onda a. La onda del ductus venoso tiene una forma característica con: Velocidad alta durante la sístole (onda S) y la diástole (onda D). (Imagen 12) Flujo anterógrado durante la contracción atrial (onda-a) Imagen 11 Cortesia Dr Alviar IMI 2011 El examen cualitativo de la onda de flujo del ductus venoso se basa en la apariencia de la onda-a : ‐ ‐ Positiva o ausente (normal)(Imagen 12). Reversa (anormal) (Imagen 13). Imagen 12 Cortesía Unidad de Medicina Materno fetal, U. Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 Capítulo 2. 27 Onda-a reversa (Imagen 9) Imagen 13 Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 En las semanas 11-13 se observa una onda-a reversa en un 4% de los fetos La onda-a reversa es más común si: La gestación es de 11 en lugar de 13 semanas La translucencia nucal está aumentada La PAPP-A en suero materno es baja La madre es de raza negra La onda-a reversa se asocia con un aumento del riesgo de: defectos cromosómicos defectos cardiacos muerte fetal Sin embargo, en un 80% de los casos con onda-a reversa, el resultado del embarazo es normal. En las semanas 11-13 una onda-a reversa aparece en: Fetos euploides 3% Fetos con trisomía 21 65% Fetos con trisomía 18 55% Fetos con trisomía 13 55% En fetos con TN aumentada el riesgo de defectos cardiacos aumenta si la onda-a del ductus es reversa. Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 28 4. Flujo tricuspideo (18): Para su valoración se deben tener en cuenta los siguientes parámetros (Imagen 14): El tamaño de la imagen debe mostrar que el tórax fetal ocupe toda la pantalla Se debe obtener una imagen de cuatro cámaras apical No se debe usar Doppler color porque no es preciso en el diagnóstico de regurgitación tricuspídea en el primer trimestre La ventana del Doppler pulsado debe ser grande (2,0-3,0 mm) y estar posicionada a través de la válvula tricúspide El ángulo de insonación de la dirección del flujo con respecto al tabique interventricular debe ser menor de 30 grados La velocidad de barrido debe ser alta (2-3 cm/s), para obtener una forma más ancha La válvula tricúspide puede ser insuficiente en una o más de sus valvas, por eso la ventana de muestra debe ponerse a través de la válvula al menos tres veces, para intentar estudiar la válvula completa Imagen 14 Cortesía IMI – Sonogyn Dr Alviar 2011 Patrón normal (Imagen 15 )cuando no hay regurgitación en sístole Regurgitación durante la mitad de la sístole al menos y con una velocidad de más de 60 cm/s Imagen 15 Cortesía IMI – Sonogyn Dr Alviar 2011 Capítulo 2. 29 Conclusion: La ecografía de primer trimestre es una herramienta indispensable en el seguimiento de la gestación, ya que nos permite valorar desde sus inicios la viabilidad de la misma; además de la realización de tamizaje para aneuploidias. Acercándonos a un diagnostico prenatal temprano. Bibliografia 1. Callen P, Ecografía obstetricia y ginecología, El sevier, 2009. 2. Morin L, Ultrasound evaluation of first trimester pregnancy complications, SOGC Clinial practice guidelines, June 2005. 581 – 585. 3. Sohaey R, Woodward P, Zweibel WJ, First –trimester ultrasound: The essentials. Semin Ultrasound CT MR 17:2, 1996. 4. Fleischer AC, Kalameris GC, et al: Sonographic depiction of normal and abnormal endometrium with histopathologic correlation. J Ultrasound Med 5:445, 1986. 5. Forrest TS, Elyaderani MK, Muilenburg MI, et al: Cyclic endometrial changes: US assessment with histologic correlation. Radiology 167:233, 1988. 6. Goldstein S, Early detection of pathologic pregnancy by transvaginal sonography. J Clin Ultrasound 18: 262, 1990. 7. Sauerbrei E, Coooperberg PL, Poland JB. Ultrasound demonstration of the normal fetal yolk sac. J Clin Ultrasound 8: 217, 1980. 8. Timor-Tritsch IE, Farine D, Rosen MG. A close look at early embryonic development with the high-frequency transvaginal transducer. Am J Obstet Gynecol 159:166,1988. 9. Yeh HC, Goodman JD, et al: Intradecidual sign: A US criterion of early intrauterine pregnancy. Radiology 162: 463, 1986. 10. Nyberg DA, Mack LA, et al: Distinguishing normal from abnormal gestational sac growth in early pregnancy. J Ultrasound Med 6:23, 1987. 11. Lindsay DJ, Lovett IS, Lyons EA, et al: Yolk sac diameter and shape at transvaginal US: Predictors of pregnancy outcome in the first trimester. Radiology 183: 115, 1992. 12. Stampone C, Nicotra M, Mutinelli C, et al: Transvaginal sonography of the yolk sac in normal and abnormal pregnancy. J Clin Ultrasound 24: 3, 1996. 30 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 13. Levi CS, Lyons EA, Zheng XH, Lindsay DJ, Holt SC. Endovaginal US: demonstration of cardiac activity in embryos of less than 5.0 mm in crown-rump length. Radiology 1990;176:71–4. 14. Merchiers EH, Dhont M, De Sutter PA, Beghin CJ, Predictive value of early embryonic cardiac activity for pregnancy outcome. Am J Obstet Gynecol 1991;165:11–4. 15. Achiron R, Tadmor O. Heart rate as a predictor of first trimester spontaneous abortion after ultrasound-proven viability. Obstet Gynecol 1991;78:330–4. 16. Rowling SE, Coleman BG, Langer JE, Arger PH, Nisenbaum HL. First-trimester US parameters of failed pregnancy. Radiology 1997;203:211–7. 17. Dimitry ES, Subak-Sharpe R, Mills M, Maragara R, Winston R. Nine cases of heterotopic pregnancies in 4 years of in vitro fertilization. Fertil Steril 1990;53. 18. http://www.fetalmedicine.com/ 19. Nicolaides K, Screening for fetal aneuploidies at 11 to 13 weeks, Prenat Diagn 2011 20. Nicolaides K, A model for a new pyramid of prenatal care based on the 11 to 13 weeks’ assessment, Prenat Diagn 2011 21. Akolekar R, Bower S, et al. Prediction of miscarriage and stillbirth at 11–13 weeks and the contribution of chorionic villus sampling, Prenat Diagn 2011 22. Beta J, Akolekar A, Prediction of spontaneous preterm delivery from maternal factors, obstetric history and placental perfusion and function at 11–13 weeks, Prenat Diagn 2011. 23. Molina F, Screening for trisomy 21, Universidad de Granada, 2009 3. Ecografía del segundo y tercer trimestre Cuando se realiza la ecografía obstétrica completa durante el segundo trimestre nos proporciona información a cerca de número de fetos, cálculo de la edad gestacional, ubicación de la placenta, marcadores blandos para aneuploidia, anatomía fetal y materna. (1). Cuando se realiza esta ecografía proporcionara la mejor oportunidad para el diagnóstico de anomalías fetales y el manejo prenatal; también se reduce el número de exámenes de ultrasonido realizados para valorar la anatomía fetal. Disminuyendo el costo y mejorando el rendimiento de la ecografía obstétrica.(1,2). En la revisión bibliográfica que realizó Cargill et col, se evidenció que hay descripciones de la anatomía fetal antes de la semana 18 con evidencia de malformación, pero otros estudios han demostrado que el diagnóstico de anomalías es más frecuente cuando la exploración ecográfica se realiza después de la semana 18. (1,2,3,4). Según el consenso de la SCOG(1,5) se recomienda la realización de la ecografía de segundo trimestre después de la semana 18 pero antes de la semana 22; esto permite diagnosticar una anomalía mas tempranamente, evitando el costo y la exposición innecesaria al ultrasonido en múltiples ocasiones pensando en la evaluación de la anatomía fetal. (1) La propuesta hecha por la ISUOG de la evaluación básica que se debe realizar tenemos: (1) Actividad cardiaca. Numero de fetos: corionicidad si hay gestación múltiple. Edad fetal Anatomía fetal básica. Apariencia placentaria y localización. A quien debe realizarse la exploración ecográfica: Todas las mujeres gestantes deben realizarse la ecografía, para confirmar la edad gestacional en gestaciones tempranas, detectar las gestaciones múltiples, detectar las malformaciones fetales.(7) Los seguimientos ecográficos seriados son coadyuvantes del estudio de madres con factores de riesgo para resultados perinatales adversos; estas ecografías no corresponden a exámenes de rutina. (7) 32 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Siempre que se realiza un procedimiento ecográfico es necesario explicarle a la madre las limitaciones, ventajas y riesgos que trae el uso de esta herramienta, actualmente se propone la realización del consentimiento informado. (7) Cuando debe realizarse? La ecografía de rutina se debe realizar entre la semana 18 – 22, en este periodo de tiempo es cuando las características de las estructuras de los órganos mayores, puede ser satisfactoriamente evaluadas con una ventana acústica adecuada; además de los beneficios para valorar la anatomía fetal y el hallazgo de anormalidades congénitas; ya que estas son visibles desde la semana 20 de gestación. (7) Equipo: Los requerimientos mínimos que debe tener un equipo son: Tiempo real – Escala de grises. Transductores de ultrasonido de 3 – 5 MHz Potencia de salida acústica ajustable Capacidad de congelación de imágenes – cine loop Caliper electrónicos. Capacidad para imprimir o para grabar las imágenes. Mantenimiento regular del equipo. Guias para la realización del examen: I. Biometria basica: Las medidas deben ser realizadas de manera estandarizada, las imágenes deben ser guardadas para documentar las medidas.(7) En el reporte los rangos de normalidad deben ser incluidos, o las desviaciones estándar de las medidas obtenidas deben ser mencionadas. (7) Usamos la estimación de la edad gestacional en el primer trimestre inicialmente por Longitud cráneo-caudal, y posteriormente por diámetro biparietal y/o circunferencia cefálica. (7) Cuando se realiza la ecografía obstétrica hay unos puntos estándar que siempre deben ser evaluados y documentados entre ellos la forma del cráneo del feto, cavum septum Capítulo 3 33 pellucido, la hoz de línea media, plexo coroideo, los ventrículos laterales cerebrales, el cerebelo, la cisterna magna, y el pliegue nucal. La cara debe ser valorada para visualizar las orbitas, los labios y su integridad. En el tórax, el corazón y los pulmones deben ser examinados, el examen cardiaco fetal será expuesto posteriormente. (1) Los pulmones deben ser examinados: evaluando su ecogenicidad; en el abdomen del feto, el estudio anatómico debe incluir la posición, la presencia y situs del estómago, la visualización del intestino, la vejiga, los riñones, la inserción del cordón, y el número de vasos del cordón.(1) La columna vertebral del feto debe ser vista en toda su longitud en los planos sagital, coronal y transversal, si es posible. (1) Debe hacerse un intento para evaluar los órganos genitales del feto. (1) Los cuatro miembros: a nivel de las manos y los pies deben ser visualizados. Evaluación subjetiva del tamaño de los huesos, la forma y la densidad se debe realizar. Esto no siempre puede ser documentado con imágenes fijas.(1) La placenta debe ser examinada: la posición, la apariencia y la presencia o ausencia de anomalías. La ubicación de la placenta y su relación con el orificio cervical interno.(1) Debe realizarse una evaluación cualitativa del volumen de líquido amniótico y reportarlo como normal, disminuido o aumentado. (1) Ver protocolo sugerido de reporte ecográfico Anexo 1. Dentro de la biometría básica incluimos las siguientes mediciones: A. DIAMETRO BIPARIETAL (DBP) (Imagen 1): (7) Estructuras anatómicas visualizadas: ‐ ‐ ‐ ‐ ‐ ‐ Corte axial a través de a cabeza fetal a nivel de los talamos. Visualización simétrica de los talamos. Angulo de isonación ideal de 90° Apariencia ecográfica simétrica entre ambos hemisferios. Eco continuo en la línea media interrumpido por el cavum del septum pellucidum. Cerebelo no debe ser visualizado. Figura 1. DBP y CC 34 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Colocación de los calipers: Para efectos de este libro se considera la medida desde tabla externa a tabla interna en la parte más ancha del cerebro pero perpendicular a la línea media. (Ver figura 1). Cuando se evidencian alteraciones de la forma craneal como: dolicocefalia (cierre prematuro de la sutura sagital da lugar a restricción del crecimiento lateral de la cabeza, resultando anormalmente larga y estrecha) y braquicefalia (cierre prematuro de la sutura coronal,con aplanamiento de la frente y acortamiento anteroposterior),se considera la circunferencia cefálica una medida más confiable. (14) Imagen 1 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 B. Circunferencia cefalica: Imagen 2 Las estructuras anatómicas visualizadas deben ser las mismas que las descritas para la toma del diámetro biparietal (Figura 1) (7) Colocación de los calipers: Cuando el equipo tiene la capacidad de medida de elipse de debe realizar la medida mediante colocación del caliper alrededor del borde externo hiperecogénico del hueso. (Ver figura 3). Si el equipo no cuenta con esta función se puede realizar el cálculo a partir del DBP y el diámetro occipito frontal (DOF medido desde el extremo distal de la calota hasta el otro extremo distal de la misma)(14) usando la siguiente fórmula: CC: 1.62 X (DBP + DOF) Imagen 2, Cortesia Dr Alviar IMI 2011 Capítulo 3 C. 35 Circunferencia abdominal: (7) Imagen 3 Estructuras anatómicas visualizadas: ‐ ‐ ‐ ‐ ‐ Corte transversal a través del abdomen fetal (tan circular como sea posible). Vena umbilical a nivel del seno portal Burbuja estomacal visualizada. Riñones no deben ser visualizados. 1 costilla completa Figura 2 Circunferencia Abdominal Colocación de los calipers (figura 2): Esta circunferencia debe ser medida como elipse cuando se dispone del equipo por la superficie externa de la línea de la piel abdominal, o también se puede realizar a partir del diámetro abdominal antero-posterior (DAAP) y el diámetro abdominal transverso (DAT), (Ver figura 4). Para la realización de la medida del DAAP los calipers deben ser ubicados en los bordes externos de las líneas de la piel, pasando por la espina del cuerpo vertebral. La circunferencia puede ser calculada usando la fórmula: AC: π (DAAP + DAT)/2 = 1.57 (DAAP + DAT) Imagen 3 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 36 D. Longitud de la diafisis del femur: (7) Imagen 4 Estructuras anatómicas visualizadas: ‐ ‐ ‐ Visualizar claramente la diáfisis con los dos extremos de la metafisis osificada. En su longitud mayor. Angulo de isonación recomendado es de 90 ° Figura 3. Longitud de fémur Colocación de los calipers (Figura 3): Cada caliper debe ser ubicado donde termina la diáfisis osificada sin incluir la epífisis femoral si esta es visible y evitando las espuelas triangulares de los extremos que pueden dar un incremento falso de la longitud. Imagen 4 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 E. Peso fetal estimado: La estimación del peso fetal se puede hacer a partir de las medidas biométricas básicas (DBP, CC, CA y LF), mediante formulas y nomogramas que combinan estos parámetros. Entre estas formulas tenemos las de Hadlock descrita en 1984, y una de las mas ampliamente usadas, teniendo en cuenta cual o cuales parámetros biométricos se han de usar, para términos de este texto recomendaremos el uso del CA y LF: Capítulo 3 37 Logaritmo 10 PFE: 1.304 + 0.05281 (CA) + 0.1938 (LF) – 0.004 (CA) (LF) (14) Actualmente se utilizan las tablas elaboradas por Hadlock, las cuales pueden tener una variación del peso fetal estimado con el real de un 15% - 25 %, de acuerdo al número de parámetros biométricos empleados. (14) El valor del PFE nos sirve para realizar una aproximación a las alteraciones del crecimiento fetal, cuando se compara con los percentiles según la edad gestacional, definiendo como pequeño para la edad gestacional a aquellos con PFE menor a percentil 10, y restricción del crecimiento intrauterino a PFE menores al percentil 3, junto con la valoración hemodinámica fetal, la cual permitirá la clasificación y manejo de la patología, tema que será desarrollado en el capitulo de medio ambiente fetal. F. Valoración de liquido amniotico: Puede ser valorado subjetivamente o usando medidas ecográficas. La valoración subjetiva no es inferior a la medida hecha ecográficamente por lago único e Índice de líquido amniótico. (Guías del ISUOG), en el capítulo de Medio ambiente fetal se explicara. La valoración anatómica detallada de cada uno de los segmentos corporales fetales, se desarrollará en la parte inicial de los capítulos de valoración anatómica anormal; definiendo la normalidad y desarrollando también las patologías fetales frecuentemente encontradas. Ver anexo 1 de: 1. Reporte ecográfico y lista de chequeo Tamizaje genético de segundo trimestre: Durante la realización de la ecografía de segundo trimestre se pueden hallar cambios ecográficos que pueden sugerir síndromes genéticos; en esta edad gestacional es cuando se evidencia la mayor cantidad de defectos anatómicos que de acuerdo a la severidad, si son únicas, o asiladas se considerara la realización de cariotipo en pro de buscar diagnostico pues puede ser un defecto corregible por cirugía intrauterina descartando una cromosomopatía subsecuente, por otro lado pueden ser tan severas e incluso incompatibles con la vida. (6) Las anormalidades fetales menores o los marcadores blandos son comunes y no usualmente están asociados a mal pronóstico, a menos que se asocien a defectos cromosómicos subyacentes. La realización de cariotipos ante la presencia de marcadores blandos puede implicar un incremento en términos de costo y riesgo de perdidas gestacionales; por lo cual se usa la estimación personal del riesgo para cromosomopatías, contando con el riesgo establecido en el tamizaje de primer trimestre que será multiplicado por el LHR especifico del marcador blando(6), permitiendo un incremento adicional del 6 % en la tasa global de detección de cromosomopatías a la del primer trimestre y un 1.2 % adicional de falsos positivos. (6) 38 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Tamizaje sérico del Segundo trimestre: Se han propuesto varios modelos matemáticos de tamizaje: A. Test integrado realizado en el primer trimestre (TN y PAPP-A) con la realización de Alfa feto proteína, Estradiol no conjugado, fracción libre de BhCG e inhibina combinando los resultados que arrojaran las pacientes de alto riesgo que justifiquen la realización del cariotipo.(6) B. Un tamizaje escalonado donde todas las pacientes tienen TN, BhCG libre y PAPP-A en el primer trimestre con riesgo intermedio o bajo, en el segundo trimestre se les realiza AFP, estradiol no conjugado, fracción libre de BhCG e inhibina y si los resultados combinados se convierten en alto riesgo será llevada a realización de cariotipo. (6) C. Tamizaje de contingencia es similar al realizado en el escalonado con la diferencia que las únicas que serán llevadas a tamizaje sérico serán las de riesgo intermedio en el tamizaje del primer trimestre. Las características ecográficas de las aneuploidias más frecuentes: a. Trisomia 21: Defectos cardiacos, atresia duodenal, hipoplasia nasal, pliegue nucal incrementado, focos ecogénicos intracardiacos, intestino hiperecogenico, hidronefrosis leve, acortamiento del fémur, signo de la sandalia y clinodactilia o hipoplasia de la falange media del quinto dedo. (6) b. Trisomia 18: Craneo en forma de fresa, quistes del plexo coroideo, ausencia del cuerpo calloso, mega cisterna magna, labio y paladar hendido, micrognatia, edema nucal, defectos cardiacos, hernia diafragmática, atresia esofágica, exoftalmos, arteria umbilical única, anormalidades renales, intestino ecogenico, mielomeningocele, RCIU, acortamiento de las extremidades, aplasia radial, superposición de dedos, pies equinovaros o en mecedora. (6) c. Trisomia 13: Holoprosencefalia, microcefalia, anormalidades faciales, anormalidades cardiacas, hiperecogénicos y aumentados de tamaño, onfalocele y polidactilia postaxial. (6) d. Síndrome de Turner: Higromas quísticos grandes, edema generalizado, derrame pleural leve y ascitis, defectos cardiacos y riñón en forma de herradura que se sospecha por la aparición de hidronefrosis bilateral leve e. Triploidía: Cuando la contribución doble es paterna, existe una placenta molar y es raro que la gestación progrese de las 20 semanas. Cuando la contribución doble es materna, la placenta es delgada pero con una consistencia normal y la gestación puede llegar al tercer trimestre. El feto presenta una restricción de crecimiento severa, ventriculomegalia leve, micrognatia, defectos cardiacos, mielomeningocele, sindactilia o dedo de autoestopista. Capítulo 3 39 3.1 Marcadores blandos Corresponden a hallazgos del examen por ultrasonido obstétrico; variantes de lo normal que, pese a no ser deformativos, están asociados a un mayor riesgo de aneuploidía fetal, malformaciones anatómicas y restricción del crecimiento intrauterino (8). El hallazgo de los marcadores blandos permiten una sospecha aneuploidias mediante el hallazgo ecográfico de: diagnostica de - Anormalidades estructurales hasta en un 25 %. - Anormalidades No estructurales (Marcadores Blandos) hasta en un 50 %. 1. Pliegue nucal: Corresponde al engrosamiento de la piel, por edema, se toma en un plano occipito bregmático a nivel del cerebelo.(9) Debe ser medido del borde externo del occipital al borde externo de la piel. Valor normal hasta 5 mm (16-18 semanas). (Imagen 6) Cuando se encuentra engrosado se recomienda una valoración cardiaca fetal. Tiene un LR + 17 Para Síndrome de Down, por lo cual se recomienda Cariotipo. Imagen 6. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 40 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 2. Huesos Largos Cortos (Acortamiento rizomélico de las extremidades): Corresponde al acortamiento de los huesos fémur y húmero; El fémur se considera acortado cuando la medida hecha/medida esperada es ≤ 0,91, y el húmero ≤ 0.89, tienen un LR positivo de 2.7 y 7.5 respectivamente.(9) (Imagen 7). Al encontrar algún hueso corto es necesario evaluar el resto del sistema esquelético, ya que si existe compromiso de todos los huesos largos hay que descartar una displasia ósea y considerar seguimiento. (9) Imagen 7. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 2. Intestino ecogénico: Corresponde a la presencia de hiperecogenicidad en el intestino comparándolo con el hueso ilíaco adyacente, utilizando un transductor de 5Mhz y bajando la ganancia al punto de ver solamente el hueso (10)(8). (Imagen 8). La ecogenicidad grados 2 y 3 debe llevar a efectuar una evaluación detallada de la morfología fetal en búsqueda de anomalías estructurales, de otros marcadores de aneuploidía y de signos de obstrucción o perforación intestinal. Tiene un LR positivo de 6.7 (10) Clasificación (Slocking et col): Grado 1: Ecogenicidad menor que la del hueso. Grado 2: Ecogenicidad es igual a la del hueso. Grado 3 es mayor a la del hueso Capítulo 3 41 Se puede encontrar en Fetos normales, fetos con aneuploidía, RCIU, sangrado intraamniótico (abruptio de placenta posterior a procedimientos invasivos), fibrosis quística, infecciones congénitas (CMV, toxoplasma, herpes, varicela), talasemia, parvovirosis, y con trisomías 13, 18 ó 21. Imagen 8. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 3. Foco ecogénico intracardiaco (Imagen 9): Corresponde a áreas de ecogenicidad comparables a las del hueso en la región de los músculos papilares, en cualquiera de los ventrículos (1,3, 6-9). El foco debe ser visto desde varios ángulos para asegurarse de que no corresponde con reflecciones especulares de los músculos papilares. Se encuentran en cerca del 1,5 al 4% de los embarazos normales. Tiene un LR positivo de 1.8 (11) 42 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional El foco ecogénico intracardiaco como hallazgo incidental en una mujer menor de 35 años no amerita estudio genético. La presencia de dicho hallazgo junto a otro marcador blando o a una anomalía estructural justifica un estudio genético (11) Imagen 9. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 4. Quistes de los plejos coroideos (Imagen 10): Corresponde a una lesión anecóica bien circunscrita dentro del plejo coroideo que mide 3 mm o más. Es vista en cerca del 1 al 2,5% de los embarazos normales como hallazgo aislado, y no tiene significado patológico. (11) Pueden ser unilaterales, bilaterales o múltiples. Se observan en el plano axial de la cabeza dentro de los ventrículos laterales. Cuando se asocian a otros hallazgos estructurales constituyen un alto riesgo para trisomía 18. En este caso hay que hacer énfasis en la evaluación morfológica de las manos. El Quiste de plejo coroideo no se ha asociado con riesgo para trisomía 21.(11). Capítulo 3 43 Imagen 10. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 5. Ventriculomegalia (Imagen 11): Es definida como un atrio entre 10 y 15 mm, se debe realizar la medida en un plano transventricular con los parámetros mencionados por la ISUOG (remitase a capitulo de valoración de SNC), se asocia con una relación inversa ya que la leve tiene más riesgo de alteraciones cromosómicas, tiene un LR positivo de 9. (11). También puede tener asociaciones con otras alteraciones no aneuploides, alteraciones en la circulación del líquido cefalorraquídeo como la obstrucción dentro del sistema ventricular, trastornos de la migración neuronal, procesos destructivos del SNC o malformaciones de éste tales como agenesia del cuerpo calloso y anomalías vasculares.(12) Imagen 11. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 44 6. Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Pielectasias (Imagen 12): Corresponde a la dilatación de la pelvis renal, es un hallazgo común en la ecografía de segundo trimestre, con una incidencia del 0,3 al 4,5%. (11). Se deben evaluar los riñones fetales como parte del tamizaje ecográfico en las semanas 16 a 20, y si se visualiza dilatación de la pelvis hay que medir el diámetro anteroposterior. Todos los fetos con una pelvis renal ≥ a 5 mm requiere una ecografía en el período neonatal, y aquellos con pelvis renal > 10 mm, control ultrasonográfico en el tercer trimestre. El hallazgo aislado de pielectasias no necesita cariotipo. Tiene un LR positivo de 1.5 (9) Imagen 12. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 7. Arteria umbilical única(Imagen 13): Corresponde a la presencia de una sola arteria en el cordón umbilical y alrededor de la vejiga. Se recomienda la evaluación de los vasos del cordón por ser considerado parte de la ecografía obstétrica que se realiza de las 16 a 20 semanas; este hallazgo exige una evaluación detallada de toda la anatomía fetal, incluyendo riñones y corazón, mas no justifica la realización de cariotipo; puesto que su correlacion con anormalidades citogenéticas es del 17 %(9) (14). Capítulo 3 45 Imagen 13. Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 8. Ausencia o hipoplasia del hueso nasal (Imagen 14): La hipoplasia del hueso nasal ha sido reconocida como una característica posnatal de la trisomía 21. El hueso nasal se busca en un corte sagital de la cara en donde se observe el maxilar superior sin que se vea el hueso cigomático. La ausencia del hueso nasal o una medida por debajo del percentil 2,5 se considera significativa. El hallazgo de hipoplasia o ausencia del hueso nasal es un marcador para trisomía 21, en tanto que un hueso nasal normal reduce significativamente el riesgo. El LR de este hallazgo depende de la raza; el promedio es de 51, pero en caucásicos es tan alto como de 132, y en africanos, de 8,5. El LR negativo es de 0,39 para caucásicos y de 0,27 para afrocaribeños. La hipoplasia nasal no se ha asociado con otras aneuploidías.(13) 46 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 14. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, Dr Arenas 2011 Conclusion: Durante la realización del tamizaje prenatal para cromosomopatías durante la gestación; el tamizaje de segundo trimestre juega un papel muy importante, puesto que con los estudios se ha evidenciado una mejoría en la sensibilidad y la especificidad en las tasas de detección cuando se realiza la combinación de los marcadores blandos. Se desarrollo una escala sonográfica para determinar el riesgo de síndrome de Down, de acuerdo a los hallazgos ecográficos teniendo puntaje de 2 las malformaciones estructurales mayores y el engrosamiento de la translucencia nucal. Un puntaje de 1 para los huesos largos cortos, intestino hiperecogénico, foco hiperecogenico intracardiaco y la pielectasia renal. (10) Cuando se tiene un valor mayor a 2; tiene una tasa de detección del 76 % para trisomía 21, con un 6 % de falsos positivos, un valor de 1 incrementa la sensibilidad hasta un 83 %, mejorando las tasas generales de detección. (11) Bibliografia 1. Cargill Y, Morin L, Content of a Complete Routine Second Trimester Obstetrical Ultrasound Examination and Report, J Obstet Gynaecol Can 2009;31(3):272–275. 2. Ecker JL, Green MF. Indications for diagnostic obstetrical ultrasound examination. UpToDate [web site] Version 15.1, December 2006. Capítulo 3 47 3. ACOG Committee on Practice Bulletins. ACOG Practice Bulletin, No. 58, October 2008. Ultrasonography in pregnancy. Obstet Gynecol 2004;104(6):1449–58. 4. Souka AP, Pilalis A, Kavalakis I, Antsaklis P, Papantoniou N, et al. Screening for major structural abnormalities at the 11- to 14- week ultrasound scan. Am J Obstet Gynecol 2006;194(2):393–6. 5. Tjepkema M. Adult obesity in Canada: measured height and weight. Statistics Canada, 82–620-MWE/2005001. 6. Nicolaides K, Screening for fetal aneuploidies at 11 to 13 weeks, Prenat Diagn 2011 7. Guias de la ecografia del ii trimester. 8. American College of Obstetrics and Gynecology. ACOG Practice Bulletin núm. 77. Screening for fetal chromosomal abnormalities. Obstet Gynecol 2007. 9. Van der Hof M, Douglas WR. Fetal Soft Markers in obstetric ultrasound. Journal of obstetrics and Gynaecology of Canada 2005: 592-612. 10. SoGc clinical practice Guideline. Prenatal Screening for Fetal Aneuploidy. J Obstet Gynaecol Can 2007; 29(2): 146-161. 11. Arenas, J, Ramirez J, Marcadores, diagnostico prenatal con ultrasonido, Texto Obstetricia integral siglo XXI, Universidad Nacional de Colombia, 2010. 12. International Society of Ultrasound in Obstetrics & Gynecology Education Committee. Sonographic examination of the fetal central nervous system: guidelines for performing the “basic examination” and the “fetal neurosonogram”. Ultrasound Obstet Gynecol 2007; 29: 109-116 13. Shipp tD, Benacerraf BR. Second trimester ultrasound screening for chromosomal abnormalities. Prenat Diagn 2002; 22: 296-307. 14. Callen P, Ecografía obstetricia y ginecología, El sevier, 2009. 4. Gestación múltiple La gestación múltiple, se define como aquella en la que se desarrollan simultáneamente 2 o más fetos [1], y supone una incidencia de 16 X 1000 nacidos vivos (98% corresponde a gestación gemelar y menos del 2% a gestaciones triples), las cuales han aumentado en los últimos años debido al uso de técnicas de fertilización asistida [2]. El diagnostico temprano de la gestación múltiple es de vital importancia ya que este, aumenta el riesgo de complicaciones maternas (anemia, trastornos hipertensivos del embarazo, distres respiratorio, cesárea, entre otros), y fetales (aborto, muerte fetal in útero, parto pretérmino, restricción de crecimiento de uno o ambos fetos, etc.) [2,3]. La determinación de la coriocinicidad y amnionicidad nos determina qué tipo de vigilancia fetal se requiere. Imagen 1. A. gestación múltiple (trillizos), las flechas señalan el numero de membranas amnióticas; B. gestación gemelar, se observan 2 sacos gestacionales cortesía Dr. Arenas/Universidad Nacional de Colombia/consultorio Yopal Embriología Existen dos mecanismos de presentación, la fecundación determinando si es una gestación bicigótica o monocigótica. de uno o más óvulos, 50 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Gestación Bicigótica Representa el 66% de las gestaciones gemelares y su génesis se debe a la fecundación de dos óvulos por dos espermatozoides, generando dos embriones diferentes genéticamente (mellizos) , pueden ser del mismo o de diferente género , cada uno de ellos con su placenta y su bolsa amniótica [1,4 ], por lo tanto las comunicaciones vasculares y complicaciones circulatorias no se presentan o son muy poco frecuentes. [3] Gestación monocigótica Corresponde al 33% de las gestaciones gemelares, ocurre luego de que un espermatozoide fecunda un ovulo, el cigoto presenta mitosis continuas en el proceso de segmentación, en este momento puede fragmentarse en 2 masas celulares totipotenciales y cada mitad puede generar un embrión, según el momento donde ocurra dicha fragmentación puede observarse las diferentes características de los gemelos monocigóticos. a. Bicoriónicos biamnióticos Se presenta cuando la fragmentación ocurre en fase de mórula, en las primeras 72 horas luego de la fecundación. Por lo tanto se caracteriza por presentar 2 embriones con placentas y bolsas amnióticas independientes. Constituyen 1/3 de los gemelos monocigóticos [1,3,4]. Imagen 2. Gestación donde se observan dos sacos gestacionales y dos vesículas vitelinas (puede ser monocigótica o dicigótica). Cortesía Dr. Arenas/Universidad Nacional de Colombia/OyG b. Monocoriónicos biamnióticos Cuando la fragmentación ocurre entre los días 4 y 8 posfecundación (en fase de blástula), caracterizándose por presentar dos embriones con una sola placenta y dos bolsas amnióticas, se presenta en 2/3 de los casos [1,3,4]. Capítulo 51 c. Monocoriónicos monoamniótico La fragmentación ocurre entre el día 9 y 13 posfecundación (en fase de gástrula), luego de la formación de la cavidad amniótica, por lo tanto se observaran 2 embriones compartiendo la placenta y la bolsa amniótica. Corresponde solo al 1% de las gestaciones gemelares [1,3,4,7]. d. Siameses La fragmentación se presenta luego del día 13 posfecundación, por lo que ocurren separaciones incompletas, dando lugar a los gemelos unidos. Imagen 3. Gemelos no amnióticos, con partes fetales en contacto, sin membrana Determinación la corionicidad y la amnionicidad divisoria cortesía Dr.de Arenas/Universidad Nacional de Colombia/hospital Engativá La identificación temprana y precisa de la edad gestacional, la corionicidad y la amnionicidad es de vital importancia, para la evaluación y seguimiento de una gestacional múltiple. La determinación de la corionicidad debería realizarse idealmente en primer trimestre ya que es el factor pronóstico más importante en las gestaciones múltiples [2,8]. Corionicidad Se determina idealmente ultrasonograficamente antes de las 14 semanas, con los siguientes hallazgos. 1. Numero de masas placentarias La presencia de una masa simple podría indicar una gestación monocorial, mientras la presencia de 2 masa placentarias indica gestación dicorionica, sin embargo hay que tener en cuenta que en ocasiones las masas coriales cercanas se pueden fusionar dando la falsa apariencia de gestación monocorial, sí la evaluación ecográfica se realiza luego de semana 14 de gestación [2,4,11]. 52 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 2. El signo lambda y el signo de la T Cuando existe una proyección triangular del tejido placentario que se extiende a lo largo de la superficie coriónica, marcando el sitio de separación de los tejidos placentarios se conoce como signo del pico o lambda (λ) determinando una gestación bicoriónica [8]. Cuando existe una gestación monocoriónica, hay ausencia de este pico de separación y se observa una simple división de las membranas amnióticas adyacente al corion, conocido como signo de la T [4,8]. Imagen 4, signo Lambda en gestación gemelar bicoriónica de 16 semanas Cortesía Dr. Arenas/universidad nacional de Colombia /OyG 3. Membranas de separación intergemelar Si el espesor de la membrana amniótica es mayor a 2 mm indica gestación bicoriónica, por el contrario si el espesor de la membrana amniótica es menor de 2 mm indica gestación monocorial, el valor predictivo positivo de estos hallazgos es del 90% , para determinar la amnionicidad sí se realiza la ecografía en primer trimestre. Si no se identifica membrana de separación puede deberse a una gestación monoamniótica, otras posibilidades es que la membrana exista, pero por su delgadez no sea observable o que existe un oligoamnios severo en uno de los gemelos (stuck twin), que impida ver la membrana amniótica divisoria [8]. Sexos discordantes Los fenotipos diferentes entre gemelos indican gestación dicigótica, por lo tanto se observaran 2 placentas y 2 sacos amnióticos. Sin embargo la concordancia de los fenotipos no indica gestación monocigótica [8,11]. Capítulo 53 Determinación de la edad gestacional: La edad gestacional se determina idealmente con la fecha de la última regla igual forma que en las gestaciones única, sin embargo en ocasiones no se dispone de esta información o es poco confiable por las variaciones biológicas que generalmente ocurren, por lo tanto es recomendable realizar un estudio ecográfico cuando los fetos tengan una longitud cráneo-caudal entre 45 a 84 mm (aproximadamente entre la 11 y las 14 semanas).[2] Al realizar el estudio ecográfico durante el segundo trimestres (entre 18 a 22 semanas), disminuye la precisión de la edad gestacional real entre 7 y 10 días[8], debido a que se debe usar unas combinaciones de parámetros (diámetro biparietal, circunferencia cefálica, circunferencia abdominal, longitud del fémur),de esta forma podremos realizar vigilancia de crecimiento fetal y evaluar las discordancia del crecimiento entre gemelos. Evaluación de anormalidades genéticas y estructurales Las anomalías cromosómicas son más frecuentes en embarazos múltiples y el riesgo aumenta a medida que aumenta la edad materna, Rodis y col en 1990 calcularon el riesgo de aneupolidía tanto en gestaciones dicigóticas como monocigóticas, concluyendo que una mujer de 31 años con gestación gemelar presenta el mismo riesgo de aneupolidía que una paciente de 35 años con una gestación única. En relación a las anomalías estructurales los gemelos Monocoriónicos tienen un riesgo de 1,2 a 2,1 veces mayor de anomalías anatómicas graves y 4,1 veces más riesgo de anomalías anatómicas leves que gestaciones únicas, entre los defectos más frecuentes se encuentran (defectos cardiacos, del tubo neural, cerebrales, hendiduras faciales, gastrointestinales y de pared abdominal anterior, entre otros)[10,11] . Se recomienda realizar de rutina el tamizaje de aneupolidía en primer trimestre, usando la medición de la transluncencia nucal y la edad materna en gestaciones gemelares y calcular el riesgo independiente para cada feto, el análisis de marcadores serológicos no se debe usar de rutina, pero puede ser útil en disminuir la tasa de falsos positivos [2,11]. Debido a la alta tasa de falsos positivos y no estandarización de los resultados, no existe evidencia que apoye el uso de marcadores blandos ecográficos, ni serológicos para realizar screening de cromosomopatía en segundo trimestre en gestaciones gemelares [11, 12]. Por otra parte en el estudio y evaluación de anormalidades estructurales se recomienda realizar una ecografía de detalle anatómico entre la semana 18 y 22 de gestación, en todas las gestaciones gemelares [2, 11,12]. - Complicaciones propias de gestaciones gemelares 54 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Evaluación de crecimiento fetal En general el potencial de crecimiento en gestaciones gemelares es menor que en gestaciones únicas, tanto en gestaciones bicoriónicas como Monocoriónicas, sin embargo en esta última se suele observar con más frecuencia, ya que una sola masa placentaria es menos eficaz para entregar nutrientes a dos fetos. La tasa de crecimiento en una gestación múltiple, en el primer e inicio de segundo trimestre es paralela a la de gestaciones únicas, sin embargo esta tasa cae ostensiblemente en el tercer trimestre de la gestación [3, 4, 11]. El colegio americano de ginecólogos y obstetras (ACOG), propuso idear unas tablas para estimar el crecimiento fetal en gestación gemelar, por su menor potencial de crecimiento y así evitar el sobrediagnóstico de restricción de crecimiento fetal, en gestaciones que estén evolucionan normalmente, la literatura médica sugiere que se deben seguir usando las mismas tablas para gestaciones únicas, mientras no exista una evidencia fuerte que avale el uso de tablas de peso para gestaciones gemelares[4, 10]. Se recomienda realizar una evolución seriada del crecimiento fetal, luego de semana 18 a 24 para detectar tempranamente, alteraciones en crecimiento fetal, restricción de crecimiento fetal selectivo [2]. Restricción de crecimiento selectivo La determinación del crecimiento fetal discordante es importante, debido a que se asocia con aumento de la mortalidad perinatal en gestaciones gemelares Monocoriónicas. Clásicamente se ha definido como la restricción de crecimiento en uno de los fetos, ocurre por reparto asimétrico del flujo placentario, donde uno de los fetos dispone de una superficie placentaria muy inferior al otro. La incidencia es difícil de precisar por la no estandarización del diagnostico, en las diferentes publicaciones se considera una tasa de 11.7% al 25% [4,5,12,13]. Criterios Diagnósticos - Diferencia superior al 25% en el peso estimado fetal entre los gemelos Monocoriónicos - Peso fetal estimado inferior al percentil 10 en uno de los gemelos - Ausencia de signos de transfusión gemelo-gemelo - Diferencia mayor a 20 mm en la medición de la circunferencia abdominal en uno de los fetos [3,5,12,13]. Diagnóstico diferencial El principal diagnóstico diferencial es el síndrome de transfusión gemelo-gemelo donde existe una secuencia polihidramnios y policitemia en uno de los gemelos y Capítulo 55 oligohidramnios y anemia en el otro gemelo, a pesar que pueda existir discordancia en el peso estimado fetal mayor del 25%, el diagnostico lo establece la secuencia polihidramnios/oligoamnios[4,5,12,13]. El manejo debe realizarse en un centro de tercer nivel, que cuente con una unidad de medicina materna fetal, sin embargo se sale del objetivo presente texto. Pronóstico: La gravedad de la restricción selectiva se determina según los hallazgos en el flujo doppler de la arteria umbilical del feto con restricción de crecimiento. existen tres patrones vasculares: tipo I flujo diastólico normal en la arteria umbilical del feto restringido, indica buen pronostico y solo requiere seguimiento; tipo II flujo diastólico reverso o ausente constante en la arteria umbilical, las características de esta onda no cambia en días ni en semanas, la secuencia de deterioro hemodinámico suele ocurrir muy lentamente; tipo III hay flujo diastólico ausente o reverso en la arteria umbilical de forma intermitente, el curso clínico es impredecible con una mortalidad del feto restringido del 15 a 25% en forma súbita, además se evidencia aumento de la morbilidad (insuficiencia cardiaca en 30%, encefalopatía hipóxico-isquémica y leucomalacia en 15 a 30% de casos) [5,8,11,13]. Clasificación de RCIU selectivo según tipo de doppler umbilical del feto con RCIU y relación con patrón de anastomosis características. Tipo RCIU selectivo Tipo I Características Doppler de la arteria umbilical normal en ambos fetos, pueden existir anastomosis arterio-arteriales de pequeño tamaño El doppler de arteria umbilical en el feto donante se observa Tipo II con flujo reverso de la arteria umbilical de forma constante; indica anastomosis arterio-venosas y arterio-arteriales de pequeño y mediano tamaño Se evidencia flujo doppler reverso en la arteria umbilical de Tipo III forma intermitente, indica anastomosis de gran tamaño mayores de 2 mm Modificado de JM Martínez, E Gratacós[13] Síndrome de transfusión gemelo-gemelo Se presenta cuando existe la secuencia oligoamnios/anemia en uno de los gemelos y polihidramnios/policitemia en el otro gemelo, con o sin crecimiento fetal discordante, se debe a la presencia de anastomosis arteriovenosas profundas con flujo unidireccional en la placenta, luego un gemelo aporta una cantidad de su volumen sanguíneo (gemelo donante) y otro la recibe (gemelo receptor). El feto donante se vuelve anémico, hipovolémico, con restricción de crecimiento, la vejiga está colapsada por la disminución en la producción de orina, finalmente va a desencadenar oligoamnios y feto colapsado 56 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional contra la pared uterina (stuck twin). El feto receptor estará hipervolémico, vejiga distendida por aumento en la diuresis, polihidramnios y finalmente signos de falla cardiaca e hidrops [10,11,14]. Es una entidad con elevada mortalidad de uno o ambos gemelos cercana al 60-80%, las secuelas neurológicas de presentan en 50% de fetos afectados, afortunadamente se presenta solo en el 10% de las gestaciones monocoriales [10,14]. Criterios diagnósticos - Feto donante con oligoamnios ILA < 2 cm y vejiga colapsada - Feto receptor con polihidramnios ILA > 8 cm y vejiga distendida - Fetos del mismo sexo - Placentación monocorial (signo de de la T) La estimación de peso fetal discordante no hace parte de los criterios diagnósticos, aunque el feto donante muy frecuentemente presenta una restricción de crecimiento intrauterino [3,11,14]. Diagnóstico diferencial: El principal diagnostico diferencial a tener en cuenta es la restricción de crecimiento fetal selectivo, el cual se trato anteriormente. En ocasiones puede observarse discordancia importante entre lo líquidos amnióticos en los gemelos monocoriales, sin que cumplan criterios de síndrome de transfusión gemelogemelo, estos casos suelen ser formas precoces del síndrome que seguramente con el seguimiento completaran los criterios diagnósticos [14]. Pronóstico: Existen dos factores pronósticos importantes en el síndrome de transfusión gemelogemelo, uno de ellos es la edad gestacional de aparición, si se presenta antes de la semana 20 a 25 de gestación existe alto riesgo de morbilidad y mortalidad perinatal [3,14]. El otro factor pronóstico es el grado de compromiso hemodinámico, el cual se evalúa con la clasificación de Quintero. Clasificación de Quintero - Estadio I: Criterios de transfusión gemelo-gemelo con vejiga visible en feto donante - Estadio II: No se identifica vejiga en el feto donante Capítulo 57 - Estadio III: Alteración en las ondas de flujo doppler en ambos gemelos (ausencia o flujo diastólico reverso en arteria umbilical en feto donante y/o ausencia o reversión de la onda A en el ductus venoso). - Estadio IV: Hidrops fetal en uno o ambos fetos y signos de falla cardiaca en feto receptor - Estadio V: Muerte de uno o ambos gemelos En relación al manejo, el estándar de oro es la visualización fetoscopica y ablación con laser de las anastomosis placentarias lo cual se realiza en centros especializados. De esta forma se trata la etiología y se puede realizarse en cualquier estadio clínico; con este procedimiento la supervivencia de al menos uno de los fetos es cercana al 80% y de ambos fetos del 60% [3,13,14]. Síndrome de perfusión arterial reversa (secuencia TRAP) También denominado gemelo acardico, es un raro trastorno con una incidencia de 1 en cada 35,000 partos y 1 de cada 100 gestaciones monocoriales. Se presenta por la existencia una gran anastomosis placentaria arterio-arterial y veno-venosa, produciendo flujo placentario unidireccional hacia uno de los gemelos (gemelo donante) y el gemelo receptor recibe sangre arterial desoxigenada, proveniente de flujo reverso de su hermano [3, 9, 11]. El gemelo donante actúa como una bomba llevando flujo al feto receptor, como el flujo llega a nivel de los vasos iliacos, perfundiendo y desarrollando la parte inferior del tronco del feto receptor, sin formación de cabeza ni corazón (feto acardico acéfalo). Si no se logran identificar los polos gemelo acardico, se denomina acardico amorfo [3,4].El feto donante suele presentar alteraciones cardiacas entre ellas cardiomegalia e insuficiencia cardiaca, debido a que no solo debe suplir su circulación, sino también la del gemelo acardico[4]. Imagen 5. Izq. Flechas indican gemelo amorfo en ecografía en modo B. Der. Reconstrucción tridimensional de gemelo acardico. Cortesía Dr. Arenas/universidad nacional de Colombia /OyG El diagnóstico definitivo se realiza con estudios de flujo doppler color, donde se evidencie la perfusión arterial reversa del gemelo acardico [3]. 58 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional La mortalidad en general es del 55% al 75% y el pronóstico depende del compromiso hemodinamico del feto donante y del tamaño del feto acardico (receptor), si es mayor del 70% la morbimortalidad aumenta. El tratamiento es discutido Tan y col. En 2003 manejaron con oclusión de los vasos umbilicales del gemelo receptor con radiofrecuencia, reportando tasas de supervivencia de 74% a 90% del gemelo donante, aunque otros autores proponen el manejo expectante con vigilancia clínica el cual suele ser la mejor opción de manejo [3,11]. Gemelos unidos Ocurre por una segmentación tardía e incompleta del disco embrionario (luego del día 13 posfecundación). La incidencia de los gemelos unidos o siameses como se conocen comúnmente oscila entre 1 por cada 50,000 a 100,000 partos. No se conoce claramente el factor etiológico, aunque suele presentarse con más frecuencia en gestantes mayores de 40 años, otros factores implicados son agentes teratogénicos [3,4,8]. El diagnostico se realiza con una ecográfia en el primer trimestre, donde se visualiza: - Partes corporales fusionadas en gemelos monocoriales monoamnióticos, Aspecto bífido del polo fetal , Posición fija de los gemelos que persiste a pesar de movimientos maternos o estimulación externa. Cabezas y cuerpos de los gemelos que se observan al mismo nivel ecográfico Incapacidad de separar órganos fetales de los contornos de la piel de gemelo adyacente, Presencia de anomalías fetales entre otras [3,4,11]. Los gemelos unidos se clasifican de acuerdo con el área corporal donde existe la fusión, de acuerdo a si la duplicidad es completa e incompleta y a si el defecto es simétrico o asimétrico. Uniones simétricas Ventrales: - Cefalópagos: gemelos unión por la cabeza donde se observa dos cara fusionadas Toracópagos: gemelos unidos cara a cara desde el tórax hasta el ombligo Onfalópagos: gemelos unidos cara a cara desde el abdomen Isquiópagos: gemelos unidos desde el ombligo además comparten órganos de la pelvis. Laterales: - Parápagos: los gemelos se encuentran fusionados lateralmente compartiendo el pubis y uno de los sacros. Capítulo 59 Dorsales: - Craneópagos: cuando los gemelos se encuentran unidos por cualquier porción del cráneo, excepto la cara. Pigópagos: gemelos comparten la región perineal, sacrococcígea y en ocasiones medula espinal. Raquiópagos: gemelos están unidos dorsalmente compartiendo diferentes segmentos de la columna [3,4]. Uniones asimétricas -Feto parasito externo: se trata de un fenómeno muy raro donde un gemelo defectuoso desaparece parcialmente y algunos de sus tejidos sobrevivientes se adhieren y son vascularizados por el gemelo sano [4]. -Feto en feto: caso extremo donde el feto parasito malformado se encapsula en una membrana fibrosa y se incorpora en el interior de su hermano, recibiendo flujo sanguíneo de este. El diagnostico diferencial más importante es teratoma maduro [3,4]. Bibliografía Recari Elizalde, Lara González , fundamentos de obstetricia (sego) embarazo y parto gemelar, pag 401-414. 2007 1. National institute for health and clinical excellence (nice), clinical guideline 129 multiple pregnancy 2011. 2. Reyes Jaqueline, Goncalves Luis F, ecografía ginecología y obstetricia fleischer, ecografía en gestaciones múltiples, 2008 pag 559-592 3. Williams obstetrics, 23e chapter 39. multifetal gestation 4. A. Goncé, M. Muñoz, J. Martínez, e: Gratacós, assistència a l’embaràs i part de gestacions multiples, 2009 5. T. Díaz, S. Ladd, L. Mahsud-dornan, ultrasound obstet gynecol 2011; 38: 130–133. 6. Lucie Morin, Outremont kenneth ultrasound in twin pregnancies, j obstet gynaecol can 2011;33(6):643–656 7. Liesbeth L. Leonardo, Gucciardo Tim van Mieghem, monochorionic diamniotic twin pregnancies: natural history and risk stratification, fetal diagn ther 2010;27:121–133 60 8. Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Annegret Geipel, A. Christophe Berg, prenatal diagnosis and obstetric outcomes in triplets bjog: an international journal of obstetrics and gynaecology . May 2005. 9. Joaquín Santolaya, Revital Faro. Twins-twice more trouble? clinical obstetrics and gynecology volume 55, number 1, 296–306 2012. 10. Prenatal screening for and diagnosis of aneuploidy in twin pregnancies, j obstet gynaecol can 2011;33(7):754–767. 11. Martínez J, Gratacós E. Retraso de crecimiento intrauterino selectivo (cirs), 2011. 12. Martínez J, Gratacós E. Síndrome de transfusión feto-fetal severo (stff). 2011. 5. Valoración de la anatomía Anormal 5.1 Cara y cuello Valoracion de cara: La valoración de cara y el cuello hace parte de la ecografía de rutina, donde se requiere la identificación de anomalías mayores y menores, pues permite la orientación de desordenes generalizados como aneuploidias y síndromes fetales, modificando el resultado obstétrico. (2). Las anormalidades no letales de la cabeza y el cuello pueden terminar en obstrucción de la vía aérea requiriendo maniobras reanimadoras al nacimiento, (2). Desde edades gestacionales tempranas como las 12 semanas podemos identificar frente, orbitas, nariz, labios, mandíbula (Imagen 1), orejas y translucencia nucal, siendo identificados los detalles anatómicos con éxito desde las 14 – 16 semanas según la vía de abordaje (Imagen 2) (4) Imagen 1. Cortesia Dr Alviar IMI – Sonogyn 2009 62 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 2 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Se deben realizar cortes axiales, coronales y sagitales de la cara y el cuello. En la vista axial se debe valorar la cabeza fetal a través de un plano transcerebelar que permite valorar pliegue nucal (Imagen 3) (5); además de cortes transversales de la cabeza en sentido caudal, que permite la evaluación de las orbitas, tamaño, distancias biorbiorbital e interorbital, visualización del cristalino, además del puente nasal, la nariz, el labio superior, paladar anterior, la lengua dentro de la cavidad bucal, labio inferior y mandíbula. (4) Imagen 3 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 63 Los cortes coronales contribuyen a la información detallada de la anatomía facial respecto a las orbitas, nariz, labios y mentón.(Imagen 4) (2) Imagen 4 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Con los cortes medio sagitales, es posible obtener la visualización del perfil fetal, valorando la presencia de hipoplasia o ausencia del hueso nasal (Imagen 5), como marcador de trisomia 21.(2). También permite la detección de condiciones como micrognatia, prominencias frontales, además de brindar información en el estudio de los labios leporinos; el uso de la ecografía 3 D, permite una buena valoración sin impacto en las tasas de detección. (Imagen 6). Imagen 5 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 64 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional En los cortes parasagitales tangenciales a la bóveda craneal permite la visualización y medición de las orejas, siendo las de implantación baja difíciles de visualizar. Imagen 6 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Anormalidades Faciales: En gestaciones de bajo riesgo, las malformaciones faciales corresponden al 0.2 %; con tasas de detección de 72 %; cuando se encuentran asociadas a otras malformaciones son detectadas hasta en un 100 %; en cambio cuando se encuentran aisladas, las tasas de detección son del 50 % (6). En las pacientes con alto riesgo se encuentra una prevalencia de malformaciones faciales del 8 %, con tasas de detección del 78 %. (7) Con las malformaciones craneofaciales es importante diferenciar el punto entre alteraciondes del desarrollo letales vs no letales, ya que sugieren estudios adicionales como el cariotipo, que permitan un diagnostico prenatal definitivo y con ello la conducta obstétrica pertinente. (7) 1. Ojos y orbitas: Usando la ecografía TV los ojos pueden ser visualizados desde las 12 semanas de gestación, el cristalino y los parpados pueden ser visibles desde las 14 semanas. Capítulo 65 El diagnostico prenatal de la microftalmia y la anoftalmia (unilateral o bilateral) es basada en la demostración de la disminución del diámetro ocular, o ausencia de un ojo, estas anormalidades son frecuentemente asociadas a síndromes genéticos. (2) El diagnostico de cataratas en útero ha sido particularmente hecho en fetos con alto riesgo de alteraciones genéticas, y su identificación ecográfica es cuando el lente es completamente ecogénico, hay imagen de doble anillo, que correspondería a la catarata. Masas Orbitarias: Pueden presentarse como orbitarias y periorbitarias, estas ultimas como el dacriocistocele (Quiste del canal lacrimal), y lesiones menos comunes como los encefaloceles, hemangiomas y teratomas. Con incidencias de 1:15.000 a 1;34000 (2) 1. Dacriocistocele: corresponde a una entidad aislada benigna generalmente, con apariencia de quiste simple localizado típicamente antero medial a un globo ocular normal, debe ser diferenciado de un cefalocele, causando desplazamientos inferolaterales del globo ocular con hipertelorismo secundario. 2. Hemangioma: se presenta como una masa solida homogénea que puede comprometer extensiones amplias de la cara y el cuello, se visualizan focos hipo ecoicos que pueden estar presentes dentro de la masa, con presencia de flujo sanguíneo a la colocación del doppler pulsado representando los canales vasculares. Los hemangiomas pueden ser exofiticos o sésiles pero no producen alteración de la anatomía ósea. 3. Hipotelorismo e Hipertelorismo: Las medidas fetales de los diámetros oculares (DO), interoculares (DIO), y el diámetro binocular (DBO) pueden ser obtenido en cortes transversales con visualización de las orbitas y comparados con valores normales. El hipotelorismo se refiere a la disminución de la distancia interocular, usualmente se puede asociar con malformaciones cerebrales severas como la holoprosencefalia, siendo esta la más frecuente, también se puede asociar a anormalidades cromosómicas como la trisomia 13, teratogenos como la hidantoina, labio y paladar hendido, displasia craniotelecefalica, síndrome de Crouzon, secuencia de Digeorge, entre otros. El hipertelorismo se define como un incremento en el DIO, puede ser debido a la detención primaria de la migración como parte del síndrome de hendidura facial mediana o secundarios a síndromes como craniosinostosis, disostosis acrofrontofacionasal, 66 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional síndrome de Apert, displasia campo mélica, labio y paladar hendido, encefalocele frontal, anormalidades cromosómicas como deleción 4p, deleción 11 q, tetrasomía 12 p, trisomía 10, trisomía 18 y la exposición a teratogenos como carbamacepina, hidantoina, isotretinoine y warfarina. El síndrome de hendidura facial mediana o displasia frontonasal, tiene un amplio espectro de presentaciones, siendo la forma más severa: ‐ ‐ ‐ ‐ Ubicación lateral de los ojos Cráneo bifidum Hendidura en la línea media del hueso frontal y hueso maxilar, posiblemente asociado a encefalocele frontal, división y separación de las fosas nasales Hendidura mediana de labio y paladar. El espectro leve esta dado por hipertelorismo, gran raíz nasal y labio superior normal. 2. Region nasal: La cara fetal y la nariz pueden ser valoradas en dos planos perpendiculares, plano tangencial oblicuo en dirección cráneo caudal, en continuación con los labios fetales, y por otro lado el plano medio sagital para visualizar el tamaño, longitud, hipoplasia o ausencia del hueso nasal. Planos para medianos, que son útiles para visualizar el perfil fetal. La incidencia de malformaciones nasales es de 1 en 1674 nacimientos; asociadas a cromosomopatías entre un 32 – 40 % de los casos. Por ecografía podemos detectar aplasia nasal, arrinia, hipoplasia de las alas nasales, probóscide, etmocefalia, hendidura nasal medial y lateral, desviación asociada a labio y paladar hendido, glioma, encefalocele e hipoplasia de hueso nasal. (8) 3. Boca y labios: La evaluación de la boca, labio superior, y paladar se puede realizar por medio de cortes axiales y coronales. El plano coronal es requerido para valorar los tejidos blandos de labio superior, la nariz y las alas nasales de ambos lados, en el plano axial se puede valorar el maxilar superior y el soporte óseo alveolar. (2) Los cortes coronales y axiales son útiles para determinar si la hendidura se limita a los labios o compromete el paladar (2). Capítulo 67 Labio y paladar hendido: Definicion: Las hendiduras faciales, son las anomalías craneofaciales más frecuentes y las segundas malformaciones congénitas más comunes, representando el 13 % de todas las anomalías. (2) Las hendiduras pueden afectar a cualquier parte de la cara, pero son más frecuentes en la línea que discurre entre cada orificio nasal y la parte central del paladar posterior; las hendiduras típicas se denominan labio hendido (LH) y paladar hendido (PH); este último corresponde a un defecto de la parte posterior del paladar cuando el labio superior y el paladar anterior son normales. El labio y paladar hendido es una entidad etiológicamente diferente del paladar hendido aislado (2), se puede visualizar incremento en la movilización de la lengua sobre el paladar duro por el defecto presente. Epidemiologia: El labio y paladar hendido es la malformación cráneo-facial más común, con una incidencia de 1:7000 nacidos vivos, con variaciones en su presentación de acuerdo a la raza y el sexo, siendo dos veces más común en fetos masculinos que en femeninos, se considera multicausal (componente genético y ambiental),(9) frecuentemente de presentación aislada, aunque se conoce su asociación con aneuploidias y defectos congénitos entre un 15 – 20 %, dentro de las cuales se encuentran alteraciones en las extremidades y la columna vertebral hasta en un 33 % y del sistema cardiovascular en un 24 %, la asociación con aneuploidias varia de acuerdo al fenotipo; siendo menos frecuentemente asociado al labio hendido unilateral en un 5.7 % y al labio y paladar hendido bilateral hasta un 48 %, porcentajes que varían de acuerdo a la revisión.(10). En un estudio que involucro 263 casos se encontró prevalencias del 27 % para labio hendido unilateral, 42 % labio y paladar hendido, 4 % labio hendido bilateral y 25 % de labio y paladar hendido bilateral. (10) Diagnóstico: La evaluación se debe realizar en la ecografía de segundo trimestre, ya que al encontrar alteraciones faciales secundarias las tasas de detección pueden llegar hasta un 100 %, y en presencia de labio y paladar hendido se puede disminuir hasta un 50 %. (2) Entrando a jugar un papel importante el uso de la ecografía 3 D para la visualización de la cara fetal y detección de anomalías faciales, permitiendo un mejor entendimiento de la lesión, pero sin un impacto significativo en el porcentaje de detección. (12) 68 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Podemos encontrar signos indirectos y sugestivos de anormalidades faciales representadas por poli hidramnios, burbuja gástrica pequeña o no visualización de la misma, como consecuencia de un mecanismo anormal de deglución (7). Clasificación: Puede ser clasificado como: - Completo: No hay conexión entre el tejido de la base de las alas nasales, y el elemento medial labial o pre maxilar. - Incompleto: La hendidura labial no se extiende al piso nasal. Clasificación Ecográfica del Labio y paladar hendido: (Adaptado 2) Tipo 1: Labio hendido sin paladar hendido Tipo 2: Labio y paladar hendido unilateral (Imagen 7 y 8) Tipo 3 a: Labio y paladar hendido bilateral con protrusión pre maxilar Tipo 3 b: Labio y paladar hendido sin protrusión, con hipoplasia media cara. Tipo 4: Labio y paladar hendido en la línea media, o agenesia pre maxilar. Tipo 5: Hendiduras asociadas a bandas amnióticas o complejos cuerpo – extremidades. Imagen 7 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 69 Imagen 8 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Manejo prenatal: Cuando se realiza el diagnostico prenatal de labio (imagen 9 y 11) y/o paladar hendido(Imagen 10), se debe realizar un examen detallado del feto incluyendo el eco cardiograma fetal, en busca de otras anomalías asociadas para realizar la estimación real del riesgo de asociación a aneuploidias que justifiquen la realización de pruebas invasivas. (11) Imagen 9 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 70 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 10 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Imagen 11 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 4. 71 Lengua: La lengua fetal puede ser visualizada desde las 14 semanas de gestación, la importancia en su valoración radica en que el tamaño de la lengua puede estar asociado a 25 síndromes diferentes. La macroglosia puede ser reconocida en planos coronales o en medio sagitales, se identifica como una protrusión de la lengua que puede asociarse a múltiples síndromes, siendo el más frecuentemente asociado el Beckwith-Wiedemann, entre otros la secuencia hipotiroidismo atiroideo, gangliosidosis generalizado tipo I, síndrome de Hunter, Talasemia ligada a X. Se debe tener en cuenta que en fetos normales se puede encontrar una protrusión normal de la lengua de manera intermitente, siendo la persistente la patológica. (2) 5. Mandíbula: La mandíbula y el maxilar están alineados en la normalidad, y pueden ser visualizados mediante cortes medio sagitales usando el maxilar de referencia, permitiendo una valoración subjetiva del tamaño. (2) Micrognatia: El diagnóstico de micrognatia es realizado en un plano sagital de manera subjetiva, pues se visualiza un mentón pequeño y hundido, donde el labio inferior se ubica posterior al superior, ante este hallazgo se debe realizar una búsqueda cuidadosa de otras anomalías fetales, ya que el 70 % se asocian a aneuploidias de tipo trisomía 18, hasta en un 50 % de los casos, y otros síndromes como el Cornelia de Lange. La micrognatia se puede asociar a poli hidramnios por trastornos en la deglución de causa anatómica. (2) La agnatia-otocefalia es una malformación letal caracterizada por la ausencia de mandíbula, microstomia, aglosia; puede ocurrir de manera aislada o en combinación con diferentes grados de holoprosencefalia - ciclopía. (13) El epignatus corresponde a un teratoma en el paladar duro, que se extiende de la boca y protruye hacia la cavidad amniótica también puede producir poli hidramnios. El épulis es un tumor de tejidos blandos aislado derivado de la cresta alveolar maxilar, que se visualiza ecográficamente como una imagen ecogénica, redondeada, homogénea, derivada de la boca que puede desplazar la lengua y los labios, de tamaño variable. Cuello: La evaluación ecográfica del cuello fetal incluye valoración de la región occipital de la cabeza, la oro faringe y los vasos del cuello. 72 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional - Región Occipital: las alteraciones usualmente corresponden a higroma quístico o encefaloceles occipitales, este último se caracteriza ecográficamente por masas de ecogenicidad mixta que se asocian a anormalidades intracraneales y defectos de la calota. - Región anterior: Pueden ser teratomas (Imagen 12, 13 y 14), hemangiomas y tiromegalia. Imagen 12 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Imagen 13 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 73 Imagen 14 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Hidroma Quístico (Imagen 15): Definición: Conocido también como linfangioma (Imagen 16) según la edad gestacional en la que se diagnostica, y la región cervical que comprometa, es resultado de una dilatación del sistema de drenaje linfático yugular y cervical que lleva progresivamente a un linfedema periférico y a un hidrops; frecuentemente ubicado en la región posterior del cuello, pero también se puede localizar anterior y lateral; que puede resolver espontáneamente. (2) Imagen 15 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 74 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Epidemiología: Tiene una alta asociación a cromosomopatías entre ellos el síndrome de Turner hasta un 75 %, trisomia 18 y 21 un 5 % cada uno, también se puede asociar al síndrome de Noonan, entre ellos. (2) Imagen 16 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Diagnostico: En la evaluación ecográfica se visualiza como una imagen quística, anecoica con presencia de tabiques, sin flujo. (2) Bibliografia: 1. Den Hollander NS, Wessels MW, Los FJ, Ursem NT, Niermeijer MF, Wladimiroff JW. Congenital microcephaly detected by prenatal ultrasound: genetic aspects and clinical significance. Ultrasound Obstet Gynecol 2000; 15:282-287. 2. Prenatal Ultrasound: Head and Neck, prenatal diagnosis, 2010 3. Chen CP, Lin SP, Chang TY, Chiu NC, Shih SL, Lin CJ, Wang W, Hsu HC. Perinatal imaging findings of inherited Sotos syndrome. Prenat Diagn 2002; 22:887892. 4. Achiron R, Kreiser D, Achiron A. Axial growth of the fetal eye and evaluation of the hyaloid artery: in utero ultrasonographic study. Prenat Diagn 2000; 20:894-899. 5. Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Secondtrimester ultrasound to detect fetuses with Down syndrome: a meta-analysis. JAMA 2001; 285:1044- 1055. Capítulo 75 6. Hafner E, Sterniste W, Scholler J, Schuchter K, Philipp K. Prenatal diagnosis of facial malformations. Prenat Diagn 1997; 17:51-58. 7. Cohen MM Jr. Malformations of the craniofacial region: evolutionary, embryonic, genetic, and clinical perspectives. Am J Med Genet 2002; 115:245-268. 8. Cicero S, Sonek JD, McKenna DS, Croom CS, Johnson L, Nicolaides KH. Nasal bone hypoplasia in trisomy 21 at 15- 22 weeks’ gestation. Ultrasound Obstet Gynecol 2003. 9. Robinson JN, McElrath TF, Benson CB, Doubilet PM, Westgate MN, Holmes L, Lieberman ES, Norwitz ER. Prenatal ultrasonography and the diagnosis of fetal cleft lip. J Ultrasound Med 2001; 20:1165-1170. 10. Walker SJ, Ball RH, Babcook CJ, Feldkamp MM. Prevalence of aneuploidy and additional anatomic abnormalities in fetuses and neonates with cleft lip with or without cleft palate: a population-based study in Utah. J Ultrasound Med 2001; 20: 1175-1180. 11. Sohan K, Freer M, Mercer N, Soothill P, Kyle P. Prenatal detection of facial clefts. Fetal Diagn Ther 2001; 16:196-199. 12. Ghi T, Perolo A, Banzi C, Contratti G, Valeri B, Savelli L, Morselli GP, Bovicelli L, Pilu G. Two-dimensional ultrasound is accurate in the diagnosis of fetal craniofacial malformation. Ultrasound Obstet Gynecol 2002; 19:543-551. 13. Schiffer C, Tariverdian G, Schiesser M, Thomas MC, Sergi C. Agnathia-otocephaly complex: report of three cases with involvement of two different Carnegie stages. Am J Med Genet 2002; 112:203-208 5.2 Evaluación del torax fetal Introducción: Las anomalías congénitas del tórax son una patología rara, por lo que la evaluación sistemática de las estructuras intratorácicas y extratorácicas como: corazón, pulmón, diafragma, timo, pleura, mediastino anterior y pared torácica, son de vital importancia para el diagnostico de anomalías congénitas, las cuales pueden alterar el desarrollo pulmonar normal, originando hipoplasia pulmonar de severidad variable, ensombreciendo el pronóstico fetal y/o neonatal [1,2]. Cuando realizar la evaluación del tórax: Aunque la evolución se puede realizar en cualquier trimestre, se recomienda realizarla entre la semana 18 a 24 de gestación, después de este momento aumenta la mineralización ósea generando una sombra acústica, lo que limita la evaluación de órganos intratoracicos especialmente en cortes coronales y sagitales. En el tercer trimestre es más fácil evaluar anomalías de la caja torácica [1]. 76 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Tórax normal Las referencia más significativa en la evaluación del tórax fetal es el corazón fetal, el cual debe: ocupar un tercio del tórax, estar lateralizado hacia la izquierda, con ápex tocando la pared izquierda del tórax y el eje cardiaco a 45° (entre 25 a 75°), cuando se realiza un corte axial, observando las cuatro cámaras cardiacas.[2] Otra referencia importante son los pulmones fetales, estos se observan simétricos y homogéneos (aunque en ocasiones el pulmón izquierdo se observa de menor tamaño por posición cardiaca), la ecogenicidad pulmonar es media.[1] Finalmente se deben observar la presencia e integridad de las estructuras del mediastino como el timo, los grandes vasos, esófago y la tráquea.[1] Que planos se deben evaluar a. Corte axial: es el plano fundamental en la evaluación del tórax fetal, debe realizarse a nivel de cuatro cámaras cardiacas, en un corte adecuado se debe observar solo una costilla a cada lado, los pulmones en sección transversal rodeando casi completamente al corazón, el pulmonar derecho se observa un poca más grande. En este corte se evalúa la posición, eje y situs cardiaco, los cuales puede estar alterados por situs inverso o por efecto de masa de estructuras anormales intratoracicas (hernia diafragmática, malformación adenomatosa quística entre otras).[1,2] b. Corte sagital: se debe realizar un corte parasagital derecho el cual es ideal para evolución del pulmón derecho fetal. Debajo del pulmón se observa una capa hipoecogénica que corresponde al diafragma su no integridad nos hace sospechar hernia diafragmática. La evaluación de la pleura se realiza en este corte, como la pleura es un espacio virtual no debe observarse en condiciones normales. [1,2] c. Corte axial mediastinal: el corte se realiza a nivel de vista de tres vasos, en este corte evaluamos los grandes vasos, el timo, la tráquea y esófago. El timo se observa en segundo trimestre como una imagen hipoecogénica redondeada bien definida entre los grandes vasos, la región paravertebral y el esternón. [1] Anomalias toracicas Hernia diafragmatica congenita Definición Es un defecto congénito del diafragma, debido a la ausencia del cierre de los canales pleuroperitoneales posteriores, que normalmente ocurren en semana 8 de gestación, permitiendo el desplazamiento de las vísceras abdominales a la cavidad torácica.[1,3,4] Capítulo 77 Epidemiología Se considera que tiene una incidencia de 1 en 2500 a 4000 nacidos vivos, el riesgo de presentar una anomalía cromosómica concomitante es de (5-15%) especialmente trisomía 18 y 21, y de presentar una anomalía estructural es del 30 a 70%. [1,3,4] Clasificación Se pueden clasifica según el sitio del defecto en: 1. Hernias posteriores o de Bochdalek las cuales corresponden al 90-95% casos a que a su vez se subclasifican en. - Posterolateral izquierda: representa el 80% de los casos, donde el contenido herniario esta formado por estomago (60% casos), intestino (90% casos), bazo e hígado (15% casos) y con menos frecuencia suprarrenales.[ 1,3,4] - Posterolateral derecha: corresponde al 20% de casos, en contenido herniario está formado principalmente por hígado y vesícula biliar.[ 1,3,4] - Posterior bilateral: representa solo el 3-4% de los casos, tienen elevada asociación con anomalías cromosómicas o estructucturales y la mortalidad es muy elevada. 2. Hernias anteriores o de Morgagni las cuales corresponden al 1-2% de los casos. A diferencia de las anteriores ocurre por un defecto congénito anterior a nivel costoesternal.[ 1,3,4] Diagnóstico prenatal El diagnóstico prenatal solo se consigue en el 50-60% de los casos y se suele realiza en segundo trimestre alrededor de semana 24 de gestación.[ 1,3,4] La ecografía nos permite a sospechar el diagnostico cuando encontramos ‐ ‐ ‐ ‐ ‐ Ausencia de estomago en la cavidad abdominal y presencia de este a nivel de hemitorax izquierdo cuando se realiza corte de 4 cámaras. Desplazamiento cardiaco al hemitorax derecho, pero el ápex continúa orientándose hacia la izquierda. Se puede observar asas intestinales en el tórax y mostrar peristaltismo En corte parasagital no se observa capa hipoecogénica que corresponde al diafragma Hernias derechas son de difícil diagnostico, sin embargo se puede observar desviación extrema del corazón el cual parece apretado contra pared del tórax izquierdo, por herniación hepática.[1,3] 78 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 1, a la izquierda corte axial de abdomen, flecha amarilla indica ausencia de cámara gástrica. A la derecha corte axial de tórax con cámara gástrica que desplaza el corazón fetal. Cortesía Dr. Arenas/universidad nacional/consultorio Y l Diagnostico diferencial Algunas patologías intratoracica pueden semejar esta patología entre ellas: malformación adenomatosa macroquistica, quistes del timo, secuestro broncopulmonar, teratomas mediastinales entre otros.[3] Pronóstico: El pronóstico depende de muchos factores los más importantes son: Presencia de otras malformaciones ya sea estructurales o cromosómicas (siempre realizar cariotipo), la mortalidad es del 90%. Herniación hepática, si está presente mortalidad 65% Bilateralidad mortalidad mayor 70% Índice pulmón/cabeza constituye el parámetro ecografía con mayor valor pronostico, se realiza. Hidrops fetal Otros (polihidramnios, compresión ventrículo izquierdo, restricción de crecimiento fetal) Índice pulmón/cabeza Consiste en establecer la relación entre el área del pulmón contralateral a la hernia y la circunferencia cefálica (área del pulmón /CC). El área pulmonar se mide en el corte de cuatro cámaras, multiplicando los ejes longitudinal y transverso. Un índice menor de 1 la mortalidad es 95% y un índice mayor a 1,4 la mortalidad es menor de 10%.[2,12,14,15] Capítulo 79 Modificado de Skari H. et al. Congenital diaphragmatic hernia, predictor of mortality. J Pediatr surg 2002;37:1269-1275 (pronostico si no se realiza tratamiento) Imagen 2. índice pulmón /circunferencia cefálica para pronostico fetal cortesía Dr. Arenas/ Universidad nacional de Colombia/consultorio Yopal Manejo prenatal Manejo primario consiste en referir a la paciente a un centro de alta complejidad, que cuente con el servicio de medicina materno fetal. La terapia fetal invasiva in útero, consiste en la oclusión traqueal por fetoscopia, la cual está justificada en caso gestaciones mayores de 26 semanas, con hernia diafragmática aislada, donde índice pulmón / CC, es menor 1, mejorando la supervivencia a los 6 meses de vida posnatal 53% comparada con manejo expectante 5,3% [12,14,15]. En caso de índice mayor de 1,4 el manejo es expectante con seguimiento ecográfico y parto electivo en semana 38 a 40 de gestación con una sobrevida mayor del 85%[2,12,14,15]. Existe actualmente gran controversia sobre el uso de la terapia fetal en el grupo con índice pulmón/CC entre 1 a 1,4, cuando estos casos de presentan se debe individualizar el manejo [2,12,14,15]. 80 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Malformacion adenomatosa quistica Definición La malformación adenomatosa quística es una anomalía broncopulmonar de etiología desconocida, caracterizada por alteración del desarrollo alveolar, excesiva proliferación y dilatación quística de los bronquiolos terminales. [1,5] Se presenta de forma unilateral en 97 % de los casos.[1] Epidemiologia Se considera una patología relativamente rara con incidencia de 1/10,000 a 1/35,000 nacidos vivos, su asociación con anomalías cromosómicas y defectos estructurales es poco frecuente, por lo que se considera un defecto aislado.[5,6,7] Clasificación Existe varias clasificaciones las usadas de pueden dividir en según características histológicas la de Stocker y según características ecográficas la de Adzick[7,8]. Clasificación histológica de Stocker Características histológicas Tipo I Uno o más quistes de 2 a 10 cm de diámetro de aspecto hamartomatoso en la microscopia. Tipo II Lesiones quísticas múltiples de 0,5 a 2 cm de diámetro, con epitelio de os bronquiolos terminales anómalos. Tipo III Lesiones microquísticas múltiples menores de 0,5 cm de diámetro, de aspecto solido en la microscopia. Clasificación ecográfica de Adzick Subtipo características prevalencia Macroquística Quistes ecogénicos únicos 58% o múltiples > 5 mm Microquística Quistes múltiples 5mm ecogénicos 42% pequeños < a Capítulo 81 Diagnostico prenatal El diagnostico prenatal solo se consigue en el 17% de los casos, con personal capacitado esperamos que aumenta la sensibilidad diagnostica del ultrasonido. El ultrasonido se debe realizar entre semana 18 y 22 de gestación, al tomar una vista de 4 cámaras cardiacas podemos caracterizar en parénquima pulmonar, en las variante macro quística observamos múltiples lesiones quísticas que ocupan gran parte del pulmón afectado, con contornos brillantes, con pocos sitio de parénquima pulmonar normal. Mientras la variante microquistica se observa una masa solida, homogénea, bien definida e hiperecogénica. Imagen 3. Flecha amarilla indica macroquiste unicolucular en tórax fetal cortesía Dr. Arenas/ Universidad nacional de Colombia Ambos tipos por definición son unilaterales y solo en 3% suele observarse bilaterales.[1,7,9] En ocasiones se puede observar desplazamiento del mediastino y el corazón contralateral a la anomalía, también puede observarse polihidramnios cuando se produce compresión esofágica e hidrops fetal por desplazamiento de grandes vasos y falla cardiaca fetal.[8] Diagnostico diferencial Entre las patologías diferenciales más importantes están la hernia diafragmática con estomago intratorácico y el secuestro broncopulmonar.[1,2,8,9] Pronostico Los criterios de mal pronóstico: si compromete la totalidad del pulmón la sobrevida es del 36%, la presencia de hidrotórax o hidrops fetal suele presentarse solo en el 10% de los casos con elevada mortalidad.[1,7,8] 82 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Sin embargo en términos generales al ser una anomalía aislada suele tener un pronóstico favorables, si compromete menos del 50% del pulmón la sobrevida es superior al 80%. Otro factor pronóstico es el índice pulmón/circunferencia cefálica si > 1,6 sobrevida mayor al 75%, si es menor de 1,6 la sobrevida cae hasta el 17%.[1] Manejo: Básicamente en manejo prenatal es el seguimiento ecográfico ya que hasta el 30% de caso puede regresar espontáneamente en el tercer trimestre, lo más importante durante el seguimiento es la búsqueda de factores de mal pronóstico como el hidrops para definir la viabilidad fetal. La terapia in útero solo reserva para casos seleccionados la cual consiste en aspiración de los quistes por fetoscopia o colocación de derivaciones toracoabdominales. Secuestro broncopulmonar Definición Es una rara malformación del tracto respiratorio inferior, que consiste en una masa no funcional de tejido pulmonar el cual carece de comunicación con el árbol traqueobronquial y recibe suministro sanguíneo de la circulación sistémica en lugar de la circulación pulmonar como el resto del parénquima pulmonar [9,10]. Esta lesión es característicamente unilateral y compromete el lóbulo inferior izquierdo en el 90% de los casos. Clasificación ‐ ‐ Intralobar: también denominada intrapulmonar se caracteriza porque la lesión se encuentra en un lóbulo pulmonar de características normales y carece de su propia pleura visceral, es la forma más común de presentación sin embargo el diagnóstico se realiza posnatalmente [10]. Extralobar: es la más frecuentemente diagnosticada prenatalmente, se caracteriza por que la masa se localiza fuera del pulmón normal y tiene su propia envoltura de pleura visceral. A su vez la extralobar se subdivide en supra diafragmática 90% casos e infra diafragmática, esta última es un diagnostico diferencial de masas abdominales.[1,9,10] Epidemiologia Es una anomalía pulmonar muy poco común, representa solo el 0,15 a 6,4% de todas las malformaciones pulmonares congénitas, además esta patología tiene una relación con el género, en la variante extralobar la relación de incidencia hombre/mujer es de 3 a 1.[9] Capítulo 83 El riesgo de anomalías cromosómicas es bajo, no de la misma manera los defectos estructurales ya que la variante intrapulmonar se presenta 17% de anomalías asociadas y en la extrapulmonar 43%. Las anomalías asociadas se encuentra la hernia diafragmática, anomalías vertebrales, anomalías cardiacas, hipoplasia pulmonar y anomalías del tracto digestivo.[1,2,9] Diagnostico prenatal Esta lesión se puede observar desde la semana 18 hasta el término, el diagnostico prenatal se puede realizar con una ecografía de rutina de segundo trimestre, se debe tomar una vista de cuatro cámaras cardiacas y teniendo en cuenta que la lesión se localiza con más frecuencia e lóbulo inferior izquierdo cerca al corazón, la variante extralobar supradiafragmática se evidencia como una masa homogénea bien definida, hiperecogénica, triangular en parte inferior de pulmón izquierdo [2,9]. La variante subdiafragmática no se observa adecuadamente en vista de cuatro cámaras porque requiere una vista axial a nivel de diafragma. Para completar los estudios es necesario tomar una vista sagital y observar la lesión en plano caudal, además esta vista es ideal para evaluar la circulación, proveniente de ramas de la aorta atreves del Imagen 3. Flecha indica Secuestro pulmonar cortesía Dr. Arenas/ Universidad nacional de flujo doppler color o power doppler. [1,10] Colombia/OyG Diagnóstico diferencial El principal diagnostico diferencial es la malformación adenomatosa quística por ecogenicidad similar. [2] Pronostico El pronóstico en general es bueno la mayoría tiende a disminuir de tamaño, incluso desaparecer en el tercer trimestre, los principales factores que ensombrecen el pronóstico es la presencia de malformaciones asociadas, presencia de hidrotórax y/o desviación contralateral del mediastino [1,2.10]. 84 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Manejo El manejo generalmente es seguimiento con ecografías seriadas, rara vez está indicada la intervención fetal ya que esta patología suele involucionar o disminuir de tamaño al final de la gestación.[2] Hidrotorax fetal Definición El derrame pleural es la acumulación de líquido en la cavidad torácica. Estas efusiones pleurales puedes ser unilaterales, bilaterales, aisladas o en el contexto de hidrops generalizado.[11] Epidemiologia Cuando se presenta de manera aislada (hidrotórax fetal primario), la incidencia oscila entre 1/10,000 nacimientos, sin embargo la mayoría de los casos está asociado a otras patologías con incidencia muy variada.[1,11,12] Etiología La etiología de los derrames pleurales es muy variada pueden formar parte del hidrops fetal generalizado producido por diversas causas entre ellas:[11] Inmunes Trastornos metabólicos(tiroxicosis) Trastornos cardiovasculares Infecciones (TORCHS) Anomalías pulmonares Alteraciones hematológicas Anomalías digestivas Anomalías cromosómicas Modificado de Donald school journal of ultrasound in obstetrics and gynecology jan-mar 2007. Cuando se presenta en forma aislada una causa frecuente es el quilotorax congénito, sin embargo este diagnostico se realiza posnatalmente luego de iniciada la vía oral. Diagnostico El diagnostico se puede realizar tomando una vista axial del tórax y aparece como una colección de liquido anecoico, puede tomar forma de media luna ya que no compromete los hilios pulmonares. Puede observarse unilateral o bilateralmente, cuando es unilateral puede desplazar en contenido del mediastino al lado contralateral.[1,11,12] Capítulo 85 Imagen 5. feto con Hidrops, con cavidad torácica llena de liquido Cortesía Dr. Arenas/universidad nacional de Colombia/hospital Engativá Pronóstico En casos de ausencia de otras anomalías o ausencia de hidrops es pronóstico es bueno, cuando existe quilotorax aislado entre el 15 a 25% de los casos pueden resolver espontáneamente o después de un simple drenaje. En casos asociados a hidrops, anomalías estructurales o anomalías cromosómicas es de mal pronóstico con mortalidad superior al 95%.[11,12] Manejo En manejo debe realizarse en un centro de alta complejidad, donde los objetivos principales de la intervención intrauterina son la prevención de la hipoplasia pulmonar, la prevención o resolución del hidrops y del polihidramnios evitando así la muerte intrauterina y el parto prematuro. Las dos terapias que se puede realizar de manera prenatal son: 1.la toracentesis fetal, la cual es una medida que puede ser transitoria y 2. la derivación pleuro- amniótica [11,12]. Conclusiones Las alteraciones del tórax fetal suelen ser patologías poco frecuente, sin embargo se requiere gran experticia del operador para caracterizarlas adecuadamente. Ante la sospecha de una anomalía mayor del tórax fetal se debe realizar seguimiento materno fetal en IV nivel de atención con equipo multidisciplinarios, que incluyan cirujanos de tórax, pediatras, neonatologos, obstetras entre otros. 86 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Bibliografía 1. D. Paladini, P. Volpe, Ultrasound of Congenital Fetal Anomalies, capitulo 6 thoracic anomalies, 2007. 2. Filip Claus, Inga Sandaite, Prenatal Anatomical Imaging in Fetuses with Congenital Diaphragmatic Hernia, Fetal Diagn Ther 2011;29:88–100 3. Gratacos, E. Medicina Fetal. Hernia diafragmática congénita. Pag 293-300. Ed. Panamericana. 2007. 4. Deprest J, Jani J, Gratacos E, Vandecruys H, Naulaers G, Delgado J, Greenough A, Nicolaides K. Fetal Intervention for Congenital Diaphragmatic Hernia: The European Experience. Semin Perinatol 2005; 29: 94-103. 5. J.L. Encinas, F. Pederiva, Malformación adenomatoidea quística: diagnóstico prenatal, Cir Pediatr 2007; 20: 87-90 6. Stephanie Mann , R. Douglas Wilson, Antenatal diagnosis and management of congenital cystic adenomatoid malformation Seminars in Fetal & Neonatal Medicine (2007) 7. F. Justicia Martínez, Actualización en la malformación adenomatoidea quística pulmonar, Hospital Clínico Universitario San Cecilio. Granada 2011. 8. M. De Agostini C, R. Levy Mizraji, Malformación adenomatosa quística pulmonar, Diagnóstico prenatal y evolución de un caso, Rev Med Uruguay 2005; 21: 159-163 9. Christopher M Oermann, Bronchopulmonary sequestration, uptodate 2008. 10. Partal Lorente AB, et al. Secuestro broncopulmonar fetal con resolución espontanea intra útero. Prog Obstet Ginecol. 2012. doi:10.1016/j.pog.2012.01.008 11. I. Gonzalez Pérez, L. Aibar Villa, derrame pleural fetal (hidrotórax fetal), hospital Virgen de las Nieves 2012. 12. R. Castagno, E. Carrera, Fetal pleural effusion, Donald school journal of ultrasound in obstetrics and gynecology jan-mar 2007. 13. R. Ruano, C. T. Yoshisaki, A randomized controlled trial of fetal endoscopic tracheal occlusion versus postnatal management of severe isolated congenital diaphragmatic hernia, Ultrasound Obstet Gynecol 2012; 39: 20–27. 14. JA Hutcheon, B Butler, Timing of delivery for pregnancies with, congenital diaphragmatic hernia, RCOG and BJOG An International Journal of Obstetrics and Gynaecology, 2010 15. J. C. Jani and K. H. Nicolaides Fetal surgery for severe congenital diaphragmatic hernia? Ultrasound Obstet Gynecol 2012; 39: 7–9 Capítulo 87 5.3 Evaluacion cardiaca fetal Introducción La cardiopatía congénita es una de las anomalías más comunes en el recién nacido, con una incidencia de 4 a 10 x 1000 nacidos vivos y una mortalidad del 42% en la infancia. La mortalidad en la población de fetos es mayor, ya la mayoría de las cardiopatías complejas termina en aborto o en interrupción voluntaria de la gestación por parte de los padres.[1,3,8] El objetivo de la detección prenatal de las cardiopatías es mejorar los resultados perinatales, ya que permite programar el parto en centro de alta complejidad y permite a los padres preparase sicológica y financieramente para afrontar esta patología. Por otra parte cuando se detecta una anomalía cardiaca 25 a 40% de los fetos presenta una alteración cromosómica y entre 37,6 al 54,6% se asocia con anomalía extracardiaca.[11] La tasa de detección prenatal de anomalías cardiacas varía entre el 15 y el 75% dependiendo: de la experiencia del examinador, uso de equipos de última generación, obesidad materna, edad gestacional y tiempo disponible para realizar la detección.[3,4] ¿A qué edad gestacional se debe realizar tamizaje de rutina? Aunque la evaluación cardiaca fetal se puede realizar desde el primer trimestre (semana 11-14 de gestación), algunos detalles cardiacos no puede ser bien objetivizados dificultando su caracterización, sin embargo algunos hallazgos como el ductus venoso pulsátil e insuficiencia tricúspidea pueden indicar anomalías cardiacas y/o cromosopatías. [8] El examen cardiaco fetal de rutina básico o básico extendido debería realizarse entre la semana 18 a 22 de gestación, porque es el momento donde se observan la estructuras más claramente, ya que las evaluaciones de tercer trimestre evidencia limitaciones debido al oligoamnios y sombras de la columna vertebral o las costillas, que hace mas dispendioso el procedimiento.[3,8,11] En países en vía de desarrollo dado las dificultades en el acceso a servicios de salud, se recomienda realizar el tamizaje cardiaco fetal de rutina básico y básico extendido en cualquier momento de la gestación a partir del segundo trimestre. Tipos de evaluación La Sociedad Internacional de Ultrasonido en Obstetricia y Ginecología (ISUOG) propuso en el año 2006 una guía para estandarizar el examen cardiaco fetal de rutina clasificando en examen cardiaco básico y examen cardiaco básico extendido en pacientes de riesgo bajo y realizar un ecocardiograma fetal en pacientes de alto riesgo.[3] 88 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Examen cardiaco básico: Consiste en una evaluación rápida de la anatomía cardiaca fetal, la cual solo tarda 2 minutos y debe realizarse de rutina a todos los fetos.[3] Este examen básico consiste en evaluar: la frecuencia cardiaca fetal (normal entre 110 a 160 lpm), el eje cardiaco, el situs cardiaco y el pilar principal del examen básico la visualización de las cuatro cámaras cardiacas la cual tiene una sensibilidad y especificidad que varia del 48 al 60% para el diagnostico de cardiopatías congénitas.[3,11] Examen cardiaco avanzado Consiste en visualizar además de lo expuesto en el examen básico también se evalúa: imágenes de tracto de salida tanto derecho como izquierdo e imagen de tres vasos y tráquea. Con la implementación del examen avanzado la tasa de detección de cardiopatías congénitas aumenta hasta 78 a 85% ya que permite identificar anomalías conotruncales como tetralogía de Fallot y transposición de grandes vasos.[3,4,8] Ecocardiograma fetal: Se trata de un análisis minucioso (la evaluación completa toma alrededor de 45 minutos) tanto de la anatomía cardiaca como de la dinámica cardiaca fetal, la cual se realiza con estudios doppler pulsado y doppler color, por lo que debe realizarse por personal entrenado y familiarizado con la enfermedad cardiaca fetal[4,6]. Con el ecocardiograma fetal la sensibilidad para detección de cardiopatía congénita alcanza el 94% y especificidad el 99%.[3,4,6] Evaluación completa del corazón fetal Un análisis completo del corazón fetal se debe incluir: 1. Posición cardiaca El corazón fetal se ubica dentro del tórax ocupando un tercio de su diámetro transverso, con una pequeña desviación hacia la izquierda, en ocasiones el corazón fetal puede estar total o parcialmente fuera del tórax como en los casos de ectopia cordis. Además algunas patologías pueden alterar la posición cardiaca normal, como ocurre en la hernia diafragmática, la hipoplasia pulmonar, malformación adenomatosa quística entre otras [3,8]. Capítulo 89 2. eje cardiaco El eje cardiaco es el ángulo que forma el tabique interventricular con el diámetro anteroposterior del tórax, se debe medir en una imagen de cuatro cámaras. El eje cardiaco normal presenta una leve desviación a la izquierda desde 45° +/- 20°.[8] Cuando existe una alteración del eje cardiaco siempre pensar en anomalía cardiaca y de los tractos de salida de los grandes vasos.[4] Figura 2. A. Forma de realizar la medición de eje y situs cardiaco. B. esquema de medición del eje cardiaco cortesía Dr Alviar/IMI /SONOGYN /2012 3. Situs Para confirmar el situs cardiaco del feto se debe confirmar que el estomago del feto este al lado izquierdo, luego de confirmar el situs abdominal, se angula el transductor cefálicamente y se evalúa si el vértice del corazón apunta al mismo lado que el estomago.[3,8,11] ‐ ‐ ‐ Situs solitus: considerado el situs normal tiene sus puntos de referencia al lado izquierdo: el estomago, el bazo, la aorta abdominal y ápex cardiaco; al lado derecho del feto se ubica el hígado y la vena cava inferior. [5,6,12] Situs inverso: cuando observamos una imagen en espejo del solitus, se asocia con enfermedad cardiaca congénita solo en 2% de los casos.[5,6] Síndromes heterotaxicos: cualquier anomalía del situs que se ubique entre estos dos extremos del espectro, se asocia con anomalía cardiaca congénita en un 75 a 90% de los casos. Las anomalías más comunes son: isomerismo atrial derecho (síndrome asplenio) e isomerismo atrial izquierdo (síndrome poliesplenio).[5,6] 90 4. Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imágenes cardiacas a evaluar A. imagen de cuatro cámaras La evaluación de las cuatro cámaras fetales es clave para el diagnóstico de anomalías cardiacas fetales por lo que su identificación y referencia hace parte del screening cardiaco básico, a pesar de que toma solo unos pocos minutos su visualización nos puede cambiar el pronóstico de la gestación.[3,8] Para su visualización debe tomar un corte axial del abdomen y luego desplazar cefálicamente el transductor. Los principales elementos a tener en cuenta son: ‐ 4 cámaras cardiacas deben ser visibles ‐ Las 2 aurículas de tamaño similar, foramen oval con flap hacia la aurícula izquierda, septum primun atrial presente. 2 ventrículos de tamaño similar, observar la integridad del septo interventricular se puede usar doppler para observar shunt en no integridad, la banda moderadora en ápex del ventrículo derecho, no observar hipertrofias de la pared ventricular. Valvas auriculoventriculares moviéndose libremente, tener en cuenta que la valva tricúspidea se inserta un poco mas apical que la mitral. No se debe observar derrame pleural Se pueden observar venas pulmonares entrando a la aurículas (no hace parte del screening ‐ ‐ ‐ ‐ ‐ ‐ básico).[3,4,5,8,12] Imagen 3. Esquema modificado. Corte de cuatro cámaras, ventrículo izquierdo (VI), ventrículo derecho (VD), aurícula izquierda (AI), aurícula derecha (AD)y septo interventricular. Cortesía Dr. Arenas/Universidad Nacional de Colombia /hospital Engativá Capítulo 91 Anomalías cardiacas asociados a vista anormal de cuatro cámaras Comunicación interventricular (CIV): es la cardiopatía congénita más frecuente presente en 30% de los casos, suele ser un marcador de cromosopatía especialmente los defectos grandes.[5] Los defectos septales son difíciles de identificar especialmente los parciales o los pequeños, el doppler color nos puede ayudar en defectos grandes, donde se observa la mezcla flujo sanguíneo.[8] Imagen 4. A. cuatro cámaras cardiacas con defecto septal apical; B. doppler evidencia flujo a través del defecto septal. Cortesía Dr. Arenas/Universidad Nacional de Colombia /OyG Síndrome de corazón izquierdo hipoplásico: corresponde al 5,5 % de las cardiopatías congénitas, se observa un ventrículo izquierdo muy pequeño, válvula mitral inmóvil e hiperecogenica y ausencia de válvula aortica, herniación del foramen oval y flujo retrogrado atreves del ductus arterioso entre otros hallazgos. Es una cardiopatía de mal pronóstico con mortalidad del 25% a la primera semana de vida.[5,8] El síndrome de corazón derecho hipoplásico se observa como una imagen en espejo del síndrome del corazón izquierdo hipoplásico.[8] Canal auriculoventricular: se observa en el 6 a 10% de los defectos cardiacos congénitos y se asocia fuertemente a cromosopatía hasta en el 50% de casos, especialmente trisomía 21 y trisomía 18. Se caracteriza por presentar defecto del tabique atrial tipo ostium primum, y del tabique interventricular en su porción membranosa y alteración valvular resultando en una sola válvula auriculoventricular que comunica los 2 ventrículos y las 2 aurículas.[5,6,8,] 92 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 5. A. vista de cuatro cámaras se evidencia síndrome de corazón izquierdo hipoplasico; B. canal AV en corte de cuatro cámaras Cortesía de Dr. Arenas/universidad nacional de Colombia/OyG Corazón bicameral: es un defecto complejo que ocurre por la no tabicación del primordio cardiaco, llevando a la formación de una aurícula y un ventrículo con solo una válvula AV. Es una cardiopatía rara con alta tasa de perdida gestacional temprana y suele asociarse a cromosopatías.[5,6] Otros: existen otras causas de desproporción en el tamaño de las cámaras cardiacas, sin embargo de requieren proyecciones adicionales para caracterizarlas adecuadamente (coartación aortica, estenosis mitral, estenosis aortica o pulmonar, atresia tricuspídea). [8] B. Imagen de 3 vasos y tráquea Representa una vista axial del mediastino superior se evalúa la arteria pulmonar, la aorta ascendente, la vena cava superior y su relación con la tráquea. La imagen de tres vasos se obtiene deslizando apicalmente el transductor a partir de la imagen de cuatro cámaras.[3,4,5,8,10] Imagen de tres vasos normal: ‐ ‐ ‐ ‐ El tronco de la arteria pulmonar se observa en sección axial de mayor tamaño, y se ubica más anterior y hacia la izquierda. Presenta una bifurcación distal en arteria pulmonar izquierda y derecha que pasa por detrás de la aorta ascendente. Vena cava superior se ve redonda en corte transverso, es más pequeña, y se ubica más posterior y hacia la derecha. La aorta ascendente es redonda tamaño mediano al corte axial, y se ubica entre el tronco pulmonar y la vena cava superior. Imagen de la tráquea debe observarse a la derecha de la aorta [3,4,8,10] Capítulo 93 Imagen 6. Vista de tres vasos, observando el tronco de la arteria pulmonar, arteria aorta y vena cava superior. En la parte inferior se muestra los esquemas de posición normal. Cortesía Dr. Alviar/IMI /SONOGYN /2012 La anomalias cardiacas asociados a una imagen de tres vasos anormal Se pueden clasificar en 4: 1. Tamaño anormal : se observa en patologias como coartacion de la aorta y sindrome de corazón izquierdo hipoplasico donde la aorta ascendetente se observa disminuia de tamaño o en la estenosis valvular pulmonar donde se observa arteria pulmonar marcadamente dilatada.[5,6] 2. Aliniación anormal: siempre sospechar patologías conotruncales como la tetralogia de Fallot entre otros.[5,6] 3. Disposición anormal: cuando el orden normal de los vasos no se conserva, se debe sospechar transposición de grandes vasos ya sea corregida o no corregida, en persistencia de vena cava superior izquierda y ausencia de la derecha.[5,6] 4. Número anormal de vasos: pueden observarse solo dos vasos en caso de tronco arterial común, o puede observarse 4 o mas vasos en casos de persistencia de vena cava superior izquierda con derecha normal. [5,6,8] C. Imagen de 5 camaras Se obtiene en una vista de cuatro camaras , se angula el transductor y se observa la quinta camara que corresponde a la raiz aortica con su válvula semilunar en centro del corazón, con las auriculas derecha e izquierda a los lados. Esta proyección nos permite confirmar la salida de la arteria aortica del ventriculo izquierdo (continuidad con el septo interventricular) y permite evaluar el tamaño aortico.[4,5,6,8] 94 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 7. A la izquierda una imagen de cuatros caramas normal, a la derecha, vista de 5 cámaras normal. Cortesía Dr. Alviar/IMI /SONOGYN /2012 D.Imagen de tracto de salida derecho Su imagen se obtiene desde una vista de cuatro camaras , luego el transductor se inclina apicalmente y se gira en direccion del hombro izquierdo fetal.[8] Un tracto de salida derecho normal se confirma con el seguimiento del tronco pulmonar originandose del ventriculo derecho (banda moderadora es la referencia), luego cruza hacia la izquierda posterior a la aorta ascendente formando un angulo de 90°, siendo de mayor tamaño que esta última y con con bifuración distal temprana.[3,5,8] E. Imagen de tracto de salida izquierdo Su imagen se obtiene similar a la del tracto de salida derecho, solo que el transductor se inclina hacia el hombro derecho fetal. Se confirma un tracto de salida izquierdo cuando se sigue la arteria que se origina desde el ventriculo izquierdo hasta observar la formacion del arco aortico, se debe observar la continuidad septo-aortica, y el cruce hacia la derecha delante del tronco pulmonar en angulo de 90°. Aunque se puede observar los tres vasos del cuello saliendo del arco aortico, algunas no lo consideran parte del examen extendido.[3,5,8] Anomalias cardiacas asociadas a imagen de tractos de salida anormal: Transposición de grandes vasos (TGV): corresponde 2 a 5% de las cardiopatías congénitas y se caracteriza por una conección ventriculo arterial discordante, con una arteria pulmonar que sale del ventriculo izquierdo y una arteria aorta que nace en el ventriculo derecho. Esta patología no suele relacionarse con cromosopatías pero el 50% casos se asocia con otras malformaciones cardiacas. [5,8,11] Es de dificil diagnóstico ya que la imagen de cuatro camaras es normal, para su diagnóstico se requiere observar el paralelismo de las grandes arterias (ausencia del angulo de 90°), ademas se observa tracto de salida derecho con morfología aortica y Capítulo 95 tracto de salida izquierdo con morfología de arteria pulmonar, ademas de una dispocision anormal de la imagen de tres vasos.[4,5,6,8] Tretralogia de Fallot (TF): Se caracteriza por: a. Comunicación interventricular perimembranosa; b. desplazamiento de la aorta que cabalga sobre el tabique interventricular; c. estenosis pulmonar de severidad variable; d. hipertrofia del ventrículo derecho la cual solo se observa en la vida posnatal. La tetralogía de Fallot corresponde al 4 a 6% de las cardiopatías congénitas, a diferencia de la TGV se asocia en el 30% de los casos con alteraciones cromosómicas especialmente trisomía 21 y 18.[4,5,6,8,12] El diagnostico se realiza observando en imagen de tracto de salida izquierdo, el cabalgamiento de la aorta sobre el septo ventricular, alineamiento anormal y aumento de tamaño de la aorta en la imagen de tres vasos, con el doppler podemos determinar la CIV y la estenosis pulmonar.[5,12] Doble tracto de salida derecho: corresponde al 3% de la anomalías cardiacas congénitas y se caracteriza porque las válvulas aortica y pulmonar surgen casi completamente del ventrículo derecho, aunque en ocasiones es difícil diferenciarla de la TF o TGV, la clave diagnostica es la imagen del tracto de salida derecho con los dos vasos aorta y pulmonar originándose del ventrículo derecho. El riesgo de anomalías cromosómicas es tan alto como del 12 al 46%.[5,6,12] 5. Evaluación del ritmo cardiaco: Las arritmias fetales es una hallazgo frecuente ya que suele presentarse hasta en el 2% de las gestaciones, sin embargo menos del 10% de ellas suponen un problema real (falla cardiaca y muerte fetal). El estudio del ritmo cardiaco se puede realizar con ecografía en modo M y con doppler (pulsado o tisular).[8,15,17] Las arritmias fetales se pueden clasificar en tres grupos: Ritmos irregulares: se debe a contracciones prematuras (extrasístoles) y las identificamos en ecografía en modo M por falta de un latido, ya que se produce una pausa compensatoria. Estas extrasístoles ya sean auriculares o ventriculares son las arritmias más frecuentes, suelen ser benignas porque no producen repercusiones hemodinámicas fetales, ni se asocian a otras anomalías cardiacas cuando son aisladas y suelen resolver espontáneamente en el tercer trimestre.[15,17] Taquicardias: se consideran patológicas si son sostenidas por encima de 180 lpm. Las taquiarritmias tienen dos mecanismos frecuentes de presentación: a. taquicardia supraventricular por reentrada AV se presenta el 70 a 90 % de los casos, con frecuencias cardiacas mayores a 220 lpm; b. Flutter auricular se presenta en 30% de los casos, en estos casos la respuesta auricular es de 300 a 400 lpm, pero por fenómeno de bloqueo AV la respuesta ventricular varia de 60 a 200 lpm. El pronóstico 96 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional de estas arritmias depende de la edad gestacional de aparición y la presencia o ausencia de hidrops.[15,17] Bradicardias: se definen con frecuencias cardiacas sostenidas menores a 100 lpm, se excluyen la bradicardia en primer trimestre de la gestación y la que se observa en el trabajo de parto. Existen tres mecanismos principales: a: extrasístoles múltiples bloqueadas; b. bradicardia sinusal asociados a QT largo y anomalías cardiacas; c. bloqueo auriculoventricular el cual se asocia a alteraciones inmunológicas maternas (presencia de anticuerpos anti Ro y anti La) con corazón estructuralmente normal [16]. El pronóstico depende del tipo de bradicardia y de la presencia de anomalías cardiacas concurrentes, todavía es controvertido el uso de coricoides en presencia de bloqueos AV . [15,17] 6. Masas cardiacas: Los tumores cardiacos son una entidad poco frecuente con una incidencia de 1 en 100,000 nacidos vivos, más del 90% de estos son benignos. Aunque pueden originarse de cualquier estructura mesenquimal, los rabdomiomas son los más frecuentes (70% de casos) se observa como tumor múltiple encapsulado, los teratomas es el segundo en frecuencia (15%) y se observa como tumor único encapsulado, otros tipos histológicos menos frecuentes: mixomas, fibromas, hemangiomas.[5,8,13,14] El diagnóstico se realiza tomando una vista de cuatro cámaras donde se observa una masa hiperecogenica, redondeada, bien definida, y pueden observarse en cualquier cámara generando aumento del tamaño de estas por obstrucción valvular.[13,14] Los tumores cardiacos no se asocian a cromosopatias ni anomalías estructurales cardiacos, pero existe fuerte asociación con la esclerosis tuberosa especialmente los rabdomiomas, el cual es un desorden autosomico dominante con penetrancia completa caracterizado por hamartomas en múltiples órganos (SNC y renal los sitios más frecuentes). El pronóstico es bueno en casos aislados y más sombríos cuando se asocia a esclerosis tuberosa.[5,6,8,13,14] Capítulo 97 Indicaciones de Eco cardiografía fetal Modificado de Ultrasound Obstet Gynecol 2006; 27: 107–113 Indicaciones para convertir una evaluación de rutina en un ecocardiograma fetal 1) 2) 3) 4) Cámaras cardiacas asimétricas Alteraciones en el eje cardiaco Agrandamiento del tamaño del corazón Arritmia cardiacas fetales Conclusión Dado la relativa frecuencia de las cardiopatías fetales y sus implicaciones, éticas, económicas e impacto familiar, resulta costo efectivo realizar tamizaje cardiaco a todas las gestantes preferiblemente entre semanas 18 a 22 de gestación, ya que con la realización de examen básico y básico extendido detecta cerca del 85% de la anomalías cardiacas cambiando el pronóstico de la gestacional. 98 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Bibliografía 1. Pilar Prats, Queralt Ferrer, Diagnóstico prenatal y evolución de cardiopatías congénitas, Elsevier :10.1016/j.diapre.2011-11-01. 2. W. Lee et al. ISUOG consensus statement: what constitutes a fetal echocardiogram?, Ultrasound Obstet Gynecol 2008; 32: 239–242. 3. Cardiac screening examination of the fetus: guidelines for performing the ‘basic’ and ‘extended basic’ cardiac scan, Ultrasound Obstet Gynecol 2006; 27: 107–113. 4. O. Gómez, M. Bennasar, F. Crispi, JM. Martínez, protocolo ecocardiografia fetal, Institut Clínic de Ginecologia, Obstetrícia , Hospital Clínic de Barcelona 25 de Mayo 2010. 5. D. Paladini , P. Volpe, Ultrasound of Congenital Fetal Anomalies, capitulo 5 Congenital heart disease, 2007. 6. E. Chiappa , A. Cook Echocardiographic Anatomy in the Fetus 2009, 7. M. E. Godfrey, Functional assessment of the fetal heart: a review, Ultrasound Obstet Gynecol 2012; 39: 131–144 8. Nitin G. Chaubal and Jyoti Chaubal, Fetal echocardiography, Indian J Radiol Imaging. 2009 February; 19(1): 60–68. 9. Carlos García Guevara, Anomalías de la cruz del corazón. Su importancia en el diagnóstico ecocardiográfico prenatal de las cardiopatías, Rev Fed Arg Cardiol 2010; 39 (4): 264-267. 10. Yoo SJ, Lee YH, Kim ES et al (1997). Three-vessel view of the fetal upper mediastinum Ultrasound Obstet. Gynecol. 9: 173-182. 11. Arthur C. Fleischer, Frank A. Manning, Sonography in Obstetrics & Gynecology: Principles and Practice, chapter 8 and 9, 2009. 12. D. Wood, M. Respondek-Liberska, B. Puerto. Perinatal echocardiography: protocols for evaluating the fetal and neonatal heart. J Perinat. Med. 2009; 37: 5-11, 13. Nuria López V. Tumores cardiacos fetales: diagnóstico ecográfico, evolución y tratamiento, REV chil obstet ginecol 2011; 76(3): 147 – 154. 14. Yinon Y, Chitayat D, Blaser S, Seed M. Fetal cardiac tumors: a single-center experience of 40 cases. Prenat Diagn 2010;30:941-9. Capítulo 99 15. Api O, Carvalho JS. Fetal dysrhythmias. Best Practice and Research Clinical Obstetrics and Gynaecology 2008; 22. 16. Friedman DM, Kim MY, Copel JA, et al. Prospective evaluation of fetuses with autoimmune-associated congenital heart block followed in the PR Interval and Dexamethasone Evaluation (PRIDE) Study. Am J Cardiol 2009 103(8) 17. R. Vázquez, M. Perín, arritmias fetales. diagnóstico y tratamiento, hospital virgen de la nieves, 2012 5.4 Evaluacion del sistema gastrointestinal fetal Introduccion En este capítulo realizaremos una descripción de las diferentes anomalías congénitas que pueden afectar el tracto gastrointestinal fetal, aunque algunas de ellas se pueden detectar prenatalmente, sin embargo la mayoría se diagnostica adecuadamente después del nacimiento. La correcta evaluación ultrasonografica del sistema gastrointestinal fetal incluye la visualización de las siguientes estructuras: 1. El estomago, 2. Intestino delgado y grueso, 3. Hígado con sus vasos principales y la vesícula biliar,4. Pared abdominal e inserción del cordón umbilical, y finalmente 5. La evaluación del diafragma.[1,7] Aunque tradicionalmente se ha considerado una baja sensibilidad de la ecografía en el diagnostico de alteraciones abdominales fetal, esta sensibilidad puede variar entre 26% a 86%, dependiendo del operador, del equipo, de posición fetal y del trimestre de evaluación[1,2,9]. En 2002, el Instituto Americano de Ultrasonido en Medicina publicó su norma revisada para la evaluación de las malformaciones del sistema gastrointestinal, dividiéndolos en 4 grupos[1]: 1. Evaluación de la pared abdominal anterior 2. Anomalías tracto digestivo 3. Masas quísticas no intestinales. 4 .Defectos diafragmáticos Cuando realizar la evaluación del abdomen fetal Las características sonográficas del sistema gastrointestinal varía a lo largo de la gestación y algunas anomalías, especialmente las lesiones obstructivas (atresia esofágica, atresia duodenal, atresia ileal, entres otras,) se visualizan mejor en tercer 100 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional trimestre de gestación, por lo tanto se recomienda una evaluación preliminar del abdomen fetal entre semana 18 a 24 y otro más detallada en el tercer trimestre de gestación[6,7,8]. 1. Defectos de pared abdominal anterior Gastrosquisis Definición Es un pequeño defecto (2 a 5 cm) que compromete todo el espesor de la pared abdominal anterior, usualmente se localiza al lado derecho de la inserción del cordón umbilical, lo que genera herniación del contenido abdominal (asas intestinales y en ocasiones hígado y bazo), los cuales se observan flotando libremente en el liquido amniótico[3,4,5]. Epidemiologia La incidencia varia de 1 a 5 por 10,000 nacidos vivo[3]. los factores de riesgo más frecuentemente asociados se encuentran[3] : Factores ambientales ‐ Gestantes joven menor de 20 años ‐ Bajo nivel socio­económico ‐ Bajo nivel educativo Teratogenos potenciales ‐ Tabaco ‐ Alcohol ‐ Cocaína ‐ Pseudoefedrina ‐ AINES ‐ Fenilpropanolamina El riesgo de presentar una anomalía cromosómica es muy bajo menor al 1 %, y de presentar una anomalía estructural concomitante es de 10 a 20%, la más frecuente es la atresia del intestino delgado, otras menos comunes incluyen (divertículo de Mekel, hidronefrosis, duplicación intestinal, alteraciones del liquido amniótico polihidramnios o oligohidramnios)[2,3,4]. Patogénesis La etiopatogenia de la gastrosquisis no está claramente entendida, existen varias hipótesis que intentan explicar el proceso [2]. o Teoría de De Vries: considera que existe una involución prematura o atrofia de la vena umbilical derecha la cual ocurre a los 43 a 47 días de amenorrea, esta atrofia Capítulo o 101 prematura antes de la aparición de la circulación colateral dependiente de la aorta, generara un infarto de todo el espesor de un segmento de la pared abdominal anterior, lo cual originaria el defecto[4,5,7]. Isquemia de la arteria onfalomesenterica: sugiere que existe una regresión prematura hacia la semana 5 a 6 de gestación de la arteria onfalomesenterica derecha, esta regresión anormal genera falla en los componentes mesodérmicos de la pared abdominal anterior y además genera mal rotación intestinal un defecto frecuentemente asociado a gastrosquisis[4,5,7]. Diagnostico prenatal En nuestro medio el diagnostico se realiza como hallazgo incidental durante una ecografía de rutina en segundo y tercer trimestre, en países desarrollados donde se realizan estudios serológicos, se puede sospechar cuando existen niveles elevados de alfa fetoproteína (AFP) en suero materno[2,5]. La ecografía tiene una sensibilidad de 60 a 75% y una especificidad superior a 90%, para realizar el diagnostico[4]. Hallazgos ecográficos ‐ ‐ ‐ ‐ ‐ ‐ ‐ Masa solida y quística adyacente a la pared abdominal anterior con apariencia de coliflor Asas intestinales flotando libremente en liquido amniótico No se observa saco o membranas recubriendo las asas intestinales No suele comprometer hígado, ni bazo El defecto se ubica al lado derecho de los vasos umbilicales Restricción de crecimiento fetal en 44% de los casos Alteración del líquido amniótico (más frecuente polihidramnios). Imagen 1. Defecto de pared abdominal y protrusión de asas; a la derecha cordón umbilical lateral al defecto. Cortesía de Dr. Arenas /universidad Nacional de Colombia/OyG 102 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnostico diferencial El diagnostico diferencial más importante es el onfalocele, en ocasiones puede observarse una ruptura de la membrana de un onfalocele, lo cual da una imagen similar a la gastrosquisis, sin embargo la observación de la inserción del cordón puede ser de ayuda para indicar el pronóstico. Otras hallazgos similares a la gastrosquisis son (engrosamiento del cordón umbilical cerca de la pared abdominal y síndrome de feto en feto)[3,5,7]. Pronostico En términos generales es una patología de buen pronostico ya suele ser una anomalía aislada, con pocas anomalías asociadas, se considera que la sobrevida es mayor al 90%[3]. Existen algunas condiciones que pueden ensombrecer el pronóstico entre ellas: la restricción de crecimiento fetal, el parto pretérmino, el dilatación de asas intra y extraabdominales mayor 11-17 mm, engrosamiento de pared intestinal mayor de 3 mm, presencia de isquemia, necrosis o perforación intestinal[6,7,8]. Manejo prenatal. No existe ninguna terapia fetal efectiva, algunos han propuesto la amnioinfusion en casos de oligoamnios y el amniodrenaje en casos de polihidramnios para disminuir el riesgo de parto pretérmino, sin embargo la evidencio no soporta estos manejos[4]. Se recomienda realizar seguimiento ecográfico cada 3 a 4 semanas evaluando el crecimiento fetal, la pared intestinal y el volumen de liquido amniótico. El parto electivo se recomienda luego de semana 37 de gestación, sin embargo no está muy claro que la cesárea electiva mejore el pronóstico posnatal[4,6,8]. Onfalocele Definición Es un defecto del cierre de la pared abdominal anterior, donde se evidencia herniación del contenido abdominal (asas de intestino, estomago, hígado y en ocasiones bazo)y compromete el sitio de inserción del cordón umbilical. Los órganos herniados están recubiertos por 2 membranas (el peritoneo y el amnios).[4,8] Epidemiologia La incidencia es variable 1 /4000 a 1/7000 nacidos vivos [1]. Factores de riesgo Capítulo Factores medioambientales 103 Teratogenos potenciales - alcohol - Gestantes mayores (mayor de 35 años) - cigarrillo -obesidad previa a embarazo - inhibidores selectivos de recaptación de serotonina En contraste con las gastrosquisis el onfalocele presenta alta tasa de anomalías asociadas entre 50 a 70%. El riesgo de anomalías cromosómicas (principalmente trisomía 18, 13 y 21, triploidias y síndrome de Turner) representando más del 30% de los casos. Anomalías no cromosómicos asociadas se presenta hasta en el 50% casos especialmente anomalías de SNC, cardiacas, genito-urinarias y de línea media, también se asocia a síndromes uno de los más importantes es el síndrome de Beckwith– Wiedemann, caracterizado por (onfalocele, macroglosia, hemihipertrofia somática, riñón poliquistico), también se puede relacionar con la pentalogia de Cantrell (onfalocele, hernia diafragmática, defecto en la fusión esternal, anormalidad cardiaca, labio leporino/paladar hendido) [1,4,8] Patogénesis En la semana 6 de vida intrauterina e, crecimiento rápido del intestino hace que este migre atreves del anillo umbilical fuera de la cavidad abdominal, alrededor de la semana 11 el intestino regresa a la cavidad abdominal, rota y se fija mientras se cierra el anillo umbilical. Cualquier falla en el retorno del intestino a la cavidad abdominal generara un onfalocele central, además si existe falla en cierre de pliegues laterales, existirá un gran defecto en el cual se herniaran el hígado y demás vísceras abdominales.[5] Diagnostico prenatal Se basa en el hallazgo ecográfico después de semana 12 donde se identifica una protrusión de vísceras a través del anillo umbilical cuyo saco herniario está cubierto por amnios y peritoneo, visualizándose en su vértice la aparición de los vasos umbilicales.[6] El objetivo del examen ecográfico es definir la magnitud de la lesión, si solo existe compromiso de asas o si también hay compromiso hepático y buscar anomalías asociadas.[7] 104 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 2. Esquema de onfalocele, donde se observa cordón umbilical insertándose directamente en el defecto de la pared y las asas intestinales rodeadas por el amnios a hallazgos ecográficos ‐ ‐ ‐ ‐ ‐ Masa en línea media que compromete inserción del cordón Vísceras herniadas recubiertas por una membrana Compromete frecuentemente hígado, estomago Doppler color ayuda a visualizar el sitio de inserción del cordón Polihidramnios se presenta frecuentemente Diagnostico diferencial Se debe realizar diagnostico diferencias con gastrosquisis, especialmente si existe ruptura de la membranas amnioperitonial, otros diagnósticos diferenciales importantes son ( la extrofia cloacal, la extrofia vesical y anomalías del tallo corporal).[8] Pronostico El pronóstico prenatal depende de las anomalías asociadas, si existe anormalidad cromosómica o síndromes, la mortalidad in útero es mayor del 95%, si existe onfalocele aislado pero hay compromiso hepático la sobrevida posnatal es pobre por complicaciones respiratoria. Por el contrario si el defecto es aislado y no compromiso hepático , la sobrevida es superior al 80%.[7,8] Manejo prenatal Cuando se diagnostica un onfalocele de deben buscar anomalías cromosómicas y no cromosómicas asociadas, por tal motivo siempre de debe realiza ecografía de detalle, ecocardiograma fetal, cariotipo, ecografías seriada cada 3 semanas para evaluar crecimiento fetal y volumen de liquido amniótico, y pruebas de bienestar fetal con perfil biofísico, monitoria, etc. luego de semanas 30-32 de gestación. [1,8] Aunque no existe consenso general, se recomienda cesárea electiva luego de semana 37 de gestación para evitar lesiones en el momento del parto, se debe programar el parto en institución de III nivel de atención , con disponibilidad de equipo multidisciplinarios, obstetras, pediatras, cirujano pediatra y disponibilidad de uci neonatal.[6,7] Capítulo 105 Anomalias del tallo corporal: Definición: Es un defecto grave del cierre de la pared abdominal anterior caracterizado por evisceración de órganos toraco abdominales los cuales se encuentran unidos a la placenta, cifoescoliosis severa, cordón umbilical corto o ausente.[10] Epidemiologia: Las anomalías del tallo corporal se presenta en 1/14,000 nacidos vivos, con incidencias mayores en primer y segundo trimestre de gestación 1/4,000 a 1/7,500.[1,10] La anomalías del tallo corporal, se consideran defectos esporádicos y no se relacionan con defectos cromosómicos, sin embargo las anomalías asociadas son frecuentes entre ellas : espina bífida, displasias del tórax, riñones hipoplasicos, atresias gastrointestinales, ausencia de genitales externos, extrofia cloacal entre otros. [12] Patogénesis: No se conoce a ciencia cierta, existe algunas teorías que son controvertidas. Normalmente entre el día 21 a 28 el disco germinal se generan cuatro plegamientos: cefálico, caudal y 2 laterales, luego se forma un tallo en la porción ventral que formara el cordón umbilical, posteriormente, la cavidad amniótica crece rodea el embrión oblitera la cavidad corionica y finalmente el amnios se fusiona con el corion a nivel del cordón umbilical. [11] La teoría más acepta describe que existe una anormalidad del plegamiento del disco embrionario, lo que impide la obliteración de la cavidad corionica y la formación del cordón umbilical, el corion tendrá comunicación directa con la cavidad peritoneal, por consiguiente la placenta va estar en contacto directo con las vísceras herniadas de la cavidad peritoneal.[7, 12] Diagnóstico prenatal: El diagnostico de esta patología se realiza en ecografía de primer trimestre con las siguientes características:[10] ‐ ‐ ‐ ‐ ‐ ‐ Cordón umbilical corto o rudimentario Protrusión de vísceras abdominales flotando en cavidad amniótica Cifoescolisis severa (70 casos) El feto se encuentra unido a la placenta Feto en hiperextensión con poca movilidad Múltiples anomalías asociadas 106 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnóstico diferencial: El diagnostico diferencial de los anomalías del tallo corporal incluyen , onfalocele aislado, gastrosquisis, síndrome de cordón umbilical corto entre otros.[12] Pronóstico: En general es una patología de muy mal pronóstico con mortalidad de 100%.[10] Manejo prenatal: Si el diagnostico de anomalía del tallo corporal se sospecha, se debe remitir paciente a institución de tercer nivel, para realizar ecografía de detalle y descartar patologías como onfalocele y gastrosquisis con curso más benigno. Esta patología no requiere estudio genético ya que la mayoría se estudios cromosómicos son normales. Si se confirma diagnostico de anomalía del tallo corporal en primer trimestre se puede ofrecer la interrupción voluntaria de la gestación.[12] 2. Anomalias del tracto digestivo Las patologías del tracto gastro intestinal representa cerca del 5% de las anomalías que pueden diagnosticarse prenatalmente[6], suelen diagnostica de forma indirecta y las características más sobresaliente es la alteración de la visualización de cámara gástrica (ausencia de burbuja gástrica, doble burbuja gástrica) en el corte axial del abdomen y el polihidramnios que se observa muy frecuentemente[8]. Atresia esofagica Definición Es una anomalía en la comunicación entre el segmento proximal del esófago y el segmento distal por ausencia o una alteración en el desarrollo del segmento intermedio. El 90% de los casos existe una comunicación anormal con la tráquea (fistula traqueo esofágica).[8,13] Epidemiologia La incidencia de esta patología es de 1 en 2500 a 1 en 4000 nacidos vivos [8]. Las anomalías mayores asociadas se encuentran entre 40 a 70% de los casos, entre ellas (del tracto digestivo 28%, cardiovascular 24%, genitourinario 13%, osteomuscular 11% , etc.). El riesgo de anomalías cromosómicas es elevado entre 20 a 40% para trisomía 18 y trisomía 21, especialmente en los casos de atresia sin fistula traqueo esofágica (tipo A) muy relaciona con S. Down [8]. Capítulo 107 El riesgo de síndromes no cromosómicos y asociaciones es elevado [14]. ANOMALIAS MONOGENICAS Gen Síndrome CHD7 CHARGE Feingold MYCN Opitz G MID1 AEG SOX2 anomalía Coloboma, cardiopatía, Atresia de coanas, Retraso del crecimiento, anomalías Genitales y de oídos Atresia intestinal, microcefalia, cardiopatía, anomalías de los dedos Fisura laringotraqueoesofágica, hipertelorismo, hipospadias, labio/paladar hendido, cardiopatía, atresia anal, retraso en el desarrollo Anoftalmia, atresia Esofágica, anomalías Genitales ASOCIACION NO CROMOSOMICA Anomalía vertebral, anorectal, cardiopatía, VACTERL anomalía renal, anomalía de extremidades, Modificado de “Julien Saada, Jean-Francois Oury, Gastroschisis, clinical obstetrics and gynecology Volume 48, Number 4, 964–972 2005” Embriológicamente la división del intestino anterior en tráquea y esófago ocurre alrededor de la semana 4 de gestación. Tanto la traque como el esófago se originan de un divertículo común en la cavidad faríngea primitiva, luego en la semana 5 aparece un septo que divide la tráquea del esófago. Si ocurre una anomalía en interrumpa la segmentación originara una atresia esofágica con grados diferente de fistulas traqueales.[13] Clasificación de anatómica de Gross y Vohgt [8]. Modificado por los autores. 108 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnostico prenatal El diagnostico ecografía se puede realizar luego de semana 25 de gestación la triada clásica: ‐ Polihidramnios: suele observarse luego de semana 24 de gestación , aislado no es un buen predictor de atresia esofágica pues solo se presenta en 44% a 58%, y en un gran número de anomalías fetales existe polihidramnios ‐ Ausencia de burbuja gástrica: realizando un corte transverso del abdomen no observamos la cámara gástrica. Tiene pobre sensibilidad ya que en casos de fistula traqueo esofágica (90% de casos) puede observarse cámara gástrica. Presencia de ´´Pouch´´: consiste en una dilatación proximal del esófago, que se observa a nivel cuello o en el mediastino superior. [14] ‐ Con estas tres características se alcanza una sensibilidad diagnostica de 80 a 100% y valor predictivo positivo 60 a 100%, si persisten en estudios ecográficos posteriores [14]. Diagnostico diferencial Los diagnósticos diferenciales incluyen patologías que generen ausencia de visualización de cámara gástrica (oligoamnios severo, masa intratoracica que comprima el esófago, hernia diafragmática, labio leporino y síndromes neuromusculares que causen dificultad en la deglución) [7,8,14]. Pronostico El pronóstico posnatal de la atresia esofágica depende de cuatro factores: 1.anomalías cromosómicas y estructurales asociadas, 2. complicaciones respiratorias, 3. peso al nacer y 4. Edad gestacional al parto [13]. Si el defecto es aislado y parto es luego de semana 32 la sobrevida es superior al 90% [7]. Manejo prenatal Si existe sospecha diagnostica la gestante debe derivarse a un tercer nivel de atención y es candidata para realizar ecografía de detalle, ecocardiografia fetal, amniocentesis y es mandatorio el cariotipo (alto riesgo de S. Down y trisomía 18) [8]. Se debe realizar seguimiento estrecho por riesgo de restricción de crecimiento fetal (40% casos), parto pretérmino por polihidramnios. El parto se recomienda al término o luego de semana 34 en institución que cuente con uci neonatal y cirugía pediátrica. Capítulo 109 Atresia duodenal Definición Es la obliteración total o parcial de la luz del intestino delgado, en 80% de los casos la obstrucción es completa y es caudal a la ampolla de Vater y el 20 % puede ser obstrucciones parciales (estenosis)[8]. Epidemiologia La incidencia de esta malformación es de 1 en 10,000 nacidos vivos. La mayoría de los casos de considera una condición esporádica, sin embargo se ha descrito casos de herencia autosomica dominante. Las malformaciones asociadas se presentan en un 40 a 50 %, especialmente otras anomalías digestivas 30% (atresia esofágica, mal rotación intestinal, agenesia anorectal) , anomalías vertebrales 33%, cardiacas 30% , etc. [12] El riesgo de anomalías cromosómicas es elevado alrededor de 40%. El síndrome de Down es el de mayor incidencia.[8] Clasificación [15] Tipo I: Presencia de diafragma completo de la mucosa o submucosa es la más frecuente y se observa en 69% de los casos. Tipo II: Presencia de extremos ciegos de asa intestinales conectados por bandas fibrosas, representan el 2% de los casos. Tipo III: atresia con dos extremos ciegos totalmente separados, 7% de los casos Tipo IV: obstrucción mecánica secundaria a páncreas anular, correspode al 20% de los casos. Patogénesis Dos teorías Teoría de recanalización de Tandler: En semanas 5 embrionaria se ocluye la luz del duodeno por proliferación epitelial rápida, con posterior vacuolización y recanalización en la semana 11. Si se produce una alteración en la recanalización genera la anomalía.[12] Teoría vascular: una obstrucción de suministro de sangre durante organogénesis temprana, dejara esa parte del intestino isquémica, sin posterior alteración del desarrollo.[8] 110 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnostico prenatal El diagnostico prenatal suele realizarse luego de semana 24 de gestación y las dos principales claves diagnosticas son la imagen de la doble burbuja gástrica cuando se realiza un corte axial del abdomen y el polihidramnios este último se presenta en el 53% de los casos. ‐ Doble burbuja : es el signo más característico en la atresia duodenal y se debe a la imagen de la cámara gástrica dilatada proximal al píloro y el duodeno dilatado, para realizar el diagnostico siempre se debe demostrar la comunicación entre las dos burbujas.[12] El diagnostico ecográfico solo se alcanza el 52 % de los casos , con una tasa de falsos positivos del 3%. Diagnostico diferencial Cualquier condición que genera una imagen similar a la doble burbuja a nivel abdominal es un diagnostico diferencial entre ellas: páncreas anular, bandas de Ladd, duplicaciones gástricas o duodenales, vólvulos, lesiones quísticas (quistes del colédoco, renales esplénicos), una técnica inadecuada de toma de imagen abdominal al quedar muy oblicua puede dar una falsa imagen de doble burbuja[8]. Imagen 3. Corte axial de abdomen donde se observa la imagen de doble burbuja. Cortesía de Dr. Arenas/universidad Nacional de Colombia/hospital Engativá Pronóstico: En general es una patología de buen pronostico cuando se presenta en forma aislada con sobrevida mayor al 90% , sin embargo cuando se encuentran anomalías asociadas la mortalidad es superior al 40%.[8,12] Capítulo 111 Manejo prenatal Cuando se confirma el diagnostico de atresia duodenal se debe realizar estudio genético con cariotipo, ecografía de detalle para diagnosticar malformaciones asociadas, e incluir un ecocardiograma fetal. Se debe realizar seguimiento estrecho de la gestación por altas tasas de parto pretérmino y restricción de crecimiento fetal[8,12, 15]. Atresia intestino delgado Definición Las atresias se refieren a la obstrucción completa del lumen intestinal, sin embargo son más comunes las estenosis (obstrucciones parciales). Las atresias pueden ocurrir en cualquier segmento del intestino, sin embargo son más frecuente en el yeyuno proximal (30% de los casos) y en el ilion distal (35% de los casos).[12,16] Epidemiología Incidencia es de 1 caso en cada 3,000 nacidos vivos.[12] El riesgo de anomalías cromosómicas asociadas y otras anomalías no cromosómicas mayores es relativamente bajo [8]. Sin embargo la frecuencia de anomalías gastrointestinales concomitantes es superior al 45%, las más frecuentes incluyen malrotación intestinal, peritonitis meconial, microcolon, atresia esofágica entre otros.[7,12,16] Clasificación [12,16] Tipo I: existe un diafragma intraluminal completo de mucosa , submucosa y musculo se observa en 32% de los casos. Tipo II: se evidencia dos segmentos ciegos de asas instetinales conectadas por bandas fibroticas, representa cerca del 25% de los casos. Tipo III: se subclaifica en tipo A y tipo B - Subtipo III A: atresia con dos segemntos ciegos totalmente separados, corresponde al 15% de los casos. - Subtipo III B: existe un defecto mesentérico, asociado a la deformidad de AppelPeel, corresponde al 11% de los casos. Tipo IV: corresponde al 6% de lo casos y se caracteriza por atresias intestinales multiples. 112 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Patogénesis La etiología del defecto es desconocida, sin embargo que se genera por pequeños insultos vasculares durante la organogénesis intestinal, esto fue apoyado por el trabajo experimental por Louw y Barnard (1955), que indujeron pequeñas atresias intestinales en los animales al ligar vasos mesentéricos en el útero.[8,14] Diagnóstico prenatal El diagnostico ultrasonografico se realiza cuando aparecen signos de obstrucción intestinal fetal, por ejemplo asas dilatadas (mayor a 15 mm de longitud y 7 mm de diámetro) y/o espesor intramural mayor de 3mm. Estos hallazgos su suelen ser evidentes luego de semana 24 y en tercer trimestre por aparición de peristalsis vigorosa. El abdomen puede distenderse con un aumento asimétrico en la circunferencia abdominal y si aparece íleo meconial la ecogenicidad intestinal aumenta .[16] El polihidramnios suele presentarse en menos del 50% , es más frecuente en obstrucciones proximales y en obstrucciones severas. Si la perforación intestinal se produce, pueden ocurrir ascitis transitoria, peritonitis meconial y pseudoquistes de meconio.[7,12,16] La resonancia nuclear magnética se está utilizando como completo, para evaluación obstrucciones intestinales en fetos, aunque parece ser mas específica para el diagnostico de obstrucción intestinal, todavía no se ha estandarizado sus hallazgos.[16] Diagnóstico diferencial Los hallazgos ultrasonograficos son similares a los observados en la enfermedad de Hirschprung (megacolon agangliónico), el vólvulos, ilio meconial, duplicaciones intestinales entre otros. [8,12] Pronóstico El pronóstico depende de 5 factores: 1. Tipo de atresia (atresia tipo IIIb y tipo IV son de pobre pronostico); 2. Presencia de anomalías asociadas; 3. Extensión total de intestino comprometido; 4.presencia de complicaciones (ilio meconial, peritonitis o quiste de meconio) y 5: peso al nacimiento.[8,16] Manejo prenatal Luego del diagnostico se debe realizar ecografía de detalle para descartar anomalías asociadas, si no existen anomalías asociados, no está indica realizar cariotipo fetal. Se debe realizar seguimiento en tercer nivel para evaluar casos de perforación intestinal, crecimiento fetal y amniodrenaje en casos de polidramnios severo que pueda generar riesgo de parto pretérmino. Capítulo 113 se considera que el parto vaginal debe ser la regla y realizado en sitio de alta complejidad con equipo interdisciplinario que incluya cirugía pediátrica y uci neonatal.[8,12,16] Atresia de colon Las atresias completas del colon son raras, sin embargos las obstrucciones parciales y distales se presenta con cierta frecuencia, incluyen enfermedad de Hirschsprung y malformaciones anorectales. a. Enfermedad de Hirschsprung La agangliosis distal del colon, conocida como Enfermedad de Hirschsprung es una de las causas más frecuente de obstrucción intestinal distal en los recién nacidos. Ocurre debido a alteración de la migración de los neuroblastos desde la cresta neural a los segmentos distales del colon. [7,17] Epidemiologia La incidencia esta patología es 1 en 5,000 nacidos vivo, con afectación más frecuente a fetos masculinos que a los femenino razón 4:1. [17] El riesgo de anomalías cromosómicas es bajo, y solo se asocia a sindrome de Down el 2% de los casos. Por otra parte el riesgo de anomalías asociadas no cromosómicas varía del 16 al 32% de los casos (cardiopatías, anomalías renales, síndrome de Smith–Lemli– Opitz, entre otros). [16,17] Diagnóstico prenatal Los hallazgos ultrasonograficos son inespecíficos, la sospecha diagnostica se realiza con la triada: polihidramnios, distensión progresiva de intestino proximal y aumento de la circunferencia abdominal, en ocasiones puede observarse intestino ecogénicos. El diagnostico de certeza se realiza en la vida posnatal, ya que la patología suele dar síntomas luego de 24 horas posparto. [12] El pronóstico y el manejo obstétrico es similar a la atresia del intestino delgado. b. Malformación anorectal Las anomalías del ano y el recto son anomalías de etiología desconocida ,por lo general han sido explicados como una detención del descenso caudal del septum urorectal, hacia la membrana cloacal entre 4 y 8 semanas de gestación. Las anomalías resultantes van desde el ano imperforado hasta la cloaca persistente.[16] 114 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Epidemiología Suele ser una patología rara con una incidencia es superior a 1 en 5,000 a 10,000 nacidos vivos.[12] el riesgo de anomalías asociadas es elevado 70 a 90% casos, tanto cromosómicos donde la trisomía 18 y 21 son las predominantes, así como síndromes no cromosómicos asociado por ejemplo( asociación VACTERL, sindrome de regresión caudal, sirenomelia ).[8,12] Diagnóstico prenatal El diagnostico ultrasonografico suele ser difícil ya que en la mayoría de los casos de anomalías rectales muy distales como ano imperforado el desarrollo fetal es normal. Los hallazgos sugerente de esta patología es la sobre distensión del recto y en ocasiones saco rectal hiperecogénica por presencia de meconio.[16] Pronóstico Cuando ocurre un caso aislado el pronóstico es bueno, sin embargo la mayoría se asocia a trastornos cromosómicos y anomalías mayores asociadas, que determinan un mal pronóstico.[8] c. Atresia de colón Es una patología muy rara y representa menos del 10% de las atresias intestinales. La etiopatogenia es por alteraciones vasculares , similar a la que ocurren en atresias del intestino delgado. [16] Epidemiología Incidencia de 1 en 10,000 nacidos vivos. El riesgo de presentar anomalías cromosómicas es muy bajo, sin embargo el riesgo de otras anomalías gastrointestinales concomitantes es cercana al 50%. [12,16] Diagnóstico prenatal Diagnostico es difícil ya que en pocas ocasiones se observa polihidramnios, pero cualquier dilatación proximal al colon puede hacer sospechar el diagnostico. [16] Pronóstico y manejo prenatal se realiza similar a la atresia del intestino delgado. 3. Masas quisticas no intestinales Las lesiones quísticas abdominales fetales es una hallazgo relativamente frecuente, a menudo se detectan cuando se realiza un estudio anatómico de rutina entre semana 18 a 24 de gestación. Pueden surgir prácticamente de cualquier órgano abdominal, sin Capítulo 115 embargo, los sistemas urogenitales y gastrointestinales son los más comúnmente involucrados. [18,19] Se pueden presumir su etiológica dependiendo de su localización. Localización Anomalía cuadrante superior derecho -quistes del colédoco -quistes hepáticos -quiste esplénico -quistes renales -hidronefrosis -quistes mesentéricos - varices de la vena umbilical -quistes de ovario -uretrocele -quiste del uraco -hidrometrocolpos Cuadrante superior izquierdo Posterior Anterior y abdomen medio Abdomen inferior Quistes de ovario Definición Suelen ser quiste funcionales benignos del ovario, frecuentemente unilateral, sin embargo se han casos de bilateralidad. Pueden tener unos pocos milímetros diámetro hasta a 7-10 cm, ser simples o complejos, si existe ecos en su interior se debe descartar torsión o infarto. [8,18] Epidemiologia Es una patología relativamente rara, con una incidencia de 1 en 1000 a 1 en 2600 nacidos vivos[12]. Suele ser un defecto aislado aunque se ha relacionado con casos de hipotiroidismo fetal. por otro lado el riesgo de anomalías tanto cromosómicas como no cromosómicas es muy bajo.[8] Patogénesis Los fólicos ováricos primarios aparecen a la semana 20 de gestación y los fólicos de Graff hacia el séptimo mes. Aunque no es muy clara la causa de los quistes ováricos, se considera que ocurren por estimulación hormonal (estrógenos maternos, gonadotrofinas fetales y gonadotrofina corionica placentaria).[12,18] 116 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnostico prenatal El diagnóstico de quiste de ovario es un diagnostico de exclusión, al descartar otras patologías quísticas genitourinarias y digestivas, en tercer trimestre de gestación. [12] Criterios diagnósticos [7,12,18] ‐ ‐ ‐ ‐ ‐ Presencia de estructura quística a un lado de abdomen fetal Descartar patología del sistema urinaria y gastrointestinal Feto femenino Polihramnios se presenta en solo 10% casos En casos de quistes mayores de 5 cm o quites complejos de debe descartar torsión Diagnostico diferencial Entre los diagnosticos diferenciales se encuentran quistes mesentericos, del uraco, quistes del tracto urinario, duplicaciones intestinales entre otras. El diagnostico prenatal de certeza no se puede establecer en la mayoria de los casos, ya que no se pueden descartan totalmente anomalias digestivas ni urinarias.[8,12,19] Pronóstico Es un una patología de buen pronostico, ya que la tasa de regresión espontanea por parto es muy alta, debido a la caída de niveles hormonales.[12] Manejo prenatal El seguimiento obstétrico no varía con respecto a la población general, no están indicadas la intervenciones tales como amniocentesis para cariotipo, ni el drenaje del quiste. Se puede realizar seguimiento ecográfico en tercer trimestre, especialmente quistes mayores de 5 cm para descartar complicaciones entre ellas.[19] ‐ Quistes mesentéricos: Malformación benigna, que consisten en estructuras quísticas llenas de líquido o quilo, situadas en el mesenterio del intestino delgado o grueso y en ocasiones en el epiplón. Esta patología suele ser de origen linfático. Diagnostico se suele realizar al final de segundo trimestre y en el tercer trimestre, ecográficamente se observa una masa quística unilocular o multilocular, de pared delgada a la evaluación del abdomen fetal. El manejo prenatal no varía, no está indica Capítulo 117 realizar intervención fetal, los diagnósticos diferenciales son similiares a los del quiste de ovario. [] Quistes hepático Los quistes hepáticos son lesiones solitarias, intrahepáticas, unicolulares, suelen estar ubicadas en el lóbulo derecho del hígado y más frecuentemente halladas en fetos femeninos. Se cree que ocurre por interrupción en el desarrollo de la vía biliar o por alteraciones vasculares intrahepáticas. ecográficamente se observa como masas quísticas uniloculares en cuadrante superior derecho del abdomen fetal, en ocasiones se asocia a poli hidramnios. El diagnostico es de exclusión y se confirma en la vida posnatal.[1] Quistes biliares Los quistes del colédoco es una dilatación quística congénita poco común del conducto biliar común. Epidemiológicamente se considera una incidencia de 1 en 2,000 nacidos vivos. Diagnostico, se realiza atreves de la ultrasonografia, observando lesiones quísticas localizadas en cuadrante superior derecho del abdomen y ductos biliares proximales dilatados. El diagnostico diferencial incluye, quistes hepáticos, quiste de ovario, etc.[1,12] Conclusiones Todas las patológicas abdominales y del tubo digestivo, únicas o asociadas a otras anomalías ya sea cromosómicas o estructurales, diagnosticadas prenatalmente, deben ser referidas a una unidad de medicina materno fetal o un centro de alta complejidad, que cuente con un equipo multidisciplinario, para manejo prenatal y posnatal. Bibliografia 1. Asim Kurjak, Frank A. Chervenak, Malformations of the Gastrointestinal System. Textbook of Perinatal Medicine 2006. 2. Mark I. Evans, Prenatal Diagnosis, Normal and Abnormal Findings of the Fetal Abdomen and Anterior Wall, CHAPTER 20, 2006. 3. Julien Saada, Jean-Francois Oury, Gastroschisis, clinical obstetrics and gynecology Volume 48, Number 4, 964–972 2005 4. Daniel J. Ledbetter, Gastroschisis and Omphalocele, Surg Clin N Am 86 (2006) 249– 260 5. Patricia C. Santiago-Muñoz, MD, Donald D. McIntire, Outcomes of Pregnancies With Fetal Gastroschisis, The American College of Obstetricians and Gynecologists, VOL. 110, NO. 3, September 2007. 118 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 6. Julia G. Fernández, María Ramírez, Defectos abdominales y del tubo digestivo, Actualización Obstetricia y Ginecología 2011 7. M. Herrera, M. Rebollero, ¨Medicina Fetal, Curso prenatal de anomalías congénitas¨ Colsanitas 2005. 8. D. Paladini , P. Volpe, Ultrasound of Congenital Fetal Anomalies, capitulo 7 anomalies of the gastrointestinal tract and abdominal wall 2007. 9. Patricia Muñoz O, Defectos de Pared Anterior del Abdomen: Diagnóstico prenatal y seguimiento. Rev Chil Ultrasonog 2006; 9: 72-79. 10. Cafici D., “Ultrasonografía en obstetricia y diagnóstico prenatal”, Editorial Journal. Primera Edición, 2007. Capítulo 15 Evaluación ultrasonográfica de los defectos de cierre de la pared anterior del abdofetal., Pág 321- 342 11. Sadler, “Langman: Embriología médica con orientación clínica” Octava Edición. Capítulo 13 Aparato digestivo. Pág 262-293 12. Diana W. Bianchi, Timothy M. Crombleholme, Fetology: Diagnosis and Management of the Fetal Patient 1st edition (April 26, 2000) 13. G. CENTINI, L. ROSIGNOLI, A. KENANIDIS and F. PETRAGLIA, Prenatal diagnosis of esophageal atresia with the pouch sign, Ultrasound Obstet Gynecol 2003; 21: 494– 497. 14. Veronique Houfflin-Debarge, Julien Bigot, Ultrasound and MRI Prenatal Diagnosis of Esophageal Atresia: Effect on Management, Volume 52, Supplement 1, May 2011 15 Agostino Pierro , Nigel J. Hall, Moti M. Chowdhury, Anomalías congénitas del tracto gastrointestinal, Current Paediatrics (2006) 16, 153–164 16. Dorothy I Bulas, uptodate 2011 Prenatal diagnosis of gastrointestinal atresia and obstruction, 17. Julio de Manueles Jiménez, Enfermedad de Hirschsprung, Protocolos diagnósticoterapéuticos de Gastroenterología, Hepatología y Nutrición Pediátrica SEGHNP-AEP 18. Agarwal R. Sonographic assessment of fetal abdominal cystic lesions : A pictorial essay. Indian J Radiol Imaging 1999;9:169-82. 19. Joshua A. Copel, What you need to know about fetal abdominal masses, Obstetrics/Gynecology & Women's Health 2010. Capítulo 119 5.5 Valoración y anormalidades del sistema urogenital Alteraciones del desarrollo renal: Epidemiologia: Dentro de las alteraciones del desarrollo fetal, las anormalidades del tracto urinario representan un 20 %, donde las alteraciones graves letales implican el 10 %. (1). El uso del ultrasonido permite diferenciar tempranamente, entre un feto normal y anormal, no siendo menos importante el uso de la Resonancia Magnética Nuclear fetal para un estudio más detallado. (1) Examen Normal: La visualización ecográfica de las siluetas renales inicia desde las 13 – 14 semanas de gestación, como estructuras ecogénicas ovales bilaterales paraespinales a nivel lumbar, en un corte longitudinal. (2) Con el progreso de la gestación se va produciendo un incremento progresivo del tamaño (1), con deposito de grasa retroperitoneal que mejora la delimitación y visualización de las siluetas renales fetales (Imagen 1)(2), manteniendo constante la relación circunferencia renal y abdominal (valor normal entre 0.27 – 0.30)(1) Imagen 1. Cortesía Instituto Materno Infantil – Sonogyn Dr Alviar, 2010 A lo largo de la gestación cambia su ecogenicidad; siendo hiperecogénicos en primer trimestre, la cual va disminuyendo progresivamente con la aparición de la diferenciación 120 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional cortico medular desde las 20 semanas, los cálices renales no son visibles en los riñones fetales normales. (1) La vejiga (Imagen 2) se puede visualizar a partir de la aparición de la producción de la orina a las 10 semanas, siendo siempre identificada a las 20 semanas, pues desde esta semana se incrementa hasta tres veces la producción de orina (3). Se debe recordar que en el corte transversal que visualiza la vejiga, se pueden evidenciar las arterias umbilicales (Imagen 2). Imagen 2 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 El uréter fetal no debe ser visible, pero en un bajo porcentaje puede serlo aunque siempre se debe sospechar su dilatación patológica. (2) La uretra normal en el feto puede identificarse de vez en cuando como una línea hiperecogenica que se extiende a lo largo del pene, En fetos femeninos es difícil de visualizarla al igual que el útero y los anexos normales. (2) En los fetos masculinos puede verse los testículos solo cuando han descendido al escroto. (2) Los genitales externos se aprecian desde el segundo trimestre hasta en el 98 % de los casos, asignándose el sexo con buena precisión, sin tener impacto relevante clínico, excepto en casos como los gemelos, en fetos con sospecha de patología obstructiva, alteraciones ligadas al cromosoma X. El sexo femenino (Imagen 3) solo se asigna al identificar los labios mayores y menores, no por ausencia de visualización del pene, se pueden detallar el glande (Imagen 4), la uretra y los cuerpos cavernosos en el feto masculino. (2) Capítulo 121 Imagen 3. Cortesía Instituto Materno Infantil – Sonogyn Dr Alviar, 2010 Imagen 4 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 122 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Alteraciones del sistema urinario: Hidronefrosis: Definición: Corresponde a la dilatación anormal de las vías urinarias; haciendo parte de cuadros clínicos urológicos.(4). Epidemiologia: Es una alteración frecuente en la gestación puede encontrarse hasta en un 5 % de todas las gestaciones. La incidencia prenatal de hidronefrosis es de 2 – 9 x 1000. (11) Diagnóstico: Se debe realizar la medición del diámetro Anteroposterior (Imagen 5) de la pelvis renal; que debe ser mayor de 4 mm en el segundo trimestre y mayor de 7 mm en el tercer trimestre, las mediciones se deben realizar en un plano transversal del riñón, su dilatación sugiere patología renal, mas no es una patología especifica. (5), teniendo en cuenta que hay factores que pueden alterar la producción de orina, entre ellos la edad gestacional, la hidratación materna y distención de la vejiga. (4) Imagen 5. Cortesía Instituto Materno Infantil – Sonogyn Dr Alviar, 2010 Las dimensiones de la pelvis renal pueden incrementarse normalmente con la edad gestacional, por lo cual hay valores diferentes para la primera y segunda mitad de la gestación, teniendo en cuenta la falta de conceso al respecto y las múltiples revisiones que relacionan los valores con sensibilidad y especificad de la patología. (4) Capítulo 123 Durante la evaluación prenatal se debe considerar la unilateralidad frente a la bilateralidad, la presencia de alteraciones de liquido amniótico (oligoamnios anhidramnios) (Imagen 6). Imagen 6. Cortesía Instituto Materno Infantil – Sonogyn Dr Alviar, 2010 Clasificación: El grado de dilatación de la vía urinaria, puede ser expresado de varias formas siendo la más simple: Leve, moderada y severa, o pelviectasia, pelvicaliectasia y caliectasias, que describe la extensión topográfica de la hidronefrosis, la pobre objetivización y reproductibilidad inter-observador de esta patología no ha permitido una buena acogida de esta última. (4) Grado de Dilatación 2do trimestre 3er trimestre Riesgo de Patología (Imagen 7) postnatal (8) Leve 4 a < 7 mm 7 a < 9 mm 11 % Moderada 7 a < 10 mm 9 a < 15 mm 45 % Severa > 10 mm > 15 mm 88 % Por otro lado tenemos la clasificación propuesta por la Sociedad de Urología fetal (Adapt de 4), basada en la apariencia posnatal del parénquima renal. Ha mostrado una buena correlación intra-observador pero modesta interobservador (7), una de las falencias que ha presentado esta; es la falta de clasificación para la dilación 124 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional segmentaria de los cálices renales o del adelgazamiento de la corteza renal, por lo cual proponen una subclasificación de la número cuatro. (8) Imagen 7 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Grados de Hidronefrosis infantil según la SFU (Adaptada de 4) GRADO 0 No dilatación GRADO 1 Dilatación de la pelvis renal. GRADO 2 Dilatación de las pelvis extrarrenales, y cálices mayores GRADO 3 y Dilatación además de cálices menores de manera uniforme parénquima renal preservado (Imagen 8 Riñón Superior) GRADO 4 Dilatación anterior más adelgazamiento del parénquima renal. (Imagen 8 Riñón inferior e imagen 9) Capítulo 125 Imagen 8 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Imagen 9 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 126 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Manejo Prenatal: Las intervenciones van dirigidas a preservar la función renal, y proveer un adecuado ambiente fetal que permita la maduración pulmonar fetal; se debe completar el estudio fetal, para descartar patologías estructurales asociadas que sugieran un síndrome y puedan cambiar el pronóstico fetal. Las opciones de manejo deben ser estudiadas por un grupo interdisciplinario, incluyen seguimiento ecográfico de las lesiones, imágenes y estudio postnatal; cirugía fetal y derivación vesico-amniotica (12); todos estos de acuerdo a la etiología de la Hidronefrosis. La hidronefrosis unilateral rara vez requiere ser intervenida, como si lo debe ser la severa bilateral, con oligoamnios secundario, frecuentemente asociado a válvas uretrales posteriores. El equilibrio del manejo prenatal está en la separación de las pacientes cuya función renal fetal esta en riesgo, vs las que no van a sufrir consecuencias fetales graves. (12) Pronóstico: La frecuencia de los hallazgos patológicos postnatales asociados a la hidronefrosis se incrementan con el grado, entre ellos dilatación transitoria del sistema colector (41 – 80 %), uropatia obstructiva del tracto urinario superior (10 -30 %) e inferior (5-10 %) y procesos no obstructivos como reflujo vesico – utereteral (10-20 %), megaureteres (5 %), displasia renal multiquística (4 %), atresia uretral (2 %), ureterocele, uréter ectópico y sistema doble (5 - 7 %), enfermedad renal quística, megalouretra y síndrome de Prune Belly, estos últimos son poco comunes. Valvas uretrales posteriores y atresia uretral: Definición: Corresponde a la presencia de valvas uretrales posteriores y ausencia uretral, causando obstrucción del tracto urinario inferior. Epidemiologia: La obstrucción del Tracto urinario inferior aparece en un 2.2 por 10.000 nacimientos; siendo consecuencia de una serie de procesos patológicos; entre ellos las valvas uretrales posteriores en un 64 % y la atresia uretral en un 39 %. Afectando frecuentemente a los fetos masculinos y encontrando patologías más complejas en los fetos femeninos. (16) Capítulo 127 Diagnóstico: El ultrasonido puede detectar la obstrucción del tracto urinario inferior con una sensibilidad del 95 % y especificidad del 80 %, sin permitir la determinación de la etiología. (16) Se sospechara cuando encontramos hidronefrosis (frecuentemente bilateral), megavejiga, adelgazamiento de la pared vesical, uretra posterior dilatada; el oligoamnios sugiere la presencia de obstrucción de la vía urinaria baja, que se diagnostica entre el 1er y segundo trimestre, sin embargo entre más temprano se realiza el diagnostico prenatal se asocia a atresia uretral. (5) La resonancia magnética nuclear ha entrado a jugar un papel importante en el estudio y seguimiento del diagnostico prenatal, puesto que no requiere del mejoramiento de la resolución que se obtiene con el líquido amniótico en la ecografía obstétrica. (16) Manejo Prenatal: Es necesario realizar un estudio ecográfico completo, descartando anomalías estructurales adicionales, además de considerar la posibilidad del cariotipo dada su asociación a cromosomopatías; la determinación del sexo es importante pues hay mayor asociación con el sexo masculino. Se debe considerar la posibilidad de la intervecion in utero como la derivación vesico amniótica cuando se ha descatardo cromosomopatias y alteraciones estructurales adicionales. (16) Pronóstico: Se asocia a alta morbi-mortalidad dado por la displasia quística y disfunción renal progresiva, el oligohidramnios y la hipoplasia pulmonar secundaria. (16) Se debe realizar seguimiento ecográfico en busca de indicadores de mal pronóstico como la displasia quística renal, oligoamnios, alteraciones estructurales adicionales y el uroanalisis. Se debe descartar en todos los casos el síndrome de microcolón, megaquiste.megaureter, mas frecuente en fetos femeninos, de peor pronóstico. (16) Enfermedad renal quistica Definición: Corresponde a una patología muy amplia pues abarca numerosas enfermedades congénitas, del desarrollo o adquiridas que comparten la presencia de quistes en uno o en ambos riñones, con causas diferentes pero con una expresión morfológica similar, mientras que una patología puede tener una expresión morfológica variable. 128 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Clasificación: Los quistes renales ha sido clasificados de múltiples maneras por su patología, etiología génetica y expresión clínica, esta ultima nos permite una diferenciación entre los quistes renales de origen genético, que es primordial conocerla al realizar el diagnostico ecográfico(tamaño renal, ecogenicidad, presencia o no de diferenciación cortico medular, tamaño de los quistes, número, localización y características asociadas (11 ). Clasificación de los QUISTES RENALES: Genéticos (hereditarios): - Enfermedad renal poliquística (autosómico dominante(Potter III), autosómica recesiva(Potter I)) - Enfermedad quística medular (nefronoptisis) - Enfermedad glomeruloquística (autosómica dominante, esporádica) - Síndromes de malformación ( Meckel-Gruber, Bardet-Biedl, esclerosis tuberosa) - Enfermedad renal microquístico (síndrome nefrótico congénito) Condiciones NO genéticas: - Displasia renal quística (riñón displásico multiquístico(Potter II), displasia renal obstructiva) - Quistes no génicos, no displasicos. Quiste simple Riñón en esponja medular Neoplasias renales quísticas (nefroma quístico multilocular) Quistes adquiridos (insuficiencia renal crónica) - Quistes renales de origen no tubular (insuficiencia renal quiste del seno endodermico, quistes pielocalicial) Desordenes Hereditarios: 1. Enfermedad renal poli quística autosómico dominante (Potter tipo III): Tiene prevalencia de 1 en 400 a 1 en 1000 nacidos vivos. Hallazgos característicos: corresponden a riñones de tamaño y ecogenicidad normales, con presencia de quistes en número limitado en la medula o en la corteza. (4); un segundo patrón corresponde a la visualización de glomeruloquistes, con riñones incrementados de tamaño, hiperecogenicos y quistes subcapsulares discretos. Capítulo 129 2.Enfermedad renal poli quística autosómico recesiva(Potter tipo I): Tiene prevalencia de 1 en 20.000 nacidos vivos. Compromiso renal bilateral y de hígado Amplia variación del espectro clínico: ‐ Forma perinatal: Enfermedad renal severa ‐ Forma juvenil: Predominio del daño hepático Hallazgos ecográficos: El patrón ecográfico (Imagen 10) es variable, sin embargo es característica su asociación a alteraciones hepáticas; los hallazgos renales corresponden a nefromegalia bilateral, con hiperecogenicidad difusa de la corteza y la medula, pérdida de la diferenciación cortico-medular, pobre definición del sistema colector, al progresar la gestación se evidencia disminución del tamaño renal, vejiga ausente y oligohidramnios según la recesividad. En el hígado fetal se puede encontrar hepatomegalia, con predominio de lóbulo izquierdo, hiperecogenicidad, dilatación quística o focal de la vía biliar, hipertensión portal asociada a fibrosis hepática. Imagen 10. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2012 130 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 3.Riñón displasico multiquístico (Potter tipo II): Epidemiología: Es la masa abdominal más frecuentemente encontrada en los recién nacidos después de la hidronefrosis (3); la prevalencia es de 1 en 1000 a 1 en 2000 fetos, y de 1 en 4000 recién nacidos. Predominio sexo masculino 2:1(14) Clasificación: Potter II A(15) (Imagen 11): • Obstrucción severa antes de la semana 8 a 10 • Atresia proximal del uréter, con atresia pelvis renal. • Túbulos colectores aumentados de tamaño quísticamente. • Tiene tendencia a involucionar. Potter IIB (Imagen 12) : • Riñones rudimentarios con quistes. Uni-bilateral, segmentaria Hallazgos ecográficos: o Corresponde a una entidad en la cual se visualizan múltiples quistes no comunicantes de varios tamaños sin identificación de parénquima renal. Se debe tener cuidado pues puede ser confundida con uropatias obstructivas(9) o Aumento de tamaño – Masa paraespinal. o No hay parénquima normal. o Es importante valorar el riñón contra lateral: 40% con anomalías contra laterales, 10 % Agenesia renal, 19 % PII, 7 % hidronefrosis. o Puede haber una forma hidronefrótica: Daño más tardío en la vida fetal. o Oligoamnios. Capítulo 131 Imagen 11. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 Imagen 12. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 132 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 4. Displasia renal quística (Potter tipo IV): • Ocurre como consecuencia de enfermedades obstructivas, en un periodo mas tardío del desarrollo fetal; como(14): Obstrucción uretral. Obstrucción urétero-vesical. Unión urétero-pélvica. Disminución del flujo de la arteria renal. Hallazgos ecográficos(15): Los riñones pueden tener cualquier tamaño. Quistes de predominio cortical. Aumento de la ecogenicidad del parénquima renal. Grados variables de compromiso funcional renal 5. Quistes simples: Se pueden encontrar hasta en un 5 % de la población general a cualquier edad al realizar una ecografía abdominal. La incidencia se incrementa con la edad 0.22 % en niños, hasta 20 % a los 40 años. En los lactantes y niños, los quistes aparecen como lesiones anecoicas limitadas, solitarias, suelen resolver frecuentemente, por lo cual se les puede dar una manejo conservador.(13) Conclusion: Las alteraciones del desarrollo renal, corresponden a una de las patologías más frecuentemente encontradas en el diagnostico prenatal, razón por la cual se debe realizar un abordaje sistemático y juicioso de la patología; que permita un adecuado diagnóstico y manejo prenatal. Bibliografia 1. Toiviainen S, et al, Fetal hydronephrosis: is there hope for consensus?, Pediatr Radiol (2004) 34: 519–529 2. Callen P, Ecografía obstetricia y ginecología, El sevier, 2009. 3. Fagerquist M,et al (2001) Fetal urine production and accuracy when estimating fetal urinary bladder volume. Ultrasound Obstet Gynecol 2001 Capítulo 133 4. Garel, L, Renal Cystic Disease, Ultrasound Clin 5 (2010) 15–59 5. Nguyen T, Herndon A, Cooper C, Gatti J, Kirsch A, Kokorowski P, Lee R, Perez M, Metcalfe P, Yerkes K, Campbell J, The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis, Journal of Pediatric Urology , 2010. 6. Kitchens DM, Herndon CDA. Antenatal hydronephrosis. Curr Urol Rep 2009;10:126 7. Keays MA, Guerra LA, Mihill J, Raju G, Al-Asheeri N, Geier P, et al. Reliability assessment of Society for Fetal Urology ultrasound grading system for hydronephrosis. J Urol 2008; 180:1680. 8. Sibai H, Salle JL, Houle AM, Lambert R. Hydronephrosis with diffuse or segmental cortical thinning: impact on renal function. J Urol 2001;165:2293 9. Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal hydronephrosis as a predictor of postnatal outcome: a metaanalysis. Pediatrics 2006;118:586. 10. Rabelo EAS, Oliveira EA, Silva GS, Pezzuti IL, Tatsuo ES. Predictive factors of ultrasonographic involution of prenatally detected multicystic dysplastic kidney. BJU Int 2005;95: 868. 11. Shokeir A, Nijman R (2000) Antenatal hydronephrosis: changing concepts in diagnosis and subsequent management. BJU Int 85:987–994 12. Wilcox D, Management of fetal hydronephrosis, Pediatr Nephrol (2008) 23 13. McHugh K, Stringer DA, Hebert D, et al. Simple renal cysts in children: diagnosis and follow-up with US. Radiology 1991;178(2):383–5 14. http://www.kidneypathology.com/Enf_quisticas_dllo.html 15. Cafici, ultrasonido en obstetricia y Diagnóstico prenatal, 2003. 16. Lissauer D, et al. Fetal lower urinary tract obstruction, Seminars in Fetal & Neonatal Medicine, 2007. 5.6 Valoracion y anormalidades del sistema esqueletico: Alteraciones del desarrollo del sistema musculo – esqueletico: La valoración ecográfica del sistema musculo esquelético, requiere un acercamiento global del cuerpo fetal, ya que las displasias esqueléticas y enfermedades musculo esqueléticas comprometen más de una región anatómica simultáneamente; debido a la distribución ubicua de los huesos y músculos. La única excepción son los defectos de reducción de las extremidades congénitas y adquiridas (síndrome de bandas amnióticas), el cual es regional por definición. (1) La valoración del sistema musculo-esquelético requiere una valoración total que incluye: 134 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional › Cabeza, cráneo y SNC › Tórax y columna › Huesos largos y extremidades › Mineralización ósea › Contracturas y fracturas Anatomía normal del sistema musculo esquelético: La apariencia de los huesos cambia según la edad gestacional debido a la mineralización progresiva, de tal manera que en el tercer trimestre la fosa posterior y el tórax se evidencian más ecogénicos debido a la mineralización de la calota y las costillas; razón por la cual algunas displasias letales pueden identificarse entre las semanas 12-14, por la presencia de micromelia severa y temprana. ‐ Para valorar el cráneo se debe realizar en un plano axial (Plano transtalamico (Imagen 1)), visualizar el Contorno, ver la presencia de deformaciones sugestivas de sinostosis como el cráneo en trébol (displasia tanatofórica); en el plano medio sagital (Imagen 2), se debe valorar el perfil de la cara ya que la micrognatia es un hallazgo frecuente en las displasias esqueléticas. Imagen 1 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 135 Imagen 2 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 El grado de mineralización ósea del cráneo se visualiza mejor en un plano transtalámico. La hipo mineralización ósea, se puede ingerir cuando al realizar una presión con el transductor se deforma el cráneo, también permite una muy buena visualización del cerebro. ‐ Tórax y Columna vertebral (Imagen 3): Se evalúa en un plano sagital medio, que nos permite evaluar los cuerpos vertebrales, contorno de la piel, este plano permite detectar alteraciones como defectos del tubo neural, fusiones vertebrales, sospechar escoliosis, que se confirma con planos coronales de la columna, permite evaluar el grado de escoliosis, el plano parasagital a nivel de las paredes torácicas externas se utilizan para evidenciar alteraciones en la mineralización y forma de las costillas, así como fracturas; excluir hipoplasia del tórax. 136 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 3. Cortesía Instituto Materno Infantil – Sonogyn Dr Alviar, 2010 ‐ Extremidades y Huesos largos: Se evalúan en planos sagitales para evaluar compromiso: Rizomélico, mesomélico o acromélico, determinar si involucra toda la extremidad o solo una parte de ella, que se puede obtener mediante una baja magnificación de la imagen. Los cortes focales con alta magnificación permiten estudiar la anatomía del segmento afectado; es necesario tener una adecuada ubicación espacial de la extremidad. (Imagen 4, 5 y 6) Capítulo 137 Imagen 4. Fémur normal. Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Imagen 5, Tibia y peroné normales. Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 138 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 6, Longitud humeral normales. Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 De acuerdo a la valoración en la armonía entre los 3 segmentos de la extremidad, podemos encontrar acortamiento de tipo: Rizomélico (Imagen 11): Cuando se afecta al fémur y al húmero.(Figura 2) Mesomélico: Compromiso de la tibia - peroné y/o cubito – radio. Acromélico: Copromiso de manos y pies. Reciben este nombre cuando se afecta uno de estos huesos en la extremidad, cuando hay evidencia ecográfica de compromiso de tres los segmentos o toda la extremidad (Femur/Humero y Tibia/peroné - Cubito/radio y manos-pies) reciben el nombre de micromelia (Figura 1). ‐ Contracturas: Para evaluarlas se debe tener una imagen con baja magnificación, pues es lo que permite definirlas mejor, si el feto es muy grande se usan vistas sagitales separadas de las extremidades. Capítulo 139 Contracturas patológicas: Miembros inferiores hiperextendidos y piernas cruzadas en tijera por que la fuerza del extensor femoral es mayor que la fuerza de los flexores. Miembros superiores: los flexores (bíceps) tienen más fuerza que los extensores (tríceps) entonces aparecen flexionados con las manos cerradas sobre el tórax. Imagen 7, Pie equino varo, Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Imagen 8, Pies normales. Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 140 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Anormalidades del sistema musculo – esqueletico: 1. Craneo: Craneosinostosis: Afecta a 1 de cada 2000 niños. Es el cierre prematuro de las suturas craneales, que produce un redireccionamiento de las fuerzas, con un crecimiento compensatorio de las zonas donde las suturas están normales, y la deformidad en la bóveda craneana secundaria a cada alteración. Usualmente clasificadas en craneosinostosis sindromaticas (asociadas a otras anormalidades) y no sindromaticas (aisladas) que son de causa desconocida. El cierre prematuro de las suturas sagital, coronal, y metópicas está se conoce como escafocefalia, braquicefalia y trigonocefalia, respectivamente. La plagiocefalia se desarrolla cuando solo está comprometida una sutura la coronal o lambda. Torricefalia es determinada por el cierre de las suturas coronal y lambda. Displasias esqueléticas Caracterizadas por: 1. Micromelia (Imagen 8): Hipoplasia de toda la extremidad y generalmente de todas las extremidades al tiempo. La hipoplasia severa de los huesos largos es una displasia letal. En general los 3 segmentos tienen huesos hipoplásicos y tienen mayor curvatura. Al tener el hallazgo de micromelia se debe realizar una búsqueda de signos adicionales que nos permitan llegar a la sospecha diagnostica y etiológica de la patología, se realizo una modificación de los esquemas diagnosticos propuestas en el libro de Paladini (1): Capítulo 141 Imagen 8, Micromelia, Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Micromelia (Imagen 9 y 10) El abordaje de la micromelia debe basarse en los hallazgos ecográficos adicionales, para una guía que permita establecer el diagnostico remitimos a la Figura 1. ‐ ‐ ‐ ‐ Hipofosfatasia: Hipo mineralización severa + Micromelia. Displasia Tanatoforica: Cráneo en trébol + Hipoplasia Torácica + Micromelia. Acondrogenesis: Hipomineralización + Hipoplasia Torácica. Sindrome de Costilla corta: Cardiopatía congénita + Polidactilia + hipo mineralización + Hipoplasia Torácica. 142 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Figura 1. Capítulo 143 Imagen 9, Micromelia. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 Imagen 10, Micromelia. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 144 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional DISPLASIA TORÁCICA ASFIXIANTE RIZOMELIA (Imagen 11) Hipoplasia torácica Hidrops Anormalidad renal Polidactilia Figura 2. Modificada Paladini. DISPLASIA DIASTROFICA ACONDROPLASIA. RIZOMELIA Deformidades posturales Contracturas articulares Micrognatia Pulgar Diastrofico RIZOMELIA Prominencia frontal Macrocrania Leve Imagen 11, Rizomelia. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 2. Displasia esquelética caracterizada por Hipoplasia torácica: Cuando se realiza el estudio de las displasias esqueleticas, se evidencia un alto procentaje de asociación a Hipoplasia pulmonar secundaria a la restricción torácica; que lleva a la muerte, constituyendo un factor pronóstico muy importante en la asesoría prenatal a los padres. (6). En el corte transversal a través del torax se visualiza un corazón alargado pero normal. Capítulo 145 Hay varios parámetros ecográficos para realizar la predicción de la hipoplasia pulmonar entre ellos, mediciones del torax y los pulmones, índices entre mediciones torácicas, velocimetria de las arterias pulmonares, mediciones volumétricas de los pulmones por ecografía 3D o resonancia magnética nuclear, y otros parámetros biométricos. (6). Dentro de los parámetros ecográficos; el propuesto por Merz cuyas medidas del diámetro del pulmón derecho defininen hipoplasia pulmonar cuando el valor del diámetro se encuentra por debajo del percentil 5 para la edad gestacional con una sensibilidad del 100 % (7), o del índice entre el diámetro del pulmón derecho y la circunferencia torácica ósea propuesto por Bahlmann y cols en el 99, que proporciona una sensibilidad y especificidad del 100 %, teniendo en cuenta que el estudio de este ultimo fue realizado en fetos con hernia diafragmatica. (6) La estimación a partir de la volumetría pulmonar fetal desde la ecografía 3D, definiendo hipoplasia pulmonar cuando encontramos volúmenes pulmonares menores al percentil 5 para la edad gestacional, sin embargo presenta una alta tasa de falsos positivos hasta un 48 %.(6). Cuando se determina que la hipoplasia torácica es severa; se considera una displasia esquelética letal por la hipoplasia pulmonar secundaria. (1) Imagen 12, Rizomelia. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 2. Displasia esquelética caracterizada por Fracturas: Las fracturas son más difíciles de ver en gestaciones tempranas, pero si se identifica una fractura en la ecografía del 2do trimestre, el diagnostico se puede realizar hacia osteogénesis imperfecta tipo II; ya que la tipo III puede ser reconocida en el tercer trimestre; con imágenes de fémures arqueados y tibias cortas (Imagen 13). 146 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 13. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 3. Displasia esquelética caracterizada por Hipomineralización: Se visualiza mejor la densidad ósea de la calota fetal en una vista axial transtalámica o en el plano medio sagital del perfil fetal; permite ver el cerebro claramente; además de poder deprimir el cráneo con una leve presión al transductor. Se debe evaluar si es de todos los huesos o un segmento. En la hipofosfatasia se encuentra la hipomineralización en todos los huesos fetales excepto la clavícula. El abordaje de la Hipomineralizacion se debe realizar también buscando los hallazgos adicionales como: ‐ ‐ ‐ ‐ ‐ Fracturas. Micromelia. Hipoplasia Toracica. Cardiopatía congénita Polidactilia Capítulo 147 4. Displasia esquelética caracterizada por Micrognatia: El estudio objetivo de la micrognatia se puede realizar a partir del índice mandibular que resulta entre el diámetro anteroposterior mandibular y el diámetro biparietal, se diagnostica cuando se obtiene un valor menor a 23, con una tasa de falsos positivos del 2 %. (6) Cuando encontramos la micrognatia debemos realizar una valoración cuidadosa de las tibias y los fémures, además de las posiciones de las extremidades por su asociación a patologías como la secuencia deformativa fetal aquinetica y la displasia diastrófica o campomélica. (1). Figura 3 Figura 3. Modificado de Palladini. 4. Displasia esquelética caracterizada por Hidrops: Las displasias esqueléticas letales, especialmente de 12 a las 14 semanas de gestación, se puede asociar a hidrops (Imagen 14) o hidroma quístico. Se debe evaluar la presencia de micromelia y otros hallazgos, puesto que el hidrops puede estar presente en patologías como (Figura 1) acondrogenesis, displasia Tanatoforica, osteogenesis Imperfecta, sindrome de Costilla Corta y distrofia torácica asfixiante. 148 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 14. Hidrops. Cortesía Unidad de Medicina Materno fetal, Universidad Nacional de Colombia, Hospital Engativa, 2011 Displasias esqueleticas mayores: Son raras, 160 tienen causa genética identificada Pueden ser letales y no letales Polihidramnios casi en todas La mayoría son fatales. Alteraciones cormosomicas poco frecuentes; el cariotipo en contracturas difusas por su asociación a trisomías 13 y 18 y neuro artrogriposis. Artrogriposis: congénita, causa desconocida, desarrollo deficiente de la musculatura esquelética, contractura simétrica y múltiple de las articulaciones. Clasificacion: › ACONDROPLASIA › OSTEOGENESIS IMPERFECTA › DISPLASIA TANATOFORICA › OTRAS: Capítulo 149 ACONDROGÉNESIS DISTROFIA TORÁCICA ASFIXIANTE DISPLASIA CONDROECTODÉRMICA O SÍNDROME DE ELLIS VAN CREVELD DISPLASIA CAMPOMÉLICA DISPLASIA DIASTRÓFICA HIPOFOSFATASIA Como fue descrito previamente son multiples las patologías que conforman las displasia musculo esqueléticas, razón por la cual se hara un descripción de las mas importantes dad su frecuencia. 1. Acondroplasia: La incidencia es de 1 en 10.000 nacidos vivos. Los hallazgos ecográficos corresponden a rizomelia entre la semanas 26 a 28, el fémur y el húmero son un poco más cortos; con biometría del percentil 1 al 5; se puede encontrar un compromiso mayor del húmero. La morfología ósea es normal. Macrocrania leve y puente nasal bajo. Pronóstico fetal: Esperanza de vida normal. No hay riesgo de retraso mental; secuelas ortopedicas y pulmonares a largo plazo debido al tórax relativamente pequeño. 2. Osteogenesis imperfecta: La incidencia es de 0.4/10 000 nacidos vivos, el 50% son del tipo II. Es un espectro de desordenes congénitos caracterizados por huesos frágiles. Los hallazgos ecográficos: Tipos I y IV no son diagnosticables en el feto. Tipo II: se caracteriza por la hipomineralización difusa del cráneo, hipoplasia torácica de distintos grados, a veces fractura de costillas y fracturas difusas tempranas que causan micromelia. Tipo III: Inicio tardío del arqueamiento de los huesos largos y fracturas. 150 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Pronóstico: Letal en el tipo II. Discapacidad motora en el tipo III, además cifosis, fracturas que empeoran con la edad por fragilidad ósea, otosclerosis (hipoacusia) problemas de dentición. 3. Displasia tanatoforica: Es muy rara, la Incidencia es de 0.69 en 10.000 nacidos vivos. Siempre letal, fenotipo de miembros cortos con hipoplasia torácica severa Es de dos subtipos: Anomalía del gen FGFR3 en ambos I: Corresponde al 80%; se caracteriza por fémur curvo; las costillas son muy cortas, la cabeza es grande y el puente nasal bajo. No hay craneosinostosis mayores. II: Fémur recto y cráneo en trébol. Los hallazgos ecográficos: Acortamiento severo de los miembros (fémures en particular). Hipoplasia torácica letal (pulmonar secundaria) Bibliografia 1. D. Paladini , P. Volpe, Ultrasound of Congenital Fetal Anomalies, capitulo 6 THORACIC ANOMALIES , 2007. 2. Ruano R, Molho M, Roume J, Ville Y. Prenatal diagnosis of fetal skeletal dysplasias by combining two-dimensional and three-dimensional ultrasound and intrauterine three-dimensional helical computer tomography. Ultrasound Obstet Gynecol 2004. 3. Faro C, Benoit B, Wegrzyn P, Chaoui R, Nicolaides KH. Threedimensional sonographic description of the fetal frontal bones and metopic suture. Ultrasound Obstet Gynecol 2005. 4. Chaoui R, Levaillant M, Benoit B, et al. Three-dimensional sonographic description of abnormal metopic suture in second- and third-trimester fetuses. Ultrasound Obstet Gynecol 2005 Capítulo 151 5. EUROCAT (European Surveilance of Congenital Anomalies) Guide 3: For the Description and Classification of Congenital Limb Defects, 2nd edn, 2004, www.eurocat.ulster.ac.uk. 6. Callen P, Ecografía obstetricia y ginecología, El sevier, 2009. 7. Merz E, et at, Prenatal sonographic chest and lung measurements for predicting severe pulmonary hypoplasia. Prenat Diagn 1999. 5.7 Evaluacion del sistema nervioso central Introducción Las anomalías del sistema nerviosos central (SNC) es una de las alteraciones congénitas más frecuentes. Su incidencia puede alcanzar 1 en 100 nacidos vivos, con incidencias mayores en viva intrauterina ya que un alto porcentaje termina en aborto espontaneo o en interrupción voluntaria de la gestación. Es la segunda causa de discapacidad infantil severa y permanente, con pobre pronostico posnatal y con alto costo para el sistema de salud.[14] La detección de anormalidades en el desarrollo del sistema nervioso central (SNC), es particularmente difícil debido a: el desarrollo de diferentes estructuras se mantiene durante toda la gestación e incluso la vida posnatal, cambiando los patrones de normalidad según la edad gestacional. Por otro lado desde la presentación de la noxa hasta que la anomalía sea evidente en imágenes ocurre mucho tiempo.[1] Neurodesarrollo Para entender muchas de las alteraciones congénitas de SNC, se requiere algunos conocimientos básicos sobre el desarrollo de mismo.[1] Los eventos mayores incluyen: 1. Neurulación primaria: ocurre en semana 3 a 4 de gestación. Se refiere a la formación del cerebro y la mayor parte del cordón espinal, mientras la neurulación secundaria comprende el desarrollo de la porción sacro-coccígea del cordón espinal. El cierre completo de la hoja anterior y posterior de tubo neural ocurren a las 26 días pos concepción y de la hoja caudal a las 7 semanas. 2. Desarrollo del prosencéfalo: el proceso inicia entre semana 5 a 6 de gestación y consiste en tres eventos secuenciales, cerradamente interrelacionados (formación, hendidura y desarrollo de línea media fetal). 152 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 3. Proliferación neuronal: La proliferación neuronal ocurre en zonas ventriculares y sub ventriculares. los neuroblastos aparecen desde la semana 6 de gestación y el pico máximo de proliferación ocurre durante tercer y cuarto mes de gestación. las células gliales se forman desde el quinto mes de gestación y terminan de proliferar después del parto. en esta etapa ocurre división activa de células madres neuronales, determinando el tamaño final de la masa encefálica. 4. Migración neuronal: se inicia durante la semana 6 de gestación y se considera que finaliza alrededor de semana 30 de gestación. Durante este periodo las neuronas que están proliferando se movilizan, desde la matriz germinal periventricular a lo largo de la corteza cerebral. La migración neuronal se relaciona con la formación de surcos y giros encefálicos. 5. Organización: proceso complejo se inicia en el quinto mes de gestación y termina en la vida posnatal. 6. Mielinización: se inicia en el tercer mes de gestación y continua durante la infancia. Generalidades La evaluación del SNC se puede dividir en examen básico y examen avanzado (neurosonografía fetal), dependiendo de los factores de riesgo y según la anormalidades halladas en el examen ultranografico de rutina.[12] Cuando realizar la evaluación Aunque algunas anormalidades del SNC fetal pueden evidenciarse en el primer trimestre y inicio del segundo trimestre, estas representan la minoría y usualmente son muy severas [ISOUG guía]. El examen básico del SNC se recomienda entre semana 18 a 22, porque en este momento ocurren eventos importantes del desarrollo cerebral fetal, como: la proliferación, migración y organización neuronal y también puede observarse lesiones adquiridas como hemorragias y tumores [9,13 ]. No es tan confiable el examen del SNC fetal en el tercer trimestre ya que la osificación del cráneo puede enmascarar algunas anomalías.[9] Examen básico El examen básico incluye la observación de diferentes estructura del cerebro y columna vertebral (se revisara en capitulo de columna), realizando una ecografía transabdominal. Los tres cortes axiales que evalúan la integridad anatómica del cerebro son: plano transvéntricular, plano transcerebeloso y plano transtalamico. En este ultimo realizamos las mediciones biométricas.[3,9]. Capítulo Tabla 1 (lista de chequeo) Lista de chequeo en examen básico Forma de la cabeza Ventrículos laterales (Atrium ) Cavum del septum pellucidum Talamos Plano transvéntricular 153 Cisterna magna Cerebelo Cordón nervioso Plexos coroideos Es el plano más cefálico, podemos observar los ventrículos laterales en su porción anterior y posterior, a nivel del atrium visualizamos los plexos coroideos como estructuras hiperrefringentes. Una medición normal del atrium es menor a 10 mm, mediciones mayores nos hacen sospechar ventriculomegalía. [3] En esta plano también visualizamos el Cavum del septum pellucidum en la línea media, el cual es una estructura de paredes delgadas llenas de liquido, su ausencia nos orienta a defectos de la línea media (holoprocencefalía, agenesia de cuerpo calloso, displasia septo-óptica, entre otras).[3,9,12] Plano transtalamico Plano inferior y paralelo al transvéntricular, donde observamos las siguientes estructuras: cuernos frontales de ventrículos laterales, Cavum de septo pellucidum, talamos y circunvolución del hipocampo. En este plano se realizan las mediciones biométricas (CC, DBP Y DOF) Plano transcerebeloso Esta es un plano más inferior con una angulación hacia atrás, que permite ver estructuras de fosa posterior. Las estructuras visualizadas : cuernos frontales, Cavum del septum pellucidum, talamos, cerebelo y cisterna magna. En esta plano realizamos la medición de la cisterna magna(entre cerebelo y hueso occipital) con valor normal 2 a10 mm, si >10 mm es anormal y sugiere: Malformación Dandy-Walker, cerebelo hipoplásico, quiste de Blake , etc. Sin embargo la no visualización de la Cisterna magna también es anormal y sugiere defecto abierto de cordón espinal, con herniación de cerebelo contra el agujero occipital.[3] Imagen 1. Planos imamaaa axiales. Modificado por autores 154 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Neurosonografía (Examen avanzado) La neurosonografia consiste en un exploración detallada del cerebro fetal, por medio de imágenes multiplanares, las cuales se obtienen alineando el transductor con las suturas y fontanelas de la cabeza fetal. Se puede realizar por vía transabdominal o transvaginal, el enfoque transvaginal tiene mayores ventajas (mayor resolución, facilidad en obtener los cortes y mayor definición en detalles anatómicos). [3,9] El examen sonografico engloba los tres planos axiales del examen básico, cuatro planos coronales y dos planos sagitales. Planos Coronales a. Transfrontal: Evalúa la cisura interhemisférica y la porción anterior de los cuernos frontales de los ventrículos laterales, por delante de la rodilla del cuerpo calloso.[Barcelona] b. Transcaudado: corte a nivel del núcleo caudado, además observamos la rodilla del cuerpo calloso que interrumpe la cisura interhemisferica, Cavum del septum pellucidum, que separa los ventrículos laterales y la cisura de Silvio.[3, 14] c. transtalamico: se observan los dos talamos cercanos separados por el tercer ventrículo en la línea media, el Cavum del septum pellucidum y los ventrículos laterales.[3,9,14] d. transcerebelar: es el plano más posterior y se obtiene angulando el transductor hacia la fontanela posterior, observando: cuernos occipitales, cisura interhemisferica, los 2 hemisferios cerebelosos y el vermis. [9,14] Planos sagitales a. sagital medio: con este plano podemos evaluar estructuras del alinea media: cuerpo calloso, Cavum del septum pellucidum, fornix, tercer y cuarto ventrículo, tronco encefálico y estructuras de fosa posterior. Si aplicamos doppler color podemos observar, arteria pericallosa y vena de galeno.[14] b. parasagitales: evalúa periventruculares [9,14] los ventrículos laterales, plexos coroideos y áreas Cordón espinal (ver capitulo de columna) Al realizar un estudio integral del SNC, se debe evaluar la columna vertebral ya que algunos de sus anomalías se relacionan con anomalías en la evaluación del encéfalo fetal. Capítulo 155 En la evaluación de la columna vertebral se incluyen tres cortes (plano sagital, plano coronal y planos axiales).[3] Hallazgos patologicos en el sistema nervioso central Ventriculomegalia Definición La ventriculomegalía es la dilatación del sistema ventricular fetal, sin aumento significativo de la presión endocranena (PIC), mientras que se la hidrocefalia se define como una dilación severa y patológica del sistema ventricular fetal con aumento significativo de PIC.[6] El diámetro transverso de los cuernos occipitales (a nivel del Atrium) se mantienen constante a los largo de la gestación entre la semana 15 a 40 de gestación. Si encontramos un diámetro atrial mayor o igual de 10mm se considera ventriculomegalía.[6] Clasificación Ventriculomegalia leve: diámetro del atrium entre 10 a 15 mm Ventriculomegalia severa (hidrocefalia): diámetro del atrium mayor de 15mm [7] Epidemiologia La incidencia de la ventriculomegalia es de 0,3 a 1,5 por 1000 nacidos vivos. Las ventriculomegalia severa tiene alta tasa de anomalía asociadas entre 45 a 80%. El riesgo de síndrome cromosómicos asociados 9 a 36%, principalmente trisomía 21. Dentro de los síndromes no cromosómicos asociados tenemos: malformación de DandyWalker, agenesia del cuerpo callosos, atresia esofágica, malformaciones cardiacas, hipoplasia pulmonar y anomalías de medula espinal.[7,8] Etiología principales [6] Estenosis de acueducto de Silvio: se presenta hasta en 40% de los casos debido a alteración congénitas o adquiridas como infección (CMV, toxoplasma, etc.), tumores, hemorragia interventricular, inflamación y/o fibrosis. Síndromes cromosómicos: síndrome de Down Síndromes no cromosómicos: malformación de Chiari II, complejo Dandy-Walker, síndrome de Walker–Warburg, síndrome kartagener entre otros. Idiopático 156 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Diagnostico prenatal Es diagnostico se realiza tomando un plano axial (transvéntricular o transtalamico) y se realiza la medición del atrium a nivel del glomus de los plexos coroideos, con los caliper situados en bordes internos. Imagen 2. A. ventriculomegalía leve en corte transventricular. B. formas correctas e incorrectas de medir el Atrium. C. ventriculomegalía severa (hidrocefalia). D. ventriculomegalía severa corte coronal Cortesía Dr. Arenas/Universidad Nacional de Colombia/hospital Engativá Diagnostico diferencial Los diagnósticos diferenciales más sobresalientes son: holoprocencefalia, hidranencefalia, porencefalia y algunas lesiones quística como os quistes aracnoideos.[6] Manejo prenatal Se recomienda un seguimiento prenatal especializado, se debe realizar ecografía de detalle y neurosonografia entre semana 28 a 32 de gestación, buscando anomalías asociadas tanto intracerebrales como extracraneales. La amniocentesis y cariotipo se recomienda cuando se identifica cualquier anomalía asociada o ventriculomegalía severa, en ventriculomegalía leve aislada evaluar riesgo beneficio.[6,13] Capítulo 157 Otros estudios a realizar es serología para TORCHS, principalmente citomegalovirus y toxoplasma igM, también se puede realizar prueba de alfa feto proteína y acetilcolinesterasa en Liquido amniótico, para descartar defecto oculto del tubo neural.[6, 13] Pronóstico El pronóstico depende de las presencia de anomalías asociadas y de la progresión de la dilatación ventricular, cuando es una ventriculomegalia aislada sin progresión de la dilatación, la supervivencia es del 80% y el 60% tendrá desarrollo neurológico normal. Si se evidencia anomalías asociadas la mortalidad perinatal es del 60 a 70%. [13] Defectos del tubo neural Este término se usa para describir las alteraciones del cierre del tubo neural que ocurren entre semana 3 y 4 de gestación (anomalías de la neurulación primaria). Estos defectos neurales se pueden clasificar en defectos abiertos o cerrados, según si se encuentran expuestos o no el tejido neural. La incidencia global es 1 en 1000 nacidos vivos. [8,10] Dentro de los factores de riesgo para cualquier defecto del tubo neural tenemos factores genéticos (Sind. Down), ambientales (déficit acido fólico, diabetes mellitus, obesidad materna), medicamentos (carbamacepina, valproato, metotrexate, antagonistas de folatos, etc.), entre otros. [10] DEFECTOS DEL TUBO NEURAL [10] Defectos de cabeza Anencefalia Exencefalia Encefalocele Iniencefalia Defectos de columna Disrrafismo espinal Ausencia de cerebro, cráneo y cuero cabelludo Ausencia de cráneo y cuero cabelludo, y cerebro exteriorizado Herniación del encéfalo por un defecto en el cráneo Triada (defecto en hueso occipital, disrrafismo cervical y retroflexión de la cabeza fetal) Abierto (mielomeningocele) Cerrado (mielocele) Anencefalia Definición Es el defecto más común del tubo neural y se caracteriza por ausencia de cerebro, bóveda craneana y cuero cabelludo. Se debe a una falla del cierre del neuroporo rostral durante el día 24 a 26 pos concepción. [10] 158 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Epidemiologia la incidencia se estima en 1 por 10,000 nacidos vivos [13]. El riesgo de anomalías asociadas es 25 a 50%, principalmente: espina bífida, labio paladar hendido, onfalocele. Menos frecuentemente anomalías cardiacas, pulmonares y malformaciones esqueléticas. [12,13] Diagnostico prenatal El diagnostico se realiza con una ecografía de rutina al final de primer trimestre y en segundo trimestre, demostrando la ausencia de bóveda craneana y la imagen típica de “cara de rana” con ojos saltones y lengua protruida.[10] el polihidramnios se presenta hasta en el 50% de los casos por alteración de la deglución.[8,10,12] Imagen 2. flecha señala ausencia de bóveda craneana, apariencia de “ojos de rana” Cortesía Dr. Arenas/Universidad Nacional Manejo prenatal Es una anomalía incompatible con la vida y se debe ofrecer la terminación del embarazo.[13] Cefalocele Definición Se caracteriza por un defecto en la bóveda craneana, por donde protruye el contenido encefálico. El saco herniado puede contener meninges (mielocele), tejido cerebral (encefalocele) o ambos.[8] aunque puede observarse en cualquier sitio del cráneo, los occipitales son los más frecuentes 75% de los casos. Epidemiologia Incidencia 0,8 a 1 en 10,000 nacidos vivos [10]. La presencia de anomalías cromosómicas asociadas es elevada, cercana al 20% y el riesgo de anomalías no cromosómicas asociadas es de 20 a 70%, los más prevalentes son Sind. Meckel-Gruber (encefalocele, microcefalia, riñón poli quístico, ambigüedad genital, polidactilia, labio paladar hendido), la agenesia de cuerpo calloso, hidrocefalia, mielomeningocele. [8] Capítulo 159 Diagnostico prenatal Se realiza con ecografía en el segundo trimestre, evidenciando un defecto en el cráneo que contiene una masa quística o solida con patrón de giros que se continua con el cerebro, se puede realizar un enfoque multiplanar para caracterizar adecuadamente la lesión.[8,10] Manejo prenatal Se recomienda realizar ecografía de detalle y neurosonografia para identificar anomalías asociadas. La amniocentesis y cariotipo fetal está indicado por alto riesgo de anomalías cromosómicas, se recomienda seguimiento prenatal estrecho y parto por cesárea por riesgo de ruptura o infección de las meninges expuestas. [13] Espina bifida Definición La mielodisrrafia o espina bífida se refiere a un defecto óseo de la columna vertebral, por donde protruyen la medula espinal, y se debe a una falla en el cierre del neuroporo posterior. ocurre frecuentemente en la región lumbosacra.[11,12] Epidemiologia Tiene una incidencia de 1 en 1000 nacidos vivos, con mayores tasas de presentación en afroamericanos e hispanos. El riesgo de anomalías cromosómicas se presenta en un 8 a 16% (trisomía 13 y 18), el riesgo de anomalías no cromosómicas es elevado, especialmente en defectos abiertos que se relacionan con la malformación de ArnoldChiari II.[1] Clasificación Defectos abiertos: (espina bífida quística): existe herniación quística de las meninges y/o cordón nervioso, por defecto de la columna vertebral, sin que existe piel que recubra la lesión. [1] Defectos cerrados (espina bífida oculta): defecto en la fusión de los cuerpos vertebrales dorsales, con piel dorsal integra. Corresponde al 15% de casos. [10] Diagnóstico prenatal La ultrasonografia tiene sensibilidad de 97 % y especificad de 100 %, en el diagnostico de defectos espinales abiertos. Se puede observar signos sonográfiacos directos e indirectos para realizar un diagnostico.[1,2,10] Signos directos: demostración de interrupción de la continuidad de la piel en columna vertebral, o una lesión quística protruyendo en el cuello o en la región sacra del feto. 160 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Signos indirectos: -signo del limón: consiste en una deformidad cóncava del hueso frontal por disminución de la PIC. Se presenta en 98% de los casos entre semana 16 y 24 de gestación -signo de la banana: curvatura anterior anormal de los hemisferios cerebelosos en forma de banana, debido a obliteración de la cisterna magna, se presenta en 72% de los casos. - hidrocefalia: por obstrucción del flujo de líquido cefalorraquídeo. [10,13] Manejo prenatal Imagen 3. Concavidades frontales (Signo del limón) Cortesía Dr Arenas/universidad Nacional/OyG Se debe realiza ecografía de detalle para descartar malformaciones asociadas, el cariotipo está indicado en defectos abiertos y en anomalías asociadas. Se prefiere el parto por cesárea para disminuir en trauma obstétrico.[10,11,13] Pronóstico: Defectos cerrados aislados tienen buen pronostico, mientras que defectos abiertos tiene una mortalidad posnatal de 20% el primer años de vida. Las secuelas neurológicos dependen del sitio de la lesión. [13] Holoprosencefalia Definición Es una malformación del cerebro anterior, en la cual existe una segmentación incompleta del prosencéfalo, que determinara una no división o una división incompleta de los hemisferios cerebrales y del sistema ventricular permitiendo una comunicación en la línea media.[1,11,13] Epidemiologia La incidencia es de 1,2 por 10,000 nacidos vivos, sin embargo la incidencia real es desconocida por alta tasa de abortos. La presencia de anomalías asociadas es elevada del 15 a 40%, especialmente de anomalías cromosómicas como trisomía 13.[1,13] Capítulo 161 Clasificación Alobar: es las forma más severa de presentación y se caracteriza por: hemisferios cerebrales y talamos fusionados, ventrículo único en línea media, ausencia de cuerpo calloso hoz del cerebro y solo un primordio óptico (ciclopía). Semilobar: existe una separación parcial del prosencéfalo posterior, la parte anterior de los hemisferios cerebrales están fusionados, segmentación incompleta de talamos, cavidad ventricular única rudimentaria. Lobar: existen separación normal de hemisferios cerebrales y tálamo, pero persisten anormalidad de cuerpo calloso, septum pellucidum y bulbo olfatorio. [1] Imagen 4. modificada por autores La holoprocencefalía de tipo alobar y semilobar se relaciones con defectos de la línea media: ciclopía, hipoterolismo, arrinencefalia, hipoplasia leve medio-facial entre otros. [1] Diagnóstico prenatal Se sospechas el diagnostico de holoprocencefalía si se demuestran cualquier alteración cerebral mas alteraciones de la línea media facial. Siempre realiza cortes axiales, medio sagital y coronal. Hallazgos ecográficos [13] Holoprocencefalía alobar y semilobar Holoprocencefalía lobar Ventrículo cerebral único Ausencia de tercer ventrículo (total o parcial) Ausencia de cuerpo calloso (total o parcial Ausencia de Cavum del septum pellucidum Ausencia de hoz del cerebro Talamos fusionados totalmente parcial o Cisura interhemisferica presente Cuerpo calloso hipoplásico o normal Septum pellucidum siempre está ausente Fusión parcial cuernos frontales Diagnostico luego de semana 18 de gestación 162 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 5. Holoprocencefalía lobar en corte axial de cráneo , durante evaluación de un feto de 23 semanas de gestación. Cortesía Dr. Arenas/universidad Nacional de Colombia/OyG Manejo prenatal En caso de diagnostico de holoprocencefalía alobar y lobar antes de semana 24, se puede ofrecer interrupción voluntaria de la gestación, por altas tasa de letalidad fetal. En caso holoprocencefalía lobar está indicado realizar ecografía de detalle, neurosografia fetal y cariotipo fetal. [10,11,13] Pronóstico La mortalidad perinatal y en primer año de vida es cercana al 98% casos de holoprocencefalía tipos alobar y semilobar. El pronóstico de holoprocencefalía lobar es relativamente bueno, sin embargo existe alta incidencia de retardo mental, incapacidad neurológica, alteraciones visuales y olfatorias. [1, 12,13] Agenesia del cuerpo calloso Definición El cuerpo calloso es una estructura compuesta de múltiples axones que conectan los hemisferios cerebrales. El cuerpo calloso se desarrolla alrededor de la semana 10 a 12 de gestación, desde la foramina interventricular de Monroe, continua su desarrollo hacia arriba y hacia atrás en forma de “C” lateral a los hemisferios cerebrales primitivos.[1,8] Las partes del cuerpo calloso de anterior a posterior son: rostro, rodilla, cuerpo, istmo y esplenio.[8] Clasificación Las agenesia del cuerpo calloso se puede dividir en parcial y completa: Agenesia completa: ausencia completa del cuerpo calloso Agenesia parcial (hipogénesis): ausencia del esplenio o de las porciones posterior del cuerpo calloso en grados variables. [12] Capítulo 163 Epidemiologia La prevalencia de la agenesia del cuerpo calloso es variable depende de los criterios diagnósticos y la población estudiada, pero en general se considera de 3 a 7 por 1,000 nacidos vivos. [12] El riesgo anomalías asociadas es elevado. Las anomalías cromosómicas asociadas se presentan en más del 20% de los casos, especialmente trisomía 13 y trisomía 18. [13] Por otro lado la incidencia de síndromes no cromosómicos asociados es cercana al 80%, los más conocidos son : síndrome de Aicardi (retraso mental severo, convulsiones, anomalías vertebrales, lesiones en la retina), malformación de Arnold-Chiari, síndrome de Dandy-Walker, síndrome Andermann, entre otras.[8,11,13] Diagnóstico prenatal El diagnostico ecográfico suele realizarse luego de semanas 20 a 22 de gestación y en el tercer trimestre. Hallazgos que sugieren agenesia del cuerpo calloso. [13] ‐ ‐ ‐ ‐ ‐ Ausencia de Cavum de septum pellucidum en plano transtalamico Colpocefalia (dilatación cuernos occipitales en forma de lagrima) Elevación anormal del tercer ventrículo Desarrollo anormal o ausencia de arteria pericallosa (con doppler color) Mayor separación de hemisferios cerebrales Diagnostico definitivo se realiza con neurosonografía o resonancia magnética, demostrando la ausencia de cuerpo calloso en planos sagital medial y planos mediocoronales.[8,13] Manejo prenatal Se debe considerar remisión a unidad de diagnostico prenatal, además se recomienda realizar ecografía de detalle anatómico, neurosonografía, eco cardiografía fetal, cariotipo, resonancia magnésica, test de TORCHS. En casos de malformación múltiples del SNC considerar la interrupción voluntaria del embarazo.[1] Pronostico En casos aislados el pronóstico suele pacientes, con desarrollo neurológico neurodesarrollo. Las malformaciones ensombrecen el pronóstico con alta neurodesarrollo.[1,12,13] ser bueno con sobrevivencia del 90% de los normal y en ocasiones retraso leve en el asociadas tanto del SNC como periféricas mortalidad neonatal y retraso severo del 164 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Agenesia de cavum del septum pellucidum El Cavum del septum pellucidum es un espacio lleno de líquido < 10mm de diámetro, ubicado entre los cuernos frontales y por debajo de la porción anterior del cuerpo calloso. Esta estructura no hace parte del sistema ventricular y puede observarse normalmente luego de semana 18 a 20 de gestación. Aunque la agenesia del Cavum del septum pellucidum se asociada frecuentemente a otros anomalías corticales y a holoprocencefalía, en algunas ocasiones puede ser defecto aislado.[1,8] El diagnostico en casos aislados es difícil ya que normalmente no se observa antes de la semanas 20, sin embargo siempre que se sospeche el diagnósticos, se debe descartar anomalías asociadas. [8] Anomalias de proliferacion neuronal Microcefalia Definición Se define como un tamaño de la circunferencia cefálica menor a 3 desviaciones estándar para la edad gestacional. La microcefalia no es una entidad en si misma, si no es una condición que puede ser secundaria a múltiples causas, estas de etiología heterogénea [13] Epidemiología La incidencia de microcefalia es variable de 1/6,250 a 1/8,500 nacidos vivos, sin embargo al primer año de vida la incidencia aumente 1,6 por 1,000 niños debido a procesos neurodegenerativos y neurogenéticos.[1,11,13] La incidencia de anomalías asociadas tanto cromosómicas, como no cromosómicas es mayor al 83% de los casos. Entre los síndromes no cromosómicos las más frecuentes se encuentra la holoprocencefalía, anormalidades de los giros cerebrales, agenesia del cuerpo callosos entre otras.[11,13] Clasificación [1,13] Microcefalia con corteza cerebral normal Microlissencefalía: microcefalia severa con corteza cerebral gruesa Microcefalia con polimicrogiria extensa o displasia cortical Diagnóstico prenatal El diagnostico se suele realizar en el tercer mes de gestación. Los criterios diagnósticos más importantes son una circunferencia cefálica 3 desviaciones estándar inferior a lo normal, alteración de la relación cabeza abdomen (CC/CA), alteración de la relación Capítulo 165 cabeza fémur (CC/LF). Otros hallazgos existe una desproporción entre la cabeza y la cara, observándose como una frente inclinada.[1,12] Manejo prenatal Siempre que se sospeche el diagnostico de microcefalia se debe realizar ecografía de detalle y neurosonografía, el cariotipo está muy indicado por la alta asociación con anomalías cromosómicas. También se debe indicar sobre el consumo de alcohol materno u otras sustancias como químicos o medicamentos.[11] Pronóstico El pronóstico depende de la etiología, sin embargo la mayoría de los pacientes que sobreviven presentan retraso mental, convulsiones, hipotonía y alteraciones motoras. Solo el 14% de los pacientes con microcefalia diagnosticada durante el primer año de vida fueron diagnosticados en la edad prenatal [13] Macrocefalia Definición Aumento del volumen cerebral en ausencia de hidrocefalia. La medición de la circunferencia cefálica (CC) se encuentra mayor al percentil 98 para edad gestacional o 2 desviaciones estándar superior a la media.[1,11] Existe una variante la hemimegaencefalia, la cual consiste en un crecimiento exagerado de un solo hemisferio cerebral y ocurre por alteración entre la proliferación/apoptosis neuronal y glial.[11,13] Epidemiología Es una patología muy poco frecuente, con incidencia que no se conoce a ciencia cierta. Aunque la mayoría de los casos se presenta como un defecto aislado (50%), el más frecuente es megalencefalia familiar que es un trastorno austosomico dominante, el cual no se relaciona con retraso mental. [11] Entre los síndromes no cromosómicos asociados se encuentran: síndrome de Sotos (gigantismo cerebral), síndrome de Beckwith–Wiedemann, síndrome de Weaver, neurofibromatosis tipo 1, la acondroplasia entre otros. [1,8,11] Diagnostico prenatal Se basa en evidenciar una circunferencia cefálica mayor al percentil 98 para edad gestacional, que persista o aumente en ecografías posteriores, donde se descarte la presencia de hidrocefalia.[1] 166 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Manejo prenatal Se recomienda eco de detalle para descartar anomalías asociadas, si estas no están presentes no se indica realizar amniocentesis para cariotipo.[11] con respecto al momento del parto no se indica adelantar la fecha probable del parto, pero se realizar análisis cuidadosos de la vía del parto.[1,11] Transtornos de la migracion neuronal Lisencefalia La lisencefalía o agiria (cerebro liso), se debe a un fracaso completo de la migración de los neuroblastos durante la semana 12 a 24 de gestación, ocasionando que el cerebro este desprovisto de giros y circunvoluciones. Epidemiologia La incidencia en fetos es desconocida. el riesgo de anomalías cromosómicas asociadas es relativamente bajo.[13] Los síndromes no cromosómicos asociados se presenta en alta frecuencia especialmente el síndrome de Walker-Warburg y el síndrome de Miller-Dierke.[12] Clasificación [13] CATEGORIA CARACTERISTICAS SINDROMES Lisencefalía clásica Solo 4 capas de corteza en vez de S. Miller–Dieker 6, existe agiria con o sin paquigiria (tipo 1) Superficie cerebral es lisa Lisencefalía empedrada (tipo 2) Ausencia casi completa de capa S. Walker–Warburg cortical, la corteza esta desorganizada en forma de S. Fukuyama adoquines Enf musculo-cerebro-ojo Otros tipos Retraso en la migración neural S. Norman-Roberts entre el epéndimo y la zona periventricular Capítulo 167 Diagnostico prenatal El diagnostico ecográfico es difícil ya que se requiere estar familiarizado con los surcos y giros en cerebro fetal y se puede realizar entre la semana 26 a 28 de gestación. la resonancia magnética puede caracterizar mejor las lesione en tercer trimestre.[8] Hallazgos ecográficos sugestivos: Disminución o ausencia de giros y surcos parieto occipitales Ventriculomegalia leve Anomalías cerebrales asociadas Manejo prenatal El manejo prenatal incluye ecografía de detalle anatómico, resonancia magnética al final del segundo trimestre y amniocentesis para diagnostico genético.[12] Pronóstico Es una patología de mal pronóstico se caracteriza por severo retardo mental, convulsiones, hipotonía y mortalidad cercana al 100% a los 5 años. [13] Imagen 6. A. ausencia de circunvoluciones cerebrales (lisencefalía), B. se observa quiste destructivo del parénquima cerebral (porencefalía). Cortesía de Dr. Arenas/universidad nacional de Colombia/OyG 168 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Esquicencefalia Es un trastorno de la migración neuronal, caracterizado por hendiduras llenas de líquido en el manto cerebral que se comunican con los ventrículos laterales. Estas hendiduras pueden ser unilaterales (63%) o bilaterales (37%). [1,8,12,13] Clasificación [8,13] Tipo 1 (bordes cerrados): existen hendiduras pequeñas simétricas, con sus bordes que se fusionan en el interior de la pia-ependimal y se continúa con el epéndimo de los ventrículos laterales. Tipo 2 (bordes abiertos): tiene hendiduras amplias que se extienden desde la superficie de los ventrículos laterales hacia el espacio subaracnoideo y los bordes no están fusionados. Diagnóstico Se realiza ecográficamente en segundo y tercer trimestre, donde se observa hendiduras en uno o ambos hemisferios cerebrales, que se extienden desde el espacio subaracnoideo hasta los ventrículos laterales. [1,8,12,13] Anomalias de fosa posterior: Malformacion de dandy-walker Definición El complejo de Dandy-Walker se refiere a un grupo de patologías, que generan dilatación quística del cuarto ventrículo y diferentes grados de hipoplasia del cerebelo. [15] Características principales [17] Dilatación quísticas del cuarto ventrículo Agenesia total y parcial del vermis cerebeloso, Alargamiento de la fosa posterior con elevación de la Torcula, senos transverso y del tentorio. Epidemiologia Incidencia de 1 en 30,000 nacidos vivos. La incidencia de anomalías no cromosómicas asociadas es cercana al 60% principalmente otras anomalías del sistema nervioso central (holoprocencefalía, agenesia del cuerpo calloso). Por otro lado las anomalías cromosómicas se presentan en un 33% entre las más frecuentes tenemos la trisomía 18 y trisomía 13. [16] Capítulo 169 Síndromes cromosómicos relacionados con el complejo de Dandy-Walker [15] Síndrome de Joubert–Boltshauser Síndrome de Walker–Warburg Síndrome de Meckel–Gruber Síndrome de Neu–Laxova Síndrome de Aicardi Malformación de klippel-feil Clasificación CARACTERISTICAS Complejo de DandyWalker Malformación Dandy-Walker (clásico) Agenesia total o parcial del vermis, dilatación quística del IV ventrículo y aumento de tamaño de la fosa posterior Variante de Hipoplasia del vermis posterior, dilatación quísticas del IV ventrículo, con fosa posterior normal Dandy-Walker Megacisterna magna Aumento de tamaño de cisterna magna (fosa posterior), con vermis cerebeloso y IV ventrículo normal Diagnostico prenatal El diagnostico se puede realizar luego de semana 22-24 de gestación, ya que el anatómicamente el vermis cerebeloso completa su desarrollo entre semana 16 a 20 de gestación. [16,18] Hallazgos ecográficos [13,15,17,18] ‐ ‐ ‐ ‐ ‐ Dilatación quística de fosa posterior que se comunica con el IV ventrículo Cisterna magna dilatada (diámetro transverso > 10 mm) Agenesia parcial o total del vermis cerebeloso (en plano axial transcerebelar) Dilatación de III ventrículos y ventrículos laterales (hidrocefalia 70% de casos) Otras anomalías del SNC y/o extracerebrales 170 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Imagen 7- A. corte axial de encéfalo, agenesia parcial de vermis cerbeloso, CM mayor de 10 mm; B. agenesia completa del vermis y comunicación con cuarto ventrículo cortesía Dr. Arenas/universidad Nacional de Colombia/OyG El diagnostico diferencial del complejo Dandy-Walker es difícil e incluye todas las malformaciones quísticas de fosa posterior, la neurosonografía en cortes sagitales permite evalúa si hay compromiso del cuarto ventrículos y del vermis, o si por el contrario es una dilatación extraventricular.[13] Manejo prenatal A todos los fetos con sospecha malformación de Dandy-Walker, se debe realiza neurosonografía de rutina, al igual que ecografía de detalle anatómico, amniocentesis con cariotipo y ecocardiograma fetal, para descartar anomalías asociadas o confirmar diagnostico y pronostico. [17,18] Pronóstico Los factores pronósticos más importantes son la presencia de anomalías asociadas y la presencia de hidrocefalia, si están presentes la mortalidad es alta y los sobrevivientes presentaran retraso del neurodesarrollo. Si se presenta una anomalía aislada sin hidrocefalia en pronóstico es bueno con pocos casos de retraso mental. [8,13,17] Quiste de bolsa de blake Definición Forma parte la lesiones quísticas de la fosa posterior y consiste en un fallo en la regresión de la bolsa de Blake (tela coroidea rudimentaria del IV ventrículo), secundario a Capítulo 171 la no perforación del foramen de Magendi, lo que genera dilatación quística superior a la cisterna magna. [13,19] Diagnostico prenatal [19] ‐ ‐ ‐ ‐ hidrocefalia tetraventricular lesión quística infra o retrocerebelar vermis cerebeloso bien desarrollado y no rotado dilatación quística del IV ventrículo sin comunicación con la cisterna magna Manejo prenatal y pronóstico Requiere eco de detalle y neurosonografia para diferenciarlo del complejo de DandyWalker y de otras lesiones quísticas de fosa posterior. El pronóstico de esta patología es muy bueno, solo requiere derivación ventrículo peritoneal. Con un bajo índice de secuelas neurológicas. [13,19] Quiste aracnoideo Definición Son colecciones llenas de LCR dentro de las capas de la membrana aracnoidea, este quiste puede o no comunicarse con el espacio subaracnoideo. Pueden ser primarios cuando se originan de un desarrollo anormal de las leptomeninges o secundarios (adquiridos) si ocurre atrapamiento del LCR por una adherencia aracnoidea. [1,8,11,12,13] Puede desarrollarse en cualquier área cerebral el 50% se presenta en fosa media y 20% en fosa posterior. Diagnostico prenatal [8,11,13] El diagnostico de quiste aracnoideos se realiza en según trimestre de gestación (18 a 22 semanas) ‐ ‐ ‐ ‐ Masa quística anecoica de paredes delgadas adyacente a hemisferios cerebrales, cerebelo o tronco cerebral. Los quistes no se comunican con ventrículos laterales Quiste puede crecer en evaluaciones posteriores No suele encontrarse anomalías asociadas 172 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Pronóstico Es una patología de buen pronostico ya que no se asocia a aneupolidía. Las secuelas posnatales dependen del efecto de masa y de la presencia de hidrocefalia.[8] Quiste de plexos coroideos Definición Los plexos coroideos se observan con estructuras refringentes al interior de los ventrículos laterales en primer y al inicio de segundo trimestre. Los quistes de los plexos coroideos suelen se redondeados, menores de 10 mm, únicos o múltiples uní o bilaterales. Por lo general desaparecen espontáneamente entre semanas 18 a 26 de gestación, su persistencia de relaciona con patología cerebrales. [8,11] Epidemiologia Su incidencia es 1% en primer y segundo trimestre. La incidencia de anomalías asociadas cuando se observan quistes de plexo coroideo que persisten luego de semana 26 de gestación o son mayores de 10 mm son de alto riesgo y suelen relacionarse con trisomía 18 principalmente y con menos frecuencia trisomía 21.[8,11,20] Entre 44 a 50% de los embarazo con trisomía 18 evidencian quistes de plexos coroideos y el 1,5 % de las trisomía 21 evidencian quistes de plexos coroideos. [11,20] Diagnóstico prenatal El aspecto típico son lesiones pequeñas sonolucentes < 10mm, de bordes bien delimitados al interior de los plexos coroideos, pueden ser únicos o múltiples, uní o bilaterales, en planos axiales y sagitales.[8,20] Imagen 8, quiste de plexo coroideo en gestación de 19 semanas Cortesía Dr. Arenas/Universidad Nacional de Colombia/hospital Engativá Capítulo 173 Manejo prenatal Cuando se observa un quiste de plexo coroideo, se recomienda realizar ecografía de detalle seriada para confirmar ausencia de de anomalías asociadas, se recomienda amniocentesis para cariotipo en caso de anomalías asociadas o persistencia de los quistes luego de semana 26-28 de gestación ya que se ha relacionado con cromosomopatías (especialmente 18 y 21).[8,11,20] Pronóstico En casos aislados es una patología de buen pronóstico y suele resolver espontáneamente a lo largo de la gestación. Los asociados a anomalías concurrentes pronostico sombrío por alta incidencia de trisomía 18. [11,20] Lesiones destructivas del cerebro Suelen ser lesiones adquiridas, donde ocurren insultos sobre el tejido cerebral fetal en desarrollo, generando necrosis, reabsorción del tejido y reemplazo por espacio quístico. Las principales lesiones destructivas son la hidranencefalia, porencefalia y encefalomalacia multiquistica. [13] Hidranencefalia Definición Se caracteriza por la ausencia casi completa de la corteza cerebral, la cual es reemplazada por un espacio lleno de liquido. Se cree que se debe a un infarto cerebral masivo por oclusión de la arteria carótida, debido a infecciones fetales como CMV o toxoplasmosis, las cuales producen vasculitis cerebral. [8, 11, 12,13] La incidencia de esta patología es de 1 a 2,5 por 10,000 nacidos vivos. Diagnostico prenatal Los hallazgos ecográficas incluyen: [1,8,13] ‐ ‐ ‐ Presencia de gran cantidad de liquido intracraneal con ecogenicidad mixta (licuefacción cerebral ), sin corteza cerebral visible. Estructuras de línea media conservadas (tabique interventricular, tercer ventrículo y cara normal) Tálamo, meninges, cerebelo, ganglios basales y tallo cerebral son normales. El principal diagnostico diferencial es la holoprocencefalía e hidrocefalia severa. [8, 11,12,13] 174 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Manejo prenatal y pronóstico Es una patología de mal pronóstico con mortalidad de casi 100% al primer año de vida, por lo tanto se puede ofrecer interrupción voluntaria de la gestación. [8,13] Porencefalia Definición Porencefalia se refiere a lesiones cavitarias cerebrales llenas de fluido, que pueden comunicarse con los ventrículos laterales y/o espacio subaracnoideo. [8,11,13] estas lesiones destructivas cerebrales pueden deberse a aéreas focales de hemorragia o isquemia, que licuan el tejido cerebral y se reemplaza por área quística. [13] La incidencia es de 1 por 10,000 nacidos vivos Ecográficamente puede observarse una lesión quística unilateral o bilateral que se comunica con el ventrículo o/y espacio subaracnoideo ipsilateral. Como es una lesión destructiva de tejido cerebral no se observa efecto de masa. [8, 11,13] En ocasiones se puede seguir la evolución de una hemorragia intracraneal focal, que en ecografías posteriores se convierte en un área anecoica llena de liquido cefalorraquídeo. [8,11,13] Manejo obstétrico y pronostico El seguimiento prenatal no cambia con respecto a otras gestaciones de riesgo obstétrico. Los principales factores pronostico son la extensión de la lesión y el lóbulo donde ocurrió. En casos unilaterales con lesiones focales el pronóstico es bueno. [8,11,13] Bibliografía 1. Gustavo Malinger, Gianluici Pilu, Diagnosis and management of fetal malformations, chapter 30 sonography of de fetal central nervous system 2008. 2. Maria P. Carrillo, Francisca S. Molina defectos congénitos. diagnóstico, pronóstico y tratamiento: defectos del sistema nervioso central. hvn 2011 3. Ana Monteagudo, Ilan E Timor-Tritsch, Fetal CNS Scanning—Less of a Headache Than You Think clinical obstetrics and gynecology / volume 55 / number 1 / march 2012 4. Teresita L. Angtuaco,Ultrasound Imaging of Fetal Brain Abnormalities Three Essential Anatomical Levels, Ultrasound Quarterly Volume 21, Number 4, December 2005 5. M Wyldes, M Watkinson, Isolated mild fetal ventriculomegaly, Arch Dis Child Fetal Neonatal Ed 2004;89:F9–F13 Capítulo 175 6. Mary E Norton, Fetal ventriculomegaly, Ultrasound Obstet Gynecol 2010 7. K. Melchiorre, A. Bhide, Counseling in isolated mild fetal ventriculomegaly, Ultrasound Obstet Gynecol 2009; 34: 212–22 8. Ana Monteagudo, Ilan E Timor-Tritsch, Prenatal diagnosis of CNS anomalies other than neural tube defects and ventriculomegaly, Ultrasound Obstet Gynecol 2010 9. International Society of Ultrasound in Obstetrics & Gynecology Education Committee. Sonographic examination of the fetal central nervous system: guidelines for performing the 'basic examination' and the 'fetal neurosonogram'. Ultrasound Obstet Gynecol 2007; 29:109. 10. Lauri Hochberg, Joanne Stone, Prenatal screening and diagnosis of neural tube defects, Ultrasound Obstet Gynecol 2010. 11. Diana W. Bianchi, Timothy M. Crombleholme, Fetology: Diagnosis and Management of the Fetal Patient 1st edition (April 26, 2000) 12. Asim Kurjak, Frank A. Chervenak, Perinatal Medicine 2006. Fetal Central Nervous System. Textbook of 13. D. Paladini , P. Volpe, Ultrasound of Congenital Fetal Anomalies, chapter 2 , Central and Peripheral nervous system anomalies, 2007 14. E.Eixarch, M.Sanz, B.Puerto, protocolo neurosonografia fetal, guias clínicas medicina materno-fetal icgon – hospital clínic Barcelona 2011 15. Pietro Spennato & Giuseppe Mirone,Hydrocephalus in Dandy–Walker malformation, Childs Nerv Syst (2011) 27:1665–1681 16. O. Klein, A. Pierre-Kahn, Dandy-Walker malformation: prenatal diagnosis and prognosis, Childs Nerv Syst (2003) 19:484–489 17. Wesley Lee, Ivana M. Vettraino, Prenatal Diagnosis of Herniated Dandy-Walker Cysts, J Ultrasound Med 2005; 24:841–848 18. Andrea Osorio , Juan Guillermo Rodríguez ,Complejo de Dandy Walker, experiencia en el Centro de Referencia Perinatal Oriente, Revista Chilena de Ultrasonografía. Volumen 9 / N˚ 4 / 2006. 19. Erwin M. J. Cornips , Geke M. Overvliet, The clinical spectrum of Blake’s pouch cyst: report of six illustrative cases, Childs Nerv Syst (2010) 26:1057–1064 20. Jose A. Lopez, Douglas Reich, Choroid Plexus Cysts, JABFM July-August 2006 vol. 19 N° 4 6. Evaluación del medio ambiente fetal Introducción La tasa de mortalidad perinatal en países desarrollados es de 6,2/ 1,000 nacidos vivos y en nuestro país es de 22 a 24/ 1,000, el 55 % de los casos corresponden a muertes fetales en tercer trimestre de gestación, por otro lado cerca del 90% de los casos de encefalopatía neonatal se originan antes del inicio del trabajo de parto. [2, 3,4] El objetivo de las pruebas de bienestar fetal antenatales, es identificar los fetos con riesgo de muerte o lesión intrauterina debido a asfixia o alteración de la circulación sanguínea, de manera que los resultados adversos que se enumeran en (tabla 1) puedan evitarse. [1,3,] Tabla 1 RESULTADOS ADVERSOS FETALES Y NEONATALES RELACINADOS CON ASFIXIA ANTEPARTO Fetales Muerte fetal intrauterina Acidosis metabólica al nacer Neonatales Muerte perinatal Acidosis metabólica Daño renal Enterocolitis necrotizante Hemorragia intracerebral Convulsiones Parálisis cerebral Encefalopatía neonatal Modificado de Journal of Obstetrics and Gynaecology Canada, septembre 2007. La prueba de bienestar fetal con mayor evidencia en los ensayos controlados en disminución de los resultados adversos en algunas entidades fetales como RCIU, sin embargo no existe evidencia que realizar pruebas de bienestar fetal de rutina en gestaciones de alto y bajo riesgo mejoren los resultados perinatales. [3,7] Aunque existen muchas pruebas para el evaluar el medio ambiente fetal entre ellas [3]: Capítulo 177 5. Conteo de los movimientos fetales 6. Monitoria sin estrés 7. Monitoria con estrés 8. Perfil biofísico/perfil biofísico modificado 9. Doppler de arterias uterinas 10. Doppler arteria umbilical En este capítulo solo nos vamos a referir al perfil biofísico y a los estudios doppler, en la evaluación del bienestar fetal. 6.1 Perfil biofísico fetal El perfil biofísico consiste en el estudio de cinco variables biofísicas, las cuatro mediante ecografía (movimientos fetales, movimientos respiratorios, tono y volumen de liquido amniótico) y la quinta mediante cardiotocografía externa, con el fin de demostrar integridad de la función cerebral fetal en ausencia de hipoxia tisular. [1,3, 7] Las variables biofísicas van apareciendo de manera secuencial durante el neurodesarrollo fetal. El tono fetal es el primero en aparecer y ocurre alrededor de la semana 7 de gestación en la corteza cerebral; posteriormente aparecen los movimientos fetales en la semana 9 de gestación en la corteza cerebral y los ganglios basales; alrededor se la semana 20-22 aparecen los centros respiratorios a nivel del tallo cerebral; y finalmente alrededor de la semana 28 de gestación aparece la reactividad de la frecuencia cardiaca en hipotálamo posterior y bulbo raquídeo. [un viejo].Las actividad biofísicas que primero aparecen en el neurodesarrollo fetal, son las ultimas en desaparecer en casos de asfixia severa. [11,13,15] La tasa de falsos negativos (probabilidad de muerte a la semana siguiente de realizado el test ) es de 0,64 por 1,000 en gestación de alto riesgo . La tasa de falsos positivos es del 50%. [3,9] Cuando realizar el test Se recomienda realizar el perfil biofísico luego de semana 28 a 32 de gestación, teniendo en cuenta que realizarlo antes de semana 32 tiene mayor posibilidad de falsos positivos.[3] Parámetros según Maning modificado. 178 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Tabla 2 VARIABLE Movimientos corporales fetales PUNTUACION 2 Tres o más movimientos corporales gruesos (tronco o extremidades) en 30 min. Uno o más movimientos respiratorios de 30 seg. De duración en 30 min Por lo menos un episodio de movimiento de una extremidad de un posición de flexión a extensión con un regreso rápido a la flexión. 0 Dos o menos movimientos corporales gruesos en 30 min. Ausencia de movimientos Movimientos respiratorios o menores de respiratorios 30 seg. En 30 min. Ausencia de movimientos Tono de extensión-flexión, ausencia de la apertura de la mano o formación del puño durante 30 min. lago de líquido Volumen del liquido Al menos un lago de líquido Un amniótico de 2x2 cm. amniótico menor de 2 x2 amniótico Monitoria categoría (ACOG) Monitoria fetal sin Monitoria categoría (ACOG) I II/III estrés Aunque el meta-análisis publicado en Cochrane 2008 evidencio que realizar el perfil biofísico de rutina, en gestaciones de alto riesgo, no disminuye significativamente la mortalidad perinatal[3,9,11], sin embargo la SOGC recomienda, que sí existe la disponibilidad del equipo y personal entrenado, se debería ofrecer de manera selectiva para seguimiento de gestaciones con alto riesgo de resultados perinatales adversos.[3,11] ver tabla 3 Efectos de tóxicos Algunas sustancia depresoras del sistema nervioso central fetal, generan puntajes muy bajos del perfil biofísico lo que podría llevar a intervenciones innecesarias, entre ellos: barbitúricos, alcohol, narcóticos opiáceos, metadona, benzodiacepinas, anticonvulivantes entre otros. [4,11] Tabla 3 MORTALIDAD PERINATAL A LA SEMANA SIGUIENTE DE LA EVALUACION DEL PBF Interpretación Mortalidad Manejo Puntaje perinatal No intervención , solo sí 10/10 riesgo de 1 en 1,000 indicación obstétrica 8/10 (LA* Bajo asfixia normal) 8/8( sin monitoria) Descartar compromiso renal y 89 en 1,000 ruptura de membranas 8/10 (LA Probable Capítulo anormal) 6/10 normal) 6/10(LA anormal) 4/10 2/10 0/10 179 compromiso crónico fetal equivoco, Variable (LA Test sospechar asfixia Probable asfixia 89 en 1,000 Alta probabilidad de 91 en 1,000 asfixia Asfixia perinatal casi 125 en 1,000 con certeza Certeza de asfixia 600 en 1,000 Sí >34 Sem. Inducir parto Sí< 34 Sem. maduración pulmonar Repetir PBF a las 24 horas Descartar compromiso renal y ruptura de membranas Sí >34 Sem. Inducir parto Sí< 34 Sem. maduración pulmonar Parto por indicación fetal Parto por indicación fetal Parto por indicación fetal Modificado de SOGC Clinical Practice Guideline. Fetal Health Surveillance: Antepartum and Intrapartum Consensus Guideline. JOGC 2007; 29(9); *LA= Liquidodel Amniótico, usando cualquier técnica, en nuestra práctica diaria usamos el Evaluación líquido amniótico ILA El líquido amniótico se produce en el primer trimestre a nivel del corion, como un trasudado del plasma. En segundo y tercer trimestre el líquido amniótico se produce a nivel pulmonar, riñón y piel, y se elimina por deglución fetal. [1,2,9,11,16] Métodos para determinar la cantidad de líquido amniótico. Cualitativos: realizado por un ecografista experimentado y determina en forma subjetiva si la cantidad de liquido amniótico visualizado es normal o anormal. [1,2,9,11,16] Semicuantitativos: existen 4 formas ‐ Técnica de Phelan: determina el índice de liquido amniótico (ILA). Se divide imaginariamente el abdomen materno en cuatro cuadrantes y se toma una medida de cada uno de ellos; el valor norma es un ILA entre 5 y 25 cm. [16] ‐ Columna vertical máxima: consiste en realizar una medición vertical en el lago amniótico mayor, considerando valores normales entre 3 a 8 cm.[16] ‐ Evaluación de un lago amniótico: desarrollado por Manning y Chamberlain consideran normal un lago mayor de 2x2 cm. [16] ‐ Percentil según edad gestacional: Moore y Cayle en la década del 90 establecieron curvas, donde correlacionaban ILA y edad gestacional, estableciendo percentiles para cada edad gestacional . definieron normalidad entre percentil 5 (ILA 7cm) a percentil 95 (ILA 20 cm). Sin embargo en el 2000 Magann y col. Redefinieron los 180 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional valores donde el percentil 5 (ILA 5), percentil 50 (ILA 9,5) y percentil 95 (ILA 19,4). [18] Imagen 1. Técnica de Phelan medición de cuatro bolsillos amnióticos Cortesía Dr. Alviar/SONOGYN/IMI Oligoamnios: se define clásicamente como un volumen de liquido amniótico total, inferior a 500cc en una gestación entre 32 a 36 semanas, o un ILA < 5 cm o una columna vertical máxima inferior a 2 cm. Puede indicar diferentes patologías entre ellas una restricción de crecimiento fetal, una ruptura de membranas, malformaciones renales y de la vía urinaria, entre otras.[ 1,2,9,11,16] Imagen 2. gestación de 22 semanas con secuencia de Potter, oligoamnios severo. A. cabeza deformada por compresión externa. B .abdomen fetal recubierto por miometrio cortesía de Dr. Alviar/SONOGYN/IMI Capítulo 181 Polihidramnios: se define como un liquido amniótico total superior a 1,500 a 2,000 cc, en cualquier momento de la gestación, o un ILA > 25 cm, o una columna vertical máxima mayor de 8 cm,o al percentil 95 para la edad gestacional. Puede presentarse en las siguientes patologías: diabetes materna, atresias de la vía digestiva fetal, defectos abiertos del tubo neural, cromosomopatías , defectos de pared abdominal anterior y insuficiencia cardiaca fetal. [1,2,9,11,16 Imagen 3, polihidramnios columna vertical máxima 9,8 cm , Phelan 35 cm cortesía de Dr. Arenas/Universidad Nacional de Colombia/hospital Engativá Imagen 3. Se observa a la izquierda la medición de columna vertical máxima de 9,4 cm, y a la derecha medición de Phelan ILA 35. Polihidramnios cortesía de Dr. Arenas/Universidad Nacional de Colombia/hospital Engativá Perfil biofísico modificado Es una forma sencilla y rápida de evaluar el bienestar fetal. Solo incluye dos parámetros el índice de liquido amniótica (ILA) y la monitoria fetal sin estrés(con o sin TEVA), de esta manera se evalúa un componente de hipoxia aguda y acidosis fetal, como es la monitoria fetal y componente de hipoxia crónica con es el ILA.[ 1,2,9,11] Esta prueba tiene una buena correlación cuando se compara con el PBF completo o una monitoria fetal con estrés para determinar el bienestar fetal. La tasa de falsos negativos es de 0,8 en 1,000 nacidos vivos y la tasa de falsos positivos es del 60%. [1,2,9,11] 6.2 Doppler feto-placentario El doppler feto placentario es una herramienta de vital importancia en la obstetricia moderna, ya que permite evaluar las diferentes características del flujo sanguíneo fetal: dirección, pulsabilidad , forma de la onda, resistencia y velocidad del flujo. Eventualmente cualquier vaso sanguíneo fetal es susceptible de medición , sin embargo los cuatros 182 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional vasos que brindan mayor información sobre el bienestar fetal alterado son: la arteria umbilical, la arteria cerebral media (ACM), ductus venoso y vena umbilical. [1,4,8] Diferentes estudios demuestran que el doppler de arteria umbilical reduce la morbilidad y mortalidad perinatal, disminuye el número de inducciones y cesáreas innecesarias, cuando se realiza en gestaciones de alto riesgo; por el contario no hay evidencia de algún beneficio cuando se realiza en gestaciones de bajo riesgo.[2] Indicaciones Diagnostico y seguimiento de restricción de crecimiento fetal Isoinmunización y anemia fetal Evaluación de embarazos gemelares monocoriales En trastornos cardiovasculares fetales Doppler de Arteria Umbilical La forma de la onda, la pulsabilidad y la resistencia varia a lo largo de la gestación, en primer trimestre la onda se observa con un pico sistólico bajo y ausencia de flujo diastólico; alrededor de la semana 20 semanas al reducirse las resistencias placentarias (debido a la segunda oleada de migración trofoblastica) , las características cambian y se observa una onda con alto flujo y pobre resistencia, permitiendo flujo continuo en sístole y diástole. [1,4,8,9,11] Como realizar la medición ‐ ‐ ‐ ‐ ‐ ‐ Identificar el asa libre del cordón flotando en liquido amniótico Ampliar la imagen que ocupe ¾ partes de la pantalla y activar el modo doppler color El Angulo de isonacion debe ser menor de 30° Observar por lo menos tres picos de ondas simétricos para realizar la medición Realizar por lo menos tres mediciones serias Mediciones cercanas a la placenta o a la inserción del cordón no se recomiendan, pueden presentar pequeñas variaciones en los resultados. [5,7] En casos de insuficiencia placentaria y restricción de crecimiento fetal, las resistencias placentarias están elevadas, la forma de la onda de arteria umbilical disminuye el flujo al final de diástole (FFD). Si persiste o se agrava la insuficiencia placentaria desaparece el flujo en diástole de la arteria umbilical y finalmente ocurre flujo reverso que indica hipoxia severa con alta tasa de mortalidad perinatal.[ 1,4,8,9,11] Capítulo 183 Imagen 4, tres vasos umbilicales y doppler de arteria umbilical normal. Cortesía Dr. Arenas / universidad nacional de Colombia/OyG Para que se evidencia disminución (FFD) debe existir por lo menos 30% de disfunción placentaria, y para que se evidencia flujo diastólico ausente o flujo reverso debe existir una disfunción placentaria mayor del 70%. [1,4,8,9,11] La evaluación del flujo doppler en la arteria umbilical fetal disminuye la mortalidad perinatal (OR 0,66) y la morbilidad perinatal (OR 0,56). Por otro lado, los cambios en el flujo doppler umbilical suelen ocurrir semanas antes de aparecer alteraciones del perfil biofísico y de la monitoria fetal, sin embargo en algunas ocasiones de hipoxia fetal aguda ocurren cambios en la monitoria fetal y el perfil biofísico antes de evidenciar alteración del doppler. [6,14] Doppler de arteria cerebral media (ACM) La ACM es una rama de la arteria carótida interna y es el vaso que aporta mayor flujo sanguíneo al SNC fetal. En este vaso aparecen los primeros indicios del fenómeno de redistribución del flujo sanguíneo fetal. [1,4,8,9,11] Normalmente este vaso tiene alta resistencia al flujo sanguíneo, por lo tanto la forma de la onda se observa con alto índice de pulsabilidad sistólica y un bajo flujo al final de diástole. Como realizar la medición ‐ ‐ ‐ ‐ ‐ ‐ Se debe tomar un corte axial a nivel de la base cráneo Activar el doppler color, observar el polígono de Willis y luego ampliar la imagen hasta ocupar ¾ de la pantalla El Angulo de isonacion debe ser menor de 15° preferiblemente 0° La medición debe realizar en ausencia de movimientos respiratorios fetales No realizar la medición en bradicardia o taquicardia fetal marcada, por alteración de forma de la onda. No se debe ejercer presión excesiva sobre la calota fetal, porque se aumenta artificialmente el índice de pulsabilidad y disminuye la velocidad de flujo. 184 ‐ Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Debe realizarse por lo menos tres mediciones [5,7] Imagen 5. Doppler de arteria cerebral media, se observa el polígono de Willys, se puede medir IP, IR y el pico Max de flujo en anemia fetal. Cortesía Dr. Arenas /OyG En casos de insuficiencia placentaria, la hipoxia generada permite que ocurra el fenómeno de redistribución del flujo sanguíneo fetal, el cual consiste en dirigir el la mayor parte del gasto cardiaco a la circulación cerebral (efecto-sparing-cerebral), en detrimento de otros órganos como riñón, sistema digestivo, piel, pulmones, entre otros. El aumento el flujo sanguíneo hace que los vasos cerebrales disminuyan su resistencia (vasodilatación cerebral), permitiendo flujo continuo durante todo el ciclo cardiaco.[4,8,12] Sí el índice de pulsabilidad de la ACM es menor al percentil 5 y/o el índice cerebroplacentario(IP ACM/IP AU <1), indican vasodilatación cerebral y fenómeno de redistribución, elevando significativamente la mortalidad perinatal.[ 1,4,8,9,11] Los estudios de Echizenya y col. Usando doppler pulsado para evaluar la velocidad de flujo máxima en la ACM y su relación con la morbimortalidad perinatal. Ellos concluyeron que la velocidad de flujo máximo en ACM es una prueba de bienestar fiable, sin embargo no se ha estandarizado su uso. [19] ACM en evaluación de anemia fetal En caso de fetos con anemia severa secundaria a isoinmunización, o infección por parvovirus B19, la evaluación de la velocidad máxima en la ACM puede determinar el grado de anemia. Este es un método no invasivo que evita amniocentesis innecesarias en un 70% casos, fue diseñado por Mary y col. Reportando una sensibilidad de 73 a 100% , con una especificidad entre 71 y 80% y una tasa de falsos positivos de 12%. [1,4,8,9,11] Doppler del Ductus venoso El ductus venoso de Arancio, es un vaso pequeño proximal a la vena umbilical que permite, en condiciones normales derivación del 30% del flujo sanguíneo directamente a Capítulo 185 la aurícula derecha, el otro 70% se dirige hacia las venas supra hepáticas; sin embargo en casos de insuficiencia placentaria entre el 60 a 85% del flujo pasa directamente de la vena umbilical a la aurícula derecha.[1,2,4,15] La forma de la onda del ductus venosa tiene características trifásicas: 1. Onda sistólica (S), 2. Onda diastólica (D) y 3. Onda (a) que corresponde a la contracción auricular.[5] Como realizar la medición ‐ ‐ ‐ ‐ ‐ Se debe tomar un corte axial del abdomen a nivel de cámara gástrica, inmediatamente inferior a la visualización cardiaca, se activa el modo doppler color donde se observara un flujo turbulento (color amarillo brillante), a la derecha de la cámara gástrica el cual corresponde al ductus venoso. La imagen debe ocupar las ¾ partes de la pantalla El Angulo de isonacion debe ser inferior a 30° Usar escalas de velocidades altas (40 a 60 m/s) Tener cuidado de no medir la vena hepática.[5,13] En casos de insuficiencia placentaria severa, se origina una hipoxia cardiaca que altera la contractilidad miocárdica, lo cual determina que desaparezca la onda (a) en ductus venoso y casos muy severo, se observa onda (a) reversa en el ductus venoso, determinado el estado final de la acidosis fetal con alto mortalidad perinatal. [2,4,7] Imagen 6. parte superior ductus venoso normal. Parte inferior ductus anormal por onda a reversa indicando disfunción cardiaca Cortesía OyG de Dr. Arenas/ Vena umbilical El flujo normal en la vena umbilical es continuo, con forma de onda horizontal sin muescas, sin embargo en casos de hipoxia y acidosis severa , se puede evidenciar un flujo pulsátil en la vena umbilical, siendo el mejor predictor de mortalidad fetal inmediata. [2,7,8,14] 186 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Conclusiones Existen diferentes métodos para intentar predecir los resultados perinatales, principalmente en gestaciones de alto riesgo. Aunque el doppler de arteria umbilical ha mostrado tener un alto rendimiento diagnostico en gestaciones de alto riesgo (restricción de crecimiento fetal, trastornos hipertensivos del embarazo, entre otros), no ha demostrado mejorar los resultados perinatales en gestaciones de bajo riesgo, por lo tanto es un estudio que tiene sus indicaciones precisas. Las otras pruebas de bienestar como el perfil biofísico y la monitoria fetal, también tienen sus indicaciones y en algunas ocasiones, pueden alterarse incluso antes de ocurrir cambios en el doppler fetal. [2,7,8,14] 6.3 Restriccion de crecimiento fetal Aunque este capítulo no está diseñado para exponer el manejo de patologías especificas, pero dada la creciente incidencia de restricción de crecimiento fetal, se efectuara algunas recomendaciones básicas para diagnostico y seguimiento. La restricción de crecimiento fetal, se ha definido clásicamente como una alteración fetal que impide lograr alcanzar el potencial de crecimiento optimo para determinado feto. se debe diferenciar entre pequeño para la edad gestacional (PEG) de la verdadera restricción de crecimiento intrauterino (RCIU), ya que en el primero es un feto pequeño, con peso fetal estimado (PFE)entre el percentil 3 y 10, sin patología conocida y estudio hemodinámico (doppler feto-placentario) normal. [11,20,21,22,23] ‐ RCIU: crecimiento fetal entre el percentil 3 y 10 para edad gestacional, con estudios doppler alterados, oligoamnios o alteración de otras pruebas de bienestar fetal, esta definición tiene un sensibilidad de 79%, especificidad 93%, VPP 83% y VPN 91%. Otra definición aceptada es circunferencia abdominal inferior al percentil 2,5 sin alteración de otros parámetros biométricos. ‐ RCIU severo: cuando existe un PFE inferior al percentil 3, independientemente de los estudios doppler. Luego del diagnostico de RCIU se debe realizar una clasificación hemodinámica con los estudios doppler para definir seguimiento y pronostico. Se debe remitir a la paciente centro de tercer nivel que cuente con el servicio de perinatología y equipo interdisciplinario (obstetra, neonatologo, anestesiólogo, medicina critica entre otros).[ 11,20,21,22,23] Doppler tipo I Sin signos sugestivos de insuficiencia placentaria (ver imagen 4). En estos casos se recomienda seguimiento semanal con doppler, monitoria fetal y PBF, cada dos semanas realizar biometría e inducir el trabajo de parto a la semana 37 de gestación. [20,21] Capítulo 187 Doppler Tipo II Existe aumento moderado de la resistencia placentaria, sin signos de redistribución hemodinámica y se determina por un índice pulsabilidad de arteria umbilical (IP AU) > p 95. [11,20,21] El seguimiento se realiza doppler, monitoria fetal y PBF semanal, cada dos semanas realizar biometría fetal y se termina el embarazo a la semana 37 de gestación, se recomienda vía vaginal. Imagen 7. A la izquierda medición de doppler de arteria umbilical en gestación de 38 semanas. A la derecha la flecha roja indica IP AU mayor a percentil 95 Cortesía Dr Arenas/Universidad Nacional de Colombia/ hospital de Engativa Doppler tipo III Existe aumento severo de la resistencia placentaria, sin signos de redistribución hemodinámica y se determina por una ausencia de flujo diastólico en la arteria umbilical en más del 50% de los ciclos. El seguimiento de estos es intrahospitalario con doppler, monitoria fetal y perfil biofísico cada 48 a 72 horas, iniciar maduración pulmonar entre semana 24 a 34 y parto electivo en la semana 34 de gestación, la vía del parto según criterio del obstetra. [11,20,21,22,23] Imagen 8. Flujo ausente en arteria umbilical en todos los 188 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Doppler tipo IV Existe signos de redistribución hemodinámica y disminución de las resistencias en la ACM, se determina observando IP ACM < percentil 5 indicando vasodilatación cerebral. En ocasiones puede observarse signos de vasodilatación cerebral, sin que se evidencie flujo ausente en arteria umbilical (alteración del índice cerebro-placentario) y suele ocurrir en gestaciones mayores de 34 semanas.[ 11,20,21,22,23] Estas pacientes requiere hospitalización, doppler cada 48 horas y pruebas de bienestar fetal diarias, iniciar maduración pulmonar en edades gestacional de 24 a 34 semanas y terminar el embarazo por vía abdominal a la semana 32 o luego 24 horas pos terminación de maduración pulmonar. [11,20,21,22,23] Imagen 9. A la izquierda medición del flujo en ACM en una gestación de 35 semanas. A la derecha se observa IP ACM inferior al percentil 5 señalados por flecha Cortesía Dr Arenas/Universidad roja. Doppler tipo V Indica alteracion hemodinamica grave definida por doppler de arteria umbilical con flujo diastolico reverso en mas del 50% de los ciclos, y/o ductos venoso con onda a ausente o revertida, y/o vena umbilical pulsatil.[ 11,20,21,22,23] En el seguimiento de estos paciente se requiere realizar doppler y PBF cada 24 horas, monitoria fetal cada 12 horas en ambiente hospitalario, se debe evaluar la viabilidad fetal y finalizacion del embarazo por via abdominal a las 28 semanas o luego de concluir la maduracion pulmonar. [11,20,21,22,23] Imagen 10. Onda a reversa en Ductus venoso cortesía Dr. Arenas / hospital Engativá Capítulo 189 Conclusion El Doppler de vasos fetales está orientado principalmente a la identificación de la Insuficiencia Placentaria con el objetivo de disminuir las complicaciones derivadas de la Asfixia Perinatal secundaria y la mortalidad fetal. [11,20,21,22,23] Bibliografía 1. N W Jones, G Bugg, Assessing fetal health, obstetrics, gynaecology and reproductive medicine. 2008 2. N W Jones, Assessing antepartum fetal health, obstetrics, gynaecology and reproductive medicine 2011 3. Robert Liston, Diane Sawchuck, Journal of Obstetrics and Gynaecology Canada, volume 29, numéro 9, septembre 2007. 4. Caroline Signore, Roger K. Freeman, Antenatal Testing – A Reevaluation: Obstet Gynecol. 2009 March ; 113(3): 687–701. 5. Figueras F, Puerto B, guía clínica: doppler en medicina fetal, Instituto Clínico de Ginecología, Obstetricia i Neonatología, Hospital Clínico de Barcelona. 2007. 6. A Kubilay Ertan, H Alper, Werner, Doppler Sonography in mHigh Risk Pregnancy, textbook of perinatal medicine 2007 7. Cafici D. Doppler en obstetricia. Rev Chil Ultrasonog. 2009; 12: 4-17. 8. Michelle L Kush, Ahmet A Baschat, Fetal Responses to Placental Insufficiency textbook of perinatal medicine 2007 9. Mario O. Parra pruebas de vigilancia fetal, obstetricia integral del siglo XXI 10. Lalor JG, Fawole B, Perfil biofísico para la evaluación fetal en embarazos de alto riesgo, La Biblioteca Cochrane Plus, 2008, Número 2 11. Lawrence D. Devoe, Antenatal Fetal Assessment: Contraction Stress Test, Nonstress Test, Vibroacoustic Stimulation, Amniotic Fluid Volume, Biophysical Profile, and Modified Biophysical Profile—An Overview 2011. 12. H.M. Mirghani, D.L. Weerasinghe, The effect of maternal fasting on the fetal biophysical profile, International Journal of Gynecology and Obstetrics 81 (2003) 17–21 190 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 13. M. Herrera, M. Rebollero, ¨Medicina Fetal, Curso prenatal de anomalías congénitas¨ Colsanitas 2005. 14. reyes jaqueline, goncalves obstetricia fleischer, luis f, rejame silva sandra, ecografía ginecología y 15.Edith A. Muller,Miguel E. Aragón, texto de obstetricia y perinatología, universidad nacional de Colombia 1999 16. Dr. J. Oliva, alteraciones del líquido amniótico: diagnostico y tratamiento, Protocolos UMF Vall Hebrón. 17. Pablo Andrés Victoria-Gómez, Valoración por ultrasonografía Doppler en medicina materno-fetal, Revista Colombiana de Obstetricia y Ginecología Sept. 2006 18- Thomas R. Moore, The Role of Amniotic Fluid Assessment in Evaluating Fetal WellBeing, Clin Perinatol 38 (2011) 33–46. 19. Mauro H. Schenone, Giancarlo Mari, The MCA Doppler and its Role in the Evaluation of Fetal Anemia and Fetal Growth Restriction, Clin Perinatol 38 (2011) 83–102 20. José Enrique Sanín-Blair, Jaime Gómez Díaz, diagnóstico y seguimiento del feto con restricción del crecimiento intrauterino(RCIU) y del feto pequeño para la edad gestacional (PEG). consenso colombiano, Revista Colombiana de Obstetricia y Ginecología Vol. 60 No. 3 • 2009 • (247-261) 21. O. M. Turan, S. Turan, Progression of Doppler abnormalities in intrauterine growth restriction, Ultrasound Obstet Gynecol 2008; 32: 160–167 22. Giancarlo Mari, Doppler Vascular Changes in Intrauterine Growth Restriction. Semin Perinatol 32:140-147- 2008. 23. Higueras,Perdomo,Carreras;crecimiento intrauterino restringido capitulo 113, Obstetricia y medicina materno fetal:Cabero,Saldivar,Cabrillo,2007 7. Cervicometría Introducción El parto pre término permanece como una de las principales causas de morbimortalidad perinatal; razón por la cual durante décadas se ha realizado una búsqueda en pro de identificar las mujeres con riesgo de parto pre término a fin de proponer estrategias de prevención.(9) La incidencia de parto pre término en Estados Unidos es de un 12 %, solamente un 15 % de los partos pre términos ocurre en pacientes con antecedente de parto pretérmino; con la intervención de estrategias efectivas de prevención se logra una disminución del 50 %; por lo cual se siguen buscando medidas que permitan disminuir estos valores. (10) Definición: Consiste en la evaluación ecográfica del cérvix durante la gestación entre las 19-24 semanas; que ha tomado gran importancia en los últimos años, por el papel que juega en la predicción de parto pre término y sus implicaciones perinatales. La cervicometria ha sido la mejor herramienta estudiada para predecir el parto pre término.(9) Técnica: El ultrasonido Transvaginal es la vía de elección que permite una mejor visualización del cérvix, sin interposición de asas, cumpliendo los siguientes parámetros técnicos: ‐ ‐ ‐ ‐ ‐ Paciente con vejiga vacía. Transductor cubierto por un condón Insertar el transductor. Colocar el transductor en el fondo de saco anterior de la vagina. Obtener una vista sagital del cérvix, con la vista del eje largo que muestre la ecogenicidad de la línea endocervical a lo largo de la longitud del cérvix (Imagen 1). 192 ‐ ‐ ‐ ‐ ‐ ‐ ‐ Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Retire el transductor hasta que la imagen sea optima, volver a aplicar la presión justa para restaurar la imagen (evitar una presión excesiva en el cuello uterino que pueda alargarlo) Ampliar la imagen de manera que el cuello uterino ocupe al menos 2/3 de la imagen. Todo el cérvix debe ser visualizado, la distancia de la línea endocervical debe ser equidistante al labio anterior y posterior. Medir la longitud cervical del orificio cervical interno al orificio cervical externo a lo largo del canal endocervical. Cuando hay una desviación del canal endocervical de más de 5 mm, en una línea recta que comunique el OCI con el OCE, se puede realizar la medida mediante 2 líneas que sigan la curva. Obtener al menos tres mediciones, y registrar el valor más corto en milímetros. Aplicar presión transfundal durante 15 segundos, y registrar cualquier cambio en la longitud cervical o canalización. Imagen 1 Cortesía Obstetricia y Ginecología LTDA, Fetal Clinic. Dr Arenas 2012 Capítulo 193 Evaluacion cervical: Diferentes parámetros han sido evaluados para predecir el parto pretérmino, frecuentemente la longitud cervical, que se mide desde el interior del OCI a lo largo del canal al OCE. Zilianti describió un proceso de tunelización del cérvix donde la forma normal corresponde a una T, posteriormente una Y, luego V y finalmente una U; este último tiene más probabilidades de parto pre-termino, pero la valoración de las tunelizaciones es una variable subjetiva, de poca reproducibilidad interobservador. Hasta en un 5 % de los casos se puede visualizar un acortamiento en la longitud cervical con la presión transfundica, lo cual indica una anormalidad basal del cérvix; pero según el estudio (4) se puede o no evidenciar un incremento del riesgo de parto pretérmino. A pesar de esto, la tunelización ha sido reportada como predictor de parto pretérmino; en población de alto riesgo una tunelización mínima (< 25 %) entre las 14 a 22 semanas, no se asoció con un riesgo incrementado de parto pretérmino (2); la tunelización moderada (25 al 50 %) y severa (> 50 %); se asocio con un 50 % más de posibilidades de parto pretérmino. (3) Predicion de parto pretermino: Hay múltiples estudios que evalúan el uso de la cervicometria en la predicción y prevención del parto pretérmino; se han realizado en múltiples poblaciones de pacientes de alto y bajo riesgo, de gestaciones únicas y múltiples; y aunque la técnica es similar, no hay homogeneidad en la población. La longitud cervical es un factor predictor de parto pretérmino en todas las poblaciones estudiadas, incluidas las mujeres asintomáticas con antecedente de conización; anomalías de Muller y dilatación múltiple. Según los estudios el valor de la longitud cervical se asocia a predicción de parto pretérmino; una longitud cervical < 25 mm, tiene una sensibilidad del 61 – 74 %, (4) por otro lado en un estudio hecho por Owen evidenció que el 90 % de los partos pre término en pacientes de alto riesgo ocurren con cervicometrias menores a 10 mm. (13). Una revisión de Cochrane del 2009(5), evaluó el uso de la cervicometria para determinar parto pretérmino, realizó una revisión desde 1966 a septiembre de 2008; se incluyeron ensayos clínicos controlados aleatorizados con gestantes entre las 14 a 32 semanas, con cervicometrias de bajo riesgo para parto pretérmino; se encontraron 5 estudios con 507 pacientes que cumplían los criterios, tres incluían gestaciones únicas con trabajo de parto pretérmino en el cual no se encontró diferencia significativa en los resultados perinatales, entre conocer y no conocer la longitud cervical. 194 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Otro estudio incluyo gestaciones únicas, trabajo de parto pretérmino y ruptura de membranas que evaluó la seguridad del uso de la cervicometria, concluyó que no hay cambios en la incidencia de las infecciones materno-fetales. El último incluyó gestaciones gemelares con o sin trabajo de parto pretérmino, sin evidenciar diferencia entre las pacientes con cervicometria conocida versus desconocida. La revisión permite concluir que no hay evidencia suficiente que recomiende el tamizaje de rutina de la cervicometria en todas las pacientes gestantes. (5) En una revisión de Berghella (2007), se encontró que el punto de corte de la cervicometria en 25 mm, varía su sensibilidad, especificidad y valor predictivo positivo de acuerdo al grupo de población a la que se aplique; (ver tabla 1, Adaptada de 7 ): GESTACIONES SIMPLES LONGITUD CERVICAL SENSIBILIDAD ESPECIFICIDAD Bajo Riesgo 25 47 84 Anormalidades uterinas 25 71 91 25 69 80 Paciente sintomáticas de parto pretérmino. 25 83 88 Previo LEEP 25 67 87 Antecedente de Parto pretérmino Tres estudios aleatorizados investigaron la eficacia del tamizaje universal con cervicometría, entre las 19 a 24 semanas, en pacientes asintomáticas con longitudes cervicales menores a 15 mm o entre 10 – 20 mm, cuyo objetivo consistía en prevenir el parto pre término (11), se excluyeron las mujeres con sangrado genital, malformaciones uterinas o patologías crónicas. Las medidas preventivas consistían en cerclaje, progesterona micronizada diaria en ovulo o gel; logrando tasas globales de disminución del parto pre término (< 34 semanas) entre 8.5 % - 15 %. (10); a partir de estos datos hacen un análisis de costo efectividad del Capítulo 195 tamizaje universal, donde el punto de corte para la cervicometría es de 15 mm; afirmando que no es costo efectivo, pues el tamizaje universal requiere de 400 – 600 cervicometrias para prevenir un parto pre término (< 34 semanas). (10 -12) En un estudio que incluyo 3073 pacientes en 10 centros, con gestaciones únicas menores de 24 semanas, excluyendo gestaciones múltiples, placenta previa, cerclaje o anomalías fetales; realizaron la cervicometria a las 24 semanas y 28 semanas; evaluando el cambio de valor de la cervicometria entre las dos semanas, encontrando un 7.2 % (196) de mujeres con Longitud cervical(LC) menor a 25 mm a las 24 semanas; de estas 72 tenían una LC < 25 mm en la segunda visita a las 28 semanas; al analizar los datos se evidenció una probabilidad de parto pre término con OR 0.97 95 % (IC 0.96 – 0.98); Durante el análisis se halló que el cambio de valor de la LC, entre las dos visitas es estadísticamente significativo independiente de otros factores como el tabaco, la fibronectina fetal, edad, raza y el índice de masa corporal. (9) Entre las mujeres con LC < 25 mm, por cada milímetro (uno) que se acorte en la cervicometria de la segunda visita hay un incremento del 3 % de riesgo de parto pre término; permitiendo mejorar la selección de pacientes candidatas a tratamiento a fin de prevenir el parto pre término. (9) Conclusion: Una longitud cervical menor de 25 mm entre las 16 y 24 semanas, ha demostrado ser un punto de corte fiable para predecir un aumento del riesgo de parto prematuro; entre más corta la longitud cervical y más temprano aparezca, mayor es el riesgo del parto pre término (7), la presencia de tunelización mayor al 25 % mejora la sensibilidad de la cervicometria con LC < 25 mm. (8) El examen debe ser realizado a pacientes con factores de riesgo; pues no es una medida costo efectiva como método de tamizaje (7)(10-12). Bibliografia 1. Berguella V, Ultrasound Assessment of the Cervix, CLINICAL OBSTETRICS AND GYNECOLOGY, 2003 2. Zilianti M, Azuaga A, Calderon F, et al. Transperineal sonography in second trimester to term pregnancy and early labor. J Ultrasound Med. 1991;10:481–485. 3. Berghella V. The natural history of cervical funneling in high-risk women. Obstet Gynecol. 2003 4. Berghella V, Daly SF, Tolosa JE, et al. Prediction of preterm delivery with transvaginal ultrasonography of the cervix in patients with high-risk pregnancies: does cerclage prevent prematurity. Am J Obstet Gynecol. 1999. 5. Guilliam L, Cervical Assessment by Ultrasound for Preventing Preterm Delivery, NOVEMBER 2009 196 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional 6. National Vital Statistics Report 2006. Martin JA, Hamilton BE, Sutton PD, Ventura SJ, Menacker F, Kirmeyer S, et al. Births: final data for 2006. National Vital Statistics Report 2009. 7. Berguella V; Cervical length and prediction of preterm delivery, Curr Opin Obstet Gynecol, 2007 8. Mella M, Berguella V, Prediction of Preterm Birth: Cervical Sonography, Semin Perinatol, 2009: 33. 9. Moroz LA, Simhan HN. Rate of sonographic cervical shortening and the risk of spontaneous preterm birth. Am J Obstet Gynecol 2012;206 10. Parry S, Universal maternal cervical length screening during the second trimester: pros and cons of a strategy to identify women at risk of spontaneous preterm, Am J Obstet Gynecol 2012. 11. Hassan SS, Romero R, Vidyadhari D, et al. Vaginal progesterone reduces the rate of preterm birth in women with a sonographic short cervix: a multicenter, randomized, double-blind, placebo-controlled trial. Ultrasound Obstet Gynecol 2011 12. Ohio Perinatal Quality Collaborative Writing Committee. A statewide initiative to reduce inappropriate scheduled births at 36(0/7)-38(6/7) weeks’ gestation. Am J Obstet Gynecol 2010. 13. Owen J, Does midtrimester cervical length >25 mm predict preterm birth in high-risk women?. Am J Obstet Gynecol 2010. 14. Mella M, Berguella V, Prediction of Preterm Birth: Cervical Sonography, Semin Perinatol, 2009: 33. A. Anexo: Reporte ecográfico y lista de chequeo - Información demográfica: Nombre de la paciente: Identificación: Identificación del hospital: Indicación de consulta: Fecha de última regla: Fecha del examen: - Número de fetos y bienestar fetal: La presencia de actividad cardiaca para cada feto. Si la gestación es múltiple: corionicidad y amnionicidad. - Biometría: (debe ser informado en mm o cm junto con equivalentes de edad gestacional estimada). Diámetro biparietal Circunferencia cefalica Circunferencia abdominal Longitud del fémur Longitud del Humero - En caso de ser reportado en milímetros si es anormal Pliegue nucal Cisterna magna Diámetro cerebeloso Ventrículo lateral - Anatomía fetal que se notifica: normal o anormal (con detalles) o no visto, con la explicación: En caso de ser declaradas por: Cráneo Ventrículos cerebrales, cavum septum pellucido, la hoz línea media, el plexo coroideo Fosa posterior: cisterna magna, cerebelo Cara: órbitas, los labios 198 Texto guía en ecografia obstetrica, para el desarrollo de programas de educación médica continuada en ultrasonido obstetrico de la Unidad de Medicina Maternofetal del Departamento de Obstetricia y Ginecología de la Universidad Nacional Columna Vertebral Tórax: Cuatro cámaras cardiacas. Tractos de salida Eje cardiaco. Situs cardíaco Estómago Intestino Riñones Vejiga Inserción abdominal del cordón. Extremidades: la presencia de las manos y la presencia de los pies. -Cantidad de líquido amniótico que se notifica es: Normal, aumentado o disminuido o ausente. - Placenta Posición, relación con el orificio cervical. Anatomía materna: Utero, ovarios, cervix, vejiga En caso de ser reportado como: • normal o anormal.