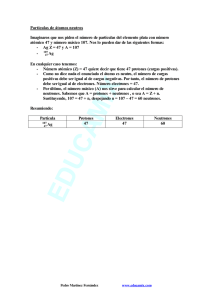
Estructura del átomo Se puede considerar al átomo como la parte
Anuncio

Estructura del átomo Se puede considerar al átomo como la parte más pequeña de un elemento. Un elemento está constituido por un mismo tipo de átomos. La estructura de un átomo comprende dos zonas básicas: > El núcleo: región central de pequeño volumen que reúne casi toda la masa del átomo. En esta zona se encuentran dos tipos de partículas: los protones (de carga eléctrica positiva) y los neutrones (sin carga eléctrica). > Por fuera del núcleo se encuentra la segunda zona, o región extranuclear, en la que se hallan en continuo movimiento partículas de masa casi insignificante y carga eléctrica negativa: los electrones. Los átomos son neutros, es decir, tienen igual número de protones que de electrones por lo tanto no tienen carga eléctrica neta porque cargas opuestas de la misma magnitud se anulan. Los electrones se mueven en capas alrededor del núcleo, estas capas se denominan orbitales. Cada orbital está caracterizado por un determinado nivel de energía (n), cuanto más cercano al núcleo menor energía tendrán. El número máximo de electrones que acepta un determinado nivel n de energía es 2 n2, es decir que el primer nivel, n1, solo podrá tener 2 electrones como máximo, el n2 8 electrones y el n3 18 electrones. El núcleo está compuesto por protones y neutrones. La masa de un protón o de un neutrón es aproximadamente 1850 veces mayor a la masa de un electrón. En consecuencia, la masa de un átomo es prácticamente igual a la del núcleo, considerando, entonces, la masa de los electrones como despreciable. Sin embargo, los electrones de un átomo son los responsables de la mayoría de las propiedades atómicas que se reflejan en las propiedades macroscópicas de la materia. El movimiento de los electrones alrededor del núcleo se explica, considerando solamente las interacciones entre el núcleo y los electrones por las fuerzas de atracción y repulsión de sus cargas (la interacción gravitatoria es completamente despreciable). Número atómico y número másico Los diferentes elementos que existen se diferencian entre sí por el número de protones que tengan en su núcleo. A la cantidad de protones que tenga un átomo en su núcleo se la conoce como el número atómico del elemento y se identifica con la letra Z, por ejemplo si el cobre (Cu) tiene 29 protones su Z = 29, si el zinc (Zn) tiene 30 protones su Z =30. Como los átomos no tienen carga Z será, también, igual al número de electrones. Z = número de protones = número de electrones A la suma de protones y neutrones, es decir, el número total de partículas del núcleo, se la conoce como el número másico o número de masa y se la identifica con la letra A. A = número de protones + número de neutrones El número de neutrones, N, será igual al número másico menos el número atómico: N=Z–A Con estos dos números se puede representar la estructura del átomo: se escribe, a la izquierda de su símbolo, el número de masa como superíndice y el número atómico como subíndice. A X (representa el símbolo de un elemento) Z Ej: 23 Na 11 Isótopos Si bien todos los átomos de un mismo elemento presentan el mismo número de protones no siempre presentan el mismo número de neutrones, por ejemplo el cloro lo podemos encontrar formado por 35 neutrones en su núcleo o por 37 neutrones. Se denomina isótopos a los átomos del mismo elemento (con igual Z) pero con distinto número de neutrones, es decir que estos átomos diferirán entre sí por su masa atómica ya que poseen distinto número de neutrones. Los isótopos las mismas propiedades químicas porque presentan el mismo número de protones y electrones. Ej: el hidrógeno (H) puede presentar su núcleo con un protón solamente y sin neutrones, denominándoselo protio (es el H ordinario); también se lo puede encontrar constituido por un protón y un neutrón, denominándoselo deuterio, o tener en su núcleo un protón y dos neutrones denominándoselo tritio. 1 H 1 Protio 2 H 1 Deuterio 3 H 1 Tritio Iones En determinadas circunstancias un átomo o un grupo de átomos puede perder o ganar electrones, transformándose en un ion. Un ion es una especie química con carga eléctrica neta. Existen dos tipos de iones: - Catión: cuando un átomo pierde uno o más electrones se transforma en un ion positivo o con carga eléctrica positiva llamado catión. - Anión: cuando un átomo gana uno o más electrones se transforma en un ion negativo o con carga eléctrica negativa llamado anión.