Ejercicios Tema 7-I - IES Medina Albaida
Anuncio
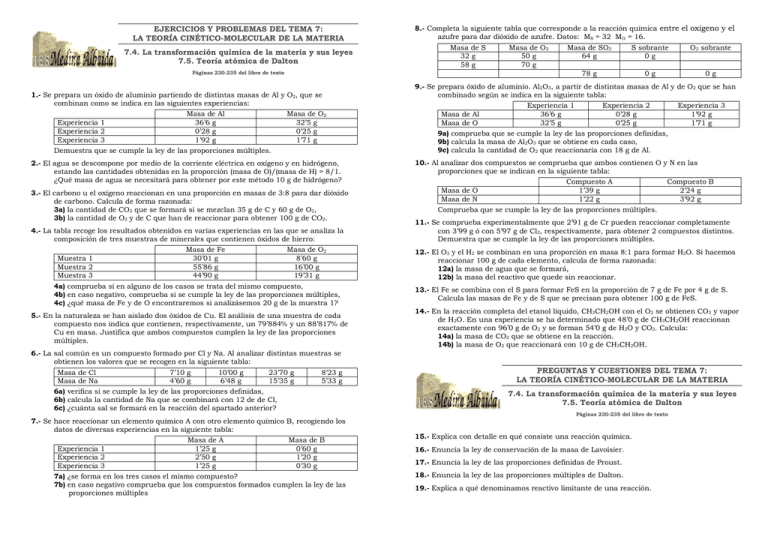
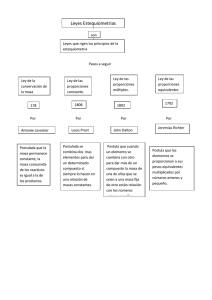
EJERCICIOS Y PROBLEMAS DEL TEMA 7: LA TEORÍA CINÉTICO-MOLECULAR DE LA MATERIA 7.4. La transformación química de la materia y sus leyes 7.5. Teoría atómica de Dalton Páginas 230-235 del libro de texto 1.- Se prepara un óxido de aluminio partiendo de distintas masas de Al y O2, que se combinan como se indica en las siguientes experiencias: Masa de Al Masa de O2 Experiencia 1 36’6 g 32’5 g Experiencia 2 0’28 g 0’25 g Experiencia 3 1’92 g 1’71 g Demuestra que se cumple la ley de las proporciones múltiples. 2.- El agua se descompone por medio de la corriente eléctrica en oxígeno y en hidrógeno, estando las cantidades obtenidas en la proporción (masa de O)/(masa de H) = 8/1. ¿Qué masa de agua se necesitará para obtener por este método 10 g de hidrógeno? 3.- El carbono u el oxígeno reaccionan en una proporción en masas de 3:8 para dar dióxido de carbono. Calcula de forma razonada: 3a) la cantidad de CO2 que se formará si se mezclan 35 g de C y 60 g de O2, 3b) la cantidad de O2 y de C que han de reaccionar para obtener 100 g de CO2. 4.- La tabla recoge los resultados obtenidos en varias experiencias en las que se analiza la composición de tres muestras de minerales que contienen óxidos de hierro: Masa de Fe Masa de O2 Muestra 1 30’01 g 8’60 g Muestra 2 55’86 g 16’00 g Muestra 3 44’90 g 19’31 g 4a) comprueba si en alguno de los casos se trata del mismo compuesto, 4b) en caso negativo, comprueba si se cumple la ley de las proporciones múltiples, 4c) ¿qué masa de Fe y de O encontraremos si analizásemos 20 g de la muestra 1? 5.- En la naturaleza se han aislado dos óxidos de Cu. El análisis de una muestra de cada compuesto nos indica que contienen, respectivamente, un 79’884% y un 88’817% de Cu en masa. Justifica que ambos compuestos cumplen la ley de las proporciones múltiples. 6.- La sal común es un compuesto formado por Cl y Na. Al analizar distintas muestras se obtienen los valores que se recogen en la siguiente tabla: Masa de Cl 7’10 g 10’00 g 23’70 g 8’23 g Masa de Na 4’60 g 6’48 g 15’35 g 5’33 g 6a) verifica si se cumple la ley de las proporciones definidas, 6b) calcula la cantidad de Na que se combinará con 12 de de Cl, 6c) ¿cuánta sal se formará en la reacción del apartado anterior? 8.- Completa la siguiente tabla que corresponde a la reacción química entre el oxígeno y el azufre para dar dióxido de azufre. Datos: MS = 32 MO = 16. Masa de SO2 S sobrante O2 sobrante Masa de S Masa de O2 32 g 50 g 64 g 0g 58 g 70 g 78 g 0g 0g 9.- Se prepara óxido de aluminio. Al2O3, a partir de distintas masas de Al y de O2 que se han combinado según se indica en la siguiente tabla: Experiencia 1 Experiencia 2 Experiencia 3 Masa de Al 36’6 g 0’28 g 1’92 g Masa de O 32’5 g 0’25 g 1’71 g 9a) comprueba que se cumple la ley de las proporciones definidas, 9b) calcula la masa de Al2O3 que se obtiene en cada caso, 9c) calcula la cantidad de O2 que reaccionaría con 18 g de Al. 10.- Al analizar dos compuestos se comprueba que ambos contienen O y N en las proporciones que se indican en la siguiente tabla: Compuesto A Compuesto B Masa de O 1’39 g 2’24 g Masa de N 1’22 g 3’92 g Comprueba que se cumple la ley de las proporciones múltiples. 11.- Se comprueba experimentalmente que 2’91 g de Cr pueden reaccionar completamente con 3’99 g ó con 5’97 g de Cl2, respectivamente, para obtener 2 compuestos distintos. Demuestra que se cumple la ley de las proporciones múltiples. 12.- El O2 y el H2 se combinan en una proporción en masa 8:1 para formar H2O. Si hacemos reaccionar 100 g de cada elemento, calcula de forma razonada: 12a) la masa de agua que se formará, 12b) la masa del reactivo que quede sin reaccionar. 13.- El Fe se combina con el S para formar FeS en la proporción de 7 g de Fe por 4 g de S. Calcula las masas de Fe y de S que se precisan para obtener 100 g de FeS. 14.- En la reacción completa del etanol líquido, CH3CH2OH con el O2 se obtienen CO2 y vapor de H2O. En una experiencia se ha determinado que 48’0 g de CH3CH2OH reaccionan exactamente con 96’0 g de O2 y se forman 54’0 g de H2O y CO2. Calcula: 14a) la masa de CO2 que se obtiene en la reacción. 14b) la masa de O2 que reaccionará con 10 g de CH3CH2OH. PREGUNTAS Y CUESTIONES DEL TEMA 7: LA TEORÍA CINÉTICO-MOLECULAR DE LA MATERIA 7.4. La transformación química de la materia y sus leyes 7.5. Teoría atómica de Dalton Páginas 230-235 del libro de texto 7.- Se hace reaccionar un elemento químico A con otro elemento químico B, recogiendo los datos de diversas experiencias en la siguiente tabla: Masa de A Masa de B Experiencia 1 1’25 g 0’60 g Experiencia 2 2’50 g 1’20 g Experiencia 3 1’25 g 0’30 g 7a) ¿se forma en los tres casos el mismo compuesto? 7b) en caso negativo comprueba que los compuestos formados cumplen la ley de las proporciones múltiples 15.- Explica con detalle en qué consiste una reacción química. 16.- Enuncia la ley de conservación de la masa de Lavoisier. 17.- Enuncia la ley de las proporciones definidas de Proust. 18.- Enuncia la ley de las proporciones múltiples de Dalton. 19.- Explica a qué denominamos reactivo limitante de una reacción.