15 • Hemoglobinúria Paroxística Noturna Diagnóstico e Tratamento
Anuncio

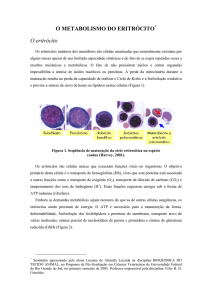
Hemoglobinúria Paroxística Noturna Diagnóstico e Tratamento » Dra. Nydia Strachman Bacal » Hematologista e Patologista Clínica » MBA em Economia e Gestão na Saúde Dra. Nydia Strachman Bacal Hematologista e Patologista Clínica Hemoglobinúria Paroxística Noturna Diagnóstico por Citometria de Fluxo • • • • • Doença HPN HAM x Citometria de Fluxo Antígenos envolvidos Tamanhos de clones HPN na HPN Clones HPN em falência medular (Anemia Aplástica) Clones HPN em Desordens medulares: MDS (Anemia Refratária), Mielopatias (Mielofibrose/ LMC) • Experiência do HIAE e Conclusão A Doença: Hemoglobinúria Paroxística Noturna • Expansão clonal adquirida, não maligna de células-tronco hematopoéticas • Hemoglobinúria noturna, icterícia, hemosiderinúria • Mutação somática adquirida do gene PIG-A • Defeito na síntese da âncora (GPI) com perda de proteínas de superfície • Para diagnóstico os antígenos mais estudados são: CD55 e CD59 , ambas proteínas inibidoras do complemento e, associadas à patogênese da doença clínica. A Doença: Hemoglobinúria Paroxística Noturna • • • • • • • • • Anemia Hemolítica / Trombose e Pancitopenia Prevalência: < 1/100.000 (rara) Sobrevida: 10 a 15 anos Morte: trombose ou citopenias progressivas raramente transformação leucêmica (<5%) Muitos pacientes apresentam hemólise intermitente e alguns evoluem para remissão espontânea. Hemólise intravascular crônica com exacerbações. Necessidade transfusional e muitas vezes, deficiência de ferro. A trombose apresenta predileção pelas veias hepáticas (S.Budd Chiari). Pacientes com AA e evidencias laboratoriais de HPN tem menor probabilidade de trombose. Quadro laboratorial • Sangue Periférico – Anemia, Reticulocitose – Leucopenia e granulocitopenia – Deficiência de ferro • Medula óssea – hiperplasia eritróide – aplasia • Urina – Hemoglobinúria – Hemossiderinúria Teste de HAM GV com HPN são susceptíveis à lise com complemento 37°C / HCL / pH Medida colorimétrica da Hb livre HPN: lise de 5% a 80% dos G.V. Scottish Charles - 1794 (cirurgião) Strübing Paul - 1882 (urina escura matutina, hemólise intravascular, trombose. Defeito no G.V.) Marchiafava, 1911 / Michelli, 1931 (anemia hemolítica com esplenomegalia e hemoglobinúria e hemosiderinúria) Ham TH, Dingle JH. Studies on the destruction of red blood cells II. Chronic haemolytic anaemia with paroxysmal nocturnal haemoglobinuria. Certain immunological aspects of the haemolytic mechanism with special reference to serum complement. J Clin Invest 1939;18:657–72. Teste de HAM • Não existe Falso (-) • Existe Falso (+) Diseritropoese congênita tipo II , mas não se o soro do paciente for utilizado ou se os globulos vermelhos do paciente já foram lisados com anticorpo à frio. Portanto o Teste de Coombs deve ser realizado em paralelo e se (+) invalida o teste de Ham. AHAI > HPN Âncora Glicosil Fosfatidil Inositol GPI NH2 âncora através da qual um peptídeo se fixa à superfície das células âncora GPI C-terminal proteína ancorada etanolamina glican fosfato glucosamina inositol membrana celular 1,2 diacilglicerol 1980. Low et cols. Âncora Glicosil Fosfatidil Inositol Normal camada bilipídica HPN A deficiência da âncora GPI resulta na perda de várias proteínas da superfície da célula. Mutação de gene PIG-A defeito na acetilglucosa minil transferase Proteínas que se ligam a membrana celular através da âncora GPI Enzimas Acetilcolinesterase Fosfatase Alcalina Leucocitária ADP-ribosil transferase Moléculas de adesão Antígeno associado a função linfocitária - LFA-3 ou CD58 CD66b Proteínas de superfície reguladoras de complemento Decay accelerating factor - DAF - ou CD55 Homologous Restriction Factor HRF Membrance inhibitor of reactive lysis MIRL ou CD59 Proteínas que se ligam a membrana celular através da âncora GPI Receptores Fc-γ Receptor III (Fc γ Rlll or CD16) Antígeno de diferenciação monocitária (CD14) Antígenos eritrocitários Yt antigens (AchE) Holley Gregory antigen Antígenos neutrofílicos NB1/NB2 Outras proteínas de superfície de função desconhecida CAMPATH-1 antigen (CDw52) CD24 GP500 CD55 - DAF Decay Accelerating Factor Participa do controle da ativação do Complemento na superfície da célula Reduz a ação do complexo C4bC2a impedindo a ativação de C3 Sua deficiência isoladamente não justifica o quadro clínico CD59- MIRL Membrane Inhibitor of Reactive Lysis Inibe a formação de C9 cujo complexo resulta na lise da célula Inibe a interação com C8 e C9 Sua inibição resulta em hemólise Sua reintrodução restaura a resistência ao Complemento CD14 - Receptor da proteina que se liga à endotoxina O LPS (lipopolissacaride da parede bacteriana) ligada à uma proteina sérica específica se liga à superfície de monócitos e macrófagos através deste receptor. Este complexo resulta na liberação de citoquinas TNF-α, IL-4 e IL-6. MOLÉCULAS LIGADAS AO GPI NA CÉLULA HEMATOPOÉTICA HUMANA G.V. PMN Monocitos Plts Linfocitos CD 55 (DAF) (+) (+) (+) (+) (+) CD 59 (MIRL) (+) (+) (+) (+) (+) (+) (+) HSC Reguladoras Complemento (+) Moléculas de Adesão CD 48 CD 58 (LFA-3) (+) (+) (+) CD66b e CD66c Enzimas Acetilcolinesterase (+) Fosfatase Alc.Leucocitária (+) CD 157 (+) (+) Receptores CD 14 (+) CD 16 (Fc RIII) (+) CD 87 (u-PAR) (+) (+) - linf B (+) (+) - linf T (+) (+) Outros CD 52 (+) - linf T CD 90 Proteina Prion (+) (+) (+) (+) (+) (+) Hoffbrand A. V.;Catovsky D.; Tuddenham E.G.D. Postgraduate Haematology –2005 5a Ed. Blackwell Publishing Citometria de Fluxo Eritrócitos Granulócitos Monócitos Linfócitos Plaquetas CD55 DAF CD59 MIRL Van der Schoot, 1990 Citometria de Fluxo Modos de Apresentação Detectores FL1 FL2 Foto multiplicadores FSC SSC FL3 Impulsos Elétricos 10 0 10 1 10 2 CD45 FITC -> Injeção da amostra Sistema Hidrodinâmico Digitalização 10 3 10 4 Citometria de Fluxo de células HPN com anti CD59 em eritrócitos Células HPN Tipo II Células HPN Tipo III Tipo I : Normal anti-CD59 Eritrócitos Controle isotipo (b) Células de HPN l e HPN III (c) Discreta população de Células HPN I, HPN II e HPN III (d) Discreta população de Células HPN I e HPN II (transição indistinta) (e) Células HPN III (f) Células HPN II indistintas das Células HPN I e HPN III Hall e Rosse, 1996 CD55 e CD59 em Granulócitos Controle isotipo CD 59 CD 55 CD55 e CD59 em Eritrócitos Controle isotipo CD 59 CD 55 CD14 em Monócitos Atenção ! Controle isotipo Interessante • Pode ocorrer diminuição do percentual de eritrócitos CD55/CD59 negativos devido à hemólise. • Eritrócitos com CD59 positivos apresentam vida média maior do que os eritrócitos com CD 59 negativos. • A severidade da anemia por hemólise e hipoplasia não está correlacionada com o percentual de CD59 positivos Fujioka 1994 Diagnóstico por Citometria de Fluxo Gold Standart Praticidade Permite trabalhar com leucócitos (meia vida normal) Eritrócitos: interferentes na avaliação do clone meia-vida diminuída transfusões Detecção de pequenos clones Células HPN na HPN Expressão variável de antígenos ligados através do GPI em 3 linhagens celulares Sharon 1996 Interessante Pacientes com menos de 20% de células anormais raramente apresentam hemoglobinúria mas podem ter hemólise e hemossiderinúria. Qualquer ponto de corte é arbitrário, mas <5% de glóbulos vermelhos tipo HPN não se observa anemia hemolítica. Clone de células HPN III maior que 60%, apresentam hemoglobinúria, mas às vezes, isto não ocorre por razões desconhecidas Indicação de Pesquisa de células HPN Pancitopenias sem causa definida,principalmente se apresentar reticulocitose Tromboses de repetição sem causa definida Hemólise intravascular sem causa definida Clone de células HPN em síndromes de falência medular Anemia Aplastica HPN Mielodisplasia 11/29 pacientes com Anemia Aplástica (38%) com presença de células HPN. Schubert J, 1994 Aumento de células HPN em 21 dos 119 pacientes com Anemia Refratária (17,6%) AR HPN (+) AR HPN (-) P Anormalidades cariotípicas (%) 1 / 21 (4.8) 21 / 64 (32.8) .01 Contagem de plaquetas (x 103/µL) 31 (4-121) 91 (9-126) .01 Resposta terapêutica a ciclosporina (%) 7 / 9 (77.8) 0 / 8 (0) .002 0 / 21 (0) 4 / 65 (6.2) .57 Progressão para SMD avançada ou LMA (%) Pesquisar células HPN em todos os pacientes com falência de medula óssea antes do tratamento, para auxílio na escolha terapêutica. Wang H, 2002 Blood Clone de células HPN em sindromes de falência medular • Relação entre HPN e AAA • Paciente menos hemolítico e mais pancitopenico pode evoluir para AA • AAA-Doença auto imune orgão específica mediada por linfócitos T citotóxico ativado (CD8) que inibe HSC • HPN-Expansão de clone de célula T anormal • Tratamento de imunosupressão melhora AAA e HPN • HPN é uma forma de AAA, HPN dano auto imune ao stem cell e mutação somática do gene PIG-A • Mutação do PIG-A pode ser demonstrada em população normal em 10/1.000.000 Pesquisa de HPN • Exames realizados desde 19/01/2004; • Até 29/03/2007: 107 solicitações; • 5 casos positivos (4,7%). • • • • • • Técnica CD 55 – PE / CD59 – FITC (Immunotech) CD 14 (clone My4) – PE (Coulter) CD 64 – FITC (Immunotech) CD13 – PE (B.D.) Glicoforina A (CD235) – PE (Dako) Cytometry (Communications in Clinical Cytometry) 42: 223-233 42: 234-238 – Aug 15, 2000 Pratical Haematology – Dacie JV., Lewis SM Controle de Qualidade • Proficiência através dos interlaboratoriais • CAP - desde Abril/2006; média de 51 laboratórios participantes. CD55/CD59 • UKNEQAS - desde Novembro/2004; média de 65 laboratórios participantes CD55/CD59/CD14 CD16 / CD24 / CD66b LEFS, 56 anos – 08/03/2006 - Hemácias Ausência de expressão antigênica do CD55 em 46,5% Ausência de expressão antigênica do CD59 em 34,9% das células identificadas por Glicoforina A LEFS, 56 anos – 08/03/2006 - Neutrófilos Controle normal: CD55(+) = 99,8% Ausência de expressão antigênica do CD55 em 97,7% dos neutrófilos. LEFS, 56 anos – 08/03/2006 - Neutrófilos Controle normal: CD59 (+) = 100,0% Ausência de expressão antigênica de CD59 em 82,7% das células identificadas pelo CD13. LEFS, 56 anos – 08/03/2006 - Monócitos Controle normal: CD14(+) = 99,8% Ausência de expressão do CD14 em 98,3% das células CD 64 (+) RTS, 16 anos – 16/05/2006 Hemácias -não realizado, pois recebeu transfusão. Neutrófilos: Controle normal: CD55(+) = 99,0% Ausência de expressão de CD55 em 5,7% dos neutrófilos RTS, 16 anos – 16/05/2006 - Neutrófilos Controle normal: CD59(+) = 99,3% Ausência de expressão do CD59 em 6,1% das células CD13 (+). RTS, 16 anos – 16/05/2006 – Monócitos Controle normal: CD14(+) = 99,0% Ausência de expressão do CD14 em 14,3% das células CD64+. HPN – Acompanhamento e Terapêutica • Tratamento de suporte: Ácido fólico, ferro suplementar se necessário Transfusão Corticóide – controverso profilaxia com anticoagulante em caso de trombose terapia trombolítica (tPA) • Transplante e terapia imunosupressora - ATG e ciclosporina • Eculizumab – inibe a ativação do complemento (C5) reduz hemólise intravascular, diminui hemoglobinuria e diminui a necessidade de transfusão Raiola AM, Van Lint MT, Lamparelli T. Haematologica 85 (1): 59-62 -2000. Hillmen P., Hall C., Marsh JC. New England Journal of Medicine 350: 552-9 2004 Conclusões O estudo de proteínas dependentes de GPI pela técnica de citometria de fluxo é o método de escolha para o diagnóstico de HPN devido à maior sensibilidade. As proteínas mais estudadas são o CD55 e CD59 em granulócitos e eritrócitos e CD14 em monócitos. A CMF permite a detecção de quantidades pequenas de células com deficiência parcial ou total das proteínas dependentes de GPI, Mesmo após crises hemolíticas severas, pode-se analisar a ausência de expressão na população de leucócitos. • EQUIPE • • Ana Claudia M. Brito João Carlos C Guerra • Nydia Strachman Bacal • Alexandra M.Cavalcante • Ruth Hissae Kanayama • Sonia Tsukasa Nozawa • Obrigada ! • [email protected] • [email protected] Gene PIG-A Localizado no braço curto do cromossomo X Xp22 Miyata, 1993 Science