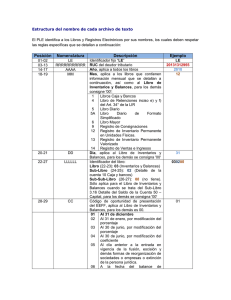
Modulo ii: balances de materia y energia
Anuncio

Módulo II: Balances de Materia y Energía Curso de Capacitación sobre Evaluación Ambiental y Gestión de Riesgos Ambientales Presenta: Ing. Leonel Hernández Depto. de Ciencias Energéticas y Fluídicas Universidad Centroamericana José Simeón Cañas Unidad 1 ¾ Importancia y ubicación de los balances de materia y energía. Introducción ¾ Importancia de los balances de materia y energía para la evaluación de impacto ambiental. ¾ Tipos de procesos y se representación ¾ Variables de proceso ¾ Sistemas de unidades. ¾ Introducción Este módulo está orientado a exponer las bases de los balances de materia y energía y su utilidad para el análisis de los procesos naturales e industriales que suelen presentarse en los estudios de impacto ambiental. No se trata de cubrir las técnicas de resolución de problemas que suelen abordarse en un curso formal de este tema, sino de identificar los aspectos clave en los que se basan dichos balances. Importancia de los balances de materia y energía La materia y la energía se encuentran en constante estado de flujo en la naturaleza, y lo que la humanidad ha hecho es aprovechar esta tendencia para obtener bienestar, alimentos, fuentes energéticas y otras cosas. Normalmente se asocia este tema con los cálculos realizados principalmente por los ingenieros químicos, pero alguna noción de ellos deben tener también todas las ramas de la ingeniería, así como las disciplinas químicas y biológicas. Los balances de materia y energía son la herramienta con la que se analiza la situación de estabilidad de un proceso, y para determinar la manera cómo se distribuyen los componentes en los sistemas o entre sistemas en contacto directo. También son de utilidad para cuantificar la energía transferida o consumida por los sistemas, el cómo esta transferencia afecta las propiedades de los sistema y la cantidad de energía útil que se puede obtener de las transformaciones. Importancia de los balances de materia y energía Una de las aplicaciones más notables de los balances de materia y energía se encuentra en la metodología conocida como Análisis de Ciclo de Vida (ACV), usada para evaluar la sostenibilidad de procesos productivos y de los impactos medioambientales, con el fin de optimizar los recursos y producir mejoras ambientales aplicables a sistemas productivos. Este último enfoque requiere una extensa recopilación de información acerca de la transformación de los materiales, y de la energía consumida (o producida) durante las distintas etapas de la producción de un bien ya sea a través de un proceso industrial o de uno que incluya una fase agraria y de manejo de recursos naturales. Algunas definiciones para recordar Sistema: se refiere a la porción del universo en el cual se centra nuestro estudio. Puede comprender una cantidad fija de masa, o un espacio o volumen determinado, o incluso una determinada extensión de territorio. Sistema y sus interacciones Tipos de Fronteras ¿Cómo definir las fronteras? La frontera de un sistema se escoge por conveniencia de acuerdo a: 1- lo que se sabe de un posible sistema, particularmente en sus fronteras; y 2- el objetivo del análisis Sistema cerrado Cuando no hay flujo de material a través de las fronteras del sistema, se habla de un sistema cerrado. Muchos análisis se pueden realizar usando este modelo. Un caso especial es cuando no hay ningún tipo de interacción con los alrededores. Entonces se habla de un sistema aislado. Volumen de control En muchas situaciones es más conveniente estudiar el material contenido en una región del espacio, y que está fluyendo a través de ella. En este caso se utiliza el volumen de control. Este modelo no reemplaza al concepto de sistema, sino que lo amplía al considerar aquellos casos que involucran velocidades y fuerzas aplicadas. Volumen de control Muchos procesos de flujo estable se estudian mejor utilizando el enfoque del volumen de control. Cuando se centra la atención en una región, es más conveniente el uso de este enfoque, ya que se consideran únicamente las interacciones en las fronteras, y no se toma en cuenta lo que suceda dentro. Estado y equilibrio El estado de un sistema se refiere a la asignación de valores en las propiedades del mismo. Cuando un sistema está en equilibrio no existen potenciales desbalanceados dentro del sistema. Un sistema en equilibrio no experimenta cambios cuando se le aísla de los alrededores. Tipos de equilibrios de interés Equilibrio térmico (la T es la misma) Equilibrio mecánico (la suma de las fuerzas actuando es cero) Equilibrio material. Si hay más de una fase, la masa de ellas no varía. Si es un sistema con reacción química, la composición de la mezcla no cambia. Procesos y ciclos Cualquier cambio que un sistema experimenta desde un estado de equilibrio a otro se conoce como proceso. La serie de estados por los que pasa el sistema durante el proceso se conoce como trayectoria. Un proceso cuyo estado inicial y final son idénticos se conoce como un ciclo. Tipos de procesos Nos interesan tres tipos de procesos: Procesos de cambio físico. Procesos de cambio químico. Procesos donde hay cambios tanto físicos como químicos. En los procesos de cambio físico las sustancias no cambian en su naturaleza química, pero sí pueden cambiar de estado de agregación. Los procesos de mezclado, separación, de cambio de fase, etc., caen dentro de esta categoría. Los procesos con cambio químico afectan la naturaleza de las sustancias, convirtiéndolas en otras con distintas propiedades. Las reacciones químicas son las que representan este tipo. Variables del proceso. Este término se refiere a las propiedades que describen el estado de los sistemas. Las propiedades son objeto de medición o de estimación. Las más utilizadas son: temperatura, presión, densidad, volumen, contenido de energía, velocidad. Dimensiones y unidades Se le llama dimensión a una característica sujeta a medición o estimación. Las más usadas son: longitud, masa, tiempo, temperatura. Una unidad es la cuantificación de una dimensión, ya sea de manera individual o combinada. Así, hay unidades de longitud, de masa, de tiempo y de temperatura, pero también las hay de otras propiedades como la velocidad, la energía, el potencial eléctrico, etc., que se forman por combinación de las dimensiones básicas a través de una relación funcional. Por ejemplo, la fuerza. Sistemas de unidades. Son las unidades las que se agrupan en conjuntos o sistemas. El más usado es el Sistema Internacional (SI), cuyas unidades son: Masa: kilogramo (kg) Longitud: metro (m) Tiempo: segundo (s) Temperatura: kelvin (K) Fuerza: newton (N) Energía: joule (J y kJ) Potencia: watt (W) Cantidad de sustancia: moles (n) Sistema inglés Masa: libra-masa (lbm) Fuerza: libra-fuerza (lbf) Tiempo: segundo (s) Longitud: pie (ft) Energía: lbf-pie Potencia: lbf-pie/s Temperatura: ° rankine (°R) Cantidad de sustancia: moles-libra (mol-lb) Unidad 2 ¾ Balances de masa. Principio de conservación de la masa y ecuación general del balance de masa. ¾ Balances totales y por componente. ¾ Balances de masa sin reacción química. ¾ Balances de masa con reacción química. ¾ Principio de conservación de la masa. Los balances de masa se fundamentan en el principio de conservación de la masa: la masa no se crea ni se destruye. Premisa que para nuestros fines es más que suficiente, pero no absoluta. Lo anterior se basa en la observación que para sistemas cerrados y abiertos, la distribución de los materiales puede cambiar entre un instante inicial y uno final, debido a cambios físicos o químicos, pero la cantidad total, medida en unidades de masa, se mantiene antes y después de un proceso. Ecuación general del balance de masa en procesos físicos. ⎛ Cambio en la ⎞ ⎜ ⎟ ⎛ Masa total ⎞ ⎛ Masa total ⎞ ⎟⎟ − ⎜⎜ ⎟⎟ ⎜ cantidad de masa ⎟ = ⎜⎜ ⎜ del sistema. ⎟ ⎝ que entra ⎠ ⎝ que sale ⎠ ⎝ ⎠ La expresión anterior se puede escribir en términos totales, o en forma de rapidez. En los procesos en los que la cantidad de masa del sistema está cambiando interesa a veces saber con qué rapidez lo hace, en ese sentido, la masa que entra y que sale se expresa en forma de flujo másico (kg/s, kg/h, kg/día, ton/día, ton/año, etc). Dentro del caso anterior pueden entrar las situaciones de llenado y vaciado de tanques o estanques. La expresión como la descrita antes se conoce como un balance total de masa, pues sólo se fija en la cantidad total de materiales, sin hacer distinción de las clases de sustancias contenidas en el sistema. También, es aplicable tanto si las sustancias son líquidas o gaseosas. En este último caso, lo que puede cambiar son otro tipo de propiedades como la velocidad o la densidad, pero ellas deben hacerlo sujetas a la restricción de la expresión general. Si dentro del sistema ocurre un cambio de fase, un mezclado, o una separación de sustancias, se pueden plantear también balances por componente, en los cuales se describe la manera cómo se distribuyen las sustancias en las distintas corrientes de entrada y salida. Un ejemplo sería un equipo de aire acondicionado, en el cual entra aire ambiente húmedo y debido al enfriamiento el agua se condensa y se separa del aire, saliendo por un lado aire frío más seco y agua condensado por el otro lado. Para este tipo de balances se requiere más información dada a través de la composición de las corrientes. La composición se refiere a la cantidad de sustancia presente en una mezcla de sustancias. Esta suele expresarse de varias maneras: en fracción de la masa, en fracción molar, y en los casos cuando las cantidades presentes son muy pequeñas, se suele usar medidas como las ppm. Ecuación general del balance de masa en procesos químicos. ⎞ ⎛ Cambio en la ⎟ ⎛ Moles totales ⎞ ⎛ Moles totales ⎞ ⎜ ⎟⎟ − ⎜⎜ ⎟⎟ + ⎜ cantidad de moles ⎟ = ⎜⎜ ⎠ ⎟ ⎝ que entran ⎠ ⎝ que salen ⎜ del sistema. ⎠ ⎝ ⎛ Moles totales ⎞ ⎛ Moles totales ⎞ ⎟⎟ − ⎜⎜ ⎟⎟ ⎜⎜ ⎝ generados ⎠ ⎝ consumidos ⎠ Mol: es la cantidad de sustancia que contiene 6.023 x 1023 unidades de dicha sustancia. El número descrito se conoce como Número de Avogadro. Así, un mol de agua contiene 6.023 x 1023 moléculas de agua y en conjunto tienen una masa de 18 gramos. Lo mismo se puede aplicar a cualquier sustancia. A diferencia del balance de masa sin reacción química, para este caso hay que considerar que aparecerán nuevas especies generadas por la reacción química y consumidas por ella. De allí que aparezcan términos de generación y consumo. Como es de esperarse, la composición de la mezcla cambiará a medida que la reacción avance, y al final puede ser que sólo haya sustancias generadas, o que queden todavía reactivos sin consumir. Esto se cuantifica a través de la conversión de la reacción. En los procesos industriales se busca obtener el máximo de conversión pues normalmente el producto es el que tiene mayor valor económico. En los procesos de tratamiento de efluentes, se busca también la mayor conversión de los materiales en sustancias más inocuas o que sean de más fácil transporte y disposición. Otro aspecto durante los procesos con reacción química es que las sustancias generadas pueden estar en diferente estado de agregación que las que entraron. Durante la reacción pueden generarse gases o líquidos para una entrada de material sólido, o pueden generarse sólidos a partir de una corriente de entrada que sólo tenga sustancias disueltas. Para los procesos industriales, estos flujos de materiales son separados del sitio donde ocurre la reacción (llámese reactor, quemador, tanque de tratamiento, etc) y deben ser procesados de acuerdo a su naturaleza y propiedades. En los procesos naturales también pueden haber separaciones de sustancias de distinto estado de agregación. Cuando ocurre una reacción química, la información a recopilar es mayor, pues además de la composición de las corrientes de entrada, se debe conocer con suficiente confiabilidad la composición de las corrientes de salida. Esto es importante para el control de la reacción y tener seguridad que el grado de conversión alcanzado es el que se espera. Acá, el balance de masa se suele hacer sobre las especies químicas presentes o en base a la masa o moles de los elementos químicos que forman las distintas corrientes. Así, es usual escuchar términos como balance de carbono, balance de oxígeno, balance de nitrógeno, etc. Unidad 3. Balances de Energía La primera ley de la termodinámica ¾ Enfoques para resolver balances de energía. ¾ Balances sin reacción química. ¾ Balances con reacción química. ¾ Primera ley de la termodinámica. La PLT es una principio natural y sus enunciados están basados en la experiencia cotidiana. Su aplicación práctica está orientada a la utilización más eficiente de la energía, a la evaluación de fuentes energéticas, y a contabilizar cuánta de ella se usa en los procesos de producción. Su enunciado más conocido es que la energía no se crea ni se destruye, sólo se transforma. Entendemos por energía a la capacidad de los sistemas para realizar cambios. Energía es un concepto del que todos tenemos alguna noción. Una idea básica es que la energía puede estar almacenada dentro de los sistemas en varias formas. La energía puede también ser convertida de una forma en otra, y transferida entre sistemas. Para sistemas cerrados, la energía puede ser transferida en forma de trabajo y calor. Formas de la energía Térmica Mecánica Cinética Potencial Eléctrica Magnética Química Nuclear Formas de la energía Energía interna :U 1 2 Energía cinética: EK = mv ; 2 Energía potencial: EP = mgz; v2 eK = 2 eP = gz Energía total : 1 2 U + EK + EP = U + mv + mgz 2 v2 Energía total específica: u + + gz 2 Sistemas de flujo Los volúmenes de control involucran flujos de fluidos por períodos prolongados de tiempo, y se hace más conveniente expresar el flujo de energía en forma de razones. m& = ρV& = ρv prom A flujo de energía: E& = m& e (kJ/s = kW) La transferencia de energía Las formas de energía mencionadas anteriormente están contenidas en el sistema, y de alguna forma pueden considerarse como formas estáticas de la energía. Las formas dinámicas de la energía constituyen las formas de transferencia de la misma, y se conocen como interacciones energéticas. En el lenguaje cotidiano, nos referimos a veces a las formas sensibles y latentes de la energía como calor, pero en termodinámica es preferible llamarles energía térmica. “Organización” de la energía Las formas más útiles de la energía son aquellas a las que podríamos denominar organizadas. La energía cinética macroscópica de un cuerpo de agua es más organizada que la energía cinética de sus moléculas, y por tanto, es más fácil de convertir en otras formas útiles. Energía mecánica Se le llama así a todas las formas de energía que posee un sistema que puede ser convertida fácilmente en trabajo mecánico de manera completa y directa por medio de algún dispositivo mecánico como una turbina. emecánica 1 2 = + v + gz ρ 2 P ⎞ ⎛P 1 2 e&mecánica = m& emec = m& ⎜⎜ + v + gz ⎟⎟ ⎠ ⎝ρ 2 P2 − P1 v22 − v12 ∆emec = + + g (z 2 − z1 ) ρ 2 ∆E& mec = m& ∆emec ⎛ P2 − P1 v22 − v12 ⎞ = m& ⎜⎜ + + g ( z 2 − z1 )⎟⎟ 2 ⎝ ρ ⎠ Transferencia de energía por calor. La energía puede cruzar la frontera de un sistemas en dos formas: calor y trabajo. El calor es la transferencia de energía entre dos sistemas (o entre un sistema y sus alrededores) debido a una diferencia de temperatura. El calor es energía en transición, y sólo se puede identificar cuando cruza la frontera entre el sistema y los alrededores. Un proceso en el que no hay transferencia de calor se conoce como adiabático. Transferencia de energía por trabajo. Al igual que el calor, el trabajo es una interacción energética con los alrededores. Si la energía que cruza la frontera de un sistema cerrado no es calor, pues sólo podrá ser trabajo. El trabajo es la transferencia de energía asociada con una fuerza actuando a través de cierta distancia. Tiene las mismas unidades del calor por ser energía transfiriéndose: kJ. El trabajo por unidad de masa es w=W/m Ejemplos de trabajo Balance de energía sin reacciones químicas. ⎤ ⎡Cantidad neta de energía Energía transferid a de Cambio en la cantidad ⎤ ⎢ ⎤ ⎡ ⎡ ⎥ transferid a hacia el sistema ⎢de energía contenida en ⎥ ⎢manera neta hacia el sistema ⎥ ⎢ ⎥ ⎥ + ⎢a través de las fronteras en ⎥=⎢ ⎢ ⎥ ⎢el sistema en un interva ‐⎥ ⎢por las corrientes de flujo de ⎥ ⎢ ⎥ ⎥ ⎢forma de transferencia de calor ⎥ ⎥ ⎢ ⎢ ⎦ ⎢en un intervalo de tiempo ⎦ ⎣entrada y salida ⎣lo de tiempo ⎥⎦ ⎣ ⎤ ⎡Cantidad neta de energía ⎥ ⎢transferida desde el sistema ⎥ ⎢ + ⎢a través de las fronteras en forma⎥ ⎥ ⎢ de trabajo en un intervalo de ⎥ ⎢ ⎥⎦ ⎢⎣tiempo. Primera ley de la termodinámica. El cambio neto (incremento o disminución) en la energía total de un sistema durante un proceso es igual a la diferencia entre la energía total que entra y la energía total que sale del sistema durante el proceso. ∆ ∆ sistema K +∆ = P 2 − 1 = − +∆ = entra − sale Mecanismos de transferencia de energía. Transferencia de calor, Q. Transferencia de trabajo, W. Flujo másico, m entrada − salida =( ( =∆ entrada − salida masa ,entrada sistema − )+ ( entrada masa ,salida ) − salida )+ Balance de energía con reacciones químicas. ⎤ ⎤ ⎡Cantidad neta de energía ⎡Cantidad neta de energía Cambio en la cantidad ⎤ ⎢ ⎡ ⎥ ⎥ ⎢transferida desde el sistema ⎢de energía contenida en ⎥ = ⎢transferida hacia el sistema ⎥ ⎥+⎢ ⎥ ⎢a través de las fronteras en ⎢ ⎥ ⎢a través de las fronteras en forma⎥ ⎥⎦ ⎢ ⎢⎣el sistema. ⎥ ⎥ ⎢ ⎦ ⎣forma de transferencia de calor⎦ ⎣de trabajo. ⎤ ⎡Energía liberada en forma ⎡Transferencia neta de energía ⎤ + ⎢⎢neta por las reacciones químicas⎥⎥ + ⎢ ⎥ por las corrientes de flujo ⎣ ⎦ ⎥⎦ ⎢⎣dentro del sistema. Enfoques para resolver balances de energía Acá se utilizan los mismos que para el balance de materia: el enfoque de sistema, y el de volumen de control. El primero se aplica a una masa fija seleccionada como el sistema, y el segundo a una región en el espacio donde la materia transcurre de manera estacionaria o no, y que está limitada por una frontera escogida a conveniencia. Las consideraciones en el caso de haber reacciones químicas tienen que ver con la energía liberada o consumida por las reacciones, las cuales deben contabilizarse en el balance. Unidad 4. Representación de los balances de materia y energía ¡Muchas gracias! Leonel Hernández [email protected]