FARMACOLOGÍA GENERAL
Anuncio

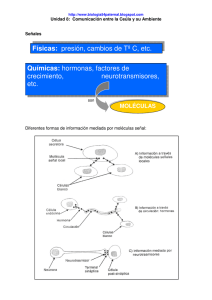
FARMACOLOGÍA GENERAL FARMACODINAMIA TEMA 8 RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G: RAPG o 7TM Código Clase de receptores 10 1.0 C Canales l iónicos ió i y canales l iónicos ió i operados d por ligando li d 2.0 Receptores acoplados a proteínas G 30 3.0 R Receptores t con actividad ti id d enzimática i áti 4.0 Receptores que actúan como factores de transcripción Multitud procesos fisiológicos. Similitud estructural-funcional 50% fármacos actúa a través de RAPG Tiempo de respuesta: Segundos RECEPTORES DE CLASE 2: RECEPTORES ACOPLADOS A PROTEINAS G: RAPG o 7TM Ligando d Receptor Proteína G Sistema efector (enzimático) Segundos mensajeros EFECTOS Contracción Secreción Despolarización/ Hiperpolarización Para ay udarle a proteger su priv acidad, PowerPoint ev itó que esta imagen externa se descargara automáticamente. Para descargar y mostrar esta imagen, haga clic en Opciones en la barra de mensajes y , a continuación, haga clic en Habilitar contenido externo. Estructura de los receptores p Una sola secuencia. Extremo amino en exterior celular. Asparraginas p g y glucosilaciones g confieren selectividad 7 dominios transmembrana. Hélices α unidas p por bucles Bucle 2-3 interacción con proteínas G. Rico en serinas y treoninas,, sensibles a fosforilación ó por proteinquinasas Tipos p de receptores p Familia A: mayoría de GPCRs. Excepción: receptores PAR de trombina A Familia B: Secretina y glucagón. Dominio extracelular grande. Cerebro y tracto gastrointestinal B Familia C: Extremo N-terminal muy grande y dividido en dos = Dominio bilobular. Glutamato, GABAB C Estructura de las Proteínas G Proteínas no integrales. Asociadas a cara interna de la membrana. membrana Formadas por subunidades α, β y γ. Heterotrímeros Subunidad α: Une GTP y GDP Dominio GTPasa Proteína G inactiva: trímero-GDP Proteína G activa: subunidad α separa de β y γ gana alta afinidad por GTP GTP GDP γ β α GDP β INACTIVA Pi RGS γ α GTP ACTIVA Tipos p de proteínas p G Familia Miembros Gs I Golf Sistemas efectores efectores. Funciones Estimulación de Adenilatociclasa (AC) y activación de canales Ca2+ Estimulación de AC en neuronas olfativas Gi Inhibición de AC Go Activación fosfolipasa C-β y canales K+; Inactivación canales Ca2+ Gt Estimulación fosfodiesterasa III Gq Activación fosfolipasa C-β IV G12 Estimulación de Rho II Ciclo Funcional Agonista → cambio conformacional del receptor C bi conformacional Cambio f i l protéina éi G → aumento de d afinidad fi id d de subunidad α por GTP → unión a GTP separa subunidad α de β−γ A ti id d GTPasa Actividad GTP subunidad b id d α GTP a GDP → Trímero Tí GTPasa activada por: 1. 2. Unión a efector Por RGS (Regulator of G-protein signalling). 30 tipos. AMPLIFICACIÓN VÍA ACTIVADA POR RECEPTORES ACOPLADOS A LA PROTEÍNA Gs z Adenilatociclasa (AC) (AC), AMPc AMPc, activación de Proteinquinasa A (PKA); dos tipos de respuestas: hormonal o vía CREB-CRE. z La vía activada por proteínas Gi inhibe AC ATP PKA inactiva AC αs GTP AMPc Núcleo CREB-P PKA respuestas a largo plazo PKA Respuestas a corto plazo CREB enzima enzima-P Transcripción CRE RESPUESTA HORMONAL Síntesis Sí t i de proteínas Vía proteína Gq-fosfolipasa C-ca2+ Fosfolipasa p C-β β ((PLC-β) β) hidroliza PIP2 a IP3 y DAG IP3: vía calmodulina Contracción muscular Secreción hormonal y neurotransmisores Proliferación celular ↑↑ Ca2+ ⇒ Translocación de PKCs a membrana celular DAG activa PKCs Vía proteína Gq-fosfolipasa C-ca2+ Fosfolipasa p C-β β ((PLC-β) β) hidroliza PIP2 a IP3 y DAG DAG IP3: vía calmodulina Contracción muscular Secreción hormonal y neurotransmisores Proliferación celular PIP2 PLC-β α q GTP Sustrato-P Sustrato IP3 Calmodulina ↑↑ ⇒ Translocación d PKCs de PKC a membrana b celular Quinasas dependientes de calcio-calmodulina DAG activa PKCs Ca2+ PKC Sustrato-P Sustrato Retículo endoplásmico Ca2+ Transducción de la señal olfativa. Vía proteína Golf-Adenilatociclasa-AMPc Proteína Golf activa Adenilatociclasa (AC), ↑↑ AMPc, AMP Apertura A de d canales de sodio Despolarización de la membrana celular Transducción de la visión. Vía rodpsina-Proteína rodpsina Proteína Gt-Fosfodiesterasa Gt Fosfodiesterasa Rodopsina p - Cis-ral ⇒ trans ral - Proteína Gt (transducina). Subunidad Gtα activa fosfodiesterasa↓↓ GMPc- Cierre canales Na+ Finalización de la señal Implicadas la arrestinas, bloquean el acoplamiento de las proteínas G al receptor t Desensibilización Internalización I t li ió Reciclaje rápido: clase A Reciclaje lento: clase B Heteróloga Homóloga L P P P PKA PKC L P P P ß-arrestinas PKA PKC GRKs Finalización de la señal L P P P P PP ß-arrestinas Clase A INTERNALIZACIÓN Clase B RECICLADO P P P PP P PP P P P P REGULACIÓN A LA BAJA DEGRADACIÓN Estado actual. RAPG o 7TM Múltiples estados conformacionales. A ti id d constitutiva Actividad tit ti 1. Dimerización o agrupaciones 2. Homóloga 3 3. Heteróloga 4. 5. Síntesis Regulación por ligandos Afinidad por ligandos Afinidad por Proteínas G Internalización 7TM. Señalización independiente de Proteínas G. Proteínas adaptadoras: Arrestinas,, SH3 y PDZ