1,3-Diclorociclohexano
Anuncio
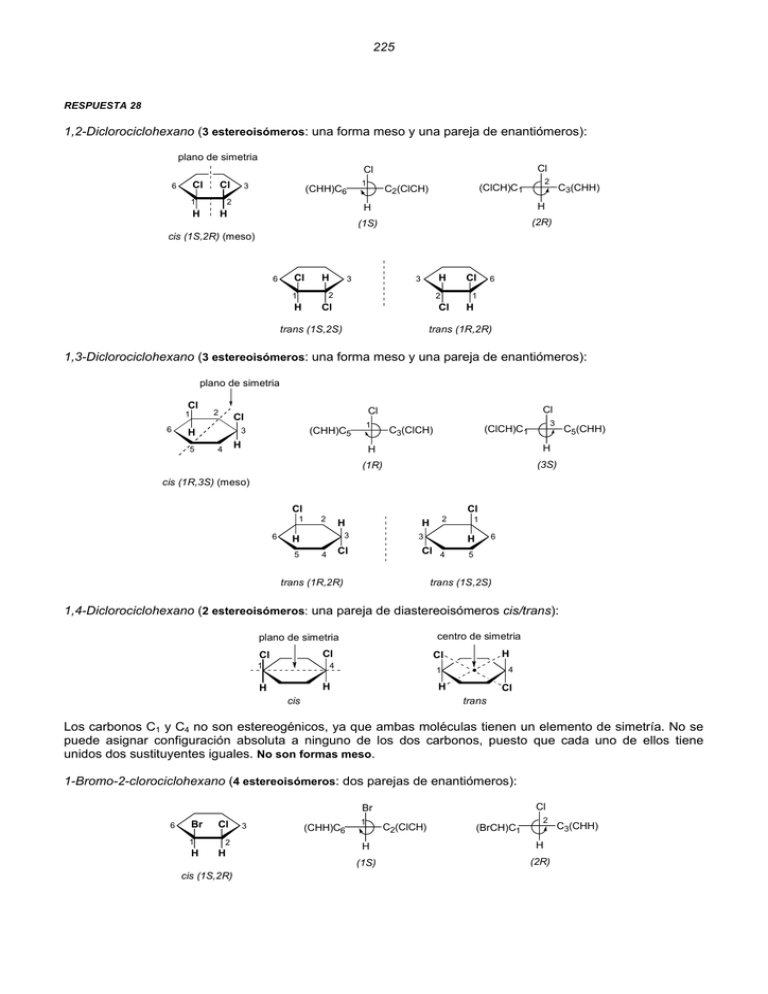
225 RESPUESTA 28 1,2-Diclorociclohexano (3 estereoisómeros: una forma meso y una pareja de enantiómeros): plano de simetria Cl Cl Cl 6 Cl 1 3 1 (CHH)C6 2 H H 2 (ClCH)C1 C2(ClCH) C3(CHH) H H (1S) (2R) cis (1S,2R) (meso) 6 Cl H 3 H 3 2 1 H 2 Cl 6 1 Cl trans (1S,2S) Cl H trans (1R,2R) 1,3-Diclorociclohexano (3 estereoisómeros: una forma meso y una pareja de enantiómeros): plano de simetria Cl 1 6 2 5 1 (CHH)C5 3 H H 4 Cl Cl Cl 3 (ClCH)C1 C3(ClCH) C5(CHH) H H (1R) (3S) cis (1R,3S) (meso) Cl 1 6 Cl 2 H 3 H 5 3 Cl 4 2 H 1 6 H Cl 4 5 trans (1S,2S) trans (1R,2R) 1,4-Diclorociclohexano (2 estereoisómeros: una pareja de diastereoisómeros cis/trans): centro de simetria plano de simetria Cl Cl 1 4 1 H H H Cl 4 H cis Cl trans Los carbonos C1 y C4 no son estereogénicos, ya que ambas moléculas tienen un elemento de simetría. No se puede asignar configuración absoluta a ninguno de los dos carbonos, puesto que cada uno de ellos tiene unidos dos sustituyentes iguales. No son formas meso. 1-Bromo-2-clorociclohexano (4 estereoisómeros: dos parejas de enantiómeros): Cl Br 6 Br 1 H Cl 2 H cis (1S,2R) 3 (CHH)C6 1 C2(ClCH) (BrCH)C1 2 H H (1S) (2R) C3(CHH) 226 Br 6 Cl 1 Cl 3 3 2 2 H Br cis (1S,2R) Br 6 1 H H 6 H 1 H 2 H cis (1R,2S) H 3 3 Br 1 2 Cl Cl trans (1S,2S) 6 H trans (1R,2R) 1-Bromo-3-clorociclohexano (4 estereoisómeros: dos parejas de enantiómeros): Br 6 H 2 Cl Br 5 Cl 1 4 1 (ClCH)C3 3 3 (BrCH)C1 C5(CHH) H H (1S) (3R) H C5(CHH) cis (1S,3R) Br 6 1 H 2 5 Cl 5 4 3 6 Cl 4 Br 1 3 2 H Br 6 H cis (1S,3R) 3 Br 1 2 H Cl Cl cis (1R,3S) 6 H 4 4 3 2 H H 5 5 H 1 trans (1R,3R) trans (1S,3S) 1-Bromo-4-clorociclohexano (2 estereoisómeros: una pareja de diastereoisómeros cis/trans): plano de simetria plano de simetria Br Br Cl 1 4 H H H 1 4 H cis Cl trans Los carbonos C1 y C4 no son estereogénicos, ya que ambas moléculas tienen un elemento de simetría. No se puede asignar configuración absoluta a ninguno de los dos carbonos, puesto que cada uno de ellos tiene unidos dos sustituyentes iguales. No son formas meso. RESPUESTA 29 La molécula no se puede dividir en dos mitades iguales; tiene dos átomos de carbono estereogénicos (C2 y C7 son asimétricos) y presenta isomería cis-trans: 1 5 H 2 Cl n = 3 ; N = 2n = 8 ; N' = 0 H Cl 2,7-Dicloro espiro[4,5]decano Existen 8 estereoisómeros (cuatro parejas de enantiómeros): cis-(2R,7R) / cis-(2S,7S) trans-(2R,7R) / trans-(2S,7S) cis-(2R,7S) / cis-(2S,7R) trans-(2R,7S) / trans-(2S,7R) 227 Cl 9 1 10 2 5 7 H Cl[1] H[2] 1 [2](HHC)C9 [1](ClCH)C7 5 2 4 3 H[4] [2](CCC)C5 3 4 6 Cl H 2 Cl[1] 7 [2](CCC)C5 C4(CHH)[3] Cl[1] (trans) H[4] (2R) (7S) r-2-Cloro-t-7-cloro Cl H 1 2 Cl Cl 10 7 6 4 7 H H (cis) (2R,7R)-r-2-Cloro-c-7-cloro H Cl H 1 10 5 7 6 Cl 6 4 Cl 2 5 5 3 H 1 10 3 4 (cis) (2S,7S)-r-2-Cloro-c-7-cloro Cl H 1 2 2 3 3 10 H 5 7 6 4 Cl (trans) (trans) (2R,7R)-r-2-Cloro-t-7-cloro (2S,7S)-r-2-Cloro-t-7-cloro Cl H 1 2 H H 10 7 7 6 4 Cl Cl (cis) (2R,7S)-r-2-Cloro-c-7-cloro Cl 10 5 7 H 6 Cl H 1 4 6 Cl 2 5 5 3 H 1 10 3 4 (cis) (2S,7R)-r-2-Cloro-c-7-cloro Cl H 2 2 3 3 1 10 Cl 5 4 6 7 H (trans) (trans) (2R,7S)-r-2-Cloro-t-7-cloro (2S,7R)-r-2-Cloro-t-7-cloro C9(CHH)[3] 228 RESPUESTA 30 NH2[3] NH2 H [2]H H2N NH2[1] H H[4] (1) (R) (R)-2,6-Diamino espiro[3.3]heptano HO2C CO2H[3] CO2H 6 [1]HO2C 2 H H[2] H H[4] (2) (S) Ác. (S)-espiro[3.3]Heptano-2,6-dicarboxílico H[4] H H 7 2 Me [2]H Me[1] CH2OH CH2OH[3] (3) (S) (S)-2-Hidroximetil-7-metil espiro[3.5]nonano En la molécula (4) C6 no es estereogénico, pero presenta isomería cis-tras respecto a C1 (en este caso, el estereoisómero es cis) H CO2H CO2H[1] H 2 1 6 4 [3]CH2 CO2H 1 C4[2] H[4] (4) (1R) Ác. cis-(1R)-espiro[3.3]heptano-1,6-dicarboxílico RESPUESTA 31 Me 3 Me[4] C3(C4C1H)[2] 1 [2]C4 (C1HH)(C4C2H)C3 Me 4 2 [4]H C4(C3HH)[3] H (1) C2(C3CH)C3(C4C1H)[1] 1 2 Me[3] C1(C3C4C)[1] (1S) (2S) Una vez conocida la configuración absoluta de un estereoisómero, la de los otros tres es evidente: Me Me 4 2 H Me 3 3 1 Me H 4 2 Me (2) (3) (2R,2R) (1S,2R) 3 1 1 enantiómeros: (1) y (2) ; (3) y (4) H 4 2 Me (4) (1R,2S) 229 RESPUESTA 32 C5(CCH)[1] 8 7 1 9 6 5 H 1 [3]C6 (CHH)(CHH)C9 H 2 4 C2(CHH)C5(CCH)[2] H[4] (1R) 3 C1(CCH)[1] (1) 5 [3]C9 (CHH)(CHH)C6 (1R,5R) C4(CHH)C1(CCH)[2] H[4] (5R) H 1 2 4 3 8 9 7 6 5 H (2) (1S,5S) RESPUESTA 33 Me 7 Me Me 5 OH 1 6 2 4 H 3 H (1S,2S,4S)-2-Hidroxi-1-metil-7-dimetilbiciclo[2.2.1]heptano C7(CCC)[2] [3](CHH)C6 OH[1] C2(OCH)[1] 1 2 [2](CCC)C1 Me[4] H[4] C3(CHH)[3] [3](CHH)(C6HH)C5 C7(CCC)[1] H[4] (1S) C3(C2HH)(OCC)[2] 4 (2S) (4S) RESPUESTA 34 OH H[4] H 2 1 H [2]HOCH 1 OH (1) OH[1] [3]CH2 CH2[3] OH[1] 2 H[4] (1R) (2R) OH H 2 1 H OH (1) trans-(1R,2R)-1,2-Ciclopropanodiol CHOH[2] 230 H H[4] OH [3]CH2 2 1 OH OH[1] H 2 [2]HOCH CHOH[2] 1 OH[1] H[4] (1S) (2) CH2[3] (2S) H OH 1 2 OH H (2) trans-(1S,2S)-1,2-Ciclopropanodiol Las moléculas (1) y (2) son enantiómeros. OH OH[1] OH 2 H 1 [2]HOCH 1 H OH[1] [3]CH2 CH2[3] H[4] (3) 2 CHOH[2] H[4] (2R) (1S) MESO OH OH 2 1 H H (3) cis-(1S,2R)-1,2-Ciclopropanodiol OH Et 2 H 1 3 H (4) OH[1] OH H [2]HOCH 1 OH[1] [3]EtCH CHEt[3] H[4] 2 CHOH[2] H[4] (2R) (1S) MESO OH Et 2 H OH 1 3 H H (4) (1S,2R,3r)-r-1-Hidroxi-c-2-hidroxi-c-3-etilciclopropano Et[1] [3] (S)C1 3 H[4] (3r) C2(R)[2] 231 OH Et 2 1 H 3 OH[1] H[4] H [2]HOCH OH [3]EtCH CHEt[3] 1 2 OH no estereogénico H Et 2 H C2(R) H (2R) (1R) (5) (R)C1 H[4] OH[1] H CHOH[2] Et 3 1 3 OH H (5) (1R,2R)-r-1-Hidroxi-t-2-hidroxi-c-3-etilciclopropano H Et 2 1 OH 3 OH[1] OH 1 [2]HOCH H H[4] CHEt[3] [3]EtCH (S )C1 3 (2R) H no estereogénico OH Et 2 OH C2(S) Et OH[1] (1S) (6) CHOH[2] 2 H[4] H Et 1 3 H H (6) (1S,2S)-r-1-Hidroxi-t-2-hidroxi-c-3-etilciclopropano Las moléculas (5) y (6) son enantiómeros. OH H 2 H 1 3 Et (7) H OH[1] OH[1] OH [2]HOCH 1 [3]EtCH CHEt[3] 2 CHOH[2] H[4] H[4] (2R) (1S) MESO OH H 2 H OH 1 3 H Et (7) (1S,2R,3s)-r-1-Hidroxi-c-2-hidroxi-t-3-etilciclopropano H[4] [3] (S)C1 3 Et[1] (3s) C2(R)[2] 232 Me OH 1 [3]CH2 H 2 OH[1] OH 3 1 H 2 [2]HOCH CHOH[2] (1R) (8) CHOH[2] [1]HOCH H[4] H[4] H Me[3] OH[1] OH 3 H 2 H CH2CHOH[2] H[4] (3S) (2S) Me 3 OH 1 (8) H (1R,2S,3S)-r-1-Hidroxi-c-2-hidroxi-c-3-etilciclobutano H H H[4] H 3 [3]CH2 Me 2 OH [2]HOCH CHOH[2] 1 1 OH[2] (1S) (9) CHMe[3] 2 OH[1] OH H[4] H[4] H 2 3 CH2CHOH[2] 3 Me[3] (3R) (2R) H [1]HOCH H Me 1 OH OH (9) (1S,2R,3R)-r-1-Hidroxi-c-2-hidroxi-c-3-etilciclobutano Las moléculas (8) y (9) son enantiómeros. OH H 2 3 [3]CH2 H 1 OH OH (10) H[4] H 1 OH[1] H (S)C1 CHOH[2] OH[1] 2 C3(S) OH no estereogénico (1S) OH H 2 3 H H 1 OH OH (10) (1S,3S)-r-1-Hidroxi-c-2,t-3-dihidroxiciclobutano [2]HOCH 3 H[4] (3S) CH2[3] 233 H 3 OH OH[1] OH [3]CH2 OH 2 1 H 1 ( R )C1 CHOH[2] H[4] H 2 C3(R) [2]HOCH 3 H H (3R) OH 3 OH CH2[3] OH[1] no estereogénico (1R) (11) H[4] OH OH 2 1 H H (11) (1R,3R)-r-1-Hidroxi-c-2,t-3-dihidroxiciclobutano Las moléculas (10) y (11) son enantiómeros. Me H[4] H 1 3 H [2]CH2CH2 CH2CHMe[1] 1 Me Me[3] [1]MeCHCH2 Me[3] (CH2)[2] H[4] (1S) (12) 3 (3S) Me H 1 3 H Me (12) trans (1S,3S)-1,3-Dimetilciclopentano Cl[1] Cl 3 H Cl 1 H (13) [3]CH2CH2 Cl[1] CH2Cl[2] 1 H[4] (3S) MESO Cl H 3 H[4] (1R) 3 [2]ClCHCH2 Cl H 1 (13) cis (1R,3S)-1,3-DIclorociclohexano (CH2)2[3] 234 Cl[1] Cl 3 Me Cl H 2 H [3]CH2 1 1 2 (R)C1 CHMe[2] H[4] H C3(S) [2]MeCH H (1R) (14) Cl[1] Me 3 CH2[3] H[4] (3S) (2s) MESO Cl Me 3 Cl H 2 H 1 H (14) (1R,2s,3S)-r-1-Cloro-c-3-cloro-c-2-metilciclohexano Cl 4 H Cl[1] Cl Cl 2 1 [3]CH2 H 1 Cl[1] CHCl[2] 2 [2]ClCH H[4] H CH2CHCl[3] [2]ClHCH2 H[4] (1R) (15) Cl[1] CH2[3] H[4] (2S) Cl 4 (4S) Cl Cl 4 H 2 1 H H (15) (1R,2S,4S)-r-1-Cloro-c-2,c-4-diclorociclohexano RESPUESTA 35 Advertencia muy importante: Cuando se hace la sustitución de un hidrógeno por un átomo de prueba Z, es preciso seguir la misma secuencia de numeración en los átomos del ciclo. En concreto, la numeración del carbono al que está unido dicho átomo Z, debe ser la misma en todas las moléculas que se comparen. Molécula (1) Z [3]CH2 2 H Z[3] Cl[1] Cl 1 1 CHZ[2] [1]ClCH H[4] H 2 CH2[2] H[4] (2S) (1R) (1R,2S) [1] H Cl[1] Cl [3]CH2 2 Z 1 H (1R,2R) [2] 1 H[4] (1R) H[4] CHZ[2] [1]ClCH 2 Z[3] (2R) CH2[2] 235 Cl[1] Z Cl 1 [2]ZHC 2 H 1 Z[3] CH2[3] [2]CH2 H[4] H 2 CHCl[1] H[4] (1S) (2R) (1S,2R) [ 3] Cl[1] H Cl 1 [2]ZCH 2 Z 1 H[4] CH2[3] [2]CH2 H[4] H CHCl[1] 2 Z[3] (1S) (2S) (1S,2S) [4] Enantiómeros: [1]–[3] ; [2]-[4] H1 Cl H2 Diastereoisómeros: [1]-[2] ; [1]-[4] ; [2]-[3] ; [3]-[4] Enantiotópicos H1-H3 ; H2-H4 H3 Diastereotópicos H4 H1-H2 ; H3-H4 H H1-H4 ; H2-H3 (1) Molécula (2) Cl[1] Z Cl 3 2 H 1 [4](CHH)C3 1 Z[3] C2(CZH)[3] [2](CHH)C3 O(H)[2] OH 2 C1(ClOC)[1] H[4] (1R) (2R) (1R,2S) [1] H Z Cl Cl 2 Cl H 2 Z 1 H 1 OH OH 2 1 OH (1R,2R) (1S,2R) (1S,2S) [2] [3] [4] H1 Cl H2 H3 H4 H (2) Enantiotópicos H1-H3 ; H2-H4 Diastereotópicos H1-H2 ; H3-H4 H1-H4 ; H2-H3 Z 236 Molécula (3) OH (R) 2 H OH OH Z 1 (R) (S) H 3 2 OH H H 1 OH (S) OH 1 2 H 3 OH H Z H 2 H H Z H Z H H (1S,2R,3r) (1S,2R,3s) (1S,2R) (1R,2S) [1] [2] [3] [4] OH H1 H3 OH OH 1 Enantiotópicos H3-H4 H4 Diastereotópicos H2 H1-H2 (3) Molécula (4) OH 2 H OH H Z 1 2 OH 3 H H OH 1 H 3 H 2 OH H OH H OH OH H Z H H (1R,2R) (1R,2R) (1R,2R) (1R,2R) [1] [2] [3] [4] OH H1 H3 H4 Homotópicos H1-H2 OH H3-H4 H2 (4) Molécula (5) OH [3](S) 2 H OH OH[1] 1 (R)[2] 3 OH (S)[3] [1] OH OH 2 3 H [4] Z Z[4] 1 (R)[2] H H OH [2] (R) 1 H OH OH [1] 3 [3] (S) 2 H Z [4] (1R,2S,3s) (1R,2S,3s) (1R,2S,3s) [1] [2] [3] OH OH OH Homotópicos H1-H2 H2 H3 H1 (5) H2-H3 H1-H3 Z 2 1 1 Z H 237 Molécula (6) OH 2 [3] (S) Z [4] H OH OH 1 (R)[2] H 3 OH (S) H Z H 1 OH [1] (S) OH (1R,2S,3r) (1S,2S) [1] [2] OH H1 H2 OH 1 (R) 2 3 H (C3 no estereogénico) H (R) 2 OH OH 3 Z (1R,2R) [3] OH Enantiotópicos H2-H3 H3 Diastereotópicos OH H1-H2 (6) H1-H3 RESPUESTA 36 Molécula (1) H C6H5 C6H5 2 5 H O H [1]C6H5 H[2] Me 1 H[4] H[4] H 3 O [2](CHH)C3 Me[3] Me C1(OOC)[1] C(HHH)[3] (R) (R)-(5S)-2-Benciliden-5-metilciclohexanona 5 (5S) (1) Molécula (2) C6H5 H O H C6H5 Me (2) O H 5 [2]H [2](CHH)C3 C6H5[1] H 1 C(HHH)[3] Me[3] Me 2 H[4] H[4] (5R) (R) (R)-(5R)-2-Benciliden-5-metilciclohexanona 5 Para nombrar las moléculas,(1) y (2) se puede emplear también la geometría del doble enlace: C6H5 H 2 H O 5 1 Me (1) E-(5S)-2-Benciliden-5-metilciclohexanona H Me 2 C6H5 O 5 H 1 (2) Z-(5R)-2-Benciliden-5-metilciclohexanona C1(OOC)[1] 238 Molécula (3) Me[3] CO2H[1] [2]H Me[3] H[4] [2]CH2 H[4] [1]MeCH C=C[1] 2 4 Me[3] (R) Me[3] CH2[2] 5 [2]CH2 H[4] H[4] (4R) (2S) CHMe[1] (5R) Me Me 5 H 1 H HO2C 4 H H 2 Me Ác. (R)-(2S,4R,5R)-2,4,5-trimetilciclohexilidenacético RESPUESTA 37 H H Me H 4 Me H H (2Z,4Z) Me H H H H H Me 2 H H Me Me H Me H H Me H (2E,4Z) (2Z,4E) (2E,4E) Los estereoisómeros (2Z,4E) y (2E,4Z) son iguales (superponibles): RESPUESTA 38 H CO2H Me 4 H H CO2H Cl 2 2 4 Et Me H Ác. (2E,4Z)-2,4-hexadienoico Et H Ác. (2E,4Z)-5-cloro-2,4-hexadienoico CH2_CO2H H H 3 Me 5 Me Cl H H Ác. 3-[(E)-1-cloropropenil]-(3Z,5E)-5-cloro-2,4-hexadienoico RESPUESTA 39 Et H Me 4 5 Me 2 Cl H (2E,4E)-2-Cloro-5-metil-2,4-heptadieno Me H Cl 4 5 Et 2 Me H (2Z,4E)-2-Cloro-5-metil-2,4-heptadieno Me H Me 4 5 Et 2 Cl H (2E,4Z)-2-Cloro-5-metil-2,4-heptadieno 239 Cl H Et 4 5 Me 2 Me H Cl H 1 Br H Me 3 H Me (2Z,4E)-2-Cloro-5-metil-2,4-heptadieno Et 5 (1Z,3Z,5E)-1-Bromo-1-cloro-3,6-dimetil-1,3,5-octatrieno RESPUESTA 40 Me H H 4 5 CH2Me 2 H H MeCH2 5 Me 4 H H Me H (1) (1') (2Z,4Z) (2Z,4Z) H CH2Me 4 5 H 2 H CH2Me H 5 Me 4 H H H (2) (2') (2Z,4E) (2Z,4E) H H 4 5 CH2Me 2 Me MeCH2 5 H 4 H (3) (3') (2E,4Z) (2E,4Z) H CH2Me 4 5 H 2 Me H H 2 H Me H H 2 H H H 2 CH2Me H 5 H 4 H 2 Me H (4) (4') (2E,4E) (2E,4E) conformación más estable: (4) ; conformación menos estable: (1’) 240 RESPUESTA 41 H H H C Me C C CH3 H H (Z)-(S)-2,3,5-Heptatrieno CH3 C H H C(HHH)[1] [2]H C(CCH)[3] (R) H H Me H C(HHH)[1] C(CCH)[3] C Me H[4] (S) H C (Z)-(R)-2,3,5-Heptatrieno H[4] [2]H C C C H H CH3 (E)-(S)-2,3,5-Heptatrieno H C CH3 H Me C H (E)-(R)-2,3,5-Heptatrieno H[4] [2]H C H[4] C(HHH)[1] [2]H C(CCH)[3] C(HHH)[1] C(CCH)[3] (S) (R) El compuesto tiene dos parejas de enantiómeros: (S)(Z) y (R)(Z) ; (S)(E) y (R)(E) RESPUESTA 42 H 5 H Me 2 C 3 C 4 Me C [2]H H (1) H[4] C(CCH)[3] Et C(HHH)[1] [2](HHC)C H C 3 C 4 (5R) C [2]H Me (2) H[4] H 5 H Me Et C(CCH)[1] C(HHH)[1] C(CCH)[3] (S) C(HHH)[3] C(CCH)[1] H[4] (R) 2 5 [2](HHC)C 5 H[4] (5S) C(HHH)[3] 241 H 5 H Me 2 C 4 3 Et C C [2]H [3](HHH)C C(HHH)[1] H (3) H[4] C(CCH)[3] Me Me 2 C 4 3 C C [2]H 5 (4) (5S) H[4] H H C(CHH)[2] C(CCH)[1] H[4] (R) H 5 C(CCH)[1] C(HHH)[1] [3](HHH)C 5 C(CHH)[2] Et C(CCH)[3] Me H[4] (5R) (S) El compuesto tiene dos parejas de enantiómeros: (1) (R)(5R) y (2) (S)(5S) ; (3) (R)(5S) y (4) (S)(5R) RESPUESTA 43 Por cualquiera de los dos caminos se llegaría al ácido D-(2R)-málico: CO2H H OH HR HS CO2H RESPUESTA 44 3RE(OH) HO2C HO2CCH2 HO CO2H _ H OH 3 2 HO2C HO2CCH2 H 2RE(H) CO2H H OH HO2C CH2 C CH2 CO2H CO2H H Ác. cítrico RESPUESTA 45 Secuencia 1 H HO2C CO2H H Ác. Fumárico HO2C H HO HO HO2C T H CO2H H CO2H O T HO2C H CO2H T H Ác. 3-Tritiooxalacético Ác. 3-Tritiomálico HO2C P O T HO2C H (1) O P H T (1) 242 Reacciones estereoespecíficas: 3re P O T HO2C H CO2H O carboxilasa HO2C 2re (1) T H malatodeshidrogenasa HO HO2C H CO2H T H Ác. 3-Tritiooxalacético HO2C H T fumarasa anti-eliminación H CO2H HO H CO2H H HO2C Ác. Fumárico (no tritiado) Ác. 3-Tritiomálico Secuencia 2 H HO2C H CO2H T HO2C T CO2H HO Ác. Fumárico HO HO2C H H CO2H O H HO2C T CO2H H T Ác. 3-Tritiooxalacético Ác. 3-Tritiomálico HO2C P O H HO2C T (2) O P T H (2) Reacciones estereoespecíficas: 3re P O H HO2C T CO2H O carboxilasa HO2C (2) 2re H T malatodeshidrogenasa HO HO2C H CO2H H T Ác. 3-Tritiooxalacético HO2C H HO H T CO2H Ác. 3-Tritiomálico fumarasa anti-eliminación HO2C H T CO2H Ác. Fumárico (tritiado) En la página siguiente aparece un esquema completo con todas las posibilidades de reacción de (1) 243 H 2si (H) HO HO2C 2si 3si (CO2H) 2re HO H T CO2H H T CO2H HO2C Ác. maleico (tritiado) CO2H HO HO2C 2re (H) H 2si 3re HO2C CO2H HO2C H Ác. 3-Tritiomálico Ác. 3-Tritiooxalacético P O H TH O HO2C T T HO2C H CO2H H HO H T CO2H Ác. 3-Tritiomálico T HO2C H T CO2H Ác. Fumárico (tritiado) H 2re 3si H (1) 2si (H) HO HO2C 2si T H HO2C 2re HO2C H HO T H H CO2H HO2C T H HO HO2C Ác. 3-Tritiooxalacético CO2H 2re (H) H T H HO2C H HO H CO2H Ác. Maleico (no tritiado) Ác. 3-Tritiomálico CO2H O 3re (CO2H) CO2H T HO2C H CO2H Ác. 3-Tritiomálico H H CO2H Ác. Fumárico (no tritiado) 244 RESPUESTA 46 HO2C H HO T CO2H CO2H H HO 2 3 CO2H H HO2C H H T HO 3 CO2H H HO H 2 3 Z HO2C H pro-(R) H CO2H Ác. 3-Tritiomálico HO2C H 2 HO (R) H CO2H CO2H H HO 2 3 T CO2H T HO2C HO2C H 2 HO 3 2 3 H pro-(R) Z Ác. 3-Tritiomálico CO2H H HO H H HO2C H (R) REACCIONES DE ADICIÓN ELECTRÓFILA RESPUESTA 47 Apartado 1: Br CH3 CH CH2 (g) + HBr (g) CH3 CH CH3 (g) ΔG 0T = −6.51 − [14.99 + ( −12.73)] = −8.77kcal / mol CH3 CH CH2 (g) + HBr (g) CH3 CH2 CH2Br (g) ΔG 0T = −5.37 − [14.99 + ( −12.73)] = −7.63 kcal / mol El primer equilibrio está más desplazado a la derecha que el segundo (mayor variación negativa de energía libre) Apartado 2: ⎛ ΔG 0 ⎞ ⎟ K eq. = ant log ⎜ − ⎜ 4 .6 T ⎟ ⎝ ⎠ Br CH3 CH CH2 (g) + HBr (g) CH3 CH CH3 (g) ⎛ ΔG 0 ⎞ ⎟ = ant log ⎛⎜ 8770 ⎞⎟ = ant log 6.3977 = 2.50 × 10 6 K eq. (1) = ant log ⎜ ⎜ 4.6 T ⎟ ⎝ 4.6 × 298 ⎠ ⎝ ⎠ CH3 CH CH2 (g) + HBr (g) CH3 CH2 CH2Br (g) ⎛ ΔG0 ⎞ ⎟ = ant log ⎛⎜ 7630 ⎞⎟ = an log 5.5661 = 3.68 × 10 5 K eq. (2) = an log ⎜ ⎜ 4.6 T ⎟ ⎝ 4.6 × 298 ⎠ ⎝ ⎠ 245 Apartado 3: K eq. (1) = [2 − bromopropano] [propeno][HBr ] K eq. (1) K eq. (2) = [2 − bromopropano] = 2.50 × 106 K eq. (2) [1 − bromopropano] 3.68 × 10 5 = [1 − bromopropano] [propeno][HBr ] = 6.79 [2 − bromopropa no] = 6.79 [1 − bromopropa no] % (2-Bromopropano) = 6.79 % (1-Bromopropano) (1-bromopropano) = 12.83 % (2-bromopropano) = 87.17 % % (2-Bromopropano) + % (1-Bromopropano) = 100 Apartado 4: ¿Por qué no se obtiene nada de 1-bromopropano? ( ( ) ) El 2-bromopropano ΔG 0f = −6.51 kcal / mol es más estable que el 1-bromopropano ΔG0f = −5.37 kcal / mol Si se deja tiempo suficiente para que la reacción alcance el equilibrio, la mezcla resultante tendrá el 87.17 % de 2bromopropano y el 12.83 % de 1-bromopropano (la reacción está sometida a control termodinámico) Cuando los productos se aíslan antes de alcanzarse el equilibrio, el producto mayoritario será el que se forma más rápidamente (la reacción está sometida a control cinético) ¿Por qué el 2-bromopropano se forma más deprisa que el 1-bromopropano? RESPUESTA 48 1 CH3 CH3 C + CH CH3 Cl CH3 Cl _ CH3 C CH3 CH3 CH3 C CH3 CH CH2 2 [carbocatión secundario] HCl 1 CH3 2 CH3 C CH CH3 CH3 + CH2 CH2 3-Cloro-2,2-dimetilbutano Cl CH3 _ CH3 C CH2 CH2Cl CH3 CH3 [carbocatión primario] 1-Cloro-3,3-dimetilbutano (no se obtiene) En el carbocatión secundario tiene lugar la transposición de un anión metilo: Me CH3 C CH3 CH CH3 + transposición [carbocatión secundario] CH3 + C CH3 CH CH3 CH3 [carbocatión terciario] Cl _ CH3 Cl CH3 C CH CH3 CH3 2-Cloro-2,3-dimetilbutano RESPUESTA 49 Reacción del (Z)-3,4-dimetil-3-hexeno con HCl: Se obtiene una mezcla de dos racémicos del 3-cloro-3,4-dimetilhexano: (1) y (4) ; (2) y (3) 246 H Cl 1 4 1 1 H Me Et (Z) + HCl 1 Me Et Me Cl 3 Me Et _ Me Et [1] (3S,4S) Et Me Et H 2 4 2 3 Me Et Me Et Cl [2] (3R,4S) Me Et 4 1 1 Me Et Me Et (Z) Me Et HCl 2 + Me Et H _ Me Cl 3 Cl [3] (3S,4R) Et H 2 Me Et 2 4 3 Me Et 2 Cl H [4] (3R,4R) Comprueba que partiendo del diastereoisómero (E) del 3,4-dimetil-3-hexeno se obtiene la misma mezcla de reacción. RESPUESTA 50 Reacción 1: H Cl H CH3 H + CH3 Cl Cl _ CH3 H (carbocatión terciario) 1-Cloro-1-metilciclohexano Reacción 2: 5 1 4 5 H 6 1 Et 3 CH3 HCl Et H H H 2 H + CH3 Cl Cl 1 3 1 4 6 Et 2 (1R,3S) Me (1) _ 3-Etil-1-metil-1clorociclohexano 2 5 (3S)-3-Etil-1-metilciclohexeno 2 4 6 Et Cl 1 3 2 Me H (2) 3-Etil-1-metil-1clorociclohexano (1S,3S) 247 Se obtiene una mezcla de dos diastereoisómeros: (1) (1R,3S) y (2) (1S,3S) Reacción 3: 5 H 1 5 6 1 4 Me 3 CH3 HOH H2SO4 H + H 2 Me 2 (4R)-1,4-Dimetilciclohexeno 1 Me H Cl CH3 OH 4 1 H 6 3 Me 2 trans-1,4-Dimetilciclohexanol _ 5 H 6 Me 1 4 2 Me 3 OH 2 cis-1,4-Dimetilciclohexanol Se obtiene una pareja de diastereoisómeros cis / trans del 1,4-dimetilciclohexanol RESPUESTA 51 (E)-2-Buteno: Br 1 Me 1 Br + 1 Me H H Br Br 2 _ H Me H [1] (2S,3S) Me 2 H Br 2 2 1 2 Me 3 H Me Br [2] (2S,3R) Me H 3 (E) H Me Br2 1 + Br 2 3 H Me Br 1 Me H Me H H Br [3] (2R,3S) _ Me 2 Br 2 Me H H 2 3 Me 2 Br Br [4] (2R,3R) 248 Enantiómeros: (1) y (4) ; Forma meso: (2) = (3) (Z)-2-Buteno: Br 1 Br H + Br _ H Me [1] (2R,3S) Me H Me 2 H Br 2 2 Br [2] (2R,3R) H 2 Me 3 H Me 1 Me 3 H Me 1 1 Br 2 (Z) Br2 H Me Me H 1 3 H Me Br 1 H Me Br 2 H + Br [3] (2S,3S) _ Me 2 2 Br Me H H 2 3 Me 2 Br Br [4] (2S,3R) Se llega al mismo resultado que con el estereoisómero (E) Enantiómeros: (2) y (3) ; Forma meso: (1) = (4) RESPUESTA 52 Br 1 2 3 H Me 1 H Me Me H Br2 2 H Me Me H Br + Br Me H Br (1) (2R,3S) _ Me Br Me Br Br 3 H Me H H Br 2 2 H 2 3 Me H (2) (2S,3R) Br H 2 3 Me Me Br 249 El resultado es el mismo que si se parte del otro catión bromonio: + Br H Me Me H RESPUESTA 53 A continuación aparece un esquema de la reacción entre XOH y los estereoisómeros (Z) y (E) de una olefina que tiene los mismos sustituyentes unidos al doble enlace. H R X 1 + X H H R HO A(1) R 1 H R H R X 2 2 H H R HO _ H R OH A(2) XOH R (Z) H R HO 1 2 1 H H R HO H R _ X A(2) R X + R H OH 2 H R X A(1) Enantiómeros: A(1) y A(2) Para obtener una de las dos parejas de enantiómeros, a partir del estereoisómero (Z), sólo es necesario trabajar con uno de los dos cationes halogenonio posibles. Si la reacción se hace con el estereoisómero (E), hace falta emplear los dos cationes halogenonio, ya que cada uno de ellos sólo da lugar a uno de los estereoisómeros de la otra pareja de enantiómeros: R H X 1 R H HO + X R H R H (E) XOH A(3) H R R HO _ H 1 2 X 2 R H H R OH A(3) 250 R H HO 1 H R 1 R H R 2 H XOH H R R (E) X A(4) HO _ H X + R H OH 2 R H X A(4) Enantiómeros: A(3) y A(4) Si en los esquemas anteriores R ≡ Me, los resultados son los siguientes: H H Me Me Me ClOH H 3 H Me (2S,3S)-3-Cloro-2-butanol Me H Me Me H ClOH H Me HO 3 2 + Me H HO (E) OH (2R,3R)-3-Cloro-2-butanol Cl 2 2 3 + H Me HO (Z) H Me Cl Cl 2 3 H Me (2S,3R)-3-Cloro-2-butanol H Cl (2R,3S)-3-Cloro-2-butanol RESPUESTA 54 Et Br Me Et HOBr OH 2 1 Me Et + 2-Bromo-2-etil1-metilciclohexanol HOBr Et Me Me 2 2-Bromo-1-etil2-metilciclohexanol 1 + Br OH Br 1 HO Et Br 2 1 _ (1R,2R) OH Me (1) Me Et 1 2 2 Br Me 1 2 Et OH (2) (1S,2S) 251 3 HOBr 3 4 HO OH Me _ (1S,2S) 2 1 Et Br (1) Et Me Et Me Br + Et 4 (1R,2R) OH 1 2 Br Me (2) Se obtienen los siguientes productos: (1R,2R) pareja de enantiómeros 2-bromo-1-etil-2-metilciclohexanol (1) (1S,2S) (1S,2S) 2-bromo-2-etil-1-metilciclohexanol (2) pareja de enantiómeros (1R,2R) RESPUESTA 55 O O Os O O KOH OH H2O Et (1S,2R) 2 1 Me Et Et OsO4 OH Me (1) Me KOH Et H2O Et O O OH OH (2) Os O (1R,2S) 1 2 Me Me O Se obtiene una pareja de enantiómeros del 1-etil-2-metil-1,2-ciclohexanodiol. RESPUESTA 56 Reacción del (Z)-2-penteno: Me H 1 H H Me H Et (Z)-2-Penteno RCO3H H Me O H Et H3O+ 3 H Et HO O+ H OH 2 Me H H2 O (1)(2S,3S) Et 1 HO 2 H 2 2 H Me Et 3 OH (2)(2R,3R) 252 Reacción del (E)-2-penteno: O O Os O H HO O Me H Et Me Et KOH H H2O OH 2 3 H Me OsO4 H Et (2)(2R,3R) H (E)-2-Penteno H Me O O O Et KOH H H2 O H Me Et H 2 HO Os 3 OH (1) (2S,3S) O En los dos casos se obtiene la misma pareja de enantiómeros. RESPUESTA 57 La molécula A es una olefina. Después de la adición de HOCl, los grupos OH y Cl deben estar situados en los carbonos que en la olefina estaban unidos por el doble enlace: CH3 CH CH CH3 OH Cl HOCl CH3 CH CH CH3 3-Cloro-2-butanol Como sólo se obtiene una pareja de enantiómeros, es razonable suponer que la reacción transcurre a través de cationes cloronio. Después de la adición, el Cl y el OH estarán situados en lados opuestos del plano molecular. Se trata de averiguar si el 2-buteno de partida es Z o E. Me 2 H Cl 3 Me OH H OH 2 Me 3 H H 3 H Me Cl Cl Cl 3 2 H Me Me OH H Me Me HO Me 3 H (2R,3S) Me H OH (1) (2S,3R) 2 2 (2S,3R) Me H HO H 2 Cl 3 Me Me OH 3 H Cl H Cl Me H 2 H Me OH 3 2 Cl (2) H (2R,3S) Fijándose en la pareja de enantiómeros, se ve bien que ambos provienen del (E)-2-buteno: Me 253 1 + Cl 1 H Me 1 H Cl 2 2 Cl + H Me 2 (2S,3R) OH (1) Me H HO 1 2 1 H Me 2 HO Me 2 H Cl + 3 (2R,3S) H Me _ Me Me Me H Cl 2 Me H (2S,3R) H 3 H Me 3 HO _ HO Me H Me Cl H OH 3 2 (2R,3S) 2 Cl H (2) Me RESPUESTA 58 H CH3 CH 2 CH CH2 CH3 HCO3H OsO4 CH3 CH CH CH2 CH3 2 Me HO 3 3 OH HO Et Et 2 Me OH 3 H H (2R,3R) (2S,3S) H H 2 Me Et 3 H 2 3 OH HO OH HO 2 Me Et 3 H H (2R,3S) (2S,3R) Con ácido peroxifórmico la adición al doble enlace es anti : H Me HO 2 3 H OH Me OH 2 Et 3 H (2R,3R) HO HO Me 3 H Et H Et H Me HO 3 2 OH H H Et 2 OH (2R,3R) 254 H HO Et H Me HO 2 3 Me 2 OH 3 OH 3 H Et OH H Me 2 3 2 H HO H OH Et H Et H HO Me (2S,3S) (2S,3S) Fijándose en la pareja de enantiómeros, resulta obvio que la olefina de partida es el (Z)-2-penteno: Et H OH 3 1 2 H O H 2 3 1)RCO3H H Me Et 2)H3O+ HO H Me H2 O H Me 1 (Z)-2-Penteno HO + H Et (2S,3S) H Me anti 2 3 2 2 H Et (2R,3R) OH Con tetraóxido de osmio la adición al doble enlace es syn : H Me 2 Et OH 3 H OH Me Et 2 3 OH Et H Me 3 H HO H OH HO OH 3 2 2 Et H OH Me H H (2R,3S) (2R,3S) H HO HO 2 3 H Me HO Me 2 Et 3 H HO OH 3 H Et H Et HO 2 H Me (2S,3R) (2S,3R) De nuevo es evidente que la olefina es el (Z)-2-Penteno: O O Os O Et H Et H 3 2 O 3 2 Me H H3O+ HO OH 3 2 Et H (2R,3S) H Me Me OsO4 syn H Et H 2 3 O O Os O O Me H H 3O + H Et HO 3 2 Me H OH (2S,3R) 255 Reacción del (Z)-2-Penteno con ácido hipocloroso: CH3 CH CH CH2 CH3 OH Cl HOCl Cl CH3 CH CH CH2CH3 CH3 CH CH CH2CH3 + 3-Cloro-2-pentanol 1 + Cl 1 H Me H Et H Cl 2 3 H Et H Cl 2 2 (2R,3R)- 2-Cloro-3-pentanol OH H Et HO 1 1 2 H Me 2 H Et Cl + 2 3 (2R,3R)- 3-Cloro-2-pentanol H Me _ HO Me (2S,3S)-3-Cloro-2-pentanol Et 3 H Me Cl + H Et Me 2 1 H Me 2-Cloro-3-pentanol HO _ HO OH Cl H OH 2 3 (2S,3S)- 2-Cloro-3-pentanol 2 H Et Cl Se obtiene una mezcla de los siguientes estereoisómeros: (2S,3S)-3-cloro-2-pentanol (2R,3R)-2-cloro-3-pentanol Enantiómeros Enantiómeros (2R,3R) 3-cloro-2-pentanol (2S,3S)-2-cloro-3-pentanol RESPUESTA 59 Reacción con tetraóxido de osmio: Me Me OH OsO4 OH Me Me O O Os OsO4 syn Me 1 2 Me O O 1 2 H3O+ 1 Me Me H3O+ 1 Me OH O Os O Me Me Me Me 1 OH (1)(1S,2R) 2 Me 2 O O OH 2 OH (2)(1R,2S) 256 (1) cis-(1S,2R) 1,2-dimetil-1,2-ciclohexanodiol (1) = (2) Forma MESO (2) cis-(1R,2S) 1,2-dimetil-1,2-ciclohexanodiol Reacción con ácido peroxibenzoico: Me Me C6H5CO3H OH OH Me Me 1 OH Me 2 1 1)R-CO3H 1 H2O 2 Me OH Me OH anti 2)H3O+ Me (3) (1S,2S) Me Me Me O+ H 2 2 1 OH (4) (1R,2R) Me (3) trans-(1S,2S) 1,2-dimetil-1,2-diclohexanodiol Pareja de enantiómeros (4) trans-(1R,2R) 1,2-dimetil-1,2-diclohexanodiol Reacción con ácido clorhídrico: Me Me HCl Cl H Me Me 1 1 H Me 1 Cl H 1 _ 2 2 H+ Me 1 2 Me H 2 Me Me H Me 1 Me (5) (1R,2R) + 2 1 Cl 1 Cl 2 Me Cl Me Cl 1 _ (6) (1R,2S) (7) (1S,2R) 2 H Me Me Me + 2 2 1 H 2 Cl (8) (1S,2S) 257 (5) trans-(1R,2R)-1,2-dimetil-clorociclohexano Pareja de enantiómeros (8) trans-(1S,2S)-1,2-dimetil-clorociclohexano (6) trans-(1R,2S)-1,2-dimetil-clorociclohexano Pareja de enantiómeros (7) trans-(1S,2R)-1,2-dimetil-clorociclohexano RESPUESTA 60 Apartado 1 H HBr C6H5CH2 CH CH CH2CH3 Br Br C6H5CH2 CH CH CH2CH3 + H C6H5 CH CH__CH2CH2CH3 1-Bromo-1-fenilpentano 1-Fenil-3-bromopentano Como se obtiene una mezcla de dos racémicos, la reacción debe transcurrir a través de carbocationes: H + C6H5CH2 CH CH CH2CH3 (1) 1 1 2 H+ C6H5CH2 CH CH CH2CH3 H + C6H5CH2 CH CH CH2CH3 (2) 2 Br 1 1 H + C6H5CH2 CH2 C (1) Br C6H5CH2 CH2 H Et _ Et racémico del 1-fenil-3-bromopentano H Et 2 C6H5CH2 CH2 2 Br En el carbocatión (2) tiene lugar una transposición, que conduce a otro carbocatión más estable (conjugado con con el núcleo bencénico): H C6H5CH H + CH CH CH2CH3 + C6H5 CH CH2CH2CH2CH3 (2) (3) El carbocatión (3) es el que da lugar al racémico del 1-Bromo-1-fenilpentano: Br 1 C6H5 H 1 C6H5 + CH Bu Br _ Bu racémico del 1-Bromo-1-fenilpentano H 2 C6H5 H Bu 2 Br 258 Apartado 2 Reacción con ácido peroxibenzoico: 1 C6H5CH2 H OH 3 2 H H Et H C6H5CH2 1)RCO3H 2)H3O+ O H C6H5CH2 H (2S,3R) H2O Et H anti 2 1 Et HO + Et H HO 3 2 2 H C6H5CH2 OH (2R,3S) Reacción con tetraóxido de osmio: O O Os O H C6H5CH2 Et H HO O H C6H5CH2 OH H3O+ Et H 2 3 H C6H5CH2 Et H (2R,3R) OsO4 syn H C6H5CH2 O O H3O+ Et H 2 H 3 OH HO Os O Et C6H5CH2 H (2S,3S) O RESPUESTA 61 C6H5 CH3 CH CH CH CH3 C6H5 HBr CH3 CH CH CH2 CH3 C6H5 + Br CH3 CH CH2 CH CH3 Br 3-Bromo-2-fenilpentano 2-Bromo-4-fenilpentano Durante la reacción tiene lugar un cambio en el esqueleto carbonado, ya que el derivado halogenado que se obtiene no es ninguno de los dos anteriores, sino el 1-bromo-1-fenil-2-metilbutano: Br Me C6H5 CH CH CH2CH3 Lo más razonable es pensar que la reacción transcurre a través de un carbocatión, que es el resultado de una transposición en el carbocatión formado inicialmente: C6H5 CH3 CH CH CH CH3 H+ C6H5 CH3 CH CH CH2 CH3 + transposición 259 CH3 + C6H5 CH CH CH2 CH3 Br Br _ CH3 C6H5 CH CH CH2 CH3 1-Bromo-1-fenil-2-metilbutano Estereoquímica: H Br Me 1 H C6H5 1 Me Et H C6H5 + H Me H 2 1 Br + Et H C6H5 Br 1 2 H Me Et _ (1S,2R) Et C6H5 H 2 C6H5 H Me 2 1 2 Et H Br H Br C6H5 1 2 H Me Et (1R,2R) Br Et H 1 1 C6H5 C6H5 H Me Et H C6H5 Me H 1 + 2 Et + H H Br C6H5 H Me 1 2 Br H Et _ (1R,2S) Me 2 C6H5 H Et H 1 2 Br 2 Me C6H5 Br Me 1 2 H H Et (1S,2S) RESPUESTA 62 Teniendo en cuenta que la reacción transcurre a través de iones cloronio, la adición al doble enlace de los grupos HO y Cl (marcados en el dibujo con negrita) es anti : OH 1 H H 2 OH Cl 3 Cl (1S,2R)-3,3-Dicloro-1,2-ciclohexanodiol La olefina se identifica también fácilmente en el resto de los estereoisómeros: 260 OH OH OH 1 H Cl H 2 H Cl 3 Cl 2 OH H 3 H 1 1 2 OH H (1S,2S) OH Cl Cl (1R,2S,3S) Cl (1S,2R,3S) El compuesto A sólo puede ser: OH H H Cl (3S)-1-Cloro-3-hidroxiciclohexeno OH 1 H 1 OH H H + Cl 1 HO 2 _ 3 3 OH Cl Cl Cl H Cl + H H 2 (1S,2R) OH Cl 2 OH Cl H 1 (1R,2S,3S) 1 2 H OH OH Cl OH Cl 1 1 H OH 2 1 2 H H HO _ Cl Cl + (1S,2S) 2 H Cl H OH OH 2 3 H (1S,2R,3S) 1 2 Cl Cl REACCIONES DE SUSTITUCIÓN NUCLEÓFILA RESPUESTA 63 Mecanismo SN1: 1 Me H C6H13 (2R) I H C6H13 + I* 1 Me *I (2S) H C6H13 _ 2 C6H13 Me H Me (2R) 2 I* 261 Supongamos: 100 moléculas (R) al principio 20 moléculas se sustituyen, dando [10(R) + 10(S)] Ahora existen 80R + [10(R) + 10(S)]; desde el punto de vista de la actividad óptica es como si quedaran 80 moléculas R. El poder rotatorio aparente ha disminuido un 20 % después del 20 % de sustitución. velocidad de sustitución = velocidad de racemización Mecanismo SN2: Me Me *I _ * I ..... ..... I I H C6H13 Me H *I H C6H13 C6H13 (2R) + I _ (2S) H C6H13 _ I H I* C6H13 + *I I _ ..... Me Me (2R) (2S) Supongamos: 100 moléculas (R) al principio 20 moléculas se sustituyen, dando 20 (S) Ahora existen [80(R) + 20(S)]; desde el punto de vista de la actividad óptica es como si quedaran 60 moléculas (R). El poder rotatorio aparente ha disminuido un 40 % después del 20 % de sustitución. velocidad de sustitución = 2 velocidad de racemización RESPUESTA 64 H (BrCH)C3 1 C5(CHH) Br H 6 Br 1 (1R) 5 Br 2 3 H Br (CHH)C5 3 H (3R) trans (1R,3R) C1(BrCH) 4 _ HO SN 2 OH 6 5 1 H H 2 3 OH trans (1S,3S) 4 262 RESPUESTA 65 CH3 C6H5 C SN 1 CH CH2Cl CH3 C6H5 C + CH CH2 HO CH3 _ C6H5 C CH CH2OH 3-Fenil-2-buten-1-ol CH3 C6H5 C HO CH CH2 CH3 _ C6H5 C + OH HO CH CH2 2-Fenil-3-buten-2-ol C6H5 + CH CH2 HO 2 C6H5 CH3 _ CH3 CH=CH2 (2R) CH3 C6H5 2 CH=CH2 (2S) HO RESPUESTA 66 CH CH2CH3 OH 1)RCO3H CH CH2CH3 2)H3O+ OH 1-(1-Hidroxipropil)ciclohexanol H H O RCO3H Et H O+ H3O+ H Et Et Carbocatión terciario incipiente: H O+ + H Et Et (terciario) H HO O Et + (terciario) Et HO (1)(1R) H H H 1 O H H + O OH H2O H Et H 1 H2O Et OH (2)(1S) 263 Carbocatión secundario incipiente: HO H + H Et +O H2O H Et 1 O H OH H (2)(1S) (secundario) + Et H H O O H + Et OH H2O H Et H 1 Et HO (secundario) (1)(1R) La reacción transcurre preferentemente a través del carbocatión incipiente terciario, pero en este caso concreto se obtienen los mismos productos con el carbocatión incipiente secundario. RESPUESTA 67 H O+ O Me H Me Me Me + H3O+ H Me Me + H2O H O+ Me Me H Me Me Me OH Me Me H Me Me O + + Me_O_H Me Me OH H Me OH H Me MeO + H3O+ H H2O RESPUESTA 68 MeO___H : O: Me _ : O: H Me _ MeO Me Me Me H Me HO OMe Me Me H Me _ + MeO OMe RESPUESTA 69 Me MeO Me MeO Br H (R) N C _ Br SN2 Me OMe + NC H H (R) (R) _ Br Me NC OMe H (R) 264 La sustitución de Br por CN hace cambiar las prioridades relativas de los grupos. Hay inversión de la configuración, pero la configuración absoluta no varia. RESPUESTA 70 Me H2O + O _ O O _ (2S) _ H HO Me Me enolato La reacción es reversible; el agua reacciona con el anión enolato regenerando la cetona: Me O _ Me O + HO _ H (2S) HO___H _ H O Me O + HO _ Me (2R) RESPUESTA 71 La síntesis de Williamson de éteres cíclicos transcurre a través de un mecanismo SN2 (p. 8). Los oxiranos no simétricos reaccionan con nucleófilos en medio ácido a través del carbocatión incipiente más estable (regioselectividad Markovnikov). Reacciones: OH Br C2H5 C CH CH3 HO CH3 _ _ O C2H5 C CH CH3 HOMe C CH3 C2H5 C O+ H H3O+ 3-Metil-2,3-epoxipentano + H OMe CH CH3 CH CH3 CH3 CH3 Br 2-Bromo-3-metil-3-pentanol C2H5 O SN2 C2H5 C OMe CH CH3 CH3 OH H2O C2H5 C CH CH3 + CH3 OH 3-Metil-3-metoxi-2-pentanol H3O+ 265 Estereoquímica: H Me HO HO 2 3 Me Et _ O _ 3 Me Et Br H Me O SN2 2 Et Me HO 3 Et Me Br Me H O SN2 Et 2 HO 2 3 Me Et Br Me H SN2 Me 2 Et Me MeO Me MeOH H H3O+ Et Me HO 2 Et Me Br H Me Me MeOH H H3O+ 2 3 O SN2 MeO H 3 Me 2 MeOH H3O+ Me Br (2R,3S) Me Me Et OH 3 2 MeO H Me (2R,3S) H Et 2 2 (2R,3R) Br _ O _ H OH 3 (2R,3S) H Me 3 3 Et (2S,3R) HO Me 2 O 2 (2S,3S) Br _ O _ OH 3 (2R,3R) Me H 3 3 Me (2S,3S) Me Et H3O+ Me Br _ O _ 2 HO 2 MeOH (2S,3S) Me H 3 3 Et (2R,3R) HO H Me Me Et Et Me OH 3 2 H Me MeO (2S,3R) (2S,3R) RESPUESTA 72 OH Cl CH3 CH CH CH3 HO _ O _ CH3 CH CH CH3 CH3 CH CH CH3 H3O+ Cl 3-Cloro-2-butanol OH2 CH3 O SN2 + OH2 CH3 CH CH CH3 O+ H2O CH CH CH3 OH OH CH3 CH CH CH3 + OH H3O+ H Estereoquímica: Me H Cl 2 HO 3 HO H (2S,3R) Me _ Me H Cl 2 O _ SN2 3 H Me H Me 2 3 O Me H A (2S,3S)-2,3-Dimetiloxirano H3O+ Me H Me O+ H H 266 + H 2O 1 H Me 2 Me H Me + O H2O B(2R,3S) (MESO) H O H Me H H2O H H + OH2 H Me 2 Me H HO Me 1 Me H OH H 2O B(2S,3R) (MESO) Me H O OH HO H Me H H 2 3 Me HO Me H H Me OH Me H O A B (2S,3S)-2,3-Dimetiloxirano (2R,3S)-2,3-Butanodiol RESPUESTA 73 El anion bromuro es un buen nucleófilo y reacciona con el epóxido protonado: OH Cl CH3 HO CH CH CH3 _ O _ CH3 3-Cloro-2-butanol CH CH CH3 CH CH CH3 CH3 H3O+ Cl _ Br O SN2 Br CH3 CH3 CH CH CH3 O+ CH CH CH3 OH H Estereoquímica: Me H Cl 2 HO 3 HO H _ Me H Cl 2 Me O SN2 3 _ H H Me Me 3 O H3O+ Me Me H Me H O+ H A (2S,3R) (2S,3S)-2,3-Dimetiloxirano 1 H Me 2 Me H + O Br Me H2O H O H Me H _ Me H Br Br 1 Me 2 3 B(2S,3R) 2 OH H H Br H 2 Me O H Me H Me H Br 2 H2O HO 3 B(2S,3R) H Me H 267 RESPUESTA 74 B sólo puede un epóxido y A un bromoalcohol: H H2N 3 Me 2 Me Me 3 2 H H Me O OH H Me H 3 H Me HO B (2R,3R) (2R,3S) Br 2 A (2R,3S) Reacciones: El anillo de los oxiranos se abre fácilmente con reactivos nucleófilos en ausencia de ácidos; la reacción SN2 tiene lugar sobre el carbono menos sustituido (menor impedimento estéreo) OH Br CH3 HO CH CH CH3 _ O _ CH3 SN2 CH CH CH3 _ O CH3 O NH3 CH CH CH3 CH3 SN2 + NH3 Br 3-Bromo-2-butanol _ O CH3 H3N: H H OH OH CH3 CH CH CH3 + CH CH CH3 NH2 CH CH CH3 + NH4 + HO _ NH2 Estereoquímica Me H Br 2 HO 3 _ Me H H Me HO Br 2 O _ SN2 3 Me H H + H3N H 1 Me H 3 Me O H O Me _ H2O NH3 H H2N 3 Me 2 Me OH H 2 H Me H 2 (2R,3R)-2,3-Epoxibutano (2R,3S)-3-Bromo-2-butanol 1 Me O Me (2R,3S) NH3, H2O SN2 Me H (2R,3R)-2,3-Epoxibutano 2 _ O + NH3 H Me H2O NH3 Me H HO NH2 2 3 H Me (2R,3S) 268 RESPUESTA 75 C sólo puede un epóxido y A/B los estereoisómeros de un bromoalcohol : OH HO _ + MeO Na _ O OH MeOH Br OMe C A/B Mecanismo de la reacción: O _ H O _ OH OH O Br H 1 OH Br HO Br OMe _ MeO _ 1 OMe H 2 1 MeO 2 _ H H 2 H H HO 1 O _ OH (1S,2S) A (1R,2R) Br 1 2 H H C H MeO 2 2 1 OH OH B (1S,2S) H (1R,2R) RESPUESTA 76 El anillo de los oxiranos se abre fácilmente con reactivos nucleófilos en ausencia de ácidos; la reacción SN2 tiene lugar sobre el carbono menos sustituido (menor impedimento estéreo) La síntesis de Williamson de éteres cíclicos transcurre a través de un mecanismo SN2 Los oxiranos no simétricos reaccionan con nucleófilos en medio ácido a través del carbocatión incipiente más estable (regioselectividad Markovnikov) Reacciones: Me OH HO Me _ O Br A Me OMe OH C + MeO Na OH MeOH OMe B H 3O + MeOH Me _ 269 Estereoquímica: Me HO Br _ MeO Na+, MeOH _ 2 1 OH Me MeO SN2 Me H 1 O 2 1 H B (1R,2S) (1R,2R) 1-Metil-1,2-epoxiciclohexano 1-Metil-2-metoxi-ciclohexanol MeOH OMe H H3O+ 1 O 2 H A (1R,2R) Me 2 OH 1 2 H Me OH A C (1R,2S) (1S,2S) 2-Metil-2-metoxi-ciclohexanol 1-Metil-1,2-epoxiciclohexano REACCIONES DE ELIMINACIÓN RESPUESTA 77 CH3 OH CH3CH2 H3O+ CH CH CH2CH3 + Me OH2 Et _H O 2 CH CH Et Me Et H2O : C + CH Et Me Et H C CH Et (Z) + (E) Todos los estereoisómeros del sustrato (un alcohol en el ejercicio) originan una mezcla de las olefinas Z y E. Estereoisómeros (3R,4R) y (3S,4R) Me Et Et H H : Me Et :OH 4 3 Et H + : OH2 Me Et _H O 2 H Et : H H H 3O + Me Et H 2O : + Et H (1) H _ H O+ 3 Me Et Et (E) H (mayoritario) (3R,4R) : Me Et :OH 4 3 H Et H + : OH2 H Et Me Et _H O 2 : H H3O+ Me Et H2O : + H Et (2) H Et H Et H Me Et H (Z) (minoritario) (3S,4R) Me _H O+ 3 Et 270 El carbocatión (1) origina el estereoisómero (E), que será el mayoritario, ya que las interacciones Et / Me y Et / H dan lugar a una conformación con menor contenido energético que (2) (impedimento estérico entre los grupos Et / Et y Me / H) Estereoisómeros (3S,4S) y (3R,4S) : Et Me : OH 3 H Et H Et Me H Et H Et Me _ H2 O H Et H Me + H Et : 4 H 3 O+ + : OH2 Et H 2O : H (3) _ H3O+ Et Me (E) (mayoritario) H Et (3S,4S) : Et Me : OH 3 4 Et H H _ Et Me H2O Et : H H H3O+ + : OH2 Et Me H2O : H + Et H (4) _ H3 O + Et Me (Z) Et H (minoritario) (3R,4S) Et Me Et H H Cualquiera de los cuatro estereoisómeros del alcohol da lugar a la misma mezcla de diastereoisómeros de la olefina. RESPUESTA 78 El radical CH3–CHBr no interviene en la reacción y lo designamos por R; la configuración del carbono asimétrico en los productos finales será la misma que en el estereoisómero de partida. Enantiómero (2R,3R) del 2,3-dibromopentano: Me H2 Br 4 R H B: Me 3 1 Br H R (2R,3R) H1 H2 H 2 E2 H 2 H H Me R (Z) H 2 Me 3 4 Me Br H (Z)-(4R) [minoritario] 1 Me H Br 4 B: 2 3 H R H H1 R Br Me H2 H E2 Me 1 H H R (E) Me 2 H 3 H1 4 Me H Br (2R,3R) (E)-(4R) [mayoritario] 271 Enantiómero (2R,3S): Me H2 Br 4 1 B: Br Me 3 H H R H (2R,3S) H1 Me H2 E2 R 2 H H R Me H 2 H2 3 4 Me (E) Br H (E)-(4R) [mayoritario] 1 Me H Br 3 4 2 B: H H H R 1 H H1 Br Me H2 E2 R Me R 1 H H 2 H Me 3 4 Me (Z) Br H (2R,3S) (Z)-(4R) [minoritario] Enantiómero (2S,3S): Me H2 Br 4 1 B: Br Me 3 H H R H (2R,3S) H1 Me H2 E2 R 2 H H R Me H 2 H2 3 4 H Me (E) Br (E)-(4S) [mayoritario] 1 Me H Br 4 H 3 2 H H B: R 1 H H1 Br Me H2 E2 R Me R 1 H H 2 H Me 3 4 Me (Z) Br H (2R,3S) (Z)-(4S) [minoritario] Enantiómero (2S,3R): Me H2 4 1 B: Br Me 3 R H Br H R (2S,3R) H1 H2 H2 E2 H 2 H H Me R (Z) H 2 3 H Me Me 4 Br (Z)-(4S) [minoritario] 1 Me H Br 4 B: 2 3 H R H H1 R Br H2 H1 Me H E2 Me H 1 R H (E) 2 H Me 3 4 H Me Br (2S,3R) (E)-(4S) [mayoritario] 272 (2R,3R)-2,3-Dibromopentano o (2R,3S)-2,3-Dibromopentano E2 (2S,3S)-2,3-Dibromopentano o (2S,3R)-2,3-Dibromopentano E2 (E)-(4R)-4-Bromo-2-penteno [mayoritario] + (Z)-(4R)-4-Bromo-2-penteno [minoritario] (E)-(4S)-4-Bromo-2-penteno [mayoritario] + (Z)-(4S)-4-Bromo-2-penteno [minoritario] RESPUESTA 79 Apartado 1 La pareja de enantiómeros (2R,3R) y (2S,3S) : Me H Zn I 2 E2 3 Me Et H I H Et H (Z) H Me I H H Me H Et I Zn E2 3 2 A (2S,3S) A (2R,3R) E2 E2 Me H I Br 3 2 Et H I _ Et H Br Me 3 SN2 A (2R,3R) Me H 2 Br H Et I Zn _ Br Br SN2 H Me I 3 2 H 3 A (2S,3S) B (2S,3S) Et (Z) H Et 2 Br B (2R,3R) Apartado 2 La pareja de diastereoisómeros (2S,3S) y (2R,3S) : Me H OH 3 1 2 H Me Et (2S,3S) H Me H 3 Et HBr SN 1 + 3 Br 3 2 H Me Et 1 Me H Me H H Br _ Me H NH3 3 SN 2 Me H Me 2 H 3 2 Et OH Me 2 Br Me H NH3 SN 2 R CH CH R H R E2 Z R CH CH R R (R,R) o (S,S) Z Z (Z) H R E2 R (R,S) H Me (2S,3S) Los tres estereoisómeros dan lugar a reacciones E2 estereoespecíficas. Z 2 Et Apartado 3 Z NH2 3 B(2R,3S) (2R,3S) NH2 (2R,3S) A(2S,3S) 2 Me 2 Et Me Et H Z (E) Zn 273 Br CH3 Br CH CH CH3 E2 Br CH3 CH C CH3 Estereoisómero (2R,3R): B: H H 2 Me Br H Me Me H 3 Br (2R,3R) H Me Br Br Me Br E2 (Z) Me [estereoespecífica] Me H H :B H Me H 2 3 Br Br Me Me Br E2 Me H Br Br (Z) Me (2R,3R) Estereoisómero (2S,3S): B: Me H H 2 H H Me 3 Br Br Me (2S,3S) E2 Me Me Br Me Br Br (Z) H [estereoespecífica] Me H H :B H H Me 2 3 Br Me Br Br Br E2 H Me Me Me (Z) Br (2S,3S) Estereoisómero (2R,3S): B: Me H H 2 Me Br H H Me 3 Br (2R,3S) Me Me Br Br Me Br E2 (E) H [estereoespecífica] Me H H H Me H 2 Br :B 3 Me Br (2R,3S) Br Br Me E2 H Me Me (E) Br 274 RESPUESTA 80 Se trata de la forma meso (2R,3S) del 2,3-dibromobutano: Br CH3 _ Br CH CH CH3 Br MeO E2 Me Br Br 2 3 CH CH2 + CH2 CH CH CH3 + (R) (2R) (3S) MeO H _ CH3 CH C CH3 (S) 4 Me H 2 1 Me H Br Br CH3 CH Me Me Br H 3 Br Br Me H (E)-2-Bromo-2-buteno (2R,3S) (2R,3S) Br (3S) MeO _ H 4 CH Me H H 1 H H 2 1 2 3 H Br H Br (2R) 4 Me H (3S)-3-Bromo-1-buteno (2R) MeO _ Br H H H CH Me 4 H Br 1 H 1 3 (3S) Me 2 H H Br H 4 3 (3R)-3-Bromo-1-buteno RESPUESTA 81 C6H5 I CH3 CH CH CO2Et E1 CH3 C6H5 CH + CH CO2Et transp. C6H5 CH3 + CH CH CO2Et (1) (2) CH3 CH3 C6H5 C (3) CH CO2Et C6H5 CH C (4) CO2Et 275 H H + C6H5 Me H (1) C6H5 CO2Et Me H C6H5 CO2Et H (mayoritario) CO2Et Me (E) (3) H H + C6H5 Me CO2Et EtO2C C6H5 H (1) (minoritario) H Me (Z) H H + Me EtO2C CO2Et C6H5 H Me H Me C6H5 CO2Et H Me C6H5 (2) H EtO2C (minoritario) C6H5 (Z) (4) H H + Me EtO2C C6H5 C6H5 Me H Me H CO2Et (2) C6H5 (mayoritario) H EtO2C (E) El giro libre en trono al enlace C2-C3 en los carbocationes (1) y (2) hace que la configuración absoluta de C2 y C3 en el producto inicial no influyan en el resultado final. RESPUESTA 82 A(C10H13Cl) EtO C6H5 _ Me C CH Me + Me CH CH CH2 (Z) Me Me C6H5 CH CH2 C6H5 (3R) H C6H5 3 CH (3R) (3R) A C6H5 I IK Me H2O CH C6H5 + CH Me Me C CH2 Me I (2R) + (2S) (2S,3S) + (2R,3S) C6H5 Compuesto A : Me 2 Me CH CH Me 3 Cl 3 C6H5 H Me Cl CH (3S) Me C6H5 3 H CHCl (3S) La reacción con EtO− es E2. Si fuese E1 se obtendría una mezcla de los estereoisómeros (Z) y (E) La configuración de C2 en A es (2R): H CH2 276 H Me 3 C6H5 _ EtO Me H H Me C6H5 Cl H Me Me 2 2 3 H Me C6H5 Cl (Z) A (2R,3S) Si la configuración de A fuese (2S,3S) se obtendría el estereoisómero (E): EtO _ H 2 Me C6H5 Me H Me 3 Me H C6H5 Cl (E) A (2S,3S) Reacciones: La reacción con IK + H2O es SN1 y tiene lugar una transposición de H: I Me 1 1 H Me 3 C6H5 SN1 + 3 2 H I _ 2 3-Fenil-2-yodobutano H Me H (2S,3S) Me C6H5 H Cl H C6H5 Me Me 3 H Me 2 A (2R,3S) 3 2 2 Me 3-Fenil-2-yodobutano C6H5 H I (2R,3S) transp. de H I 1 1 C6H5 + CH2Me Me I 2 Et (2R)- 2-Fenil-2-yodobutano C6H5 Me _ C6H5 Me 2 2 2 Et (2S)- 2-Fenil-2-yodobutano I La reacción con EtO−/EtOH es E2: EtO _ H H Me 2 Me C6H5 3 Cl A (2R,3S) E2 Me H C6H5 Me (Z) (2-Fenil-2-buteno) [Saytzev] 277 H H Cl 3 CH 2 Me C6H5 E2 CH3 3 Me C6H5 A (2R,3S) (3-Fenil-1-buteno) [Hofmann] CH2 CH 2 (3R) RESPUESTA 83 E es una síntesis acetilacética, luego E tiene que ser un β-cetoéster: El paso D(R-Br) _ MeCO CH R Br MeCO CH R CO2Et CO2Et _ 1)HO (conc.) 2)H3O+ Me R CH2CO2H C6H5CH2CH CH2CO2H (E) Me Me C6H5CH2CH R C6H5CH2CH Br El haluro de alquilo D es: D(C9H11Br) Br B(C9H9Br) presenta isomería (Z)/(E) y sólo puede ser: C6H5 CH C Me B(C9H9Br) Br C6H5 CH C Me Br H2 C6H5 CH2 CH Me * (D) [Pd] (B) H también es una síntesis acetilacética, y H será otro β-cetoéster: Análogamente, el paso F(C9H11Cl) _ MeCO CH R' Cl MeCO CH R' CO2Et CO2Et _ 1)HO (conc.) 2)H3O+ C6H5 R' CH2CO2H MeCH2CH (E) C6H5 R' C6H5 MeCH2CH El haluro de alquilo F es: MeCH2CH Cl F(C9H11Br) Cl C(C9H9Cl) presenta isomería (Z)/(E) y será: Me CH C C6H5 C(C9H9Cl) Cl Me CH C C6H5 C(C9H9Cl) H2 [Pd] Cl Me CH2 CH C6H5 F(C9H11Cl) CH2CO2Et 278 Como A sufre una reacción de eliminación, para dar B + C, sólo puede ser: Cl C6H5 Br Cl E2 CH CH Me * * C6H5 Br + C CH Me C6H5 (Z)-B (A) CH C (Z)-C Las configuraciones absolutas de los estereoisómeros del racémico A son: EtO _ HC H 6 5 H Me Br 1 2 Me Br Cl H C 6H 5 (Z)-B A(1R,2R) EtO _ C 6H 5 H H 1 Br Me 2 Br Me Cl C 6 H5 H (Z)-B A(1S,2S) EtO _ Me H H 1 Cl C6H5 Cl C6H5 2 Br Me H (Z)-C A(1S,2S) EtO _ H 1 C 6H 5 Cl H Me C6 H5 Cl 2 Br H Me (Z)-C A(1R,2R) Todas las reacciones indican que A es el racémico [(1R,2R) + (1S,2S)] Si A fuese el racémico [(1R,2S) + (1S,2R)] se obtendrían los estereoisómeros (E) de B y C: EtO _ HC H 6 5 H 1 Br Me E2 2 Br Me Cl H C 6H 5 (E)-B A(1R,2S) EtO _ Me H H 2 C 6H 5 Cl 1 A(1R,2S) Br E2 C6H 5 Cl Me H (E)-C Me 279 EtO _ C 6H 5 H H 1 E2 Me Br 2 Me Br C 6H 5 H Cl (E)-B A(1S,2R) EtO _ H H 2 Cl C 6H 5 Me E2 Cl C 6H 5 1 H Me Br (E)-C A(1S,2R) RESPUESTA 84 Secuencia 1 H Me H OH 2 Br H 2 Br 3 H Me 3 Me OH Me B(2S,3R) H Me Me H HOBr "onio" A(C4H8) Br 2 3 H Me H Me H HO OH H OH 2 Br I HI 3 _ H Me SN2 Me I 3 Br I C(2S,3S) _ Me H Br 2 3 H Me Me H H 2 B(2S,3R) SN2 OH B(2R,3S) I Br HI 2 H Me 3 Me B(2R,3S) Me 2 Me 3 Me H C(2R,3R) Br H 280 EtO _ Me H H 2 I Me _ EtO E2 3 I Me Me H Br (Z)-2-Yodo-2-buteno C(2S,3S) EtO _ Me H H 3 Br Me 2 _ EtO Br E2 Me Me H I (Z)-2-Bromo-2-buteno El enantiómero C(2R,3R) da lugar a los mismos productos de eliminación. Secuencia 2 _ H CO2Et Et H D(C6H10O3) Br SN2 (R)-E(C4H9Br) _ H Et H H Et COMe 3 4 Et Me H CO2Et Br SN2 Me MeOC H 4 3 H Et EtO2C H (R)-E(C4H9Br) 2)H3O+ CO2Et F(3R,4S) EtO2C 4 3 (3R,4S)-F(C10H18O3) _ 1)HO (conc.) 3 Me Et 3 COMe 4 Me H D(C6H10O3) MeCO CH MeOC H EtO2C Me MeCO EtO2C H Me MeCO 4 (3S,4S)-F(C10H18O3) Me HO2C CH2 3 Me H Et _ 1)HO (dil.) 2)H3O+ CO2H Ác. (3S)-3-Metilpentanoico H Et Me MeCO CH H Et _ CO2 Q Me MeCO CH2 4 H Et (4S)-4-Metil-2-hexanona El diastereoisómero C(3S,4S) da lugar a los mismos productos, ya que C4 tiene la misma configuración absoluta y C3 deja de ser asimétrico. 281 RESPUESTAS DE LOS EJERCICIOS ADICIONALES ESTEREOQUÍMICA RESPUESTA 1 CH3 HC C CH2 H2C CH CH2 HC C H2C C CH2 H2C CH CH3 C C (1) (2) (3) (4) (5) (6) 2-Propinilo Alilo Etinilo Isopropenilo Vinilo 1-Propinilo CH _ CH 2 _ (2) H2C C__CH2_ (1) HC (5) H2C CH_ C1(CHH) C2(CCH) C1(CHH) C2(CCC) C1(CCH) Me (3) HC Prioridad creciente C_ (4) H2C C_ _ (6) CH3 C C_ C1(CCC) C2(CHH) C1(CCC) C2(CCH) C1(CCC) C2(CCC) RESPUESTA 2 ClCH _ CH CH2CH2CH3 CH2 1-Cloro-1-penteno _ CH3 CH3 _ CH2 CH CH CH2CH3 3-Cloro-1-penteno Cl CH_CH2CHCH3 CH3_CH 4-Cloro-1-penteno 4-Cloro-2-penteno 1-Cloro-1-penteno (dos estereoisómeros: una pareja de diastereoisómeros Z / E): Cl CH CH CH2CH2CH3 1-Cloro-1-penteno Cl C3H7 Cl H H H H C3H7 (Z)-1-Cloro-1-penteno (E)-1-cloro-1-penteno 3-Cloro-1-penteno (dos estereoisómeros: una pareja de enantiómeros): Cl CH2 CH_CH_CH2CH3 3-Cloro-1-penteno CH CH2 CH=CH2 Et 3 H (3S) Cl H Et Cl CH CH2 Cl H Et CH_CH_CH3 CH=CH2 Cl 3 H (3R) Et 282 4-Cloro-1-penteno (dos estereoisómeros: una pareja de enantiómeros): Cl _ CH CH2CHCH3 CH2 4-Cloro-1-penteno CH2_CH=CH2 Me CH2 CH CH2 Cl 4 H Me H Cl H Me Cl Cl CH2_CH=CH2 CH CH2 CH2 Me 4 H (4R) (4S) 4-Cloro-2-penteno (cuatro estereoisómeros: dos pareja de enantiómeros) Cl CH3 CH CH CH CH3 4-Cloro-2-penteno H H Me Me Cl 4 Cl (Z)-(4R)-4-cloro-2-penteno Cl (E)-(4S)-4-cloro-2-penteno Me 4 H H (4S) (4R) (E)-(4R)-4-cloro-2-penteno CH=CH_CH3 CH=CH_CH3 Me Cl Cl 4 H (4S) (4R) 2,3-Hexadieno (dos estereoisómeros: una pareja de enantiómeros) CH C CH CH2 CH3 2,3-Hexadieno Me Et C C H Et C C H (S)-2,3-Hexadieno (S) C Me H (R)-2,3-Hexadieno Et[3] H[2] H[4] C H Et[3] [1]Me 4 H RESPUESTA 3 CH3 H Me Cl Cl CH=CH_CH3 Cl 4 H Me H Me CH=CH_CH3 H H H 4 4 (Z)-(4S)-4-cloro-2-penteno Me H H 4 H Me Me Me H [2]H Me[1] H[4] (R) Me 283 2,4-Dicloro-2,3-pentadieno (dos estereoisómeros: una pareja de enantiómeros): Cl CH3 Cl C C C CH3 2,4-Dicloro-2,3-pentadieno Me Me C Me C C Cl C Cl C Me Cl Cl (S)-2,3-Hexadieno (R)-2,3-Hexadieno Me[4] [2]Me C Me[4] Cl[1] [1]Cl Cl[3] Me[2] Cl[3] (S) (R) 2,3,4-Hexatrieno (dos estereoisómeros: una pareja de diastereoisómeros Z / E) CH3_CH=C=C=CH_CH3 2,3,4-hexatrieno H C C C H C Me H C C C Me C Me Me (Z)-2,3,4-Hexatrieno H (E)-2,3,4-hexatrieno RESPUESTA 4 Cl CH3 CH3 C CH CH C CH2CH3 2-Cloro-5-metil-2,4-heptadieno Me H Et 2 4 Cl H Me (2Z,4Z)-2-Cloro-5-metil-2,4-heptadieno Cl Me H Me 2 Me Me 2 4 4 Cl H (2E,4E) Et Cl H H (2Z,4E) H Et 2 4 Me Et H (2E,4Z) Me 284 RESPUESTA 5 6 4 H 3 Br H[4] 1 C 1' C Et 4' C [2](CCC)C1 H 2 [2](CHH)(CHH)C6 C5(CHH)[3] 3 trans (3R) RESPUESTA 6 2 Et OH 1 (1R,2S)-2-Cloro-1-etil -2-metilciclopropanol C(CHH)(ClCC)[3] 1 [1](O) C(CHH)[3] C(CHH)(HHH)[4] 2 [4](HHH)C C(ClCC)[2] Cl[1] C(OCC)[2] (1R) (2S) O H MeO H 3 2 CH2Cl (2S,3R)-2-Clorometil-3-metoxiciclobutanona C(OOC)[2] [1](ClHH)C C(CHH)[3] [1](O)C H[4] 2 3 H[4] C(CCH)[2] C(OCH)[3] (2S) (3R) H HO Me 2 O 5 1 H (2R,5S)-2-Hidroxi-5-metiloxolano C(CCH)[3] [4]H 2 O[2] O(C)[1] (2R) 4' C [1](BrCH)(CHH)C2 Br[1] Me Cl 1 C C(CHH)[2] [4]H 5 C(HHH)[3] O(C)[1] (5S) Et[1] H[2] 285 Et Me 5 OH 3 O H (3S,5S)-5-Etil-3-hidroxi-5-metilciclohexanona C(CHH)(CCC)[3] [4]H 3 C(CHH)(HHH)[3] O[1] [1](OOC)(CHH)C 5 C(CHH)(OCH)[2] C(HHH)[4] C(CHH)(OOC)[2] (3S) (5S) H OMe 3 EtO 1 Me (1S,3S)-3-Etoxi-1-metil-1-metoxiciclopentano C(CHH)(CHH)[3] [4](HHH)C 1 C(CHH)(CHH)[3] O[1] [4]H C(CHH)(OCH)[2] 3 O[1] C(CHH)(OCC)[2] (1S) (3S) 2 H 3 1 CH=CH2 4 (3R)-3-Vinilciclobuteno C2(CCH)C1(CCH)[1] 3 [2](CHH)(CCH)C H[4] C4(CHH)[3] (3R) EtOCH2 EtOCH2CH2 4 3 2 5 O1 (3R)-3-(2-Etoxietil)-3-etoximetiloxolano C4(CHH)(OHH)O(CHH)−C3[4] [2]C(HHH)(CHH)O(OHH)C 3 C(CHH)(CHH)O(CHH)(HHH)[3] C2(OHH)O(CHH)(CHH)−C3[1] (3R) 286 CH=CH2 H 6 1 5 2 4 3 H C CH (3S,6S)-3-Etinil-6-vinilciclohexeno CH=CH2 CH2CH2-CH-CH=CH−(C3) H 3 C4(CHH)[3] CH C 3 [4]H CH=CH-CH-CH2CH2−(C3) C(CCC)[1] C2(CCH)[2] CH=CH2 (3S) CH=CH2 1 2 3 6 (C6)−CH=CH-CH-(CH2)2 C CH 1 2 3 CH= CH-CH-CH2CH2−(C6) C CH H C(CCH)(CHH)[2] [3](CHH)C5 6 C1(CCH)(CCH)[1] H[4] (6S) MeOCH2 MeOCH2CH2CH2 3 2 O1 (3S)-3-Metoximetil-3-(3-metoxipropil) oxano CH2CH2CH2OCH2-(C3) MeOCH2 3 (CH2)2CH2OMe CH2O-(CH2)3-(C3) C(CHH)(CHH)(OHH)(O)(CHH)-(C3)[3] [2](HHH)(O)(OHH)C 3 C(CHH)(CHH)(OHH)(O)(HHH)[4] C(OHH)(O)(CHH)[1] (3S) 287 HC C H 3 2 1 4 H CH2 CH (3S,4R)-3-Etinil-4-vinilciclobuteno 2 1 CH CH2 CH CH CH 4 3 H [4]H C CH 1 4 C2(CCH)[3] (C3) 2 CH CH CH 2 (3S) 1 HC C CH CH CH 4 H CH 1 (C4) C3(CCH)[1] CH CH2 3 CH CH 2 C(CCC)[1] C4(CCH)[2] (C3) CH CH2 3 3 [4]H 4 C(CCH)(CHH)[3] C1(CCH)(CCH)[2] (C4) (4R) C CH RESPUESTA 7 2-Cloro-1,3-ciclopentanodiona Ningún estereoisómero (plano de simetria) O O Cl 1,3-Ciclohexanodiol Tres estereoisómeros: una pareja de enantiómeros y una forma meso. HO OH OH 1 H 3 H (1) cis-(1S,3R) OH H H OH 1 H 3 OH (2) trans-(1S,3S) 3 OH OH 1 H (3) trans-(1R,3R) 288 1,2-Dimetilciclobuteno Ningún estereoisómero (plano de simetria) Me Me 4-Amino-2,3-butadieno Dos estereoisómeros: una pareja de enantiómeros (eje quiral) CH3 CH NH2 H CH3 C C C CH NH2 H2N C C C H CH3 C H H (R) (S) 2-Metil-1,3,butadieno Ningún estereoisómero Me CH3 CH2 C CH H H CH2 H H H 2-Metoxicarbonil-1,3-ciclohexadiona Ningún estereoisómero (plano de simetria) O O CO2Me 2-Metoxi espiro[3,3]heptano Ningún estereoisómero (plano de simetria) OMe OMe H 289 3-Nitro-1-penteno Dos estereoisómeros: una pareja de enantiómeros NO2 CH3CH2 CH CH CH2 H H 3 NO2 CH CH2 Et 3 NO2 CH2 CH Et (3S) (3R) 1,2,3-Pentatrieno Ningún estereoisómero CH2 C C CH CH3 H C C H C C H CH3 Ciclohexilamina Ningún estereoisómero (plano de simetria) H NH2 NH2 RESPUESTA 8 1) 3-Nitrociclobuteno Dos estereoisómeros: una pareja de enentiómeros (3R)/(3S) O2 N 2 1 1 2 NO2 3 3 H H (3R) (3S) 2) 3-Metilclorociclohexano Cuatro estereoisómeros: dos parejas de enantiómeros. Me 3 Cl 1 H H cis-(1S,3R) H H 1 3 Cl Me cis-(1R,3S) Cl H 1 3 H Me trans-(1S,3S) Me H 1 Cl 3 H trans-(1R,3R) 290 3) Ácido 1,3-ciclopentanodioico Tres estereoisómeros: una pareja de enantiómeros y una forma meso. HO2C H H 1 3 CO2H H 3 1 CO2H trans-(1S,3S) CO2H HO2C CO2H 1 3 H H H trans-(1R,3R) cis-(1R,3S) (MESO) 4) Espiro [3.3] 2-metoxicarbonil-6-formilheptano Dos estereoisómeros: una pareja de enantiómeros (eje quiral) CO2Me H OHC 6 2 MeO2C 6 2 H H (R) H CHO (S) 5) 5-Fenil-2,3-hexadieno Cuatro estereoisómeros: dos parejas de enantiómeros. H Me H C C C H 5 H Me C6H5 Me C 5 C6H5 H C H Me (R)(5S) H C C H (S)(5R) Me C C H 5 H Me Me C6H5 5 C6H5 C C C Me H H (R)(5R) (S)(5S) 6) 3-Metil-4-hexen-2-ona Cuatro estereoisómeros: dos parejas de enantiómeros (Z)/(E) H H H H MeCO Me Me H Me 3 3 Me (Z) (3R) Me H COMe (Z) (3S) H H Me Me H H H COMe MeCO 3 3 (E) (3S) H Me (E) (3R) 291 7) Metilciclopropano Ningún estereoisómero. Me H RESPUESTA 9 Apartado 1 Cl Cl 1 H[4] H 2 8 5 H [2](CCC)(CHH)C 3 C(CHH)(CHH)[3] Cl[1] (2R) (Z)(2R)-2,8-Dicloro espiro [4,5] decano Cl C H CH2 2 (2R) C6H5 CH CMe3 Me3C C(OOH)[2] H[4] (2R) C6H5 C [3](CCH)C H CHO CH (2R)-2-Cloro-3-butenal CH C Cl[1] Cl O H2C CH CH CH3 CH 2 C(CCC)[2] [1](CCC)C CH CH2 C CH C(CCC)[3] 3 C(CCH)[4] (3R) (3R)--3-terc-butil-3-Fenil--4-hexen-1-ino Apartado 2 CH2NH2 CH3CH2 CH CH CH3 OH 3-Metilamino-2-pentanol H NH2CH2 3 HO 2 H (2R,3R) Et Me NH2CH2 H Et Et 3 3 2 2 H HO H CH2NH2 Me Me H OH H Et Me 3 2 H (2S,3S) CH2NH2 OH 292 H Et HO 3 CH2NH2 2 Me Et H CH2NH2 3 3 2 2 H HO Me H H Et NH2CH2 NH2CH2 Me H OH Me Et 3 OH 2 H H (2S,3R) (2R,3S) RESPUESTA 10 (3-Metil-2-ciclohexenil)amina NH2 1 2 CH3 3 Dos estereoisómeros (una pareja de enantiómeros): 5 NH2 6 NH2 6 1 4 3 Me H NH2[1] [3](C5HH)C6 1 4 1 H 2 5 3 2 Me NH2[1] [2](C3CH)C2 C2(C3CH)[2] H[4] 1 C6(C5HH)[3] H[4] (1R) (1S) 5-Metil-2-ciclohexeno-1-carbaldehido CHO 1 2 CH3 5 3 Cuatro estereoisómeros (dos parejas de enantiómeros): Me 5 4 6 1 H 3 2 CHO[1] CHO H [3](C5HH)C6 1 H[4] (1R) C2(C3CH)[2] Me[3] [2](C2CH)C3 5 H[4] (5R) C1(C2CH)[1] 293 Me 5 4 1 H 3 4 2 4 1 Me 3 H trans-(1R,5S) H 5 Me 1 H 2 3 cis-(1S,5S) CHO 6 CHO 6 5 H H cis-(1R,5R) H 5 1 H 2 Me CHO 6 CHO 6 3 2 trans-(1S,5R) Ácido 2-Metil-3-pentenoico CH3 CH3 CH CH CH CO2H Cuatro estereoisómeros (dos parejas de enantiómeros): H 4 H 3 Me H C3[2] H [4]H 2 Me H CH CO2H Me Me CO2H Me[3] (Z) H 4 Me H 3 2 Me (2R) H H 3 H Me 4 4 Me H Me H HO2C (Z)-(2R) Me H 3 H 3 2 2 CO2H CO2H[1] 2 Me (Z)-(2S) CO2H H HO2C CH CH3 1 Cuatro estereoisómeros (dos parejas de enantiómeros): Cl Cl Me H H Me (Z) 3 (E) Cl Cl[1] 2 1 H Me H [3](C4HH)C3 2 H[4] (Z)-(2R) H Me (E)-(2S) 2-Cloro-1-etilidenciclohexano 2 H 2 (E)-(2R) Cl 4 (2R) C1(CCC)[2] 4 294 3 Cl Cl 2 H 2 1 Me H 1 Me 3 Cl 3 H H (Z)-(2R) Cl 2 2 1 H (Z)-(2S) H Me 1 H Me (E)-(2R) 3 H (E)-(2S) (9-Acetil-3-ciano-2-hidroxi) espiro[5.5]undecano 10 MeCO 9 OH 11 1 2 6 8 CN 3 7 5 4 Ocho estereoisómeros (cuatro parejas de enantiómeros): OH 1 H MeCO 2 3 H 6 H 4 O[1] C1(C2HH)C2(OC3H)[1] [2]H [1]MeCO 6 CN [3](C6HH)C1 C5(C4HH)C4(C3HH)[2] 2 C(NNN)[2] [1](OC1 H)C2 C3(C4CH)[2] 3 H[4] trans (2R) 1 H MeCO H[4] OH CN 2 OH 2 CN 3 H 6 (3R) 3 H 4 H H H MeCO 6 MeCO H 6 OH OH 2 H 3 4 CN 3 cis- (2R,3R) 1 2 H H H 6 CN 4 H COMe trans- (2S,3R) OH CN 2 OH 2 CN 3 H 4 H COMe trans-(2S,3S) trans- (2R,3S) 1 6 4 trans- (2R,3R) 1 1 H 3 H H 1 6 4 cis- (2S,3S) COMe H C4(C5HH)[3] 295 MeCO H OH OH 1 2 6 H 2 H H 3 4 CN 3 1 H COMe H 6 CN 4 cis- (2R,3S) cis- (2S,3R) 1,2,3-Trimetilciclobuteno Me Me Me Dos estereoisómeros (una pareja de enantiómeros): Me Me 3 3 H 2 1 Me H Me Me Me[3] 3 [2](C1HH)C4 1 2 Me Me[3] C2(C1CC)[1] [1](C1CC)C2 H[4] 3 C4(C1HH)[2] H[4] (3R) (3S) RESPUESTA 11 (1) Ácido 2-Amino-3-metilpentanoico Me CH3CH2 H H(Et) NH2 H2N CH CH CO2H (H)H2N CO2H(Me) H CO2H 2 3 Me Et (2R,3R) (2) 1-Cloro-2-metil-1,3-butadieno Me Cl Cl Me H CH CH2 H H H H (E) (3) 1-Etoxicarbonil-1,2-propadieno H H C H C C CO2Et (no tiene estereoisómeros) 296 (4) 1,2-Dimetilciclohexano H 6 1 Me Me Me 2 1 [2](CHH)C6 1 Me 2 3 H Me[3] H[4] H 2 [1](CCH)C1 C2(CCH)[1] Me[3] H H[4] (1S) trans-(1S,2S) C3(CHH)[2] (2S) (5) 1-Ciano-2-metil-2-vinilciclobutano 1 CN H CH2 CH H 2 2 [3](CHH)C4 1 1 Me Me CH CH2 H[4] 4 3 C(CCH)[2] C2(CCC)[2] [1](CCH)C1 C(NNN)[1] CN trans-(1S,2R) 2 C(HHH)[4] (1S) (2R) (6) 3-Cloro-9-hidroxi espiro[5,5]undecano Cl[3] Cl HO H [1]HO H H[2] H[4] (R) (7) 1,4-Dimetilciclohexano Me H 1 4 Me H Me Me H H trans (ópticamente inactiva; no es MESO) (8) 3-Amino-4-metil-3-nitro-1-hexen-5-ino C Me NO2 1 HC C CH C CH CH2 NH2 H2N Me C CH NO2 H CH CH2 C3(CHH)[3] Me 4 H2N CH H 3 CH CH2 NO2 (3S,4R) 297 (9) Ácido 2-amino-3-metilpentanoico H CH3CH2 CO2H NH2 Me Me NH2 3 CH CH CO2H Et HO2C 2 H 3 NH2 H NH2 2 Et Me (2S,3S) (10) 2,3-Diclorobutano Cl CH3 Cl Me Me H Cl Cl 2 CH CH CH3 3 Me H Cl Me 2 3 H Cl H (2R,3S) (MESO) RESPUESTA 12 n = 2 ; N = 2n = 4 ; N' = 0 OH CH3 2-Metilciclohexanol Cuatro estereoisómeros: dos parejas de enantiómeros. H Me Me 2 2 1 OH 1 trans-(1R,2R) 1 OH OH H H H H H 2 2 Me Me cis-(1R,2S) trans-(1S,2S) Cl H 1,3-Diclorociclopentano Tres estereoisómeros: una pareja de enantiómeros y una forma meso. H Cl 1 Cl 3 H trans (1R,3R) Cl 3 H 1 H Cl trans (1S,3S) 1 OH cis-(1S,2R) n = 2 ; N = 2(n-1) = 2 ; N' = 2(n-2)/2 = 1 Cl H Cl 1 H Cl 3 H cis (1S,3R) [forma MESO] 298 OH OH OH CH3 n = 3 ; N = 2n = 8 ; N' = 0 CH CH CH CHO 2,3,4-Trihidroxipentanal Ocho estereoisómeros: cuatro parejas de enantiómeros. CHO CHO 2 H 3 H 4 H HO H HO OH HO H H OH HO H H (2R,3R,4R) 2 3 HO 4 H OH HO H (2R,3S,4R) HO H CH3 (2R,3S,4S) CHO OH HO H OH HO HO H H H H OH CH3 (2S,3R,4S) Cl OH H H CH3 CH3 HO CHO H H H OH OH (2S,3R,4R) CHO HO OH OH H CH3 (2S,3S,4S) CHO CHO H CH3 CH3 H CHO OH CH3 (2S,3S,4R) (2R,3R,4S) n = 3 ; N = [2(n-1) - 2(n-1)/2] = 2 ; N' = 2(n-1)/2 = 2 Cl OH 2,5-Diclorociclopentanol Cuatro estereoisómeros: una pareja de enantiómeros (C2 no es estereogénico) y dos formas meso (C2 es pseudoasimétrico) H OH 1 Cl Cl 3 2 H (1R,3R) H OH Cl H 3 1 2 H H Cl H 1 H Cl 3 2 OH H (1S,2r,3R) [MESO] (1S,3S) [el carbono 2 no es estereogénico] HO Cl n = 3 ; N = 2n = 8 ; N' = 0 2-Bromo-4-metilciclopentanol OH Cl 1 H 3 2 H H (1S,2s,3R) [MESO] [el carbono 2 es pseudoasimétrico] Br CH3 Cl 299 Ocho estereoisómeros: cuatro parejas de enantiómeros. Me H OH 1 OH 3 Br 2 1 (1R,2R,3R) H H Br H 3 2 H H H (1R,2S,3R) Br Me (1S,2R,3S) OH Br CH3 Me H 1 2 H 3 2 Br OH H Br 1 3 2 H H H (1R,2S,3S) H 1 Me OH (1S,2R,3R) H 3 H Me H OH 3 2 Br OH 1 (1S,2S,3S) OH 1 2 H Me Br H 3 H H Me Me H 2 OH (1R,2R,3S) H 1 3 H Br (1S,2S,3R) OH CH CH CH CH3 n = 3 ; N = [2(n-1) - 2(n-1)/2] = 2 ; N' = 2(n-1)/2 = 2 3-Bromo-2,4-pentanodiol Cuatro estereoisómeros: una pareja de enantiómeros (C3 no es estereogénico) y dos formas meso (C3 es pseudoasimétrico) CH3 CH3 HO Br H 2 3 4 H H OH CH3 H H Br H Br OH HO H H CH3 CH3 (2S,4S) (2R,4R) [el carbono 3 no es estereogénico] CH3 OH H OH H H Br OH H OH CH3 CH3 (2S,3r,4R) [meso] (2S,3s,4R) [meso] [el carbono 3 es pseudoasimétrico] CH3 2 HO 1 3 OH n = 3 ; N = [2(n-1) - 2(n-1)/2] = 2 ; N' = 2(n-1)/2 = 2 2-Metil-1,3-ciclohexanodiol Cuatro estereoisómeros: una pareja de enantiómeros (C2 no es estereogénico) y dos formas meso (C2 es pseudoasimétrico) 300 OH H Me 3 OH 2 OH OH 1 1 H Me H H 2 H 3 OH H (1R,3R) (1S,3S) [el carbono 2 no es estereogénico] Cl 1 OH H OH H 2 OH 1 Me H 2 3 Me H (1S,2r,3R) [meso] OH 3 H (1S,2s,3R) [meso] [el carbono 2 es pseudoasimétrico] OH OH OH OH CH CH CH CH Cl n = 4 ; N = [2(n-1)] = 8 ; N' = 2(n-2)/2 = 2 1,4-Dicloro-1,2,3,4-tetrahidroxibutano Diez estereoisómeros: cuatro parejas de enantiómeros y dos formas meso. Cl HO H HO H 1 2 3 4 Cl H H OH H HO H OH HO HO H 1 2 3 4 HO H H H OH HO H H HO H OH HO OH HO H H OH H HO H H OH H (1S,2R,3S,4S) (1S,2R,3R,4S) Cl H H 2 3 4 H H Cl Cl Cl H Cl OH H H (1R,2S,3S,4S) HO H 1 H OH H (1R,2S,3R,4R) OH Cl Cl OH Cl H HO H H HO OH (1S,2R,3R,4R) Cl H OH H H Cl (1S,2S,3S,4S) Cl HO OH Cl (1R,2R,3R,4R) Cl H OH HO Cl Cl OH (1R,2S,3S,4R) Cl OH HO OH H OH H OH H OH OH HO H Cl Cl (1S,2R,3S,4R)[MESO] (1R,2R,3S,4S)[MESO] Br Cl CHOH CHOH CH CHOH CHOH Cl 3-Bromo-1,5-dicloro-1,2,4,5-tetrahidroxipentano n = 5; N = [2(n-1) - 2(n-1)/2] = 12 ; N' = 2(n-1)/2 = 4 301 Dieciséis estereoisómeros: seis parejas de enantiómeros y cuatro formas meso. Dos parejas de enantiómeros en los que C3 no es estereogénico: Cl Cl 1 HO H OH H H OH Br H Br H Br H H OH H HO 2 HO 3 H 4 H 5 H Cl Cl H OH HO OH HO Cl Cl (1R,2R,4R,5R) (1S,2S,4S,5S) H HO OH HO H H H OH H Br HO H H H OH Cl Cl (1S,2R,4R,5S) (1R,2S,4S,5R) Cuatro parejas de enantiómeros en los que C3 es asimétrico [prioridades: (RR)=(SS)>(RS)=(SR)]: H 1 HO 2 H 3 H 4 H 5 Cl Cl Cl OH H HO OH Br H H OH HO H OH HO H H OH HO H Cl 2 3 4 5 H H HO 1 H H H H OH OH H Cl H HO Br HO H H Br Cl (1S,2R,3S,4R,5R) (1R,2S,3R,4S,5S) H OH H Br H Cl HO Cl (1S,2R,3R,4R,5R) (1R,2S,3S,4S,5S) Cl H H Cl Cl OH HO OH HO H H Br Br H Br OH HO H H OH HO H H Cl Cl Cl H OH H OH HO H H OH HO OH HO Br H H Cl Cl (1R,2S,3S,4R,5R) (1S,2R,3R,4S,5S) H (1R,2S,3R,4R,5R) (1S,2R,3S,4S,5S) Cuatro formas meso en las que C3 es pseudoasimétrico: Cl H HO H HO H 1 2 3 4 5 Cl OH H Cl Cl OH H OH H OH H OH H H Br OH H HO H H Br Br H Br H HO H H OH H OH H OH H OH Cl (1S,2R,3r,4S,5R) H Cl (1S,2R,3s,4S,5R) Cl (1S,2S,3r,4R,5R) OH OH Cl (1S,2S,3s,4R,5R) 302 HO n = 4 ; N = [2(n-1)] = 8 ; N' = 2(n-2)/2 = 2 OH H3C CH3 2,3-Dimetil-1,4-ciclohexanodiol Diez estereoisómeros: cuatro parejas de enantiómeros y dos formas meso: H OH OH OH Me 1 2 H H 3 H H H 3 OH 2 Me H 3 OH 1 OH 2 H H H H 3 (1R,2S,3R,4R) OH H H 2 H Me 1 1 H H OH H 4 OH OH Me 3 Me Me 2 1 H H (1R,2S,3S,4R) OH H H H 2 H 4 OH 4 Me (1R,2S,3S,4S) (1S,2R,3R,4S) H 3 3 H OH Me 3 Me H 2 Me OH H H Me 1 (1S,2R,3S,4S) 1 H OH H 4 Me OH 1 2 Me Me 3 2 OH 4 (1S,2R,3R,4R) H H H H H OH 4 4 OH Me 1 (1S,2S,3S,4S) OH H Me Me Me (1R,2R,3R,4R) 1 H H 4 4 2 Me H 3 4 H Me (1S,2S,3R,4R) [meso] (1S,2R,3S,4R) [meso] RESPUESTA 13 La molécula no se puede dividir en dos mitades iguales y tiene dos átomos de carbono estereogénicos: C2 es asimétrico y C9 da lugar a isomería cis-trans: Me 9 n = 2 ; N = 2n = 4 ; N' = 0 2 Cl 2-Cloro-9-metil espiro[5,5]undecano Dos parejas de enantiómeros: cis-(2R) / cis-(2S) y trans-(2R) / trans-(2S) H Me 5 9 4 Cl 6 1 3 2 H cis-(2R) Cl[1] [3](CHH)C4 2 H[4] (2R) C6(CCC)[2] [2]H C(CHH)(CHH)[2] [1]Me C(CHH)(ClCH)[1] cis 303 H H 6 Me 3 2 1 Cl cis-(2S) H[4] [3](CHH)C4 C6(CCC)[2] 2 [2]H C(CHH)(CHH)[2] [1]Me C(CHH)(ClCH)[1] Cl[1] cis (2S) Me Cl 6 H 3 2 1 H trans-(2R) Cl[1] 2 [3](CHH)C4 C(CHH)(CHH)[2] [1]Me C6(CCC)[2] C(CHH)(ClCH)[1] [2]H H[4] trans (2R) Me 6 H H 3 2 1 Cl trans-(2S) H[4] [3](CHH)C4 C(CHH)(CHH)[2] [1]Me C6(CCC)[2] 2 C(CHH)(ClCH)[1] [2]H Cl[1] trans (2S) RESPUESTA 14 La molécula no se puede dividir en dos mitades iguales y tiene dos átomos de carbono estereogénicos: C3 es asimétrico y C4’ da lugar a isomería (Z)-(E): 4' C Br n = 2 ; N = 2n = 4 ; N' = 0 Et 3 Dos parejas de enantiómeros: (Z)-(3R) / (Z)-(3S) y (E)-(3R) / (E)-(3S) 5 C C H 4 3 Br C 2 (Z)-(3R) 4' H Et 304 H[4] [2](CCC)(CHH)C2 [2](CHH)C5 C4(CHH)(CHH)[3] 3 C C C 4' C 4' C 4' C 4' [1](BrCH)C3 Br[1] H[2] C(CHH)[1] (Z) (3R) 5 Br 4 3 C C C 4' H Et 2 H (Z)-(3S) Br[1] 3 [2](CCC)(CHH)C2 [2](CHH)C5 C4(CHH)(CHH)[3] C C [1](BrCH)C3 H[4] H[2] C(CHH)[1] (Z) (3S) 5 5 C C H 4 3 Br C 4' Et H 2 (E)-(3R) H[4] [2](CCC)(CHH)C2 [2](CHH)C5 C4(CHH)(CHH)[3] 3 C C [1](BrCH)C3 Br[1] C(CHH)[1] H[2] (E) (3R) 5 Br 4 3 H C C C 4' Et H 2 (E)-(3S) Br[1] 3 [2](CCC)(CHH)C2 C4(CHH)(CHH)[3] [2](CHH)C5 C C [1](BrCH)C3 H[4] C(CHH)[1] H[2] (E) (3S) RESPUESTA 15 La molécula no se puede dividir en dos mitades iguales y tiene tres átomos de carbono estereogénicos: C6 y C8 son asimétricos y C3 da lugar a isomería cis-trans: Me HO Me 3 C CH COMe 8 6 OH n = 3 ; N = 2n = 8 ; N' = 0




