ESTRUCTURAS DE LEWIS Cl Cl Cl
Anuncio
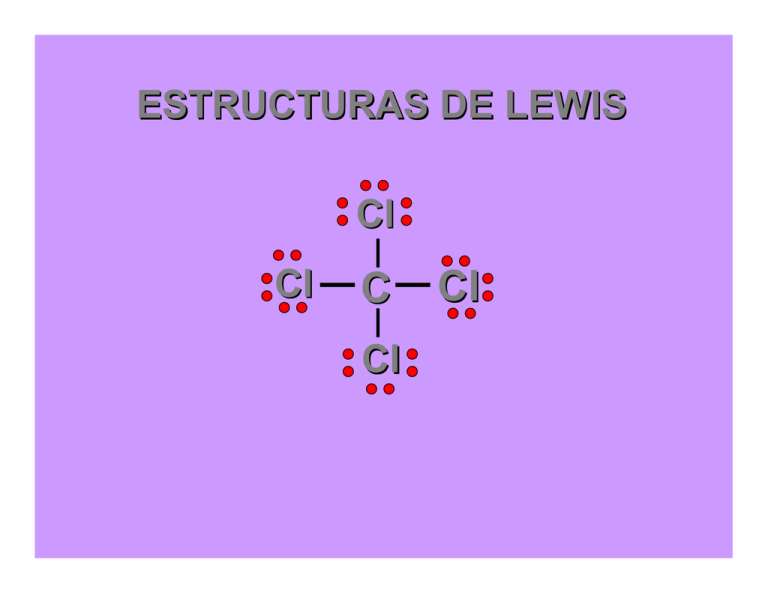
ESTRUCTURAS DE LEWIS Cl Cl C Cl Cl Las propiedades químicas de un elemento dependen de los electrones de la configuración electrónica externa de los átomos. Esos electrones más externos son llamados electrones de valencia. Una forma de representar esos electrones de valencia Es usar los símbolos (puntos) de Lewis. Por ejemplo, los símbolos de Lewis para el flúor se muestran debajo: F El flúor, del grupo 17 ( o 7A), tiene siete electrones de valencia indicados por los 7 puntos Dos átomos podrían combinarse para formar una molécula, y cuando lo hacen, una unión se forma entre ellos. La unión entre los átomos resulta de compartir los electrones. Este compartir electrones es llamado unión covalente. covalente Considérese la formación de la molécula de flúor: F F Cada átomo de flúor tiene 7 electrones de valencia. Cuando dos átomos forman una molécula comparten un par de electrones. De acuerdo con Lewis cuando los átomos se combinan para formar moléculas, lo hacen de tal forma que llenan sus orbitales de valencia. De esta manera los átomos obtienen una configuración electrónica estable equivalente a la del gas noble más cercano. Para los elementos del período 2, este hecho es denominado como regla del octeto. Para el hidrógeno, en el período 1, la configuración estable es un par de electrones. Para otros elementos, en el período 3 y superiores, el número de electrones que pueden acomodarse en los orbitales de valencia puede ser superior a 8. Los electrones de valencia que se encuentran involucrados entre los átomos se denominan pares ligantes. El resto de los pares de electrones se denominan pares solitarios o pares libres. F F ¿Cómo dibujar estructuras de LEWIS? 1- Sumar los electrones de valencia de todos los átomos. 2- Escribir los símbolos de los átomos para indicar cuales átomos están unidos entre sí y conectarlos con un enlace simple. 3- Completar los octetos de los átomos unidos al átomo central. 4- Colocar los electrones que sobren en el átomo central. 5- Si no hay suficientes electrones para que el átomo central tenga un octeto, probar con enlaces dobles o triples. Veámos como dibujar una estructura de Lewis. Tomaremos de ejemplo el tetracloruro de carbono Cl4C. En éste el carbono está en el centro rodeado de cuatro átomos de cloro. Cl Cl C Cl Cl El carbono tiene 4 electrones de valencia y cada cloro tiene 7 electrones de valencia. Así hay 4 + (4x7) = 32 electrones de valencia para acomodar entre los átomos. Formaremos una unión covalente entre el átomo de carbono central y cada átomo de cloro. Los electrones remanentes serán dispuestos como pares solitarios. Cl Cl Cl C Cl Cl C Cl Cl Cl UNIONES MÚLTIPLES Si dos átomos se mantienen juntos compartiendo un par de electrones se dice que están unidos por una unión simple. Sin embargo, en muchas moléculas, dos átomos comparten más de un par de electrones. Se dice de tales moléculas que poseen uniones múltiples. Si los átomos comparten dos pares de electrones, la unión covalente es una doble unión. Si los dos átomos comparten tres pares de electrones, entonces se ha formado una triple unión. CARGA FORMAL En algunos casos es posible dibujar varias estructuras de Lewis distintas para una misma sustancia. ¿Cómo decidimos cuál es la más adecuada?. Una estrategia consiste en calcular la carga formal de los átomos. Las cargas formales de los átomos en una representación de Lewis describe la distribución aproximada de los electrones en la molécula pero no representan las cargas reales de los átomos. La estructura de Lewis más estable será aquella en la que: (1) los átomos tengan la carga formal más cercana a cero y (2) las que poseen las cargas negativas sobre los átomos más electronegativos. La estructura de Lewis del ozono. ( 18 electrones de valencia) se muestra abajo. Vamos a determinar la carga formal, comenzando con el átomo de la izquierda. O O O Un átomo aislado de oxígeno tiene 6 electrones de valencia. En el ozono, el átomo en el circulo tiene 8 electrones. O O O Número de electrones de valencia del átomo 6 Número de electrones no ligantes 6 ½ Número de electrones ligantes 1 Carga formal -1 _ N C S _ N C S _ N C S ESTRUCTURA MÁS ADECUADA DEL IÓN TIOCIANATO NCS_ CARBONO, 4 - 4 = 0 NITRÓGENO, 5 – 6 – 1 = - 2 AZUFRE, 6 – 2 – 3 = + 1 N C S _ N C S _ N C S CARBONO, 4 - 4 = 0 NITRÓGENO, 5 – 4 – 2 = - 1 AZUFRE, 6 – 4 – 2 = 0 CARBONO, 4 - 4 = 0 NITRÓGENO, 5 – 2 – 3 = 0 AZUFRE, 6 – 6 – 1 = - 1 ESTRUCTURA DE LEWIS DEL AMONIACO 1- El átomo de nitrógeno es el átomo central. 2- Se cuentan todos los electrones de valencia, 5 electrones de N + (3 x 1) electrones de H = 8 electrones 3- Se forman enlaces entre el átomo central y los periféricos. Los electrones restantes se sitúan como pares libres (no enlazantes) para completar el octeto del nitrógeno H N H H Carga formal de nitrógeno, 5 - 2 - 3 = 0 ESTRUCTURA DE LEWIS DEL IÓN SULFITO 1- El átomo de azufre es el átomo central. 2- Se cuentan todos los electrones de valencia, 6 electrones de S + (3 x 6) electrones de O + 2 electrones del ión = 26 (13 pares de electrones) 3- Se forman enlaces simples entre el átomo central y los periféricos. Los electrones restantes se sitúan como pares libres (no enlazantes) para completar el octeto del azufre. 2- O S O O Carga formal de azufre, 6 - 2 - 3 = + 1 Carga formal de los oxígenos, 6 – 6 – 1 = -1 ESTRUCTURA DE LEWIS DEL CO2 1- El átomo de carbono es el átomo central. 2- Se cuentan todos los electrones de valencia, 4 electrones de C + (2 x 6) electrones de O = 16 (8 pares de electrones) 3- Se forman enlaces múltiples entre el átomo central y los periféricos para completar el octeto de los átomos. O C O Carga formal de carbono, 4 - 4 = 0 Carga formal de los oxigenos, 6 – 4 – 2 = 0 ESTRUCTURA DE LEWIS DEL SO2 1- El átomo de azufre es el átomo central. 2- Se cuentan todos los electrones de valencia, 6 electrones de S + (2 x 6) electrones de O = 18 (9 pares de electrones) 3- Se forman enlaces simples para completar el octeto de los átomos unidos al átomo central. 4- Se forman enlaces múltiples para que el átomo central tenga su octeto. O S O Carga formal del azufre, 6 – 2 – 3 = +1 Carga formal de los oxígenos, 6 – 6 – 1 = -1 6–4–2=0 ESTRUCTURAS DE RESONANCIA O S O O S O O S O O S O ESTRUCTURA DE LEWIS DEL IÓN SULFATO 6 electrones de S + (4 x 6) electrones de O + 2 electrones del ión = 32 (16 pares de electrones) 2- O O S O O Carga formal de azufre, 6 - 4 = + 2 Carga formal de los oxígenos, 6 – 6 – 1 = -1 ESTRUCTURA DE LEWIS DEL IÓN SULFATO r u t c u Estr a má !!! e l b a b o r sp O 2- O S O O Carga formal de azufre, 6 - 6 = 0 Carga formal de los oxígenos con enlace múltiple, 6 – 4 – 2 = 0 Carga formal de los oxígenos con enlace simple: 6 – 6 – 1 = -1 EXCEPCIONES A LA REGLA DEL OCTETO 1- Moléculas con un número impar de electrones. En moléculas como el ClO2, NO y NO2 el número de electrones es impar. Por lo tanto es imposible aparear estos electrones y tampoco puede lograrse un octeto en torno a todos los átomos. N O N O EXCEPCIONES A LA REGLA DEL OCTETO 5 electrones del nitrógeno + (2 x 6) electrones de O = 17 electrones O N O Los átomos que tienen uno o más electrones sin aparear son atraídos por un campo magnético y se denominan paramagnéticos O N O O N O El NO2 a 0 oC se dimeriza en N2O4 y el fenómeno se revierte. EXCEPCIONES A LA REGLA DEL OCTETO 2- Moléculas en las que un átomo tiene menos de un octeto Esta situación se encuentra en compuestos que tienen boro o berilio. Ej: BF3, trifluoruro de boro F B F F EXCEPCIONES A LA REGLA DEL OCTETO 3- Moléculas en las que un átomo tiene más de un octeto Esta situación se encuentra en algunas moléculas o iones en las que hay un elemento central que pertenece al tercer período o superior. Ej: PCl5, AsF6-, ICl4-, XeF2,PO42-. Cl Cl Cl P Cl Cl ESTRUCTURA DE LEWIS DEL ÁCIDO H2SO4 6 electrones de S + (4 x 6) electrones de O + 2 electrones del ión = 32 electrones O H O S O O H ESTRUCTURA DE LEWIS DEL IÓN CARBONATO 4 electrones de C + (3 x 6) electrones de O + 2 electrones del ión = 24 2- O C O O 2- O C O O O C O O 2- ESTRUCTURA DE LEWIS DEL H2CO3 4 electrones de C + (3 x 6) electrones de O + 2 electrones del H = 24 ES R e se o p NO O !! A I C NAN O C O H O H ESTRUCTURA DE LEWIS DE COMPUESTOS IÓNICOS HIDRÓXIDOS _ 2 O H Ca2+ OXOSALES, OXOSALES son sales oxigenadas formadas por retículos cristalinos que contienen cationes metálicos y aniones formados por un no metal y oxígeno. Para escribir la estructura de Lewis de una oxosal debemos tener en cuenta que el metal cede electrones transformándose en un catión y estos electrones, a su vez generan un anión. O Na+ O S O O 2- Na+ ESTRUCTURA DE LEWIS DEL CLORATO DE POTASIO _ O O Cl O K+ SALES IÓNICAS NO OXIGENADAS _ F _ Ca2+ F _ Cl Na+ _ Cl Ca2+ _ Cl





