Sesion 8 - Página Personal de Jose Luis Mesa Rueda
Anuncio
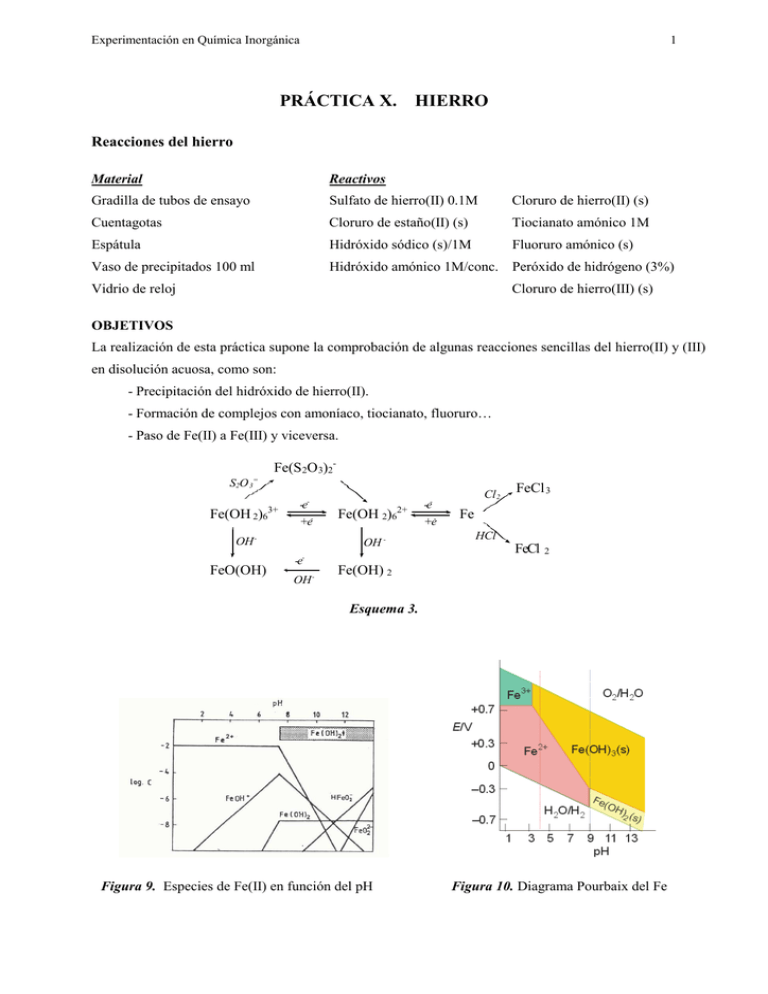
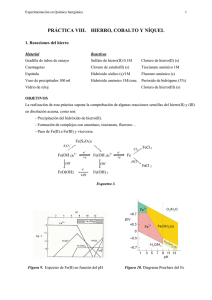
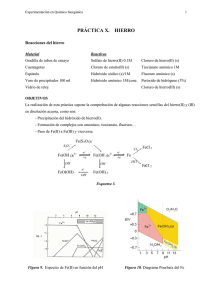
Experimentación en Química Inorgánica 1 PRÁCTICA X. HIERRO Reacciones del hierro Material Reactivos Gradilla de tubos de ensayo Sulfato de hierro(II) 0.1M Cloruro de hierro(II) (s) Cuentagotas Cloruro de estaño(II) (s) Tiocianato amónico 1M Espátula Hidróxido sódico (s)/1M Fluoruro amónico (s) Vaso de precipitados 100 ml Hidróxido amónico 1M/conc. Peróxido de hidrógeno (3%) Vidrio de reloj Cloruro de hierro(III) (s) OBJETIVOS La realización de esta práctica supone la comprobación de algunas reacciones sencillas del hierro(II) y (III) en disolución acuosa, como son: - Precipitación del hidróxido de hierro(II). - Formación de complejos con amoníaco, tiocianato, fluoruro… - Paso de Fe(II) a Fe(III) y viceversa. Fe(S 2O 3)2S2O 3= Fe(OH 2)63+ -e+e- OH - FeO(OH) Fe(OH 2)62+ OH - -eOH - -e+e- Cl 2 FeCl 3 Fe HCl FeCl 2 Fe(OH) 2 Esquema 3. Figura 9. Especies de Fe(II) en función del pH Figura 10. Diagrama Pourbaix del Fe Experimentación en Química Inorgánica 2 PROCEDIMIENTO 1. Preparar una disolución de sulfato de hierro(II) y utilizando 3 ó 4 gotas, añadir: a) Gota a gota hidróxido sódico 1M hasta la aparición de un precipitado. Adicionar una o dos lentejas de hidróxido sódico hasta la redisolución del precipitado, y posteriormente unas gotas de peróxido de hidrógeno. b) Repetir el ensayo anterior empleando hidróxido amónico 1 M en lugar de sosa. 2. Sobre una disolución de cloruro de hierro(III), preparada con dos microespátulas de la sal en 2 ó 3 mL de agua, añadir dos gotas de tiocianato amónico 1M. Dividir la disolución resultante en dos partes: a) Añadir un poco de fluoruro amónico. b) Añadir cloruro de estaño(II). Calentar. PREGUNTAS 1. Escribe todas las reacciones que tienen lugar. Describe todo lo que hayas observado. 2. ¿Es anfótero el hidróxido de hierro(II)?. 3. ¿Qué función desempeña el cloruro de estano(II) en el ensayo 2a.?. 5.4. Síntesis del oxalato de hierro(II) dihidratado: Fe(C2O4).2H2O Material Reactivos Vasos de precipitados Sulfato de hierro(II) y amonio (s) : (NH4)2[Fe(H2O)6](S04)2 Probeta Ácido sulfúrico (2M) (l) Sistema de filtración a vacío (Kitasato)con Ácido oxálico (s) placa filtrante Agitador magnético Procedimiento : Disolver sulfato de hierro(II) y amonio, (NH4)2[Fe(H2O)6](S04)2, (4 g) en 12.5 mL de agua destilada que ha sido previamente acidificada con aproximadamente 0.5 mL de ácido sulfúrico 2M. Añadir a la disolución resultante otra disolución de ácido oxálico (2.5 g en 15 mL de agua destilada) y hervir mientras se agita. Filtrar el precipitado amarillo resultante a vacío y lavarlo varias veces con agua caliente. Finalmente, lavar con acetona y secarlo en corriente de aire. Calcular el rendimiento de la reacción. Experimentación en Química Inorgánica 3 PRÁCTICA XI. COBALTO Reacciones del cobalto Material Reactivos Gradilla de tubos de ensayo Cloruro de cobalto(II) Cloruro de mercurio(II) 0.1M Cuentagotas Hidróxido sódico (s) /1M Fluoruro amónico (s) Papel indicador Peróxido de hidrógeno (3%) Nitrito potásico (s) Espátula Hidróxido amónico 1M y conc. Acido acético 2M Vidrio reloj Tiocianato amónico (s) Cloruro sódico (s) Acetona Eter etílico OBJETIVOS Verificar el comportamiento en disolución acuosa de los iones Co(II) y Co(III), mediante: - Precipitación de los hidróxidos - Formación de tiocianocomplejos y su estabilidad - Formación de complejos amoniacales, nitrocomplejos y clorocomplejos Figura 11 . Diagrama Pourbaix del cobalto CoCl 42Cl - Co(OH 2)63+ -e+e- OH - Co(OH 2)62+ NH 3 Co(NH 3+ 3)6 O2 Co(NH H+ OH - Co(OH) 42- Co(OH) 2 O2 2+ 3)6 Esquema 4. Reacciones del cobalto CoO(OH) Experimentación en Química Inorgánica 4 PROCEDIMIENTO Utilizar una disolución de cloruro de cobalto(II) 1M. 1. Añadir gota a gota una disolución de hidróxido sódico 1M. ¿Se redisuelve el precipitado formado con exceso de reactivo?. Probar con hidróxido sódico sólido. Adicionar peróxido de hidrógeno. 2. Repetir el ensayo anterior con hidróxido amónico, sin adicionar H2O2. 3. Añadir nitrito potásico sólido y acidular con ácido acético 2M. 4. Añadir cloruro sódico y calentar fuertemente. 5. (En vitrina) Disolver en aproximadamente 25 mL de agua destilada 100 mg de CoCl2, 300 mg de tiocianato amónico sólido y 210 mg de HgCl2. Calentar hasta ebullición. Filtra a vacío el sólido azul, lavar varias veces con agua y secar en corriente de aire, y posteriormente en estufa. Calcular el rendimiento de la reacción. PREGUNTAS 1. Escribe todas las reacciones que tengan lugar en las diferentes pruebas relacionándolas con las observaciones realizadas en el desarrollo de las mismas. 2. ¿Es anfótero el hidróxido de Co(II)?. 3. Formular el compuesto que se forma en el ensayo 5. 4. ¿Dequé color son los complejos tetraédricos de Co(II)?. Experimentación en Química Inorgánica 5 PRÁCTICA XII. NÍQUEL Reacciones del níquel Material: Reactivos Pinza de madera Hidróxido sódico (s)/1M Ácido clorhídrico 1M Papel indicador Hidróxido amónico (s)/1M Sulfato o cloruro de níquel(II) Tubos de ensayo dimetilglioxima OBJETIVOS Verificar algunas reacciones sencillas del Ni(II), en disolución acuosa, como: - Intervalo de pH en el que precipita el hidróxido. - Formación y estabilidad de los complejos que forma con dimetilglioxima. NiCl 42Cl - Ni(OH 2)63+ CO ∆ - Ni -e Ni(OH 2)62+ H+ Ni(OH) OH - 2 NH 3 Ni(NH 3)62+ Esquema 5. Reacciones del níquel PROCEDIMIENTO Utilizar una disolución de sulfato o cloruro de níquel(II). 1. Examinar el efecto del hidróxido sódico 1M y del hidróxido amónico 1M. Probar también con ambos reactivos concentrados. 2. Investigar el efecto de la dimetilglioxima a diferentes pH (HCl 1M, H2O, NaOH 1M). Dimetilglioxima (DMG) [Ni(DMG)2] Experimentación en Química Inorgánica PREGUNTA 1.- Escribe todas las reacciones que tienen lugar en base a las observaciones realizadas. 2.- ¿Es anfótero el hidróxido de Ni(II)?. 3.- El complejo de Ni(II) con DMG es aniónico, catiónico o neutro?. 6