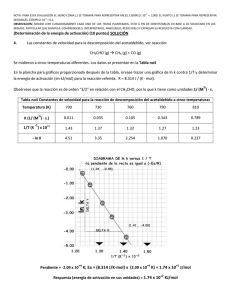
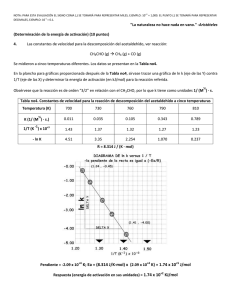
VELOCIDAD DE REACCION
Anuncio

VELOCIDAD DE REACCION 1. Señalar las proposiciones correctas referentes a la velocidad de una reacción química: a) Se puede expresar en las unidades mol-1·s-1. Solución. Concentración mol l Falso. Sus unidades son = = mol ⋅ l −1 ⋅ s −1 Tiempo s b) Se puede expresar en las unidades mol·l-1·s-1. Solución. Verdadero. c) Se puede expresar en las unidades mol-1·l·s-1. Solución. Falso. La unidades de la velocidad son concentración por unidad de tiempo, y las de concentración son masa por unidad de volumen, que no corresponden a mol−1·l. d) Las unidades de su expresión dependen de la ecuación de la velocidad. Solución. Falso. Las unidades de la velocidad no dependen en absoluto de la ecuación integrada de la velocidad, de esta expresión dependen las unidades de la constante de velocidad. e) Su valor numérico es constante durante todo el tiempo que dure la reacción. Solución. Falso. La velocidad de reacción directa empieza siendo máxima y va disminuyendo a medida que transcurre la reacción, ocurre lo contrario con la velocidad de reacción inversa, empieza siendo nula y va aumentando a medida que transcurre la reacción. f) Su valor numérico depende de la temperatura a la que se realice la reacción. Solución. Verdadero. La velocidad de una reacción depende de la temperatura a través de la constante de velocidad según la ecuación de Arrehenius: − Ea k = A ⋅ e RT donde se puede observar que la velocidad es directamente exponencial a la temperatura. Si aumenta la temperatura, aumenta la velocidad de reacción. También se puede justificar por el aumento en la energía cinética de las partículas que forman el sistema, y por tanto el aumento de la frecuencia de los choques efectivos(Teoría de colisiones) 2. Señalar las proposiciones correctas: a) La cte. de velocidad, k, de cualquier reacción química, puede expresarse siempre en las unidades mol-1·l·s-1 Solución. Falso. Las unidades de la constante dependen del orden total de la reacción, y deben cuadrar el análisis dimensional de la ecuación integrada de velocidad. ( ) Dim(v ) = Dim k ⋅ A ⋅ ... α b) Las unidades de k dependen de la ecuación de la velocidad. Solución. Verdadero. Dependen del orden total de la reacción. mol ⋅ l −1 ⋅ s −1 [v] [k ] = = = mol1− n ⋅ l n −1 ⋅ s −1 n n 1 − Concentració mol ⋅ l [ ] ( ) c) La cte. de velocidad conserva el mismo valor numérico durante toda la reacción. Solución. Verdadero. El valor numérico de la constante de velocidad se mantiene durante el transcurso de la reacción, lo que varia es el valor de la velocidad. d) El valor numérico de la k es independiente de la temperatura a la que se realice la reacción. Solución. Falso. Según la ecuación de Arrhenius, − Ea k = A ⋅ e RT la constante es función directa y exponencial de la temperatura. El orden total de la reacción química es siempre igual a la suma de los coeficientes estequiométricos de los reactivos. Solución. Falso. Solo para reacciones elementales, para los demás tipos de reacciones se deben determinar de forma experimental e) f) El orden total de cualquier reacción química es siempre un número entero. Solución. Falso. Puede ser valores enteros o fraccionarios. 3. La velocidad de una cierta reacción química, en fase gaseosa, esta relacionada con la concentración de las sustancias reaccionantes, A y B, por la ecuación: v = k·[A][B]. Sin variar las cantidades absolutas de A y B, se cambia el recipiente de reacción por otro cuyo volumen es la mitad del primitivo. ¿ Variara su velocidad?. Solución. Si, en fase gaseosa la concentración depende del volumen. Si disminuimos el volumen aumentamos la concentración y por tanto aumenta la velocidad de reacción. Si el volumen se diminuye a la mitad, la concentración se duplica. n n n Si : A = A : A ′ = A = 2 ⋅ A = 2 ⋅ A operando igual para B: B ′ = 2 ⋅ B V V V 2 planteando la ecuación integrada de velocidad para la nuevas condiciones: v ′ = k ⋅ A ′ ⋅ B ′ = k ⋅ 2 A ⋅ 2 B = 4k ⋅ A ⋅ B = 4 v se obtiene la relación pedida, si disminuimos el volumen a la mitad la velocidad se cuadruplica. 4. De las siguientes proposiciones referentes a la energía de activación, señalar las que considere correctas: a) En general es pequeña en reacciones exotérmicas y grande en las endotérmicas. Solución. Falso. No depende en absoluto de la entalpía de la reacción. b) Es independiente de la variación de Entalpía de la reacción. Solución. Verdadero. Depende fundamentalmente de la naturaleza de los reactivos (tipo de enlace,...) c) En general se reduce a la mitad al elevar 10 ºC la temperatura. Solución. Falso. La energía de activación no depende de la temperatura sino más bien de la naturaleza de los reactivos, si bien es cierto que al aumentar la temperatura se aumenta la energía de las partículas y por lo tanto es más fácil que sus choques alcancen el valor de activación. d) En general varía notablemente al introducir un catalizador. Solución. Verdadero. Es la función elemental de los catalizadores, modificar la energía de activación para de esta forma aumentar o disminuir la velocidad de la reacción. e) La energía de activación de la reacción directa es siempre menor que la de la reacción inversa. Solución. Falso. Depende de la entalpía de la reacción. E a (d ) = E a (i ) + ∆H R Si la reacción es endotérmica (∆H > 0 ) y por lo tanto Ea (d) > Ea(i) Si la reacción es endotérmica (∆H < 0) y por lo tanto Ea (d) < Ea(i) 5. La reacción de descomposición del bromo etano en etileno y bromuro de hidrogeno tiene una variación de Entalpía de 18 Kcal., y su energía de activación es de 54 Kcal. Calcúlese la energía de activación de la reacción inversa. Solución. Teniendo en cuenta la relación: E a (d ) = E a (i ) + ∆H R sustituyendo. 54 Kcal = Ea(i) + 18 Kcal despejando la energía de activación inversa: Ea(i) = 36 Kcal 6. de las siguientes proposiciones referentes a la cte. de velocidad, k, de la reacción señale las correctas: a) El valor de k aumenta con la temperatura. Solución. Verdadero. Según la ecuación de Arrhenius, − Ea k = A ⋅ e RT la constante es función directa y exponencial de la temperatura. b) El aumento de la cte. con la temperatura se debe principalmente a que al aumentar la temperatura aumenta mucho el número de choques entre las moléculas. Solución. Verdadero. Al aumentar la temperatura, se aumenta la energía cinética de las partículas constituyentes del sistema produciendo dos efectos, aumenta su velocidad, y por tanto disminuye el volumen efectivo por lo que aumenta la probabilidad de choque, por otro lado al tener mayor energía cinética las partículas que producen el choque, este puede liberar más energía y alcanzar el nivel de activación c) El valor de k aumenta siempre con la concentración de las sustancias reaccionantes. Solución. Falso. La constante solo de velocidad es función únicamente de la temperatura y de la naturaleza de los reactivos. d) El valor de k varía notablemente al introducir un catalizador en el medio de reacción. Solución. Verdadero. El uso de catalizador modifica el valor de la energía de activación, y como pone de manifiesto la ecuación de Arrhenius, la constante es inversamente exponencial a Ea. k = A⋅e − Ea RT e) El conocimiento de los valores de k a varias temperaturas permite calcular el calor de reacción. Falso. La constante de velocidad no está relacionada con la entalpía de la reacción. El conocimiento de los valores de k a varias temperaturas permite calcular la energía de activación de la reacción. Solución. Verdadero. E E E Ea 1 1 − a − − a − − a RT1 k 1 k1 = A ⋅ e RT1 RT2 R T2 T1 : e e = = E − a k2 RT2 k2 = A⋅e f) tomando logaritmos neperianos en ambos miembros de la igualdad k E 1 1 − Ln 1 = a k 2 R T2 T1 expresión que permite despejar el valor de Ea conocidos dos valores de la constante a diferentes temperaturas 7. Para la reacción de formación del yoduro de hidrogeno a 400ºC, a partir de sus elementos, la energía de activación es de 41 Kcal/mol. Calcular el aumento que experimentará la velocidad de dicha reacción al elevar la temperatura desde 400 a 500ºC. Solución. Para la reacción: H 2 + I 2 ↔ 2HI la ecuación integrada de velocidad es: v = K⋅ H2 α I2 β Si manteniendo las concentraciones constantes se realiza la reacción a dos temperaturas diferentes, la expresión de la velocidad para cada temperatura será: v1 = k 1 ⋅ H 2 v2 = k2 ⋅ H2 α α I2 I2 β β dividiendo una entre otra para encontrar la relación entre ellas: v1 k 1 ⋅ H 2 = v2 k ⋅ H 2 2 α I2 α I2 β β : simplificando : v1 k 1 = v2 k 2 sustituyendo las constantes por la expresión de Arrhenius: − Ea Ea 1 1 1 1 − v1 e RT1 R T2 T1 = = e E v2 − a RT2 e sustituyendo por los datos del enunciado(T1 = 673 K, T2 = 773 K) ( ) 41000 cal⋅mol −1 − −1 −1 v1 = e 1'987 (cal⋅mol K ) 773(K ) 673(K ) = 0'02 ⇒ v 2 = 50v1 v2 8. Una reacción del tipo A(g) → B(g) se han medido las velocidades cuando la concentración de A era 0,10 M. y cuando era 0,040 M. ¿Cual será el orden de la reacción si la relación entre la velocidad primera (a 0,10 M) y la segunda (a 0,040 M) resulto ser de 6,25?. Solución. Para la reacción A(g) → B(g), la ecuación integrada de velocidad es: v = k⋅ A α aplicada a cada una de la experiencias: α • Experiencia 1: v 1 = k ⋅ 0'1 • Experiencia 2: v 2 = k ⋅ 0'04 α Dividiendo para establecer la relación entre ellas: α α k ⋅ 0'1 v1 v1 0'1 = : Simplifica ndo : = v 2 k ⋅ 0'04 α v 2 0'04 operando y sustituyendo por la relación de velocidades dada 6'25 = 2'5 α despejando mediante logaritmos neperianos: Ln 6'25 =2 Ln 2'5 el orden total de la reacción es 2, y su ecuación integrada es de la forma: Ln 6'25 = α ⋅ Ln 2'5 ⇒ α = v = k⋅ A 2 9. De las siguientes proposiciones, referentes a la adición de un catalizador positivo a un sistema reaccionante, señale las que considere correctas: a) Hace más negativo el valor la variación de Entalpía de la reacción, con lo que esta es más exotérmica y por lo tanto más rápida. Solución. Falso. La adición de catalizador solo modifica la energía de activación de la reacción, no varía ninguna función de estado de estado de la reacción. La variación de entalpía (∆H) en la reacción es la misma tanto si se usa catalizador o no, puesto que el catalizador, al permanecer inalterable en la reacción, no puede comunicar o sustraer energía al sistema. ∆HR = Σ ∆HPROD − Σ ∆HREACT b) Hace más negativo el valor de la variación de la energía libre de Gibbs de la reacción, con lo que se hace más espontánea y por lo tanto más rápida. Solución. Falso. Los catalizadores no son capaces de provocar reacciones que sin ellos no hubieran tenido lugar, su papel se reduce a modificar la velocidad de reacción. La variación de energía libre de Gibbs (∆G) en la reacción es la misma tanto si se usa catalizador o no, puesto que el catalizador, al permanecer inalterable en la reacción, no puede comunicar o sustraer energía al sistema. ∆HR = Σ ∆HPROD − Σ ∆HREACT Por tanto: • Si la reacción es espontánea (∆G<0), lo será con catalizador o sin él. • Si el proceso no es espontáneo (∆G>0), el catalizador no puede convertirlo en espontáneo. Disminuye la energía de activación, con lo que aumenta el nº de choques moleculares eficaces y con ello la velocidad de reacción. Solución. Verdadero. Al disminuir la energía de activación, será más fácil que un choque llegue a producir la energía de activación. Actualmente se supone que el catalizador toma parte activa en la reacción, originando un compuesto activado distinto, más lábil y menos energético. c) d) Aumenta la velocidad de la reacción directa y también la velocidad de la reacción inversa. Solución. Verdadero. Disminuye ambas. e) Aumenta únicamente la velocidad de la reacción directa. Solución. Falso. Modifica las dos por igual, aumentando o disminuyendo ambas en la misma cantidad. f) Modifica el estado de equilibrio del sistema. Falso. El equilibrio se alcanza cuando ∆G = 0, como la variación de energía libre no varia con el empleo de catalizadores, el equilibrio tampoco. 11. ¿Qué se entiende por velocidad de reacción? ¿En qué unidades se mide? Solución. Es la derivada respecto del tiempo, de la concentración de cualquier reactivo o producto, dividida entre su respectivo coeficiente estequiométrico y convertida en número positivo. Sus Unidades son: mol · l−1 · s−1. 12. ¿Qué diferencia existe entre molecularidad y orden de una reacción? Solución. Es un hecho experimental que en la mayoría de las reacciones químicas la velocidad de reacción es directamente proporcional al producto de las concentraciones de los reactivos elevadas a coeficientes enteros o fraccionarios. Se llama orden total de reacción a la suma de los exponentes a que están elevadas las concentraciones en la ecuación integrada de velocidad. Ejemplo: A + B → productos α β α ≡ Orden parcial de rección respecto de A v = k⋅ A B : β ≡ Orden parcial de rección respecto de B Orden Total (n) = + Molecularidad de una reacción es el número de moléculas necesarias para que con su colisión simultanea se origine el complejo activado, y por tanto tenga lugar la reacción. 13. A una cierta temperatura la constante de la velocidad correspondiente a la reacción H2 + F2 ↔ 2HF vale K=7,5 mol−1·1·s−1. Calcular la velocidad de formación del fluoruro de hidrógeno en un momento en que las concentraciones de hidrógeno y flúor son, respectivamente, 0,1 moles/1 y 0,2 moles/l. Solución: Teniendo en cuenta las unidades de la constante, la reacción es de orden 2. −1 −1 [k ] = [Velocidad] n = mol ⋅ l ⋅ sn = mol −1 ⋅ l ⋅ s −1 ⇒ n = 2 [Concentración ] mol ⋅ l −1 por lo que su ecuación integrada de velocidad es: v = 7'5 ⋅ [A ]⋅ [B] sustituyendo las concentraciones por su valores: [ ] v = 7'5 ⋅ [0'1]⋅ [0'2] = 0'15 mol −1 ⋅ l ⋅ s −1 14. En ciertas condiciones la velocidad de formación del agua viene dada por la ecuación: V = K [H2]2· [O2] Indicar: a) El orden de la reacción. Solución. El orden total de reacción es suma de los exponentes a que están elevadas las concentraciones en la ecuación integrada de velocidad. n=2+1=3 b) Las unidades de la constante de la velocidad K. Solución. −1 −1 [k ] = [Velocidad] 3 = mol ⋅ l ⋅ s3 = mol −2 ⋅ l 2 ⋅ s −1 [Concentración ] mol ⋅ l −1 [ ] 15. En una reacción aA + bB (productos, estudiada expimentalmente en el laboratorio, se observa que si se duplica la concentración inicial de A, manteniendo constante la de b, la velocidad de reacción queda multiplicada por 8, mientras que si triplica la concentración de B, manteniendo constante la de A, la velocidad de reacción también se triplica. Calcular, basándose en estos datos, el orden de reacción. Solución. La ecuación integrada de velocidad es de la forma: v 1 = k ⋅ [A ]α [B]β Si se duplica la concentración de A manteniendo constante la de B, la ecuación integrada queda de la forma: v 2 = k ⋅ [2A ]α [B]β dividiendo la segunda entre la primera v 2 k ⋅ [2A ]α [B]β = v1 k ⋅ [A ]α [B]β simplificando y teniendo en cuenta la relación entre las velocidades (v2 = 8v1 ) 8 = 2α ⇒ α = 3 Si se triplica la concentración de A manteniendo constante la de B, la ecuación integrada queda de la forma: v 3 = k ⋅ [A ]α [3B]β dividiendo la tercera entre la primera v 3 k ⋅ [A ]α [3B]β = v1 k ⋅ [A ]α [B]β simplificando y teniendo en cuenta la relación entre las velocidades (v2 = 3v1 ) 3 = 3β ⇒ β = 1 El orden de reacción es la suma de + n=3+1=4 y la ecuación integrada queda de la forma: v = k ⋅ [A ]3 [B] 16. La reacción A + B → AB es de primer orden respecto a A y a B. Cuando la concentración de A es 0,2 M y la de B 0,8 M, la velocidad de formación de AB es de 5’6 · 10−3 mol ·1−1 ·s−1. a) Calcular el valor de la constante de velocidad. Solución. Por ser una reacción de primer orden especto de A y B, su ecuación integrada es de la siguiente forma: v = k⋅ A ⋅ B sustituyendo los datos del enunciado: 5’6 · 10−3 mol ·1−1 ·s−1 = k · 0’2 mol·l−1·0’8 mol·l−1 despejando el valor de k k = 3,5 · 10−2 mol−1 ·l·s−1 b) ¿Cuánto valdrá la velocidad de reacción en el momento en que [A]=0’1 moles/l y [B] =0’4 moles/l? Solución. Conocido el valor de la constante, la ecuación integrada de velocidad queda de la forma: v = 3'5 × 10 −2 ⋅ A ⋅ B para las concentraciones propuestas, la velocidad será: v = 3'5 × 10 −2 ⋅ 0'1 ⋅ 0'4 = 1'4 × 10 −3 mol ⋅ l −1 ⋅ s −1 17. Supongamos una reacción de primer orden: A→B + C. Si en el instante inicial [A]= 2 moles/l al cabo de 20 segundos [A]=1 mol/l, ¿cuánto valdrá la concentración de A al cabo de un minuto? Solución: Cada 20 segundos se rebaja a la mitad la concentración de reactivo por lo que al cabo de 40 segundos la concentración habrá vuelto a rebajarse a la mitad y a los 60 otra vez, por lo que su concentración será de 0’25 mol·l−1 18. Supongamos la reacción A→ B + C. La concentración de A varía con tiempo de la forma siguiente: [A] (moles/l) TIEMPO 0,50 0 0,48 5 0,41 10 0,30 15 a) ¿Cuál es la velocidad media de reacción en los primeros cinco segundos? Solución. Se define la velocidad media respecto del reactivo A como: − 1 ∆ A − 1 A(t = 5) − A(t = 0 ) 0'48 − 0'50 = ⋅ ⋅ =− = 4 × 10 −3 mol ⋅ l −1 ⋅ s −1 vm = a ∆t 1 5−0 5 b) ¿Y entre los segundos 5 y 15? Solución. − 1 ∆ A − 1 A(t = 15) − A(t = 5) 0'30 − 0'48 ⋅ = ⋅ =− = 1'8 × 10 − 2 mol ⋅ l −1 ⋅ s −1 vm = a ∆t 1 15 − 5 10 19. Una reacción exotérmica ¿se verificará a elevada velocidad? Razonar la respuesta. Solución. No tiene porque. La velocidad de una reacción es función de la energía de activación, a mayor energía de activación menor velocidad y viceversa, no siendo función de la entalpía de la reacción. 20. ¿Podrá darse el caso de dos reacciones, una exotérmica y otra endotérmica, que tengan la misma energía de activación? Solución. Si. 21. Representar en un diagrama entálpico el camino de una reacción endotérmica rápida y de otra exotérmica que sea más lenta que la anterior. 22. Definir los conceptos de energía de activación y complejo activado. Solución. Energía de activación, es la energía que deben ganar los reactivos para alcanzar el complejo activado y de es forma queden rotos los enlaces que unen sus átomos o grupos atómicos, quedando estos libres 23. Una sustancia A se descompone según una reacción de segundo orden. A 600 K el valor de la constante de velocidad es K =0’55 mol−1 ·l · s−1. a) ¿Cuál es la velocidad de descomposición a esta temperatura si [A]=3·10−3 moles/l? Solución. La ecuación integrada de velocidad para T = 600 K tiene la forma: v = 0'55 ⋅ A 2 si la concentración de [A] = 3·10−3 moles/l, la velocidad será: v = 0'55 ⋅ 3 ⋅10 −3 2 = 4'95 ⋅10 −6 mol ⋅ l −1 ⋅ s −1 b) Si a 625 K, k = 1’50 mol−1·l·s−1, ¿cuál es la energía de activación de la reacción en el intervalo de temperaturas considerado? Solución. La expresión de la constante para T = 600 K es: K (T = 600) = A ⋅ e La expresión de la constante para T = 625 K es: − Ea 600 R − Ea 625R = 0'55 = 1'50 K (T = 625) = A ⋅ e dividiendo una entre otra se encuentra el valor de la energía de activación. A⋅e − − Ea 600 R Ea Ea = Ea Ea 1 1 Ea − − − − − − 0'55 : e 600R 625R = 0'367 : e R 600 625 = 0'367 : e 15000R = 0'367 1'50 A ⋅ e 625R Tomando logaritmos neperianos se despeja Ea. − Ea Ea = −1'003 : R = 8'31 J ⋅ mol −1 ⋅ K −1 : E a = 125061 J ⋅ mol −1 Ln e 15000R = Ln(0'367 ) : − 15000R Ea = 125 kJ·mol−1 ( ) 24. ¿Cuál es la energía de activación de una reacción cuya velocidad se duplica al pasar de 40º C a 50º C? Solución. Al no decir nada sobre las concentraciones se supone que a ambas temperaturas es la misma, por lo que la relación entre la velocidades es la misma que entre las constantes α α v(T = 313 K ) = K (T = 313 K )· A ⋅ ... v(T = 313 K ) K (T = 313 K )· A ⋅ ... = : α v(T = 323 K ) = K (T = 323 K )· A ⋅ ... v(T = 323 K ) K (T = 323 K )· A α ⋅ ... v(T = 313 K ) K (T = 313 K ) 1 = = v(T = 323 K ) K (T = 323 K ) 2 La expresión de la constante para T = 600 K es: K (T = 313) = La expresión de la constante para T = 625 K es: −Ea 313 A⋅e R −Ea K (T = 323) = A ⋅ e 323R dividiendo una entre otra se encuentra el valor de la energía de activación. −Ea −Ea 1 1 −10 E a − K (T = 313) A ⋅ e 313R 1 R 313 323 = e = = e 101099R = − E a K (T = 323) 2 A ⋅ e 323R Tomando logaritmos neperianos, y aplicando sus propiedades: −10E a 1 = Ln : E a = 58`23 kJ ⋅ mol −1 R = 8'31 ⋅10 −3 kJ ⋅ mol −1 ⋅ K −1 101099R 2 25. Citar los valores que influyen en la velocidad de una reacción química, explicando la razón de su influencia. Solución. • De la Naturaleza de los reactivos. En general, la fortaleza del enlace es inversamente proporcional a la velocidad Por lo general son más lentas las reacciones entre sustancias covalentes que entre sustancias iónicas disueltas, en estas últimas los enlaces están rotos. • Del grado de división de los reactivos. Sí aumenta la superficie de contacto se aumenta la posibilidad de colisión y por tanto la velocidad. Los gases y líquidos reaccionen más rápidamente que los sólidos, y estos, cuanto más finamente estén divididos, reaccionan también más rápido. • De la concentración. Al aumentar la concentración, aumenta el número de moléculas reaccionantes por unidad de volumen, lo que provoca un aumento en el número de choques aumentando la velocidad de la reacción. • De la Presión. Solo para gases. Al aumentar la presión parcial aumenta la concentración, favoreciéndose la reacción. • De la temperatura. Si aumenta la temperatura, aumenta la energía cinética de las moléculas reaccionantes y como consecuencia una mayor efectividad de Las colisiones intermoleculares, aumentando la velocidad de la misma. • La relación entre la velocidad de la reacción y la temperatura la expresa la ecuación de Arrhenius • K = A ⋅ e RT De la presencia de catalizadores. Varían la energía de activación modificando la velocidad. Si aumentan la energía de activación, disminuyen la velocidad, o viceversa. − Ea 26. Sea La reacción que transcurre en una etapa simple, 2A + B = 3C donde A y B son los reactivos y C es el único producto. a) Exprese la velocidad de reacción, vr, indicando sus unidades, en función del reactivo A y del producto C. Solución. −1 d A 1 d C v= = 2 dt 3 dt b) La ecuación cinética de esa reacción es vr = k |A|·|B|. Indique el orden total de la reacción así como las unidades de la constante cinética, k. Solución. Orden total(n): Suma de los exponentes de las concentraciones en la ecuación integrada de velocidad n=1+1=2 [k ] = [Velocidad] [Concentración ] 2 = mol ⋅ l −1 ⋅ s −1 [mol ⋅ l ]2 −1 = mol −1 ⋅ l ⋅ s −1 27. Dada la reacción exotérmica del tipo: A + B = C + D a) Represente y comente el diagrama de energía potencial frente a la coordenada de reacción, señalando la Entalpía de reacción (∆H) y las energías de activación directa (Ed) e inversa (Ei); Exprese la relación entre tres magnitudes. b) Represente y comente el diagrama correspondiente cuando actúe un catalizador sobre la reacción anterior. AZUL: Reacción no catalizada ROJO: Reacción catalizada La adición de catalizador positivo rebaja tanto la energía de activación directa como la inversa