determinación de la constante universal de los gases
Anuncio

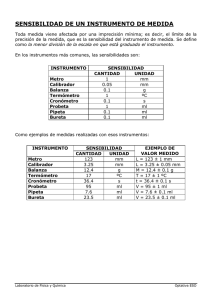
* DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES * Determinar experimentalmente la CONSTANTE UNIVERSAL de los gases R y el VOLUMEN MOLAR del hidrógeno. PROBLEMA Manteniendo constantes • Cantidad de materia (n), • Presión (P) • Temperatura (T) Obtener experimentalmente La constante universal de los gases R y Vm a condiciones ambientales, a partir de la reacción Mg(s) + HCl(ac) MgCl2(ac) + H2(g) * Variables y modelos que describen el comportamiento de los gases Gas Hipotético Condiciones Normales y estándar IUPAC * Es una constante física que relaciona diversas FUNCIONES DE ESTADO TERMODINAMICO * Estableciendo esencialm Relación ENERGÍA-TEMP-mol * Proporcionalidad que combina LEYES AVOGADRO, LUSSAC y CHARLES CONSTANTE UNIVERSAL DE LOS GASES VALOR DE R UNIDADES 8.31434 J mol-1 K-1 8.31434 Pa m3 mol-1 K-1 1.98717 cal molh-1A K-1 1.98584 BTU lbmol-1 ºR-1 0.0820562 L atm mol-1 K-1 82.0562 atm cm3 mol-1 K-1 10.7314 psia pie3 lbmol-1 ºR-1 * Figura 1 1. 3M Con el equipo armado, verificando que no existan fugas 2. Inyectando aire 3. Se trabaja en EL EXTREMO DE LA MESA para que NO SE EXTRANGULE LA MANGUERA Coloca el embudo en la PARTE superior, lo más arriba que se pueda de su soporte. Llena con agua, la bureta hasta el limite del vástago del embudo y el punto de referencia de la probeta MESA 4.- Asegúrate que no existan burbujas de aire en la bureta y mangueras. *5.- Mide la T A (Tamb) y presión barométrica (Patm) *Patm=776 hPa 6.- La tira de Magnesio -dóblala en 4 partes -obtén la masa inicial m1 -introdúcela en el tubo de ensayo -sella todo con parafilm DETERMINACIÓN 7. Mide el volumen inicial en la bureta (V1). 8. Inyectar 0.5 mL de HCl 3M. 9. Espera 15 minutos a que la reacción finalice y que el gas obtenido alcance el equilibrio con la T Amb. 10.- MUEVE el embudo para igualar el nivel del agua con el nivel de la bureta, como se muestra en la Figura 2. 11. MIDE EL VOLUMEN V2 Desconecta el tubo del dispositivo y recuperar el Mg que no reacciono. 12. Lava y seca perfectamente el Mg recuperado y obtener la masa final (m2). Si es necesario utiliza acetona o alcohol. 13.- Repite el experimento una vez más y registra (nota: no necesitas secar el matraz o tubo, ni cambiar el agua en la bureta). Incluir %error Toxicidad: Mg, HCl LENGUAJE TERMODINAMICO PARA UNA MEZCLA DE 2 COMPONENTES QUE SON LOS PRODUCTOS DE LA REACCION y OBEDECEN LA LEY DE DALTON A partir de la masa final e inicial del Mg y la NÚMERO DE MOLES reacción balanceada con el HCl, se obtienen los moles de H2 formados. m1 –m2= m reacción VOLUMEN Con el volumen inicial y final medido en la bureta, se obtiene el volumen del H2 recolect. V2-V1 =V H2 PRESIÓN El H2 no es el único gas en la bureta, existe Patm = PH20 + PH2 también vapor de agua, para poder determinar la presión parcial del H2 seco se necesita conocer la Pparcial del vapor de agua. En el experimento se ajusta el nivel de agua en el embudo con el de la bureta, esto significa que la presión total del sistema es igual a la presión atmosférica TEMP La temperatura será (Tamb). VOLUMEN MOLAR Se conoce el volumen y el número de moles generadas de H2 R Finalmente utilizando la ecuación del gas ideal se obtendrá R en (L Atm/mol K) V m H2= VH2 /nH2 *