Soluciones
Anuncio

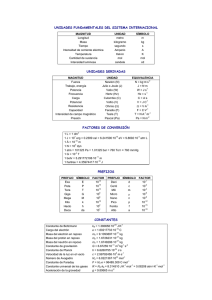
EJERCICIOS RESUELTOS 1.- Una muestra impura de óxido de hierro (III) (sólido) reacciona con un ácido clorhídrico comercial de densidad 1,19 gAcm–3, que contiene el 35% en peso del ácido puro. a) Escriba y ajuste la reacción que se produce, si se obtiene cloruro de hierro (III) y agua. b) Calcule la pureza del óxido de hierro (III) si 5 gramos de este compuesto reaccionan exactamente con 10 cc del ácido. c) ¿Qué masa de cloruro de hierro (III) se obtendrá? PAU-07 Fe2O3 + 6 HCl ÷ 2 FeCl3 + 3 H2O a) b) masa disolución = V Cd = 10 C1,19 = 11,9 g masa de HCl puro = 11,9 C35/100 = 4,165 g Pm (HCl) = 36,5 n(HCl) = 4,165/36,5 = 0,114 mol participan en la reacción n (Fe2O3) = 0,114/6 = 0,019 mol puros participan en la reacción Pm (Fe2O3) = 159,6 m (Fe2O3 puro) = 0,019 C159,6 = 3,035 g riqueza = [m(Fe2O3 puro) / m(Fe2O3 total)] x 100 = 3,035 C100 / 5 = 60,7% c) Pm (Fe Cl3) = 162,3 n (FeCl3) = 0,114/3 = 0,038 moles m (Fe Cl3) = 162,3 C0,038 = 6,17 g 2.- El acetileno o etino (C2H2) se obtiene por reacción del carburo de calcio (CaC2) con agua. a) Formula y ajusta la reacción de obtención del acetileno, si se produce además hidróxido de calcio. b) Calcula la masa de acetileno formada a partir de 200g de un carburo de calcio del 85 % de pureza. c) ¿Qué volumen de acetileno gaseoso se produce a 25 ºC y 2 atm de presión con los datos del apartado anterior. PAU-08 3.- La entalpía para la reacción de obtención de benceno líquido a partir de etino gaseoso: 3 C2H2 ÷ C6H6, es -631 kJ/mol. En todo el proceso la temperatura es 25 ºC y la presión 15 atm. Calcula: a) Volumen de etino necesario para obtener 0,25 L de benceno líquido. b) Cantidad de calor que se desprende en dicho proceso. c) Densidad del etino en dichas condiciones. PAU-04 4.- En una cámara cerrada de 10 L a la temperatura de 25 ºC se introduce 0,1 mol de propano con la cantidad de aire necesaria para que se encuentre en proporciones estequiométricas con el O2. A continuación se produce la reacción de combustión del propano en estado gaseoso, alcanzándose la temperatura de 500 ºC. a) Ajusta la reacción que se produce. b) Determina la fracción molar de N2 antes y después de la combustión. c) Determina la presión total antes y después de la combustión. Datos: R = 0,082 atm.L/K.mol; Composición del aire: 80//o N2, 20% O2 PAU-04 //