regulacion hormonal del balance fosfocalcico
Anuncio

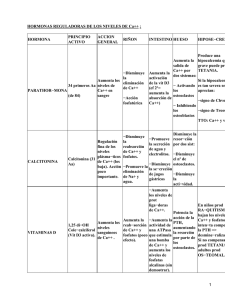
Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica REGULACION HORMONAL DEL BALANCE FOSFOCALCICO Actualización 2007 Brandan, Nora C. Profesora Titular. Cátedra de Bioquímica. Facultad de Medicina. UNNE. Llanos, Isabel Cristina. Jefa de Trabajos Prácticos. Cátedra de Bioquímica. Facultad de Medicina. UNNE. Ruiz Díaz, Daniel A. N. Ayudante Alumno por Concurso. Cátedra de Bioquímica. Facultad de Medicina. UNNE. INDICE Estructura y metabolismo óseo.......................................................................................................................... 1 Metabolismo del Calcio..................................................................................................................................... 2 Metabolismo del Fósforo................................................................................................................................... 2 Metabolismo del Magnesio ............................................................................................................................... 3 Glándula paratiroides......................................................................................................................................... 3 Hormona paratiroidea........................................................................................................................................ 3 Estructura ...................................................................................................................................................... 3 Biosíntesis, Secreción y Metabolismo .......................................................................................................... 3 Síntesis...................................................................................................................................................... 3 Regulación de la secreción de PTH .......................................................................................................... 4 Receptor sensor del calcio extracelular..................................................................................................... 4 Receptor de PTH....................................................................................................................................... 4 Metabolismo ............................................................................................................................................. 4 Acciones........................................................................................................................................................ 5 Sobre el Riñon .......................................................................................................................................... 5 Sobre el Hueso .......................................................................................................................................... 5 Sobre el Intestino ...................................................................................................................................... 5 Vitamina D ........................................................................................................................................................ 5 Síntesis .......................................................................................................................................................... 5 Metabolismo.................................................................................................................................................. 6 Receptor de Vitamina D................................................................................................................................ 6 Acciones de la Vitamina D ........................................................................................................................... 7 A nivel intestinal....................................................................................................................................... 7 A nivel óseo .............................................................................................................................................. 7 A nivel de la glándula paratiroides ........................................................................................................... 7 Déficit de vitamina D .................................................................................................................................... 7 Calcitonina......................................................................................................................................................... 8 Conclusión: Esquema Integrado del Sistema .................................................................................................... 8 Acción de otras hormonas sobre el metabolismo fosfocálcico.......................................................................... 9 Las hormonas tiroideas. ................................................................................................................................ 9 Los estrógenos............................................................................................................................................... 9 Los esteroides corticosuprarrenales. ............................................................................................................. 9 La hormona del crecimiento.......................................................................................................................... 9 Bibliografía........................................................................................................................................................ 9 Cuadros anexos................................................................................................................................................ 10 Estructura y metabolismo óseo El hueso es un tejido dinámico que se remodela constantemente durante toda la vida. Este constituye un depósito de calcio, magnesio, fósforo, sodio y otros iones necesarios para las funciones homeostáticas. El esqueleto se haya muy vascularizado y recibe casi el 10% del gasto cardíaco. El remodelamiento del hueso se logra gracias a dos tipos de células características: los osteoblastos, que producen la matriz ósea, y los osteoclastos, que la resorben. Los componentes extracelulares del tejido óseo constan de una fase mineral sólida íntimamente ligada a una matriz orgánica, de la que 90 a 95% es colágeno de tipo I y proteínas séricas, como la albúmina, al igual que muchas proteínas de producción local, cuyas funciones no se conocen del todo. Entre éstas hay proteínas de adhesión y señalización celular, como la trombospondina, la osteopontina y la fibronectina; proteínas fijadoras de calcio, como la proteína gla de la matriz y la osteocalcina, y proteoglicanos, como el biglucano y la decorina. Algunas de estas proteínas organizan las fibrillas de colágena; otras inician el proceso de mineralización y de fijación de la fase mineral a la matriz. La fase mineral está constituida por calcio y fosfato y la mejor manera de clasificarla es como una hidroxiapatita mal cristalizada. La fase mineral del hueso se deposita al principio en relación íntima con las fibrillas de colágeno y se encuentra en sitios específicos de los "agujeros" situados entre las fibrillas de colágeno. Los osteoblastos sintetizan y secretan la matriz orgánica. A medida que el osteoblasto secreta matriz, que luego se mineraliza, la célula se convierte en un osteocito. Se piensa que estos son mecanosensores del hueso y que comunican señales a los osteoblastos de la superficie y a sus progenitores a través de la red canalicular. Aunque esta mineralización aprovecha las altas concentraciones séricas de calcio y fosfato, próximas a la saturación, la mineralización es un proceso regulado que depende de la actividad de la fosfatasa alcalina derivada de los osteoblastos. Los estudios genéticos en seres humanos y en ratones han identificado varios genes decisivos que controlan el desarrollo del osteoblasto (ver tabla 1). Tabla 1. Factores que regulan el desarrollo de los osteoblastos Factor Tipo Comentarios CBFA1 (RUNX2) Factor de transcripción FGF 2 y 18 Factor de crecimiento β PDGF Factor de crecimiento β IGF I y II Factor de crecimiento β Ihh Molécula paracrina BMP Proteínas de Regula expresión de diversas proteínas: osterix (factor de transcripción), osteopontina, sialoproteína ósea, colágeno tipo I, osteocalcina y RANK. CBFA1: core-bindig factor A1 (factor de fijación de núcleos A1). También llamado RUNX2. RANK: receptor-activator of NFkB (ligando del receptor activador de NFkB). FGF: fibroblast growth factor (factor de crecimiento fibroblástico). PDGF: platelet-derived growth factor (factor de crecimiento derivado de plaquetas). IGF: insulin-like growth factor (factor de crecimiento similar a la insulina). señalización Ihh: Indian hedgehog (erizo indio) Regulan la expresión de CBFA1 BMP: bone morphogenic proteins (proteínas morfógenas óseas). La resorción ósea es realizada principalmente por los osteoclastos, células multinucleadas que se forman por la fusión de células derivadas del precursor común de macrófagos y osteoclastos. Se han identificado múltiples factores que regulan el desarrollo del osteoclasto (ver tabla 2). Los factores producidos por los osteoblastos o las células del estroma medular permiten que los osteoblastos controlen el desarrollo y la actividad del osteoclasto. La mayor parte de las hormonas que influyen en el funcionamiento del osteoclasto no actúan directamente sobre esta célula, sino que más bien influyen en la señalización del M-CSF y el ligando de RANK por parte de los osteoblastos. La hormona paratiroidea como la 1,25-(OH)2D aumentan el número y la actividad de los osteoclastos, en tanto que el estrógeno disminuye el número y la actividad de los osteoclastos por este mecanismo indirecto. Por su parte la calcitonina se une a su receptor en la superficie basal de los osteoclastos e inhibe directamente la función de estas células. La resorción ósea mediada por osteoclastos se produce por una adhesión, a través de una integrina αvβ3 específica, a componentes de la matriz ósea como la osteopontina. El osteoclasto queda así fijado a la matriz subyacente, secretando protones, cloro y proteinasas, lo que solubiliza la fase mineral. El remodelamiento del hueso ocurre a lo largo de las líneas de fuerza generadas por la tensión mecánica. Las señales de estas fuerzas mecánicas son percibidas por los osteocitos, que transmiten señales a los osteoclastos, a los osteoblastos o a sus precursores. Los productos de la actividad del osteoblasto y del osteoclasto ayudan a diagnosticar y tratar las enfermedades óseas. La actividad del osteoblasto puede valorarse determinando los niveles séricos de fosfatasa alcalina específica del hueso. 1 Tabla 2. Factores que regulan el desarrollo de los osteoclastos Factor Tipo Comentarios M-CSF: macrophage colonystimulating factor (factor estimulador de colonias de macrófagos). TNF: tumor necrosis factor (factor de necrosis tumoral). M-CSF Factor de crecimiento Ligando de RANK Miembro de la familia del TNF Osteoprotegerina Receptor IL: interleukine (interleucina). INFγ: interferón gamma IL 1,6 y 11 TNF e INFγ Provoca la fusión de las células progenitoras de los osteoclastos: osteoclastos activos multinucleados. Se expresa en progenitores de osteoblastos y fibroblastos. Tras su unión a RANK estimula la diferenciación y activación del osteoclasto. Fija RANK e inhibe la diferenciación. Modulan diferenciación y función.. Metabolismo del Calcio El calcio (Ca) es uno de los constituyentes iónicos más importantes en el organismo. Se combina con el fósforo para formar las sales que constituyen el componente principal de los huesos y los dientes. Tiene un rol esencial en la transmisión neuromuscular del impuso nervioso. Es un componente clave en la cascada de la coagulación, cofactor de muchas enzimas del organismo, influye en la secreción de gastrina y es participe esencial en la contractilidad muscular. En el adulto, el Ca corporal total asciende a unos 1200 mg, más del 90% esta fijo en los huesos, principalmente en forma de cristales de hidroxiapatita, el Ca restante se halla en el líquido extracelular. El Ca de los huesos esta en equilibrio dinámico permanente con el Ca del líquido extracelular. En la sangre la concentración total de Ca es de 8,5 a 10,5 mg/dl. El Ca sérico total se compone de tres fracciones: El 50% ionizado (aproximadamente), que es la porción biológicamente activa y regulada directamente por hormonas. Un 5% formando complejos con fosfato, citrato, lactato, heparina , sulfato y bicarbonato. Estas dos constituyen la fracción difusible o ultrafiltrable de calcio. El 45% ligado a proteínas de carga negativa, como la albúmina e inmunoglobulinas, esta fracción es no difusible. Las alteraciones séricas de proteínas afectan directamente a la concentración total de Ca en sangre, aun cuando el Ca ionizado permanezca normal (por cada gr/dl de albúmina por debajo de 4g/dl se eleva el Ca total en 0,8 mg/dl, esto se llama calcio corregido). La acidosis también altera el Ca ionizado al disminuir su unión a proteínas. La absorción intestinal de Ca ingerido requiere de ácido gástrico, e implica mecanismos activos (transcelulares) y pasivos (paracelulares). La absorción pasiva de Ca no es saturable y corresponde al 5% del Ca ingerido diariamente, en tanto que el mecanismo activo, el cual es controlado por calcitriol, fluctúa entre el 20 y 70%. Este tiene lugar en duodeno y yeyuno proximal. Alrededor de 8 a 10 gr/día de Ca son filtrados por los glomérulos renales, de los que solo 2 a 3% aparecen en la orina. El 65 % del Ca filtrado se reabsorbe en los túbulos proximales de manera pasiva no regulada específicamente. La rama ascendente gruesa del asa de Henle reabsorbe un 20% del Ca también de manera pasiva, que requiere una proteína llamada paracelina-1, la que es inhibida por el aumento de las concentraciones sanguíneas de Ca o magnesio que actúa a través del receptor sensor de Ca; este es un mecanismo independiente de la PTH y Calcitriol mediante el cual el Ca iónico controla la reabsorción renal de Ca. En los túbulos contorneados distales (TCD) se reabsorbe el 10% del Ca filtrado por un mecanismo transcelular (activo) que es regulado directa e indirectamente por PTH. Metabolismo del Fósforo El contenido de fósforo (P) del organismo es de alrededor de 700 gr, de los cuales el 85% está en el esqueleto y el resto, en los tejidos blandos y los líquidos corporales. El P óseo está íntimamente asociado con el Ca, formando los cristales de hidroxiapatita. El P extraóseo es fundamentalmente intracelular y una parte mínima inorgánico, ya que el resto está ligado a hidratos de carbono, lípidos y proteínas. El P es necesario para la integridad funcional de la célula y de los procesos metabólicos orgánicos; regulando un buen número de enzimas. Desempeña un papel importante en el aporte de oxígeno a los tejidos (a través de los niveles de 2,3difosfoglicerato), forma parte de los sistemas tampón de la orina y el plasma e interviene en los procesos de almacenamiento de la energía del organismo (ATP). Dada la amplia distribución del P en los alimentos, es difícil que en condiciones normales exista déficit de origen alimentario. El adulto ingiriere unos 1400 mg/día de P, con grandes oscilaciones, describiéndose déficit de P exógeno solo 2 en los pacientes sometidos a nutrición parenteral. Se lo encuentra en alimentos como la leche de vaca, carne rojas, pescados y legumbres. La concentración normal de P en sangre oscila entre 2,5 a 4,5 mg/dl en los adultos y es algo superior en los niños. Las determinaciones de P en el extracelular pueden no reflejar con precisión la disponibilidad de fosfato dentro de las células. Se absorbe eficientemente (65%) en el intestino delgado (por difusión pasiva y transporte activo), incluso en ausencia de vitamina D, mediante los procesos activos (mediado por una proteína transportadora) que son aumentados por calcitriol e intensificándose la misma hasta el 85-90% de lo ingerido, siendo entonces la absorción de 500 a 1000 mg/día. El control de P sérico está determinado principalmente por la tasa de reabsorción renal. El 90 % del P inorgánico circula libre y unido a aniones mono y divalentes (ultrafiltrable) y el 10% ligado a proteínas. La cantidad de P absorbida en el túbulo se incrementa a medida que aumenta la carga de P filtrada hasta alcanzar un máximo por encima del cual toda elevación de la carga filtrada es enteramente excretada. Metabolismo del Magnesio La concentración sérica de magnesio (Mg) es de 1,9 a 2,1 mg/dl. Es uno de los cationes más abundantes del organismo y está muy concentrado dentro de las células, interviene en múltiples funciones celulares como la adhesión celular, activación de membrana, transporte de membrana, transmisión del impulso nervioso y contracción muscular, pero sobre todo es un catión importante en el control del metabolismo del Ca y P, de la vitamina D y sus metabolitos, de la calcitonina y parathormona. Una dieta normal contiene unos 300 mg, de los cuales se absorbe unos 30-35%, en su mayor parte se encuentra en el hueso y en menor proporción en músculo estriado, hígado, cerebro, riñón y bazo. Su absorción intestinal es proporcional a la dieta pero es saturable. Los alimentos abundantes en Mg son cacao, nueces, mariscos, arroz y cereales. La eliminación de Mg se realiza principalmente por la orina, pero también por sudor y la leche materna. Glándula paratiroides Las cuatro glándulas paratiroides están localizadas por detrás de la glándula tiroides. Producen la hormona paratiroidea (parathyroid hormone, PTH), que es segregada por las células principales, células oxífilas y células del núcleo claro, ésta hormona es el principal regulador de la fisiología del calcio. La PTH actúa directamente sobre el hueso y sobre el riñón e indirectamente sobre el intestino. Las concentraciones séricas de PTH están estrechamente reguladas por un mecanismo de retroalimentación negativa. El Ca, a través del sensor de Ca, y la vitamina D, a través de su receptor nuclear, inhiben la síntesis y liberación de PTH. Hormona paratiroidea Estructura La PTH es un péptido de cadena sencilla de 84 aminoácidos (aa) de longitud. La zona de actividad biológica de la PTH se encuentra en los primeros 34 aa del extremo N-terminal. Bastan los fragmentos sintéticos modificados de la secuencia aminoterminal tan pequeños como PTH(1-11) para activar al receptor principal. La región carboxiloterminal de la PTH se fija a un receptor separado (cPTH-R), pero que aún no ha podido clonarse. Los fragmentos acortados sobre la terminación amino se fijan al cPTH-R e inhiben las acciones de la PTH(1-84) de longitud completa o a los fragmentos PTH(1-34) activos. Biosíntesis, Secreción y Metabolismo Síntesis Las células paratiroideas tienen múltiples métodos para adaptarse al incremento de la demanda de PTH: 1º) El más rápido (en minutos) es la secreción de hormona preformada como respuesta a la hipocalcemia. 2º) En segundo lugar, en el lapso de horas, la hipocalcemia sostenida induce a la expresión de RNAm de PTH. 3º) Finalmente, las necesidades prolongadas producen en días replicación celular, que incrementa la masa de la glándula. Esta hormona se sintetiza como un precursor de 115 aa llamado pre-pro-PTH, que por medio de proteasas pasa a pro-PTH de 90 aa, que se transformará en la hormona activa de 84 aa, la PTH. La síntesis de PTH en condiciones fisiológicas está activada y su control regulado básicamente por los niveles de RNAm. El nivel de pre-pro-PTH se incrementa al aumentar el RNAm, el cual aumenta con la hipocalcemia 3 y disminuye con la hipercalcemia y la elevación de la 1,25(OH)2D3. Otro regulador de menor intensidad es el Mg. La regulación de la destrucción proteolítica de la hormona preformada (regulación postraduccional de la producción de hormona) es un mecanismo de importancia para mediar los cambios rápidos (en minutos) de la disponibilidad de la hormona. A concentración elevada el calcio incrementa la destrucción proteolítica de las reservas de la hormona, y a concentración baja la inhibe. Regulación de la secreción de PTH La secreción de PTH aumenta bruscamente hasta cinco veces como máximo por encima de la secreción basal cuando el Ca desciende desde su concentración normal hasta valores de 7.5 a 8 mg/dl de Ca total. La fracción ionizada del Ca sanguíneo es el determinante que cuenta para la secreción hormonal. Un déficit intenso del Mg intracelular disminuye la secreción de PTH. Existen 2 mecanismos de regulación de PTH: Control y regulación de la síntesis Control y regulación de la secreción El control de la secreción por las células paratiroides depende de la concentración de Ca ionizado del líquido extracelular y del nivel de 1,25(OH)2D3. También influyen las catecolaminas y sus derivados, el glucagón, la secretina, la calcitonina, la prostaglandina E, los corticoides y los niveles de Mg, litio y aluminio. El Ca del líquido extracelular controla la secreción de PTH al entrar en interacción con un sensor de este ión, un receptor acoplado a proteína G (G protein-coupled receptor, GPCR) para el que los iones Ca actúan como ligandos. Receptor sensor del calcio extracelular El clonaje de los receptores de PTH y calcitriol ha ayudado a dilucidar mejor los mecanismos celulares involucrados en la rama eferente de la regulación del calcio extracelular. Precisamente fue de paratiroides bovinas de donde se aisló la secuencia de DNA que codifica el receptor denominado sensor del calcio extracelular (CaSR). Este receptor es un miembro de una subfamilia distintiva de la superfamilia GPCR que se caracteriza por un gran dominio extracelular adecuado para "pinzar" a la pequeña molécula Ca. El receptor se encuentra en las glándulas paratiroides y las células secretoras de calcitonina (células C) de la glándula tiroides, así como en otros sitios como cerebro y riñón. El Ca ionizado actúa como si fuera una hormona; al activarse el receptor, genera los segundos mensajeros DAG e IP3, inhibe la adenilciclasa y por consiguiente disminuye la concentración intracelular de AMPc. El clonaje del gen para este receptor ha mostrado un mecanismo que permite la liberación de PTH en respuesta al Ca por parte de la glándula paratiroides y la regulación de la reabsorción tubular de Ca medida por el propio Ca ionizado, que juega un importante papel en la homeostasis normal del Ca. Afecta pues directamente la síntesis y secreción de la PTH y de la calcitonina. Receptor de PTH Se han descripto 2 tipos de receptores (PTH1R y PTH2R) El PTH1R pertenecen al grupo de receptores tipo 2 de la familia de la proteína G, estos se acoplan a la proteína Gs y Gq. El PTH1R se localiza en las células del túbulo contorneado del riñón, en los osteoclastos y en el tejido fetal. El PTH2R cuyo mecanismo de acción no está bien dilucidado, se expresa en tejidos cerebral, pancreático, células parafoliculares de la tiroides y células del endotelio vascular y cardíacas. El ligando endógeno de este receptor es un péptido diferente a la PTH, es un péptido hipotalámico de 39 aa, denominado “péptido infundibular tubular” (TIP-39). Metabolismo La metabolización de la PTH se realiza cerca del 60 % en hígado, 30% en riñón y es posible que un porcentaje pequeño en la propia célula paratiroidea. Se producen y se liberan unos fragmentos N-terminales y C-terminales. No parece que el metabolismo periférico de la PTH esté regulado por estímulos fisiológicos (Ca elevado o bajo, etc.); de ahí que el metabolismo periférico de la hormona, aunque ocasione rápida eliminación de la hormona secretada, se trate al parecer de un proceso catabólico de gran capacidad y metabolicamente invariable. La eliminación de la sangre del péptido secretado de 84 aminoácidos es más rápida (8-10 minutos) que la depuración de los fragmentos correspondientes a las regiones central y C-terminal de la PTH, biológicamente inactivos. En consecuencia, la interpretación de los radioinmunoanálisis está influida por la naturaleza de los fragmentos de péptidos detectados por los anticuerpos. 4 Acciones La hormona actúa directamente sobre el hueso y el riñón e indirectamente sobre el intestino a través de sus efectos en la síntesis de 1,25(OH)2D para elevar las concentraciones de Ca en el suero. Sobre el Riñón Estimulación de la reabsorción tubular del Ca: estimula la reabsorción de Ca en el túbulo distal (5-10%), en la porción gruesa del asa ascendente de Henle (20%) y no influye sobre la que tiene lugar en el túbulo proximal (70%) y el resto de la nefrona. La PTH también potencia la reabsorción de Mg en el túbulo distal. Inhibición del transporte de fosfato: la reabsorción del P ocurre principalmente en los túbulos proximales. La PTH se liga a un receptor en la cara basal de la célula tubular activando el sistema adenilciclasa e incrementando el AMPc, el cual, al unirse a la subunidad reguladora de la proteincinasa del borde luminal, disocia a ésta de la subunidad catalítica. La fosforilación de proteínas de la membrana celular por la subunidad catalítica activada inhibe el transporte de sodio y fosfato hacia el interior. Mecanismos similares podrían estar implicados en otras acciones de la PTH como inhibición de la reabsorción tubular proximal de bicarbonato, sodio y agua. Otros efectos renales de la PTH: la PTH estimula la síntesis de la 1,25(OH)2D en el túbulo proximal por la estimulación de la 25(OH)D1-α-hidroxilasa y disminuyendo la actividad de la 24hidroxilasa renal. Sobre el Hueso Estimula la resorción ósea: mediante el incremento de la actividad y número de osteoclastos por varios mecanismos. Los osteoclastos, que median la desintegración del hueso, carecen de receptores de PTH. La estimulación de los osteoclastos mediada por la PTH es indirecta y se produce en parte por medio de citocinas secretadas por los osteoblastos (que cuentan con receptores para PTH) para activar a los osteoclastos; se ha visto en estudios experimentales sobre la resorción ósea in vitro que debe haber presentes osteoblastos a fin de que la PTH active a los osteoclastos para que resorban hueso. El efecto neto es aumentar la liberación de Ca y P a la sangre. Sobre el Intestino La PTH estimula indirectamente la absorción intestinal de Ca y P, al promover la biosíntesis de la 1,25(OH)2D. Vitamina D Síntesis La 1,25-dihidroxivitamina D (1,25[OH]2D) también conocida como Calcitriol, es la principal hormona esteroide que interviene en la regulación de la homeostasis del ión mineral. La vitamina D y sus metabolitos son hormonas y precursores hormonales más que vitaminas, ya que en las condiciones biológicas apropiadas pueden sintetizarse de manera endógena. En el cual por reacción a la radiación ultravioleta sobre la piel, se produce un desdoblamiento fotoquímico formándose la de vitamina D a partir de 7deshidrocolesterol. También se puede obtener vitamina D a través de los alimentos, es decir de fuentes exógena. Estas son en gran medida los cereales fortificados y los productos lácteos, además de los aceites de pescado y las yemas de huevo. La vitamina D de origen vegetal se encuentra en forma de vitamina D2, mientras que la procedente de animales está en forma de vitamina D3. Estas dos formas tienen una actividad biológica equivalente y se activan con la misma eficacia por medio de las hidroxilasas de vitamina D en el ser humano. Desde su lugar de absorción en el intestino o de síntesis en la piel: 1) La vitamina D entra en la circulación unida a la proteína transportadora de vitamina D, una globulina alfa que se sintetiza en el hígado. 2) La vitamina D sufre después una 25-hidroxilación en el hígado por enzimas semejantes a las del citocromo P450 que se encuentran en la mitocondria y los microsomas. La actividad de esta 25-hidroxilasa no está muy bien regulada y el metabolito resultante, la 25-hidroxivitamina D (25[OH]D), es la principal forma circulante y de depósito de la vitamina D. Alrededor de 88% de la 25(OH)D circula unida a la proteína 5 transportadora de vitamina D, 0.03% se encuentra en estado libre y el resto circula unido a la albúmina. La vida media de la 25(OH)D es de casi dos a tres semanas; sin embargo, se acorta espectacular- mente cuando se reducen los niveles de proteína transportadora de vitamina D, como puede ocurrir cuando aumentan las pérdidas urinarias en el síndrome nefrótico. 3) La hidroxilación final necesaria para la formación de hormona madura ocurre en el riñón. La enzima 25(OH)D-1αhidroxilasa es una oxidasa de función mixta semejante a la del citocromo P450 que está estrechamente regulada en las células del túbulo contorneado proximal: Es estimulada por la PTH. Es reprimida por el Ca y el producto de la acción de la enzima, la 1,25(OH)2D. La 25(OH)D-1α-hidroxilasa también se encuentra en los queratinocitos epidérmicos, pero la producción de 1,25(OH)2D por el queratinocito no se considera que contribuya a los niveles de esta hormona en la circulación sanguínea. También se halla en la capa trofoblástica de la placenta. La producción cutánea de vitamina D disminuye con la melanina y con los protectores solares que contienen factor de protección solar en gran concentración, que eficazmente alteran la penetración de la luz ultravioleta en la piel. En las personas de piel oscura la producción de vitamina D3 es menor, requiriéndose mayor exposición solar para la biosíntesis de similares cantidades de vitamina D. En los niños y adultos jóvenes la producción cutánea de vitamina D3 durante la primavera, verano y otoño es suficiente y se almacena principalmente en tejido adiposo y músculo, para cubrir las necesidades del invierno. Esto no sucede en los individuos de mayor edad. El mayor uso de protectores solares y la menor exposición de la población general en los últimos decenios han llevado a que cada vez se confíe más en las fuentes alimentarias de vitamina D. Metabolismo La principal vía de inactivación de los metabolitos de la vitamina D es un paso de hidroxilación adicional que lo realiza la D-24-hidroxilasa, una enzima que se expresa en casi todos los tejidos. El calcitriol, el principal inductor de la enzima D-24-hidroxilasa, promueve así su propia inactivación, limitando con ello sus efectos biológicos. Los metabolitos polares de la 1,25(OH)2D se secretan hacia la bilis y se resorben a través de la circulación enterohepática. Receptor de Vitamina D La 1,25(OH)2D ejerce sus efectos biológicos mediante su unión a un miembro de la superfamilia de los receptores nucleares, el receptor de vitamina D (vitamin D receptor, VDR), que se expresa en una amplia gama de células y tejidos. Este receptor pertenece a la superfamilia que incluye los receptores de hormona tiroidea, los receptores retinoides y los receptores activados del proliferador de peroxisomas. No obstante, a diferencia de otros miembros de esta superfamilia, únicamente se ha aislado un receptor de vitamina D. Éste se une a las secuencias de DNA específicas en forma de heterodímero con el receptor de retinoide X (RXR), esta unión origina un cambio conformacional y una fosforilación en residuos de serina específicos produciéndose un complejo activado Hormona-VDR (VDR*), reclutando un conjunto de coactivadores que dan por resultado la inducción de la transcripción de determinados genes. Cuando el VDR reprime la expresión de los genes, interfiere en la acción de los factores activadores de la transcripción o recluta proteínas nuevas hacia el complejo del VDR, que producen una represión transcripcional. El VDR presenta 3 dominios; un dominio N-terminal, uno de unión al DNA y uno de unión al ligando. El dominio de unión al DNA posee 2 estructuras en dedos de zinc que hacen contacto con bases específicas de nucleótidos en el DNA. Dentro de este dominio se encuentra una secuencia de residuos aminoacídicos importantes en la heterodimerización con el RXR. El dominio de unión al ligando presenta una estructura muy compleja en forma de bolsillo tridimensional que interacciona con el ligando. El VDR aparte de su localización nuclear tiene receptores de membrana, estos últimos participan en efectos no genómicos de la hormona que implican activación de fosfolipasas, producción de DAG, IP3, regulación de los canales de Ca, activación de PK-C y MAP-K. La vía no genómica modula un transporte rápido de Ca llamado “transcaltaquia” que involucra la apertura de canales de Ca operados por voltaje a través de la membrana , transporte vesicular de Ca asociado a la polimerización de microtúbulos que marcan el tráfico entre membranas. El receptor de membrana de la vía no genómica es peculiar porque es afín con el del citosol (ligan el mismo esteroide: 1,25-dihidroxivitamina D), pero con diferente dominio proteico para la unión. La afinidad del VDR por la 1,25(OH)2D es alrededor de tres veces mayor que la que tiene por los demás metabolitos de la vitamina D. En circunstancias fisiológicas normales, estos otros metabolitos no estimulan las acciones dependientes del receptor. Sin embargo, en los estados de toxicidad por vitamina D, los niveles tan altos de 25(OH)D originan hipercalcemia al interactuar directamente con el VDR y además de desplazar a la 1,25(OH)2D de la proteína transportadora de vitamina D en el suero, lo que trae consigo una mayor biodisponibilidad de la hormona activa. El VDR también se expresa en tejidos y órganos que no intervienen en la homeostasia de iones minerales. En este sentido, es notable la observación de que la 1,25(OH)2D ejerce un efecto antiproliferativo sobre varios tipos de células, entre los que se incluyen los queratinocitos, las células del cáncer mamario y las células del cáncer prostático. 6 Acciones de la Vitamina D A nivel intestinal Favorece la absorción de Ca por difusión facilitada: ésta hormona es un inductor importante de la calbindina D 9K, una proteína fijadora de Ca que absorbe el Ca por difusión facilitada. Liga el Ca en el borde en cepillo (superficie luminal) que se incorporaron a través de los canales del Ca o transportadores, posteriormente ocurre el traslado del complejo calbindina D-Ca a la membrana basal, donde se transfiere el ión Ca a una bomba Ca2+ATPasa que lo lleva a la circulación. También induce la producción de la fosfatasa alcalina (FAL), la Ca2+-ATPasa de baja afinidad, la actina del borde en cepillo, la calmodulina y las proteínas del borde en cepillo de 80 a 90 KDa. Induce a los dos principales transportadores de Ca expresados en los epitelios intestinales que son ECaC e IcaC. Al inducir a la expresión de estos y otros genes en el intestino delgado, la 1,25(OH)2D aumenta la eficiencia de la absorción intestinal de Ca. A nivel óseo Favorece la diferenciación del osteoclasto y aumenta la actividad osteoclástica: al igual que la hormona paratiroidea induce la expresión del ligando de RANK. Regula la expresión de varios genes en los osteoblastos: los genes diana incluyen las proteínas de la matriz ósea, la osteocalcina y la osteopontina, que son regulados al alza y suprime la expresión del colágeno de tipo I. Todas la acciones a nivel óseo mediados por el calcitriol se traducen en un aumento de la resorción ósea con el consiguiente aumento de Ca y P sanguíneos. A nivel de la glándula paratiroides Ejerce efectos antiproliferativos sobre las células paratiroideas Suprime la transcripción del gen de la PTH. Déficit de vitamina D El síndrome clínico del déficit de vitamina D puede deberse a producción deficiente de esta vitamina en la piel, falta de aporte en los alimentos, pérdidas aceleradas de esta vitamina, alteraciones en su activación o resistencia a los efectos biológicos de la 1,25(OH)2D. Los ancianos y los residentes en hospicios corren particular riesgo de sufrir déficit de vitamina D, ya que tanto la eficiencia de su síntesis en la piel como su absorción en el intestino declinan con el envejecimiento. La absorción intestinal deficiente de grasas alimentarias también puede llevar a un déficit de vitamina D. Esto se exacerba más con la presencia de una enfermedad del ileon terminal, que produce alteraciones en la circulación enterohepática de los metabolitos de la vitamina D. La alteración de la 1α-hidroxilación prevalece en la población con insuficiencia renal crónica (ver aplicaciones clínicas), y habrá que pensar en realizar intervenciones terapéuticas en los pacientes cuya depuración de creatinina sea menor de 30 ml/min. El déficit leve a moderado de vitamina D es asintomático, en tanto que el déficit crónico de esta vitamina produce: Hipocalcemia acompañada de hiperparatiroidismo secundario. Alteraciones en la mineralización del esqueleto (osteopenia en las radiografías o disminución en la densidad mineral ósea) Miopatía proximal. En ausencia de alguna enfermedad intercurrente, la hipocalcemia que acompaña al déficit crónico de vitamina D rara vez se manifiesta por síntomas agudos de hipocalcemia, como entumecimiento, sensación de hormigueo o convulsiones. 7 Calcitonina La tiroides es la principal fuente de calcitonina (CT) y las células que intervienen en la síntesis de esta hormona proceden del tejido de la cresta neural. Durante la embriogénesis, estas células migran al cuerpo ultimobranquial, derivado de la última bolsa branquial Las calcitoninas naturales consisten en una cadena peptídica de 32 aminoácidos. Se observa variabilidad considerable de la secuencia entre las especies. La concentración de CT circulante en el ser humano es menor que en otras especies de mamíferos. En seres humanos incluso las variaciones extremas de la producción de CT no cambian el metabolismo del calcio y del fosfato; no se pueden atribuir efectos específicos a la deficiencia de CT (los pacientes sometidos a tiroidectomía total sólo reciben reemplazo de tiroxina) o al exceso de esta hormona (pacientes con carcinoma medular tiroideo, que es un tumor secretor de CT). Es una hormona hipocalcémica que actúa en diversas especies de mamíferos como antagonista de la PTH. Parece tener poca importancia fisiológica en el ser humano, tal vez en la homeostasia del Ca. La acción hipocalcémica se obtiene principalmente a: En primer lugar a la inhibición de la resorción ósea mediada por osteoclastos. En segundo lugar, estimulando la eliminación renal del calcio. Estos efectos están mediados por los receptores que poseen los osteoclastos y las células del túbulo renal. La CT ejerce otros efectos mediante receptores presentes en el cerebro, tubo digestivo y sistema inmunitario. Esta hormona posee efectos analgésicos directos sobre el hipotálamo y estructuras afines, posiblemente al actuar sobre los receptores de las hormonas peptídicas relacionadas, como el péptido relacionado con el gen de la calcitonina (calcitonin gene-related peptide, CGRP) o amilina. Estos últimos ligandos tienen receptores específicos de gran afinidad y también pueden unirse a los receptores de la CT y activarla. Los receptores de CT tienen una estructura homóloga con respecto al PTH1R. Existen dos genes de la CT, α y β; el control transcripcional de estos genes es complejo. Hay dos moléculas distintas de RNAm que son transcriptas por el gen α; una se traduce en el precursor de la CT y el otro mensaje se transcribe en un producto distinto, el CGRP. El CGRP se sintetiza siempre que se expresa el RNAm de CT, por ejemplo, en el carcinoma medular del tiroides. El gen β, o CGRP-2, se transcribe en el RNAm del CGRP en el sistema nervioso central (SNC); este gen no produce CT. El CGRP posee acciones sobre el aparato cardiovascular y puede actuar como neurotransmisor o intervenir en el desarrollo del sistema nervioso central (SNC). Conclusión: Esquema Integrado del Sistema La homeostasis mineral se mantiene para fines prácticos por la interacción de dos grandes sistemas, a saber: un sistema hormonal que puede considerarse como el componente modulador y en el que la PTH y la vitamina D tienden a conservar minerales y a elevar su concentración en plasma y la CT tiende a disminuir la concentración de los minerales en plasma; un grupo de órganos blanco o componente efector, cuyas principales funciones son: a) La adquisición de minerales a partir de la dieta. b) Su remoción o almacenamiento en las reservas corporales. c) Su eliminación o conservación en los líquidos corporales. El componente modulador estimula o inhibe la actividad del componente efector, mediante la secreción o no de sus hormonas; la actividad secretora de este componente hormonal determina la concentración intra y extracelular de minerales y por la concentración de las mismas hormonas calciotrópicas. En endocrinología esta interacción se conoce como un sistema de retroalimentación o servomecanismo y peculiarmente, en el metabolismo mineral, está constituido por tres componentes: modulador, efector, y regulador; éste último representado por la concentración de minerales en los fluidos corporales (intra- y extracelulares). Para resumir: Cuando la concentración sérica de Ca disminuye, se produce una respuesta instantánea a nivel de las glándulas paratiroides que secretan un pulso de hormona; esta PTH aumentará el recambio esquelético a nivel de la osteólisis y compensará, o sea, elevará la calcemia. Si la hipocalcemia persiste o su corrección es incompleta, se secretará más hormona PTH, lo que a su vez aumentará la reabsorción intestinal y renal de Ca por medio de la producción de calcitriol. Si a pesar de ello persiste la hipocalcemia, se estimulará aun más la reabsorción de Ca a partir de la matriz mineral del esqueleto, al activarse los osteoclastos. Las distintas líneas de respuesta a una hipocalcemia aguda son: Inmediatas: osteólisis osteocítica y reabsorción tubular de Ca. Tardías: absorción intestinal y reabsorción esquelética. Una vez que la concentración de Ca en suero regresa a lo normal, el CaSR en las glándulas paratiroides inactiva la secreción hormonal y mantiene su nivel normal, también conocida como secreción basal. El ritmo 8 de biosíntesis de PTH depende tanto de la actividad secretora como de los niveles producidos de calcitriol. Ambos reguladores (señales retroalimentarias o servomecanismos) dependen a su vez de la concentración extracelular de Ca y de la cantidad de PTH circulante (ver cuadro anexo N°1). Cuando el Ca sérico aumenta, se secreta CT a la circulación en cantidad suficiente para inhibir la osteólisis osteocítica y favorecer la excreción urinaria de Ca; de este modo, la calcemia retorna a su valor normal. Si la calcemia persiste elevada, la CT inhibe la reabsorción osteoclástica y trata de compensar el defecto; simultáneamente se inhibe la secreción de PTH y se inhibe también la síntesis de calcitriol. Estos mecanismos, conllevan a una eliminación mayor de Ca por el riñón, a una disminución del recambio esquelético y a una pobre absorción intestinal del catión, de esta manera la calcemia regresa a los valores normales. (ver cuadro anexo N°2) Con estos dos ejemplos se pretende ilustrar como se integra el sistema al utilizar tres componentes; el modulador de naturaleza hormonal, el efector, que radica en los órganos blancos (hueso, intestino y ileón) de estas hormonas, y el regulado, o sea, la homeostasis del Ca corporal. Acción de otras hormonas sobre el metabolismo fosfocálcico Las hormonas tiroideas. Disminuyen la absorción intestinal y la reabsorción tubular del Ca. Aumentan la resorción ósea. Son hipercalcemiantes. Los estrógenos. Inhiben la resorción ósea. Los esteroides corticosuprarrenales. Disminuyen la absorción intestinal y la reabsorción tubular del Ca. Aumentan la resorción ósea y disminuyen la actividad de los osteoblastos. Aumentan la absorción intestinal y la reabsorción tubular del Ca y del P. La hormona del crecimiento. Aumenta la absorción intestinal y la reabsorción tubular del Ca y del P. Activa la formación del hueso. Bibliografía Jara Albarrán A. Endocrinología. Primera edición. Editorial Médica Panamericana. Madrid 2001. Harrison, et al. Principios de Medicina Interna. Decimosexta edición. Editorial McGraw-Hill Interamericana. Madrid 2005. 3. Farreras-Rozman. Medicina Interna. Volumen II. Decimocuarta edición. Editorial Hardcourt. 2000. 1. 2. 9 Cuadros anexos Cuadro N° 1 Disminución de la calcemia ↑ Secreción de PTH ↓ Secreción de CT ↑ Resorción ósea ↓ Síntesis 24,25(OH)2D3 Riñón Hueso ↑ Síntesis calcitriol Intestino: ↑ absorción Ca/P Riñón: ↓ Calciuria ↓ Fosfaturia ↑Salida de Ca del LEC ↑Osteólisis periostiocitaria ↑Activ y N° de osteoclastos ↓ Calciuria ↑ Fosfaturia Cuadro N°2 Aumento de la calcemia ↑ Síntesis 24,25(OH)2D3 ↓ Secreción PTH Hueso ↓ Síntesis calcitriol Riñón ↑ Secreción CT Riñón Hueso Intestino: ↓ absorción Ca/P ↓ Salida Ca del LEC ↓ Activ y N° osteoclastos 10 ↑ Calciuria ↓ Fosfaturia ↑ Calciuria ↑ Fosfaturia ↓ Osteólisis periostiocitaria ↓ Activ y N° osteoclastos