ENERGÍA y METABOLISMO ENERGÍA y METABOLISMO
Anuncio

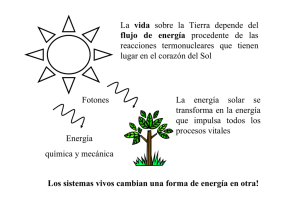
ENERGÍA ENERGÍA y y METABOLISMO METABOLISMO Energía Energía es la capacidad de realizar trabajo. A pesar que existen varias formas de energía: química, luminosa, mecánica, etc. , solo hay dos tipos básicos: Potencial: es la capacidad de realizar trabajo como resultado de su estado o posición. Puede estar en los enlace químicos, en un gradiente de concentración, en un potencial eléctrico, etc. Cinética: es la energía del movimiento, puede existir en forma de calor, luz, etc. • • Energía Potencial – Capacidad para hacer trabajo debido a la posición o estado. – La energía química es energía potencial almacenada en enlaces químicos. Energía Cinética – Energía de movimiento FORMAS DE ENERGÍA CINÉTICA POTENCIAL Luz Electricidad Calor Sonido Rotación Viento Magnética Gravedad Química Elástica Nuclear Masa En términos bioquímicos, la energía representa la capacidad de cambio, ya que la vida depende de de que la energía pueda ser transformada de una forma a otra, cuyo estudio es la base de la termodinámica. Sus leyes son aplicables a los sistemas cerrados o aislados, es decir aquellos que no intercambian energía con el medio que los rodea; las células son sistemas abiertos, o sea pequeñas partes de un sistema cerrado mayor. Las leyes de la termodinámica expresan: 1º Ley: en un sistema aislado la energía no se crea ni se destruye, puede ser transformada de una forma en otra. 2º Ley: no toda la energía puede ser usada y el desorden tiende a aumentar, lo que se conoce como entropía. • Un sistema cerrado no inter-cambia energía con sus alrededores Sistema Cerrado • Los organismos vivos son sistemas abiertos Sistema Abierto Intercambio de energía alrededores alrededores ¿Energía para que? • Reproducción • Crecimiento • Desarrollo • Movimiento • Adaptación • Nutrición - transporte - degradación & síntesis ¿Energía… de dónde? Los organismos vivos capturan, transforman y transfieren energía mediante: Reacciones de oxi-reducción de: - moléculas inorgánicas reducidas - moléculas orgánicas reducidas. Captura de energía lumínica para ser trasnformada en energía potencial (energia química - moléculas orgánicas reducidas) mediante reacciones de oxireducción. ¿Energía… de dónde? Captura y transformación de energía solar ¿Energía… de dónde? Oxidación de Moléculas Inorgánicas Reducidas O2 NO3 Fe+++ QUIMIOAUTOTROFOS ¿Energía… de dónde? heterotrofos Oxidación de Materia Orgánica Oxidación versus Reducción OXIDACIÓN - PÉRDIDA O REMOCIÓN DE ELECTRONES REDUCCIÓN - GANANCIA O ACEPTACIÓN DE ELECTRONES Agente Oxidante y Agente Reductor Gana electrones Pierde electrones + + Agente oxidante Agente reductor Agente oxidante reducido Agente reductor oxidado A esta combinación se le conoce como reacción redox REACCION REDOX C6H12O6 + 6O2 6CO2 + 6H2O + energía Oxidación – Reducción del Carbono OXIDACIÓN Molécula de carbono oxidada Molécula orgánica reducida REDUCCIÓN Oxidación – Reducción del Carbono OXIDACIÓN I C O=C=O I REDUCCIÓN Reconocer el estado redox de moléculas orgánicas utilizando como criterio los grupos funcionales asociados al carbono. OXIDACIÓN I I C C OH I I O II C H O II C OH O II C CH3 REDUCCIÓN O=C=O Los organismos vivos capturan, transforman y transfieren energía mediante las reacciones químicas que integran el metabolismo celular. Metabolismo: – Suma de todas las actividades químicas que se llevan a cabo en un organismo – Anabolismo • Síntesis de moléculas complejas a partir de substancias simples – Catabolismo • Rompimiento de moléculas grandes en moléculas más simples Las reacciones químicas que ocurren en los organismos vivos estan sujetas a las mismas leyes de termodinámica que operan en sistemas cerrados. • Primera Ley de Termodinámica – La energía no puede ser creada ni destruida – La energia puede ser transferida y cambiada de forma. En consecuencia: • La suma de la energía de los productos de la reacción y la de la energía liberada o consumida en la reacción misma es igual a la energía inicial de las sustancias que reaccionan. • Los organismos no pueden producir energía, pero como sistemas abiertos pueden capturar energía de sus alrededores mediante reacciones químicas. •Segunda Ley de Termodinámica – La entropía está en contínuo aumento – Ningún transferimiento de energía es 100% eficiente – Parte de la energía se disipa como calor La segunda ley establece que en el curso de las conversiones energéticas, el potencial termodinámico -o energía potencial termodinámica- de un sistema en el estado final siempre será menor que el potencial termodinámico del mismo sistema en el estado inicial. En consecuencia: Para mantener la organización de la cual depende la vida, los sistemas vivos deben tener un suministro constante de energía que les permita superar la tendencia hacia el desorden creciente. El Sol es la fuente original de esta energía. La energía solar es transformada por los fototrofos en energía alamacenada en enlaces químicos. La energía para la célula proviene en última instancia de reacciones químicas. Reacciones Quimicas Las transformaciones energéticas en las células vivas implican el movimiento de electrones de un nivel energético a otro y, frecuentemente, de un átomo o molécula a otro. Las reacciones químicas son procesos de intercorversión de substancias químicas. Las moléculas que participan en una reacción química se conocen como reactivos o reactantes. Una vez iniciada una reacción química la misma puede evolucionar de dos maneras diferentes: la reacción puede desarrollarse hasta que se agote uno de los reactivos o bien transcurrir hasta un cierto punto en el que, aunque existan reactivos en cantidad suficiente, la reacción, aparentemente, se detiene. A + B C+ D Reacciones Ireversibless A medida que la reacción progresa, disminuye el número de moléculas A y B, y aumenta en número de moléculas C y D. Como las sustancias C y D, no reaccionan entre sí, la reacción continua hasta que las moléculas A y B se consumen. Este tipo de reacción se denomina irreversible . Graficando este caso tenemos: Ejemplo: 2HCl + Zn ZnCl2 + H2 (g) Reacciones Reversibles En el segundo caso se dice que el sistema formado por los reactivos, los productos y el medio de reacción ha alcanzado un estado de equilibrio. A pesar de que un sistema químico en equilibrio parece que no se modifica con el tiempo, esto no significa que no está ocurriendo ningún cambio. Inicialmente, los reactivos se combinan para formar los productos, pero llega un momento en que la cantidad de producto es los suficientemente grande como para que estos productos reaccionen entre sí volviendo a formar los reactivos iniciales. De esta manera transcurren simultáneamente dos reacciones, directa e inversa. El equilibrio se alcanza cuando los reactivos se transforman en productos con la misma velocidad que los productos vuelven a transformarse en reactivos. A + B V1 C+ D V2 En el punto de equilibrio: V1 = V2 Reacciones Reversibles Si la moléculas C y D pueden reaccionar entre sí, la reacción avanzará hacia la derecha mientras la concentración de las moléculas A y B sea importante, a medida que comiencen a formarse moléculas C y D, la velocidad de reacción disminuirá hasta que la concentración de las moléculas C y D sea tal que la reacción comenzará a desplazarse hacia la izquierda, hasta que se establezca un punto de equilibrio, donde ambas velocidades se equilibran, y en el cual coexistirán moléculas A, B, C y D. Este tipo de reacciones se denominan reversibles, y se representan con flecha de ida y vuelta: A+B C+D CH3-COOH + CH3OH ácido etanoico + metanol CH3-CO-O-CH3 + H2O etanoato de metilo + agua Equilibrio Químico Si tenemos un equilibrio de la forma: aA+bB cC+dD Se define la constante de equilibrio Kc como el producto de las concentraciones en el equilibrio de los productos elevadas a sus respectivos coeficientes estequiométricos, dividido por el producto de las concentraciones de los reactivos en el equilibrio elevadas a sus respectivos coeficientes estequiométricos, para cada temperatura. Kc = [C]c[D]d / [A]a[B]b Si K < 1, se favorece la formación de reactivos. Si K > 1, se favorece la formación de productos. Equilibrio Químico • Sólo puede existir equilibrio permenente en un sistema cerrado: un sistema en el que ni la energía ni las sustancias entren o salgan continuamente. • Cuando se alcanza el estado de equilibrio, las propiedades observables del sistema (color, masa del reactivo sin reaccionar, temperatura, etc.), no varían con el tiempo. • Toda situación de equilibrio se altera cuando se modifica la temperatura, pero se restablece cuando el sistema vuelve a la temperatura original. Factores Externos que pueden afectar el Equilibrio Químico 1. Los efectos de la concentración: el aumento de las concentraciones de A y B, produce más C y D para contrarrestar el aumento de A y B. Ocurre lo mismo en el caso inverso. 2. Los efectos de la presión: en el caso de que A o B sean gases, el aumento de presión, el sistema reaccionará disminuyendo su volumen para contrarrestar el aumento de presión, con lo cual la reacción se desplazará hacia la derecha. 3. Los efectos de la temperatura: si la reacción entre A y B libera calor (exotérmica),y retiramos las calorías producidas, el sistema reaccionará produciendo más calor para contrarrestar la pérdida, con lo cual la reacción se desplazará hacia la derecha. Si por el contrario, le suplimos calorías, el sistema contrarrestará la modificación desplazándose hacia la izquierda. La influencia de esos tres factores se puede predecir, de una manera cualitativa por el Principio de Le Chatelier,que dice lo siguiente: Si en un sistema en equilibrio se modifica alguno de los factores que influyen en el mismo (i.e. temperatura, presión o concentración), el sistema evoluciona de forma que se desplaza en el sentido que tienda a contrarrestar dicha variación. Es probable que todas las reacciones químicas puedan producirse en ambos sentidos, pero en muchos casos la magnitud de la reacción inversa es tan insignificante que puede ignorarse. Cuando las condiciones son tales que, tanto la reacción directa como la inversa pueden producirse en magnitud apreciable, el proceso se describe como una reacción reversible. Cada célula desarrolla miles de reacciones químicas que pueden ser exergónicas (con liberación de energía) o endergónicas (con consumo de energía), que en su conjunto constituyen el METABOLISMO CELULAR. Si las reacciones químicas dentro de una célula están regidas por las mismas leyes termodinámicas ... entonces cómo se desarrollan las vías metabólicas? 1. Las células asocian las reacciones: las reacciones endergónicas se llevan a cabo con la energía liberada por las reacciones exergónicas. 2. Las células sintetizan moléculas portadoras de energía que son capaces de capturar la energía de las reacciones exergónicas y las llevan a las reacciones endergónicas. 3. Las células regulan las reacciones químicas por medio de catalizadores biológicos: ENZIMAS. La diferencia entre los potenciales termodinámicos de los estados inicial y final en una reaccin quimica se conoce como cambio en la energía libre (o de Gibss) del sistema y se simboliza como ΔG. Las reacciones exergónicas (que liberan energía) tienen un ΔG negativo y las reacciones endergónicas (que requieren de energía) tienen un ΔG positivo. Los factores que determinan el ΔG incluyen Δ H, el cambio en el contenido de calor, y ΔS, el cambio en la entropía, que es una medida del comportamiento aleatorio o desorden del sistema. Estos factores se relacionan según la siguiente fórmula: ΔG=ΔH - TΔS La entropía de un sistema es una medida del "grado de desorden" o "grado de aleatoriedad" de ese sistema. • Entalpía es la energía potencial total de un sistema • Según aumenta la entropía,disminuye la cantidad de energía libre • H = G + TS • • • • H es entalpía G es la energía libre S es entropía T es la temperatura absoluta en grados Kelvin Entropía La entropía es una función de estado (no puede conocerse su valor absoluto, sino sólo la diferencia entre los estados inicial y final). La entropía mide el grado de desorden de un sistema. Los sistemas desordenados tienen una entropía elevada, mientras que los sistemas ordenados tienen una entropía muy baja. En las reacciones exotérmicas (se produce desprendimiento de calor) aumenta la entropía del entorno. En las reacciones endotérmicas (se absorbe calor) disminuye la entropía del entorno. Reacción Exergónica versus Reacciôn Endergónica • Reacciôn Exergónica – Libera energía con la que se puede realizar trabajo – En reacciones acopladas, suple energía libre para promover una reacción endergônica • Reacción Endergónica conlleva un aumento en la energía libre de los productos Espontaneidad de las reacciones químicas Se denominan procesos químicos espontáneos los que tienen lugar de forma natural en unas condiciones determinadas. Sobre esto pueden hacerse algunas consideraciones: •Algunos procesos espontáneos requieren un estímulo inicial. Es el caso de la reacción de formación del agua. •La espontaneidad no implica nada acerca de la velocidad de los procesos. Por ejemplo, la oxidación del hierro es un proceso espontáneo extraordinariamente lento. •Si una reacción es espontánea en determinadas condiciones, la reacción inversa no lo es en esas mismas condiciones. Así, la descomposición del agua mediante electrólisis no es espontánea, sino que necesita suministro de energía eléctrica y la reacción se detiene cuando se interrumpe el paso de la corriente eléctrica. •La mayor parte de los procesos espontáneos son exotérmicos. Sin embargo, existen excepciones, como la fusión del hielo, que es un proceso endotérmico y espontáneo. • •Existen reacciones no espontáneas a bajas temperaturas, pero que sí lo son a temperaturas elevadas. Es el caso de la descomposición del carbonato de calcio. Ejemplos de reacciones químicas espontáneas Oxidación del hierro expuesto a la intemperie: 2Fe (s) + 3/2 O2 + 3 H2O (l) ® 2 Fe (OH)3 (s) ; DH = -791 kJ Combustión de una cerilla al frotarla: P4S3 (s) + 8 O2 (g) ® P4O10 (s) + 3 SO2 (g) ; DH = -620 kJ Incineración de una mezcla de oxigeno e hidrogeno en presencia de una chispa: 2 H2 (g) + O2 (g) ® 2 H2O (l) DH = -572 kJ Energía de Activación Energía de Activación Y las Enzimas Enzimas – Son agentes catalíticos – Las células regulan la razón de las reacciones quimicas con enzimas. – Disminuyen la energía de activación (energía requerida para romper los enalces quimicos existentes). – Aunque la mayoría de las enzimas son proteínas . Existen tambi´n ciertos tibos de RNA con actividad catalítica (ribozimas). Enzimas – Trabajan mejor dentro de rangos limitados de tempertura y pH. – Virtualmente catalizan la mayoría de las reacciones químicas que ocurren en la célula. – Algunas enzimas consisten solo de poteínas (holoenzimas) – Algunas enzimas tienen dos componentes: • Proteína llammada apoenzima • Cofactor Enzimas Control del Metabolismo por Enzimas • Inhibición por retroalimentación – Formación de un producto final inhibe una reacción anterior en el trayecto metabólico Rate of reaction Rate of reaction Factores que afectan la velocidad de reacciones catalizadas por enzimas Enzyme concentration Substrate concentration Factores que afectan la velocidad de reacciones catalizadas por enzimas Temperatura pH Factores que afectan la velocidad de reacciones catalizadas por enzimas INHIBIDORES • Reversible inhibition – Competitive inhibition • Inhibitor competes for the substrate for the active site – Noncompetitive inhibition • Inhibitor binds with enzyme at a site other than active site – Irreversible inhibition • Inhibitor combines with an enzyme and permanently inactivates it Para-aminobenzoic acid (PABA) Generic sulfonamide (Sulfa drug) INHIBIDOR COMPETITIVO Inactive form of the enzyme Active form of the enzyme Enzyme-substrate complex Cyclic AMP Active Site Substrates Regulator (inhibitor) (a) (b) (c)