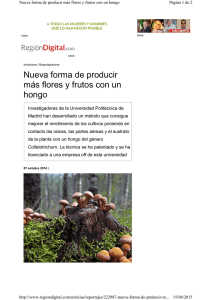
DIAGNÓSTICO DE LA PROBLEMÁTICA ACTUAL DE
Anuncio

DIAGNÓSTICO DE LA PROBLEMÁTICA ACTUAL DE ENFERMEDADES EN EL CULTIVO DE UCHUVA Physalis peruviana L. EN EL DEPARTAMENTO DE ANTIOQUIA LUZ ANGELA SILVA TAMAYO TRABAJO DE GRADO Presentado como requisito parcial Para optar al título de MICROBIOLOGA AGRICOLA Y VETERINARIA PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA AGRÍCOLA Y VETERINARIA Bogotá, D. C. (19 de Septiembre de 2006) 1 NOTA DE ADVERTENCIA Artículo 23 de la Resolución N° 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. 2 DIAGNÓSTICO DE LA PROBLEMÁTICA ACTUAL DE ENFERMEDADES EN EL CULTIVO DE UCHUVA Physalis peruviana L. EN EL DEPARTAMENTO DE ANTIOQUIA LUZ ANGELA SILVA TAMAYO APROBADO Nombre, Título profesional profesional Director Nombre, Título Asesor ________________________ _______________________ Nombre, Título profesional profesional Jurado Nombre, Título Jurado 3 DIAGNÓSTICO DE LA PROBLEMÁTICA ACTUAL DE ENFERMEDADES EN EL CULTIVO DE UCHUVA Physalis peruviana L. EN EL DEPARTAMENTO DE ANTIOQUIA LUZ ANGELA SILVA TAMAYO APROBADO Nombre, Título profesional Profesional Decano Académico Nombre, Título Director de Carrera 4 Este trabajo esta dedicado primero que todo a Dios, a mis padres quienes con su esfuerzo, ejemplo y dedicación hicieron no solo de mi, sino de cada uno de sus hijos unas personas de bien, a mi hija quien me regalo la alegría más grande al llegar a mi vida y es el eje central de todo lo que hago y a mi amor quien hizo parte fundamental de este proyecto, gracias por todo tu tiempo y apoyo. Los amo…. 5 Este proyecto se llevo a cabo gracias a la unión y al esfuerzo de dos entidades en particular la Universidad Nacional sede Medellín, quienes me acogieron, orientaron y brindaron todos los recursos económicos durante el proyecto, en especial la fitopatologa Lucia Afanador Kafury codirectora del proyecto quien siguió paso a paso todo mi proceso, “muchas gracias por tu tiempo y dedicación” y la Pontificia Universidad Javeriana, universidad a la que orgullosamente pertenezco y quienes me enseñaron todo lo que hoy día se como profesional, mil gracias. Agradezco también y muy especialmente a mi Directora Maria Clemencia Forero De la Rotta, quien me apoyo y oriento también durante todo el proyecto, brindándome todo su conocimiento. Reconocimientos también a la empresa exportadota Caribbean Exotics quienes me colaboraron en todo el proceso de campo que se llevo a cabo en el corregimiento de Santa Elena, ya que permitieron que trabajara en su cultivo durante casi un ano y al director de los Uchuveros del municipio de La Unión el señor Erasmo García, quien me guió durante todos mis recorridos y facilito la entrada en mas del 20% de los cultivos de la zona. 6 INTRODUCCION La uchuva (Physalis peruviana L.) es una especie frutícola que se ha venido destacando como un producto de exportación por excelencia, ocupando en la actualidad el segundo lugar, después del banano, en las exportaciones de frutas colombianas con un promedio de 600 ha cultivadas con gran tendencia a crecer y con ingresos de US$ 5.000.000 en exportaciones. La uchuva es una de las frutas más promisorias para el desarrollo de ciertas regiones altas en el país, como Cundinamarca, Boyacá, Antioquia, entre otras. Además es un cultivo con una gran ventaja comparativa para Colombia, que como país tropical puede garantizar un suministro constante en los mercados internacionales. Cada día la uchuva tiene una mayor importancia como fruto de exportación no solo por el lugar que ocupa, sino por la constante apertura del mercado extranjero lo cual incrementa la importancia estratégica de este cultivo en el país. El éxito de este producto en las exportaciones está basado en el manejo oportuno de todos los factores productivos y el cumplimiento de las exigencias que los mercados imponen, dentro de las cuales una de las que ha cobrado gran importancia es el manejo integrado de plagas y enfermedades, aspecto fundamental para obtener un producto de excelente calidad bajo los estándares exigidos por los mercados de exportación. Dadas estas circunstancias, los agricultores tienen que afrontar durante la etapa de producción uno de los aspectos de mayor importancia como es el manejo las enfermedades ocasionadas por hongos, bacterias, nematodos. Además, la uchuva es atacada por algunos insectos-plaga que afectan el capacho, el fruto, y las hojas, ocasionando en algunos casos la pérdida en rendimientos y en la calidad del producto final. Debido a la carencia de información actualizada y confiable sobre problemas fitosanitarios que están afectando a los cultivos existentes, se requirió desarrollar proyectos de investigación tendientes a hacer de este cultivo una actividad productiva, rentable, competitiva y sostenible. Por todo lo anterior, este proyecto busca identificar las principales enfermedades en los cultivos de Uchuva ubicados en la zona del departamento de Antioquia, por medio de muestreos de diferentes tejidos de las plantas en que se sospeche la presencia de enfermedades, buscando así una mayor producción y mejor calidad en este cultivo. 7 MARCO TEORICO Generalidades La uchuva (P. peruviana) bien conocida por los Incas, es originaria del Perú (Legge, 1974), aunque existen indicios de que proviene del Brasil y fue aclimatada en los altiplanos del Perú y Chile (CRFG, 1997). Es una planta silvestre o semi-silvestre que crece entre Colombia y Chile a una altura entre 1500 y 3000 m.s.n.m; es considerada como una fruta tropical con extraordinarias propiedades nutricionales y medicinales. La especie P. peruviana es la mas conocida del género y se caracteriza por tener un fruto azucarado y buenos contenidos de vitaminas A y C, además de hierro y fósforo. (Fischer y Almanza, 1993). Actualmente es producida en Colombia y ocupa el primer lugar en la producción mundial seguido por Sudáfrica y Kenya. De acuerdo con Fischer, (2000), fue introducida por los españoles en Sudáfrica hace más de 200 años y es el segundo país de mayor producción, y de allí la uchuva ha sido distribuida a Kenia, Zimbabwe, Australia, Nueva Zelanda, Hawai y la India, donde se está cultivando comercialmente. Si embargo, hoy se le encuentra sembrada en casi todos los altiplanos de los trópicos, (Verheij y Coronel, 1991) y en varias partes de los subtrópicos, incluyendo Malasia, China y el Caribe, entre otros (Fischer, 2000). En el año 1982 la FAO la caracteriza como una especie muy tolerante que, a pesar de ser originaria de regiones tropicales se adapta bien al clima mediterráneo y se acomoda a cualquier tipo de suelo. La uchuva es apta como planta de cobertura para proteger los terrenos de la erosión, sobre todo por su crecimiento vigoroso y expansión rápida sobre el suelo. En Nueva Zelanda se cultiva en suelos pobres y secos para limitar el crecimiento de la planta y según Klinac (1986), los suelos fértiles contribuyen al desarrollo vegetativo exuberante, mientras con poca fertilidad se induce a la producción de frutos. Se debe tener especial cuidado ya que la uchuva por su rápido y expandido crecimiento, se convierte fácilmente en maleza, si se le deja propagar descontroladamente. (Fischer, 2000). La uchuva es clasificada por Pérez (1986), como maleza común en las tierras frías de Colombia, mientras que Romero (1991) destaca su ventaja por ser muy rústica, crecer en toda clase de suelos, prefiriendo los rastrojos y lugares sombreados. El National Research Council (1989) la describe como una planta pionera para suelos recientemente formados y todavía sin vegetación y destaca su robustez, y habilidad de adaptación; además menciona que esta predestinada para ser cultivada en 8 áreas marginales. También se siembra en asociación con otros cultivos para un uso mas efectivo de la tierra, con frutales como la curuba, feijoa, tomate de árbol y las hortalizas, arveja y fríjol o también con tubérculos, maíz y cereales. Actualmente se cultivan tres tipos de uchuva originarias de Colombia, Kenia y Sudáfrica, pero la colombiana se caracteriza por tener una mejor coloración y mayor contenido de azúcares, características que la hace más apetecible en los mercados internacionales. (Fischer, 2000) La mayor área cosechada de uchuva en Colombia se encuentra en el departamento de Cundinamarca, con 267 hectáreas, equivalentes al 84.5% del total de área cosechada en el país. En el año 2000 se iniciaron los registros de los cultivos de uchuva en los departamentos de Antioquia y Boyacá, con áreas de 28 y 15 hectáreas, respectivamente, que equivalen al 13.6% del área cultivada (Fischer, 2000). Importancia económica La uchuva ha tenido gran auge en los mercados mundiales dadas sus características de fruta tropical exótica que la hacen llamar “fruta de oro”. En los mercados nacionales es una fruta escasamente conocida por las amas de casa de la clase alta y muy poco por otros estratos sociales, o poco valorada por estos, debido a que siempre se ha conocido como maleza, ignorando su alto valor nutritivo, sus grandes propiedades medicinales y el gran aprecio de que goza en los mercados internacionales, donde genera divisas que alcanzan los 5 millones de dólares anuales, ocupando el segundo puesto después del banano, en las exportaciones de frutas colombianas. Según la Corporación Colombiana Internacional, en 1998 Colombia exporto 1.655 toneladas de frutas exóticas, de las cuales la uchuva participo con el 60% de este volumen. La participación de Colombia en los mercados internacionales le ha permitido al exportador ocupar un lugar de importancia teniendo en cuenta que el reto de eficiencia y competitividad les exige trabajar sobre la base del mejoramiento de calidad y tecnificación de sus sistemas de producción. Las exigencias del mercado internacional obligan a que el empresario garantice la calidad del producto en términos fitosanitarios y de empaque, además de asegurar la continuidad de la oferta para que haya permanente abastecimiento. (Rodríguez y Botia, 2000) Entre los problemas mas importantes de la comercialización se destacan: El rechazo del producto para el mercado externo por problemas fitosanitarios y de calidad, tamaño y color. 9 Ausencia de programas de investigación para mejorar el proceso productivo en términos de adopción de tecnologías que redunden en productos de alta calidad para mantener su actual situación en el mercado exterior. (Rodríguez y Botia, 2000). Taxonomía La uchuva (P. peruviana ), que pertenece a la familia de las Solanáceas y al género Physalis, cuenta con más de ochenta variedades que se encuentran en estado silvestre y que se caracterizan porque sus frutos están encerrados dentro de un cáliz acreciente o capacho. Bernal en 1986, afirmó que el género incluye unas 100 especies herbáceas perennes y anuales originarias de América. Sin embargo, en Colombia, primer productor mundial de uchuva, aun no se han seleccionado variedades y solamente se conocen ecotipos o plantas procedentes de diferentes regiones o países, que se diferencian por el tamaño, el color y el sabor, la forma del cáliz y el porte de la planta. Propagación En Colombia los estudios dedicados a la propagación de esta planta son poco conocidos, por ello no se ha logrado la unificación de conceptos y criterios técnicos en busca de un mejoramiento genético del fruto, que logre la aceptación nacional y el favorecimiento de la calidad de exportación. Este producto pertenece a las frutas exóticas conocidas, que por sus características organolépticas ha adquirido elevados precios en el mercado internacional. (Fischer, 2000) Las formas mas conocidas para reproducir la uchuva son: la vía sexual, en donde se emplean semillas; y la vía asexual, que involucra diferentes métodos y partes de la planta. (Almanza, 2000). La mejor vía reproductiva es por semilla la cual varía en su tiempo de germinación dependiendo de la forma de obtención, almacenamiento y tratamientos a que sea sometida (Bernal, 1965). En la propagación por semilla se requiere desarrollar semilleros que permitan su germinación y su posterior transplante a los sitios de siembra. Agroecología Suelo: Para un buen desarrollo de la planta, los suelos que han mostrado mejores resultados son aquellos que poseen una estructura de tipo granular y una textura areno– arcillosa. En algunos cultivos del país se ha encontrado que la planta responde bien a las aplicaciones de materia orgánica. El suelo donde se desarrolla la uchuva debe ser rico 10 en elementos nutritivos con buenos contenidos de Nitrógeno, fósforo y Potasio, además buen contenido de elementos menores y un pH que puede oscilar entre 5,7 y 7,0. Clima En Colombia la uchuva prefiere sitios entre 1800 y 2800 m.s.n.m. con una temperatura promedio anual entre los 13 y 18° C, cuando es muy alta puede afectar la floración y fructificación. En suelos calientes (22-29 °C), las ramas tienden a crecer longitudinalmente produciendo un aumento en el número de frutos, en suelos con una temperatura mayor, como en las laderas expuestas directamente al sol, se aumenta la caída prematura de frutas y hojas por una senescencia anticipada. Pese a que esta planta es considerada como susceptible a las heladas, se ha observado alguna tolerancia cuando son ligeras (Moncada, 1988), sin embargo también se ha observado que después de una baja de temperatura pueden ocurrir rebrotes de las ramas basales; entre tanto, las plantaciones no prosperan cuando las temperaturas nocturnas son constantemente menores a los 10 º C (Fischer, 2000). La precipitación debe oscilar entre 1000 a 2000 mm bien distribuidos a lo largo del año, con una humedad relativa del 70 al 80%. Las precipitaciones demasiado altas, conllevan a un crecimiento vegetativo exuberante y atrasan la fructificación; una alta humedad durante la época de cosecha deteriora el fruto y le causa rajaduras, además este tipo de estrés puede estancar el crecimiento. La humedad del terreno debe ser permanente, sin llegar a sobrepasar la capacidad de campo, ya que la uchuva es susceptible a encharcamientos (Piza Bermúdez, 1989), estos pueden causar la muerte del sistema radical y posteriormente la de la planta. Así, en zonas de alto riesgo de humedad se recomiendan los suelos tipo arcillo-arenoso con un buen drenaje y enriquecidos con un alto porcentaje de materia orgánica. La fructificación de la uchuva parece ser fomentada por una alta radiación solar; sin embargo la planta también crece en asociación con un bosque abierto, bajo cierta sombra. En cuanto al fotoperíodo la planta es aparentemente neutral. (Bernal, 1986). Es recomendable construir una barrera contra los vientos fuertes (López, 1998) ya que en la época de floración estas se pueden caer; además la uchuva se muestra susceptible al volcamiento. (Moncada, 1988). Producción Desde el transplante hasta la primera cosecha transcurren en promedio 90 días, dependiendo de la altitud; en zonas más altas este período es mas largo. Una vez se 11 inicia la cosecha, la producción de uchuva en Colombia es continua a lo largo del año, lo cual permite realizar recolecciones semanales y en ocasiones dos por semana, dependiendo de los grados de madurez y de los requerimientos del mercado; con un adecuado manejo agronómico, especialmente en lo relacionado con las practicas de fertilización, podas, controles fitosanitarios y suministro de agua el cultivo puede alcanzar una vida productiva hasta de dos años (Zapata, 2002). Enfermedades limitantes del cultivo de uchuva La problemática fitopatologica se presenta en las planta desde los primeros estados de desarrollo hasta la fase de poscosecha, con posibilidades de tener una alta incidencia en los costos de producción. Cuando las pérdidas son críticas, los organismos causales de tales enfermedades adquieren importancia económica y se vuelven objeto de observación y estudio; es también cuando el diagnóstico que permite identificar la etiología de las enfermedades resulta primordial para adoptar medidas de control (Blanco 2000). De acuerdo con Blanco (2000), las enfermedades que con mayor frecuencia se presentan en el cultivo de uchuva son: mancha gris, muerte descendente, esclerotiniosis, mal del semillero, secamiento descendente de ápice del cáliz y nemátodos. Mancha Gris La enfermedad conocida como “mancha gris” de hojas y cáliz es causada por el hongo Cercospora sp. y se presenta con mayor intensidad en épocas de alta humedad y se considera como la principal enfermedad foliar de la uchuva (Moncada, 1988 y Blanco, 1992). Los síntomas pueden aparecer indistintamente en cualquier parte de la lámina foliar preferentemente en el área que delimita el ápice, como también en el capacho, en forma de manchas de forma angular o redonda, de un tamaño de 2 a 5 mm inicialmente de color verde claro; por el haz el borde de la lesión se torna amarillento y su parte central adquiere un color marrón de aspecto seco y quebradizo. Se observa que generalmente la infección ocurre primero en las hojas más viejas y avanza hacia el follaje nuevo. Las infecciones severas ocasionan una defoliación y pérdida de frutos; es una enfermedad limitante de la producción (Blanco, 2000). 12 Muerte descendente La enfermedad es ocasionada por el hongo Phoma sp. que se puede localizar en los tallos, hojas, capachos y frutos de las plantas en cualquier estado de desarrollo. En las hojas los primeros síntomas se presentan como manchas oscuras muy pequeñas, que ocurren cuando se presenta alta humedad y temperatura baja, luego las lesiones se pueden unir dando origen a grandes manchas necróticas de forma irregular (Zapata, 2002). Este hongo se encuentra en la uchuva atacando principalmente los tallos, en donde se forman lesiones alargadas que producen la muerte descendente de los mismos. Aparecen manchas en forma de zonas poco definidas que van desde color verde pálido hasta el amarillento, las cuales gradualmente se delimitan con mayor claridad, apareciendo en el centro de las mismas un color gris ceniza, donde se encuentran los picnidios o cuerpos fructíferos del microorganismo (Blanco, 2000). Las lesiones también se encuentran presentes en el cáliz o capacho, mostrando los mismos síntomas que ocasionan en las hojas; la mancha avanza en forma irregular, tomando una coloración café claro en los primeros estados, que luego se torna más oscura. El fruto también puede ser atacado por el patógeno, mostrando que la enfermedad en la mayoría de los casos se inicia en el punto de inserción del fruto con el pedúnculo. Generalmente la lesión rodea el tejido y avanza hasta el extremo opuesto del fruto, la mancha se torna mas oscura y cuando se presenta alta humedad se desarrolla un micelio de color blanco (Zapata, 2002). Marchitez de las ramas A pesar de que Moncada en 1988 menciona que esta enfermedad es muy similar a la muerte descendente, atribuye su causa a complejo fungoso, de donde se han aislado los hongos Gloesporium sp y Phoma sp; sin embargo Forero de la Rotta et all en el 2005 atribuye como agente causal del marchitamiento y muerte de las plantas, al microorganismo Fusarium oxysporum Schlechtendahl. Esclerotiniosis También se conoce con el nombre de moho blanco, pudrición blanca algodonosa, enfermedad del esclerocio y pudrición dura (Blanco, 2000). Es causada por el hongo Sclerotinia sclerotiorum, se manifiesta por la presencia de lesiones de apariencia húmeda, con áreas de tejido decolorado que se vuelven de color plomizo-marrón y están 13 cubiertas por un micelio blanco algodonoso, presente en diferentes partes de la planta pero con mas frecuencia en el tallo principal a nivel del cuello de la planta (Blanco, 2000). La médula central del tallo se destruye y el vacío se llena con un micelio blanco que posteriormente se transforma en esclerocios duros y negros de 0.5 a 1.0 cm de largo; la planta se adormece completamente y el tallo se quiebra a nivel del suelo, cuando los esclerocios germinan, forman capas miceliales y pequeños apotecios en forma truncada desde los cuales las ascosporas son liberadas y se transportan por el viento e infectan las hojas y los tallos de muchas de las dicotiledóneas cultivadas y malezas (Blanco, 2000). Mal del semillero Los hongos, Pythium sp., Rhizoctonia sp. y Fusarium sp, producen síntomas muy similares en cualquiera de las fases de desarrollo de la plántula, sin embargo al parecer el primero de ellos es el más importante (Zapata, 2002). Los síntomas producidos por la enfermedad en los semilleros varían con la edad y la etapa de desarrollo de las plántulas, pero el síntoma mas común es la pudrición de las raíces y/o de los tallos, sin embargo también se presenta amarillamiento y necrosis de las plántulas, acompañadas de depresiones en la base de los tallos. El mal de semillero se puede presentar en todos los cultivos que requieran de la práctica de germinación de la semilla, desarrollo de las plántulas y su posterior transplante al campo. Cuando el ataque de la enfermedad es temprano y la humedad en los semilleros es excesiva, las pérdidas pueden llegar a ser del 100%. Moho gris Agente causal Botrytis sp, causan síntomas que consisten e manchas necróticas de forma irregular que al colocarlos en condiciones de cámara húmeda desarrollan un micelio de color gris, que puede cubrir completamente el fruto; también afecta eventualmente las hojas. (Zapata, 2002). Carbón de la hoja: El agente causal es atribuido al hongo Entyloma australe Schlechtendahl. registrado desde 1975 por Molina y recientemente evaluado en campo por Forero de La Rotta et all en el 2005. 14 Las lesiones ocasionadas por este hongo en hojas, se inician con manchas circulares o angulares cloróticas y bordes definidos. conforme el microorganismo avanza en el tejido vegetal, la mancha toma una coloración café en el centro que se va extendiendo en forma de pústula en la superficie de la hoja rodeado de un halo clorótico bien definido, en algunas ocasiones se evidencia alrededor de la lesión una coloración púrpura como resultado de las antocianinas producidas en respuesta por la planta, Especialmente en estados finales de daño se hace referencia al desprendimiento de los tejidos enfermos que con el tiempo se contraen y forman ampollas; En ambos casos, en el envés de las hojas se observa la producción de estructuras reproductivas del hongo por la coloración blanquecina que toma. Microscópicamente se observó micelio hialino con producción de basidiosporas y teliosporas. (Forero De La-Rotta, 2005) Enfermedades de poscosecha De acuerdo con Rao y Subramonian (1976) el secamiento descendente del cáliz es atribuido al complejo de hongos Cladosporium sp. y Alternaria sp.; en este caso inicialmente el ápice cambia de turgencia, se acartona, se vuelve seco y áspero al tacto; el color verde amarillento normal en esta época de maduración del fruto se torna pálida y translúcida y se produce un secamiento gradual del cáliz en dirección de la base, en esta fase el fruto como tal no es afectado. Posteriormente el cáliz se seca completamente y los frutos caen al suelo en su mayoría; en frutos con cáliz, Sharma y Khan (1978) reportan la presencia de estructuras de Cladosporium sp. y Alternaria sp., además mencionan que en frutos inoculados con Alternaria sp. se produce una decoloración inicial del tejido y más tarde lesiones oscuras hasta de 1cm de diámetro, seguidas por la formación de una masa fungosa de color verde oliváceo; el hongo Cladosporium sp. produce lesiones café oscuras de 0.5 a 1 cm de diámetro. Mancha grasienta Las pérdidas causadas por enfermedades bacterianas en uchuva son generalmente de menor importancia que las causadas por hongos y virus. Sin embargo, en algunos casos, los cultivos se ven seriamente limitados en su crecimiento a causa de un patógeno bacteriano muy destructivo en diferentes etapas de la planta (Billing, 1987). El organismo causal es posiblemente Xanthomonas sp. no se conoce el mecanismo de diseminación de la enfermedad, ni los factores climáticos favorables para su desarrollo. El daño consiste en la presencia de manchas pequeñas que en pocos días se tornan grandes y decoloran el tejido dando la apariencia de papel parafinado o engrasado. El patógeno no afecta el fruto, pero deteriora su apariencia reduciendo la calidad para el 15 mercado externo; como el producto con destino al mercado nacional se consume sin capacho, este daño no reviste importancia. Hasta ahora no se conocen métodos de control en campo (Zapata, 2002). Marchitez bacterial El organismo causal Ralstonia solanacearum Schlechtendahl. (Smith) Yabunchi et al. puede atacar muchas especies de la familia de las Solanáceas, se disemina fácilmente por herramientas, por el agua de riego o por las lluvias. El síntoma de la enfermedad en condiciones de campo, consiste en la marchitez de la planta, con una mayor evidencia en las horas de mayor temperatura. Cuando se inicia el síntoma, la planta no muestra clorosis. Sin embargo después de tres o cuatro días calurosos los tejidos se tornan amarillos y luego se mueren. La enfermedad se puede presentar e cualquier estado de desarrollo del cultivo; inicialmente solo una o pocas plantas muestran los síntomas pero si las condiciones son favorables para el desarrollo de la enfermedad se puede diseminar al resto del cultivo. Al realizar un corte del tallo de plantas fuertemente afectadas por la enfermedad se pueden observar rayas angostas de color oscuro que corresponden a los haces vasculares infectados (Zapata, 2002). La enfermedad se puede transmitir fácilmente mediante herramientas utilizadas para las podas, labores de desyerba y la cosecha. Cuando la enfermedad se presenta, las plantas no tienen capacidad de recuperación y no existe control para combatirla (Zapata, 2002). Ojo de gallo El organismo causal es de etiología desconocida, sin embargo todas las características del patógeno llevan a suponer que es de origen bacterial. Debido a su baja incidencia no se conoce la importancia de los daños que ocasiona, ni las estrategias de manejo. En condiciones de campo la enfermedad se presenta afectando principalmente las hojas, como manchas necróticas de color marrón oscuro, rodeadas de un halo clorótico y formando en el centro un punto de color claro asemejando la forma de un ojo (Zapata, 2002). Los nemátodos como patógenos La importancia económica de los nemátodos en el cultivo de uchuva, no solo se debe a la amplia distribución eco-geográfica como fauna nativa del suelo, potencialmente capaz 16 de invadir con severidad y adaptarse a un monocultivo causando directamente en las plantas lesiones, clorosis, deformaciones de los órganos y pérdida de vigor, sino también, a que en el sitio donde se inicia el ataque se convierte en puerta de entrada para hongos, bacterias y virus que pueden llegar a causar daños mas severos que aquellos ocasionadas por el nemátodo mismo (Blanco, 1992). Nemátodos formadores de nódulos en uchuva El nemátodo reportado como agente causante de enfermedades en uchuva es el denominado nemátodo del nódulo de la raíz, Meloidogyne sp. Estos nemátodos son polífagos y se encuentran desde zonas frías hasta zonas cálidas; sus daños son particularmente serios en suelos arenosos. Los ataques de los nemátodos favorecen las infecciones por bacterias, hongos y otros patógenos que pueden llegar a causar daños más severos que aquéllos ocasionados por los mismos nemátodos (CIP, 1996) Existen diversas formas de manejar la enfermedad, las que reducen la población de los nemátodos y sus daños; rotación de cultivos con cereales, períodos de barbecho con ruptura del suelo y abonamiento con grandes cantidades de materia orgánica. El tratamiento con fumigantes de suelo puede ser muy costoso (Blanco, 2000). Para el control cultural se deben tener en cuenta las siguientes recomendaciones: conocer la población del nemátodo problema y sus hospederos, rotación de cultivos, estricto control de malezas, en lo posible utilizar cultivos trampa y solarizar el suelo mediante barbechos. 17 Formulación del problema y justificación: Formulación del problema: El departamento de Antioquia es una de las zonas productoras de uchuva importantes en Colombia y debido a la carencia de información actualizada sobre problemas fitosanitarios, se realizo la evaluación de los agentes causales y la incidencia de estos, haciendo referencia a la importancia que desde el punto de vista económico están ocasionando las enfermedades en uchuva y al desconocimiento por parte de los productores, asistentes técnicos y comunidad en general de su forma de manejo dado que la etiología de algunas de las enfermedades en uchuva aun no se conoce claramente, además es necesario conocer la relación de las mismas con el estado de desarrollo de las plantas o su estado fenológico. Justificación de la investigación: Colombia esta reconocido actualmente como un país productor potencial de uchuva, y gracias a esto su producción es continua a lo largo del año, sumado a lo anterior las exportaciones de esta fruta tropical se han incrementado alrededor de 50% en los últimos años, por esta razón han merecido importancia todos aquellos inconvenientes que se pueden generar en la producción del fruto especialmente las plagas y enfermedades que afectan la producción. Una de las zonas productoras de uchuva en Colombia es la región de Antioquia principalmente los municipios de Santa Elena y La Unión, de la cual la información que se tiene es muy poca y no es actualizada. Este trabajo se centró en el estudio de los diferentes agentes causales de enfermedades en la uchuva, consistente en el aislamiento, identificación y pruebas de patogenicidad para la confirmación de signos y síntomas asociados con la enfermedad en cultivos de los municipios productores del departamento de Antioquia y conocer su incidencia de acuerdo con el estado de desarrollo de las plantas. 18 Objetivos: Objetivo general: Conocer las principales enfermedades que se presentan en los cultivo de uchuva (Physalis peruviana L.) localizados en la zona productora de Antioquia y su relación con el estado fenológico de las plantas. Objetivos específicos: 9 Conocer la etiología de los agentes causales de las enfermedades y describir los síntomas de las enfermedades ocasionadas por hongos, bacterias y nemátodos desde semillero, hasta poscosecha. 9 Demostrar la patogenicidad de los microorganismos aislados. 9 Conocer la incidencia de las enfermedades de acuerdo con el estado fenológico de las plantas. Materiales y métodos. Localización del Estudio La fase de reconocimiento y análisis del estado fitosanitario de los cultivos de uchuva, se llevo a cabo en 14 fincas productoras de los municipios de La Unión y en el corregimiento de Santa Elena, Departamento de Antioquia. El municipio de La Unión, está localizado a una altura de 2500 m.s.n.m., tiene una temperatura media de 13°C y la precipitación media anual es de 2000 mm. El municipio de Santa Elena presenta una altitud de 2500 m.s.n.m; con una temperatura media aproximada de 18-20°C, limita al norte con Guarne, al este con Rionegro, por el sur con La Ceja y al oeste con Medellín. La fase de aislamiento, identificación y multiplicación de los agentes fitopatógenos se llevó a cabo en el Laboratorio de Sanidad Vegetal de la Universidad Nacional de Colombia, Sede Medellín, localizado en la ciudad de Medellín a una altura de 1550 m.s.n.m, y una temperatura promedio entre 18 y 28 C . Evaluación preliminar de la zona de estudio En las zonas productoras se realizaron 5 visitas con el fin de determinar de forma preliminar la situación fitosanitaria de los cultivos y planear la estrategia de muestreo a seguir. En esta primera fase del estudio, se adelantó el diagnóstico de las enfermedades mediante un análisis previo de las condiciones del cultivo, en donde se colectó la 19 información relacionada con variedad utilizada por el agricultor, tipo de suelo, temperatura de la zona, altitud, edad del cultivo, distancia de siembra, las prácticas de riego, fertilización y la aplicación de plaguicidas. La fase siguiente consistió en identificar las posibles enfermedades presentes en el cultivo mediante la observación detallada de síntomas y características asociadas a estas en tallos, ramas, hojas, flores, frutos y en los casos necesarios en raíces. Esta información fue consignada en un formato elaborado específicamente para ello (Anexo 1). Colecta y procesamiento de muestras en campo La colecta de material vegetal con posibles síntomas de enfermedad se realizó en 14 fincas, con base en 100 plantas para las fincas localizadas en el municipio de Santa Elena y 1000 plantas para la finca propiedad de Caribbean Exotics en La Unión. Cada muestra de hojas, tallo, flores, frutos o raíces correspondientes a un tipo diferente de síntoma, fue empacada en papel toalla y luego en bolsa plástica. Las muestras una vez colectadas, se almacenaron en una nevera portátil para mantener las condiciones de humedad y baja temperatura para evitar el deterioro de los tejidos. Luego se llevaron al Laboratorio de Sanidad Vegetal para su procesamiento. En aquellas plantas con posibles síntomas de enfermedades causadas por nemátodos, se tomaron muestras de raíz y de suelo, para ser utilizados en la extracción e identificación de los mismos. A cada muestra se le abrió una ficha de identificación en la cual se consignó toda la información correspondiente a el tipo de suelo, la temperatura de la zona, la altitud, la edad del cultivo, la distancia de siembra, las prácticas de riego, fertilización y la aplicación de plaguicidas, también se consigno el tipo de síntomas colectado y las observaciones macro y microscópicas que se hacían durante el proceso de aislamiento e identificación de cada una. Esta fase del estudio fue realizada con la colaboración y asesoría del presidente de la Asociación de Uchuveros del municipio de La Unión, el señor Erasmo García y la coordinadora de la empresa exportadora Caribbean Exotics en el corregimiento de Santa Elena, la señora Andrea Rodríguez. 20 Aislamiento e identificación de Agentes Fitopatógenos Aislamiento de Bacterias En los casos en los cuales se sospechó enfermedad de origen bacteriano, de los órganos afectados se tomó una porción de tejido que comprendía una zona enferma y sana. El tejido fue luego desinfestado en hipoclorito de sodio al 1% por un tiempo de 2 minutos y luego se lavo con agua destilada estéril. La muestra se depositó sobre una gota de agua estéril en un portaobjetos previamente flameado y se maceró con la ayuda de un bisturí. La suspensión resultante, se dejo en reposo por 10 minutos y luego se sembró en medio agar nutritivo (AN), utilizando un estriado por agotamiento de tal manera que permitiera una dilución de las bacterias presentes y el desarrollo de colonias individuales. Las cajas de Petri se incubaron a una temperatura de 25-28oC por un tiempo de 24 a 48 horas. Transcurrido el tiempo de incubación, se tomaron las colonias individuales y se repicaron nuevamente en AN utilizando la misma técnica. Una vez asegurada la pureza de las colonias bacterianas, estas se almacenaron a 4ºC en viales con agua destilada estéril. Cada cultivo bacteriano fue luego caracterizado mediante una prueba de tinción de Gram, KOH al 3% y observación de las características macro y microscópicas tales como: color de la colonia, aspecto y tiempo de crecimiento. Aislamiento de Hongos Las muestras que presentaban síntomas de marchitamiento vascular, manchas foliares o con evidentes signos de enfermedad causada por hongos, se incubaron durante 3-6 días en cajas plásticas acondicionadas con una rejilla y agua en el fondo a manera de cámaras húmedas, para estimular la esporulación y el desarrollo de estructuras reproductivas y vegetativas que permitieran la identificación de los hongos presentes. Simultáneamente a la incubación en cámara húmeda, se hizo aislamiento e identificación de los hongos de cada una de las muestra con síntomas de posibles enfermedades fungosas. El aislamiento consistió en cortar porciones de tejido sano y enfermo de aproximadamente 0.5 cm, desinfestación en etanol al 70% por 1 minuto y en hipoclorito de sodio al 1% por dos minutos, seguido de lavado en agua destilada estéril y siembra en medio de cultivo PDA Papa Dextrosa Agar (PDA acidificado). Los tejidos aislados se dejaron en incubación a una temperatura de 25- 28ºC, por un tiempo de 5 a 10 días y se efectuaron revisiones periódicas a fin macroscópicas de los hongos resultantes. 21 de evidenciar características micro y Posteriormente, las colonias obtenidas se purificaron mediante la siembra de un bloque de Agar con micelio en medio PDA acidificado, obtenido a partir del borde de la colonia desarrollada. Una vez purificados los hongos, cada uno se almaceno en papel filtro a una temperatura de 4ºC. Para determinar el mejor medio para el crecimiento y esporulación de los hongos aislados, se realizó una prueba preliminar en los medios de cultivo PDA, Agar avena, Agar Marthur y Agar jugo V8. Para este ensayo se sembraron los hongos en los diferentes medios de cultivos y se evaluó la rata de crecimiento y la esporulación que presentaron escogiendo así el medio en el cual obtenían un mejor desarrollo. El mejor medio fue utilizado para la multiplicación masiva de cada hongo con el fin de obtener inóculo suficiente para las pruebas de patogenicidad. La identificación de los hongos, se hizo con base en la observación macroscópica de características como producción de pigmentos en el medio de cultivo, tipo de micelio producido, textura, tamaño de las colonias, tipo y velocidad de crecimiento, entre otros, además de las observaciones al microscopio del tipo de micelio, presencia o ausencia de cuerpos fructíferos y tipo de espora. Para la extracción de nemátodos se utilizó la técnica del Embudo de Baermann en combinación con el empleo de tamices para la separación de huevos y estados juveniles de los nematodos presentes en la muestra. Este ensayo se llevo a cabo en Agrolab; Asistencia Agroindustrial de la ciudad de Medellín. Pruebas de patogenicidad de bacterias y hongos: Para las pruebas de patogenicidad se utilizaron plántulas de uchuva de tres meses de edad y frutos verdes de la variedad usada por los productores de la zona. Las inoculaciones se llevaron a cabo en la casa de malla de la Unidad Experimental Paysandú perteneciente a la Universidad Nacional de Colombia, sede Medellín, localizada en el corregimiento de Santa Elena, bajo una temperatura promedio de 18 a 20 y humedad relativa alta, además se sometieron a condiciones de cámara húmeda. Preparación de inóculo e inoculación de bacterias Para la preparación del inóculo, cada bacteria fue crecida en medio AN por un periodo de 48 horas y una temperatura de 25 - 28 ºC. Con los cultivos resultantes se prepararon suspensiones acuosas. 22 Las suspensiones acuosas se prepararon depositando 20 mililitros de agua destilada estéril sobre la colonia obtenida, seguido de la remoción de la misma con un portaobjetos estéril. De la suspensión resultante se preparó una dilución 1:10 y ésta se utilizó como solución de trabajo para la inoculación. La inoculación se hizo mediante aspersión de la suspensión bacteriana en 15 frutos de uchuva. Cada fruto con capacho fue asperjado individualmente con la ayuda de un atomizador plástico hasta humedecerlo completamente. Una vez inoculados los frutos con capacho, se colocaron en una caja plástica con tapa y acondicionada con una rejilla y agua destilada en el fondo, para garantizar condiciones de humedad. Las cajas con los frutos se incubaron a temperatura ambiente 25 - 28 ºC. por un período de 14 días, haciendo observaciones cada 3 días. Una vez identificado el género bacteriano como el agente causal de la enfermedad, se realizo una caracterización final e identificación de géneros y especies por medio de reacciones bioquímicas y crecimiento en medios selectivos y específicos. Este análisis se llevo a cabo en Agrolab; Asistencia Agroindustrial en la ciudad de Medellín. Preparación de inóculo e inoculación de hongos La preparación de inóculo se hizo a partir de cultivos de cada hongo crecidos por 10 días en el mejor medio para esporulación de cada uno de ellos. Se prepararon suspensiones acuosas de micelio y/o esporas mediante la adición a cada caja petri de 100 mililitros de agua destilada más 0.1% de tween 20, seguido de la remoción del micelio y las esporas con un portaobjeto estéril y filtración de la solución resultante a través de un pedazo de muselina. La concentración de propágulos (esporas o micelio) fue determinada en un hemocitometro y se ajusto hasta obtener una lectura final de 1x10 -6 esporas por mililitro y de 1x104 propágulos por mililitro. Las suspensiones acuosas de cada hongo fueron utilizadas para la inoculación de plántulas de tres meses de edad, 25 para cada hongo y de 24 frutos con capacho verdes de uchuva. Inoculación En el caso de patógenos foliares y del fruto, la inoculación se hizo por aspersión con un atomizador plástico de la suspensión acuosa de esporas. Para los patógenos de la raíz, el método de inoculación consistió en hacer un corte en las puntas de las raíces de cada 23 planta, seguido de la inmersión de éstas en una suspensión de las esporas del hongo por un tiempo de 30 minutos y luego de la siembra en materos con suelo esterilizado. Aquellos hongos en los cuales no se logró esporulación, fueron inoculados mediante el método de disco de Agar con micelio. Los discos de Agar con micelio, se cortaron a partir de colonias activas del hongo y luego se depositaron dos discos sobre el haz de la hoja, uno a lado y lado de la nervadura central. Después de inoculadas, las plantas fueron cubiertas con una bolsa plástica para mantener condiciones de humedad alta y favorecer la germinación de las esporas y promover el proceso de penetración e infección de los hongos. Las bolsas fueron mantenidas por tres días y después se abrieron parcialmente, al quinto día se removieron totalmente y las plantas se dejaron sobre las mesas de la casa de malla. (Figura 1). Figura 1. Condiciones de inoculación e incubación de plántulas de uchuva con cada uno de los patógenos evaluados. A: Detalle del método de inoculación por disco de Agar; B: Detalle del método de inoculación por aspersión; C: Plántulas cubiertas con bolsa plástica a manera de cámara húmeda La evaluación de aparición y desarrollo de síntomas en las plantas inoculadas se hizo semanalmente durante 6 semanas. Trabajo de campo La fase de campo consistió de dos etapas: una primera etapa de reconocimiento de las enfermedades más importantes del cultivo, selección de las fincas para el muestreo y determinación del número de plantas para conocer la incidencia de cada enfermedad. La segunda etapa correspondió a la toma de muestras de tejido enfermo para corroborar la presencia de cada una de las enfermedades identificadas durante la primera etapa. El muestreo y evaluación de las enfermedades reconocidas como más importantes para el cultivo se hizo sobre el 20% del área sembrada en cada zona: 14 cultivos 24 correspondiente a 14 fincas en el municipio de La Unión, pertenecientes a productores pequeños y un único cultivo en el municipio de Santa Elena, el cual pertenece a la empresa Caribbean Exotics, compañía exportadora de fruta. En cada uno de las fincas productoras del municipio de La Unión se evaluó sobre una población de 100 plantas, la incidencia de cada una de las enfermedades previamente reconocidas de acuerdo con el estado fenológico de la planta. En todos los casos se seleccionaron cultivos que se encontraban en diferentes estados de desarrollo; para este efecto se establecieron las siguientes fases de acuerdo con el estado vegetativo o productivo de las plantas: Etapa 0: Plántulas de 0 – 1 mes Etapa 1: Plantas en inicio de producción Etapa 2: Plantas en plena producción Etapa 3: Plantas en baja producción Etapa 4: Frutos en poscosecha La evaluación sobre las plantas se hizo determinando sobre el tallo el número de ramas, hojas, capachos y frutos afectados por la enfermedad en relación con los aparentemente sanos o el total de los tejidos de la planta. En el caso de las plantas que presentaron marchitamientos vasculares se midió la cantidad de plantas con los síntomas de la enfermedad sobre las 100 plantas evaluadas. En el cultivo de la finca de propiedad de la empresa Caribbean Exotics, el muestreo se hizo de manera aleatoria en todas las 9000 plantas del cultivo y se midió la incidencia en 1000 de estas plantas, siguiendo la misma metodología que se utilizó en los cultivos de La Unión. Resultados y discusiones: Fase de Reconocimiento La fase de reconocimiento en las fincas seleccionadas para el estudio dio como resultado la identificación preliminar de seis posibles enfermedades en hojas, fruto y en planta en general. La sintomatología asociada a estas enfermedades estuvo caracterizada por: a) Mancha gris de forma angular a redondeada en hojas, con tamaños de 2 a 5 mm, las cuales tienen inicialmente un color verde claro o grisáceo, luego la lesión se torna amarilla en el borde y en la parte central se torna de color marrón y con una consistencia seca y quebradiza (Figura 2) 25 A. B. C. Figura 2. Características principales de la sintomatología en hojas y frutos de plantas de uchuva afectadas por mancha gris. A: Síntoma en capacho del fruto; B. Sintomatología en hojas grado de infección severa; C. Síntomas característicos en hojas de tres tamaños y edades diferentes. b) dormidera o marchitamiento vascular en plantas, clorosis general y necrosis de los haces vasculares observados en cortes transversales hechos en la parte basal de los tallos (Figura 3). A. C. B. Figura 3. Plantas de uchuva afectadas con dormidera o marchitamiento. A: planta presentando el síntoma típico de dormidera o marchitamiento; B: detalle de un corte transversal en tallo, en el que se observa la necrosis en haces vasculares; C: clorosis y marchitamiento. c) muerte descendente, caracterizada por manchas necróticas de forma irregular y centro gris en hojas. En los frutos, la enfermedad se inicia en el pedúnculo y luego avanza hasta necrosarlos completamente (Figura 4). En el envés de las hojas, la lesión presenta el desarrollo de estructuras negras a manera de cuerpos fructíferos semejantes a picnídios. Figura 4. Sintomatología típica de muerte descendente en frutos. Nótese el desarrollo de manchas necróticas avanzando en el capacho del fruto. 26 d) manchas en hojas de color café oscuro a negro, forma irregular y borde amarillento. En frutos las manchas son de forma redondeada y presentan anillos concéntricos (Figura 5). A. B. Figura 5. Manchas en hojas y frutos de uchuva. A: manchas de color café oscuro y anillos concéntricos en frutos; B: manchas oscuras en hojas y con halos cloróticos. e) manchas oscuras de color morado en hojas y frutos (Figura 6). A. B. C. Figura 6. Síntomas típicos de mancha morada en hojas y frutos de uchuva. A: manchas en hojas y fruto; B: manchas en fruto y C: detalle de los síntomas en el capacho del fruto. e) mancha grasienta en frutos, caracterizada por la presencia de áreas de aspecto grasoso en el capacho las cuales le dan a este un aspecto parafinado o apergaminado (Figura 7). Figura 7. Frutos de uchuva con síntomas de Mancha Grasienta en la parte superior del capacho. 27 Muestras representativas de cada una de las posibles enfermedades fueron procesadas en el laboratorio según se describe en la sección de materiales y metodología. La información correspondiente a cada muestra se presenta de forma amplia en el Anexo 3. Aislamiento e identificación de agentes fitopatógenos Aislamiento de Bacterias Las plantas con síntomas de marchitamiento vascular y mancha grasienta fueron procesadas para evaluar la presencia de bacterias asociadas a este tipo de sintomatología. De las muestras con síntomas de marchitamiento se obtuvo en su mayoría el crecimiento de un hongo de micelio blanco algodonoso y crecimiento rápido. Las muestras con síntomas de mancha grasienta presentaron crecimiento bacteriano en medio AN. Las bacterias resultantes presentaron colonias de color blancas puntiformes mucosas, convexas con borde continuo, superficie lisa. El análisis de los cultivos puros de éstas dio como resultado bacilos muy cortos Gram negativos, KOH positivas este se pudo identificar por medio de reacciones bioquímicas entre las cuales se utilizó Lisina TSI, Citrato, SIM, MRVP, Urea entre otros. Aislamiento de Hongos Las muestras con síntomas de dormidera o marchitamiento, mancha gris, muerte descendente, macha foliar y mancha morada fueron procesadas para evaluar la presencia de hongos asociados a este tipo de enfermedades. La incubación en cámara húmeda y crecimiento en medio de cultivos de los tejidos con cada una de estas sintomatologías dio como resultado lo siguiente: Mancha gris en hojas y frutos Se observo el desarrollo de un crecimiento micelial de color gris sobre las lesiones en hojas y frutos. La observación al microscopio de los micropreparados del micelio y estructuras reproductivas, indicó la presencia de conidias y micelio típicos del hongo Cercospora sp. Se observan conidioforos de color pardo oscuro que se desarrollan a partir de estromas inmersos en el tejido del capacho del fruto. A partir de los conidioforos se desarrollan conidias hialinas, filiformes o en forma de mazo y con dos o más septos. 28 Las colonias del hongo en medio de cultivo Agar V8 presentan un crecimiento lento (0.25 cm/día), son compactas, de color blanco cuando jóvenes y a medida que maduran se tornan de color gris y una tonalidad palo de rosa hacia el centro de ésta. El crecimiento radial es muy bajo y presenta un aspecto abultado o de crecimiento hacía arriba (Figura 8). Figura 8. Colonia típica de Cercospora sp en medio de cultivo Agar V8 El hongo Cercospora sp. pertenece a la clase Deuteromycetes, Orden Moniliales, Familia Moniliácea, género Cercospora. En uchuva ha sido reportado por Blanco, (2000) y Moncada (1988) produciendo manchas en forma angular o redonda, de un tamaño de 2 a 5 mm, inicialmente son de color verde claro o gris; por el haz el borde de la lesión se torna amarillento y su parte central adquiere un color marrón de aspecto seco y quebradizo. Marchitamiento vascular o dormidera Las muestras con síntomas de dormidera o marchitamiento fueron procesadas para evaluar la presencia de hongos asociados a este tipo de enfermedad; además de los síntomas descritos anteriormente, en el momento de la recolección se realizaron cortes en la base del tallo, donde se observó que en los haces vasculares presentaron coloraciones oscuras como consecuencia de la obstrucción de los mismos, por las microconidias y micelios que produce el microorganismo. En medio de cultivo PDA se obtuvo el crecimiento de un hongo con colonias de color blanco con un ligero pigmento rosado perteneciente a la clase Deuteromycete, con dos tipos de conidias (macro y microconidias) hialinas y septadas, micelio hialino y septado, características que lo ubican en el género Fusarium y muy posiblemente en la especie F.oxysporum (Figura 9). Esta enfermedad se registra por primera vez en los cultivos ubicados en la zona de Antioquia y recientemente fue reportado por Forero de La-Rotta (2005) en la zona productora de Cundinamarca y Boyacá, ocasionando síntomas similares a los encontrados en este estudio. 29 A. B. Figura 9. Características microscópicas 40X de Fusarium oxyporum obtenido de la parte basal de tallos y raíces de uchuva. A. Macroconidias. B. Microconidias y macroconideas. Las macroconidias son fusiformes y moderadamente curvas, con un tamaño de 3 a 5 μm, con dos a tres septas, paredes delgadas y una célula basal alongada y una apical atenuada. Las microconidias son ovales, cilíndricas, rectas o curvas, unicelulares, sin septos y tienen un tamaño de 2.2 - 3.5 μm. Igualmente, el hongo presenta células de paredes engrosadas que actúan como estructuras de resistencia denominadas clamidosporas, pueden ser terminales o intercalares, globosas, se encuentran solitarias o en pares formadas a partir de la condensación del contenido de las hifas y las conidias, su tamaño varía de 5 a 15 μm de diámetro. Con estas estructuras el hongo sobrevive en condiciones ambientales desfavorables y en ausencia de plantas hospedantes. Las macroconidias y las microconidias de F. oxysporum se pueden encontrar en los vasos del xilema, pero las microconidias son mas predominantes en tejidos infectados. Microscópicamente el hongo presenta colonias de crecimiento rápido (1 cm/día), con micelio generalmente aéreo, abundante y algodonoso de color blanco y que luego se torna de color púrpura o violeta, tonalidad que también es observada en el medio de cultivo (Figura 10). A. B. Foto 10. Colonia típica de de Fusarium oxysporum en medio de cultivo PDA: A: colonia pura; B: colonia no purificada desarrollándose a partir de fragmentos de tallo de uchuva. 30 Muerte descendente De las muestras de plantas que presentaban síntomas de muerte descendente se aisló un hongo que se clasifico taxonómicamante dentro del genero Phoma sp con colonias de color café oscuro, crecimiento algodonoso y con una tasa de crecimiento de 0.5 cm/día. El micelio es de color negro con tonalidades grisáceas (Figura 11). Foto 11. Colonia típica del hongo Phoma sp. Aislado a partir de hojas y frutos de uchuva A medida que la colonia madura, se observa el oscurecimiento del micelio y el desarrollo de puntos negros distribuidos de forma homogénea en el medio. La observación al microscopio de micropreparados del hongo, indico la presencia de conidias pequeñas unicelulares, hialinas, septadas, de forma elíptica a ovalada que surgen de una célula poco diferenciada presente en la cavidad de un picnidio en forma de un brotamiento repetitivo monopolar. Los picnídios tienen forma globosa o subglobosa y nacen generalmente solitarios pudiendo estar reunidos en un estroma, son separados, esferoides; pigmentados o hialinos, con paredes delgadas simples o de varias células densas, la capa externa forma una pared especializada diferente. Su descripción corresponde a la citada por Blanco (2000). El microorganismo también se encontró en los capachos del fruto de uchuva; los picnídios están sumergidos en el tejido, son erupentes o con cuello corto que rompen la epidermis y las conidias se desarrollan a partir de conidióforos cortos o rudimentarios. Las fialides son hialinas, indistinguibles de las células internas de la pared picnidial. Células conidiógenas enteroblásticas (sin segmentación) en forma de botella (Figura 12). Microscópicamente Phoma sp presenta un crecimiento optimo en el medio de cultivo Agar avena medio en el cual esporuló mas rápidamente que en PDA y con una tasa de crecimiento de 0.5 cm/día. 31 Las características arriba descritas, permitieron ubicar a este hongo dentro del género Phoma, perteneciente a la clase Coelomycetes, Orden: Sphaerosipdales, Familia: Sphaeropsidales. Figura 12. Conidias típicas del hongo Phoma sp aislado de plantas de uchuva con síntomas de muerte descendente, en un objetivo de 40 X. Mancha foliar y en frutos De aquellas plantas con síntomas de manchas foliares y en frutos se obtuvo el crecimiento de un hongo de color grisáceo, algodonoso, con un borde blanco y de crecimiento rápido (0.7 mm/día). Microscópicamente se observaron conidias de color marrón, obclavadas u ovoides, multicelulares, con septas transversales y longitudinales. El tamaño de las esporas es grande y fácil de observar bajo el microscopio. Los conidióforos son simples o ramificados, septados, con una cicatriz de espora terminal o a veces lateral (Figura 13). Estas características permitieron identificar a este hongo en el género Alternaria, clase Deuteromycete, perteneciente al grupo “semi arborescente”. Los conidióforos son altamente ramificados, las conidias son formadas en cadenas ramificadas y su tamaño varía entre 30-65 µm de largo por 10-15 µm de ancho, posee 3-7 septos transversales y 0-3 longitudinales (Figura 13). A. B. C. Figura 13. Características de la colonia, conidias y conidioforos típicos de Alternaria sp. aislada de hojas y frutos de uchuva. (A) Conidia y conidioforo (B) detalle de las conidias de Alternaria; C: colonia del hongo en medio PDA. 32 Mancha morada De aquellas muestras que presentaban manchas de color morado en hojas y frutos se obtuvo el crecimiento de un hongo con un crecimiento miceliar semialgodonoso superficial en el medio de cultivo PDA; con una coloración gris claro a blanco en el margen de avance. A medida que la colonia envejece, se observan puntos negros a partir de los cuales se desarrollan masas de esporas de color rosado a salmón (Figura 14 A). Las esporas son abundantes y vistas al microscopios son hialinas, unicelulares, ovaladas, oblongadas o cilíndrica con los extremos redondeados y un tamaño que varía entre 7-8 micras y 3-4 micras de ancho (Figura 14 B). B. A. Foto 14. Colonia y conidias típicas de Colletotrichum spp. aislado de hojas y frutos de uchuva. A: Colonia de Colletotrichum sp; B. Esporas y micelio del hongo. Las características observadas permitieron ubicar a este hongo dentro del género Colletotrichum, división Deuteromycota, orden Melanconiales, familia Melanconiaceae. Evaluación de medios de cultivo La evaluación de medios de cultivo para el crecimiento y esporulación de los hongos obtenidos de cada muestra indicó al medio PDA como el más óptimo para el crecimiento y esporulación de los hongos F. oxysporum y Alternaria spp. , el medio Agar V8 resultó mejor para el crecimiento de Cercospora spp., pero no para su esporulación, el medio Agar avena resultó ser el más óptimo para el crecimiento y esporulación del hongo Phoma spp. y Agar Marthur fue el medio más adecuado para el hongo Colleotrichum spp. (Tabla 1) Tabla 1. Evaluación de los medios de cultivos PDA, Agar V8, Agar avena y Agar Marthurs en el crecimiento y esporulación de Fusarium spp., Alternaria spp., Phoma sp, Cercospora sp y Colletotrichum spp. aislados de tejidos de uchuva. 33 Hongo Medio de cultivo Fusarium Oxysporum Agar PDA (Agar, papa, dextrosa) Cercospora sp Agar V8 Alternaria sp Agar PDA(Agar, papa, dextrosa) Phoma sp Agar Avena Colletotrichum sp Agar MRS Medio de cultivo seleccionado para el crecimiento de cada hongo. Pruebas de patogenicidad: Material Vegetal Para obtener las mejores condiciones ambientales que favorecieran el desarrollo de las plantas de uchuva a utilizar en las pruebas de patogenicidad, se construyeron unas estructuras en plástico y PVC. Dentro de cada estructura se colocaron de forma separada las plantas inoculadas con cada uno de los patógenos a evaluar. Estas estructuras permitieron mantener separados cada uno de los tratamientos y evitaron la contaminación cruzada entre patógenos, permitiendo además un mejor desarrollo y crecimiento de las plantas por el incremento de la temperatura dentro de ellas (Figura 15). Las plantas fueron mantenidas bajo estas condiciones por un periodo de tres meses, tiempo en el cual se hizo la inoculación. Durante este tiempo las plantas fueron fertilizadas cada 4 días. Figura 15. Plántulas de uchuva de 60 días de edad, crecidas bajo condiciones de casa de malla en la zona de Santa Elena. 34 Inoculación de bacterias La inoculación de la cepa bacterial obtenida a partir de frutos de uchuva con síntomas de mancha grasienta fue negativa en dos de los ensayos realizados, no hubo desarrollo de los síntomas típicos de la enfermedad y los frutos mostraron al cabo de 8 días un deterioro visible y el crecimiento de hongos saprofitos. En un tercer ensayo de inoculación, se logró el desarrollo de manchas de aspecto grasiento sobre los frutos inoculados. El cáliz o capacho del fruto presentó una consistencia semejante al papiro o al papel parafinado, el fruto no sufrió ningún cambio ni presentó el desarrollo de síntomas asociados con la enfermedad (Figura 16). Bajo las condiciones naturales del cultivo, la bacteria afecta únicamente el capacho del fruto sin afectar éste directamente. Sin embargo, este se constituye en un factor suficiente para el rechazo del mismo y no pasa a ser considerado como óptimo para la exportación, razón que hace a esta enfermedad una de las más importantes económicamente. A. B. Foto 16. A. Inoculación artificial de frutos de uchuva con Xanthomonas spp. aislada de frutos con síntomas de mancha grasienta. A: Frutos de uchuva inoculados con la bacteria bajo condiciones de cámara húmeda. B: Detalle de un fruto en el cual se observa el desarrollo de los síntomas de mancha grasienta sobre el capacho. A partir de los frutos que desarrollaron los síntomas bajo condiciones de inoculación artificial, se realizó el reaislamiento de la bacteria, obteniéndose colonias con las mismas características morfológicas descritas inicialmente. Posterior al aislamiento y purificación de la bacteria, ésta fue sometida a una serie de pruebas bioquímicas a fin de confirmar su identidad. Las pruebas realizadas y los resultados obtenidos se indican en la Tabla 2. El proceso de identificación mediante pruebas bioquímicas se llevó a cabo en los laboratorios de la empresa Agrolab; Asistencia Agroindustrial de la ciudad de Medellín. Los resultados de estas pruebas permitieron determinar las siguientes características macroscópicas: Colonias blancas puntiformes, de consistencia mucosas, convexas con borde continuo y superficie lisa. Microscópicamente se observaron bacilos muy cortos, 35 Gram Negativos. Las pruebas bioquímicas llevaron a ubicar a la bacteria dentro del género Xanthomonas, resultados que concuerdan con lo reportado en la literatura para cultivos de uchuva en el departamento de Antioquia, zona en la cual esta enfermedad no es considerada limitante, ya que solo se presenta de forma esporádica en el cultivo. Tabla 2. Resultado de las pruebas bioquímicas realizadas en cultivos bacteriales obtenidos de frutos de uchuva con síntomas de mancha grasienta. Tipo de Prueba Respuesta Oxidasa - Gelatinasa + Arg. hidrolasa - Amilasa ND Crec. Amarillo en Agar nutritivo 30 C + Crecimiento mucoide + Ácido sulfhídrico - Indol - Movilidad + Anaerobiosis - Catalasa + Malonato + Citrato + MRVP -/-/- TSI -/-/- Caseinasa - Simbología: Positivo: +, Negativo: -, No Determinado: ND. Pruebas de patogenicidad para hongos Marchitamiento Vascular Las plantas inoculadas fueron evaluadas semanalmente durante seis semanas. Los primeros síntomas fueron observados a los seis días en las plantas inoculadas con el hongo F. oxysporum, presentándose en éstas pérdida de turgencia en las hojas, clorosis, acaparamiento y marchites en comparación con los controles (Figura 17). El hongo entra en contacto con las raíces de la planta a través de su micelio y esporas, estructuras que pueden penetrar los tejidos e invadir las células de las raíz produciendo 36 una pudrición radicular, luego se mueve hacia el tejido vascular por colonización intracelular a los vasos del xilema. Este patógeno coloniza por crecimiento del micelio o por medio del transporte pasivo de microconidias. Como la infección progresa, los tallos se palidecen y el xilema es obstruido por toxinas que producen una oxidación y al realizar en el tallo un corte transversal, este presenta en los haces vasculares una coloración amarillenta o marrón. Las raíces también presentan pudriciones de coloración oscura, Fusarium sp, es un habitante natural del suelo, pero en este caso se creó artificialmente esta condición. A. B. Figura 17. Plantas de uchuva inoculadas con F. Oxysporum mediante el método de corte del ápice de la raíz. A: Control (izquierda) y planta inoculada con el hongo (derecha); B: Detalle de una planta inoculada con el hongo, mostrando síntomas severos de marchitamiento y clorosis. En el departamento de Antioquia no se había reportado la presencia de F. oxysporum en cultivos de Uchuva, algunos estudios realizados por Corpoica La Selva Zapata (2000), reportan plantas con la misma sintomatología pero se lo atribuyen a Ralstonia solanacearum. En el presente estudio, la bacteria F. oxysporum estuvo siempre asociado con plantas que presentaban marchitamiento y necrosamiento de los haces vasculares, lográndose aislar de cada una de las plantas evaluadas. La especie F. oxysporum se caracteriza por atacar diversos tipos de plantas económicamente importantes en distintos países en diferentes regiones, causando marchitamientos vasculares y muerte de las plantas; se caracteriza por producir colonias de rápido crecimiento, con una tasa diaria cercana a un centímetro en medio de PDA A 25°C, la morfología de las colonias es muy variable. Una de las dificultades para evitar su diseminación consiste en que el hongo coloniza el sistema vascular antes de la expresión de los síntomas externos, esto en cuanto a la propagación y la otra fuente de diseminación es el suelo contaminado, en donde el hongo puede sobrevivir muchos años a través de las clamidosporas. El agua también puede ser un agente de diseminación del hongo, debido a su capacidad para sobrevivir en ese elemento y por último el aire puede transmitir el patógeno en suelo contaminado. 37 En este caso, la forma de diseminación más frecuente es la del suelo, por eso, esta enfermedad es tan limitante ya que su control es muy complejo. La temperatura es uno de los factores ambientales que mayor influencia tiene en el desarrollo de la enfermedad y en la expresión de los síntomas, así como la nutrición de la planta. La temperatura óptima para el desarrollo del patógeno está entre 25 –30°C. Esta enfermedad según los productores es la enfermedad más limitante y preocupante para ellos, ya que no conocen métodos para controlarla y les causa grandes pérdidas económicas. Mancha gris en hojas y frutos Las plantas inoculadas con el hongo Cercospora sp presentaron los primeros síntomas de la enfermedad a los 15 días después de la inoculación. Los síntomas fueron inicialmente observados como manchas pequeñas redondeadas y bien delimitadas, inicialmente con una coloración grisácea y posteriormente se tornaron de color marrón claro y halos concéntricos. A medida que avanza la enfermedad, esta causa el secamiento total de las hojas y finalmente su muerte, observándose en este momento el desarrollo de puntos de color negro y la presencia de micelio de color gris sobre las lesiones, lo que corresponde a conidióforos y conidias desarrolladas en el envés de la hoja (Figura 18). A. B. Figura 18. Hojas de uchuva mostrando el desarrollo de síntomas de la enfermedad mancha gris. A: Síntomas iniciales; B: Síntomas avanzados en los que se observan las lesiones bien desarrolladas con anillos concéntricos. La infección se inició a partir de esporas que germinaron sobre los tejidos, al parecer el tubo germinativo penetra a las hojas, por la apertura de los estomas, posteriormente el hongo se desarrolló sobre el parénquima foliar. Bajo condiciones de campo, las lesiones aparecen especialmente después de una temporada de lluvia, en la cual la temperatura oscila entre 17 y 20°C. La diseminación de las conidias se lleva a cabo por corrientes de aire y al ser depositadas sobre las hojas húmedas se da inicio al proceso de infección. Se observa además, que la infección 38 inicia de abajo hacia arriba y de adentro hacia fuera, en el follaje más viejo afectando los brotes de las ramas, el follaje y los capachos. Los capachos severamente afectados pueden caer progresivamente hacia los extremos de las ramas, causando la infección en éstas y finalmente su muerte. La enfermedad causada por Cercospora sp se desarrollo mejor en tiempo cálido y con alta humedad relativa, la diseminación de los conidios se lleva a cabo por corrientes de aire y al ser depositados en las hojas húmedas, se concluyó que el las lesiones aparecen especialmente después de las épocas lluviosas, pero los agricultores opinan que esta enfermedad es muy controlable con funguicidas aplicados a tiempo y que no representa para ellos un problema mayor. Muerte descendente El hongo aislado de plantas con síntomas de muerte descendente fue identificado como Phoma spp. y fue encontrado afectando hojas y frutos de uchuva, por lo tanto una vez fue aislado y purificado se llevaron a cabo las pruebas de patogenicidad utilizando plántulas y frutos desprendidos. Los resultados de la inoculación en planta fueron negativos en los dos ensayos realizados, a los 20 días después de la inoculación, las plantas presentaron un amarillamiento general pero no hubo desarrollo de lesiones u otro síntoma típico sobre hojas y tallos. En fruto, la enfermedad se observó cuatro días después de la inoculación, observándose manchas circulares de color pardo grisáceo, en contraste con los controles los cuales se encontraban totalmente sanos. A los siete días se hizo una nueva evaluación y se observó que las manchas se tornaron de mayor tamaño y de un color pardo oscuro, presentando además el desarrollo de picnídios (Figura 19). Las primeras lesiones desarrolladas en el fruto se fueron extendiendo hasta tomar gran parte de este, produciendo úlceras oscuras. A. B. 39 Foto 19. Frutos de uchuva presentando el desarrollo de síntomas causados por el hongo Phoma spp. A: Control sin desarrollo de síntomas; B: Frutos mostrando lesiones iniciales de la enfermedad y un ligero amarillamiento producido por el ataque del hongo. Phoma sp tienen una mayor diseminación cuando se presenta una alta humedad relativa y una temperatura baja, se puede decir que es la menos severa y se puede combatir con fungicidas sin que cause mayores daños en el cultivo. Los hongos Alternaria sp y Colletotrichum sp aislados a partir de hojas y frutos con síntomas de mancha foliar y mancha morada respectivamente, fueron igualmente inoculados sobre plántulas y frutos de uchuva a fin de probar su patogenicidad. Los resultados de estas pruebas fueron negativos ya que no se logró el desarrollo de síntomas de estas enfermedades en las plantas y frutos inoculados, lo que llevó a concluir que muy posiblemente estos hongos están presentes como saprófitos, colonizando los tejidos de hojas y frutos atacados previamente por hongos o bacterias fitopatógenas. En las pruebas con Alternaria sp las plántulas inoculadas y los controles se tornaron de un color morado. Las plántulas inoculadas con Colletotrichum sp, solo presentaron una clorosis general (Figura 20). A. B. Foto 20. Plántulas de uchuva inoculadas con los hongos Alternaria spp. y Colletotrichum spp. A: Plantas inoculadas con el hongo Alternaria spp. mostrando síntomas de coloración morada en hojas; B: Plántulas inoculadas con Colletotrichum spp. mostrando clorosis general. Trabajo de campo: Para la estimación de los porcentajes de incidencia y la comparación de las dos localidades se aplicaron tablas de contingencia, enfrentando la ubicación con la presencia de las enfermedades, para cada estrato o piso vegetal, enfermedad, y etapa de desarrollo del cultivo. Se partió de la hipótesis nula de homogeneidad en los niveles de incidencia, según lo cual, al nivel poblacional, los dos municipios tienen la misma incidencia de las enfermedades evaluadas, y las diferencias observadas se deben al efecto del muestreo. Esta hipótesis se rechazó si la probabilidad de la prueba X2 fue 40 menor o igual a 0,05 (nivel de significancia), en cuyo caso se concluyó que la incidencia era diferente entre las dos localidades al nivel poblacional. Resultados En la Tabla 3 se presentan los resultados de incidencia de las enfermedades para cada una de las enfermedades, por ubicación y estado de desarrollo del cultivo, en cada una de las estructuras observadas. En la Tabla 4 se presentan los resultados de la aplicación de las pruebas de Chicuadrado, Los resultados del análisis se presentan por separado para cada una de las estructuras vegetales analizadas. Se observa que a nivel de follaje predomina Cercospora y Fusarium. Las diferencias entre localidades por el nivel de incidencia de estas enfermedades se observa en los estados 3 y 4, según lo cual en Santa Elena se presentó mayor incidencia en general para las dos enfermedades. Fusarium se manifiesta en toda la planta, pero Cercospora en los dos estratos bajos. En el capacho se presentan especialmente Cercospora, Phoma y Xanthomonas. Tanto Cercospora como Poma se presentan con diferencias significativas entre municipios en los estados 3 y 4 y en los estratos bajos (1 y 2), y fue en el municipio de Santa Elena donde se hizo mayor la incidencia de estas enfermedades con respecto a la Unión. Las diferencias por el ataque de Xanthomonas se presentaron en todos los estados de desarrollo del cultivo y en los estratos altos de la planta (2 y 3). Fue en la Unión donde la incidencia de Xanthomonas se hizo mayor. Para el efecto de los tallos, ramas y ramitas, los resultados fueron similares, en cuanto que se observó la presencia de Fusarium con diferencias entre localidades para todos los estados de desarrollo del cultivo y a lo largo de toda la planta. Fue en Santa Elena donde los niveles de incidencia se hicieron mayores. 41 Tabla 3. Niveles de incidencia de diferentes enfermedades que atacan el cultivo de Uchuva, en dos ubicaciones y cinco estados de desarrollo de las plantas Enfermedad Ubicación Estado Hoja Capacho Tallo Rama La Union Cercospora La Union 0 Cercospora La Union 1 19,33 21,33 0,00 0,00 Cercospora La Union 2 44,67 44,67 0,00 0,00 Cercospora La Union 3 37,33 35,33 0,00 0,00 Cercospora La Union 4 45,33 43,33 0,00 0,00 Cercospora Santa Elena 0 1,33 1,33 0,00 0,00 Cercospora Santa Elena 1 21,33 19,33 0,00 0,00 Cercospora Santa Elena 2 39,33 38,00 0,00 0,00 Cercospora Santa Elena 3 62,67 62,67 0,00 0,00 Cercospora Santa Elena 4 63,33 64,00 0,00 0,00 Phoma La Union 0 Phoma La Union 1 0,00 18,00 0,00 0,00 Phoma La Union 2 0,00 32,67 0,00 0,00 Phoma La Union 3 0,00 24,00 0,00 0,00 Phoma La Union 4 0,00 31,33 0,00 0,00 Phoma Santa Elena 0 0,00 0,67 0,00 0,00 Phoma Santa Elena 1 0,00 15,33 0,00 0,00 Phoma Santa Elena 2 0,00 27,33 0,00 0,00 Phoma Santa Elena 3 0,00 38,67 0,00 0,00 Phoma Santa Elena 4 0,00 41,33 0,00 0,00 Fusarium La Union 0 Fusarium La Union 1 34,00 0,00 34,00 34,00 Fusarium La Union 2 54,00 0,00 54,00 54,00 Fusarium La Union 3 74,00 0,00 74,00 74,00 Fusarium La Union 4 89,00 0,00 89,00 89,00 Fusarium Santa Elena 0 0,00 0,00 0,00 0,00 Fusarium Santa Elena 1 37,00 0,00 37,00 37,00 Fusarium Santa Elena 2 63,00 0,00 63,00 63,00 Fusarium Santa Elena 3 97,00 0,00 97,00 97,00 Fusarium Santa Elena 4 100,00 0,00 100,00 100,00 Xanthomonas La Union 0 Xanthomonas La Union 1 0,00 7,33 0,00 0,00 Xanthomonas La Union 2 0,00 15,33 0,00 0,00 Xanthomonas La Union 3 0,00 19,33 0,00 0,00 Xanthomonas La Union 4 0,00 28,67 0,00 0,00 Xanthomonas Santa Elena 0 0,00 0,00 0,00 0,00 Xanthomonas Santa Elena 1 0,00 1,33 0,00 0,00 Xanthomonas Santa Elena 2 0,00 2,67 0,00 0,00 Xanthomonas Santa Elena 3 0,00 3,33 0,00 0,00 Xanthomonas Santa Elena 4 0,00 4,67 0,00 0,00 42 Ramita 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 34,00 54,00 74,00 89,00 0,00 37,00 63,00 97,00 100,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Tabla 4. Resultados de la prueba Ji-cuadrado (probabilidad o valor P) para la comparación de la incidencia de enfermedades en las hojas de las plantas de uchuva, por estado de desarrollo del cultivo y por tercio de la planta Estructura Enfermedad Estado Tercio Probabilidad* Hojas Cercospora 1 1 0,6450 Hojas Cercospora 1 2 0,6450 Hojas Cercospora 2 1 0,2413 Hojas Cercospora 2 2 0,2413 Hojas Cercospora 3 1 0,0001 Hojas Cercospora 3 2 0,0001 Hojas Cercospora 4 1 0,0001 Hojas Cercospora 4 2 0,0001 Hojas Fusarium 1 1 0,6575 Hojas Fusarium 1 2 0,6575 Hojas Fusarium 1 3 0,6575 Hojas Fusarium 2 1 0,1965 Hojas Fusarium 2 2 0,1965 Hojas Fusarium 2 3 0,1965 Hojas Fusarium 3 1 0,0001 Hojas Fusarium 3 2 0,0001 Hojas Fusarium 3 3 0,0001 Hojas Fusarium 4 1 0,0006 Hojas Fusarium 4 2 0,0006 Hojas Fusarium 4 3 0,0006 • Valores menores o iguales a 0,05 indican diferencias significativas en la incidencia entre las dos localidades. 43 Tabla 5. Comparación de los niveles de incidencia de enfermedades del capacho de la uchuva por estado de desarrollo del cultivo y tercio de la planta Estructura Enfermedad Estado Tercio Probabilidad Capacho Cercospora 1 1 0,6450 Capacho Cercospora 1 2 0,6450 Capacho Cercospora 2 1 0,1452 Capacho Cercospora 2 2 0,1452 Capacho Cercospora 3 1 0,0001 Capacho Cercospora 3 2 0,0001 Capacho Cercospora 4 1 0,0001 Capacho Cercospora 4 2 0,0001 Capacho Phoma 1 1 0,5136 Capacho Phoma 1 2 0,5136 Capacho Phoma 2 1 0,2555 Capacho Phoma 2 2 0,2555 Capacho Phoma 3 1 0,0018 Capacho Phoma 3 2 0,0018 Capacho Phoma 4 1 0,0332 Capacho Phoma 4 2 0,0332 Capacho Xanthomas 1 2 0,0098 Capacho Xanthomas 1 3 0,0098 Capacho Xanthomas 2 2 0,0001 Capacho Xanthomas 2 3 0,0001 Capacho Xanthomas 3 2 0,0001 Capacho Xanthomas 3 3 0,0001 Capacho Xanthomas 4 2 0,0001 Capacho Xanthomas 4 3 0,0001 • Valores menores o iguales a 0,05 indican diferencias significativas en la incidencia entre las dos localidades. Tabla 6. Comparación de los niveles de incidencia de enfermedades del tallo, ramas y ramitas de la uchuva por estado de desarrollo del cultivo y tercio de la planta Enfermedad Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Fusarium Estado 1 1 1 2 2 2 3 3 3 4 4 4 Tercio 1 2 3 1 2 3 1 2 3 1 2 3 44 Probabilidad 0,6575 0,6575 0,6575 0,1965 0,1965 0,1965 0,0001 0,0001 0,0001 0,0006 0,0006 0,0006 • Valores menores o iguales a 0,05 indican diferencias significativas en la incidencia entre las dos localidades. Conclusiones: En el departamento de Antioquia, más específicamente en el Municipio de la Unión y en el corregimiento de Santa Elena, zonas en las cuales se realizó el estudio, las enfermedades más limitantes en el cultivo de uchuva son el marchitamiento vascular, causado por F.oxysporum, la mancha gris, causada por Cercospora sp y la muerte descendente o mal de tierra, causado por Phoma sp. Presentando una menor incidencia la enfermedad de la mancha grasienta ocasionada por Xanthomonas spp. Las tres enfermedades encontradas se consideran de gran importancia económica, debido a que el ataque se da en frutos incidiendo de forma directa en su calidad y por consiguiente en la posibilidad de su exportación. El marchitamiento vascular ocasionado por el hongo F. oxysporum es una enfermedad limitante desde que inicia la producción de la planta a los 4 o 5 meses y hasta los 10 meses, período en el cual ésta baja. La mancha gris ocasionada por el hongo Cercospora sp y la muerte descendente causada por Phoma sp son enfermedades que se presentan en cualquier fase de desarrollo de la planta de uchuva, especialmente después de los tres meses de edad, siendo más severas en las épocas de alta pluviosidad. Con esta investigación se logro obtener información actualizada y detallada de los agentes causales de enfermedades que afectan los cultivos de uchuva (P. peruviana) en el departamento de Antioquia y su incidencia de acuerdo con el estado de desarrollo de las plantas. Los resultados obtenidos permitirán a los agricultores y productores de uchuva, trazar un plan de manejo que integre diferentes medidas de control para lograr una mayor productividad y calidad del producto dedicado en su totalidad a los mercados internacionales. El desconocimiento de estas enfermedades y sus causas por parte de los productores y técnicos del cultivo en esta región fue evidente. Aspecto que da una gran importancia a este estudio, ya que permite tener un conocimiento general de la problemática fitosanitaria del cultivo y transmitir éste a los agricultores para que sean aplicadas las medidas más adecuadas para su control. 45 Se concluye que en cuanto a la incidencia en Santa Elena se presentó mayor incidencia en general para Fusarium. Cercospora, Phoma y Xanthomonas. F. oxysporum se manifiesto en toda la planta, encambio Cercospora en los dos estratos bajos; y en el capacho se presentan especialmente Cercospora, Phoma y Xanthomonas. Referencias: AGRIOS, G.. Plant Pathology. 1988. Academic Press, Inc. Thrid edition. London. 803 pp. ALMANZA, P.J, FISCHER, G. 1993. Nuevas tecnologías de la Uchuva (Physalis peruviana).en agro desarrollo 4 (1-2) Págs. 292-304. ALMANZA, P. J. 2000. Producción, poscosecha y exportación de la uchuva (Physalis peruviana).Pág. 27. Propagación de la uchuva. Bogota. BERNAL, José Antonio, Noviembre de 1986. La Uchuva (Physalis peruviana) historia, taxonomia y biología.Tunja. Pag1-5. BLANCO, Jorge Orlando, Noviembre de 1986. Enfermedades diagnosticadas en el cultivo de la uchuva (Physalis peruviana).Tunja.pag 31-36. BLANCO, Jorge Orlando. 2000. Producción, poscosecha y exportación de la uchuva (Physalis peruviana). Pág. 57. Manejo de enfermedades. Bogota. BORRERO, S. Diccionario Geográfico de Colombia (IGAC), Rabal – Zuzagua. Tomos No. 2, 4 1996. CRFG. 1997. Cape gooseberry (Physalis peruviana). En California rare fruit growers, Inc., pag 3. FAO (Food and Agriculture Organization of the United Nations). 1982 “Fruit – bearing forest trees technical notes”. Roma, p 140 – 143. FISCHER, G., ALMANZA, P.J., 1993. La uchuva (Physalis peruviana). Una alternativa promisoria para las zonas altas de Colombia, en Agricultura Tropical 30, Págs. 79-87. FISCHER, Gerhard. 2000. Producción, poscosecha y exportación de la uchuva (Physalis peruviana). Pág. 9 Crecimiento y desarrollo de la uchuva. Bogota. FLOREZ, V., FISCHER, G. & SORA, A. Producción, Poscosecha y Exportación de la Uchuva. Universidad Nacional de Colombia. Facultad de Agronomía. Marzo de 2000 Pág.: 12 -166. FORERO DE LA-ROTTA, M. C. y QUEVEDO E., K. 2005. Marchitamiento vascular en Uchuva Physalis floridana L. ocasionada por Fusarium oxysporum. En: Resúmenes XXVI Congreso de Ascolfi. Bogota Octubre 5-7. 70p. 46 FORERO DE LA-ROTTA, M. C. y QUEVEDO E., K. 2005. El carbón de la hoja Entyloma australe sobre plantas de uchuva Physalis floridana L. En: Resúmenes XXVI Congreso de Ascolfi. Bogota Octubre 5-7. FOX, R. Principles of Diagnostic Techniques in Plant Pathology. International Mycological Institute. England, 1993. Pág: 37-65 HIGUITA, Claudia Maria, Muñoz, Dora Inés. 1992. efecto de tres distancias de siembra en el rendimiento de la uchuva (Physalis peruviana) en el norte de Antioquia. Ingeniero agrónomo, ICA- Secretaria de Agricultura de Antioquia. Medellín. Pág. 115. KLINAC, D.J. 1986. Cape gooseberry (Physalis peruviana). Production systems. En Journal of Experimental Agriculture 14, pags. 425-430. LEEGE, A.P., 1974. Notes on the history, cultivation and uses of (Physalis peruviana), en Journal of the Royal Horticultural Society, pags. 310-314. LOPEZ, A., 1978.Un Nuevo cultivo de alta rentabilidad, la uvilla o uchuva. En Revista ESSO Agrícola. Bogota, 25(2), Págs. 21-28. MEDINA, M. El Cultivo de la Uchuva Tipo Exportación Colombia. Agricultura Tropical Volumen 28 No. 2. 1991. MONCADA, B.J., Producción del cultivo de la Uchuva (Physalis peruviana). III curso nacional sobre frutales de clima frio. Págs. 21-30. Nacional Research Council, Goldenberry (Cape gooseberry) en Lost crops of the incas. National Academy Press, Washington D.C. 1989 p. 241 – 251. PEREZ, A. Plantas útiles de Colombia. Editorial, sucesores Vadeneira, Madrid 1986. p 707 - 708 PIZA BERMUDEZ, L.F., 1989. El cultivo de la uchuva (Physalis peruviana). Medellín, Seminario facultad de Ciencias Agropecuarias. Universidad Nacional sede Medellín. PROEXPORT, Exportaciones Colombianas por Posición Arancelaria: Uchuva. Bogota, 1998. RODRIGUEZ, L.F., BOTIA, Y. 2000. Economía y gestión de la producción, en Producción, postcosecha y exportación de la uchuva (Physalis peruviana).Pág. 91-108. ROMERO, R. Frutas silvestres de Colombia, instituto Colombiano de Cultura Hispánica, Bogota. 1991 p 458 - 460 VERGARA, Rodrigo A. 1986. Insectos plaga en el cultivo de la Uchuva (Physalis peruviana).Tunja. Pág. 16-30. VERHEIJ,E.W.M., Coronel, R.E.(Eds.). 1991. Plantresources of South- East Asia. Editorial Pudoc Wageningen, Págs. 254-256. ZAPATA, Jose Luis, SALDARRIAGA, alegria; LONDONO, Mauricio; DIAZ, Cipriano. 2002. Manejo del cultivo de la uchuva en Colombia, Regional cuatro, Centro de investigación La Selva, apartado aéreo 100, Rionegro Antioquia, Colombia. Boletín técnico. 42 paginas. 47 Anexos: Anexo 1. Formato para el diagnóstico de enfermedades en el cultivo de uchuva (Physalis peruviana L.) Finca Fecha: Nombre del productor Ubicación de la finca Teléfono Condiciones climáticas recientes Altitud Temperatura promedio Fecha de recolección muestra Nombre de la Finca Municipio de la Fecha de recepción de la muestra Vereda Depto Tipo de suelo o sustrato Arenoso Arcilloso Franco Libre exposición Hidroponía Invernadero Otro Que se envía? Suelo Raíz Tallo Hojas Nombre del cultivo Nombre de la variedad Distancia de siembra Tipo de Asocio Edad 48 Flores Fruto Planta completa Descripción de los síntomas Que enfermedades ha habido en el lote? Que cultivo existía antes en el lote Que enfermedades presentó este? Topografía del lote Plano Pendiente Quebrado Área o número de plantas cultivadas Área o número de plantas con el problema (%) Productos aplicados en el cultivo Nombre Dosis Fecha de Aplicación Observaciones de cámara húmeda? Observación de colonias en medio de cultivo? Observaciones microscópicas Microorganismo 49 INTRODUCCION ......................................................................................................................................... 7 MARCO TEORICO ...................................................................................................................................... 8 Generalidades ............................................................................................................................................ 8 Importancia económica ............................................................................................................................. 9 Taxonomía ................................................................................................................................................ 10 Propagación ............................................................................................................................................. 10 Agroecología ............................................................................................................................................ 10 Clima.......................................................................................................................................................... 11 Producción ............................................................................................................................................... 11 Enfermedades limitantes del cultivo de uchuva................................................................................... 12 Mancha Gris.............................................................................................................................................. 12 Muerte descendente ................................................................................................................................ 13 Marchitez de las ramas............................................................................................................................ 13 Esclerotiniosis.......................................................................................................................................... 13 Mal del semillero ...................................................................................................................................... 14 Moho gris .................................................................................................................................................. 14 Carbón de la hoja:.................................................................................................................................... 14 Enfermedades de poscosecha ............................................................................................................... 15 Mancha grasienta..................................................................................................................................... 15 Marchitez bacterial................................................................................................................................... 16 Ojo de gallo............................................................................................................................................... 16 Los nemátodos como patógenos........................................................................................................... 16 Nemátodos formadores de nódulos en uchuva.................................................................................... 17 Formulación del problema y justificación:............................................................................................ 18 Formulación del problema: ..................................................................................................................... 18 Justificación de la investigación:........................................................................................................... 18 Objetivos:.................................................................................................................................................. 19 Objetivo general:...................................................................................................................................... 19 Objetivos específicos: ............................................................................................................................. 19 Materiales y métodos............................................................................................................................... 19 Evaluación preliminar de la zona de estudio ........................................................................................ 19 Colecta y procesamiento de muestras en campo ............................................................................... 20 Aislamiento e identificación de Agentes Fitopatógenos ..................................................................... 21 Aislamiento de Bacterias ........................................................................................................................ 21 Aislamiento de Hongos ........................................................................................................................... 21 Pruebas de patogenicidad de bacterias y hongos:.............................................................................. 22 Preparación de inóculo e inoculación de bacterias ............................................................................. 22 Preparación de inóculo e inoculación de hongos................................................................................ 23 Inoculación ............................................................................................................................................... 23 Trabajo de campo .................................................................................................................................... 24 Resultados y discusiones:...................................................................................................................... 25 Fase de Reconocimiento......................................................................................................................... 25 Aislamiento e identificación de agentes fitopatógenos....................................................................... 28 Aislamiento de Bacterias ........................................................................................................................ 28 Aislamiento de Hongos ........................................................................................................................... 28 Mancha gris en hojas y frutos ................................................................................................................ 28 Marchitamiento vascular o dormidera ................................................................................................... 29 Muerte descendente ................................................................................................................................ 31 Mancha foliar y en frutos......................................................................................................................... 32 Mancha morada........................................................................................................................................ 33 Evaluación de medios de cultivo ........................................................................................................... 33 Pruebas de patogenicidad: ..................................................................................................................... 34 Material Vegetal........................................................................................................................................ 34 Inoculación de bacterias ......................................................................................................................... 35 50 Pruebas de patogenicidad para hongos................................................................................................ 36 Marchitamiento Vascular......................................................................................................................... 36 Mancha gris en hojas y frutos ................................................................................................................ 38 Muerte descendente ................................................................................................................................ 39 Trabajo de campo: ................................................................................................................................... 40 Conclusiones: .......................................................................................................................................... 45 Referencias:.............................................................................................................................................. 46 Anexos: ..................................................................................................................................................... 48 Anexo 1. Formato para el diagnóstico de enfermedades en el cultivo de uchuva ........................... 48 (Physalis peruviana L.) ............................................................................................................................ 48 51 DIAGNÓSTICO DE LA PROBLEMÁTICA ACTUAL DE ENFERMEDADES EN EL CULTIVO DE UCHUVA Physalis peruviana L. EN EL DEPARTAMENTO DE ANTIOQUIA Luz Angela Silva Tamayo Introducción La uchuva (Physalis peruviana L.) es una especie frutícola que se ha venido destacando como un producto de exportación por excelencia. El éxito de este producto en las exportaciones : manejo oportuno de todos los factores productivos cumplimiento de las exigencias que los mercados imponen, como el manejo integrado de plagas y enfermedades. Los agricultores tienen que afrontar durante la etapa de producción con el manejo de las enfermedades ocasionadas por hongos, bacterias, nematodos. Este proyecto busca identificar las principales enfermedades en los cultivos de Uchuva ubicados en la zona del departamento de Antioquia. Generalidades La uchuva (P. peruviana) es originaria del Perú (Legge, 1974), aunque existen indicios de que proviene del Brasil y fue aclimatada en los altiplanos del Perú y Chile (CRFG, 1997). Es una planta silvestre o semi-silvestre que crece entre Colombia y Chile a una altura entre 1500 y 3000 m.s.n.m; Actualmente es producida en Colombia y ocupa el primer lugar en la producción mundial seguido por Sudáfrica y Kenya Importancia económica La mayor área cosechada de uchuva en Colombia Cundinamarca, con 267 hectáreas, En el año 2000 se iniciaron los registros de los cultivos de uchuva en los departamentos de Antioquia y Boyacá, con áreas de 28 y 15 hectáreas, respectivamente, que equivalen (Fischer, 2000). La uchuva (Physalis peruviana L.) es una especie frutícola que se ha venido destacando como un producto de exportación por excelencia, ocupando en la actualidad el segundo lugar, después del banano, en las exportaciones de frutas colombianas con un promedio de 600 ha cultivadas con gran tendencia a crecer y con ingresos de US$ 5.000.000 en exportaciones. Taxonomía pertenece a la familia de las Solanáceas y al género Physalis, cuenta con más de ochenta variedades que se encuentran en estado silvestre y que se caracterizan porque sus frutos están encerrados dentro de un cáliz acreciente o capacho. Propagación Las formas mas conocidas para reproducir la uchuva son: la vía sexual, en donde se emplean semillas; y la vía asexual, que involucra diferentes métodos y partes de la planta. (Almanza, 2000). La mejor vía reproductiva es por semilla la cual varía en su tiempo de germinación dependiendo de la forma de obtención, almacenamiento y tratamientos a que sea sometida (Bernal, 1965). Agroecología Suelo: Para un buen desarrollo de la planta, los suelos que han mostrado mejores resultados son aquellos que poseen una estructura de tipo granular y una textura areno–arcillosa. El suelo donde se desarrolla la uchuva debe ser rico en elementos nutritivos con buenos contenidos de Nitrógeno, fósforo y Potasio, además buen contenido de elementos menores y un pH que puede oscilar entre 5,7 y 7,0. Clima En Colombia la uchuva prefiere sitios entre 1800 y 2800 m.s.n.m. con una temperatura promedio anual entre los 13 y 18° C, cuando es muy alta puede afectar la floración y fructificación. La precipitación debe oscilar entre 1000 a 2000 mm bien distribuidos a lo largo del año, con una humedad relativa del 70 al 80%. Producción Desde el transplante hasta la primera cosecha transcurren en promedio 90 días, dependiendo de la altitud; en zonas más altas este período es mas largo. Una vez se inicia la cosecha, la producción de uchuva en Colombia es continua a lo largo del año. Enfermedades limitantes del cultivo de uchuva Mancha Gris La enfermedad conocida como “mancha gris” de hojas y cáliz es causada por el hongo Cercospora sp. y se presenta con mayor intensidad en épocas de alta humedad y se considera como la principal enfermedad foliar de la uchuva. Muerte descendente La enfermedad es ocasionada por el hongo Phoma sp. que se puede localizar en los tallos, hojas, capachos y frutos de las plantas en cualquier estado de desarrollo. En las hojas los primeros síntomas se presentan como manchas oscuras muy pequeñas, que ocurren cuando se presenta alta humedad y temperatura baja, luego las lesiones se pueden unir dando origen a grandes manchas necróticas de forma irregular (Zapata, 2002). Esclerotiniosis También se conoce con el nombre de moho blanco, pudrición blanca algodonosa, enfermedad del esclerocio y pudrición dura (Blanco, 2000). Es causada por el hongo Sclerotinia sclerotiorum, se manifiesta por la presencia de lesiones de apariencia húmeda, con áreas de tejido decolorado que se vuelven de color plomizo-marrón y están cubiertas por un micelio blanco algodonoso, presente en diferentes partes de la planta pero con mas frecuencia en el tallo principal a nivel del cuello de la planta (Blanco, 2000). Mal del semillero Los hongos, Pythium sp., Rhizoctonia sp. y Fusarium sp, producen síntomas muy similares en cualquiera de las fases de desarrollo de la plántula, sin embargo al parecer el primero de ellos es el más importante (Zapata, 2002). el síntoma mas común es la pudrición de las raíces y/o de los tallos, sin embargo también se presenta amarillamiento y necrosis de las plántulas, acompañadas de depresiones en la base de los tallos. Moho gris Agente causal Botrytis sp, causan síntomas que consisten e manchas necróticas de forma irregular que al colocarlos en condiciones de cámara húmeda desarrollan un micelio de color gris, que puede cubrir completamente el fruto; también afecta eventualmente las hojas. (Zapata, 2002). Carbón de la hoja: El agente causal es atribuido al hongo Entyloma australe Schlechtendahl. registrado desde 1975 por Molina y recientemente evaluado en campo por Forero de La Rotta et all en el 2005. Las lesiones ocasionadas por este hongo en hojas, se inician con manchas circulares o angulares cloróticas y bordes definidos. conforme el microorganismo avanza en el tejido vegetal, la mancha toma una coloración café Mancha grasienta El organismo causal es posiblemente Xanthomonas sp. no se conoce el mecanismo de diseminación de la enfermedad, ni los factores climáticos favorables para su desarrollo. El daño consiste en la presencia de manchas pequeñas que en pocos días se tornan grandes y decoloran el tejido dando la apariencia de papel parafinado o engrasado. El patógeno no afecta el fruto, pero deteriora su apariencia reduciendo la calidad Marchitez de las ramas A pesar de que Moncada en 1988 menciona que esta enfermedad es muy similar a la muerte descendente, atribuye su causa a complejo fungoso, de donde se han aislado los hongos Gloesporium sp y Phoma sp; sin embargo Forero de la Rotta et all en el 2005 atribuye como agente causal del marchitamiento y muerte de las plantas, al microorganismo Fusarium oxysporum Schlechtendahl. Marchitez bacterial El organismo causal Ralstonia solanacearum Schlechtendahl. (Smith) Yabunchi et al. El síntoma de la enfermedad en condiciones de campo, consiste en la marchitez de la planta, después de tres o cuatro días calurosos los tejidos se tornan amarillos y luego se mueren. Al realizar un corte del tallo de plantas fuertemente afectadas por la enfermedad se pueden observar rayas angostas de color oscuro que corresponden a los haces vasculares infectados (Zapata, 2002). Formulación del problema: El departamento de Antioquia es una de las zonas productoras de uchuva importantes en Colombia y debido a la carencia de información actualizada sobre problemas fitosanitarios, se realizo la evaluación de los agentes causales y la incidencia de estos, haciendo referencia a la importancia que desde el punto de vista económico están ocasionando las enfermedades en uchuva Justificación de la investigación: Una de las zonas productoras de uchuva en Colombia es la región de Antioquia principalmente los municipios de Santa Elena y La Unión: la información que se tiene es muy poca y no es actualizada. Este trabajo se centró en el estudio de los diferentes agentes causales de enfermedades en la uchuva, y en conocer su incidencia de acuerdo con el estado de desarrollo de las plantas. Los nemátodos como patógenos La importancia económica de los nemátodos en el cultivo de uchuva, no solo se debe a la amplia distribución eco-geográfica como fauna nativa del suelo, sino también, a que en el sitio donde se inicia el ataque se convierte en puerta de entrada para hongos, bacterias y virus que pueden llegar a causar daños mas severos que aquellos ocasionadas por el nemátodo mismo (Blanco, 1992). Objetivos Objetivo general: Conocer las principales enfermedades que se presentan en los cultivo de uchuva (Physalis peruviana L.) localizados en la zona productora de Antioquia y su relación con el estado fenológico de las plantas Objetivos específicos: 9Conocer la etiología de los agentes causales de las enfermedades y describir los síntomas de las enfermedades ocasionadas por hongos, bacterias y nemátodos desde semillero, hasta poscosecha. 9Demostrar la patogenicidad de los microorganismos aislados. 9 Conocer la incidencia de las enfermedades de acuerdo con el estado fenológico de las plantas. Localización del Estudio La fase de reconocimiento y análisis del estado fitosanitario de los cultivos de uchuva, se llevo a cabo en 14 fincas productoras de los municipios de La Unión y en el corregimiento de Santa Elena, Departamento de Antioquia. El municipio de La Unión, está localizado a una altura de 2500 m.s.n.m., tiene una temperatura media de 13°C y la precipitación media anual es de 2000 mm. El municipio de Santa Elena presenta una altitud de 2500 m.s.n.m; con una temperatura media aproximada de 18-20°C. El proyecto se realizo en tres etapas: una primera etapa de reconocimiento de las enfermedades más importantes del cultivo, aislamiento identificación y pruebas de patogenicidad del agente causal de cada una, selección de las fincas para el muestreo. La segunda etapa correspondió a la toma de muestras de tejido enfermo para corroborar la presencia de cada una de las enfermedades identificadas durante la primera etapa . la tercera en la determinación del número de plantas para conocer la incidencia de cada enfermedad por estado fonológico de la planta. Materiales y métodos Aislamiento de Bacterias En los casos en los cuales se sospechó enfermedad de origen bacteriano, de los órganos afectados se tomó una porción de tejido que comprendía una zona enferma y sana. El tejido fue luego desinfestado en hipoclorito de sodio al 1% por un tiempo de 2 minutos luego se lavo con agua destilada estéril. La muestra se depositó sobre una gota de agua estéril en un portaobjetos previamente flameado y se maceró. La suspensión resultante, se dejo en reposo por 10 minutos y luego se sembró en medio agar nutritivo (AN), utilizando un estriado por agotamiento de tal manera que permitiera una dilución de las bacterias presentes y el desarrollo de colonias individuales. Las cajas de Petri se incubaron a una temperatura de 25-28oC por un tiempo de 24 a 48 horas. Transcurrido el tiempo de incubación, se tomaron las colonias individuales y se repicaron nuevamente en AN utilizando la misma técnica. Una vez asegurada la pureza de las colonias bacterianas, estas se almacenaron a 4ºC en viales con agua destilada estéril. Cada cultivo bacteriano fue luego caracterizado mediante una prueba de tinción de Gram, KOH al 3% y observación de las características macro y microscópicas tales como: color de la colonia, aspecto y tiempo de crecimiento. Aislamiento de Hongos Las muestras que presentaban síntomas de marchitamiento vascular, manchas foliares o con evidentes signos de enfermedad causada por hongos, se incubaron durante 3-6 días en cámaras húmedas, para estimular la esporulación y el desarrollo de estructuras reproductivas y vegetativas que permitieran la identificación de los hongos presentes. Simultáneamente,se hizo aislamiento e identificación de los hongos de cada una de las muestra con síntomas de posibles enfermedades fungosas. El aislamiento consistió en cortar porciones de tejido sano y enfermo de aproximadamente 0.5 cm, desinfestación en etanol al 70% por 1 minuto y en hipoclorito de sodio al 1% por dos minutos, seguido de lavado en agua destilada estéril y siembra en medio de cultivo PDA Papa Dextrosa Agar (PDA acidificado). Los tejidos aislados se dejaron en incubación a una temperatura de 25- 28ºC, por un tiempo de 5 a 10 días y se efectuaron revisiones periódicas a fin de evidenciar características micro y macroscópicas de los hongos resultantes. Posteriormente, las colonias obtenidas se purificaron mediante la siembra de un bloque de Agar con micelio en medio PDA acidificado, obtenido a partir del borde de la colonia desarrollada. Una vez purificados los hongos, cada uno se almaceno en papel filtro a una temperatura de 4ºC. Extracción de nematodos Para la extracción de nemátodos se utilizó la técnica del Embudo de Baermann en combinación con el empleo de tamices para la separación de huevos y estados juveniles de los nematodos presentes en la muestra. Este ensayo se llevo a cabo en Agrolab; Asistencia Agroindustrial de la ciudad de Medellín. Pruebas de patogenicidad Para las pruebas de patogenicidad se utilizaron plántulas de uchuva de tres meses de edad y frutos verdes de la variedad usada por los productores de la zona. Las inoculaciones se llevaron a cabo en la casa de malla de la Unidad Experimental Paysandú perteneciente a la Universidad Nacional de Colombia, sede Medellín, localizada en el corregimiento de Santa Elena, bajo una temperatura promedio de 18 a 20 y humedad relativa alta, además se sometieron a condiciones de cámara húmeda. Preparación de inóculo e inoculación de bacterias Para la preparación del inóculo, cada bacteria fue crecida en medio AN por un periodo de 48 horas y una temperatura de 25 - 28 ºC. Con los cultivos resultantes se prepararon suspensiones acuosas. la suspensión resultante se preparó una dilución 1:10 y ésta se utilizó como solución de trabajo para la inoculación. La inoculación se hizo mediante aspersión de la suspensión bacteriana en 15 frutos de uchuva. Una vez inoculados los frutos con capacho, se colocaron en una caja plástica con tapa y acondicionada con una rejilla y agua destilada en el fondo, para garantizar condiciones de humedad. Las cajas con los frutos se incubaron a temperatura ambiente 25 - 28 ºC. por un período de 14 días, haciendo observaciones cada 3 días. Una vez identificado el género bacteriano, se realizo una caracterización final e identificación de géneros y especies por medio de reacciones bioquímicas y crecimiento en medios selectivos y específicos. Preparacion del inoculo La preparación de inóculo se hizo a partir de cultivos de cada hongo crecidos por 10 días en el mejor medio para esporulación de cada uno de ellos. Se prepararon suspensiones acuosas de micelio y/o esporas mediante la adición a cada caja petri de 100 mililitros de agua destilada más 0.1% de tween 20, seguido de la remoción del micelio y las esporas con un portaobjeto estéril y filtración de la solución resultante a través de un pedazo de muselina. Inoculación En el caso de patógenos foliares y del fruto, la inoculación se hizo por aspersión con un atomizador plástico de la suspensión acuosa de esporas. Para los patógenos de la raíz, el método de inoculación consistió en hacer un corte en las puntas de las raíces de cada planta, seguido de la inmersión de éstas en una suspensión de las esporas del hongo por un tiempo de 30 minutos y luego de la siembra en materos con suelo esterilizado. Aquellos hongos en los cuales no se logró esporulación, fueron inoculados mediante el método de disco de Agar con micelio. Los discos de Agar con micelio, se cortaron a partir de colonias activas del hongo y luego se depositaron dos discos sobre el haz de la hoja, uno a lado y lado de la nervadura central. Después de inoculadas, las plantas fueron cubiertas con una bolsa plástica para mantener condiciones de humedad alta y favorecer la germinación de las esporas y promover el proceso de penetración e infección de los hongos. Resultados Mancha gris: Manchas de forma angular a redondeada en hojas, con tamaños de 2 a 5 mm, las cuales tienen inicialmente un color verde claro o grisáceo, luego la lesión se torna amarilla en el borde y en la parte central se torna de color marrón y con una consistencia seca y quebradiza. Mancha gris Se observo el desarrollo de un crecimiento micelial de color gris sobre las lesiones en hojas y frutos. Las conidias son hialinas, filiformes o en forma de mazo y con dos o más septos. Prueba de patogenicidad Las plantas inoculadas presentaron los primeros síntomas de la enfermedad a los 15 días después de la inoculación. manchas pequeñas redondeadas y bien delimitadas, inicialmente con una coloración grisácea y posteriormente se tornaron de color marrón claro y halos concéntricos. Colonia de Cercospora sp Dormidera o marchitamiento vascular en plantas Se observo clorosis general y necrosis de los haces vasculares observados en cortes transversales hechos en la parte basal de los tallos Dormidera o marchitamiento vascular en plantas Colonias de color blanco con un ligero pigmento rosado perteneciente a la clase Deuteromycete, con dos tipos de conidias (macro y microconidias) hialinas y septadas, micelio hialino y septado, características que lo ubican en el género Fusarium y muy posiblemente en la especie F.oxysporum Pruebas de patogenicidad Los primeros síntomas fueron observados a los seis días en las plantas inoculadas con el hongo F. oxysporum, presentándose en éstas pérdida de turgencia en las hojas, clorosis, acaparamiento y marchites en comparación con los controles En el departamento de Antioquia no se había reportado la presencia de F. oxysporum en cultivos de Uchuva, algunos estudios realizados por Corpoica La Selva Zapata (2000), reportan plantas con la misma sintomatología pero se lo atribuyen a la bacteria Ralstonia solanacearum. En el presente estudio, F. oxysporum estuvo siempre asociado con plantas que presentaban marchitamiento y necrosamiento de los haces vasculares, lográndose aislar de cada una de las plantas evaluadas. Colonia de Fusarium Muerte descendente Se caracterizada por manchas necróticas de forma irregular y centro gris en hojas. En los frutos, la enfermedad se inicia en el pedúnculo y luego avanza hasta necrosarlos completamente En el envés de las hojas, la lesión presenta el desarrollo de estructuras negras a manera de cuerpos fructíferos Muerte descendente se aisló Phoma sp con colonias de color café oscuro,crecimiento algodonoso y con una tasa de crecimiento de 0.5 cm/día. El micelio es de color negro con tonalidades grisáceas. Conidias pequeñas unicelulares, hialinas, septadas, de forma elíptica a ovalada Muerte descendente En fruto, la enfermedad se observó cuatro días después de la inoculación, observándose manchas circulares de color pardo grisáceo, en contraste con los controles los cuales se encontraban totalmente sanos. A los siete días se hizo una nueva evaluación y se observó el desarrollo de picnídios Colina de Phoma sp Mancha grasienta en frutos se caracterizada por la presencia de áreas de aspecto grasoso en el capacho las cuales le dan a este un aspecto parafinado o apergaminado Prueba de patogenicidad Luego de la inoculación, se logró el desarrollo de manchas de aspecto grasiento sobre los frutos inoculados. El cáliz o capacho del fruto presentó una consistencia semejante al papiro o al papel parafinado, el fruto no sufrió ningún cambio ni presentó el desarrollo de síntomas asociados con la enfermedad Las pruebas bioquímicas llevaron a ubicar a la bacteria dentro del género Xanthomonas, Tipo de Prueba Respuesta Oxidasa - Gelatinasa + Arg. hidrolasa - Amilasa ND Crec. Amarillo en Agar nutritivo 30 C + Crecimiento mucoide + Ácido sulfhídrico - Indol - Movilidad + Anaerobiosis - Catalasa + Malonato + Citrato + MRVP -/-/- TSI -/-/- Caseinasa - Simbología: Positivo: +, Negativo: -, No Determinado: ND. Trabajo de campo: Incidencia por estado fonológico y zona. Para la estimación de los porcentajes de incidencia y la comparación de las dos localidades se aplicaron tablas de contingencia, enfrentando la ubicación con la presencia de las enfermedades, para cada estrato o piso vegetal, enfermedad, y etapa de desarrollo del cultivo. Se partió de la hipótesis nula de homogeneidad en los niveles de incidencia, según lo cual, al nivel poblacional, los dos municipios tienen la misma incidencia de las enfermedades evaluadas, y las diferencias observadas se deben al efecto del muestreo. Esta hipótesis se rechazó si la probabilidad de la prueba X2 fue menor o igual a 0,05 (nivel de significancia), en cuyo caso se concluyó que la incidencia era diferente entre las dos localidades al nivel poblacional. Resultados Se observa que a nivel de follaje predomina Cercospora y Fusarium. Las diferencias entre localidades por el nivel de incidencia de estas enfermedades se observa en los estados 3 y 4, según lo cual en Santa Elena se presentó mayor incidencia en general para las dos enfermedades. Fusarium se manifiesta en toda la planta, pero Cercospora en los dos estratos bajos. En el capacho se presentan especialmente Cercospora, Phoma y Xanthomonas. Tanto Cercospora como Phoma se presentan con diferencias significativas entre municipios en los estados 3 y 4 y en los estratos bajos (1 y 2), y fue en el municipio de Santa Elena donde se hizo mayor la incidencia de estas enfermedades con respecto a la Unión. Las diferencias por el ataque de Xanthomonas se presentaron en todos los estados de desarrollo del cultivo y en los estratos altos de la planta (2 y 3). Fue en la Unión donde la incidencia de Xanthomonas se hizo mayor. Para el efecto de los tallos, ramas y ramitas, los resultados fueron similares, en cuanto que se observó la presencia de Fusarium oxysporum con diferencias entre localidades para todos los estados de desarrollo del cultivo y a lo largo de toda la planta. Fue en Santa Elena donde los niveles de incidencia se hicieron mayores. Conclusiones: En el departamento de Antioquia, más específicamente en el Municipio de la Unión y en el corregimiento de Santa Elena, zonas en las cuales se realizó el estudio, las enfermedades más limitantes en el cultivo de uchuva son el marchitamiento vascular, causado por F.oxysporum, la mancha gris, causada por Cercospora sp y la muerte descendente o mal de tierra, causado por Phoma sp. Presentando una menor incidencia la enfermedad de la mancha grasienta ocasionada por Xanthomonas spp. El marchitamiento vascular ocasionado por el hongo F. oxysporum es una enfermedad limitante desde que inicia la producción de la planta a los 4 o 5 meses y hasta los 10 meses, período en el cual ésta baja. La mancha gris ocasionada por el hongo Cercospora sp y la muerte descendente causada por Phoma sp son enfermedades que se presentan en cualquier fase de desarrollo de la planta de uchuva, especialmente después de los tres meses de edad, siendo más severas en las épocas de alta pluviosidad. El desconocimiento de estas enfermedades y sus causas por parte de los productores y técnicos del cultivo en esta región fue evidente. Se concluye que en cuanto a la incidencia en Santa Elena se presentó mayor incidencia en general para Fusarium. Cercospora, Phoma y Xanthomonas. F. oxysporum se manifiesto en toda la planta, encambio Cercospora en los dos estratos bajos; y en el capacho se presentan especialmente Cercospora, Phoma y Xanthomonas.