GEOMETRÍA MOLECULAR
Anuncio
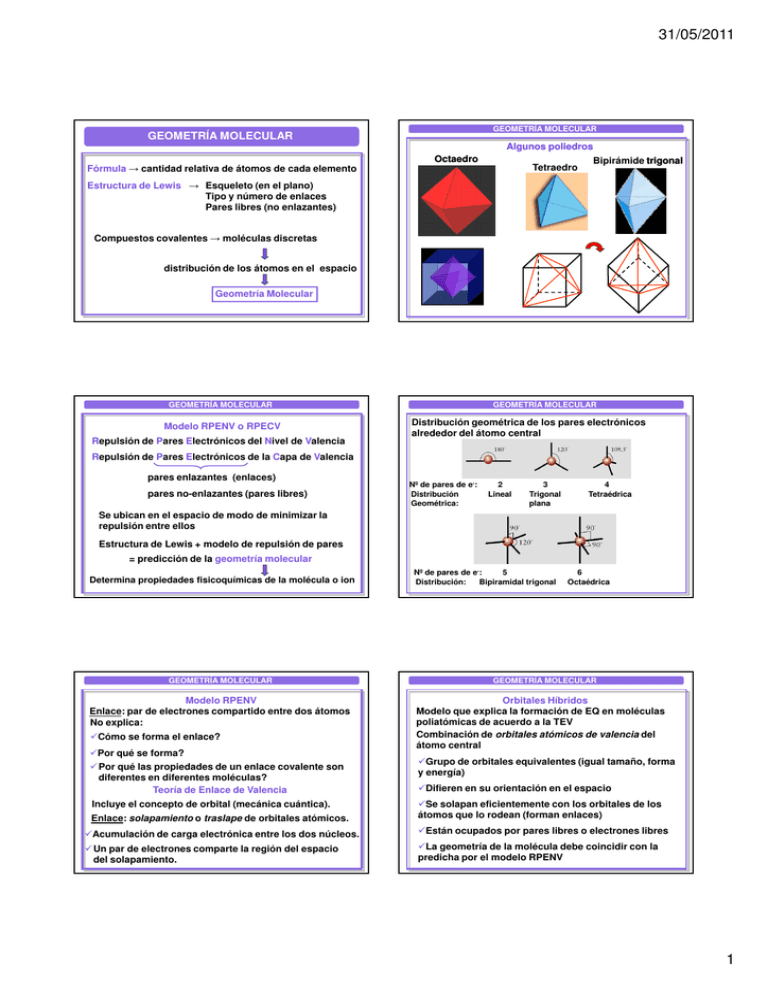
31/05/2011 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Fórmula → cantidad relativa de átomos de cada elemento Algunos poliedros Octaedro Tetraedro Bipirámide trigonal Estructura de Lewis → Esqueleto (en el plano) Tipo y número de enlaces Pares libres (no enlazantes) Compuestos covalentes → moléculas discretas distribución de los átomos en el espacio Geometría Molecular GEOMETRÍA MOLECULAR Modelo RPENV o RPECV Repulsión de Pares Electrónicos del Nivel de Valencia GEOMETRÍA MOLECULAR Distribución geométrica de los pares electrónicos alrededor del átomo central Repulsión de Pares Electrónicos de la Capa de Valencia pares enlazantes (enlaces) pares no-enlazantes (pares libres) Nº de pares de e-: Distribución Geométrica: 2 Lineal 3 Trigonal plana 4 Tetraédrica Se ubican en el espacio de modo de minimizar la repulsión entre ellos Estructura de Lewis + modelo de repulsión de pares = predicción de la geometría molecular Determina propiedades fisicoquímicas de la molécula o ion GEOMETRÍA MOLECULAR Modelo RPENV Enlace: par de electrones compartido entre dos átomos No explica: Cómo se forma el enlace? Por qué se forma? Por qué las propiedades de un enlace covalente son diferentes en diferentes moléculas? Teoría de Enlace de Valencia Incluye el concepto de orbital (mecánica cuántica). Enlace: solapamiento o traslape de orbitales atómicos. Nº de pares de e-: 5 Distribución: Bipiramidal trigonal 6 Octaédrica GEOMETRÍA MOLECULAR Orbitales Híbridos Modelo que explica la formación de EQ en moléculas poliatómicas de acuerdo a la TEV Combinación de orbitales atómicos de valencia del átomo central Grupo de orbitales equivalentes (igual tamaño, forma y energía) Difieren en su orientación en el espacio Se solapan eficientemente con los orbitales de los átomos que lo rodean (forman enlaces) Acumulación de carga electrónica entre los dos núcleos. Están ocupados por pares libres o electrones libres Un par de electrones comparte la región del espacio del solapamiento. La geometría de la molécula debe coincidir con la predicha por el modelo RPENV 1 31/05/2011 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR 2 orbitales sp Orbitales Híbridos sp Se hibridizan y forman 4 orbitales sp3 Orbitales Híbridos sp2 Híbridos sp2 Todos juntos 1 orbital s Híbridos sp3 todos juntos 2 orbitales p 3 orbitales híbridos sp2 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR De la combinación de N orbitales atómicos se obtiene un grupo de N orbitales híbridos np n sp n sp2 n sp3 Densidades Orbitales electrónicas Atómicos 2 Geometría de la hibridación Pares de enlace Pares no enlazantes 2 sp Geometría molecular 0 Lineal Lineal ns spp 3 Habrá tantos orbitales híbridos como densidades electrónicas (δ δe) alrededor del átomo central Ejemplo 3 0 Trigonal plana Trigonal plana Un enlace (simple, doble o triple) Una δe 2 Un par libre (no enlazante) 1 Un electrón libre (desapareado) Angular GEOMETRÍA MOLECULAR Densidades electrónicas 4 Orbitales Geometría de la atómicos hibridación Pares de Pares no enlace enlazantes 4 sppp Geometría molecular GEOMETRÍA MOLECULAR Ejemplo Tetraédrica 3 5 spppd 0 PCl5 Bipirámide trigonal Bipirámide trigonal 0 Tetraédrica 5 4 1 SF4 Balancín o tetraedro distorsionado 1 3 ClF 2 3 Pirámide trigonal Forma de T 2 2 2 Angular XeF2 3 Lineal 2 31/05/2011 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Geometrías derivadas de la Bipirámide Trigonal 6 6 spppdd SF6 0 Octaédrica Par libre → Octaédrica 5 1 BrF5 Pirámide de base cuadrada 4 Tetraedro distorsionado Balancín o sube y baja 2 XeF4 Cuadrada plana GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR ÁNGULOS DE ENLACE Geometría de la hibridación => cuerpos geométricos regulares y ángulos ideales Ejemplos: Geometría de la hibridación del CO2 ? Lineal Si el átomo central tiene pares libres (no enlazantes) G.M.= Lineal Geometría de la hibridación ≠ Geometría Molecular Ángulos de enlace ≠ ángulos ideales Molécula G pares G molecular ángulo CH4 Tetraédrica Tetraédrica 109.5º NH3 Piramidal 107.3º H2O Angular 104.5º La repulsión de los pares libres es mayor que la de los enlaces Geometría de la hibridación del BF3, NO2? Trigonal plana NO2 G.M.=Trigonal plana GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Geometría de la hibridación del CH4, NH3, H2O ?: CH4 NH3 Tetraédrica Geometría de la hibridación: Bipirámide Trigonal PCl5 H2O Bipirámide trigonal SF4 Balancín Tetraedro distorsionado ClF3 G.M.=Pirámide trigonal G.M.Tetraédrica G.M.= Angular XeF2 G.M.=Angular Forma de T Lineal 3 31/05/2011 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Momento dipolar Geometría de la hibridación: Octaédrica SF6 BrF5 Dipolo: dos cargas eléctricas de igual magnitud y signo opuesto separadas cierta distancia Q+ G.M.=Octaédrica G:M:=Pirámide de base cuadrada µ Q- r La magnitud del dipolo depende de los valores de Q y de r Está dada por el momento dipolar µ µ=Qxr XeF4 Unidad de µ: Debye (D) = 3,34x10-30 Coulomb x metro Q (e-) = 1,6 x 10-19 C 1Å = 10-10 m G.M.=Cuadrada plana GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Momento dipolar de moléculas covalentes Molécula polar: distribución asimétrica de carga → µ ≠ 0 POLARIDAD DE LAS MOLÉCULAS Las moléculas polares interactúan con el campo eléctrico eléctrico.. Molécula no-polar: distribución simétrica de carga → µ = 0 Moléculas diatómicas δ+ δH Cl Cl Cl µ=0 µ≠0 Enlace no polar → molécula no-polar Enlace polar → molécula polar Moléculas poliatómicas Sin campo eléctrico Con campo eléctrico Enlace no polar → molécula no-polar Enlace polar → molécula polar MOLÉCULAS NO POLARES (µ (µ = 0) MOLÉCULAS NO MOLECULAR POLARES (µ (µ = 0) GEOMETRÍA Moléculas diatómicas que no contienen enlaces polares. PCl5 I3- Ej: F2, H2, N2, O2 etc. Moléculas poliatómicas simétricas con enlaces polares o pares libres que se cancelan. cancelan. b+c+a=0 Ejemplos: CO2 a BCl3 b C b+c SF6 XeF4 Cl4C 4 31/05/2011 MOLÉCULAS NO POLARES (µ (µ ≠0) MOLÉCULAS POLARES (µ (µ ≠0) BrF3 Moléculas diatómicas que presentan un enlace polar. IF5 Ejemplo: HF HCl Moléculas poliatómicas que contienen enlaces polares y/o pares de electrones libres distribuidos de manera tal que no se cancelan entre sí. Ejemplos: NH3 CHCl3 NF3 H2O GEOMETRÍA MOLECULAR EN RESUMEN: Enlace no polar Moléculas Diatómicas Molécula no-polar Enlace polar Molécula polar Ejemplos: Enlaces no polares y molécula no polar (µ (µ = 0) I3Enlaces no polares y molécula polar (µ ≠ 0) O3 Moléculas Poliatómicas: Poliatómicas: para determinar su polaridad se debe conocer su geometría molecular. molecular. Enlaces polares y molécula polar (µ (µ ≠ 0) NO2, NH3, H2O, SCl4, BrF5, ICl3 Se debe considerar: Polaridad y posición relativa de los enlaces. Enlaces polares y molécula no polar (µ (µ = 0) Presencia de e- libres y su distribución espacial. CO2, BF3, CCl4, SO3, PCl5, SF6 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Enlaces múltiples Modelo RPENV: no distingue diferentes enlaces son pares de electrones compartidos (1,2 o 3) 1s 1s Enlaces sigma Teoría de Enlace de Valencia : Distintos tipos de enlace Enlace σ: traslape o solapamiento frontal de los orbitales atómicos H-H Región de solapamiento Enlace π: traslape o solapamiento lateral de los orbitales atómicos Región de solapamiento Los orbitales híbridos sólo participan de enlaces σ Los orbitales s sólo participan de enlaces σ En los enlaces π participan orbitales p y d (presentan lóbulos) H-Cl Cl-Cl 5 31/05/2011 GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Enlace π Eteno Eje internuclear Cada C tiene hibridación sp2 np np Enlace simple (OE=1): 1 enlace σ Enlace doble (OE=2): 1 enlace σ + 1 enlace π Enlace triple (OE=3): 1 enlace σ + 2 enlaces π Enlace de cualquier orden → 1 enlace σ → 1 orbital híbrido Una densidad electrónica GEOMETRÍA MOLECULAR GEOMETRÍA MOLECULAR Etino (o acetileno) H-C≡ ≡C-H Estructura de Lewis RPENV Hibridación de cada carbono sp TEV Nº de pares de electrones Nº de densidades electrónicas Tipo de orbitales híbridos Geometría de pares de electrones Geometría de hibridación CO2 GEOMETRÍA MOLECULAR Polaridad Tipo de enlaces (sigma y pi) 6






