Tendencias periódicas de las propiedades de los elementos
Anuncio

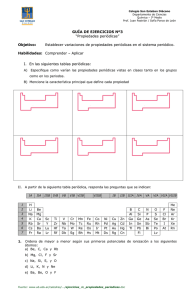
Tendencias periódicas de las propiedades de los elementos PROPIEDADES PERIÓDICAS Son las propiedades que dependen de los electrones del nivel más externo de un átomo. Se llaman periódicas porque se repiten en la tabla periódica al cabo de un cierto número de elementos, debido a la coincidencia a la capa de valencia. Ciertas propiedades de los elementos, exhiben un cambio gradual conforme nos movemos a lo largo de un periodo o una familia. Las principales propiedades periódicas son: 1. Radio atómico 2. Energía de ionización 3. Afinidad electrónica 4. Electronegatividad 5. Carácter metálico RADIO ATOMICO (Nos da idea del tamaño del átomo en unidades de A0 = 10-10m) A) Al bajar en una familia (columna) de la tabla periódica, el radio atómico crece B) Al avanzar hacia la derecha en un periodo (renglón) de la tabla periódica, el radio atómico decrece. Del modelo cuántico del átomo podemos concluir que un átomo no tiene una frontera definida (los orbitales son regiones en el espacio con la máxima probabilidad de encontrar un electrón y no define con precisión donde está el ultimo electrón). Por lo que se puede estimar el radio atómico suponiendo que los átomos son objetos esféricos que se tocan unos a otros al estar unidos en una molécula. ENERGIA DE IONIZACION (Se define como la energía que se requiere para sacar al electrón más externo de un átomo neutro en estado gaseoso). Na + E Na+ + 1ePara quitar los electrones restantes se requiere cada vez más energía, es decir la energía de ionización es mayor para cada electrón subsiguiente. A) Al bajar en una familia (columna) de la tabla periódica, la energía de ionización disminuye un poco B) Al avanzar hacia la derecha en un periodo (renglón) de la tabla periódica, la energía de ionización aumenta. AFINIDAD ELECTRONICA (Es la energía que se desprende cuando un átomo en estado gaseoso acepta un electrón y forma un ion negativo). - Cl (g) + 1e Cl + E A) Al bajar en una familia (columna) de la tabla periódica, la energía de ionización disminuye. B) Al avanzar hacia la derecha en un periodo (renglón) de la tabla periódica, la energía de ionización aumenta. La afinidad electrónica varía en la tabla periódica exactamente igual que el potencial de ionización. ELECTRONEGATIVIDAD (Es la capacidad de un átomo a atraer electrones). Na : Cl Na : Cl Na+ Cl- C) Al bajar en una familia (columna) de la tabla periódica, la energía de ionización disminuye. D) Al avanzar hacia la derecha en un periodo (renglón) de la tabla periódica, la energía de ionización aumenta. Electronegatividad de Cl = 3.2 & Electronegatividad de Na = 0.9 CARÁCTER METÁLICO Los metales se caracterizan por: Ser elementos con pocos electrones en su nivel más externo. Tener tendencia a perder electrones y formar iones positivos, son poco electronegativos. Se oxidan fácilmente, son reductores (forman óxidos básicos). Tener baja electronegatividad (escala 0-4). Los no metales se caracterizan por: Ser elementos con muchos electrones en su nivel más externo. Tener tendencia a ganar electrones y formar iones negativos, son muy electronegativos. Se reducen fácilmente, son oxidantes (forman óxidos ácidos). Tener alta electronegatividad (escala 0-4). La siguiente tabla ejemplifica las tencias que tienen las propiedades periodicas en la tabla periodica.