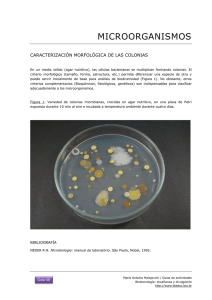
Trabajos Prácticos - Microbiología e Inmunología
Anuncio

MICROBIOLOGÍA E INMUNOLOGÍA DEPARTAMENTO DE QUÍMICA BIOLÓGICA FACULTAD DE CIENCIAS EXACTAS Y NATURALES UNIVERSIDAD DE BUENOS AIRES GUÍA DE TRABAJOS PRÁCTICOS 2010 2 3 4 5 6 7 8 TP N°1 A) MÉTODOS DE ESTERILIZACIÓN OBJETIVO Adquirir experiencia en el manejo de equipos de esterilización y aplicar métodos de desinfección y esterilización empleando distintos agentes físicos o químicos. Agentes físicos Calor húmedo (autoclave) El alumno se familiarizará con el uso del autoclave que incluye: 1- Preparación del material a autoclavar. 2- Carga del autoclave con el material a esterilizar o decontaminar. 3- Cierre del autoclave y encendido. 4- Eliminación del aire contenido en su interior (hasta emisión de chorro continuo de vapor por la espita o válvula de descarga). 5- Cierre de la válvula de descarga y control hasta llegar a la presión de esterilización deseada. 6- Control del tiempo de esterilización requerido. 7- Apagado del autoclave. 8- Apertura de la válvula para igualar presiones. 9- Retirado y secado del material autoclavado. Se esterilizarán distintos materiales de vidrio y otros que resistan la temperatura, como así también soluciones y medios de cultivo. También se decontaminará material que contenga cultivos bacterianos (en especial cultivos de microorganismos que forman esporas). Se harán controles de esterilidad después del autoclavado para verificar que el proceso fue eficiente. Calor seco (horno) 1- Preparación del material a hornear. 2- Carga del horno. 3- Control hasta llegar a la temperatura de esterilización. 4- Control del tiempo de esterilización. 5- Apagado, enfriado y apertura del horno. Se esterilizarán materiales que no puedan ser autoclavados y/o que resistan altas temperaturas. Incineración por llama El alumno adquirirá práctica en el flameado de la boca de botellas, frascos y tubos y en la esterilización y decontaminación del ansa que se emplea para transferir cultivos bacterianos. Radiación ultravioleta Se empleará la radiación ultravioleta como agente desinfectante o esterilizante. Se pondrán debajo de la luz U.V. objetos que no puedan autoclavarse ni hornearse ( Ej: tapas plásticas, membranas filtrantes, etc.). Filtración Se procederá a esterilizar líquidos que contienen componentes sensibles al calor como proteínas, vitaminas, antibióticos y soluciones salinas definidas. 9 Se emplearán filtros de celulosa utilizando vacío o presión positiva. Agentes químicos Se emplearán distintos agentes germicidas y desinfectantes (soluciones de hipoclorito de sodio, cloroxilenol, formaldehído, etc.) para desinfectar superficies. Se analizará la reducción de la cantidad de microorganismos presentes en una mesada de trabajo, pasando un hisopo con el que se sembrarán placas conteniendo agar nutritivo, antes y después de haber sido tratada con el desinfectante en cuestión. Bibliografía: Seeley, H.W.Jr.; Vandermark, P.J., Lee, J.J., ¨Microbes in action. A laboratory manual of microbiology¨. Editores W. H. Freeman and Company, Cuarta Edición, Capítulo 5, 1991. Tortora G.J., Funke B.R., Case C.L. Introducción a la Microbiología. Editorial Acribia SA, Zaragoza España, 1993. Vullo D.L., Wachsman M.B., Alché L.E. Microbiología en Práctica. Editorial Atlante S.R.L. Buenos Aires, 2000. B) MICROORGANISMOS DEL MEDIO AMBIENTE (OBSERVACIÓN MACROSCÓPICA) OBJETIVOS - Observar la gran variedad de microorganismos presentes en el medio ambiente (laboratorio de T.P.), determinando las diferentes morfologías de colonias que se obtienen. - Poner de manifiesto la necesidad de trabajar en estricta esterilidad en microbiología debido a la gran facilidad con que se puede contaminar el material de trabajo. DESARROLLO DEL PRÁCTICO 1- Exponer placas con agar nutritivo al medio ambiente durante distintos tiempos. 2- Estriar con un hisopo previamente pasado por la mesada de trabajo sobre una placa con agar nutritivo. 3- Incubar las placas a temperatura ambiente hasta la clase siguiente. 4- Observar las colonias obtenidas y describirlas teniendo en cuenta las siguientes características: .Forma: puntiforme, circular, rizoide, irregular, filamentosa. .Tamaño: grande (más de 3 mm), mediana (2-3 mm), pequeña (1-2 mm) .Color .Borde: entero, ondulado, lobulado, filamentoso, ondeado .Elevación: plano, elevado, convexo, pulvinado, umbonado .Superficie: suave, brillante, rugosa, plegada, seca, polvorienta 10 C) TÉCNICAS MICROBIOLÓGICAS BÁSICAS OBJETIVOS - Adquirir experiencia en el manejo de los materiales y técnicas básicas que se utilizarán a lo largo del curso de trabajos prácticos. - Reforzar los conocimientos previos sobre el trabajo de laboratorio en condiciones de esterilidad. Coordinar la operativa de trabajo en el laboratorio y las normas de seguridad. DESARROLLO DEL PRÁCTICO - En todos los prácticos que se realicen en condiciones de esterilidad se debe, en primer lugar, limpiar el área de trabajo de la mesada con alguna sustancia desinfectante y encender el mechero. - Preparar placas de Petri con agar nutritivo fundido y mantenido a 45 °C. - Esperar que el medio solidifique y luego secar las placas invertidas en estufa a 37 °C. -Preparar y rotular tubos de hemólisis para realizar diluciones seriadas al décimo desde 10-1 hasta 10-3. - Colocar en cada tubo 1,8 ml de solución fisiológica estéril siguiendo las instrucciones del docente en cuanto al trabajo en esterilidad. - Agregar al tubo rotulado 10-1 0,2 ml de una solución estéril. Descartar la pipeta. Homogeneizar en agitador. Con una nueva pipeta tomar 0,3 ml del tubo anterior y descargar 0,2 ml de esta dilución (10-1) en el tubo rotulado 10-2. Continuar haciendo las diluciones hasta 10-3. - A partir de la dilución 10-3 sembrar: a) con ansa por estriado sobre agar nutritivo b) con pipeta (0,1 ml) y posterior rastrillado sobre agar nutritivo - Incubar las placas INVERTIDAS en cuarto estufa a 37ºC hasta la clase siguiente. 11 Procedimiento para preparar una placa por volcado (aislamiento en profundidad). A) Fundir el medio contenido en un tubo y luego enfriarlo hasta que se lo pueda tomar con la mano sin quemarse. B) Flamear el ansa C) y D) Transferir microorganismos al medio con el ansa. E) Agitar rotando el tubo entre las manos para que se homogeinice bien. F) Volcar en una placa de Petri estéril. G) Agitar con un movimiento rotatorio hasta asegurar una buena distribución. H) Incubar boca abajo. Un método alternativo muy usado es volcar en la placa vacía una suspensión bacteriana y luego con el medio fundido y enfriado según A) volcarlo y efectuar los pasos G) y H). 12 Procedimiento para obtener colonias aisladas estriando en placa: A) Flamear el ansa B) Obtener un inóculo con ella (en forma estéril) C) Estriar con el ansa en medio estéril contenido en una placa de Petri siguiendo uno de los modelos mostrados en D. 13 Siembra en agar inclinado (pico de flauta) por estría. A) Flamear el ansa B) Obtener material a sembrar C) Apoyar el ansa sobre la superficie del agar y estriar con el diseño mostrado en D) 14 Inoculación por punción A) Flamear un ansa recta B) Sumergirla una vez fría, en una suspensión bacteriana C) Punzar cuidadosamente en el centro del tubo hasta el fondo y retirar el ansa cuidadosamente tratando de recorrer el mismo camino que para la inoculación. D) Flamear el ansa E) Incubar el tubo 15 T.P.N°2 EVALUACIÓN DE LA DIVERSIDAD MICROBIANA EN UNA MUESTRA NATURAL Columna de Winogradsky Introducción A diferencia de los estudios realizados por Luis Pasteur y Roberto Koch sobre cultivos puros, dos famosos microbiólogos: Sergei N. Winogradsky (1856-1953) y Martinus Willem Beijerinck (18511931), fueron los primeros en estudiar las relaciones entre diferentes tipos de microorganismos que conviven en un mismo habitat y cuyas poblaciones se mezclan. Una demostración simple de laboratorio - la columna de Winogradsky- ilustra cómo diferentes microorganismos interactúan entre sí, de forma tal que la actividad metabólica de un microorganismo posibilita el crecimiento de otros y viceversa. Estas columnas, que llevan el nombre del microbiólogo ruso que las utilizó por primera vez, son sistemas completos autoreciclables, puestos en marcha solamente por energía lumínica. Inicialmente, todos los microorganismos están presentes en muy baja proporción, pero cuando la columna se incuba por 2 o 3 meses, los distintos tipos de microorganismos proliferan y ocupan distintas zonas en donde las condiciones ambientales favorecen sus actividades específicas. La columna de Winogradsky es una demostración clásica de cómo los microorganismos ocupan micrositios altamente específicos de acuerdo a sus tolerancias ambientales y sus requerimientos de carbono y energía. Además, la columna permite ver cómo los elementos minerales son reciclados tal como ocurre en los ambientes naturales. En este trabajo práctico, se enfoca principalmente la utilización del azufre por los distintos microorganismos, pero realizando pequeñas modificaciones se pueden estudiar ciclos equivalentes para el nitrógeno, carbono y otros elementos. OBJETIVOS Los alumnos deberán: 1- Armar una columna de Winogradsky. 2- Observar y describir la sucesión temporal de microorganismos en la columna. Material de laboratorio • • • • • • • Muestra de barro de un arroyo, lago, pantano o costa de mar o río (aproximadamente 100–150 gr de sedimento superficial o subsuperficial). Recipiente alto de paredes trasparentes y rectas (botellas plásticas o probetas de vidrio. Tapón de goma o cobertura plástica. Pipetas de vidrio, portaobjetos, cubreobjetos, cajas de Petri. Medios de cultivo de enriquecimiento, selectivos y diferenciales, colorantes, reactivos para realizar pruebas bioquímicas. Papel de filtro o en su defecto papel de diario finamente cortado. 6 gr de cada una de las siguientes sales: CaCO3 , CaSO4 , CaHPO4. Procedimiento 1- Colectar una cantidad de tierra o barro para llenar el recipiente hasta una altura aproximada de 10 cm. Remover las piedras, ramas o partículas grandes del material en estudio. Mezclarlo con las sales y el papel finamente cortado. 16 2- Colocar la mezcla en un recipiente adecuado (en nuestro caso una probeta de vidrio de 500 ml) y añadir suficiente agua destilada hasta aproximadamente 3 – 5 cm del borde. Revolver la mezcla para eliminar burbujas de aire. 3- Marcar el nivel de agua y cubrir la boca de la probeta con una envoltura plástica para reducir la evaporación. Puede ser necesario reponer agua para mantener el nivel original. 4- Incubar a temperatura ambiente cerca de una ventana para que reciba una adecuada cantidad de luz, pero no excesiva. 5- Observar la columna semanalmente, anotando cualquier cambio de aspecto (color, crecimiento microbiano, etc.). Guía para la interpretación de la columna de Winogradsky Una columna ideal de Winogradsky se podría representar con el siguiente esquema: 17 Apéndice Medios de enriquecimiento y condiciones de cultivo para aislar las especies representativas de uno o más grupos fotosintéticos. Organismos a ser enriquecidos Bacterias verde azuladas Fuente de C orgánica ninguna Bacterias verdes del azufre ninguna Bacterias púrpuras del azufre Bacterias púrpuras Sales inorgánicas ninguna NH4Cl: 1,0 Na2S.9H2O: 2,0 NaHCO3: 5,0 ninguna NH4Cl: 1,0 Na2S.9H2O: 1,0 NaHCO3: 5,0 malato de sodio: NH4Cl: 1,0 5,0 extracto de levadura: 0,5 Atmósfera pH aerobia o aerobia + 5%CO2 ninguna 6,0 - 8,0 ninguna 8,0 - 8,5 ninguna 7,0 - 7,5 7,5 El medio basal contiene: MgSO4.7H2O................................... 0,2 K2HPO4........................................... 1,0 FeSO4.7H2O.................................... 0,01 CaCl2................................................ 0,02 MnCl2.4H2O.................................... 0,002 NaMoO4.2H2O................................ 0,001 NaCl................................................. 0,5 La concentración de los componentes de los medios se expresa en gr/l. Medio ambiente: iluminación constante y 25 - 30 °C. Las técnicas de coloración y las pruebas bioquímicas están detalladas en las guías correspondientes a esos temas. Bibliografia Brock, T. D., Madigan, M. T. Microbiología. Sexta edición. Prentice Hall Hispanoamericana S.A. 1993. Seeley, H. W. Jr., VanDemark, P. J., Lee, J. J.: Microbes in action. A Laboratory Manual of Microbiology. W. H. Freeman and Company New York. Fourth Edition. 1991. Tortora, G. J., Funke, B. R., Case, C. L.: Introducción a la Microbiología. Editorial Acribia, S.A. Zaragoza, España. 1993. Vullo, D., Wachsman, M., Alche, L. Microbiología en Práctica. Manual de técnicas de laboratorio para la enseñanza de Microbiología básica y aplicada. Primera edición Editorial Atlante S.R.L., Buenos Aires, 2000. 18 T.P N°°3 OBSERVACIÓN MICROSCÓPICA DE MICROORGANISMOS OBJETIVOS Entrenamiento en preparación de extendidos y realización de coloraciones. Observación microscópica de morfología y agrupamientos bacterianos. Microorganismos a usar Escherichia coli Klebsiella pneumoniae Pseudomonas aeruginosa Staphylococcus aureus Streptococcus faecalis Micrococcus luteus Bacillus subtilis Bacillus cereus Bacillus sphaericus Mycobacterium phlei 1-Preparación de extendidos y coloración por el método de Gram. a-Rotular convenientemente cada uno de los portaobjetos. b-Preparar extendidos de los microorganismos indicados por el docente. Tomar material de la colonia elegida, con un ansa previamente esterilizada a la llama y suspender este material en una gota de agua colocada en la mitad del portaobjetos. Extender el material sobre toda la superficie del portaobjeto. c-Dejar secar al aire junto a la llama del mechero. d-Fijar con calor pasando el preparado por sobre la llama SIN QUEMARLO. e-Cubrir el extendido con una solución del colorante cristal violeta. Dejar en contacto 2 minutos. f-Volcar el colorante. Cubrir con solución de lugol. Dejar en contacto durante 2 minutos. g-Decolorar con alcohol-acetona (exhaustivamente). Lavar con agua. h-Cubrir con safranina (colorante de contraste). Dejar en contacto 1 minuto. Lavar con agua. i-Secar j-Observar al microscopio óptico con objetivo de inmersión. Se deberán reconocer las características morfológicas y tintoriales de las distintas bacterias. El alumno deberá informar el agrupamiento, forma, coloración, pudiendo utilizar como guía para dicha descripción la siguiente clasificación: Forma: esférica (COCOS) alargada (BACILOS) bacilos cortos (COCOBACILOS) Agrupamiento: aislado (individual) diplos tetradas cadenas racimos empalizada 19 2-Coloración de ácido resistencia OBJETIVO: Detección en materiales biológicos de especies de Mycobacterium y/o Nocardia que pueden ser patógenas. Se vincula a una peculiar composición de las paredes en estas bacterias. INSTRUCCIONES: 1-Preparar extendidos de los microorganismos a estudiar. 2-Fijar con calor. 3-Cubrir todo el porta con fucsina básica fenolada (carbolfucsina) 4-Calentar hasta emisión de vapores y seguir dicho calentamiento durante 3 minutos más. Si se seca alguna parte del porta, agregar colorante sobre el preexistente y no sobre la parte seca, hasta cubrirlo nuevamente. 5-Lavar con agua. 6-Decolorar con alcohol-ácido hasta que no se desprenda más colorante. 7-Lavar con agua. 8-Cubrir el extendido con azul de metileno. Dejar en contacto durante 30 segundos. 9-Lavar con agua. Secar. 10-Observar con objetivo de inmersión. Solución de Ziehl (Fucsina fenicada) 1-Fucsina básica Alcohol etílico 2-Fenol Agua destilada 0.3 g 10 ml 5g 95 ml Mezclar soluciones 1 y 2. Alcohol ácido HCl (densidad 1.19) Alcohol etílico 3 ml 97 ml Solución de azul de metileno Azul de metileno Agua destilada 1.4 g 100 ml 3-Coloración de esporas. OBJETIVO: Esta técnica permite distinguir las esporas, del cuerpo vegetativo del microorganismo, como así también ver su localización y forma. INSTRUCCIONES: 1-Prepare un extendido del microorganismo. 20 2-Fijar por calor y cubrir todo el portaobjeto con una solución de verde de Malaquita. 3-Calentar hasta emisión de vapores y seguir dicho calentamiento durante 3 minutos (no permitir que se seque el colorante. Si esto ocurriera, agregar colorante, sobre el preexistente y no sobre la parte seca, hasta cubrirlo nuevamente.) 4-Lavar con agua y cubrir con solución de Safranina. Dejar actuar 1 minuto. Lavar con agua, secar y observar con objetivo de inmersión. 5-Informar: morfología, color y tipo de espora. Solución de Verde de Malaquita. Verde de Malaquita al 5 % en agua destilada. Solución de Safranina Safranina 0.5 g en agua destilada. 4) Tinción negativa INSTRUCCIONES 1-Colocar una pequeña gota de tinta china en la parte central del portaobjetos. 2-Utilizando el ansa, colocar una gota de la suspensión de microorganismos sobre la tinta china. 3-Colocar sobre el preparado un cubreobjeto para que se forme un film (tinta-cultivo) 4-Observar con objetivo de inmersión. ACLARACIÓN: Los tiempos que aparecen en los protocolos de las tinciones en la guía de T.P. son los que figuran en los kits comerciales. Si se utilizan los colorantes en otra concentración, puede ser que dichos tiempos se modifiquen. BIBLIOGRAFÍA Brock, T.D.; Smith, D.W. & Madigan, M.T. ¨Microbiologia¨, Prentice Hall Hispanoamericana S.A., Sexta Edición, 1993 21 T.P.N°4 RECUENTO DE CÉLULAS VIABLES OBJETIVO: Determinar las unidades formadoras de colonias de una muestra de bacterias por el método de recuento en placa. INTRODUCCIÓN TEÓRICA El método de recuento en placa se utiliza a menudo para contar sólo las células vivas (capaces de dividirse). En el método de placa extendida, una muestra pequeña (generalmente 0.1 ml) se extiende en esterilidad sobre la superficie de una caja de cultivo con agar que contiene medio adecuado y se incuba hasta que las colonias sean visibles a simple vista. Se infiere que cada colonia se originó de una sola célula, entonces contando el número de colonias se puede calcular la cantidad de células viables de la muestra. Para minimizar errores al calcular el tamaño de la población se ha determinado prácticamente que debe haber entre 30 y 300 colonias por caja de cultivo, por eso para suspensiones densas es necesario realizar diluciones del cultivo. El tamaño de la población se calcula usando la siguiente fórmula: ufc/ml = N / vol x dil donde: ufc:unidades formadoras de colonias N: número promedio de colonias obtenidas para una dilución dada. vol: volumen de inóculo dil: dilución MATERIALES -cultivo bacteriano -solución fisiológica -agar nutritivo -material de vidrio estéril (tubos, pipetas, placas de Petri) MÉTODO 1- Hacer diluciones seriadas al décimo de las muestras a titular: dil.(-1) 0.1 ml muestra + 0.9 ml solución fisiológica dil.(-2) 0.1 ml dil(-1) + 0.9 ml solución fisiológica dil.(N) 0.1 ml dil.(N-1) + 0.9 ml dilución fisiológica 2- Sembrar por rastrillado 0.1 ml de cada dilución en placas de Petri con agar nutritivo (cada dilución se siembra por duplicado). 3- Las placas se incuban 24 - 48 horas en estufa a 37 °C. 4- Contar las colonias obtenidas en cada placa. 22 5- Elegir la dilución en la cual se hayan obtenido entre 30 y 300 colonias y calcular las unidades formadoras de colonias (ufc) según la fórmula: 6- Tomar 1 ml de la muestra original (a partir de la cual se hicieron las diluciones) y medir la densidad óptica en un espectrofotómetro a 600 nm. 7- Comparar los resultados obtenidos de ufc/ml y D.O., entre los distintos microorganismos utilizados. Bibliografía 1- Seeley, H.W.Jr.; Vandermark, P.J. , Lee, J.J., ¨Microbes in action. A laboratory manual of microbiology¨. Editores W. H. Freeman and Company, Cuarta Edición, Capítulo 5, 1991. 2- Brock, T.D.; Smith, D.W. & Madigan, M.T. ¨Microbiologia¨ Prentice Hall Hispanoamericana S.A., Sexta Edición, 1993 23 T.P.N°5 AISLAMIENTO DE DISTINTAS ESPECIES BACTERIANAS Para aislar un microorganismo de la naturaleza, se debe conocer previamente los requerimientos nutricionales y las condiciones ambientales óptimas para su crecimiento. Los alumnos deberán buscar en la bibliografía, las características metabólicas y el hábitat de los microorganismos que se van a utilizar. OBJETIVO: Aislamiento y posterior identificación de distintas especies bacterianas a partir de diferentes muestras. METODOLOGÍA: Para el aislamiento de las distintas especies se va a seguir el siguiente esquema: - Inocular la muestra en un caldo de enriquecimiento (que puede o no ser selectivo al mismo tiempo), para favorecer el crecimiento del microorganismo de interés. - Incubar a temperatura y tiempo adecuados. - Tomar una muestra del caldo ya crecido y estriar con un ansa en un medio sólido que sea selectivo, para inhibir la flora acompañante del microorganismo que quiero aislar, y obtener colonias del mismo. Este medio puede a la vez ser diferencial (se diferencian cepas o especies bacterianas en base a alguna característica de las colonias). - Incubar a temperatura y tiempo adecuados. - Observar crecimiento de colonias aisladas. Luego del aislamiento se hará un repique de alguna de las colonias obtenidas a un agar nutritivo para hacer una coloración de Gram. Posteriormente se identificarán los microorganismos en base a las pruebas bioquímicas y a las otras técnicas de coloración. Aislamiento de Enterobacterias 1- Tomar 1ml de muestra de agua y sembrar en caldo Mac Conkey 1X en tubos con campanita de Durham. 2- Incubar durante 48 hs. a 37°C. 3-Observar crecimiento (la formación de gas y viraje del indicador Azul de Bromocresol a amarillo indica probable presencia de E. coli). 4- Tomar una muestra con el ansa y estriar sobre placas con agar EMB. 5- Incubar durante 24 hs. a 37 °C. 6- Observar colonias con distinta morfología y color. Aislamiento de Pseudomonas sp. 1- Sembrar 1 ml. de agua en caldo M9. 2- Incubar 48 hs. a 37 °C. 3- Si se observa crecimiento, tomar una muestra con el ansa y estriar sobre una placa con agar Cetrimida. 4-Incubar 48 hs a 42°C. 5- Observar crecimiento de colonias con pigmento verde 24 Aislamiento de Bacillus sp. 1- Agregar 10 g. de arroz (una cucharada) a 30 ml de solución fisiológica estéril. 2- Agitar durante 15 minutos. 3- Calentar a 80 °C durante 5 minutos. 4- Tomar 1 ml. del sobrenadante y pasarlo a un tubo con caldo nutritivo. 5- Incubar 48 hs. a 37 °C. 6- Estriar en agar Mossel (selectivo y diferencial) 7- Incubar 48 hs. a 37 °C 8- Observar el crecimiento de colonias con un halo rosa y precipitado de lecitina (B. cereus, manitol -, lecitinasa +) y colonias con halo amarillo sin precipitado (B. subtilis, manitol +, lecitinasa -). Aislamiento de Lactobacillus sp 1- Realizar diluciones de yogur en solución fisiológica y sembrar 0,1 ml de cada dilución en agar MRS 2-Incubar 48 horas a 37 °C en anaerobiosis. 3- Calcular el recuento de bacterias lácticas del yogur y observar los distintos fenotipos de colonia crecidos en el agar MRS. 4- Seleccionar 2 fenotipos de colonias diferentes y a partir de ellas sembrar por estría con ansa en agar Rogosa. 5- Incubar en condiciones de anaerobiosis a 37 °C. Bibliografía Brock, T.D.; Smith, D.W. & Madigan, M.T. ¨Microbiologia¨ Prentice Hall Hispanoamericana S.A., Sexta Edición, 1993 25 T.P.N°6 PRUEBAS BIOQUIMICAS Se trata de un conjunto de reacciones basadas en el metabolismo de los microorganismos. Entre otros aspectos, se analiza la acción de la bacteria sobre los hidratos de carbono (qué fuente de carbono utiliza, en qué condiciones, cómo la utiliza, qué productos se obtienen), la liberación de exoenzimas, metabolitos y toxinas al medio de cultivo, la motilidad, etc. A partir del conocimiento del metabolismo, las pruebas bioquímicas nos permiten determinar el género y la especie de la bacteria en estudio. Esta identificación debe hacerse a partir de un cultivo puro y fresco (18-24 horas). Hay que tener en cuenta, además, que las características metabólicas de los microorganismos pueden variar en función de distintos factores de manera que para realizar una caracterización confiable es necesario realizar las pruebas en condiciones estandarizadas (en cuanto al inóculo, los reactivos, las condiciones de incubación y el tiempo de lectura) y utilizar más de una prueba en cada caso. La elección de las mismas se hará en base a la familia en estudio, lo cual se irá determinando en el curso del aislamiento. Las pruebas más comunmente utilizadas son: 1) Prueba de oxidasa Esta prueba sirve para la determinación de la presencia de la enzima citocromo oxidasa en preparaciones de microorganismos. Permite diferenciar enterobacterias, distintas especies de Streptococcus, Staphylococcus y Micrococcus (-) de algunas especies de Pseudomonas u Aeromonas (+). Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tiras de papel de filtro impregnadas en reactivo de Kovacs (1 naftol + dimetilparafenilendiamina). - ansa. Procedimiento: 1.- Levantar con el ansa una colonia del cultivo puro. 2.- Aplicar dicha colonia sobre la tira de papel de filtro embebida con el reactivo de Kovacs, asegurándose de extender bien el material. 3.- Esperar 5-10 segundos y observar la coloración. Interpretación de resultados: * Prueba positiva: la tira de papel de filtro embebida en reactivo de Kovacs vira al color azul por oxidación de dicho compuesto a azul de indofenol. * Prueba negativa: el color de la tira de papel de filtro embebida en reactivo de Kovacs no se modifica. 2) Prueba de catalasa Esta prueba sirve para comprobar la presencia de la enzima catalasa en preparaciones de microorganismos. Permite diferenciar: 26 A) géneros: Streptococcus (-) de Micrococcus (+) y/o Staphylococcus (+); Bacillus (+) de Clostridium (-) y Corynebacterium (+) de Erysipelothrix (-), siendo excepciones en este último caso, Corynebacterium pyogenes (-) y Corynebacterium haemolyticum (-). B) especies: Moraxella bovis (variable) y Moraxella kingii (-) de otras especies de Moraxella (+). Materiales: - Cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - ansa. - portaobjetos limpios. - agua estéril. - agua oxigenada fresca. Procedimiento: 1.- Colocar una gota de agua en un portaobjetos limpio. 2.- Colocar dos ansadas del cultivo a probar sobre la gota de agua y hacer una suspensión espesa (no dejar secar). 3.- Agregar 2 o 3 gotas de agua oxigenada fresca. 4.- Observar los resultados. Interpretación de resultados: * Prueba positiva: formación inmediata de burbujas bien visibles (desprendimiento de O2). * Prueba negativa: no hay formación de burbujas (no se forma O2). 3) Prueba de licuefacción de la gelatina Esta prueba sirve para determinar la capacidad de un microorganismo de producir enzimas de tipo proteolítico (gelatinasas) que licuan la gelatina. Permite diferenciar especies: Staphylococcus aureus (+) de Staphylococcus epidermidis (lento y +) y especies de Micrococcus (variables y lentas); Listeria monocytogenes (-) de Corynebacterium ulcerans (+), Corynebacterium haemolyticum (+) y Corynebacterium pyogenes (variable). También ayuda a identificar: Serratia liquefaciens (+), Serratia marcescens (+), Pseudomona aeruginosa (+, rápida) y especies de Flavobacterium (+). Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - ansa. - tubos de hemólisis con gelatina nutritiva. Procedimiento: 1.- Inocular por punción los tubos conteniendo gelatina nutritiva. Dejar un tubo sin inocular como control. 2.- Incubar a 37 oC durante 48 horas. 3.- Colocar en heladera 2 horas y luego observar licuación y crecimiento. Interpretación de resultados: * Prueba positiva: a) tubo inoculado: medio líquido. b) tubo control: medio se mantiene sólido. * Prueba negativa: a) tubo inoculado: el medio se mantiene sólido. Volver a incubar un tiempo adicional. b) Tubo control: el medio se mantiene sólido. 27 4) Prueba de reducción de nitratos Esta prueba permite determinar la capacidad de un organismo de reducir el nitrato en nitritos o en nitrógeno libre. Sirve para identificar miembros de la familia Enterobacteriaceae (por lo general +) y diferenciar: 1.- Haemophilus ducreyi (-) y Haemophilus vaginalis (-) de otras especies de Haemophilus (+). 2.- Branhanella catarrhalis (+) y Neisseria mucosa (+) de otras especies de Neisseria(-) Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos con caldo nitrato. - Reactivo A: solución de dimetilnaftilamina 0,6%. - Reactivo B: solución de ácido sulfanílico 0,8%. - polvo o limaduras de cinc. Procedimiento: 1.- Inocular tubos de caldo nitrato con el microorganismo que se desea estudiar. 2.- Incubar durante 18-24 horas a 37 oC. 3.- Determinar nitritos: Fase I: - Agregar directamente al cultivo en caldo nitrato, 1 ml de reactivo A y 1 ml de reactivo B. - Agitar bien. - Esperar 30 segundos y observar coloración. Si el resultado fuera positivo, la prueba se da por terminada. Si el resultado fuera negativo, continuar con la fase II. Fase II: - Agregar al tubo que ya contiene los reactivos A y B una pizca de polvo de cinc. - Agitar bien. - Esperar 30 segundos y observar coloración. Interpretación de los resultados: A) Fase I: * Prueba positiva: color rosado a rojo intenso porque el nitrato ha sido reducido a nitrito por el organismo. * Prueba negativa: no se observa cambio de color. B) Fase II (prueba de la reducción del cinc): * Prueba positiva: no se observa cambio de color, por ausencia de nitrato en el medio, lo cual indica que el organismo redujo el nitrato en nitrito y luego redujo nuevamente el nitrito. * Prueba negativa: color rosado a rojo intenso, por presencia de nitrato que no ha sido reducido por el organismo. El cinc redujo el nitrato en nitrito. 5) Prueba del agar hierro de Kligler Permite determinar la capacidad de un microorganismo de metabolizar un hidrato de carbono específico incorporado a un medio de crecimiento básico así como la de producir gas y ácido sulfhídrico. Se utiliza para identificar diferentes especies bacterianas pertenecientes a la familia Enterobacteriaceae. 28 Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos en pico de flauta con agar hierro de Kligler, pH=7,4. - ansa. Procedimineto: 1.- Inocular cada uno de los microorganismos aislados por punción y por estría en el mismo tubo de medio agar hierro de Kligler. 2.- Incubar a 37 oC durante 18-24 horas. 3.- Observar entre las 18 horas y las 24 horas de cultivo (ni antes ni después). Interpretación de resultados: La utilización de un hidrato de carbono implica la liberación al medio de productos ácidos capaces de ser detectados por un indicador de pH. Si el microorganismo es incapaz de utilizar el hidrato de carbono, consume las peptonas del medio liberando productos que alcalinizan el medio. Cuando se interpretan los resultados de esta prueba deben analizarse los siguientes aspectos: A) Utilización del hidrato de carbono: * Si el microrganismo en estudio sólo fermenta la glucosa: a) en superficie: reacción alcalina, color rojo. b) en profundidad: reacción ácida, color amarillo. * Si el microorganismo en estudio es capaz de fermentar tanto la glucosa como la lactosa: a) en superficie: reacción ácida, color amarillo. b) en profundidad: reacción ácida, color amarillo. * Si el microorganismo en estudio no es capaz de fermentar la glucosa ni la lactosa (no entérico): a) en superficie: reacción alcalina, color rojo. b) en profundidad: si el microorganismo es aerobio no se observa crecimiento ni cambio de color; si el microorganismo es facultativo, reacción alcalina, color rojo. * Si el microorganismo en estudio no es capaz de fermentar la glucosa pero si de oxidarla: a) en superficie: reacción ácida a tiempos cortos y luego alcalina, color rojo. b) en profundidad: no se observa crecimiento ni cambio de color. B) Producción de gas: * Si el microorganismo en estudio es aerogénico, la producción de H2 y CO2 se manifiesta mediante la formación de una o varias burbujas o el desprendimiento del medio del fondo del tubo dejando un área clara. * Si el microorganismo en estudio es anaerogénico, no hay producción de gases. C) Producción de ácido sulfhídrico (SH2): * Si el microorganismo en estudio produce este ácido, se manifestará por la presencia de un precipitado negro de sulfuro de hierro en la parte profunda del tubo. * Si el microorganismo en estudio no produce este ácido, se manifestará por la ausencia de dicho precipitado. 6) Prueba de extracción de pigmento con cloroformo Esta prueba bioquímica permite investigar los pigmentos producido por cepas de Pseudomonas. Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos con caldo nutritivo. - ansa. - cloroformo 29 Procedimiento: 1.- Sembrar el microorganismo en estudio en caldo nutritivo. 2.- Incubar a 37 oC. 3.- Agregar 1 ml de cloroformo al contenido del tubo y agitar. 4.- Observar los resultados. Interpretación de resultados: * Prueba positiva: la fase clorofórmica toma color azul verdoso por extracción de piocianina. * Prueba negativa: la fase clorofórmica permanece amarilla (no se extrajo pigmento). 7) Prueba de hidrólisis de almidón Permite investigar la presencia en el microorganismo en estudio de una enzima capaz de hidrolizar el almidón. Esta enzima es muy común en distintos miembros del género Bacillus. Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - placas de Petri con agar almidón. - ansa. - lugol. Procedimiento: 1.- Sembrar el microorganismo en estudio por estría en una placa con agar almidón. 2.- Incubar a 37 oC hasta observar desarrollo. 3.- Inundar la placa con lugol. 4.- Dejar actuar 10 minutos. 5.- Observar la coloración. Interpretación de resultados: * Prueba positiva: halos de degradación (marrones o transparentes) alrededor de las colonias sobre fondo azul. * Prueba negativa: ausencia de halos; coloración azul alrededor de las colonias (presencia de complejo Iodo-almidón). 8) IMViC Son cuatro pruebas que se utilizan para distinguir bacterias coliformes entre si. Las pruebas son: Indol, Rojo de Metilo, Voges Proskauer y Citrato. Investigación de la producción de Indol. Con esta prueba bioquímica se mide la capacidad del microorganismo de producir indol a partir de la molécula de triptofano. Sirve para diferenciar Escherichia coli y distintas especies del género Edwarsiella (+) de especies de los géneros Salmonella, Klebsiella y Enterobacter (-). Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos con caldo triptona. - ansa. 30 - reactivo de Kovacs: alcohol amílico + paradimetilbenzal- dehído en medio ácido. Procedimiento: 1.- Inocular tubos conteniendo caldo triptona. Dejar un tubo sin inocular como control. 2.- Incubar a 37 oC durante 48 horas. 3.- Determinar la presencia de indol utilizando el reactivo de Kovacs. Para ello, colocar en un tubo de ensayo 1 ml de medio, agregar 0,1 ml de reactivo y dejar reposar hasta la formación de un anillo. 6.- Observar coloración. Interpretación de los resultados * Prueba positiva: un anillo rojo en la superficie del medio en la capa alcohólica (corresponde a la formación de un compuesto quinónico coloreado derivado del indol). * Prueba negativa: anillo amarillo en la superficie del medio en la capa alcohólica (ausencia de indol en medio de cultivo). Investigación de la producción de acetil metil carbinol (Voges Proskahuer) y ácidos (rojo de metilo). Con estas dos pruebas se estudia qué tipo de fermentación (butilenglicólica o ácido mixta) realiza el microorganismo en estudio. La prueba de Voges-Proskauer sirve para comprobar la capacidad de algunos organismos de producir un producto final neutro, el acetilmetilcarbinol (acetoína) a partir de la fermentación (butilenglicólica) de la glucosa. Esta prueba permite diferenciar Klebsiella pneumoniae y Enterobacter (+) de Escherichia coli y otras especies de Klebsiella (-). La prueba del rojo de metilo sirve para comprobar la capacidad de un organismo de producir y mantener estables los productos terminales ácidos de la fermentación (ácido mixta) de la glucosa. Esta prueba permite diferenciar Escherichia coli (+) de distintas especies pertenecientes a los géneros Enterobacter y Klebsiella (-). Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos con caldo glucosa fosfato. - ansa. - reactivos para la determinación de acetil-metil-carbinol (solución alcohólica de naftol al 5% y KOH al 40%). - reactivos para la determinación de ácido (solución de rojo de metilo 0,1%). Procedimiento: 1.- Inocular tubos conteniendo caldo glucosa fosfato. Dejar un tubo sin inocular como control. 2.- Incubar a 37oC durante 48 horas. 3.- Dividir el contenido de cada uno de los tubos en dos partes iguales. En una mitad, investigar la presencia de acetil-metil-carbinol y en la otra la presencia de ácidos. - Para determinar acetil-metil-Carbinol: a) Agregar 0.6 ml de solución alcohólica de naftol al 5%. b) Agregar 0,2 ml de solución de KOH al 40%. c) Agitar y dejar en reposo 5-10 minutos. d) Observar la coloración resultado. - Para determinar ácidos: a) Agregar al cultivo 10 gotas de solución de rojo de metilo 0,1%. b) Observar la coloración. 31 Interpretación de resultados: Voges-Proskauer * Prueba positiva: color rojo rosado en la superficie del medio (presencia de acetoína). * Prueba negativa: sin cambio de color (color amarillo) en la superficie del medio. Rojo de Metilo * Prueba positiva: el cultivo es lo suficientemente ácido como para permitir que el reactivo rojo de metilo mantenga un color rojo definido (pH= 4,4) en la superficie del medio. * Prueba negativa: color amarillo (pH= 6) en la superficie del medio. Investigación del aprovechamiento de citrato Se usa para determinar la capacidad del microorganismo para utilizar citrato como única fuente de carbono. Permite diferenciar especies de Salmonella, Klebsiella y Enterobacter (+) de Escherichia coli y especies de Edwarsiella, Yersinia, Actinobacillus (-). Materiales: - cultivos puros de bacterias crecidos 18-24 horas en agar nutritivo. - tubos con caldo citrato de Koser. - ansa. Procedimiento: 1.- Inocular tubos conteniendo caldo citrato de Koser. Dejar un tubo sin inocular como control. 2.- Incubar a 37oC durante 48 horas. 3.- Observar la presencia o ausencia de crecimiento. Interpretación del resultado: * Prueba positiva: hay crecimiento (turbidez). * Prueba negativa: ausencia de crecimiento. Bibliografía Mac Faddin, J. F., Pruebas Bioquímicas para la identificación de bacterias. Editorial Médica Panamericana, Buenos Aires, Argentina, 1980. 32 SISTEMAS MULTIPRUEBAS PARA LA IDENTIFICACIÓN DE MICROORGANISMOS 1) SISTEMA API 20E PARA ENTEROBACTERIAS Descripción general: Es un sistema miniaturizado de las pruebas convencionales que se emplean para la identificación de enterobacterias y otras bacterias Gram negativas. Se trata de microtubos con sustratos deshidratados a los que se les agrega una suspensión bacteriana y se incuban durante 18 a 24 hs. a 37 ºC. En cada microtubo se halla incorporado un sistema indicador. Al cabo del tiempo de incubación ese sistema es afectado por metabolitos de la bacteria o por reactivos agregados. Se registran los resultados obtenidos en cada microtubo y en base a ellos se identifica la bacteria en cuestión. Instrucciones para el uso del sistema: a)- Agregar 5 ml. de agua en la base de la caja antes de sacar la tira. Esto sirve para mantener una atmósfera húmeda durante la incubación. b)- Picar con el ansa una colonia y resuspender en un tubo con solución fisiológica estéril. Agitar con vortex. c)- Ubicar la tira en la bandeja con agua. d)- Sembrar muy suavemente la suspensión bacteriana con pipeta Pasteur. Para ello se debe tener en cuenta lo siguiente: cada microtubo está compuesto por un tubo y una cúpula y la cantidad de inóculo a agregar a cada uno depende del tipo de prueba. Para el llenado se inclina la bandeja y se apoya la punta de la pipeta contra un costado de la cúpula. Cada uno de los 20 microtubos se llenan hasta el volumen del tubo. Los microtubos correspondientes a las pruebas CIT, VP y GEL se llenan completamente (tubo + cúpula). Aquellos correspondientes a las pruebas cuyos nombres están subrayados se llenan hasta el volumen del tubo y luego se completa el volumen de la cúpula con aceite mineral. e)- Incubar entre 18 y 24 hs. a 37 ºC. f)- Luego de la incubación, se anotan los resultados obtenidos en todas las pruebas que no requieran el agregado de reactivos. Si el microtubo de glucosa es negativo (azul o verde), se debe contar el total de ensayos positivos. Pueden entonces presentarse las siguientes alternativas: 1)- Si dicho número es menor o igual a 2, se reincuba 18-24 hs. a 37 ºC. 2)- Si el número es mayor que 2 se agregan los reactivos a las pruebas que correspondan, se realiza la prueba de oxidasa (ver más adelante) y se anotan todos los resultados obtenidos. Si el ensayo de glucosa es positivo (amarillo) al cabo de las primeras 18-24 hs. de incubación, se procede de la misma forma que en el caso de la alternativa 2) del párrafo anterior. g)- Identificación de la bacteria por comparación de los resultados obtenidos con una tabla. Características de las pruebas e interpretación de resultados. ONPG: determina la actividad de la enzima β-galactosidasa. β-galactosidasa ONPG---------------------------------------------ortonitrofenol (Orto-nitrofenil(amarillo) β-D-galactopiranósido) Reacción positiva: amarillo. Reacción negativa: incoloro. 33 ADH: determina actividad de la enzima arginina dehidrolasa. ADH arginina---------------------------ornitina + NH4 + CO2 El amonio produce un cambio en el pH y un viraje del indicador del amarillo al rojo. Reacción positiva: rojo. Reacción negativa: amarillo. LDC: determina actividad de la enzima lisina decarboxilasa. LDC lisina------------------------------cadaverina (amina) La amina produce un cambio de pH y un viraje del indicador del amarillo al rojo. Reacción positiva: rojo. Reacción negativa: amarillo. ODC: determina actividad de la enzima ornitina decarboxilasa. ODC ornitina---------------------------putrescina (amina) La amina produce un cambio de pH y un viraje del indicador del amarillo al rojo. Reacción positiva: rojo. Reacción negativa: amarillo. CIT: determina la capacidad de la bacteria de usar el citrato como única fuente de carbono. El consumo del citrato produce un aumento de pH y un viraje del indicador de verde a azul. Reacción positiva: azul. Reacción negativa: verde. H2S: determina la capacidad de la bacteria de reducir el tiosulfato a H2S para reducir la tensión de oxígeno. El H2S se combina con sales de hierro y forma un precipitado negro. Reacción positiva: precipitado negro. Reacción negativa: ausencia de precipitado. URE: determina la actividad de la enzima ureasa. ureasa urea---------------------------NH4 El amonio produce un cambio de pH y un viraje del indicador de amarillo a rojo si se observa entre las 18 hs. y las 24 hs., o de naranja a rojo si se observa entre las 36 y 48 hs. 34 Reacción positiva: rojo o naranja. Reacción negativa: amarillo. TDA: determina la actividad de la enzima triptofano deaminasa. TDA triptofano-----------------------indolpirúvico + NH4 Al final de la incubación se agrega una gota de cloruro férrico al 10%. El ácido indolpirúvico produce un color rojo-amarronado en presencia del mismo. Reacción positiva: rojo-amarronado. Reacción negativa: amarillo. IND: determina la capacidad de la bacteria de metabolizar el triptofano. triptofanasa triptofano------------------------indol Al final de la incubación se agrega una gota del reactivo de Kovacs. La reacción debe ser leída dentro de los dos minutos de agregado el mismo. El indol se combina con el p-dimetilamino benzaldehído presente en el reactivo y se forma una quinona de color rojo violáceo. Reacción positiva: color rojo. Reacción negativa: amarillo. VP: Determina la presencia de acetoína como intermediario en el metabolismo de la glucosa. Al final de la incubación se agrega una gota de KOH al 40% y luego una gota de alfa-naftol. Se esperan 10 minutos antes de observar el resultado. Reacción positiva: rojo Reacción negativa: incoloro Reducción de nitratos: Determina la capacidad del microorganismo de reducir el nitrato a nitrito o a nitrógeno libre. La prueba se lleva a cabo en el mismo microtubo que la de glucosa. Además de anotar el resultado de dicha prueba, se observa si hay burbujas, lo cual indica que se redujeron los nitratos a nitrógeno gaseoso. Se agregan dos gotas de ácido sulfanílico al 0.8% y dos gotas de N,N- dimetil-α naftilamina. Se espran de 2-3 minutos. Si hay nitritos en el medio, los mismos forman un complejo de color rojo con los reactivos. Los resultados negativos se confirman agregando zinc al microtubo. Los nitratos son reducidos por el zinc dando un color rosa anaranjado. Si no hay un cambio de color, es porque los nitratos fueron reducidos primeramente a nitritos y posteriormente a N2 o a alguna amina aerogénica. 35 GEL: Determina la activiada de la enzima gelatinasa. La licuefacción de la gelatina por esta enzima libera un pigmento negro que difunde al medio. Reacción positiva: difusión del pigmento negro Reacción negativa: no hay difusión. GLU, MAN, INO, SOR, RHA, SAC, MEL, AMY, ARA: Determinan la capacidad de un organismo anaeróbico de fermentar el carbohidrato o la de un organismo aeróbico de oxidarlo. GLU: glucosa, MAN: manitol, INO: inositol, SOR: sorbitol, RHA: ramnosa, SAC: sacarosa, MEL: melibiosa, AMY: amigdalina, ARA: arabinosa. Como consecuencia de la utilización del carbohidrato, se forman productos ácidos. El descenso de pH produce un viraje del indicador de azul a amarillo. MAN; INO; SOR: determina la actividad de la enzima catalasa. 2 H2O2 2 H2O + O2 (gas) La reacción se lleva a cabo en los mismos microtubos utilizados para MAN; INO y SOR. Después de leer los resultados de dichas reacciones, se agrega una gota de H2O2 al 1.5% a cada tubo. Se espera de 1-2 minutos y se observa si hay formación de burbujas. Reacción positiva: formación de burbujas Reacción negativa: no se forman burbujas Prueba de oxidasa: Se embebe un papel de filtro con una suspensión bacteriana similar a la utilizada para inocular los microtubos. Se agrega una gota de clorhidrato de tetrametil-pfenildiamina al 1%. Si la reacción es positiva, el área del papel que contiene la suspensión de bacterias toma un color púrpura dentro de los 30 segundos. Si la reacción es negativa no se registra ningún cambio de color. 36 T.P.N°7 RASTREO DE CEPAS PRODUCTORAS DE DE ENZIMAS INTERÉS BIOTECNOLÓGICO Objetivos: Determinar la capacidad de los microorganismos aislados en el TP anterior de producir enzimas de interés industrial utilizando ensayos en placa y verificar actividad a distintas temperaturas de incubación. Introducción: En el siguiente trabajo práctico se estudiará la capacidad de los microorganismos aislados de diversas fuentes de producir enzimas que se utilizan en la industria en general. Principalmente se seleccionarán aquellos que tengan una mayor actividad con respecto a los controles empleados y a distintas temperaturas de incubación. Además cuando sea posible se utilizará dicha característica para la identificación de los mismos. Las enzimas se producen comercialmente desde fines del siglo pasado y a partir de la década del 60 comienza la producción masiva con microorganismos. Los microorganismos ofrecen grandes ventajas como sistemas de producción de enzimas, dada su alta velocidad de síntesis, alto rendimiento de conversión de sustrato en proteína enzimática, gran versatilidad y mayor simplicidad en la manipulación ambiental y genética de su capacidad productiva. Las enzimas de uso industrial, son mayoritariamente hidrolasas extracelulares de estructura simple, estables y sin requerimientos de cofactores disociables para su actividad. Estas enzimas son producidas por las bacterias como respuestas adaptativas de fase estacionaria que le sirven para la provisión de nutrientes en condiciones de hambreado extremo como lo es la situación en su hábitat natural. Mientras que para las bacterias Gram positivas la exportación al extracelular esta facilitada por carecer de membrana externa, las Gram negativas presentan complejos sistemas de secreción para atravesar la capa externa de LPS. Además existen diferentes niveles de control genético de la expresión de estas actividades, que han sido ampliamente estudiados. Uno de los problemas de las enzimas es su inestabilidad, siendo particularmente sensibles a la temperatura; de manera que la vida media puede llegar a ser muy corta o su actividad baja en temperaturas ambiente. En la siguiente tabla se muestra las enzimas de producción microbiana que serán rastreadas y su campo de aplicación industrial: Nombre de la enzima y reacción catalizada Origen microbiano Campo de aplicación industrial α-Amilasa Hidrólisis de almidón Bacillus, Aspergillus, otros hongos Obtención de jarabe de glucosa; eliminación del apresto del almidón Proteasa Hidrólisis de proteínas Bacillus y otras bacterias, también hongos Pseudomonas y Hongos Aditivos de productos de lavado; curtidos Lipasa Hidrólisis de lípidos Curtidos, aditivos de productos de lavado Metodología: Para todas las actividades que se evaluaran se empleara el sistema de detección en placa de halos de degradación. Esto se realiza en forma directa por inspección de la placa o por revelado especifico que produce diferencias en la coloración en las zonas degradadas respecto del fondo no hidrolizado. En todos los casos se comparara la actividad con respecto a los controles empleados. Estas comparaciones requieren que exista un desarrollo microbiano similar para evaluar cuantitativamente los resultados a distintas temperaturas de incubación. 37 1) Producción de amilasas. El almidón es un polisacárido de reserva complejo. Almidón es un polímero de glucosa en enlace glucosidico lineal (amilasa) α-1,4 o ramificado (amilopectina) α-1,6. Un test cualitativo para determinar su presencia es la aparición de un color azul luego de la adición de una solución de ioduro de potasio/ I2. Luego de la hidrólisis del almidón, los productos de clivaje (dextrinas, maltosa y glucosa) no dan este color. Este principio será utilizado para testear la hidrólisis del almidón en este trabajo. La capacidad de un microorganismo de hidrolizar el almidón esta asociada a la enzima alfa-amilasa extracelular. Esta sirve como criterio de identificación de aislamientos desconocidos. 1. Sembrar el microorganismo en estudio por estría en una placas de Agar Almidón. Inocular dos placas con microorganismos control, Escherichia coli y Bacillus subtillis. 2. Incubar a 22, 30 y 42 oC durante 48 hs o hasta observar desarrollo. 3. Testear la hidrólisis del almidón por acción del microorganismo cubriendo la superficie de la placa con una solución de ioduro de potasio/ I2 (lugol) 4. Dejar actuar 10 minutos. 5. Observar la coloración: halos de degradación (marrones o transparentes) alrededor de las colonias sobre fondo azul. Comparar con los controles ensayados y en cada temperatura. 2) Producción de proteasas Muchas bacterias pueden degradar diversas proteínas y utilizar los péptidos y aminoácidos resultantes como fuente de energía y para sintetizar sus propias proteínas. Un ejemplo es la hidrólisis de la caseína. La caseína existe en la leche como una suspensión coloidal que da a la leche su aspecto opaco. Muchas bacterias producen enzimas que hidrolizan esta proteína dando derivados solubles y transparentes. La ruptura de proteínas a veces llamada peptonización, es útil en la identificación de especies microbianas. 1. Sembrar el microorganismo en estudio por estría en una placa de Agar Leche Inocular dos placas control con Escherichia coli y Bacillus subtillis. 2. Incubar a 22, 30 y 42 oC durante 48 hs o hasta observar desarrollo. 3. Colocar las placas sobre una superficie negra y analizar la presencia o ausencia de zonas claras (halos de degradación) alrededor del área de crecimiento de los microorganismos testeados. Comparar con los controles ensayados y en cada temperatura. 38 3) Producción de lipasas Las lipasas tienen la capacidad de hidrolizar fosfolípidos, como los presentes en las lecitinas de la yema del huevo. El clivaje de las uniones fosfoester por acción de la Fosfolipasa C forma un diglicérido insoluble en agua. Esta actividad enzimática puede ser detectada por una zona de opalescencia en el medio alrededor de la masa celular. Otra posible acción enzimática es la de la Fosfolipasa A, dando un producto soluble en agua (lisolecitina), que en cambio se observa como una zona transparente alrededor de la masa celular. Los fosfolípidos son componentes mayoritarios y funcionales de las membranas celulares. La capacidad de hidrólisis de fosfolípidos de células huéspedes es un factor importante de virulencia de las bacterias que la poseen y por lo tanto su determinación es una herramienta utilizada para caracterizar e identificar miembros de los géneros Pseudomonas, Staphylococcus, Bacillus y Clostridium. 1. Sembrar el microorganismo en estudio por estría en una placa de Agar Yema de huevo. Inocular placas control con Bacillus cereus, Steptomyces sp, Pseudomonas aeruginosa y Escherichia coli. 2. Incubar a 22, 30 y 42 oC durante 48 hs. o hasta observar desarrollo. 3. Observar la presencia o ausencia de halos de precipitado insoluble o traslúcido alrededor del área de crecimiento de los microorganismos testeados. 39 T.P.N°8 ANÁLISIS MICROBIOLÓGICO DE AGUAS INTRODUCCIÓN Uno de los principales requisitos para que el agua sea apta para consumo es que esté libre de bacterias patógenas para el hombre. Generalmente, los análisis de rutina no están dirigidos a la búsqueda directa de microorganismos causantes de enfermedades que se transmiten a través del agua (ej: fiebre tifoidea, cólera, etc.). Por lo general se busca detectar la presencia de microorganismos característicos del intestino de mamíferos. La presencia de éstos indicaría contaminación fecal en las fuentes de agua utilizadas. Asimismo se utiliza como indicador de contaminación el recuento de bacterias totales. OBJETIVO - Determinación de la presencia de bacterias coliformes en agua para establecer si es apta para consumo humano. Para ésto, se determinarán las bacterias coliformes totales, y entre éstas se discriminarán las que son de procedencia fecal de las que no lo son. MATERIALES Y MÉTODOS - Caldo Brila Fluorocult (Merck) (ver al final) de simple y doble concentración - Caldo Citrato de Koser - Tubos de ensayo con campanitas de Durham - Baños o estufas a 37 °C . - Luz U.V. Fundamentos del método En un primer ensayo se busca detectar la presencia de bacterias coliformes totales, basándose en la capacidad de dichos organismos de fermentar lactosa con la producción de ácido y gas. Se considera indicador positivo la producción de gas, dado que otros microorganismos (no coliformes) son capaces de producir acidez y no gas. Un segundo paso consiste en la diferenciación entre las bacterias coliformes de origen fecal y no fecal. El primer grupo está representado por E. coli fecal cuyo hábitat es el intestino humano y el de otros animales. El segundo grupo, antiguamente llamado IAC, está representado por bacterias cuyo origen es el suelo y la vegetación (Escherichia sp., Enterobacter, Citrobacter y Klebsiella). Finalmente, la cuantificación se hace por el método del número más probable, que es un método estadístico basado en la teoría de las probabilidades de Poisson. Para ello se tiene en cuenta el número de porciones de la muestra que se siembra en el medio original de crecimiento y el número de dichas porciones que contienen coliformes. El volumen de las porciones a sembrar y el número de diluciones consecutivas a realizar, depende del conocimiento que se tenga del grado de contaminación del agua. De cualquier forma, los volúmenes deberán ser tales que: 1) Todos o la mayoría de los tubos de la mayor dilución hayan dado negativos a la producción de gas en el Caldo Brila a 37 °C. 2) Todos o la mayoría de los tubos de la menor dilución hayan dado positivos a dicho ensayo Para que el agua de una fuente dada pueda ser considerada potable desde el punto de vista microbiológico, las bacterias presentes en la muestra no deben superar los siguientes valores: Coliformes totales: < 2.2 coliformes/100 ml Coliformes fecales: 0 coliformes/100 ml 40 Práctica: A) Determinación de coliformes totales: 1) Se siembran por triplicado en tubos de fermentación que contienen 10 ml de Caldo Brila , 10, 1 y 0.1 ml de la muestra de agua. Las siembras que se hagan con un volumen de 10 ml, se harán en un volumen igual de caldo de cultivo de doble concentración. Las siembras que se hagan con un volumen igual o menor a 1 ml, se harán directamente en 5 ml de caldo de cultivo de simple concentración. 2) Se incuban los tubos sembrados a 37 °C durante 48 hrs. 3) Se observan los tubos a las 48 horas. Se considera resultado positivo la producción de gas (debido a la fermentación de la lactosa) que ocupe más de 1/3 del volumen de la campanita de Durham. 4) Se anota la cantidad de tubos positivos de cada dilución. Se selecciona mediante un criterio adecuado la combinación de tubos con la que se continuará el análisis. B) Diferenciación de las bacterias coliformes de origen no fecal y fecal: Coliformes de origen no fecal: A partir de los tubos que dieron positivo (producción de gas) se siembran, con ansa recta, tubos conteniendo caldo Citrato de Koser y se los incuba a 37 °C por 48 horas. Solo los coliformes no fecales pueden crecer utilizando el Citrato como única fuente de carbono a esa temperatura. Un resultado positivo en estos tubos se evidencia por la aparición de turbidez. Coliformes de origen fecal: En los tubos positivos, la detección de la presencia de E. coli se efectúa mediante fluorescencia al iluminar con luz U.V.. Para confirmar el ensayo se utilizan como indicadores la formación de gas y la prueba del indol utilizando el reactivo de Kovacs. Un resultado positivo ( presencia de gas, viraje del reactivo de Kovacs al rojo y fluorescencia a la luz U.V.)), estaría indicando la presencia de E. coli. Se observan y anotan los tubos positivos de cada dilución. Cálculos e Informe: Con todos los resultados obtenidos, se buscan los datos en las tablas de números más probables y se confecciona un informe Mediante un simple cálculo de proporcionalidad, se puede obtener a partir de los datos de la tabla las concentraciones de las coliformes fecales y no fecales: Coliformes fecales = X. a/(a+b) Coliformes no fecales = X. b/(a+b) Siendo: X: Número más probable de coliformes según las tablas de probabilidad. a: Número más probable de coliformes fecales b: Número más probable de coliformes no fecales X, a y b están referidos a un volumen de 100ml, por lo tanto los resultados se informarán como el Número más probable de bacterias por 100ml de agua. Medio de cultivo para la demostración rápida de E. coli mediante fluorescencia. Fundamento Al margen de ciertas especies de Salmonella y Shigella, la bacteria Escherichia coli, es la única especie perteneciente al grupo de las Enterobacterias que posee la enzima β-D-glucuronidasa. Esta enzima es capaz de escindir el sustrato 4-metilumbeliferil-β-D-glucurónido (MUG), formando 4metilumbeliferona. Esta sustancia se caracteriza por ser fluorescente al iluminarse con luz U.V., lo 41 que permite su detección fácilmente. Este hecho es, al mismo tiempo, un indicador de la presencia de E. coli. Caldo Brila Fluorocult Composición (g/litro) Peptona ......................................................10,0 Lactosa........................................................10,0 Verde Brillante.............................................0,0133 L-Triptofano................................................1,0 Bilis de buey desecada..................................20,0 MUG............................................................0,1 Bibliografía: 1) Brock. T.D., Smith D.W. & Madigan M.T. " Microbiología" 4ta. edición . pp 637-647. 1984 2) Seeley H.W., Vandemark P.J & Lee J.J. " Microbes in action (A laboratory manual of microbiology)" 4th. edition chapter 12. 1991 3) Ferramola R." Examen bacteriológico de aguas". Editorial el Ateneo. 1947. 42 T.P. Nº 9 FORMACIÓN DE BIOFILMS BACTERIANOS INTRODUCCIÓN En los últimos años se ha demostrado que muchas bacterias en ambientes naturales, clínicos e industriales no se encuentran como células planctónicas estudiadas típicamente el laboratorio, sino que se unen a superficies formando estructuras denominadas biofilms. Los biofilms se definen como poblaciones o comunidades microbianas unidas a una superficie que puede ser biótica o abiótica. La formación de los mismos depende de muchos factores de la superficie y ambientales tales como las características de sustrato, el inóculo y la disponibilidad de nutrientes. Los microorganismos que habitan estas estructuras poseen una alta resistencia a diversos factores, incluyendo los bactericidas, por lo que algunos problemas derivados de los biofilms, en muchos casos, son difíciles de solucionar. Entre las ventajas que representa este modo de vida para los microorganismos se encuentran la mayor disponibilidad de nutrientes cerca del soporte o superficie, la capacidad de promover el intercambio genético y, en el caso de los patógenos, el incremento de la protección frente a las defensas del hospedador. Además de las ventajas mencionadas, este modo de vida constituye una defensa frente a la predación en ambientes naturales y en el caso de suelos también frente a la desecación. El conocimiento de las características de los biofilms resulta de utilidad en estudios aplicados de biorremediación y en algunos procesos como la biocatálisis. Por otra parte, los microorganismos formadores de biofilms provocan problemas en redes de distribución de agua y otras cañerías como las del transporte de petróleo o combustibles, tienen importancia en fenómenos de biocorrosión y desde el punto de vista clínico son frecuentemente responsables de las inflamaciones asociadas a los catéteres, etc. OBJETIVO Analizar la capacidad de formación de biofilms en Pseudomonas putida y Escherichia coli. Existe una gran variedad de sistemas disponibles para evaluar la formación de biofilms bacterianos. Como un primer paso para estudiar la capacidad de formación de los mismos se utilizarán microplacas de 96 pocillos fondo en U estériles para evaluar la unión de las bacterias a una superficie abiótica. Está técnica se emplea para analizar biofilms estáticos. PROCEDIMIENTO Inocular 3-5 ml de caldo de cultivo con las bacterias de interés e incubar hasta fase estacionaria. Medir la densidad óptica (DO). Diluir los cultivos en caldo nutritivo fresco hasta DO600nm=0,025 e inocular 5 pocillos con 150 µl de cada cultivo. Llenar 5 pocillos con el medio de cultivo utilizado. Tapar la microplaca. Incubar durante 24-48 h a 30°C. Observar el crecimiento en los pocillos sembrados y ausencia en los controles. Retirar con pipeta cuidadosamente (sin tocar las paredes ni el fondo) el medio de cultivo para eliminar las células planctónicas. Lavar los pocillos con agua. Teñir con 150 µl de cristal violeta (0,1%), dejar en contacto con el colorante 20 min. Retirar el colorante que no se haya unido a las células y observar el patrón de unión. Lavar el exceso de colorante con agua. 43 Solubilizar el colorante con 200 µl de etanol (95%) a temperatura ambiente durante 10-15 min. Transvasar el contenido de los pocillos a una placa de 96 pocillos fondo plano y cuantificar midiendo la DO a 500-600 nm utilizando un lector de ELISA. Con esta metodología se comparará la capacidad de formación de biofilms en Pseudomonas putida y Escherichia coli. BIBLIOGRAFÍA O`Toole, G.A. and R. Kolter. (1998). Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signaling pathways: a genetic analysis. Molecular microbiology, 28:449-461. Palmer J, Flint, S and J. Brooks, (2007) Bacterial cell attachment, the beginning of a biofilm. J Ind Microbiol Biotechnol (2007) 34:577–588 44 T.P. Nº 10 Parte A: PREPARACIÓN DE STOCKS Y TITULACIÓN DE BACTERIÓFAGOS OBJETIVOS - Preparación y determinación del título de stocks de bacteriófagos a través de la formación de placas de lisis. Microorganismos a utilizar: - Bacteriófagos T4 - Escherichia coli Desarrollo experimental: Preparación de stocks de los bacteriófagos T4 - Inocular dos cultivos en fase exponencial de Escherichia coli ccda uno con una suspensión del bacteriófago T4 a una multiplicidad de infección de 0,1. - Incubar a 37 °C con agitación durante dos a cuatro horas. - Centrífugar a 10.000 rpm durante aproximadamente 15 minutos a 4 °C, para eliminar en el pellet los restos celulares y cosechar el sobrenadante en otro tubo. - Filtrar el sobrenadante por una membrana de nitrocelulosa de 0,45 µ de tamaño de poro. - Controlar la ausencia total de bacterias en los stocks mediante plaqueo de una alícuota en agar LB. Titulación de los stocks 1- Se preparan 12 placas de Petri conteniendo agar LB. Se dejan solidificar y se secan en estufa. 2- Se preparan diluciones seriadas decimales de los stocks de T4 y M13 en caldo LB(10-1 a 10-6). 3- Se dispone de tubos de hemólisis conteniendo 3 ml de agar LB blando (0,7% de agar), los cuales son mantenidos en un baño termostatizado a una temperatura de 45-50 ºC, sin dejar que solidifiquen. 4- Se inoculan 6 tubos conteniendo agar blando con 0,1 ml de un cultivo de Escherichia coli en crecimiento exponencial, que se corresponda con el tubo 1 de la escala de Mc Farland. Seguidamente, cada tubo se inocula con 0,1 ml de las diluciones 10-4, 10-5 y 10-6 de los fagos T4 y M13, se agita vigorosamente y la mezcla correspondiente a cada dilución se vierte (por duplicado) sobre una placa conteniendo agar LB, la cual se mueve en forma circular para esparcir completamente el agar blando. 5- Las placas se incuban durante 48 hs. a 37 ºC. 6- Al cabo de dicho lapso, se observan las placas de lisis correspondientes a los bacteriofagos T4 y a M13. Se eligen aquellas placas en las cuales se puedan contar alrededor de 100 placas de lisis y se calcula el título de cada stock como: Título viral = promedio del número de placas de lisis (UFP/ml) volumen de inóculo x dilución Bibliografía Adams, M. H. Bacteriophages. Editorial Interscience N Y, 1959 45 T.P. N° 11 ANTIBIÓTICOS A) PRODUCCION DE ANTIBIOTICOS A PARTIR DE Streptomyces sp. AISLADOS DE UNA MUESTRA DE SUELO INTRODUCCIÓN La búsqueda de microorganismos productores de nuevos antibióticos utilizados en diversos ámbitos (agricultura, veterinaria y la industria farmacéutica) ha sido y continúa siendo intensa debido, principalmente, al fenómeno de resistencia a los antibióticos. Una gran cantidad de bacterias pertenecientes al Phylum Actinobacteria (actinomycetes) tienen la capacidad de sintetizar diferentes metabolitos secundarios biológicamente activos: antibióticos, herbicidas, pesticidas, antiparasitarios y enzimas que son utilizadas para el tratamiento de desechos. En particular, los antibióticos resultan de gran importancia terapéutica y comercial. Los actinomycetes constituyen un grupo ampliamente distribuido en la naturaleza. Semejantes a los hongos en su estructura filamentosa ramificada, estas bacterias son Gram positivas, aeróbicas, mesófilas, morfológicamente irregulares. Alrededor del 80% de los aislamientos del suelo pertenecen al Género Streptomyces; se encuentran en concentraciones viables de 106-107 por gramo de tierra. Diversas especies de Streptomyces producen geosminas responsables del olor característico de la tierra fértil. Su aislamiento es relativamente sencillo pues son nutricionalmente muy versátiles: utilizan almidón, asparragina o malato cálcico como fuente de carbono y caseína no digerida o nitrato potásico como fuente de nitrógeno. Producen esporas, denominadas conidios, por tabicación. Se han obtenido más de 50 antibióticos diferentes a partir de especies de Streptomyces, incluyendo la estreptomicina, la neomicina, el cloranfenicol y las tetraciclinas. Objetivo: Obtener colonias de Streptomyces sp. productoras de antibióticos a partir de muestras de suelo. Desarrollo experimental 1) Preparar 3 placas de Petri con AS. Dejar solidificar y secar bien en estufa a 37 ºC. 2) Mezclar 1 gr. de tierra en 100 ml de agua destilada en un frasco estéril (un frasco por cada 4 alumnos). Agitar vigorosamente durante 5 min.. Tomar 0,2 ml de dicha suspensión y diluirla en 1,8 ml de solución fisiológica estéril en un tubo de hemólisis. Homogeneizar en agitador de tubos. Repetir la dilución 3) Sembrar 0,2 ml con rastrillo de cada dilución en placas de Petri con un inóculo proveniente de la suspensión original y con otros dos inóculos proveniente de la suspensión diluida. 4) Sembrar placas con S. aureofaciens y/o S. Venezuelae Estas bacterias son productoras de clortetraciclina y cloranfenicol, respectivamente. 5) Incubar a temperatura ambiente durante 5 días. 2do. día 1) Observar el desarrollo de colonias en las placas estriadas el 1er. día y describir su aspecto macroscópico. Las colonias de Streptomyces son pequeñas, de consistencia firme y adheridas fuertemente al sustrato solidificado, de aspecto granuloso y pulverulento, generalmente pigmentadas (blanco, amarillo, rojo). Identificar una colonia aislada, realizar una tinción de Gram y observar al microscopio. 2) Preparar una suspensión de un microoganismo sensible (E.coli) colocando varias colonias en un tubo de hemólisis conteniendo 1 ml de solución fisiológica estéril. Homogeneizar en agitador de tubos. Agregar 4.ml de agar AS blando. Conservar a 40ºC. 46 3) Volcar con cuidado la suspensión de agar blando con las bacterias sensibles sobre las placas de Petri que tienen las colonias provenientes de las muestras de tierra, y las que tienen colonias de S. aureofaciens y/o S. venezuelae. 4) Dejar secar las placas durante 5 min. e incubar durante 24 hs. a a 37 ºC . 3er. día Observar los halos de inhibición del crecimiento de B. subtilis y E. coli en las placas con AN controles debidos a la producción de antibióticos de S. aureofaciens y/o S. venezuelae, y compararlos con los obtenidos a partir de los aislamientos de tierra. Bibliografía Madigan M.T., Martinko J.M. and Parker J. “Biología de los microorganismos”, 10ª Edición, pp 415, 721-722, 2004. Seeley H.W., Vandemark P.J. and Lee J.J. “Microbes in action” (A laboratory manual of microbiology) 4th edition, pp. 173-176, 1991. http://www.accessexcelence.org/AE/AEC/AEF/1995/goudie_soil.html http://www-micro.msb.le.ac.uk/video/Streptomyces.html “Purification and structure elucidation of antifungal and antibacterial activities of a newly isolated Streptomyces sp. Strain US80”. Fourati-Ben Fguira L., Fotso S., Ben Ameur-Mehdi R., Mellouli L and Laatsch H. Research in Microbiology 156: 341-347, 2005. “Plasticity of the Streptomyces genome-evolution and engineering of new antibiotics”. Hranueli D., Cullum J., Basrak B., Goldstein P. and Long P.F. Current Nedical Chemistry 12: 1697-1704, 2005. 47 T.P. N° 12 DETERMINACIÓN DE LA SUSCEPTIBILIDAD A LOS ANTIBIÓTICOS INTRODUCCIÓN El uso y abuso de los antibióticos en las terapias contra infecciones de origen bacteriano, conlleva a la selección de cepas bacterianas resistente. La diseminación de estas resistencias a otras cepas de la misma o diferente especie se ve facilitada cuando los marcadores de resistencia (genes) se encuentran en elementos genéticos móviles como son plásmidos y/o transposones La susceptibilidad de los microorganismos a los antibióticos se determina mediante técnicas basadas en la dilución o difusión del antibiótico en un medio de cultivo donde desarrolla el microorganismo en estudio. Las técnicas de dilución en caldo y agar son utilizadas para medir la actividad de un agente antimicrobiano frente a una cepa bacteriana y permiten determinar la concentración inhibitoria mínima (CIM) que es la menor concentración de antimicrobiano capaz de inhibir el crecimiento bacteriano. La CIM indica la concentración de antimicrobiano que se necesita para matar o inhibir el crecimiento del microorganismo analizado y permite valorar comparativamente la potencia de los antimicrobianos. La reproducibilidad de estas pruebas es de ± 1 dilución y para evitar una gran variabilidad éstas deben ser estandarizadas y controladas muy cuidadosamente. Los métodos estandarizados se detallan ampliamente en el NCCLS (National Committee for Clinical Laboratory Standards) Para el caso de las técnicas que se basan en la difusión del antibiótico, el método universalmente utilizado es el de Bauer y Kirby comúnmente llamado antibiograma. Este método consiste básicamente en un disco de papel embebido en el antibiótico que es colocado sobre un medio de cultivo sólido inoculado con el microorganismo a ensayar; luego de 18 a 24 horas de incubación se mide el halo de inhibición del crecimiento bacteriano que produce el antibiótico al difundir desde el disco de papel que lo contiene, radialmente hacia el medio de cultivo donde esta creciendo el microorganismo. El diámetro del halo de inhibición del crecimiento en un antibiograma y el valor de la CIM para un determinado antibiótico son un criterio de referencia experimental para determinar si un microorganismo es resistente o sensible a ese antibiótico. Otro novedoso método es el EtestTM , que permite la determinación de la (CIM) . El EtestTM es una tira plástica que contiene un gradiente continuo de un antibiótico, la técnica combina el fenómeno de difusión con el de dilución del antibiótico para determinar la CIM para un dado microorganismo. Este método, como veremos en el trabajo práctico, es mucho más certero que el antibiograma y más rápido y preciso que la técnica de dilución para obtener la CIM, que usualmente se realiza en varios pasos de dilución y cultivo lo cual requiere disponer de mucho material estéril para una sola determinación. Materiales Cultivo exponencial de la cepa bacteriana a analizar. Agar Müller Hinton Cajas de Petri estériles Rastrillo (alcohol 70% para esterilizarlo) Ansa Pipetas de 1 ml y 10 ml estériles Solución fisiológica estéril Solución de hipoclorito al 5% para descarte de material contaminado. Tubos de ensayo estériles Hisópos estériles 48 Escala de McFarland Discos de antibiograma Tiras de EtestTM para distintos antibióticos Estufa a 37 °C Desarrollo del trabajo práctico Determinación de la CIM por dilución en caldo 1. Se realizan diluciones al medio decrecientes del o los antibióticos en tubos conteniendo 1 ml de caldo Mueller-Hinton 2. Se siembra 1ml de una suspención bacteriana de aproximadamente 10 5 bacterias por ml que equivale a una dilución 1/500 del tubo 1 de la escala de Mc Farland. 3. Se realiza un control de crecimiento inoculando un caldo sin antibiótico y un control negativo con caldo sin inocular. 4. Se incuban todos los tubos a 37 °C durante 24 horas. Luego se observa turbidez indicativa del desarrollo bacteriano. 5. Se determina la CIM como aquella concentración del antibiótico contenida en el tubo que posee la mayor dilución del mismo en la que se detecta falta de turbidez. La mínima concentración que inhibe el crecimiento bacteriano. Bibliografía Bauer, A., Kirby, W., Sherris, J., Turk, M. American Journal of Clinical Pathology, 45: 493-496, 1986. Davis, D. B., Dulbecco, R., Eisen, H., Ginsberg, H., Tratado de Microbiología. capítulo 7 Salvat Editores, Tercera edición, 1984. 49 T.P. N° 13 TÉCNICA DE INMUNODIFUSIÓN RADIAL PARA LA DETERMINACIÓN DE INMUNOGLOBULINAS Y OTRAS PROTEÍNAS EN LÍQUIDOS BIOLÓGICOS Introducción La inmunodifusión radial en placa de agarosa conteniendo antisueros específicos constituye un excelente recurso diagnóstico para la determinación cuantitativa de proteínas de líquidos biológicos. El procedimiento consiste en una inmunoprecipitación en agarosa entre un antígeno a cuantificar y su anticuerpo homólogo. Se realiza incorporando uniformemente uno de los dos reactivos inmunes (generalmente el anticuerpo) en un gel de agarosa y luego introduciendo el otro reactivo en pocillos excavados en el mismo gel. El antígeno difunde radialmente en el gel que contiene el anticuerpo y se forma un disco o anillo de precipitación visible en un punto que depende de la relación estequiométrica antígeno-anticuerpo. A medida que el antígeno difunde desde el pocillo hacia el gel, el anillo se redisuelve y reaparece a una distancia mayor del pocillo. Este aumento en el diámetro de precipitación continúa hasta que antígeno y anticuerpo reaccionan completamente. Mientras que el precipitado se está expandiendo (16 a 20 horas) la relación entre el diámetro del anillo y el logaritmo de la concentración de antígeno es aproximadamente lineal. Al completarse la reacción, la relación entre el diámetro al cuadrado y la concentración es lineal. Equipamiento necesario para el desarrollo de la técnica * Inmunoplacas para 12 determinaciones * Micropipetas que permitan medir 5 µl con precisión * Sueros testigos con 3 niveles de la proteína a determinar * Regla de lectura que permita leer con una precisión de 0,1 mm Desarrollo de la reacción 1- Abrir la placa para permitir que se evapore el exceso de humedad, si lo hubiera 2- Sembrar 5 µl de muestra o control utilizando micropipetas de precisión. 3- Incubar en posición invertida en cámara húmeda el tiempo indicado en la tabla que acompaña cada placa (48 horas a temperatura ambiente) Lectura de los resultados El punto final de la difusión esta indicado por la aparición de un anillo de bordes netos. El mismo se alcanza una vez cumplido el tiempo de incubación. A partir de ese momento puede efectuarse la lectura, ya que el halo no aumentará de tamaño. El cálculo de los resultados se realiza con alguno de los siguientes métodos: A) Determinación de rutina: Utilizando tabla de valores. a) Medir los halos con una precisión de 0,1 mm. b) Interpolar el dato anterior en la tabla de valores que acompaña a cada placa. B) Determinación de alta precisión: Trazando curva de calibración. a) Las tres primeras posiciones de cada placa se utilizan para sembrar los sueros controles. b) Medir los diámetros de los halos con una precisión de 0,1 mm. c) Graficar las concentraciones de los sueros de referencia versus el diámetro al cuadrado de los halos de precipitación. d) Trazar la recta que mejor una los tres puntos. e) Interpolar el valor de la muestra desconocida. C) Determinación de rápida orientación: Método cinético de lectura rápida. 50 a) Tomar la lectura entre 16 y 20 horas de incubación con una diferencia máxima de ± 30 minutos respecto al suero de referencia. Medir los diámetros con una precisión de 0,1 mm. b) Graficar los diámetros de los sueros de referencia versus el logaritmo de sus respectivas concentraciones. c) Trazar la recta que mejor una los tres puntos. d) Interpolar el valor de la muestra desconocida. e) No es necesario trazar una curva cada vez que se procesa una nueva muestra. Sin embargo, debe efectuarse la lectura en el mismo tiempo en que se leyeron los sueros de referencia. Si se efectúa una nueva siembra, con más de una semana de diferencia respecto a la calibración, es recomendable introducir un testigo en cada corrida. NOTA: La tabla de valores se confecciona sobre un gran número de placas de cada lote utilizando un programa estadístico por computación para trazar la mejor recta. Solo es válida para el número de lote indicado. Variaciones en los parámetros del ensayo, como volumen de muestra, temperatura, tiempo de incubación y utilización de la placa una vez abierta por un lapso superior a 1 mes pueden producir diámetros no concordantes con los especificados en la tabla. Es recomendable incluir sueros controles para trazar una curva de calibración. Errores factibles en la utilización de la técnica 1- Debe tenerse precaución al sembrar, evitando derramar muestra fuera del pocillo, romper los bordes del mismo o introducir burbujas de aire. En caso que esto ocurra, sembrar un nuevo pocillo. 2- Si una vez abierta la placa se observan signos de deshidratación o deterioro en el gel, debe ser desechada. 3- Deben evitarse las variaciones brúscas de temperatura, ya que afectan la velocidad de difusión y, por lo tanto, los diámetros de precipitación. 4- Las placas no deben ser congeladas. Si esto ocurriera, deben ser descartadas. Evaluación de los resultados Es recomendable que cada laboratorio establezca sus propios valores de referencia. Los rangos que aquí se dan corresponden a pacientes ambulatorios presuntamente sanos. Inmunoglobulina G: Adultos: 600-1650 mg/dl Niños: 560-1500 mg/dl Inmunoglobulina A: Adultos: 90-400 mg/dl Niños: 100-210 mg/dl Inmunoglobulina M: Adultos: 75-300 mg/dl Niños: 40-200 mg/dl Inmunoglobulina D: 100 UI/ml C3: 80-160 mg/dl C4: 20-40 mg/dl Bibliografía Weir, D. M., Handbook of Experimental Immunology. Volume 1 Immunochemistry. Blackwell Scientific Publications. Fourth Edition. 1986. Margni, R. A., Inmunología e Inmunoquímica. Editorial Médica Panamericana. Quinta Edición. 1996 T.P.N° 13 51 T.P. N° 14 REACCIÓN DE AGLUTINACIÓN Cuando un anticuerpo específico es puesto en contacto con un antígeno, si éste es particulado (por ejemplo un glóbulo rojo, una bacteria o cualquier otra célula), las partículas se aglutinan formando una malla visible. Esta reacción se conoce con el nombre de aglutinación. Los principios que regulan la aglutinación son los mismos que en la precipitación. La ocurrencia de uno u otro fenómeno depende del tipo de antígeno involucrado (soluble o particulado). La reacción de aglutinación se usa para identificar un antígeno particulado, el cual va a reaccionar con un inmunosuero específico o para determinar el título aglutinante de un suero inmune. Para titular un antisuero se mezcla una cantidad constante de la suspensión antigénica con diluciones crecientes del suero a examinar y se determina su título como la inversa de la máxima dilución capaz de dar una aglutinación positiva. El título depende de la técnica utilizada y deben estandarizarse distintos factores tales como concentración de la suspensión antigénica, temperatura, concentración salina en el medio y tiempo de reacción, para que los resultados sean comparables. Objetivo: Titular anticuerpos en suero utilizando la técnica de aglutinación directa Materiales: - PBS pH 7,2 - microplacas de 96 pocillos con fondo en "U". - micropipetas y tips. - suspensiones homogéneas de Salmonella newport y Salmonella oranienburg crecidas en caldo nutritivo y diluidas hasta ajustar la concentración tomando como referencia el tubo 1 de la escala de Mac Farland (3 x 108 bacterias / ml aproximadamente). Estas suspensiones bacterianas representan el antígeno flagelar llamado antígeno H (Suspensión H). - suspensiones homogéneas de Salmonella newport y Salmonella oranienburg crecidas en agar nutritivo y diluidas de igual forma que las crecidas en medio líquido. Estas suspensiones bacterianas representan el antígeno somático llamado antígeno O o endotoxina de naturaleza glucolipídica (Suspensión O). S. oraniemburg (estructura antigénica= 6,7:m,t) y S. newport (6,8:e.h:1,2) y los antisueros O6,8; He,h y Hm,t (antisuero anti O preparado en conejo inmunizado con antígeno O purificado). Procedimiento: 1.- Se colocan 50 µl de PBS en cada uno de los 12 pocillos de una hilera de una microplaca de 96 pocillos con fondo en "U". 2.- Se colocan 50 µl del suero anti H a titular en el primer pocillo de la hilera. 3.- Se realizan diluciones seriadas al medio de dicho antisuero. Para ello se homogeniza el contenido del primer pocillo y se trasvasan 50 µl de la mezcla al segundo pocillo. Se repite el procedimiento a lo largo de toda la hilera. 4.- Se trasvasan 25 µl de cada pocillo al pocillo correspondiente de la siguiente hilera. 5.- A cada pocillo de la primera hilera, se agregan 75 µl de la suspensión antigénica H. 6.- A cada pocillo de la segunda hilera, se agregan 75 µl de la suspensión antigénica O. 7.- Se repite idéntico procedimiento con el suero anti O. 8.- En todos los casos se homogeniza y se incuba a 37 °C durante 2 hs. 9.- Se realiza una primera lectura de los resultados, anotando la mayor dilución del antisuero que produce aglutinación. 52 10.- Se incuba durante toda la noche a 4 ºC y luego se realiza una segunda lectura, verificando el título definitivo. 11.- Como controles se utilizan sueros normales de conejos obtenidos con anterioridad a la inoculación de los distintos antígenos. Bibliografía Weir, D. M., Handbook of Experimental Immunology. Volume 1 Immunochemistry. Blackwell Scientific Publications. Fourth Edition. 1986. Margni, R. A., Inmunología e Inmunoquímica. Editorial Médica Panamericana. Quinta Edición. 1996 53 Guía para la confección de informe TURNO TP: ........ GRUPO Nº: .......... INTEGRANTES:................................ ................................. ................................. INFORME TRABAJO PRACTICO Nº .... TITULO: .................................................................................................. OBJETIVOS:.......................................................................................................................................... ................................................................................................................................................................ ................................................................................................................................................................ ........................................................................................................... RESULTADOS OBTENIDOS: (se pueden utilizar tablas y/o gráficos que expresen los resultados en forma concreta, sin detalles de los métodos utilizados que figuran en la guía de TP). ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ .................................................................................. CONCLUSIONES: (comente brevemente las conclusiones obtenidas a partir del análisis de los resultados) ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ ................................................................................................................................................................ .................................................................................. 54 APÉNDICE MEDIOS DE CULTIVO CALDO NUTRITIVO Extracto de carne..................................... 3,0 g. Peptona de carne...................................... 5,0 g. Agua destilada c.s.p. .................................. 1 lt. pH = 7,0 ± 0,2 CALDO MAC CONKEY Peptona de caseína................................ 20,0 g. Lactosa................................................. 10,0 g. Bilis de Buey desecada............................ 5,0 g. Púrpura de Bromocresol....................... 0,01 g. Agua destilada c.s.p. ................................. 1 lt. pH = 7,1 ± 0,1 CALDO CEREBRO-CORAZÓN Infusión de cerebro............................... 12,5 g. Infusion de corazón................................ 5,0 g. Proteosa-peptona.................................. 10,0 g. D(+) glucosa........................................... 2,0 g. Cloruro de sodio..................................... 5,0 g. Di-sodio hidrógeno fosfato..................... 2,5 g. Agua destilada c.s.p. ................................. 1 lt. pH = 7,4 ± 0,2 CALDO TIOGLICOLATO Peptona de caseína............................... 15,0 g. Extracto de levadura.............................. 5,0 g. D (+) glucosa......................................... 5,5 g. L (+) cisteína.......................................... 0,5 g. Cloruro de sodio.................................... 2,5 g. Sodio tioglicolato................................... 0,5 g. Resazurina sódica............................... 0,001 g. Agua destilada c.s.p. ................................. 1 lt. pH = 7,1 ± 0,1 55 CALDO M9 (2X) NH4Cl.................................................... 1,0 g. Na2 HPO4.............................................. 6,0 g. KH2PO4................................................. 3,0 g. Cloruro de sodio.................................... 0,5 g. Glicerol o asparragina............................ 5,0 g. Agua destilada c.s.p. ................................ 1 lt. Agregar en frío Sulfato de magnesio 1N.......................... 1 ml. Cloruro de Calcio 0,01 M...................... 10 ml (autoclavados aparte) CALDO MRS (según DE MAN, ROGOSA Y SHARPE) Peptona universal....................................... 10,0 g. Extracto de carne......................................... 5,0 g. Extracto de Levadura................................... 5,0 g. D (+) glucosa............................................. 20,0 g. Di-potasio hidrógeno fosfato........................ 2,0 g. Tween 80..................................................... 1,0 g. Di-amonio hidrógeno citrato........................ 2,0 g. Acetato de sodio.......................................... 5,0 g. Sulfato de magnesio..................................... 0,1 g. Sulfato de Manganeso................................ 0,05 g. Agua destilada c.s.p. .......................................1 lt. pH = 6,5 ± 0,1 CALDO LB Triptona de soya..........................................10,0 g. Extracto de levadura......................................5,0 g. Cloruro de sodio..........................................10,0 g. Agua destilada c.s.p. ........................................1 lt. pH = 7,5 ± 0,1 CALDO CITRATO DE KOSER Sodio y amonio hidrogenofosfato.................. 1,5 g. Sulfato de magnesio...................................... 0,2 g. Potasio hidrógenofosfato............................... 1,0 g. Citrato de Sodio............................................ 3,0 g. Agua destilada c.s.p. ....................................... 1 lt. pH = 6,7 ± 0,1 56 AGAR NUTRITIVO Extracto de carne..................................... 3,0 g. Peptona de carne...................................... 5,0 g. Agar....................................................... 15,0 g. Agua destilada c.s.p. .................................. 1 lt. AGAR CETRIMIDA Peptona de gelatina....................................................... 20,0 g. Cloruro de Magnesio...................................................... 1,4 g. Sulfato de potasio......................................................... 10,0 g. N-cetil-N,N,N-trimetilamoniobromuro (cetrimida).......... 0,3 g. Agar............................................................................. 13,6 g. Agua destilada c.s.p. ..........................................................1 lt. pH = 7,2 ± 0,2 Aditivo: glicerina 10 ml AGAR MOSSEL Peptona de carne.............................................. 10,0 g. Extracto de carne............................................... 1,0 g. D (-) manita.................................................... 10,0 g. Cloruro de sodio.............................................. 10,0 g. Rojo de fenol................................................. 0,025 g. Agar................................................................ 12,0 g. Agua destilada c.s.p. ......................................... 0,9 lt. ADITIVOS: Luego de autoclavar, agregar 100 ml. de una emulsión de yema de huevo al 50 % y 0,1/0,01 g. de Polimixina B. EMULSIÓN DE YEMA DE HUEVO: Huevos de gallina frescos se lavan durante varias horas en etanol al 70 %. Luego se flamean y se abren asépticamente. Bajo condiciones de esterilidad, se separan las yemas de las claras. Se mezclan homogeneamente 50 ml. de yema de huevo con 50 ml. de solución fisiológica estéril, utilizando un homogeneizador de pequeña velocidad de rotación (para evitar formación de espuma). POLIMIXINA B: Solución estéril (por filtración). AGAR EMB (LEVINE) Peptona de carne............................................ 10,0 g. Di-potasio hidrógeno fosfato............................ 2,0 g. Lactosa.......................................................... 10,0 g. Eosina yellow................................................... 0,4 g. Azul de metileno........................................... 0,065 g. Agar............................................................... 15,0 g. Agua destilada c.s.p. .......................................... 1 lt. pH = 7,0 ± 0,2 57 AGAR MAC CONKEY Peptona de caseína.......................................... 17,0 g. Peptona de carne............................................... 3,0 g. Cloruro de sodio............................................... 5,0 g. Lactosa........................................................... 10,0 g. Sales biliares..................................................... 1,5 g. Rojo neutro.................................................... 0,03 g. Cristal violeta............................................... 0,001 g. Agar.............................................................. 13,5 g. Agua destilada c.s.p. .......................................... 1 lt. pH = 7,1 ± 0,1 AGAR MANITA SAL COMÚN ROJO DE FENOL Peptona de carne........................................... 10,0 g. Extracto de carne............................................ 1,0 g. Cloruro de sodio........................................... 75,0 g. D (-) manita.................................................. 10,0 g. Rojo de fenol.............................................. 0,025 g. Agar............................................................. 12,0 g. Agua destilada c.s.p. ......................................... 1 lt. pH = 7,4 ± 0,1 AGAR ALMIDON Extracto de carne.......................................... 3,0 g. Peptona......................................................... 5,0 g. Almidón soluble............................................ 2,0 g. Agar........................................................... 25,0 g. Agua destilada c.s.p. ....................................... 1 lt. pH = 7,2 ± 0,1 AGAR LECHE Triptona…………………………………5 g Extracto de levadura………………….. 2,5g Glucosa …………………………………1g Agar……………………………………. 15g Leche descremada 10%........................... 20 ml Agua destilada……………………… …..980 ml AGAR YEMA DE HUEVO Triptona………………………… 5 g Extracto de levadura……………. 2,5 g Glucosa…….…………………… 1 g Agar………………………………..15 g Solución de yema de huevo 5% …..100 ml Agua destilada …………………….900 ml 58 Solución de yema de huevo 5%: Lavar huevos de gallina frescos durante 30 minutos en etanol 70%. Luego se abren asépticamente. Bajo condiciones de esterilidad se separan las claras de las yemas. Se mezclan homogéneamente 5 ml de yemas de huevo con 95 ml de sc. fisiológica estéril. AGAR HIERRO DE KLIGLER Extracto de carne.......................................... 3,0 g. Extracto de levadura..................................... 3,0 g. Peptona....................................................... 15,0 g. Proteosa peptona........................................... 5,0 g. Lactosa....................................................... 10,0 g. Dextrosa(glucosa)......................................... 1,0 g. Sulfato ferroso.............................................. 0,2 g. Cloruro de sodio........................................... 5,0 g. Tiosulfato de sodio....................................... 0,3 g. Rojo fenol..................................................0,024 g. Agar...............................................................12 g. Agua destilada c.s.p. ....................................... 1 lt. pH = 7,4 AGAR ROGOSA Peptona de caseína...................................... 10,0 g. Extracto de levadura..................................... 5,0 g. D (+) glucosa.............................................. 20,0 g. Potasio di-hidrógeno fosfato......................... 6,0 g. Citrato de amonio......................................... 2,0 g. Polioxietilen sorbitan monoleato................... 1,0 g. Acetato de sodio......................................... 15,0 g. Sulfato de magnesio.................................. 0,575 g. Hierro II sulfato........................................ 0,034 g. Sulfato de manganeso................................. 0,12 g. Agar........................................................... 15,0 g. Agua destilada c.s.p. ....................................... 1 lt. pH = 5,5 ± 0,1 AGAR SELECTIVO PARA ACTINOMYCETES (AS) Caseinato de Na 2 g/l Almidón 5 g/l K2HPO4 0,5 g/l MgSO4 0,2 g/l FeCl3 0,01 g/l Agar-agar 15 g/l Agua destilada 1000 ml pH 7 Preparar 1000 ml y fraccionar en frascos de a 150 ml cada uno. 59 AGAR MUELLER-HINTON Infusión de carne..........................................5,0 g. Caseina hidrolizada.....................................17,5 g. Almidón........................................................1,5 g. Agar............................................................12,5 g. pH = 7,4 ± 0,2 COLORANTE ESCALA de pH COLOR Ácido - Alcalino ROJO DE METILO 4,4 – 6,0 Rojo - Amarillo ROJO NEUTRO 6,8 – 8,0 Rojo - Amarillo ROJO FENOL 6,8 – 8,4 Amarillo - Rojo ROJO CRESOL 7,2 – 8,8 Amarillo - Rojo AZUL CON BROMO TIMOL 6,0 – 7,6 Amarillo - Azul PÚRPURA CON BROMO CRESOL 5,2 – 6,8 Amarillo - Púrpura 8,3 - 10,0 Incoloro - Rojo 3,8 - 5,4 Amarillo - Azul FENOLFTALEINA VERDE CON BROMO CRESOL 60 Problemas ESTERILIZACIÓN 1) ¿Qué consideraciones debe tener en cuenta para cargar el autoclave con material a esterilizar? 2) ¿Qué método utilizaría para esterilizar cada uno de los siguientes materiales y soluciones? Placas de Petri descartables, material de cirugía, ropa de cama hospitalaria, solución fisiológica, suero fetal bovino, vitaminas, antibióticos, etanol, glicerol. 3) Una solución salina se fraccionó en partes iguales en dos frascos A y B. La fracción A se esterilizó en autoclave en una atmósfera conteniendo 100% de vapor; la fracción B se esterilizó también en autoclave pero en una atmósfera que contenía 60% de vapor y 40% de aire, durante el mismo tiempo. ¿Cuál de los dos procedimientos asegura la eliminación total de esporas? ¿Por qué? 4) ¿Qué características de un material o sustancia deben tenerse en cuenta para la elección de un método de esterilización? 5) ¿Por qué se requiere mayor tiempo de esterilización en horno que en autoclave ?. ¿ Cuál es el agente esterilizante en cada caso? 6) ¿Cómo decontaminaría un erlenmeyer de vidrio donde fue crecido un cultivo de Bacillus cereus y uno utilizado para crecer Escherichia coli ? 7) Un tubo conteniendo medio M9 + 0,5 % de glucosa fue autoclavado y posteriormente incubado a 37 °C durante 72 horas. Al cabo de dicho tiempo se detectó crecimiento de microorganismos. a) ¿Qué parámetros debería controlar para que el proceso de esterilización se lleve a cabo de manera adecuada? b) Una vez solucionado el inconveniente, ¿Cómo determinaría si dicho medio está efectivamente estéril? 8) ¿Cómo realizaría un control de esterilización y un control de esterilidad ? 9) Ud. dispone en su laboratorio de un mechero, autoclave, una solución de etanol 70 %, un horno y una lámpara de UV y necesita preparar y esterilizar los siguientes medios de cultivo: Caldo M9, agar nutritivo y agar Mossel con yema de huevo y polimixina B. Además necesita esterilizar una membrana de nitrocelulosa de 0,2 µm, placas de petri de vidrio, el rastrillo y el ansa. a) Indique que método de esterilización y/o desinfección de los que se dispone en su laboratorio utilizaría para cada uno de los materiales mencionados. b) ¿Necesita disponer de algún otro método de esterilización? ¿Por qué? 61 DIVERSIDAD MICROBIOLÓGICA 1) ¿Qué tipos de bacterias se encuentran asociadas con las zonas de color púrpura y verde de la columna de Winogradsky? 2) ¿En qué zona de la columna esperaría encontrar un anaerobio estricto? 3) Describa una sucesión microbiana en la columna de Winogradsky 4) Qué gradientes se forman en la columna de Winogradsky? Qué elementos se utilizan en el laboratorio para garantizar la formación de los mismos? 5) a) Indique que función cumplen cada uno de los elementos agregados en la columna de Winogradsky. b) Ubique en relación al gradiente de SH2 a los siguientes microorganismos: bacterias reductoras de sulfato, bacterias verdes del azufre, bacterias púrpuras del azufre, cianobacterias, diatomeas. c) En base a que otro/s parámetro/s ambientales podría ubicarlas. Justifique en todos los casos. 6) A partir de libros de texto, citas bibliográficas o búsquedas a través de internet, recabar más información sobre el metabolismo y los requerimientos de oxígeno de los organismos que pueden estar presentes en la columna de Winogradsky. Muchos de estos microorganismos se mencionan más abajo. Utilizando la información obtenida, dibujar una columna de Winogradsky y ubicar los microorganismos en el lugar apropiado. Thiobacillus sp., Clostridium sp., Algae, Desulfovibrio sp., Cyanobacteria, Chromatium sp., Rhodospirillum sp., Chlorobium sp. 7) Los siguientes 4 tipos metabólicos se encuentran presentes en la columna de Winogradsky: fotoautótrofos, fotoheterótrofos, quimiolitoautótrofos y quimioorganoheterótrofos. a) Mencione un ejemplo de cada uno de estos microorganismos que pueda ser encontrado en una columna de Winogradsky típica. En base a los ejemplos por usted seleccionados señale: b) Qué microorganismos participan en el ciclo del azufre y qué transformaciones realizan de ese compuesto. c) Ubique espacialmente c/u de los microoganismos seleccionados en función del gradiente de O2. TINCIONES 1) ¿En qué consiste una tinción diferencial? ¿Para qué se emplea? 2) ¿Qué sucede si a un cultivo envejecido de Bacillus sp. se le realiza una tinción de Gram? 3) ¿Cómo espera observar las bacterias luego de la tinción de Gram si se olvida de realizar el paso de decoloración? 4) ¿Qué sucederá si no se calienta en presencia del colorante en las tinciones de ácido resistencia y esporas? 5) ¿Podría utilizar un colorante básico como primer colorante en la tinción de esporas? 62 6) ¿Por qué no se tiñen las células alcohol -ácido resistentes por la coloración de Gram? 7) ¿Qué características debe tener un colorante para ser empleado en una tinción negativa? 8) Las tinciones de Gram, esporas y Ziehl Neelsen permiten determinar diferencias estructurales en células de distintos géneros. ¿Cuáles son esas diferencias y cuál es el paso de cada coloración que las pone en evidencia? ¿Qué tipos de colorantes se utilizan en cada caso? 9) Bacillus subtilis presenta color violeta al microscopio óptico luego de una tinción de Gram y color rosado al efectuarse una coloración de esporas. ¿Por qué motivo el cristal violeta en el primer caso y la safranina en el segundo tiñen la bacteria de esa manera? 10) Indique cuál o cuáles de las tinciones realizadas en los trabajos prácticos ponen en evidencia diferencias estructurales de la pared bacteriana. Explique brevemente. 11) Diga si las siguientes afirmaciones son verdaderas o falsas y justifique su respuesta. a) En una tinción negativa los colorantes utilizados tienen afinidad sólo por la pared bacteriana. b) En la tinción de esporas el verde de malaquita no tiñe el citoplasma celular porque es removido por los solventes orgánicos que se utilizan en el paso de decoloración. c) Las células Gram negativas no se tiñen con cristal violeta porque el mordiente no puede atravesar la pared de peptidoglicano. d) El calentamiento en la coloración de ácido resistencia permite que la fucsina fenolada se combine con el ácido micólico presente en la pared bacteriana. 12) Se dispone de un kit de Gram y un frasco de verde de malaquita. Con estos colorantes podría realizar una tinción para determinar la ubicación de las esporas en una especie de Bacillus que se quiere identificar? Explique. RECUENTO DE BACTERIAS 1) Se dispone de 6 ml de un cultivo bacteriano con 8,4 x 108 UFC/ml. ¿Qué diluciones debería realizar para contar aproximadamente 40 colonias por placa, si se siembra 0,1 ml de dicha dilución? 2) Partiendo de un cultivo bacteriano que tiene 4 x 108 UFC/ml : ¿Cómo procedería para obtener 80 colonias en una placa de agar nutritivo? Indique los volúmenes a utilizar. 3) ¿Qué dilución debería realizar para obtener 2 ml de una suspensión de bacterias que contenga 2 x 105 UFC totales, si parte de un cultivo que contiene 2 x 109 UFC/ml ? 4) Un cultivo bacteriano se diluye 1/4. A partir de esa dilución se realizan diluciones seriadas al décimo. Se siembra 0,1 ml de cada dilución en placas de agar nutritivo por triplicado obteniéndose los siguientes resultados: Dilución Número de colonias 63 Placa 1 10-4 10-5 10-6 621 64 5 Placa 2 546 56 9 Placa 3 356 68 4 ¿Qué dilución elegiría para calcular las UFC del cultivo original? Justifique su elección. 5) Un cultivo bacteriano de 10 ml tiene un recuento de 250 UFC cuando se plaquea 0,1 ml de la dilución 10-4. Si 2 ml de ese cultivo se inoculan en 100 ml de medio fresco para realizar una curva de crecimiento: ¿Cuál es la concentración bacteriana inicial? ¿Qué diluciones realizaría del mismo para contar 100 colonias si sembrara 0,1 ml ? 6) Un fabricante de yogurt afirma que sus productos contienen 4 x 106 bacterias lácticas viables / ml. ¿ Qué método de recuento utilizaría para corroborar ese número ? Describa el protocolo, condiciones y materiales que utilizaría para realizar dicha determinación. 7) Enumere las ventajas y desventajas de los siguientes métodos de recuento de bacterias: i) turbidez, ii) recuento en placa, iii) conteo directo al microscopio. 8) Para un cultivo exponencial de Escherichia coli se realiza una curva de calibración de recuento en placa vs. turbidez (D.O. leída a 600 nm). A partir de la misma se establece una relación UFC/ml por unidad de D.O. de 4. 107 a) ¿Qué ventajas tiene realizar una curva de calibración de recuento vs. turbidez? b) Qué diluciones debería realizar para contar 100 colonias en una placa de agar nutritivo sembrada con 0,1 ml de un nuevo cultivo de E. coli con una D.O. de 0.5. 9) Un investigador dispone de una curva de calibración de DO vs UFC/ml para E. coli en caldo nutritivo. ¿Podría utilizar la misma curva para un cultivo de: Bacillus megaterium y otro de Micrococcus luteus ? Justifique su respuesta. 10) Un cultivo de Klebsiella pneumoniae en fase exponencial tiene una DO = 0,2 medida a 600 nm. Al realizar un recuento en placa se contaron 40 colonias al sembrar 0,2 ml de la dilución –4 del cultivo original. a) Calcular las UFC/ml b) Calcular las UFC totales si el volumen del cultivo original es de 3 ml. c) ¿Qué diluciones debería realizar a partir del mismo cultivo de Klebsiella pneumoniae cuando alcanza una DO = 0,5 para contar en una placa 100 colonias. d) ¿En un cultivo exponencial de Baccillus megaterium que tiene una DO = 0,5 esperaría obtener más o menos UFC/ml que en el cultivo de Klebsiella pneumoniae que tiene igual DO? ¿Por qué? 64 AISLAMIENTO DE MICROORGANISMOS 1) ¿ Qué tipos de medios son el agar manitol salado y el agar Mossel? ¿ Para qué sirven cada uno de sus constituyentes? ¿ Podría reemplazar el manitol por otro azucar y el rojo fenol por rojo neutro? 2) Diseñe un medio que le permita diferenciar microorganismos Gram negativos que degradan la maltosa con producción de ácido de los que no lo hacen. 3) Discuta las siguientes afirmaciones: a- Para determinar la carga bacteriana de una muestra debe realizarse un enriquecimiento previo. b- Un enriquecimiento selectivo se realiza en medio líquido pues hay libre competencia por los nutrientes. c- El paso de aislamiento selectivo y/o diferencial puede hacerse en medio líquido. d- La premisa fundamental en un protocolo de aislamiento es conseguir un cultivo puro. 4) La composición del caldo nutritivo es: extracto de carne y peptona en agua a pH 7. La composición del caldo Mc Conkey es: peptona, lactosa, sales biliares, púrpura de bromocresol y cloruro de sodio en agua a pH 7. ¿Cuál es la función de cada uno de los componentes en cada medio? 5) Los principales componentes del agar Rogosa utilizado en el aislamiento de Lactobacillus son: glucosa, extracto de levadura, extracto de carne, peptonas, acetato de sodio, tween 80 (pH 5,5). Explique cuál es la función de cada uno de ellos y por qué la incubación se realizó en anaerobiosis. 6) Discuta los siguientes enunciados y justifique: a) Cualquiera de los siguientes medios podría ser utilizado para diferenciar aquellos microorganismos capaces de fermentar la lactosa: Medio 1 Peptona de carne Lactosa Rojo fenol Agua Agar ---- Medio 2 Peptona de carne Extracto de carne Lactosa Rojo fenol Agua ---- Medio 3 Cloruro de amonio Lactosa Rojo fenol Agua Agar ---- Medio 4 Cloruro de amonio Lactosa Glucosa Rojo fenol Agua Agar b) Especies del género Bacillus pueden ser aisladas en placas de agar Mc Conkey. 7) En el estudio de la esporulación de Bacillus cereus, cuya espora es oval y central, se observaron al microscopio bacilos con esporas terminales características de Bacillus subtilis. Diseñe un medio de cultivo que le permita diferenciar ambos microorganismos. 65 PRUEBAS BIOQUIMICAS 1) Diga si es verdadero o falso a) En el agar EMB y en el agar Fe de Kligler se pueden diferenciar microorganismos que realizan fermentación ácido-mixta de aquellos que realizan fermentación butilenglicólica. b) Las pruebas bioquímicas Rojo de Metilo y Voges-Proskauer, pueden realizarse en cualquiera de los siguientes medios: i) Extracto de carne, peptona de carne, agua. ii) Peptona, glucosa, buffer fosfato, agua. 2) ¿Qué resultados espera obtener en las pruebas bioquímicas de agar hierro de Kligler y oxido/fermentación de lactosa como única fuente de carbono, para microorganismos con las siguientes características metabólicas? a) Aerobio estricto que no utiliza la lactosa como fuente de carbono b) Aerobio facultativo que no utiliza la lactosa como fuente de carbono c) Aerobio facultativo que utiliza la lactosa como fuente de carbono 3) ¿Qué tipo de metabolismo y qué productos se ponen en evidencia al realizar las pruebas de Rojo de Metilo y Voges-Proskahuer? ¿Qué precauciones debería tener para la correcta interpretación de ambas pruebas? 4) A partir de una muestra de agua del Río de la Plata, se obtienen cultivos puros de 5 microorganismos (A, B, C, D, E) A cada uno de ellos se le realizan las pruebas de agar hierro de Kligler, Rojo de Metilo y Voges Proskahuer, obteniéndose los siguientes resultados: A B C D E Kligler Ac/Ac con gas Alc/SC sin gas Alc/Ac sin gas Alc/Ac con gas ↓↓ Ac/Ac con gas Rojo de Metilo + + - Voges Proskahuer + + A partir de los resultados obtenidos: a) ¿Qué características metabólicas puede inferir para cada uno de los microorganismos aislados? b) ¿De qué otra forma podría determinar la capacidad de utilizar la lactosa por parte de los cinco microorganismos? 66 5) Discuta las siguientes afirmaciones; a) El color rojo de las colonias en agar McConkey se debe a los productos ácidos generados por la fermentación de la lactosa. b) Los resultados de las pruebas de Rojo de Metilo y Voges Proskauer a diferencia de la prueba de agar hierro Kligler son independientes del tiempo de lectura. c) La aparición de un producto coloreado en la primera parte de la prueba de reducción del nitrato se considera positiva. 6) En una placa sembrada a partir de un cultivo de E. coli se observa una presunta contaminación con Pseudomonas aeruginosa. Indique por lo menos 3 pruebas bioquímicas y los resultados esperados de las mismas que le permitirían comprobar que se trata de estos dos microorganismos. 7) A partir de una muestra de agua se realiza un cultivo de enriquecimiento en caldo Mac Conkey, el cual es sembrado en placas de agar EMB-Levine , obteniéndose los siguientes resultados: .- Colonias transparentes. .- Colonias con centro pardo-grisáceo sin brillo metálico. .- Colonias con brillo verde metálico. a) Sobre la base del aspecto macroscópico de las colonias ¿qué componentes del medio de cultivo utilizan los microorganismos para su crecimiento? Explique. b) En caso de que posean un metabolismo fermentativo, ¿podría inferir que tipo de fermentación realizan y a qué colonias corresponden los microorganismos con esas características? Explique. c) ¿Qué pruebas bioquímicas emplearía para verificar el tipo de fermentación, qué colonias utilizaría y cuál sería el resultado de dichas pruebas en cada caso? d) Qué características deberían tener los microorganismos aislados para poder ser identificados empleando un test multiprueba API 20 E. RASTREO DE ACTIVIDADES ENZIMÁTICAS a) ¿Las enzimas responsables de las hidrólisis de los sustratos ensayados en el TP 7 son exo o endocelulares? Justifique b) ¿Puede el método ensayado dar resultados cuantitativos? ¿Qué debe tener en cuenta? c) ¿Puede Ud sugerir un ensayo para evaluar la hidrólisis de gelatina como sustrato proteico en placa d) ¿Qué otras actividades enzimáticas podría ensayar en placa como método de rastreo? 67 AGUAS 1) En un laboratorio un técnico realiza el análisis de una muestra de agua debiendo informar el NMP de coliformes totales/100 ml. y NMP de coliformes no fecales/100 ml. Para ello el técnico usó el método de Wilson pero se olvidó de realizar la siembra en caldo Citrato. Sin embargo, de acuerdo a los resultados que obtuvo decidió que no era necesario repetir el ensayo. Los resultados fueron: Diluciones de la muestra TC -1 -2 -3 -4 Tubos sembrados 3 3 2 2 2 Positivos en McConkey 37ºC 3 3 2 0 0 Positivos en McConkey 44ºC 3 3 2 0 0 Volumen sembrado (ml.) 1 1 1 1 1 a) ¿Qué opina de la decisión del técnico? b) ¿Qué podría informar Ud. a partir de estos resultados? 2) Con el objeto de investigar una eventual contaminación de las aguas de un afluente del Riachuelo, se tomó una muestra y se procedió a analizarla. El protocolo y los resultados fueron los siguientes: Nº de tubos sembrados 3 3 3 3 3 3 3 Vol. (ml.) 10 1 1 1 10 1 1 Dil. 100 100 10-1 10-2 10-3 10-3 10-4 Numero de tubos positivos Caldo Brila 37 °C 3 3 3 1 1 0 0 Fluorescencia + 3 3 2 1 1 0 0 Calcular el Nº más probable (NMP) de coliformes totales, fecales y no fecales/100 ml. Citrato 37 °C 3 2 1 0 0 0 0 68 3) Se realiza un análisis de aguas empleando caldo Brila Fluorocult, obteniéndose los siguientes resultados: Nº de tubos sembrados 3 3 3 3 3 3 3 Vol. (ml.) 0,01 1 0,1 1 0,01 1 0,01 Dil. 10-1 10-2 10-3 10-3 10-3 10-6 10-4 Número de tubos positivos Caldo Brila 37 ºC 3 3 3 3 2 1 1 Fluoresce ncia + 3 3 2 3 2 1 1 Citrato 37 °C 2 3 1 2 0 0 0 Calcular el NMP de coliformes totales, fecales y no fecales/100ml. 4) Se realiza un análisis de agua por el método de Wilson obteniéndose los siguientes resultados: Nº de tubos sembrados 3 3 2 2 1 1 Vol. (ml.) 10 1 1 1 1 1 Dil. 100 100 10-1 10-2 10-3 10-4 Nº de tubos positivos Mc Conkey 37ºC 3 3 2 0 1 0 Mc Conkey 44ªC 3 3 1 0 0 0 Citrato 2 1 0 0 1 0 Calcular el número más probable de coliformes totales, fecales y no fecales en 100 ml de agua. 5) Una muestra de agua se analiza para comprobar potabilidad por el método de Número más probable y se obtienen los siguientes resultados: N° Tubos Vol (ml) Diluc. 3 3 2 2 1 1 10 1 0,1 1 1 1 10 0 10 0 10 0 10 –2 10 –3 10 -4 N° Tubos Positivos Brila 37 °C 3 3 2 0 1 0 Fluoresc. Pos. Citrato 37 °C 3 2 3 1 1 0 0 0 0 1 0 0 Calcular el número más probable de coliformes totales, fecales y no fecales en 100ml de agua 69 FAGOS 1) ¿Cuál es el título de un stock de fagos a partir del cual se cuentan 38 placas de lisis en la dilución 10-5? Volumen de inóculo 0,1 ml. 2) Si un lisado de título 5 x 108 UFP/ml se utilizó para infectar a una m.i = 20 ¿Qué cantidad de bacterias fueron necesarias para la infección? 3) Se dispone de 5 ml de un stock de fago T4 para titular, el cual es diluido 1 : 5 . A partir de esta dilución se realizan diluciones seriadas al décimo (10-1 a 10-8) y se siembran 0,2 ml en agar blando, por duplicado. Los resultados obtenidos fueron: Dilución 10-5 10-6 10-7 10-8 Número de placas de lisis 520-480 60-54 3-6 0-1 a) Calcule el título del stock de fago. ¿Qué esperaría observar en las placas correspondientes a diluciones menores que 10-5? b) ¿Qué diluciones haría a partir del cultivo original para obtener 35 placas de lisis en una placa de Petri? 4) Se preparan dos lisados del fago virulento P1. Del primero se obtienen 20 ml que se titulan en placa con un recuento de 50 playas de lisis en la dilución 10-6. Del segundo se obtienen 2.5 ml que se diluyen al medio con solución fisiológica y se titula en placa con un recuento de 200 playas de lisis en la dilución 10-6. ¿Cuál de los dos lisados tiene mayor número de UFP totales? (Volumen de inóculo = 0,1 ml). Si es necesario infectar a una m.i. = 5 ¿Qué cantidad de bacterias utilizaría para cada uno de los lisados? (Considere volumen de inóculo = 0,1 ml para fagos y bacterias). 5) Se prepara un nuevo stock de fagos utilizando un cultivo bacteriano susceptible cuyo recuento en placa es de 108 UFC/ml y un viejo stock cuyo título es 1010 UFP/ml, de manera de aumentar el título. Protocolo: Volumen de cultivo bacteriano infectado: 10 ml. Inóculo del viejo stock: 0.1 ml de una dilución 10 –1. Tiempo de incubación a 37 °C: 5 horas. El lisado obtenido es centrifugado y filtrado. a) ¿Qué rango de 3 diluciones debería plaquear para poder verificar que el título aumento un orden? b) ¿Qué multiplicidad de infección utilizó al preparar el stock? 6) Se dispone de un stock de fagos con un título de 106 UFP/ml. Se desea preparar un nuevo stock de mayor título teniendo en cuenta que cada bacteria sensible produce 300 fagos. Para ello se cuenta con un cultivo de bacterias en fase exponencial con 5x109 bacterias/ml. La preparación 70 de dicho stock se realiza mezclando 1 ml del stock original con 1 ml de la dilución del cultivo bacteriano que garantice un fago por bacteria (mi = multiplicidad de infección = 1). a) ¿Qué diluciones tendría que realizar para obtener una mi = 1? Indique los volúmenes. b) ¿Qué diluciones del nuevo stock de fagos haría para determinar el título viral? Indique los volúmenes. ANTIBIOTICOS 1) Diseñe un protocolo para determinar la concentración inhibitoria mínima de un antibiótico para un determinado microorganismo. Este protocolo ¿es aplicable en el caso de un bacteriostático, un bactericida lítico y un bactericida no lítico ? 2) Para obtener un cesped de un microorganismo se siembra con hisopo una placa conteniendo: agar, glucosa, NH4Cl, MgSO4, K2HPO4 y se aplican distintos discos de papel embebidos con diferentes cantidades de un determinado antibiótico. Luego de 48 horas de incubación se observa un halo de inhibición alrededor del disco que contiene 5 µg de antibiótico. Cuando se hace lo mismo pero utilizando un medio que contiene agar, triptona y extracto de levadura, se observa un halo de inhibición del mismo tamaño que el anterior recién alrededor del papel que contiene 50 µg del antibiótico. Discuta las posibles explicaciones para estos resultados. 3) Diseñe un protocolo experimental para comprobar que una bacteria A libera al medio un compuesto con actividad antibiótica. ¿Cómo determinaría si dicho compuesto es bactericida o bacteriostático ? 4) Se dispone de dos cultivos bacterianos: uno en estado de crecimiento estacionario y otro en estado de crecimiento exponencial. Si se agrega la misma concentración de penicilina en ambos cultivos ¿Qué resultados esperaría obtener? Grafique y explique. 5) Se inoculan caldos nutritivos con Staphylococcus aureus y se incuban a 37 °C, tomando alícuotas a distintos tiempos para medir número de células viables y D.O. A los 120 minutos (fase log) se agregan a cada cultivo diferentes agentes: a) penicilina, b) cloranfenicol, c) solución fisiológica. A los 240 minutos, los cultivos se centrifugan a baja velocidad, se resuspenden en un volumen igual de medio fresco y se continúa la incubación. Esquematice las curvas de crecimiento esperadas en cada caso (número de células viables y D. O.). Justifique. 6) ¿Qué efecto espera obtener si se agrega en forma combinada un bacteriostático y un antibiótico de acción sobre síntesis de pared a un cultivo bacteriano en crecimiento exponencial ? 71 7) En un antibiograma, una cepa de E. coli presenta un halo de inhibición 3 veces mayor para el antibiótico A que para el antibiótico B. ¿Qué conclusión se puede extraer de esta prueba ? Justifique. 8) Se dispone de tres sustancias obtenidas por síntesis química con presunta actividad antimicrobiana para bacterias gram negativas. a) ¿Cómo determinaría cual de las tres presenta mayor actividad? b) ¿Qué parámetros debería tener en cuenta en el ensayo experimental? c) ¿Cómo determinaría su mecanismo de acción? 9) a) A qué se debe la aparición de colonias dentro de la zona de inhibición del crecimiento en un ensayo de concentración inhibitoria mínima? b) ¿Qué resultados esperaría obtener al comprobar la CIM de las bacterias que forman estas colonias en relación a las que crecen por fuera del halo de inhibición? ¿Cómo la calcularía? Nota: Ud. esta trabajando con un cultivo puro 10) Debido al recorte presupuestario, la Cátedra de Microbiología no pudo comprar las tiras de E-Test Penicilina para la determinación de la CIM (concentración inhibitoria mínima). ¿Qué metodología alternativa podría emplear para calcularla? Explique detalladamente el método por Ud. propuesto. Nota: Se dispone de todo el material de laboratorio necesario. 11) Un antibiótico A que actúa por unión reversible a la subunidad menor del ribosoma bacteriano se modifica químicamente obteniéndose una serie de compuestos distintos: B, C y D. Al realizar una prueba de sensibilidad en agar para un determinado microorganismo se obtuvieron los siguientes diámetros (d en mm) en los halos de inhibición: dA 25, dB 6, dC 30 y dD 6. a) ¿Qué conclusiones se pueden obtener a partir de estos resultados? Justifique. b) ¿Cómo comprobaría que C tiene más actividad que A? Explique brevemente. Al determinar el mecanismo de acción de C se obtuvieron las siguientes curvas de DO600 nm (---) y log UFC/ml () en función del tiempo: c) ¿Qué tipo de actividad presenta C? Justifique brevemente. d) ¿Cambió respecto de A? Explique. Nota: la flecha indica el tiempo de agregado de C. 72 INMUNOLOGÍA 1) Indique: a) ¿Cómo procedería para verificar la efectividad del proceso de purificación de un antígeno bacteriano soluble? b) ¿Cómo procedería para cuantificar un antígeno bacteriano soluble utilizando una técnica inmunológica? 2) Un paciente con Salmonellosis concurre a un laboratorio A y le informan que el título de anticuerpos en el suero es de 64 usando la técnica de aglutinación con una suspensión de Salmonella typhi como Ag. Asustado el paciente concurre a otro laboratorio B ese mismo día donde le informan que el título es 256 usando también Salmonella typhi como Ag. para la reacción de aglutinación. El paciente está desconcertado. ¿Qué explicación le daría a Ud. a este paciente? 3) A partir de un suero humano se desea purificar la albúmina. Dicho suero es sometido a tres pasos de purificación sucesivos. ¿Cómo determinaría la concentración de albúmina después de cada paso de purificación? Nota: Ud. dispone de: antisuero anti humano total, antisuero monoespecífico anti albúmina humana, albúmina humana purificada de origen comercial de concentración conocida, agar, solución fisiológica, material de vidrio y micropipetas. 4) Se inmuniza un conejo con una suspensión de Salmonella typhi. a) ¿Cómo estudiaría la cinética de aparición de anticuerpos séricos anti-flagelos a fin de determinar el momento en que se obtiene el pico máximo de la respuesta inmune? b) ¿Qué indicaría la obtención de 6 bandas de precipitación en una inmunodifusión unidimensional doble cuando se enfrenta un lisado de S. typhi con el suero inmune obtenido? c) ¿Qué técnica emplearía para saber si S. typhi comparte determinantes antigénicos con S.newport? Describa brevemente la técnica elegida usando como control suero normal. d) ¿Cómo determinaría la concentración del antígeno flagelar presente en varios lisados de S. typhi obtenidos por distintos métodos? Describa brevemente la técnica que emplearía. 5) Qué metodología emplearía para: a) Detectar anticuerpos anti una proteína soluble de pneumococos en el suero de un cobayo inmunizado con dicha bacteria. Enumere y dé el fundamento de las técnicas que conoce para dicho fin. b) Determinar la concentración de IgE humana en muestras obtenidas de pacientes alérgicos. Dé el fundamento del método elegido y esquematice el protocolo de trabajo. 7) Se inyectan 2 conejos con Salmonella newport siguiendo distintos esquemas de inmunización. Luego de la última inoculación se sangran los animales y se obtienen los sueros. 73 Cómo determinaría cuál de los dos animales alcanzo el título más elevado de anticuerpos anti Salmonella newport? Describa brevemente la técnica empleada y cómo expresaría los resultados. 8) En el estante de una congeladora del laboratorio de Microbiología se encontraron 2 tubos rotulados de la siguiente manera: Suero anti Salmonella N° 1 y Suero anti Salmonella N° 2. a) Sabiendo que allí se trabaja con 2 especies de dicha bacteria: Salmonella schottmulleri y Salmonella typhi, ¿Podría Ud. determinar que especie de Salmonella se empleó para obtener cada antisuero? ¿Qué técnica emplearía? Explíquela brevemente. Describa los resultados que le permitirían identificar ambos antisueros. Nota: Las bacterias presentan los siguientes antígenos Salmonella schottmulleri: Antígeno O (determinantes antigénicos 1, 4, 5 y 12). Salmonella typhi: Antígeno O (determinantes antigénicos 9 y 12) y Antígeno Vi. b) ¿Cómo determinaría cual de los 2 antisueros tiene mayor título aglutinante? ¿Qué técnica emplearía? Explique brevemente. c) Si los antisueros fueron hechos en conejo, ¿Cómo determinaría la concentración de IgG en cada suero? Explique la técnica. PROBLEMAS COMBINADOS PROBLEMA 1 Se desea estudiar la efectividad de un método de irradiación para esterilizar arroz. Para ello se dispone de tres muestras de arroz esterilizadas en autoclave (5 g/ 8,5 ml), de 10 ml de un cultivo de E. coli con un recuento de 50 UFC cuando se plaquean 0,1 ml de la dilución 10-6 y de 5 ml de una suspensión de esporas de B. cereus de 4x107 esporas/ml. Cada una de las muestras de arroz esterilizadas se inoculó con 1 ml del cultivo de E. coli y con 0,5 ml de la suspensión de esporas y se sometió a una dosis diferente de radiación. Al cabo de los respectivos tratamientos se cuantificó en cada muestra el número de UFC totales de E. coli y de B. cereus sobrevivientes obteniéndose los siguientes resultados: Tratamiento E. coli B. cereus ND= no detectable. 1 2,5x104 2,5x104 2 ND 2x102 3 ND ND a) Discuta sobre la efectividad de cada uno de los tratamientos como método de esterilización. b) ¿Cuál es la carga bacteriana total con que se inoculó cada muestra antes de someterlas a la radiación? c) Describa el protocolo para hacer los recuentos de los sobrevivientes justificando los pasos que realizaría. Indique volúmenes, diluciones, medios de cultivo empleados con la función de sus constituyentes. d) Ud. dispone de una cuarta muestra de arroz esterilizada en el autoclave simultáneamente con las otras tres muestras. ¿Qué tipo de control le realizaría previamente a dicha muestra para garantizar que los sobrevivientes de las otras muestras provienen de la inoculación artificial? 74 PROBLEMA 2 Se sembraron en agar Mossel sin polimixina B los siguientes microorganismos: Cepas patrón de ensayo Bacillus cereus Bacillus cereus variedad mycoides Bacillus subtilis Escherichia coli Pseudomonas aeruginosa Proteus mirabilis Staphylococcus aureus Color del medio rosadas rosadas amarillas rosadas rosadas rosadas amarillas Precipitado + + + a) ¿Cuál es la fuente de carbono que permite el crecimiento de cada uno de los microorganismos en este medio? ¿Cuál es la relación con el color de las mismas? b) ¿Qué paso realizado en el aislamiento del TP para Bacillus disminuye la aparición de la flora acompañante en este medio sin polimixina? PROBLEMA 3 A partir de una muestra de agua del lago de Palermo se preparó una dilución 10-2 y se sembró por rastrillado 0,1 ml de dicha dilución en tres placas con los siguientes medios: Agar nutritivo Agar Mac Conkey 62 colonias 38 colonias Agar Cetrimida 5 colonias a) Indique cómo esterilizaría dichos medios. Explicar a qué se deben las diferencias observadas en el nº de colonias que aparecen en cada medio considerando que se inoculó la misma cantidad de muestra en cada uno. b) Describa todos los tipos de morfología de colonias que podrían encontrarse en la placa con agar Mac Conkey explicando a qué se deben las diferencias. c) Describa un protocolo para cuantificar el número de esporas presentes en 10 ml de la muestra de agua. 75 MICROBIOLOGÍA E INMUNOLOGÍA DEPARTAMENTO DE QUÍMICA BIOLÓGICA FACULTAD DE CIENCIAS EXACTAS Y NATURALES UNIVERSIDAD DE BUENOS AIRES TRANSPARENCIAS TRABAJOS PRÁCTICOS 2010