preparaciòn de fases mobiles
Anuncio

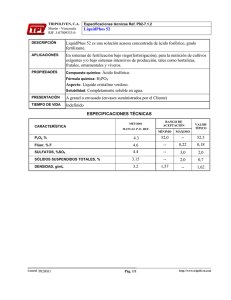
PREPARACIÒN DE FASES MOBILES Los solventes acuosos, orgánicos y la mezcla entre ellos son típicamente usados como fases móviles en cromatografía liquida (HPLC).Por su parte las soluciones buffer son también muy usadas junto con soluciones acuosas. Sin embargo existen entre ellas algunas restricciones en su preparación y uso. Para algunas bibliografías la definición de buffer es vaga y a veces confusa. Existen casos donde, debido a las diferencias entre las instrucciones dadas en la documentación y los métodos de preparación actualmente usados se muestra disparidad en cuanto a la preparación de las fases móviles, las cuales afectan el resultado de los cromatogramas y por supuesto el análisis de los resultados. Existen múltiples aspectos en la preparación de fases móviles que pueden convertirse en un punto ciego en el tema. Esto aplica no solo a soluciones buffer sino también por ejemplo a los métodos de mezclado de solventes. Aquí usaremos un buffer de fosfato como ejemplo, y observaremos el efecto que puede ocasionar el utilizar un método de preparación diferente, en el análisis de los resultados, especialmente para la separación de compuestos como cafeína, dihidrocodeina y acetaminofen. 1) En la preparación de la Solución Buffer. En general ¿Cómo se describe una solución buffer de “20mM de fosfato (pH 2,5) y como se prepara? El valor de pH de una solución acuosa de 20mM de fosfato de sodio es aproximadamente 5.0, entonces en orden de tener un valor de pH de 2.5 indudablemente se requiere el ajuste con algún tipo de sustancia ácida. Para esto tenemos dos posibles alternativas. La primera se obtiene si asumimos que tomamos una solución buffer y ajustamos el pH a 2,5 con ácido fosfórico, mas los contra iones usados no están claros, si se incluyen en la concentración o no, de esta forma el problema es que “20 mM” se refiere a la concentración de acido fosfórico o fosfato de sodio. Si asumimos que hay una cierta cantidad de iones sodio, el siguiente problema es… ¿Como sabemos si en efecto tenemos una solución buffer de 20 mM de acido fosfórico o tenemos una solución fosfato sódico? , Podemos considerar que “ 20 mM” será la concentración del acido fosfórico? Podríamos decir a ciencia cierta que “20mM”será la concentración de sodio simplemente, podemos pensar que esta solución como “una solución buffer creada por el ajuste de pH de una solución de 20 mM de fosfato dihidrogenado de sodio”. Es así que dependiendo del ácido utilizado en el ajuste de pH, el efecto de par iónico puede ocurrir o no, y de ahí surgen algunas discrepancias en al análisis de los resultados. De esta manera podemos ver que existen dos posibles y muy validas interpretaciones de solución buffer. Fig1 Muestra el efecto en el FIGURA 1. INFLUENCIA DEL A análisis de los resultados de CORMATOGRAFICO interpretar el ejemplo anterior en las dos diferentes maneras. La línea superior muestra el resultado obtenido de interpretar “20 mM” como concentración de acido fosfórico y usando una solución prepara como “20mM” de ácido fosfórico (sódico) ajustado a (pH 2.5) como fase móvil. El cromatograma de un medio e inferior muestra el resultado obtenido interpretando “20mM” como la concentración de fosfato hidrogenado de sodio y posteriormente ajustado a pH 2,5 adicionando el respectivo par iónico (ácido fosfórico) y con ajuste usando un ácido diferente como ácido perclórico. Como se muestra la hidrocodeina en este ejemplo, se encuentra que en algunos casos donde el tiempo de retención y consecuentemente la robustez de la técnica de análisis son significativamente afectadas. Indicando que el método de preparación de la solución buffer y la presión en encontrar ayudas adecuadas previene los problemas resultante de las diferentes interpretaciones. 2. En la mezcla de solventes orgánicos y acuosos. Soluciones obtenidas de mezclar solventes orgánicos y acuosos son en algunos momentos usadas como fases móviles. La forma en que esta mezcla es obtenida puede causar efectos significativos en los resultados. Como ejemplo, consideremos una mezcla del 90% 20mM de solución de acido fosfórico (sódico) a pH2.5 y 10% de acetonitrilo. Si consideramos esta descripción para indicar que la relación de mezcla es 9:1 esto implica que la relación en volumen de la solución de buffer de 20mM de ácido fosfórico (sódico) a pH 2.5, con acetonitrilo es 9:1, en otras palabras, la cantidad correspondiente está medida fuera de la preparación y posteriormente mezclada. Por otro lado, si se considera esta descripción simplemente como “10% de acetonitrilo”, esto implica que la 20 mM de acido fosfórico (sódico) ajustado a pH2,5 es usado, y que este es diluido con acetonitrilo dentro de la preparación. Aplicando la última interpretación los cambios en los volúmenes relativos y la concentración de buffer 20 mM de ácido fosfórico (sódico) es consecuentemente mayor. Existe una tendencia de pensar que no hay diferencias significativas entre estas dos interpretaciones. La figura 2., Sin embargo muestra como los métodos de mezcla usados pueden tener un efecto significativo en el análisis de los resultados (particularmente en los tiempos de retención). En general, dependiendo de la preparación de las fases móviles en HPLC, se puede notar que “A:B= 3:2 (V:V)”, indica que la cantidad de solución A corresponde a un volumen relativo de 3 a que la cantidad de solución B corresponde a un volumen relativo de 2, que son medidas separadas y posteriormente mezcladas, como comúnmente se debería interpretar. (En la práctica, el volumen total de la mezcla deberá ser inferior que el volumen relativo de 5 = 3+2). Los problemas mencionados no solo ocurren en la preparación de las fases móviles, sino también en la preparación de las muestras y en otras diluciones. Sin embargo las diferentes prácticas y las convenciones usadas en diferentes campos ( ej, farmacéuticos, e industria química), causando además una potencial causa de confusión. Documentos oficiales, como la Farmacopea Japonesa, el “Standard Methods” para análisis para químicos de higiene, y la (JIS) de sus siglas Estándar de Industria Japonesa, da unos principios generales y unas definiciones relacionadas para la preparación de las soluciones. Es recomendable referirnos a estos documentos y esforzarnos a diario para utilizar la notación que evite la confusión. Escrito por: Juan Felipe Barrios Químico, Especialista en Aplicaciones, Unidad de Instrumental Purificación y Análisis de Fluidos.