Laboratorio de Introducción a la Microbiología Practico N° 3
Anuncio

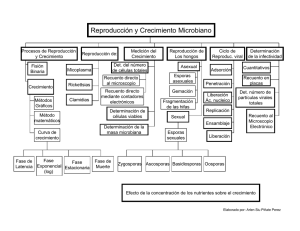
Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental Laboratorio de Introducción a la Microbiología Practico N° 3 “RECUENTO BACTERIANO Y ANÁLISIS DE AGUA” CRECIMIENTO BACTERIANO Introducción Crecimiento es el incremento ordenado de todos los componentes de un organismo. La multiplicación celular es una consecuencia del crecimiento. En organismos unicelulares la multiplicación conduce a un aumento en el número de individuos dando lugar a una población o aun cultivo. El crecimiento microbiano puede medirse en términos de concentración celular (número de células por unidad de volumen de cultivo) o densidad celular (peso seco de las células por unidad de volumen de cultivo). Estos dos parámetros no siempre son equivalentes, debido a que el promedio de peso seco de la célula varía en las distintas etapas de la historia del cultivo. Cinética exponencial Durante la fase exponencial de crecimiento, la tasa de incremento de la masa bacteriana en un tiempo determinado es proporcional a la masa presente: dB/dt = B (1) donde B es la masa bacteriana, t el tiempo y la tasa constante de crecimiento instantáneo para cada cultivo concreto ( es decir el aumento relativo por unidad de tiempo) Por tanto: dB/B = dt (o d ln B = dt) (2) Bt = Bo et; e integrando: (3) lnBt/Bo = t, o ln Bt = ln Bo + t (4) Por tanto, durante esta fase, la representación gráfica del logaritmo de B frente al tiempo da lugar a una línea recta. Esta gráfica semilogaritmica suele ser la que se emplea para representar curvas de crecimiento bacteriano. Suele ser útil expresar la tasa de crecimiento como tiempo de duplicación (tD), denominado también tiempo medio de Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental generación (TMG). Este valor se obtiene asignando a Bt el valor 2Bo en la ecuación 4 ( es decir, el doble): ln Bt/Bo = ln2 = tD tD = (1/) ln 2 = 0,69 (1/) 1/tD = = 1,45 El valor recíproco del TMC, (= 1/tD), es la tasa constante de crecimiento exponencial, expresada en generaciones por hora. Su valor es 1,45 veces mayor que la tasa constante de crecimiento instantáneo , ya que el valor de B, y, por tanto, de B, aumenta continuamente durante el crecimiento exponencial, y cuando se duplica la masa bacteriana, la tasa de síntesis celular se duplica con respecto al instante inicial (ver Figura de gráfica). RECUENTO DE MICROORGANISMOS El recuento es un procedimiento que permite conocer el número de microorganismos que hay en una muestra. Para este propósito, existen diferentes métodos mediante los cuales se pueden contar microorganismos vivos (recuento de viables), o bien vivos y muertos (recuento de totales). A su vez todos los tipos de recuento, se pueden clasificar en directos e indirectos. Un recuento directo es aquel en el que se cuentan las células por observación directa al microscopio, y el recuento indirecto es aquel en el que se determina el número por crecimiento o alguna propiedad de los microorganismos. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental 1.- Recuento de Totales a) Recuento de Breed Es un método que entrega recuento de totales. Se utiliza para recuento de microorganismos en la leche. Para realizar este método usted, sobre un porta objetos limpio y desengrasado dibuje con un lápiz un cuadrado de un centímetro cuadrado. Homogenice la muestra problema y con una pipeta Pasteur coloque una gota de la muestra (aproximadamente 0,01 ml) sobre el cuadrado y extiéndala bien sin salirse de él. Seque y fije al calor suavemente, luego cubra la extensión con cristal violeta durante un minuto. Lave con agua y seque. Observe al microscopio con aceite de inmersión. Cuente el número de microorganismos en varios campos, no menos de 5. Luego calcule el promedio de microorganismos contados y multiplique por 3000 (área del campo del microscopio) y por 100 (inverso del inoculo colocado en el cuadrado). Nº de células/ml = X de células por campo x 3000 x 100 3000, corresponde al área del campo del microscopio y debe ser calculado para cada uno, o referirse al fabricante. 100, corresponde al inverso del inoculo depositado en el portaobjeto. b) Recuento con cámara de Petroff-Hauser o Hemocitómetro. Este método consiste en colocar una diminuta gota de cultivo en un portaobjetos especial llamado Hemocitómetro (porque fue ideado originalmente para el recuento de glóbulos rojos). La muestra queda depositada en un espacio de 0,02 mm entre el porta y el cubreobjeto. La excavación completa tiene 25 cuadrados cada uno dividido en 16 cuadrados más pequeños. Para calcular el número de células por ml de muestra, se debe hacer la siguiente operación: - Contar las células presentes en varios cuadrados grandes y sacar un promedio. Multiplicar el promedio por 25 (con esto se obtiene el Nº de células en un mm2). Multiplicar por 50 (esto entrega el número de células en un mm3). Multiplicar por 1000, para transformar todo a cm3. Nº cel/ml = X cel x 25 x 50 x 1000 Este recuento representa la cantidad de células vivas y muertas. El método es aplicable a cualquier suspensión de partículas microscópicas. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental c) Recuento con sales de tetrasolium. Las sales de tetrasolium son un compuesto que se agrega a la preparación, el cual se reduce como producto del metabolismo y las células se tiñen de color rojo. Las células muertas quedan sin teñir (el compuesto no es utilizado y queda insoluble). d) Recuento por Microscopia de Fluorescencia. Las bacterias se tiñen con naranja de acridina, compuesto que es capaz de integrarse al DNA bacteriano por lo que las células vivas quedaran fluorescentes. Éste método es también un método de recuento de viables y no de totales y directo. 2.- Recuento de células viables. En muchos casos queremos contar sólo las células vivas. Una célula viva se define como aquella capaz de dividirse, y un conteo de la viabilidad celular generalmente se efectúa determinando la cantidad de células de una población que son capaces de dividirse y formar colonias. El método de conteo en placas es el más ampliamente usado y dos son las versiones de esta técnica: la placa vertida y la placa extendida. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental a) Método de la placa extendida En el método de la placa extendida, una muestra generalmente pequeña de 0,1 ml se extiende asépticamente sobre la superficie de una placa de cultivo con el medio adecuado y bien seco y se incuba hasta que las colonias son visibles a simple vista. Se entiende que cada colonia se originan de una sola célula por lo tanto contando el número de colonias se puede calcular la cantidad de células viables de la muestra. b) Método de la placa vertida Con el procedimiento de la placa vertida, la muestra se mezcla con el agar el cual debe encontrarse a una temperatura de 45 a 50ºC colocándose posteriormente sobre la placa de Petri estéril. Los microorganismos quedan entonces fijos dentro del agar y forman colonias. Con las placas servidas se pueden emplear volúmenes de muestra de 1,0 ml o más, siendo posible el recuento de lodos o suspensiones como las que se obtienen de alimentos o medios homogeneizados. Una desventaja importante de esta técnica es que los microorganismos dañados por el breve calentamiento del agar fundido no pueden contarse. El recuento en placa es muy sensible debido a que, en principio, cualquier célula viable, si se pone en medio de cultivo adecuado, dará lugar a una colonia. Además de su sensibilidad, el recuento en placa permite también la identificación positiva del organismo que se va a contar, en vista de que la colonia formada puede servir como inoculo para un cultivo puro puede a su vez ser identificado taxonómicamente. Más aun, puesto que organismos diferentes frecuentemente producen colonias diferentes en forma, textura, tamaño y color, diferentes tipos de organismos pueden contarse en una mezcla. Una de las principales suposiciones en los procedimientos para el recuento en placa es que cada colonia se origina de una sola célula, pero sin por el azar dos células quedan dispuestas muy cerca de una de la otra, durante la incubación, pueden dar origen a una sola colonia fusionada, que no puede diferenciarse de la que se originó de una sola célula. La experiencia práctica ha determinado que debe haber menos de 300 colonias por cada placa de cultivo para minimizar el problema. c) Método de las diluciones y plaqueo (viables). Se toma 0,1 ml de un cultivo problema bien homogeneizado con una pipeta estéril y se diluye progresivamente en tubos con 9 ml de solución salina estéril al 0,8% de NaCl. En lo posible se recomienda hacer cada dilución con una pipeta nueva homogeneizando bien la suspensión en cada paso. Se obtienen así las siguientes diluciones: 10-1 , 10-2 , 10-3 .................................... 10-8 , 10-9, 10-10 Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental De las tres últimas se toma 0,1 ml y se siembra en la superficie de una placa de Petri con agar nutritivo bien seco y posteriormente con un asa de Drigalsky se homogeniza la siembra por todo el medio el cual debe estar bien seco. Incubar las placas a la temperatura adecuada de crecimiento durante 24-48 horas. Una vez incubadas las placas, cuente el número de colonias que aparecen en cada una de ellas y saque un promedio. Tome en cuenta las placas que contengan entre 30 y 300 colonias solamente. Luego el valor promedio del número de colonias multiplicado por el valor recíproco de la dilución correspondiente y por 10 (colocamos 0,1 ml de inoculo) nos da el número de microorganismos por ml de la muestra problema. Nº cel/ml = X colonias x factor de dilución x 10 Ejercicio: Si en la placa correspondiente a la dilución 10-8 aparecen 38 colonias, el número de microorganismos viables por ml de muestra inicial será? d) Método Turbidimétrico. Un medio de cultivo estéril, que ha sido inoculado va presentando turbidez a medida que la población celular va en aumento. Este fenómeno puede ser medido en un espectrofotómetro. Se coloca un volumen medido de cultivo, en un tubo especial de vidrio transparente de diámetro conocido. Este es interpuesto entre una unidad de foco luminoso, y otra unidad fotoeléctrica, la cual está acoplada a un galvanómetro o disco de lectura, el cual registra el porcentaje de la luz transmitida a través de la suspensión de Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental células. El porcentaje de tramitancia de la luz a través del tubo se relacionará de manera inversa con la turbidez del tubo. Este método es rápido, sencillo y puede determinarse el número de células correspondiente a cada lectura por recuento en placa. Con él se puede confeccionar la curva de crecimiento de un cultivo bacteriano, información necesaria cuando se desea trabajar con cultivos en fase exponencial. Figura El espectrofotómetro. (a) El espectrofotómetro mide la turbidez, es decir, la cantidad de luz que transmite un cultivo, expresada en unidades de absorbancia. La célula bacteriana dispersa la luz, de manera que no es detectada por el detector sensible a la luz. (b) El tubo de la izquierda no tiene células bacterianas y está transparente. El de la derecha contiene alrededor de mil millones (109) de células por mililitro y, por lo tanto, está turbio. (c) La curva patrón relaciona la absorbancia con el número de células bacterianas por mililitro. Una vez que se obtiene, esta curva puede usarse para convertir cualquier medida de absorbancia en número de células. Por ejemplo, a partir de esta curva, una lectura de 1,6 unidades de absorbancia significa que el cultivo contiene 100 millones (108) de células por mililitro e) Número más probables de microorganismos. Es posible hacer determinaciones de conteo de viabilidad empleando sólo cultivos líquidos, con la técnica del Número Más Probable (NMP). En esta técnica, la muestra que va a ser contada se diluye hasta que la densidad celular sea de menos de 1 célula por ml. En estas condiciones ya no es apropiado hablar de concentraciones de células, sino más bien de la probabilidad de encontrar una célula. Por ejemplo, si existen 5 células en 10 ml, la concentración puede expresarse como 5 x 10-1 células por ml. Sin embargo, las células viables son desde luego individuales, por lo tanto, decimos que en Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental este ejemplo existe una probabilidad de 0,5 por cada ml del tubo de que contenga una célula viable. Si el tubo se vaciara tomando 10 muestras de 1 ml cada una, 5 de ellas se esperaría que contuvieran una célula y 5 que carecieran de ella. Este concepto es la base del procedimiento del NMP. Se toma una cantidad de muestra pequeña por duplicado (generalmente 1 ml), de una muestra diluida, y cada una de ellas es inoculada en un tubo separado de medio fresco de crecimiento, que posteriormente es incubado para permitir la proliferación del microorganismo. Los tubos que reciben una célula mostrarán crecimiento (proliferación) y los que no la tienen no mostrarán crecimiento. La proporción de tubos inoculados que muestran crecimiento es una medida de la probabilidad que se acaba de mencionar. Esta probabilidad puede convertirse nuevamente a concentración celular en la muestra, considerando el número de diluciones y el empleo de las tablas del NMP. Las tablas del NMP son una derivación estadística del número más esperado o más probables de células que producirá el patrón de crecimiento observado. Para que llegue a ser útil es procedimiento del NMP, la muestra debe diluirse lo suficiente, sino se hace esto, todas las muestras contendrán células viables y todos los tubos inoculados mostrarán crecimiento cuando se incube. Por el contrario, si la muestra ha sido muy diluida, ninguno de los tubos inoculados mostrará crecimiento. El método está diseñado para trabajar con series de 3, 5 y 10 tubos por cada dilución. Cuando mayor sea la cantidad de tubos empleados, mayor será la precisión del método. El método del número más probable (NMP) proporciona un recuento de viables. Al aumentar el factor de dilución, se alcanza un punto en el que algunos tubos contienen sólo un organismo y los otros, ninguno. A partir del número, determinado por los tubos que presentan turbidez en tres diluciones sucesivas (en este caso 5, 3, 1), puede determinarse el número más probable de células. Este valor, multiplicado por el factor de dilución nos proporciona el número de células viables de la muestra. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental El método del NMP se utiliza para contar microorganismos que son difíciles de cultivar en medio sólido. También se usa para determinar el número de células de un cultivo mixto que pueden crecer en un medio líquido determinado. Por ejemplo, puede emplearse para determinar la contaminación del agua potable, determinando el número de bacterias que pueden crecer en un medio que contiene lactosa. Estas bacterias probablemente sean Escherichia coli provenientes de aguas residuales contaminadas, y la presencia de E. coli en el agua potable es una prueba presuntiva de contaminación. f) Recuento en filtro de membrana. f.1) Introducción En 1955 la décima edición de los Standar Methods for Examinacion of Water, incluía como método tentativo en la determinación de coliformes la técnica de filtración por membrana. En las ediciones siguientes de esta publicación, éste método se hizo oficial para la determinación de coliformes. Actualmente, está siendo utilizada como un método normalizado. Cada laboratorio deber realizar pruebas comparativas con la técnica de los tubos múltiples con la finalidad de poder aplicarla mejor. Esta técnica permite examinar volúmenes muy variables de agua y ofrece resultados directos de la concentración de bacterias coliformes en lugar de un estimado estadístico, como es el caso de la técnica de los tubos múltiples. Ciertos tipos de muestras no pueden ser filtradas debido a la presencia de turbiedad, poblaciones excesivamente altas de bacterias no coliformes, o metales pesados. Estas dificultades pueden encontrarse al examinar muestras de algunas aguas de pozos, lagos pequeños o efluentes industriales. f.2) Resumen del método El procedimiento de filtración consiste en pasar con ayuda del vacío la muestra de agua a través de una membrana de celulosa de 0,45 micrones. La limitación con los volúmenes depende también de la presencia de turbiedad. Cuando se trata de aguas contaminadas es necesario diluir previamente las muestras. Para efectuar la dilución se debe tener en consideración que el número ideal de colonias en el filtro de membrana está entre 20 y 60. La muestra se filtrará a través del filtro de membrana convenientemente colocado en el soporte de filtración. El filtro es colocado en una placa de petri conteniendo un medio con agar adecuado: M-FC para coliformes fecales, temperatura de incubación 44,5ºC por 24 horas M-Endo para coliformes totales, temperatura de incubación 37ºC por 24 horas. El tiempo transcurrido desde la filtración hasta la incubación no debe exceder a los 30 minutos. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental Ventajas Los resultados son obtenidos más rápidamente, principalmente para bacterias del grupo coliformes. Volúmenes mayores de muestra pueden ser examinadas Los resultados son más precisos que los esperados por la técnica de los tubos múltiples Los equipos y materiales necesarios ocupan menor espacio con relación a la técnica de los tubos múltiples. Limitaciones En las muestras con bajo recuento de coliformes y relativamente gran cantidad de sólidos en suspensión, el crecimiento bacteriano se puede constituir a veces en una película continua sobre la superficie de la membrana, imposibilitando el recuento. Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental Ejercicios 1.- En el estudio de una curva de crecimiento a las 4 horas se determinó el número de microorganismos por el método de Breed, obteniéndose al contar 3 campos 11, 8 y 10 MO. A las 16 horas por el método de diluciones y plaqueo, tres placas presentaron 150, 215, 180 UFC, con un inoculo de 0,01 en la dilución 10-8. Calcule: a) Tiempo generacional b) K 2.- Una muestra se diluyo a la tercera parte de su volumen, posteriormente se realizaron 5 diluciones decimales y tres centesimales. A partir de la serie de diluciones centesimales, se siembran 3 series de 5 tubos por dilución, mediante NMP. Después de la incubación se obtuvieron los siguientes resultados: 534 Calcule el NMP/ml 3.- Se toma 1 litro de agua de pozo para ser analizado mediante la técnica de los tubos múltiples: de esta forma se tomaron 10 ml y se diluyeron en 90 ml de solución salina, luego se realizaron diluciones sembrándose 3 alicuotas de 1 ml de cada dilución hasta la dilución 10-3. Se obtuvieron los siguientes resultados: 532. Calcule el Nº de NMP/l. 4.- En el estudio de una curva de crecimiento a las 4 horas se determinó el número de microorganismos por el método de Breed, obteniéndose al contar 5 campos 13, 9, 7, 9 y 12 MO. A las 16 horas por el método de dilución y plaqueo, se toman 800 [mL] y de estos 10 [mL] se diluyen en 90 [mL]. Luego se hacen 7 diluciones decimales. AL sembrar en placas de la última dilución se obtienen: 310, 470, 301 UFC. A continuación se realizan 8 diluciones decimales, 2 centesimales y 7 milesimales, sembrando de la penúltima dilución en una serie de placas obteniendo como resultado: 310, 250, 130, 70, 28, 13. Calcule: a) Tiempo generacional b) K 5.- De una muestra de leche, se realizó el recuento de Breed en 6 campos distintos, contando 6, 7, 15, 4 y 8 microorganismos a las 5 horas. Luego, de 50 [mL] de leche, se tomaron 25 y se diluyen en 225 [mL] de caldo peptonado, de esa dilución, se realizaron 6 diluciones decimales, 5 centecimales y 4 milidecimales, del último tubo, se sembró en placas, obteniendo 500, 298, 150, 420, 49, 63 y 301 UFC a las 10 horas. Calcular: a) Nº microorganismos/mL b) Nº microorganismos/mL de la muestra inicial c) Constante k d) Tiempo Generacional Universidad Técnica Federico Santa María Departamento de Ingeniería Química y Ambiental 6.- Se desea conocer el número de microorganismos presente en una muestra de agua y su tiempo de duplicación. Se entrega las curvas de crecimiento y absorbancia y además se recomienda para obtener un buen resultado realizar 7 diluciones de 1 en 9. De la última dilución se mide la absorbancia obteniéndose 1.68. Absorbancia vs tiempo Curva de Crecim iento 2,5 1500000 MOml Absorbancia 2 1,5 1 1000000 500000 0,5 0 0 0 0 20 40 Tiem po [m in] 60 80 20 40 60 80 100 Tiem po [m in] 7.- Usted debe analizar una muestra de 400 [ml] de leche de cabra comprada en el mercado de Valparaíso, a continuación realiza dos procedimientos paralelos para determinar la presencia de coliformes: Procedimiento A: Se realizan 3 diluciones milesimales y se siembra 3 series de tubos por dilución, mediante NMP, con un inóculo de 0,1 [ml] en caldo BRILA. Después de la incubación, se obtuvieron los siguientes resultados: 552. Procedimiento B: Se realiza 2 diluciones decimales y 2 centesimales, de la última dilución se toma 1 [ml] y lo lleva a 99 [ml]. De esta última dilución se filtra en triplicado para M-ENDO y en triplicado para M-FC. El volumen filtrado cada vez fue de 1 [l]. Luego de incubar a condiciones que cada medio requiere, se obtuvieron 110, 70 y 55 UFC en MENDO; mientras que para M-FC se contaron 20,60 y 40 UFC. Calcule: a) Nº de coliformes totales en la muestra original determinado por NMP. b) Nº de coliformes fecales por [ml] de muestra por método de filtración c) Nº de coliformes totales por [ml] de muestra por método de filtración 8.- Se desea saber el grado de contaminación de un río. Se toman 400 [L] de los cuales se sacan 10 [mL] y se diluyen en 90 [mL]. Luego se diluye hasta la dilución 10-7. A partir de esta se realizan una siembra en 4 placas con la técnica de placa extendida, obteniendo 301, 420 y 450 UFC. Más tarde se hacen 10 diluciones más: 3 decimales, 5 centesimales y 2 milesimales, tomando de la penúltima dilución y sembrando por técnica de placa extendida en 7 placas obteniendo 380, 280, 140, 32, 29, 75 y 83 Calcular el Nº de microorganismo en la muestra original. 100