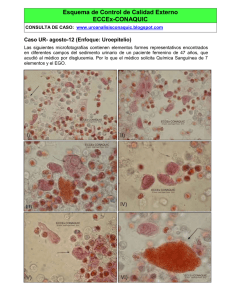
Vertidos en la cuenca Matanza- Riachuelo, Buenos Aires: Parque
Anuncio

Vertidos en la cuenca Matanza- Riachuelo, Buenos Aires: Parque Industrial Burzaco y Planta de Tratamiento de efluentes cloacales de AySA. Kevin Brigden 1, Iryna Labunska, David Santillo & Paul Johnston Nota Técnica 05/2010 del Laboratorio de Investigación de Greenpeace Contenidos Resumen……………………………………………………………………2 Introducción………………………………………………………………...7 Programa de muestreo……………………………………………………...7 Metodología………………………………………………………………...8 Resultados y discusión……………………………………………………..8 Burzaco………………………………………………………………9 Resultados…………………………………………………...10 Planta de tratamiento de aguas residuales AySA…………………..24 Resultados…………………………………………………...25 Conclusiones……………………………………………………………...30 Referencias………………………………………………………………..32 Anexo 1. Metodología Analítica………………………………………….38 1 [email protected], Laboratorio de Investigación de Greenpeace, Departamento de Innovación, Fase 2, Escuela de Biociencia, Universidad de Exeter, Exeter EX4 4RN, Reino Unido. 1 GRL-TN-05-2010 Resumen El Área Metropolitana de Buenos Aires (AMBA) incluye una gran cantidad de zonas industriales que resultan en una diversa mezcla de operaciones de manufactura, procesamiento y prestación de servicios; comprendiendo por lo general pequeñas y medianas empresas. Muchas de estas industrias descargan sus efluentes en aguas superficiales que alimentan la cuenca Matanza-Riachuelo, que fluye de oeste a este atravesando Buenos Aires antes de llegar al Río de la Plata. Algunos efluentes, tratados o no, son descargados en el Matanza o sus tributarios a través de pequeñas tuberías y caños de descarga, ya sea de un solo establecimiento industrial o de una pequeña colección de establecimientos. Otros, mediante un contrato, disponen de sus descargas en uno de los cuatro sistemas de recolección de aguas residuales municipales, cada uno servido por una planta de tratamiento. Este estudio fue diseñado para proveer un vistazo de la calidad de los vertidos industriales que están siendo descargados en dos sitios y que pueden ejemplificar el panorama general, incluyendo el rango de efluentes que descargan al Arroyo El Rey (que fluye a través del Parque Industrial Burzaco antes de unirse al Riachuelo) y tres muestras (recolectadas en días diferentes) del principal efluente de descarga de la planta depuradora Sudoeste ,ubicada en Aldo Bonzi, operada por Agua y Saneamientos Argentinos (AySA) (que descarga en el río Matanza). Entre Enero y Febrero de 2010 fueron recolectadas un total de 28 muestras (incluyendo agua de río, efluentes y sedimentos asociados) que fueron enviadas al Laboratorio de Investigación de Greenpeace en la Universidad de Exeter, Reino Unido, para un análisis cuantitativo de metales tóxicos y cualitativo de contaminantes orgánicos, tanto volátiles como extraíbles con solvente.. Parque Industrial Burzaco Las muestras fueron recolectadas del Arroyo El Rey en 11 puntos diferentes en dirección de la corriente que fluye hacia el norte atravesando el parque industrial. Las muestras recolectadas arroyo arriba, tanto de agua como de sedimentos, estaban relativamente limpias, mostrando pocos indicios de contaminación urbana o industrial. Sin embargo, en varios puntos del mismo parque industrial se detectó evidencia de aportes significativos de contaminantes llevados por el agua, incluyendo: • • Las descargas de la Planta de envasado y procesamiento de carne del Frigorifico Guiale que contenían más de 70 compuestos orgánicos, incluyendo un rango de compuestos clorados y fenólicos, tales como el Triclosan, sospechado disruptor endócrino; que pueden ser usados en el lugar para desinfección. Una muestra de sedimento recolectada junto al caño de descarga también mostró elevaciones en las concentraciones de los metales tóxicos cobre, zinc y plomo respecto a los niveles hallados aguas arriba, y respecto a niveles de fondo típicos, aunque el origen de estos contaminantes en este caso no es claro. El efluente recolectado de un desagüe pluvial que corre por debajo de la calle Ortíz, de origen desconocido, pero otra vez, soltando una compleja mezcla de compuestos orgánicos en el arroyo El Rey, incluyendo trazas del débilmente estrogénico almizcle sintético Galaxolido (HHCB), usado para realzar aromas en una amplia variedad de productos industriales y bienes de consumo. La concentración de metales tóxicos en los sedimentos en esta locación fueron 2 GRL-TN-05-2010 • • • particularmente significativos, con niveles de cromo, cobre y níquel entre 10 y 20 veces más altos que los encontrados corriente arriba. La concentración de cromo excede el umbral de “seriamente contaminado” de sedimentos determinado en Holanda. En estos sedimentos también se encontraron residuos de di y tri-clorobenceno. Dos descargas diferentes provenientes de la fábrica de radiadores C.R.A., que contenían las mayores concentraciones de metales disueltos y en suspensión de todas las muestras recolectadas en este estudio, incluyendo niveles totales de cobre entre 2030 y 2770 ug/l. En el efluente de una de estas tuberías se encontraron también concentraciones elevadísimas de zinc (9240 ug/l), mientras que la otra tubería era una fuente de plomo (483 ug/l) y cadmio (14 ug/l) para el arroyo. Este segundo efluente también contenía trazas de numerosos compuestos orgánicos persistentes, incluyendo Galaxolido y el tris(2-cloroisopropil) fosfato que es un fosfato clorado usado como ignífugo de nombre comercial Fyrol PCF. Las muestras de sedimentos recolectadas, adyacentes a las descargas de la planta C.R.A. que contenían cobre (hasta el 2.5% del peso del sedimento), zinc (hasta el 2% del peso), plomo (hasta el 0.3% del peso) y cadmio en altas concentraciones, así como también rastros de mercurio. Los niveles más altos de cobre y zinc registrados en estos sedimentos excedían por 130 y 30 veces respectivamente el umbral holandés de “seriamente contaminado”. También se encontraron trazas de di y tri-clorobenceno y del químico DEHP utilizado en la industria de los plásticos. Las descargas combinadas de los desagües pluviales de la calle Melián que, a pesar de no contener cantidades significativas de metales disueltos y en suspensión, contenían cargas complejas de compuestos orgánicos, incluyendo ftalatos plastificantes, compuestos organosulfurados y organonitrogenados, rastros de ignífugo y almizcle sintético, y del químico intermedio p-tertbutilfenol. Las muestras de agua tomadas del Arroyo El Rey aguas abajo del Parque Industrial Burzaco, aún mostraban signos de elevadas concentraciones de cobre y zinc, así como también de algunos compuestos orgánicos, aunque inevitablemente diluidos por mezclarse con el agua de río a esa altura. Muestras de sedimento de la misma locación revelaron una acumulación de metales un poco mayor, y como era de esperarse, las concentraciones de cobre, zinc, plomo, cobre y níquel eran 15, 10, 6, 2 y 2 veces mayores, respectivamente, que las determinadas en la muestra río arriba del parque industrial. Esta muestra también contenía niveles detectables de cadmio (1mg/kg), un metal que en la muestra corriente arriba no estaba presente. La situación fue cualitativamente similar con respecto a los contaminantes orgánicos, que también era de esperarse que se acumularan más en los sedimentos que en el flujo de agua, y que fueran más numerosos en las muestras río abajo que en las de río arriba. Un hallazgo significativo adicional fue la presencia en el sedimento río abajo de 5 isómeros de nonil-fenol, un compuesto bioacumulativo, persistente y tóxico que provoca trastornos hormonales, usado en la fórmula de algunos detergentes y dispersantes; pero de origen desconocido. Sumados, estos resultados demuestran que los vertidos de por lo menos algunos de los establecimientos industriales de Burzaco, están induciendo a la contaminación del agua y los sedimentos del Arroyo El Rey a medida que fluye hacia el norte a través del 3 GRL-TN-05-2010 parque industrial. Como el agua y los sedimentos suspendidos finalmente desembocan en el Riachuelo, queda claro, en definitiva, incluso desde este limitado estudio, que el Parque Industrial Burzaco es una de las fuentes de metales tóxicos y contaminantes orgánicos persistentes en la cuenca Matanza-Riachuelo. A pesar de que el Arroyo El Rey puede no ser el tributario más contaminado de la cuenca es claramente uno de varios tributarios semejantes que recibe una variedad de descargas industriales y puede, por ende, dar un ejemplo de lo que puede estar sucediendo en los otros. Serían necesarias investigaciones adicionales y más detalladas para rastrear las fuentes exactas de los contaminantes claves identificados en este estudio para extender este trabajo a otros arroyos similarmente industrializados que alimentan la cuenca MatanzaRiachuelo. Planta de tratamiento de efluentes cloacales Sudoeste de AySA, en la localidad de Aldo Bonzi Las tres muestras de efluentes tratados de la planta de tratamiento sudoeste de AySA situada en Aldo Bonzi, recolectadas en tres fechas diferentes entre el 26 de Enero y el 11 de Febrero de 2010, revelaron que este establecimiento es también una fuente significativa de metales y compuestos orgánicos persistentes que contaminan la cuenca Matanza-Riachuelo. Después de los vertidos altamente contaminados originados por la fábrica de radiadores C.R.A. en Burzaco, los efluentes tratados de esta planta municipal de tratamiento de aguas residuales contenían la mayor concentración de metales tóxicos registrada en este estudio. El rango de niveles de cromo fue de 66 a 192 ug/l, el de cobre de 59 a 205 ug/l, el de níquel de 22 a 95 ug/l, y el de zinc de 444 a 860 ug/l; aunque en todos los casos la mayor contribución fue de metales adheridos a partículas materiales suspendidas en el agua de descarga. Las concentraciones de metales en la muestra final, recolectada el 11 de Febrero, fueron alrededor del doble de las encontradas en las muestras recolectadas en las 2 ocasiones anteriores a fines de Enero, lo cual sugiere una significativa variabilidad periódica en la calidad del agua residual descargada. Este fenómeno también fue evidenciado en el monitoreo oficial de este establecimiento, publicado por el programa ACUMAR. En definitiva, los rangos de concentraciones de metales determinados en este estudio fueron similares a los previamente reportados por ACUMAR. Los sedimentos recolectados en cada ocasión de un punto del río adyacente a la tubería de descarga revelaron una contaminación metálica similar a la contenida en el mismo vertido. Una vez más, las concentraciones de cobre y zinc en las tres muestras de sedimento, y la concentración de plomo en la muestra del 11 de Febrero, fueron por encima del umbral determinado en Holanda para la identificación de sedimentos “seriamente contaminados”. Estos mismos sedimentos contenían también altos niveles de mercurio, unas 30 veces mayores a los que pueden esperarse en un curso de agua no contaminado. De las tres muestras de agua residual, pudieron aislarse entre 53 y 136 compuestos orgánicos individuales. Perteneciendo el rango más amplio a la muestra recolectada el 11 de Febrero, que es también la que mostró la mayor concentración de metales. La cantidad de compuestos que pudieron identificarse fiablemente oscilan entre 18 y 43, incluyendo los siguientes compuestos, detectados en todas las muestras independientemente de la fecha de recolección: 4 GRL-TN-05-2010 • • • • Atrazina, uno de los herbicidas más usados para el control de malezas y hierbas; Trazas de diclorobencenos Compuestos esteroides y terpenoides Hidrocarburos alifáticos Algunos compuestos que fueron identificados en por lo menos dos ocasiones incluyen: • • • • Fyrol PCF, un ignífugo Hidrocarburos Aromáticos Policíclicos (HAPs) Alquil-bencenos Trazas de compuestos orgánicos clorados volátiles como cloroformo, tricloroeteno y tetracloroeteno. Además, varios compuestos fueron detectados en una sola de las tres muestras, lo que nuevamente refleja las variaciones periódicas en la calidad final del vertido. Estos químicos incluyen metilfenol, diisoadipato, deciltetraglicol y diclorometano en la muestra del 26 de Enero. En la muestra tomada dos días después se encontraron 12 isómeros de nonilfenol, y en la última, recolectada el 26 de Febrero, el HAP fenantreno. A pesar de estas variaciones inevitables, la información total obtenida indica claramente que está ocurriendo una contaminación a través de estos vertidos que contienen un abanico de compuestos tóxicos y persistentes, algunos de los cuales están atravesando el proceso de tratamiento inalterados. El resultado de los análisis de las muestras de sedimento recolectadas en igual tiempo y locación respaldan esta observación, revelando la presencia de residuos de numerosos contaminantes orgánicos persistentes incluyendo el almizcle sintético Galaxolido, el organofosfato tóxico Chlorpyrifos usado como insecticida, el éster ftalato DEHP y trazas de bencenos clorados. Por su persistencia y toxicidad ambiental, tanto el Clorpirifos como la Atrazina (encontrados en las muestras) son reconocidas como prioritarias por el European Water Framework Directive (Directiva Marco de Agua de la Unión Europea). Una vez más, mientras que la planta municipal de tratamiento de aguas residuales de AySA es sólo una de muchas fuentes de vertidos en la cuenca Matanza-Riachuelo, no deja de ser un punto significativo. El hecho de que se pueda identificar en el efluente final, supuestamente tratado, en el punto de descarga en el ambiente acuático, un amplio rango de contaminantes industriales, nos da una idea de las limitaciones inherentes de las plantas de tratamiento convencionales en cuanto al manejo y descontaminación de las aguas residuales de la industria original. A pesar de que es imposible determinar qué proporción de la carga total de metales y contaminantes orgánicos persistentes dirigidos a la planta de tratamiento desde fuentes industriales están siendo degradados o retenidos en lodos cloacales, es evidente que ni la degradación ni la retención son capaces de prevenir que estos contaminantes primordiales sean descargados en la cuenca, y que contaminen de esta manera, el ambiente río abajo. Al mismo tiempo es probable que una proporción significativa de aquellos contaminantes más resistentes a la degradación se acumulen progresivamente en los residuos generados por la planta de tratamiento, aumentando el peligro potencial de una contaminación más amplia como resultado subsecuente al desecho de estos residuos. Conclusiones 5 GRL-TN-05-2010 Como ya fue explicado previamente, tanto el Parque Industrial Burzaco como la planta de tratamiento sudoeste de AySA son meros casos de estudio que reflejan lo que aparentemente es un problema mucho más amplio, peligroso y general de contaminación química en el agua proveniente de actividades industriales en el Área Metropolitana de Buenos Aires. Juntas, nos permiten ilustrar las consecuencias de vertidos pobremente controlados o incluso sin ningún tratamiento de por medio, de un amplio rango de unidades y/o zonas industriales y, la inhabilidad de las plantas de tratamiento de aguas residuales municipales para manejar de forma eficiente los tóxicos y químicos persistentes industriales, sea cual fuere su origen. Mientras que este estudio solo provee un vistazo limitado de fuentes de contaminación acuática con químicos peligrosos en dos áreas de Buenos Aires, también demuestra la urgente necesidad de una investigación más extensiva y detallada del problema a través de todo el AMBA, con el fin de determinar la escala y grado de severidad total. Dichas investigaciones, junto con iniciativas que apunten a hacer un inventario del corriente uso y liberación de un amplio rango de sustancias peligrosas de industrias locales, deberían proveer las bases para una forma más sustentable del manejo de químicos y protección de recursos acuíferos en el futuro. Si el propósito a largo plazo fuere la protección del ambiente y la salud, es vital establecer un objetivo a cumplirse inmediatamente de “vertido cero” de los compuestos más peligrosos tanto orgánicos como inorgánicos utilizados hoy en día por la industria; implementando en lo posible un reemplazo progresivo de sustancias peligrosas por otras alternativas menos nocivas o preferentemente no-tóxicas. Dichas políticas a las que apuntamos son científicamente comprobables y tecnológicamente posibles; y ya fueron desarrolladas (y están siendo implementadas) en otras partes del mundo, incluyendo zonas de la Unión Europea, Noreste Atlántico (OSPAR) y la región Báltica (HELCOM). 6 GRL-TN-05-2010 Introducción Este estudio investigó la presencia de químicos peligrosos en descargas directas de aguas residuales al ambiente acuático de establecimientos industriales en el área del Gran Buenos Aires. Muestras de aguas residuales y sedimentos asociados de los cursos de agua receptores fueron recolectadas en dos áreas para ser analizadas: el arroyo El Rey en la localidad de Burzaco al sur de Buenos Aires, y la planta municipal de tratamiento de aguas residuales de AySA que recibe una mezcla de residuos industriales y municipales de la región sudoeste del AMBA y descarga en el río Matanza-Riachuelo. En la zona de Burzaco (Parque Industrial Burzaco), existen establecimientos que comprenden un amplio rango de actividades industriales que descargan sus efluentes en el arroyo El Rey, que es un tributario que corre hacia el norte hasta unirse al canal principal del río Riachuelo. En algunas circunstancias, las aguas residuales de establecimientos individuales del parque industrial son descargadas en tuberías subterráneas comunes, y son subsecuentemente descargadas en el arroyo. En el AMBA, el sistema municipal de cloacas está actualmente dividido en cuatro sectores: Sudoeste, Norte, Ezeiza y Berazategui. Cada una de estas cloacas fluye hacia una planta de tratamiento diferente. La región sudoeste recolecta una porción de los efluentes totales generados en una zona del partido de La Matanza, que son enviados a la planta para ser tratados. Esta planta está ubicada en Aldo Bonzi, cerca del Mercado Central. Es la más antigua de las cuatro plantas y fue construida en el año 1972. La planta Sudoeste es operada por Agua y Saneamientos Argentinos (AySA). Esta empresa estatal es la responsable de la recolección, transporte, tratamiento y disposición de las aguas residuales, incluyendo los efluentes que el sistema vigente permite descargar en la cloaca. Esta planta de tratamiento provee de sus servicios a una población de 575.000 habitantes, con una capacidad de tratamiento de 170.000 m3/día. Utilizan tanques de decantación para retener sólidos (tratamiento primario), con un subsecuente tratamiento biológico del agua remanente, seguido de una clarificación que separa los materiales sólidos de los líquidos (tratamiento secundario). AySA dice llevar a cabo controles de calidad en las aguas residuales recibidas para asegurarse de la calidad de éstas. Programa de muestreo Las dos áreas investigadas en este estudio (el arroyo El Rey en Burzaco, y la planta de tratamiento de aguas residuales de AySA) fueron visitadas entre Enero y Febrero de 2010, y se recolectó un total de 28 muestras entre efluentes, agua de río y sedimentos. En Burzaco, se recolectaron efluentes de varios caños que descargan en el arroyo El Rey. Por cada punto de descarga, se recolectó también una muestra de sedimento, ya sea de la porción del arroyo adyacente a la tubería o una mezcla de sedimento de adentro de la tubería y del arroyo adyacente a la descarga. Además, muestras de agua y sedimentos fueron recolectadas en dos ubicaciones, una río arriba y otra corriente abajo de todas las tuberías de descarga contempladas en este estudio. La planta de tratamiento de aguas residuales AySA fue visitada en tres ocasiones diferentes, y en cada una de ellas fue tomada una muestra de efluente en el punto de descarga en el río Matanza-Riachuelo, y una muestra de sedimento de la porción de río adyacente a la tubería. 7 GRL-TN-05-2010 En todos estos casos, las muestras fueron recolectadas y almacenadas en botellas de vidrio que fueron previamente enjuagadas con ácido nítrico y un grado analítico de pentano con el fin de remover todos los residuos orgánicos y metales pesados. Las muestras de agua residual y de agua de río fueron recolectadas en botellas de 1 litro con tapa a rosca para ser sometidas a un análisis cuantitativo de metales y cualitativo de compuestos orgánicos semi-volátiles (extraídos por disolución).Una muestra duplicada fue recolectada en botellas de 125ml color ámbar con un tapón de vidrio esmerilado (llenadas sin dejar espacio en cabeza) para el análisis de químicos orgánicos volátiles. Las muestras de sedimento fueron recolectadas en botellas de 100ml con tapa a rosca. Todas las muestras fueron inmediatamente enfriadas y conservadas en frío y a oscuras durante su traslado a la Universidad de Exeter en el Reino Unido para ser analizadas. En el Anexo se presenta una descripción detallada de la preparación de las muestras y los procedimientos de análisis. Metodología Diferentes análisis fueron llevados a cabo sobre las muestras de agua residual, agua de río y sedimentos. Las concentraciones de metales pesados para todas la muestras fueron determinadas mediante una espectrometría de emisión atómica por plasma de acoplamiento inductivo (ICP-AES), previa digestión ácida, y utilizando materiales de referencia certificados además de cumplir con las reglas internas del laboratorio. Muchas muestras de agua contenían sólidos disueltos, es por eso que, para todas las muestras, determinamos separadamente las concentraciones totales (sin filtrar), y disueltas en una muestra filtrada. Los compuestos orgánicos extraíbles fueron aislados e identificados en la medida de lo posible utilizando la cromatografía gaseosa y espectrometría de masas (GC-MS), previa extracción acelerada con solventes para las muestras sólidas con una mezcla de pentano y acetona; o extracción en fase sólida con etil acetato, pentano y tolueno para las muestras de agua. Los compuestos orgánicos volátiles (VOCs) fueron identificados y cuantificados en las muestras de aguas residuales a como fueron recibidas (sin un tratamiento previo) utilizando GC-MS con el sistema de introducción de la muestra con HeadSpace. Un listado de VOCs cuantificados en las muestras de agua con sus correspondientes límites de detección y cuantificación es presentado en la Tabla 6 del Anexo. Ningún VOC investigado en este estudio fue detectado por encima del nivel de cuantificación. Resultados y discusión Los resultados de los análisis de las muestras de agua y sedimento son presentados y discutidos en la siguiente sección, en forma separada para cada una de las dos áreas investigadas. Algunos químicos clave fueron identificados en muestras de más de una locación, y por ello se adiciona información al respecto a lo largo del texto de discusión en los Cuadros A-F. 8 GRL-TN-05-2010 Es preciso remarcar que todos los metales cuantificados en este estudio son encontrados naturalmente en muestras no contaminadas, tanto de agua como de sedimentos, aunque en concentraciones bajas. El aporte de fuentes puntuales, tales como las descargas industriales pueden, sin embargo, aumentar estos niveles hasta exceder ampliamente las concentraciones naturales. La siguiente sección se enfoca en aquellos metales encontrados en las muestras cuyas concentraciones están por encima de los niveles del agua no contaminada, y que por ende prueban la significativa contribución de la industria u otras fuentes antropogénicas. Burzaco En el área de Burzaco, las muestras de aguas residuales fueron recolectadas en varios puntos de descarga en el arroyo El Rey. Por cada punto de descarga, se recolectó también una muestra de sedimento, ya sea de la porción de arroyo adyacente a la tubería o una mezcla de sedimento de adentro de la tubería y del arroyo adyacente a la descarga. En la Tabla 1 se presentan los detalles de todas las muestras asociadas con los vertidos en el Arroyo El Rey en la zona de Burzaco, y en la Figura 1 se ilustra un mapa que indica las locaciones de donde se extrajeron las muestras. Figura 1. Croquis del Arroyo el Rey en Burzaco, Buenos Aires, mostrando las ubicaciones donde fueron recolectadas las muestras de tuberías de descarga y de la corriente misma. 9 GRL-TN-05-2010 MUESTRA TIPO AR10001 Agua residual AR10002 Sedimento AR10003 Agua residual AR10004 Sedimento AR10005 AR10006 AR10007 AR10008 AR10009 Agua del arroyo Sedimento del arroyo Agua del arroyo Sedimento del arroyo Agua residual AR10010 Sedimento AR10011 Agua residual AR10012 Sedimento AR10013 Agua residual AR10014 Sedimento AR10015 Agua residual AR10016 Sedimento AR10017 Agua residual AR10018 Sedimento AR10019 Agua residual AR10020 Sedimento AR10021 Agua residual AR10022 Sedimento DESCRIPCIÓN Tubería de descarga de la Instalación del arroyo El Rey adyacente a la tubería Tubería de descarga de la Instalación del arroyo El Rey adyacente a la tubería Río arriba del Parque Industrial Burzaco Río arriba del Parque Industrial Burzaco Río abajo del Parque Industrial Burzaco Río abajo del Parque Industrial Burzaco INSTALACIÓN: ACTIVIDAD PRINCIPAL Diransa: Pintura, Barnices, Adhesivos Guiale: Procesamiento y Envasado de Carne Arroyo El Rey (Río Arriba) Arroyo El Rey (Río Abajo) Desagüe pluvial de la calle Viel del arroyo El Rey adyacente al desagüe Desagüe pluvial de la calle Melián del arroyo El Rey adyacente a al desagüe Tubería de descarga 1 (la más cercana a la calle Cuyo) del arroyo El Rey adyacente a la tubería 1 Tubería de descarga 2 (la más cercana a la calle Ortíz) Mezcla de sedimentos de adentro de la tubería 2 y del arroyo El Rey adyacente a la misma Tubería de descarga escondida , de la calle Ortíz Mezcla de sedimentos de adentro de la tubería y del arroyo El Rey adyacente a la misma Larga tubería de cemento para descargas de la Instalación del arroyo El Rey contigua a la tubería 2do y más pequeño desagüe de la calle Melian (cerca de AR10011) Mezcla de sedimentos de adentro del desagüe y del arroyo El Rey adyacente al mismo Varios Varios C.R.A.: Fábrica de Radiadores C.R.A.: Fábrica de Radiadores Desconocido Fradealco: Alcohol y Productos de Limpieza, Lavandina, Vinagre, Azufre Varias: Cercana a una Compañía de Pintura, y Fábrica de Barnices, Colores, Pigmentos Tabla 1 - Descripción de muestras recolectadas de los desagües en la vecindad del arroyo El Rey, Burzaco, Buenos Aires, Argentina 2010. Resultados La información obtenida de los análisis se encuentra resumida en las Tablas 2a-2c, y es discutida en las siguientes secciones para cada vertido o conjunto de vertidos en el arroyo El Rey. 10 GRL-TN-05-2010 Arroyo El Rey, río arriba El agua del arroyo El Rey (AR10005) y el sedimento (AR10006) que se recolectaron río arriba de las descargas muestreadas no contenía niveles de metales por encima de los usualmente encontrados en aguas superficiales o sedimentos no contaminados. Se aislaron ocho compuestos orgánicos de la muestra de sedimento y sólo cuatro de ellos, todos hidrocarburos alifáticos, fueron identificados con un alto grado de confiabilidad. La muestra de agua no tenía niveles detectables de compuestos orgánicos. Diransa (fábrica de pintura/barnices/adhesivos) Yendo río abajo, el efluente del establecimiento de Diransa (AR10001) no contenía niveles elevados de los metales cuantificados, y el sedimento asociado (AR10002) contenía niveles similares para todos lo metales a aquellos encontrados en el sedimento no contaminado de río arriba (AR10006). Tanto la muestra de agua como la de sedimento de esta locación contenían sólo una pequeña cantidad de compuestos orgánicos (10 y 12 respectivamente) y sólo el benzaldehído (que puede ser de origen natural) fue confiablemente identificado en la muestra de sedimento. Se identificaron dos compuestos orgánicos en la muestra de agua, ambos eran hidrocarburos alifáticos. MUESTRA AR10005 TIPO Agua del arroyo BREVE DESCRIPCIÓN El Rey, río arriba METAL Antimonio Arsénico Bario Cadmio Cromo Cromo (VI) Cobalto Cobre Plomo Manganeso Mercurio Níquel Selenio Vanadio Zinc pH Nro de compuestos orgánicos aislados Nro de compuestos organicos identificados de forma confiable (% del total) Bencenos clorados Fenoles clorados Otros fenoles Alquil-bencenos Indol y derivados HAPs Terpenoides Galaxolido Esteroides Hidrocarburos alifáticos Otros compuestos Compuestos volátiles: Disulfuro, Dimetil Cloroformo Totales (µg/l) <20 <50 52 <10 <20 <50 <20 <20 <50 59 <2 <20 <200 110 20 Disueltos (µg/l) <20 <50 37 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 118 <10 7 AR10006 Sedimento del arroyo El Rey, río arriba (mg/kg) <20 <20 199 <1 26 _ 13 21 14 558 0.5 11 <30 59 73 _ AR10001 AR10002 AR10003 AR10004 AR10017 AR10018 Agua residual Sedimento Agua residual Sedimento Agua residual Sedimento Tubería de Diransa adyacente a la tubería Tubería de Guiale adyacente a la tubería Desagüe calle Ortíz Tubería + Arroyo Totales (µg/l) <20 <50 41 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 93 <10 Disueltos (µg/l) <20 <50 38 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 105 <10 7 (mg/kg) <20 <20 213 <1 23 _ 13 23 13 431 0.8 13 <30 65 93 _ Totales (µg/l) <20 <50 63 <10 <20 <50 <20 30 <50 39 <2 <20 <200 101 128 Disueltos (µg/l) <20 <50 32 <10 <20 <50 <20 <20 <50 36 <2 <20 <200 67 78 7 (mg/kg) <20 <20 269 <1 71 _ 11 93 102 616 0.9 31 <30 63 280 _ Totales (µg/l) <20 <50 112 <10 <20 <50 <20 22 <50 51 <2 <20 <200 47 74 Disueltos (µg/l) <20 <50 106 <10 <20 <50 <20 <20 <50 23 <2 <20 <200 38 <10 7 (mg/kg) <20 <20 104 <1 514 _ 25 233 119 2100 0.2 152 <30 32 164 _ 5 8 12 10 79 10 28 12 0 4(50%) 2(17%) 1(10%) 30(38%) 1 4 2 2 4 3 2 5(50%) (2) 13(46%) (1) 9(50%) (3) 1 1 1 4 2 1 6 3 3 9 2 5 1 (1) Tabla 2a. Compuestos orgánicos identificados, y concentraciones de metales y metaloides, en las muestras de agua residual y sedimentos asociados con los vertidos en la vecindad del Arroyo El Rey, en la zona de Burzaco, Buenos Aires, Argentina 2010. Las muestras de los sitios que van desde río arriba a río abajo se presentan de izquierda a derecha. (..) corresponde a compuestos orgánicos traza utilizando el método SIM (monitoreo selectivo de iones). Las concentraciones en las muestras de agua residual y agua de río son dadas en μg/l tanto para las concentraciones totales de la muestra completa como para las 11 GRL-TN-05-2010 concentraciones disueltas de las muestras filtradas; las concentraciones para sedimentos son dadas en mg/kg de peso seco. MUESTRA TIPO BREVE DESCRIPCIÓN METAL Antimonio Arsénico Bario Cadmio Cromo Cromo (VI) Cobalto Cobre Plomo Manganeso Mercurio Níquel Selenio Vanadio Zinc pH Nro. de compuestos orgánicos aislados Nro. de compuestos organicos identificados de forma confiable(% del total) Bencenos clorados Alquil-bencenos Ftalatos Terpenoides Galaxolido Firol PCF (check) Esteroides Hidrocarburos alifáticos Otros compuestos Compuestos volátiles: Tricloro-eteno AR10015 AR10016 AR10013 AR10014 AR10009 Agua residual Sedimento Agua residual Sedimento Agua residual C.R.A. - Tubería 2 Tubería 2 + Arroyo C.R.A. - Tubería 1 Tubería 1 + Arroyo Desagüe pluvial de la calle Viel Totales (µg/l) <20 <50 92 14 <20 <50 <20 2770 483 106 <2 <20 <200 44 429 Disueltos (µg/l) <20 <50 102 <10 <20 <50 <20 1215 171 102 <2 <20 <200 41 331 Totales (µg/l) <20 <50 36 <10 <20 <50 <20 2030 250 <10 <2 <20 <200 86 9240 Disueltos (µg/l) <20 <50 141 <10 <20 <50 <20 935 <50 <10 <2 <20 <200 69 7070 7 Totales (µg/l) <20 <50 175 <10 <20 <50 <20 <20 <50 25 <2 <20 <200 63 34 Disueltos (µg/l) <20 <50 67 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 70 14 7 (mg/kg) <20 <20 229 <1 44 _ 13 32 15 588 0.3 14 <30 63 98 _ AR10019 AR10020 Agua residual Sedimento Tubería de Fradealco Porción del Arroyo adyacente Totales (µg/l) <20 <50 55 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 88 14 Disueltos (µg/l) <20 <50 55 <10 <20 <50 <20 <20 <50 <10 <2 <20 <200 95 <10 7 7 (mg/kg) <20 <20 213 12 35 _ 10 24700 300 333 0.8 20 <30 119 957 _ 32 23 35 14 34 11 24 11 12(38%) 17(74%) 11(31%) 7(50%) 9(26%) 4(36%) 8(33%) 4(36%) 9 4 8 4 (4) (mg/kg) <20 45 187 2 86 _ 11 8870 2780 520 4.1 39 <30 152 20000 _ AR10010 Sedimento del arroyo Porción del Arroyo adyacente (mg/kg) <20 <20 207 <1 14 _ 10 17 7 501 0.6 8 <30 41 51 _ (1) 1 1 5 1 1 2 3 11 9 6 1 (1) Tabla 2b. Compuestos orgánicos identificados, y concentraciones de metales y metaloides, en muestras de agua residual y sedimentos de vertidos en la vecindad del Arroyo El Rey en la zona de Burzaco, Buenos Aires, Argentina 2010. Las muestras de los sitios que van desde río arriba a río abajo se presentan de izquierda a derecha. (..) corresponde a compuestos orgánicos traza utilizando el método SIM (monitoreo selectivo de iones). Las concentraciones en las muestras de agua residual y agua de río son dadas en μg/l tanto para las concentraciones totales de la muestra completa como para las concentraciones disueltas de las muestras filtradas; las concentraciones para sedimentos son dadas en mg/kg de peso seco. 12 GRL-TN-05-2010 MUESTRA TIPO BREVE DESCRIPCIÓN METAL Antimonio Arsénico Bario Cadmio Cromo Cromo (VI) Cobalto Cobre Plomo Manganeso Mercurio Níquel Selenio Vanadio Zinc pH Nro. de compuestos orgánicos aislados Nro. de compuestos organicos identificados de forma confiable (% del total) Bencenos clorados DiNP Otros Ftalatos HAPs Indol y derivados Derivados de benzotiazol Cyclic diene derivs? Nonilfenol Otros fenoles Galaxolido Fyrol PCF?? Terpenoides Esteroides Hidrocarburos alifáticos Otros compuestos AR10011 AR10012 AR10021 AR10022 AR10007 Agua residual Sedimento Agua residual Sedimento Agua del Arroyo Desagüe pluvial de la calle Melian Porción de Arroyo adyacente Desagüe pluvial de la calle Melian 2 Tubería + Arroyo El Rey, río abajo Totales (µg/l) <20 <50 50 <10 <20 <50 <20 <20 <50 53 <2 <20 <200 87 22 Disueltos (µg/l) <20 <50 54 <10 <20 <50 <20 <20 <50 30 <2 <20 <200 77 12 Totales (µg/l) <20 <50 99 <10 <20 <50 <20 30 <50 136 <2 <20 <200 41 200 Disueltos (µg/l) <20 <50 64 <10 <20 <50 <20 <20 <50 17 <2 <20 <200 31 27 Totales (µg/l) <20 <50 66 <10 <20 <50 <20 59 <50 64 <2 <20 <200 68 117 Disueltos (µg/l) <20 <50 69 <10 <20 <50 <20 23 <50 56 <2 <20 <200 61 49 AR10008 Sedimento del arroyo El Rey, río abajo 7 (mg/kg) <20 <20 128 <1 47 _ 7 75 41 384 0.7 13 <30 31 167 _ 7 (mg/kg) <20 <20 177 <1 17 _ 9 22 7 494 0.2 9 <30 56 67 _ 7 (mg/kg) <20 <20 194 <1 55 _ 11 326 81 368 1 22 <30 87 755 _ 28 124 33 10 12 82 9(32%) 47(38%) (2) 17 14(42%) (1) 5(50%) 2(17%) 36(44%) (2) 3 1 1 2 1 1 1 1 1 1 2 6 1 1 8 1 22 1 1 5 1 5 1 1 1 1 19 1 Tabla 2c. Compuestos orgánicos identificados, y concentraciones de metales y metaloides, en las muestras de agua residual y sedimentos asociados con los vertidos en la vecindad del Arroyo El Rey, en la zona de Burzaco, Buenos Aires, Argentina 2010. Las muestras de los sitios que van desde río arriba a río abajo se presentan de izquierda a derecha. (..) corresponde a compuestos orgánicos traza utilizando el método SIM (monitoreo selectivo de iones). Las concentraciones en las muestras de agua residual y agua de río son dadas en μg/l tanto para las concentraciones totales de la muestra completa como para las concentraciones disueltas de las muestras filtradas; las concentraciones para sedimentos son dadas en mg/kg de peso seco. Frigorifico Guiale: procesamiento y envasado de carne El agua residual descargada por el establecimiento de procesamiento y envasado Guiale (AR10003) contenía un total de concentraciones de cobre y zinc levemente elevadas por sobre las concentraciones de fondo de aguas superficiales, aunque las concentraciones disueltas de dichos metales, eran ambas de algún modo menores. En contraste, la carga de compuestos orgánicos en esta muestra fue bastante elevada, con 79 compuestos aislados. Entre ellos, 30 compuestos orgánicos fueron confiablemente identificados, incluyendo una variedad de compuestos clorados. Se detectaron 6 compuestos fenólicos en esta muestra: fenol; su derivado metilado 4 metilfenol, 2 metilfenoles clorados y fenoxifenol clorado también conocido como Triclosan. A pesar de que se desconoce el origen preciso de dichos compuestos en el vertido de una planta de procesamiento y envasado de carne, es posible que provengan de preparados antibacterianos o desinfectantes usados en el lugar. El Triclosan es un agente desinfectante antimicrobiano que es usado en una gran variedad de bienes de consumo, y fue detectado en muchos medios en otras partes del 13 GRL-TN-05-2010 mundo, incluyendo aguas superficiales de ríos (Hua et al. 2005), aguas residuales tratadas y lodos biosólidos (Coogan et al. 2007) y también en el cuerpo humano incluso en leche materna (Allmyr et al. 2006a), plasma (Allmyr et al. 2006a), y orina (Calafat et al. 2008). Debido a la remoción incompleta del Triclosan en el tratamiento de aguas residuales, es ubicuo en el medio ambiente. Recientemente se demostró que el Triclosan es un potente inhibidor de la sulfonación del estradiol y la estrona en la placenta ovina (James et al. in press). Los resultados de este estudio sugieren que la exposición de ovejas preñadas, y por analogía, de mujeres embarazadas al Triclosan podría peligrar la gestación mediante la reducción de la secreción total de estrógeno placental, reduciendo por ende la acción del estrógeno en tejidos clave críticos para mantener la preñez. Otro compuesto clorado, el 1,4 diclorobenceno, bien conocido por ser un contaminante ambiental muy utilizado como desodorante y desinfectante en productos sanitarios, también fue identificado. En el Cuadro A se presenta información adicional acerca de los bencenos clorados. El dimetil disulfuro es un compuesto orgánico volátil tóxico y muy oloroso con una acción similar a la del sulfuro de hidrogeno; y también fue detectado en esta muestra. Muy posiblemente provenga de la degradación de materia orgánica y/o del uso de compuestos sulfurados durante el procesamiento de la carne. Se detectaron tres hidrocarburos aromáticos policíclicos (HAPs), a saber: fenantreno, naftaleno y un derivado hidrogenado del naftaleno. Otros de los compuestos aromáticos presentes incluían el Indol y tres de sus derivados, junto con dos alquilo bencenos. Esta muestra también mostró la presencia de cloroformo a nivel de trazas. Adicionalmente, la muestra contenía varios hidrocarburos alifáticos, terpenoides naturales y el esteroide colesterol. El sedimento asociado (AR10004) también contenía cobre y zinc, así como también plomo, a niveles de algún modo superiores comparados con el sedimento río arriba (AR10006), lo cual puede indicar una acumulación de cobre y zinc en el sedimento en esta locación a causa de la continua descarga de estos metales en el vertido. La fuente de plomo no es clara. De todos modos, los niveles de estos tres metales en el sedimento (AR10004) son sólo 2-3 veces superiores a los rangos de concentración esperados para sedimentos de río no contaminados. A pesar de estar presentes en una mayor concentración que la de los sedimentos río arriba (AR10006), los niveles de cromo y níquel presentes en el sedimento adyacente a la descarga de Guiale se encuentran en el rango de concentraciones esperado para sedimentos no contaminados en otras locaciones. Se aislaron sólo 10 compuestos orgánicos de la muestra de sedimento. No obstante, dos de ellos fueron confiablemente identificados como diclorobencenos, uno de los cuales, el 1,4 diclorobenceno, también fue detectado en la muestra de agua residual AR10003. Se presenta más información sobre bencenos clorados en el Cuadro A. Otros compuestos identificados en esta muestra fueron hidrocarburos alifáticos. 14 GRL-TN-05-2010 Cuadro A. Bencenos Clorados Los bencenos clorados, o clorobencenos, son derivados clorados simples del benceno, que poseen entre uno y seis átomos de cloro (o sea de mono- a hexaclorobenceno). Los clorobencenos, especialmente las formas mono-, di-, tri- y hexacloradas, tuvieron una variedad de usos como solventes (en formulaciones comerciales de PCB (bifenilos policlorados)), y productos intermedios en la fabricación de otros químicos como antioxidantes, tinturas y pigmentos, productos farmacéuticos y químicos agrícolas. Hoy en día solo el mono- y el diclorobenceno siguen siendo fabricados en cantidades sustanciales. Los clorobencenos son relativamente persistentes y pueden bioacumularse tanto en sistemas terrestres como acuáticos. Se han reportado efectos tanto agudos como crónicos en un amplio rango de organismos acuáticos y en mamíferos. Las reacciones a la exposición varían dependiendo del clorobenceno en cuestión, aunque los impactos más comunes son en hígado, tiroides y sistema nervioso central (SNC). En líneas generales, la toxicidad aumenta con el grado de cloración (WHO 2004). Por ejemplo, la exposición humana al monoclorobenceno causa depresión del SNC e irritación del tracto respiratorio, mientras que los estudios en animales reflejan necrosis hepática, intoxicación renal y efectos en el páncreas, sangre, linfa y glándulas suprarrenales (Ware 1988a, Meek et al. 1994). Los efectos reportados para el diclorobenceno en humanos incluyen anemia, lesiones cutáneas, vómitos, jaquecas e irritación de los ojos y del tracto respiratorio (Ware 1988b). Un estudio más reciente (Yan et al. 2008) reportó que el 1,4 diclorobenceno puede afectar la transducción de señales neuronales en las células del neuroblastoma humano SH-SY5Y al interferir con las actividades funcionales de los receptores de acetilcolina. Para los tri- y tetraclorobencenos, los impactos más comunes en mamíferos son en hígado, riñón y tiroides (Giddings et al. 1994a, b). Se presentó también algo de evidencia de toxicidad fetal y de desarrollo relacionada con la exposición a tetra- y pentaclorobencenos. Descarga en la calle Ortíz El agua residual de origen desconocido descargada vía una tubería oculta proveniente de la calle Ortíz (AR10017) también contenía concentraciones totales de cobre y zinc ligeramente elevadas en comparación con las concentraciones de fondo del agua superficial, aunque ligeramente menores en comparación al vertido de Guiale. De todos modos, las concentraciones disueltas de estos metales estaban por debajo del límite de detección para los métodos utilizados. Se aislaron 28 compuestos orgánicos de esta muestra de agua residual. De 13 compuestos que fueron confiablemente identificados, predominaron los hidrocarburos alifáticos. Sin embargo, una vez más, se detectaron niveles de traza de 1,4 diclorobenceno. Esta muestra también contenía Galaxolido (HHCB), un almizcle policíclico (conocido también como almizcle blanco) que es utilizado como realzador de fragancias en la industria de la perfumería y en un amplio rango de productos de cuidado personal. Este químico fue detectado en vertidos de aguas residuales y aguas superficiales en otros países (Rimkus 1999), y se informó recientemente que es el almizcle sintético más abundante en las descargas a los estuarios Tamar y Plym en el Reino Unido (Sumner et al. 2010). En efecto, las descargas de plantas de tratamiento de aguas residuales son consideradas la primer vía a través de la cual estos compuestos ingresan a los ambientes acuáticos. El Galaxolido también fue detectado en el cuerpo humano, incluso en la sangre (Hutter et al. 2005). Es sabido que posee una débil actividad estrogénica in Vitro, y ahora se cree que la importancia in vivo fue hasta la fecha, subestimada por muchos; especialmente cuando 15 GRL-TN-05-2010 se encuentra presente como uno de los componentes de complejas mezclas de compuestos hormonalmente activos (van der Burg et al. 2008). En esta muestra también se detectaron dos alcoholes de ácido graso, el 1-dodecanol y el 2-etilhexanol (2-EH). El dodecanol, también conocido como dodecil alcohol o alcohol laurílico, es usualmente obtenido de aceites de plantas naturales por reducción y tiene una variedad de usos que incluyen la producción de surfactantes, aceites lubricantes y productos farmacéuticos. El uso principal del 2-etilhexanol es en la producción del éster de ftalato bis (2-etilhexil) ftalato (DEHP), un plastificante normalmente usado para suavizar el plástico PVC y que es regulado en Europa como “tóxico para la reproducción”. El 2-etilhexanol es en sí mismo un compuesto tóxico que puede irritar la piel, los ojos y el tracto respiratorio. También puede causar nauseas y jaquecas después de su inhalación, y diarrea y vómitos después de su ingestión. La muestra de sedimento asociado (AR10018), una mezcla de sedimento de adentro de la tubería y del arroyo El Rey adyacente a ella, contenía niveles elevados de cromo, cobre y níquel, y en menor medida plomo, manganeso y zinc. Los niveles de cromo, cobre y níquel eran entre 10 y 20 veces más elevados que los encontrados en el sedimento corriente arriba del arroyo El Rey (AR10006). Las concentraciones de cromo y níquel fueron las más altas de todas las muestras de sedimentos de este estudio. Los estándares para definir umbrales de concentración de metales aceptables en sedimentos de río aún no han sido definidos en Argentina. De todos modos las concentraciones de cromo exceden el nivel de umbral para sedimentos seriamente contaminados de Holanda (ver la Tabla A1 en el Cuadro B (NMHSPE 2000). A pesar de que se aisló una cantidad relativamente baja de compuestos orgánicos en esta muestra (12 compuestos), tres de los 9 compuestos identificados de forma confiable eran bencenos clorados, incluyendo dos diclorobencenos y un benceno triclorado. Uno de estos diclorobencenos, el 1,4 diclorobenceno también se detectó (aunque a nivel de trazas) en la correspondiente muestra de agua AR10017. Se presenta más información sobre bencenos clorados en el Cuadro A. Es bastante común que las muestras de sedimento en zonas de vertidos acumulen químicos que fueron descargados en un período de tiempo, proveyendo así una imagen de los aportes de los contaminantes integrados en el tiempo. Es posible que éste sea el caso aquí, aunque sin una información clara de los orígenes industriales de este vertido en particular, es imposible afirmarlo. Fábrica de radiadores C.R.A. De todas las muestras de agua residual analizadas, aquellas descargadas por la fábrica de radiadores C.R.A. eran las más contaminadas con metales. El vertido de ambas tuberías contenía concentraciones totales de cobre altas y similares (2030-2770 μg/l), y concentraciones disueltas justo por debajo de la mitad de la carga total para ambas muestras. El agua residual descargada a través de la tubería más cercana a la calle Cuyo (AR10013) también contenía una alta concentración de zinc (9240 μg/l) predominantemente en formas disueltas, y en menor medida plomo. El agua residual descargada a través de la tubería más cercana a la calle Ortíz (AR10015) contenía aproximadamente el doble de la concentración total de plomo (483 μg/l), aunque una concentración de zinc mucho menor. Este agua residual también contenía cadmio a 14 16 GRL-TN-05-2010 μg/l, que es un nivel elevado para las concentraciones de fondo de este metal tóxico que generalmente está presente en el ambiente en concentraciones muy bajas. Cuadro B. Metales Cadmio (Cd) Es un metal raro que se encuentra en la naturaleza en concentraciones muy bajas, por lo general debajo de los 2mg/kg en sedimentos (Alloway 1990, ATSDR 2008). Cuando es liberado en ambientes acuáticos, el cadmio es más móvil que la mayoría de los metales (ATSDR 2008). Este metal tiene muchos usos, incluso es usado en aleaciones y enchapados (ATSDR 2008, Hawkins et al. 2006). No se le conocen funciones bioquímicas ni nutricionales y es un elemento altamente tóxico para plantas, animales y humanos (ATSDR 2008, WHO 1992). El cadmio es un tóxico acumulativo y la exposición a largo plazo puede resultar en daño renal y toxicidad ósea. Estudios relativamente recientes han demostrado que los niveles de exposición que causan daño renal en humanos son más bajos de los previamente anticipados (Hellstrom et al. 2001). Otros efectos nocivos para la salud ocasionados por la exposición al cadmio incluyen alteraciones de los mecanismos del calcio que se reflejan en problemas óseos, desarrollo de hipertensión (presión sanguínea alta) y enfermedades cardíacas. En el corto plazo la inhalación de vapores o polvo de óxido de cadmio también pueden afectar el sistema respiratorio (ATSDR 2008, Godt et al. 2006, WHO 1992). Además, se sabe que el cadmio y sus compuestos son carcinogénicos para el ser humano, especialmente cáncer de pulmón en consecuencia de la inhalación (DHSS 2005). Cromo (Cr) Es usado principalmente en la industria metalúrgica (para la fabricación de acero inoxidable y otras aleaciones), así como también en varios procesos industriales tales como el curtido de cueros. Los compuestos con cromo hexavalente son usados en acabados metálicos (enchapado en cromo), en conservantes de maderas y en anticorrosivos (ATSDR 2008b). El cromo en la naturaleza prevalece en su forma trivalente Cr (III) y es de baja solubilidad, tiende a precipitar rápidamente o es adsorbido por partículas en suspensión o sedimentos de fondo. La forma hexavalente Cr (VI) puede existir, pero es mucho más escaso, y suele ser rápidamente convertido en Cr (III) por compuestos reductores. Las formas hexavalentes se disuelven fácilmente en agua, y por ende puede tener una gran movilidad en ambientes acuáticos (ATSDR 2008b, DeLaune et al. 1998, Lin 2002). El Cr(III) es un nutriente esencial para plantas y animales, aunque las altas dosis pueden ser perjudiciales. Por el contrario, la forma hexavalente es altamente tóxica aún en concentraciones mínimas, incluso para muchos organismos acuáticos (Baral et al. 2006). Los compuestos de cromo hexavalente son también corrosivos, y en seres humanos se manifiestan alergias cutáneas luego de una exposición, independientemente de la dosis (ATSDR 2008b). Además, el cromo hexavalente es conocido como carcinogénico para los seres humanos en algunas circunstancias (IARC 1990). Cobre (Cu) Es un metal muy utilizado, ya sea como metal puro o como parte de aleaciones, y también los compuestos con cobre tienen una gran variedad de usos, como por ejemplo algunos acabados metálicos. Uno de los principales usos del cobre y sus aleaciones es la fabricación de materiales de plomería, en parte debido a su maleabilidad y capacidad de conducción del calor (ATSDR 2004). Los niveles de cobre en el ambiente son generalmente bajos, comúnmente menos de 50mg/kg en sedimentos de cursos de agua no contaminados (ATSDR 2004), y menos de 30 mg/kg en suelos (Alloway 1990). Las concentraciones de cobre soluble en aguas superficiales no contaminadas pueden variar significativamente, pero los niveles están normalmente debajo de los 10 μg/l, y frecuentemente son mucho menores (ATSDR 2004, Comber et al. 2008). El cobre es un elemento importante para animales y humanos en bajas dosis. De todos modos, la exposición a altos niveles de cobre biodisponible, puede llevar a la bioacumulación e intoxicación (ATSDR 2004). La liberación de cobre en ambientes acuáticos es particularmente preocupante, ya que muchos organismos acuáticos son extremadamente sensibles al cobre, en especial a sus formas solubles que son en general mucho más biodisponibles y tóxicas para una gran variedad de plantas y animales acuáticos (ATSDR 2004, Adams & Chapman 2006), y algunos efectos se manifiestan incluso en presencia de concentraciones muy bajas (Sandahl et al. 2007). Plomo (Pb) Es un metal que se encuentra naturalmente en el ambiente, aunque en concentraciones muy bajas, excepto en lugares que reciben aportes de actividades humanas. Los sedimentos de 17 GRL-TN-05-2010 cursos de agua y suelos no contaminados poseen por lo general menos de 30mg/kg (Alloway 1990, ATSDR 2007). Aparentemente, el plomo no tiene ninguna función bioquímica ni nutricional y es altamente tóxico para los seres humanos, así como también para muchas plantas y animales (ATSDR 2007, Adams & Chapman 2006, WHO 1989). Los niveles pueden acumularse en el cuerpo a través de repetidas exposiciones y puede causar efectos irreversibles en el sistema nervioso, lo cual es particularmente preocupante en jóvenes con un sistema nervioso aún en desarrollo, cuando esta clase de impactos ocurren incluso a niveles de exposición muy bajos. Otros efectos incluyen daños en el sistema circulatorio e impactos en riñones y funciones reproductivas (ATSDR 2004, Jusko et al. 2008, Sanders et al. 2009). Algunos estudios indican que puede no existir un nivel seguro de exposición, sobre todo en lo que se refiere al sistema nervioso central en desarrollo de los seres humanos (Canfield et al. 2003). Mercurio (Hg) Este metal y sus compuestos han sido usados en numerosos productos y procesos industriales, tales como pilas, baterías, termómetros y otros instrumentos de control y medición, así como también en arreglos bucales que es sabido que contribuyen al aporte de aguas residuales municipales (ATSDR 1999, Danish EPA 2004, UNEP 2002). El principal proceso industrial que emplea mercurio es el de cloro-álcali que se lleva a cabo en celdas de mercurio (ATSDR 1999, UNEP 2002). De todos modos, en muchos países, los usos más tradicionales del mercurio están siendo progresivamente restringidos o directamente eliminados debido a preocupaciones que conciernen la salud y el medio ambiente (UNEP 2002). El mercurio se encuentra naturalmente en el ambiente en concentraciones extremadamente bajas. Los niveles en sedimentos de cuerpos de agua pueden variar pero no suelen superar los 0.4 mg/kg (Salomons & Forstner 1984). Las aguas superficiales sin ninguna fuente reconocida de contaminación de mercurio generalmente contienen una concentración total menor a 1ng/l (0.001μg/l) (Hope & Rubin 2005). Cuando es liberado a un ambiente acuático, el mercurio puede transformarse rápidamente en metilmercurio, una forma altamente tóxica que puede bioacumularse y biomagnificarse (acumulación progresiva) en los escalones altos de las cadenas alimentarias, particularmente en los peces (WHO 1989, UNEP 2002). El mercurio y sus compuestos son altamente tóxicos y este metal no tiene valor bioquímico ni nutricional (WHO 1989). Para la población general la principal ruta de exposición al mercurio es a través de la alimentación en la forma de metilmercurio (UNEP 2002). Esta forma de mercurio puede acumularse en el organismo y su impacto principal es en el sistema nervioso. El metilmercurio puede atravesar fácilmente la placenta y la barrera sangre-cerebro, y puede tener efectos adversos en el desarrollo del sistema nervioso y el cerebro de fetos y niños, incluso a niveles de exposición al cual la gente de algunos países está actualmente expuesta (Mahaffey et al. 2004, UNEP 2002). Estudios recientes demostraron también que la exposición puede incrementar el riesgo cardio-vascular y cardíaco (Virtanen et al. 2005). Níquel (Ni) Tiene muchos usos industriales, como metal, como aleación y como compuestos niquelados; incluyendo enchapados, plomería, dispositivos electrónicos, en catalizadores, baterías, pigmentos y cerámicas (ATSDR 2005, DHHS 2005). Los niveles de níquel en el ambiente son generalmente bajos, por ejemplo los sedimentos de cursos de agua no contaminados contienen unos 60mg/kg (Alloway 1990, ATSDR 2005). A pesar de que el níquel unido a suelos o sedimentos es bastante persistente, los compuestos de níquel solubles en agua pueden tener alta movilidad. Cantidades muy pequeñas de níquel son esenciales en el crecimiento y la reproducción de la mayoría de los animales y plantas, y lo más probable es que esto también sea así para los humanos (ATSDR 2005, Alloway 1990). De todos modos, la exposición a concentraciones más elevadas puede ser tóxica y carcinogénica para muchas formas de vida, e incluye efectos gastrointestinales y cardíacos (ATSDR 2005, Cempel & Nikel 2006). En los seres humanos, una proporción significativa de la población (2-5%) es sensible al níquel, y en estos individuos los impactos pueden ocurrir a concentraciones muy bajas (ATSDR 2005, Cempel & Nikel 2006). Además, algunos compuestos niquelados fueron clasificados como carcinogénicos para los seres humanos, y también hay evidencia de carcinogenicidad en animales (DHHS 2005, IARC 1990). Zinc (Zn) Este elemento y sus compuestos tienen numerosos usos industriales. Como metal es principalmente usado como recubrimiento protector de hierro, acero y otros metales/ aleaciones, particularmente a través de la galvanización, incluso en la fabricación de materiales de plomería y dispositivos electrónicos. Los compuestos de zinc también tienen numerosos usos, como en pinturas y pigmentos, baterías y catalizadores (ATSDR 2005b). Los niveles de zinc en el ambiente son generalmente bajos, por lo general debajo de los 100mg/kg en suelos y sedimentos no contaminados (ATSDR 2005b). El zinc es un nutriente esencial para animales y seres humanos, aunque una 18 GRL-TN-05-2010 exposición a altas concentraciones de zinc biodisponible puede resultar en una bioacumulación significativa con posibles efectos tóxicos, incluyendo organismos acuáticos (Adams & Chapman 2006, ATSDR 2005). Los síntomas en humanos ante altas dosis incluyen daño pancreático, anemia y trastornos gastrointestinales. Los síntomas reportados en animales son similares (ATSDR 2005, IPCS 2001). Sedimentos contaminados, umbrales de contaminación y concentraciones de fondo de metales. Los estándares para definir umbrales de concentración de metales aceptables en sedimentos de río aún no han sido definidos en Argentina. Por ende, algunos umbrales de otros países han sido presentados en la Tabla A1, que incluye los límites para las concentraciones de metales en sedimentos fijados en Holanda (NMHSPE 2000), y los niveles definidos por la Administración Nacional Oceánica y Atmosférica (NOAA) de Estados Unidos, por sobre los cuales normalmente se han observado efectos adversos en organismos acuáticos (Long & Morgan 1990). A fines comparativos, también se incluyó información sobre la muestra (AR10006) recolectada río arriba en el Arroyo el Rey en Burzaco, a modo de indicador de las concentraciones de fondo. Metal (mg/kg) Valor máximo de este estudio Umbral holandés (a) Cadmio Cromo Cobre Plomo Mercurio Níquel Zinc 12 (AR10016) 514 (AR10018) 24700 (AR10016) 2780 (AR10014) 10.7 (AR10028) 152 (AR10018) 20000 (AR10014) 12 380 190 530 10 210 720 Nivel NOAA (b) 9.6 145 390 110 1.3 50 270 AR10006 (contexto local) <1 26 21 14 0.5 11 73 Tabla A1. Niveles de umbral para sedimentos y niveles de fondo de ciertos metales, en mg/kg. (a)NMHSPE 2000, (b) Long & Morgan 1990. Los metales presentes en altas concentraciones en los vertidos pueden ser tóxicos para la vida acuática. Es particular motivo de preocupación el alto nivel de cobre, ya que muchos organismos acuáticos son altamente sensibles a este metal, especialmente cuando está presente en formas disueltas, y los impactos pueden ocurrir a concentraciones muy bajas (ATSDR 2004, Bryan & Langston 1992, Sandahl et al. 2007). Los patrones de compuestos orgánicos identificados en las muestras de vertidos AR10013 y AR10015 fueron bastante diferentes. La muestra recolectada de la tubería ubicada más cerca de la calle Cuyo (AR10013) contenía mayormente hidrocarburos alifáticos con trazas del compuesto volátil clorado tricloroeteno. El tricloroeteno es un compuesto orgánico tóxico que es utilizado como solvente. Ha sido comúnmente encontrado en vertidos de complejos industriales en otras partes del mundo, incluyendo aquellos involucrados en la producción de solventes clorados, así como también en las descargas de las operaciones de desengrase de metales. El tricloroeteno fue clasificado en el Grupo 2A según la Agencia Internacional para la Investigación del Cáncer (o sea, “probablemente carcinogénico para humanos”). La muestra recolectada de la tubería más cercana a la calle Ortíz (AR10015) contenía los siguientes químicos: el almizcle policíclico Galaxolido, el ignífugo tris-(2-cloroisopropil) fosfato (nombre comercial Fyrol PCF); triciclodecenol, uno de los componentes del aceite de inmersión usado en microscopía; los compuestos esteroideos stigmasta-5,22-dien-3-ol y cholest-5-en-3-ol; y compuestos de origen natural incluyendo la (1,1-dimetiletil) ciclohexanona y el terpenoide escualeno, dihidromircenol y dihidrometil jasmonato. Nótese que el almizcle policíclico Galaxolido también fue detectado en la descarga de la tubería (muestra AR10017) situada corriente arriba de AR10015. Para más información acerca del Fyrol PCF, referirse al Cuadro C. 19 GRL-TN-05-2010 Las elevadas concentraciones de metales en las aguas residuales se vieron reflejadas en las muestras de sus sedimentos asociados. Los niveles de estos metales en los sedimentos sugieren su acumulación a lo largo del tiempo a causa de una continua descarga de aguas residuales contaminadas del establecimiento de C.R.A. Ambos sedimentos contenían elevados niveles de cobre (8870-24700 mg/kg, 0.9-2.5% por peso), particularmente en la muestra asociada con el vertido más cercano a la calle Ortíz (AR10016). El sedimento asociado a la tubería más cercana a la calle Cuyo (AR10014) también contenía elevados niveles de zinc (20000 mg/kg, o 2.0% por peso) y plomo (2780 mg/kg, o 0.3% por peso). Estos dos metales también estaban presentes en el otro sedimento (AR10016) en concentraciones más bajas, aunque todavía elevadas. Las concentraciones de cobre, plomo y zinc en estas dos muestras fueron las más altas para todas las muestras de sedimentos de este estudio. Las concentraciones de cobre y zinc en ambas, y de plomo en AR10014, exceden los niveles del umbral para sedimentos seriamente contaminados de Holanda (ver la Tabla A1 en el Cuadro B (NMHSPE 2000)). El nivel de cobre en AR10016 excedió este valor 130 veces, mientras que el zinc en AR10014 excedió el umbral 30 veces. AR10014 también contenía una elevada concentración de mercurio, y ambas muestras de sedimentos contenían vanadio a niveles ligeramente más altos que los encontrados en otros sedimentos analizados en el área. El mercurio y el vanadio no estaban presentes en las aguas residuales descargadas en ninguna de las dos tuberías al momento del muestreo, por lo tanto su origen en esta locación no es claro. Los niveles en los sedimentos pueden reflejar vertidos que varían en calidad a lo largo del tiempo, o el resultado de descargas históricas que ya no se llevan a cabo. Serían necesarias investigaciones posteriores y más detalladas para determinar el origen de esta contaminación. Cuadro C: Fyrol PCF o Tris (monocloroisopropil) fosfatos (TMCPPs) Los tris (monocloroisopropil) fosfatos (TMCPPs) son cuatro isómeros de formula molecular C9H18Cl3O4P que pertenecen a los ésteres de alquil fosfatos clorados. El isómero más abundante en productos comerciales es el completamente ramificado, tris (1-cloro 2-propil) fosfato y el menos abundante es el isómero completamente lineal, tris (2 cloropropil) fosfato. Las variantes en los métodos de producción resultan en fórmulas comerciales con diferentes proporciones de los cuatro isómeros. A pesar de que el tris (1-cloro 2-propil) fosfato es el más abundante, algunas compañías tienden a referirse a su producto por el nombre tris (2 cloropropil) fosfato. Los TMCPPs no se forman en la naturaleza, pero son producidos a partir de óxido de propileno y oxicloruro de fósforo (IPCS 1998). Los TMCPPs son usados como ignífugos en espumas de poliuretano flexibles y rígidas, aunque también se usan en acabados textiles en accesorios (NRC 2000). Las mezclas de TMCPP son vendidas bajo varios nombres comerciales que incluyen Antiblaze 80, Amgard TMCP, Fyrol PCF, y Hostaflam PO 820. El tris (1-cloro 2-propil) fosfato no se biodegrada fácilmente en los lodos cloacales aunque es rápidamente metabolizado por los peces (IPCS 1998). Estos compuestos son relativamente estables y solo se someten a una lenta hidrólisis bajo condiciones alcalinas o ácidas suaves. Se han detectado rastros de tris (1-cloro 2-propil) fosfato en efluentes industriales y domésticos, pero no en aguas superficiales ni sedimentos (IPCS 1998). También se han detectado tres isómeros de TMCPP en muestras de aire de ambientes de trabajo comunes, o sea oficinas, guarderías, escuelas, etc. (Carlsson et al. 1997). 20 GRL-TN-05-2010 El tris (1-cloro 2-propil) fosfato va de baja a aguda toxicidad por vía oral (la DL50 en ratas es 1014200 mg/kg de peso corporal), dérmica (la DL50 en ratas y conejos es >5000 mg/kg de peso corporal), e inhalatoria (la DL50 en ratas es > 4.6 mg/litro) (IPCS 1998). Los estudios de irritación ocular en ratas y conejos indican que el tris (1-cloro 2-propil) fosfato es no-irritante o poco irritante. La toxicidad reproductiva, inmunotoxicidad y el potencial carcinogénico del tris (1-cloro 2-propil) fosfato no han sido investigados. No hay información acerca de la toxicidad crónica y subcrónica de los TMCPPs para las vías de exposición oral, dérmica o inhalatoria (NRC 2000). El Consejo Nacional de Investigación (NRC) recalca la necesidad de desarrollar estudios sobre los efectos de la liberación de vapores de TMCPP en el aire y en el agua salada de las telas tratadas (NRC 2000). Además, no hay estudios disponibles respecto del efecto de este ignífugo en humanos. De todos modos están disponibles los valores de toxicidad aguda para otros organismos, cuyo DL50 oscila entre 3.6 y 180 mg/litro. La información acerca de la toxicidad acuática muestra que ocurren cambios en algas, dáfnidos y peces a concentraciones de 6.32 y 9.8 mg/litro respectivamente (IPCS1998). A pesar de la falta de información en el potencial carcinogénico de los TMCPPs identificados, se realizaron estudios en un compuesto muy similar, el tris (2 cloroetil) fosfato, y reflejaron que posee propiedades carcinogénicas en ratones y ratas (IPCS 1998); y fue recientemente agregado a la lista de candidatos como “sustancia altamente preocupante” bajo el reglamento REACH (ECHA 2010). Tanto la muestra de sedimento AR10014 como la AR10016 contenían una variedad de hidrocarburos alifáticos, así como también el aparentemente ubicuo 1,4-diclorobenceno (aunque solo a nivel de trazas en estas muestras). Adicionalmente, la muestra AR10016 (que contenía una combinación de los sedimentos del Arroyo El Rey y de los depósitos de la tubería de descarga más cercana a la calle Ortíz) mostró trazas de 1,2 dicloro-, 1,2,3 tricloro- y 1,2,4 triclorobenceno. También fueron identificados residuos del plastificante bis (2-etilhexil) ftalato (DEHP) en la muestra AR10016. Se presenta más información sobre DEHP en el Cuadro D. Desagüe pluvial de la calle Viel La muestra de agua residual recolectada del desagüe pluvial de la calle Viel (AR10009), y el sedimento asociado (AR10010) no contenían ningún metal en niveles por encima de los típicamente encontrados en aguas superficiales y sedimentos no contaminados. Los compuestos orgánicos identificados en ambas muestras sólo fueron representados por hidrocarburos alifáticos, que bien pueden estar reflejando simplemente un contexto de contaminación urbana. Fabrica de alcohol y productos de limpieza Fradealco Ni la muestra de agua residual recolectada de la tubería de descarga del establecimiento de Fradealco (AR10019) ni el sedimento asociado (AR10020) contenían metales a niveles por encima de los típicamente encontrados en aguas superficiales y sedimentos no contaminados. Nuevamente, en las muestras de este sitio, se identificó solamente una cantidad limitada de hidrocarburos alifáticos. Desagües pluviales de la calle Melián La muestra de agua residual recolectada del desagüe pluvial de la calle Melián (AR10011) no contenía ningún metal a niveles por encima de los típicamente encontrados en aguas superficiales. Los compuestos orgánicos identificados en esta muestra fueron otra vez sólo hidrocarburos alifáticos y escualeno, que puede ser de origen natural. La muestra de sedimento asociado (AR10012) también estaba en gran parte no contaminada, con concentraciones de metales similares a las del sedimento corriente arriba (AR10006). A pesar de que en el sedimento AR10012 el cobre, el plomo y el zinc se encontraban en concentraciones 2-3 veces mayores a las del 21 GRL-TN-05-2010 sedimento río arriba, estos niveles estaban apenas por encima de los rangos de concentración típicos para sedimentos no contaminados. En contraste, la carga de compuestos orgánicos en esta muestra de sedimento fue muy alta, con 124 compuestos aislados, de los cuales 47 fueron confiablemente identificados. La muestra AR10012 contenía 17 isómeros del plastificante diisononil ftalato (DiNP), comúnmente usado como reemplazo de otros ésteres de ftalato, más tóxicos, como por ejemplo el DEHP. Se presenta más información sobre el DiNP y el DEHP en el Cuadro D. Esta muestra también contenía una elevada cantidad de hidrocarburos alifáticos, junto con hidrocarburos aromáticos incluyendo un compuesto que contenía azufre (un derivado del benzotiazol), el hidrocarburo aromático policíclico fenantreno, y un compuesto que contenía nitrógeno (un derivado del indol). Todos juntos sugieren una contaminación por aceite, reciente o histórica, en el sitio investigado. La muestra de agua residual recolectada en el 2do (y más pequeño) desagüe pluvial de la calle Melián (AR10021) estaba en gran medida no contaminada por metales, aunque las concentraciones totales de cobre y zinc se encontraban levemente elevadas por encima de los típicos niveles de fondo para aguas superficiales. Las concentraciones disueltas para ambos metales fueron, sin embargo, mucho más bajas y se encontraban en el rango de concentraciones de fondo. Por otra parte, las concentraciones de metales en el sedimento asociado (AR10022) fueron equivalentes al sedimento no contaminado recolectado corriente arriba (AR10006). El patrón de compuestos orgánicos identificados en la muestra de agua residual AR10021 fue muy similar al de la muestra AR10015. El rango de compuestos detectados en ambas muestras incluía una vez más, el almizcle policíclico Galaxolido, el ignífugo Fyrol PCF, un número de compuestos esteroideos e hidrocarburos alifáticos. Además, la muestra AR10021 también contenía trazas de 1,4 diclorobenceno y de 4(1,1 dimetiletil) fenol, también conocido como p-tert-butilfenol. Este último químico es un intermedio en la producción de resinas fenólicas, aunque el origen preciso en esta muestra en particular no puede ser determinado. Arroyo El Rey, corriente abajo Las muestras de agua (AR10007) y sedimento (AR10008) fueron recolectadas del arroyo El Rey en una locación corriente debajo de todas las descargas muestreadas previamente descritas. En este punto, el arroyo contenía concentraciones de cobre y zinc tanto totales como disueltas, superiores a aquellas recolectadas río arriba (AR10005). Además, el sedimento corriente abajo (AR10008) contenía concentraciones más elevadas de varios de los metales resaltados para las muestras asociadas con los diferentes vertidos en el Arroyo El Rey, en comparación con la muestra corriente arriba (AR10006). Los más notables son el cobre y el zinc, cuyas concentraciones en el sedimento río abajo eran 15 y 10 veces más elevadas que las de la muestra AR10006, respectivamente. La concentración de plomo fue 6 veces mayor, y las de cromo y níquel 22 GRL-TN-05-2010 Cuadro D. Ftalatos (Ésteres de ftalato) Los ftalatos (o, más precisamente, diésteres de ftalato) son químicos no halogenados con varios usos, pero usados principalmente como plastificantes (o suavizadores) de plásticos, especialmente en el PVC (por ejemplo en cables u otros componentes flexibles). Otras aplicaciones incluyen usos como componentes de tintas, adhesivos, selladores, revestimientos de superficies y productos de cuidado personal. Algunos ftalatos son químicos discretos, como por ejemplo el muy conocido di (2 etilhexil) ftalato (DEHP), mientras que otros son complejas mezclas de isómeros como el diisononil ftalato (DINP). Todos los usos de los ftalatos, especialmente su uso principal como plastificante de PVC, resultan en pérdidas de gran escala para el ambiente (tanto en interiores como en exteriores) en el transcurso de la vida útil de los productos, y nuevamente cuando se desechan. Sólo en la Unión Europea, esto equivale a miles de toneladas por año (CSTEE 2001a). Como resultado, los ftalatos se encuentran entre los químicos artificiales más ubicuos encontrados en el ambiente. Se encuentran ampliamente en interiores, incluso en el aire y el polvo (Otake et al.2001, Butte & Heinzow 2002, Fromme et al. 2004) y en concentraciones que por lo general reflejan la prevalencia de plásticos y algunos componentes textiles en las habitaciones muestreadas (Abb et al. 2009). Los ftalatos se encuentran con facilidad en tejidos humanos, incluso en la sangre y, como metabolitos, en la orina (Colon et al. 2000, Blount et al. 2000, Silva et al. 2004), y se reportan niveles significativamente más elevados de ingesta en niños (Koch et al. 2006). En seres humanos y otros animales son rápidamente metabolizados y convertidos en monoéster, pero esta forma es frecuentemente más tóxica que su compuesto padre (Dalgaard et al. 2001). Existen grandes preocupaciones en lo que respecta a la toxicidad de los ftalatos para la vida silvestre y los seres humanos. Por ejemplo, es sabido que el DEHP, uno de los más utilizados en la actualidad, es tóxico para el desarrollo reproductivo de los mamíferos; son capaces (en su forma de monoéster MEHP) de interferir con el desarrollo de los testículos en la temprana edad, que se cree es provocado a través de un impacto en la síntesis de testosterona (Howdeshell et al. 2008, Lin et al. 2008). Incluso en dosis bajas, la exposición a mezclas de ftalatos pueden resultar en efectos acumulativos en el desarrollo testicular de las ratas (Martino-Andrade et al. 2008). Se reportaron también efectos adversos posteriores a la exposición a estos químicos en la reproducción de ratas hembras y en el desarrollo de los jóvenes (Lovekamp-Swan & Davis 2003, Grande et al. 2006, 2007, Gray et al. 2006). Se ha reportado que el butilbencilftalato (BBP) y el dibutilftalato (DBP) también ejercen toxicidad reproductiva (Ema & Miyawaki 2002, Mylchreest et al. 2002, Aso et al. 2005). Tanto el DEHP como el DBP son clasificados como “tóxicos para la reproducción” en Europa. Otro estudio reveló una correlación entre la exposición a ftalatos durante la preñez y una disminución en la distancia anogenital en los niños varones (Swan et al. 2005). La reducción de esta distancia se correlacionó con las concentraciones de cuatro metabolitos de ftalatos, a saber: monoetil ftalato (MEP), mono-n-butil ftalato (MBP), monobencil ftalato (MBzP) y monoisobutil ftalato (MiBP). También se encontró que el DBP no sólo puede ser incorporado por cultivos, entrando así a la cadena alimentaria, sino que también afecta la formación del proteoma afectando también la morfología y fisiología de algunos cultivos durante su crecimiento (Liao 2006). Hay otros ftalatos, incluyendo las formas isoméricas de DINP y DIDP (diisodecil ftalato), que son de inquietud dado a efectos observados en riñón e hígado, aunque a dosis más elevadas. En la actualidad, hay relativamente pocos controles en el marketing y el uso de ftalatos, a pesar de su toxicidad, los volúmenes usados y su propensión a desprenderse de los productos a lo largo de su vida. De los controles que sí existen, de todos modos, el más popular probablemente sea la prohibición de la Unión Europea del uso de seis ftalatos en juguetes para niños y productos de cuidado infantil, primeramente acordada como una medida de emergencia en 1999 y finalmente hecha permanente en 2005 (EC 2005). Mientras esto señala una vía de exposición importante, la exposición a través de otros bienes de consumo por ahora sigue sin ser regulada. En Europa se propuso que tres ftalatos (DBP, BBP y DEHP) fueran incluidos en la primer lista de siete sustancias para las cuales sería requerida una justificación detallada y una autorización para cualquier uso continuado propuesto (ECHA 2009). Estos ftalatos, junto con el recientemente agregado diisobutil ftalato (DiBP), fueron incluidos como candidatos en la lista de “sustancias altamente preocupantes” del reglamento REACH (ECHA 2010). Dentro de la Unión Europea, el DEHP está enlistado como sustancia prioritaria bajo la Directiva Marco de Agua, una regulación diseñada para mejorar la calidad del agua en la Unión Europea (EU 2008). El DEHP y el DnBP también han sido identificadas como sustancias que necesitan una acción prioritaria bajo el Convenio OSPAR, bajo el cual los países firmantes han acordado un acuerdo de cesación de vertidos, emisiones y pérdidas de todas 23 las sustancias peligrosas para el GRL-TN-05-2010 ambiente marino del Atlántico Noreste para el 2020, el objetivo de cese en “una generación” (OSPAR 1998). ambas fueron dos veces más altas. Además, se detectó cadmio en el sedimento corriente abajo (aunque sólo a 1mg/kg), que no estaba presente en la muestra corriente arriba. A pesar de considerables variaciones en los niveles de contaminación por metales en los sedimentos del Arroyo El Rey en los diferentes sitios de muestreo, el hecho de que en general se encontraron niveles más altos en la muestra final de río abajo que en la muestra inicial recolectada río arriba, puede reflejar la contribución combinada de la entrada de residuos y escorrentías de todos los puntos y fuentes difusas al arroyo a medida que fluye a través del Parque Industrial Burzaco. Se aisló una cantidad más bien limitada de compuestos orgánicos de la muestra de agua del arroyo, y sólo se identificó confiablemente un hidrocarburo alifático y azufre molecular. De todos modos, la muestra de sedimento AR10008 sí mostró signos de una mayor carga de compuestos orgánicos que la muestra de sedimento recolectada corriente arriba de todos los otros sitios (AR10006). Aquellos identificados en esta última muestra de corriente abajo, incluían varios que también fueron detectados en las muestras de sedimento adyacentes a los vertidos río arriba, incluyendo residuos de bencenos clorados, esteroides, hidrocarburos aromáticos y alifáticos, y el plastificante DEHP. Esta muestra también contenía dos ésteres de ftalato más, que no fueron detectados en las otras muestras, estos son el diisobutil y el butil bencil ftalato. Se presenta más información sobre los ftalatos en el Cuadro D. Fueron conspicuos también varios compuestos fenólicos en esta muestra de sedimento de corriente abajo; incluían 5 isómeros del persistente nonil fenol que provoca trastornos hormonales. La presencia de este compuesto sugiere un punto-fuente adicional al arroyo además de los muestreados en este estudio, o tal vez un incidente de contaminación histórico. Dada la sabida toxicidad acuática de este químico, su presencia y posible origen merecen ser investigados con urgencia. Los elevados niveles de ciertos metales y la presencia de contaminantes orgánicos en la muestra de sedimento del Arroyo El Rey que fue recolectada corriente abajo de todos los vertidos investigados, indican la contaminación del arroyo como el resultado de continuos aportes de aguas residuales contaminadas. Planta de Tratamiento de Aguas Residuales AySA En tres ocasiones diferentes entre el 26 de Enero y el 11 de Febrero de 2010, se recolectaron muestras de las aguas tratadas descargadas por el establecimiento de AySA, junto con muestras de sedimento de las márgenes del Río Matanza-Riachuelo adyacentes a la tubería de descarga. Se presentan los detalles de las muestras en la Tabla 3. Muestra AR10023 AR10024 AR10025 AR10026 AR10027 AR10028 Fecha Tipo Agua 26/01/2010 residual Sedimento Agua 28/01/2010 residual Sedimento Agua 11/02/2010 residual Sedimento Descripción Tubería de descarga en el río MatanzaRiachuelo Borde del río adyacente a la tubería Tubería de descarga en el río MatanzaRiachuelo Borde del río adyacente a la tubería Tubería de descarga en el río MatanzaRiachuelo Borde del río adyacente a la tubería 24 GRL-TN-05-2010 Tabla 3. Descripción de las muestras asociadas con la planta de tratamiento de aguas residuales AySA, Aldo Bonzi, La Matanza, Argentina, 2010. Resultados La información de los análisis es resumida en la Tabla 4 y discutida a continuación. Las tres muestras de agua residual tratada (AR10023, 25 & 27) contenían notables concentraciones totales de cromo (66-192 μg/l), cobre (59-205 μg/l), níquel (22-95 μg/l) y zinc (444-860 μg/l). De estos cuatro metales, sólo el zinc estaba presente en las formas disueltas por encima del límite de detección de los métodos utilizados, dentro del rango 33 – 58 μg/l. Las concentraciones totales (de toda la muestra) de estos cuatro metales en las muestras de agua tratada fueron los niveles totales más altos de todas las muestras de agua residual incluidas en este estudio, después de las dos muestras de los vertidos de la fábrica de radiadores C.R.A. Las concentraciones de estos metales son muchas veces más altas que los típicos niveles de fondo encontrados en aguas superficiales. Además de las elevadas concentraciones totales, este estudio demostró variaciones significativas en las concentraciones de ciertos metales en las aguas tratadas descargadas en las distintas ocasiones. El agua recolectada el 11 de Febrero (AR10027) contenía concentraciones totales de cromo, cobre, níquel y zinc dos veces más altas que los niveles de las muestras recolectadas en las ocasiones anteriores (AR10023, 25). Se han publicado datos acerca de la composición de las aguas residuales vertidas por la planta de tratamiento AySA para el período comprendido entre otoño de 2008 y verano de 2009, bajo el programa de monitoreo integrado de la calidad de aguas superficiales y sedimentos de la cuenca del Río Matanza-Riachuelo y de la Franja Costera Sur del Río de la Plata (ACUMAR 2009). Dichos datos también demuestran variaciones en las concentraciones de metales en el agua residual tratada de este establecimiento. En una ocasión, una muestra de agua residual tratada descargada en otoño de 2008 contenía concentraciones totales y disueltas de níquel 40 y 4 veces más altas, respectivamente, que los niveles de otras tres muestras recolectadas en otras ocasiones por ACUMAR. Las concentraciones de metales halladas en este estudio para las tres muestras de aguas residuales descargadas (AR10023, 25, 27) son, para la mayoría de los metales, consistentes con los datos previamente publicados por ACUMAR para muestras de agua residual recolectadas en el mismo desagüe en cuatro ocasiones entre otoño de 2008 y verano de 2009 (ACUMAR 2009), como se resume en la Tabla 5. Existen unas pocas MUESTRA TIPO BREVE DESCRIPCIÓN FECHA pH METAL Antimonio Arsénico Bario Cadmio Cromo Cromo (VI) Cobalto Cobre Plomo Manganeso Mercurio Níquel Selenio AR10023 AR10025 AR10027 Agua Residual Tubería de descarga 26/01/2010 28/01/2010 11/02/2010 Total Disuelto Total Disuelto Total Disuelto 7 7 7 7 7 7 (μg/l) (μg/l) (μg/l) (μg/l) (μg/l) (μg/l) <20 <20 <20 <20 <20 <20 <50 <50 <50 <50 <50 <50 200 93 174 92 291 94 <10 <10 <10 <10 <10 <10 66 <20 71 <20 192 <20 <50 <50 <50 <50 <50 <50 <20 <20 <20 <20 <20 <20 59 <20 82 <20 205 <20 <50 <50 <50 <50 <50 <50 108 76 128 75 250 107 <2 <2 <2 <2 <2 <2 22 <20 43 <20 95 <20 <200 <200 <200 <200 <200 <200 25 AR10024 AR10026 AR10028 Sedimento Río Matanza - Riachuelo 26/01/2010 28/01/2010 11/02/2010 _ (mg/kg) <20 <20 322 1 271 _ 6 731 498 200 5.8 119 <30 _ _ <20 <20 288 2 268 _ 6 494 405 205 6.6 138 <30 <20 <20 245 1 194 _ 6 1570 1020 265 10.7 78 <30 GRL-TN-05-2010 Vanadio Zinc Nro. de compuestos orgánicos aislados Nro. de compuestos organicos identificados de forma confiable (% del total) Bencenos clorados Chlorpyrifos Atrazina Galaxolido Ftalatos Fyrol PCF Nonilfenol Otros fenoles HAPs Alquilbencenos Derivados de ciclodieno Terpenoides Esteroides Deciltetraglicol Di-iso octil adipato Indol y derivados Hidrocarburos alifáticos Otros compuestos Compuestos volátiles: Cloroformo Tricloroeteno Tetracloroeteno Diclorometano 25 444 <20 58 32 427 <20 39 59 860 <20 33 86 1050 105 1090 69 984 53 75 136 41 63 82 18(34%) 38(51%) 43(32%) 18(44%) 33(52%) 30(37%) (2) (1) 1(1) (2) (2) 1 (2) 1 1 1 1 1 1 1 1 1 1 1 12 1 6 7 1 5 1 3 1 1 1 2 1 1 1 1 1 10 1 11 1 16 2 13 (1) (1) (1) (1) (1) (1) (1) 2 1 4 2 21 2 1 14 2 Tabla 4. Los compuestos orgánicos identificados, y las concentraciones de metales y metaloides, en muestras de aguas residuales y sedimentos asociados con la planta de tratamiento de aguas residuales de AySA. (..) corresponde a compuestos orgánicos traza utilizando el método SIM (monitoreo selectivo de iones). Las concentraciones en las muestras de agua residual y agua de río son dadas en μg/l tanto para las concentraciones totales de la muestra completa como para las concentraciones disueltas de las muestras filtradas; las concentraciones para sedimentos son dadas en mg/kg de peso seco. Diferencias mínimas entre los dos juegos de información, que fueron recolectados en diferentes períodos de tiempo. Las concentraciones totales promedio de cromo y zinc encontradas en este estudio eran aproximadamente dos veces más altas que los niveles correspondientes publicados por ACUMAR. La concentración total promedio de níquel publicada por ACUMAR fue por lejos más alta que el dato correspondiente de este estudio, pero esta diferencia se debió a un único valor atípicamente alto en los datos de ACUMAR de otoño de 2008. Excluyendo esta sola muestra, la concentración total promedio de níquel sería similar a la determinada en el presente estudio. Un diverso rango de compuestos orgánicos fue detectado en las tres muestras de agua residual tratada (AR10023, AR10025 y AR10027), con una cantidad de compuestos aislados que van de 53 en la muestra AR10023 a 136 en la muestra AR10027. El número de compuestos que pudieron ser identificados confiablemente fue de 18 a 43. Entre esos, los siguientes compuestos fueron detectados en todas las muestras, independientemente de la fecha de muestreo: • • • • Atrazina, uno de los herbicidas más usados para el control de malezas y hierbas; Trazas de diclorobencenos Compuestos esteroides y terpenoides Hidrocarburos alifáticos Algunos compuestos que fueron identificados en por lo menos dos ocasiones incluyen: • • • Fyrol PCF, un ignífugo Hidrocarburos Aromáticos Policíclicos (HAPs) Alquil-bencenos 26 GRL-TN-05-2010 • Trazas de compuestos orgánicos clorados volátiles como cloroformo, tricloroeteno y tetracloroeteno. Además, varios compuestos fueron detectados en una sola de las tres muestras, lo que nuevamente refleja las variaciones periódicas en la calidad final del vertido. Estos químicos incluyen metilfenol, diisoadipato, deciltetraglicol y diclorometano en la muestra AR10027, 12 isómeros de nonilfenol en la muestra AR10025, y HAP fenantreno en la muestra AR10023. A pesar de estas variaciones inevitables, la información total obtenida indica claramente que está ocurriendo una contaminación a través de estos vertidos que contienen un abanico de compuestos tóxicos y persistentes, algunos de los cuales están atravesando el proceso de tratamiento inalterados. Cuadro E. Atrazina La atrazina, un herbicida selectivo del grupo de las triazinas, es un químico artificial que es utilizado para controlar malezas residuales en el maíz y el maíz dulce. El nombre químico completo de este compuesto es 6-cloro-N-etil-N-isopropil-1,3,5-triazinadiil-2,4-diamina. Otros nombres comerciales son granulos de Atrazina, New Chlorea, Residox, Weedex, Primatol A, Tripart Atrazine. La atrazina es el herbicida del grupo de las triazinas más usado en el mundo. Sólo en los Estados Unidos se aplican aproximadamente 70 millones de libras por año (US EPA 2009a). Este compuesto es relativamente persistente en el suelo (hasta 1 año) y, como es moderadamente soluble en agua, puede migrar a aguas superficiales y subterráneas. Los métodos convencionales para el tratamiento de aguas residuales y agua para consumo humano son muy ineficaces en la remoción de la atrazina (Ghosh & Philip 2004; William & Lauren 1996; Ternes et al., 2002; Verstraeten et al., 2002). Por lo tanto, es frecuentemente detectada en aguas superficiales, subterráneas y también en agua para consumo humano (Battaglin & Hay 1996; Paul & Steven 2001; Cerejeira et al. 2003; Hua et al. 2006). La atrazina fue clasificada como Pesticida de Uso Restringido en EEUU debido a su potencial de contaminación subterránea. La atrazina puede degradarse en uno de muchos metabolitos, cada cual de variada persistencia y toxicidad. Los metabolitos más comunes de la atrazina son la hidroxiatrazina (HA), la deetilatrazina (DEA), la deisopropilatrazina (DIA), la didealquilatrazina (DDA), y la deetilhidroxiatrazina (DEHA), que pueden formarse a partir de cinco procesos de degradación diferentes: hidrólisis, adsorción, volatilización, fotodegradación, y degradación microbiana. Algunas evidencias toxicológicas indican que sólo los metabolitos clorados DEA, DIA y DDA, además de la atrazina, representan un riesgo para la salud humana (Winkelmann & Klaine 1991). Mientras que los efectos tóxicos de la atrazina aún están siendo evaluados, se sabe muy poco de los efectos de varios de sus metabolitos, particularmente en el ambiente acuático. La atrazina está incluida en la “Lista de sustancias prioritarias en el ámbito de la política de aguas” del Anexo X del Parlamento y el Consejo de la Unión Europea (EC 2001), que corrigió la Directiva Marco del Agua 2000/60/EC, como posible “sustancia peligrosa prioritaria” dada su amplia distribución en el ambiente y los efectos tóxicos que puede presentar en los seres vivos. 27 GRL-TN-05-2010 La alta movilidad de la atrazina en el suelo y su potencial de contaminación subterránea pueden representar un serio peligro para la salud humana a causa de los efectos tóxicos potenciales de este herbicida. La atrazina fue identificada como una sustancia que ocasiona trastornos del sistema endócrino en varios estudios realizados con animales de laboratorio y organismos acuáticos (Salaberria et al. 2009; Freeman et al. 2005; Victor-Costa et al. 2010; Friedmann 2002; Song et al. 2009). También puede afectar los sistemas nervioso y reproductor (Cooper et al. 2000; Narotsky et al. 2001; Rodriguez et al. 2005). Una exposición excesiva a la atrazina puede afectar sistema digestivo, ojos, corazón, riñones, hígado y piel. En el 2009, la Agencia de Protección Ambiental (EPA) de EEUU comenzó una nueva y exhaustiva evaluación de la atrazina para determinar sus efectos en los seres humanos (US EPA 2009b). Cuando termine este proceso, la agencia decidirá si deben revisar su actual evaluación de riesgo y si son necesarias nuevas restricciones para una mejor protección de la salud pública. La EPA evaluará los efectos cancerígenos y no-cancerígenos de este pesticida en humanos. Se incluirán en esta nueva evaluación los estudios más recientes sobre la atrazina y su potencial asociación con defectos de nacimiento, bajo peso al nacer y nacimientos prematuros. La EPA considerará los efectos potenciales cancerígenos y no-cancerígenos de la atrazina, e incluirá información generada desde el 2003 en estudios de laboratorio y de población. Del 26 al 29 de Abril de 2010, el Panel Científico Consultivo de FIFRA tuvo un encuentro para revisar y considerar la “Reevaluación de los Efectos en la Salud Humana de la Atrazina: Revisión de estudios in Vitro y experimentos con animales, y frecuencia de monitoreos del agua para consumo humano”. ACUMAR TOTAL Metal (μg/l) ESTE ESTUDIO (AR10023, 25, 27) DISUELTO TOTAL DISUELTO Rango Promedio Rango Promedio Rango Promedio Rango Promedio <18 <18 <18 <18 <50 <50 <50 <50 Cadmio 0,5 - 1,4 0,8 nd - 0,4 0,4 <10 <10 <10 <10 Cromo 26 - 83 54 12 - 16 14 66 - 192 110 <20 <20 Cobre 26-128 70 6-24 14 59-205 115 <20 <20 0.039-0.062 0.051 0.008 0.008 <2 <2 <2 <2 Níquel 30-1705 452 (34*) 7-117 43 (18*) 22-95 53 <20 <20 Plomo 4-31 19 3-6 5 <50 <50 <50 <50 102-519 310 23-84 45 427-860 577 33-58 43 Arsénico Mercurio Zinc Tabla 5. Comparación de las concentraciones de metales de las aguas residuales descargadas muestreadas en este estudio (AR1023, 25, 27) con los datos publicados por ACUMAR (ACUMAR 2009), mostrando el rango de valores y los valores promedio, tanto para las concentraciones totales de toda la muestra como para las concentraciones disueltas de la muestra filtrada. *quitando el valor atípico elevado obtenido. Las concentraciones de metales en las tres muestras de sedimento recolectadas del Río Matanza-Riachuelo inmediatamente adyacente al vertido de AySA (AR10024, 26 y 28) reflejaron en general los perfiles de metales de las muestras de agua residual (AR10023, 25 y 27). Todas las muestras de sedimento contenían altos niveles de cobre y zinc, entre 10 y 30 veces más elevados que las concentraciones esperadas para sedimentos de río no contaminados. En menor medida, las muestras de sedimento contenían cromo y níquel, a niveles 2-3 veces más altos que los niveles de fondo para sedimentos de agua dulce. Las concentraciones de cobre y zinc en las tres muestras, y la de plomo en AR10028, excedían los niveles umbral holandeses para sedimentos seriamente contaminados (ver Tabla A1 en el Cuadro B (NMHSPE 2000)). Además, todas las muestras de sedimento contenían niveles elevados de plomo y mercurio. Estaban ambos metales presentes en todas las muestras a concentraciones entre 15 y 30 veces superiores a las concentraciones típicamente encontradas en sedimentos de río no contaminados. La concentración de mercurio en AR10028 fue la más elevada de todos los sedimentos analizados en este estudio; y los niveles de mercurio y plomo excedían los niveles umbral holandeses para sedimentos seriamente contaminados (nuevamente, ver Tabla A1 en el Cuadro B (NMHSPE 2000)). El plomo 28 GRL-TN-05-2010 y el mercurio no estaban presentes en ninguna de las muestras de agua residual en niveles superiores al límite de detección. Los elevados niveles de estos metales en los sedimentos del río indican su acumulación en esta locación debido a su persistente descarga en las aguas residuales tratadas, o posiblemente se deba a descargas históricas a través de esta tubería. La cantidad de compuestos orgánicos aislados en estas mismas tres muestras de sedimento AR10024, AR10026 y AR10028 fue proporcional al número de compuestos aislados en sus correspondientes muestras de agua (AR10023, AR10025 y AR10027), y consistió en 41, 63 y 82 compuestos respectivamente. En otras palabras, la muestra de sedimento y la de agua residual AR10028 y AR10027 recolectadas en el mismo momento tenían la mayor carga de compuestos orgánicos. Sin embargo, varios grupos de compuestos orgánicos se encontraban presentes en las tres muestras de sedimento: • • • Galaxolido, un almizcle sintético policíclico; Trazas de diclorobenceno; Hidrocarburos alifáticos Los compuestos que fueron detectados en por lo menos dos muestras fueron: • • • • Clorpirifos, un organofosfato insecticida utilizado para controlar plagas de insectos. Entre los nombres comerciales se encuentran Brodan, Detmol UA, Dowco 179, Dursban, Empire, Eradex, Lorsban, Paqeant, Piridane, Scout, y Stipend. El clorpirifos es un químico moderadamente tóxico y la exposición crónica a él fue vinculada a efectos neurológicos, trastornos del desarrollo y trastornos autoinmunes. Se presenta información adicional sobre el clorpirifos en el Cuadro F; El éster de ftalato DEHP, regulado en Europa como “tóxico para la reproducción”; Terpenoides; Indol y sus derivados. Además, varios compuestos orgánicos fueron detectados en sólo una de las tres muestras, que incluyen alquilbencenos y compuestos esteroideos en la muestra AR10028, dos derivados de dienos cíclicos (ciclododecadieno y alquil-cicloheptadieno) en la muestra AR10026 y fenantreno en la muestra AR10024. Ni el Clorpirifos ni el Galaxolido fueron detectados en las muestras de agua correspondientes al momento del muestreo. Su presencia en los sedimentos en la vecindad del vertido puede indicar descargas pasadas o periódicas de estos químicos provenientes de la planta de tratamiento de aguas residuales AySA. Tanto la Atrazina como el Clorpirifos están incluidos en la “Lista de sustancias prioritarias en el ámbito de la política de aguas” del Anexo X del Parlamento y el Consejo de la Unión Europea (EC 2001), que corrigió la Directiva Marco del Agua 2000/60/EC, como posible “sustancia peligrosa prioritaria” dada su amplia distribución en el ambiente y los efectos tóxicos que pueden presentar en los seres vivos. Además las pruebas de toxicidad conjunta del clorpirifos y la atrazina en peces, mostraron reacciones más que simplemente aditivas en invertebrados, sugiriendo que pueden surgir impactos más numerosos y complejos ante una mezcla de químicos peligrosos en 29 GRL-TN-05-2010 el ambiente, a pesar de que las interacciones en vertebrados fueran menos pronunciadas (Mehler et al. 2008). Conclusiones Los resultados de este estudio demuestran que la descarga de aguas residuales de por lo menos algunos de los establecimientos industriales situados en el área de Burzaco, están llevando a la contaminación del agua y de los sedimentos del Arroyo El Rey a medida que fluye hacia el norte a través del Parque Industrial. Como el agua y los sedimentos suspendidos en este arroyo finalmente fluyen al Riachuelo, queda claro incluso desde este limitado estudio que el Parque Industrial Burzaco está actuando como un punto fuente de metales tóxicos y contaminantes orgánicos persistentes para la cuenca Matanza-Riachuelo en general. A pesar de que el Arroyo El Rey puede no ser el tributario más contaminado del sistema, es claramente uno de muchos tributarios en la cuenca que recibe una variedad de descargas de basura industrial y puede, por ende, dar un ejemplo de lo que puede estar sucediendo en algún otro lado. Serían necesarias investigaciones posteriores y más detalladas para rastrear las fuentes exactas de los contaminantes clave identificados en este estudio y para extender este trabajo a otros arroyos similarmente industrializados que alimenten el sistema Matanza-Riachuelo. Cuadro F. Clorpirifos El clorpirifos pertenece al grupo de compuestos orgánicos denominado organofosfatos (OPs). OP es el término genérico normalmente utilizado e implica a todos los insecticidas que contengan fósforo. Todos los organofosfatos son derivados de uno de los ácidos de fósforo, y como grupo, son generalmente el pesticida más tóxico para los vertebrados. Dada la similitud entre la estructura de los OP y la de los “gases nerviosos”, su modo de acción es también similar. Sus cualidades insecticidas fueron observadas en Alemania durante la Segunda Guerra Mundial en el estudio de los extremadamente tóxicos gases nerviosos de OP: sarin, soman y tabun. Inicialmente, el descubrimiento fue hecho en la búsqueda de sustitutos para la nicotina para el control de áfidos (Metcalf 1995). El clorpirifos es un organofosfato heterocíclico. Entre los nombres comerciales del clorpirifos se encuentran Dursban, Lorsban, Loxiran, Zidil, Detmol, Perinex, Brodan, Eradex y Spannit. En su forma pura, el clorpirifos es un compuesto blanco cristal con un suave olor a mercaptano. Es soluble en agua a 2 mg/l (Galo & Lawryk 1991). Es estable en medios neutros o ácidos suaves y sufre hidrólisis en medios alcalinos fuertes. El clorpirifos es un insecticida de amplio espectro (Metcalf 1995). El clorpirifos es uno de los insecticidas más utilizados en la actualidad en interiores. Fue usado también como ingrediente activo en formulaciones de agroquímicos para un amplio rango de cultivos incluyendo frutas de pepita, frutas de hueso, cítricos, frutos secos, frutillas, higos, bananas, vides, vegetales, papas, remolacha, tabaco, porotos de soja, girasoles, maní, arroz, algodón, alfalfa, cereales, maíz, ornamentales de exteriores, césped y en silvicultura (RSC 1987). También se utiliza en collares pulguicidas y pipetas, sprays y shampoos para animales, alfombras, sprays para grietas y hendiduras, y para el tratamiento subterráneo de termitas. Según la Agencia de Protección Ambiental de EEUU existen 972 productos registrados que contienen clorpirifos de uso generalizado para el control de termitas y cucarachas, y para usos en el jardín y el hogar (US EPA 1997). 30 GRL-TN-05-2010 Los OPs tienen dos características distintivas: son generalmente mucho más tóxicos para los vertebrados que otros insecticidas, y químicamente son más inestables y no-persistentes. Es esta última característica la que hizo que se incorporaran en agricultura como sustitutos de los persistentes organoclorados. Los insecticidas organofosforados son compuestos reactivos y se degradan con facilidad por oxidación, hidrólisis y seres vivos (Saint-Fort 1991). La vida media del clorpirifos es de 80-100 días. El principal metabolito es el 3,5,6 tricloro-2-piridinol, que subsecuentemente se degrada en compuestos organoclorados y dióxido de carbono (RSC 1987). En animales ocurre un metabolismo rápido, seguido de la administración oral de clorpirifos siendo el metabolito principal el 3,5,6 tricloro-2-piridinol y 23 monoetil clorpirifos. Entonces, los OPs son biocidas generales que son tóxicos para casi todos los animales. Los valores de la DL50 por vía oral (mg/kg) del clorpirifos en el pato real y el faisán es de 75 y 12 respectivamente (Metcalf 1995). Mullie y Keith (1993) reportaron que la aplicación aérea del clorpirifos resultó en una disminución temporaria de la abundancia de aves, del alimentos de las aves y de los niveles de colinesterasa en algunas especies. El clorpirifos es también altamente tóxico para peces, abejas, parásitos benéficos y predadores (RSC 1987). La LC50 (96 horas) del clorpirifos para la trucha arco iris es de 0.003mg/l. Incluso si no provoca la muerte, las dosis subletales pueden ser una amenaza importante para las especies y su equilibrio poblacional modificando su fisiología o parámetros de comportamiento tales como la comunicación feromonal (Delpuech et al. 1998). Como resultado, la contaminación del ambiente por este insecticida puede llevar a la modificación global de la biodiversidad. En el 2009 la EPA de EEUU estableció nuevas limitaciones en el uso de clorpirifos para proteger el salmón y la trucha steelhead, especies amenazadas y en peligro de extinción en Califarnia, Idaho, Oregon y Washington (US EPA 2009). Recientes experimentos en ratas sugieren que el clorpirifos puede ser un neurotóxico en desarrollo y que la exposición in utero pueden causar aberraciones funcionales y bioquímicas en las neuronas fetales, así como también déficits en el número de neuronas (Landrigan et al. 1999; Slotkin 1999; Brimijoin & Koenigsberger 1999). También se reportó (US EPA 2006) que el clorpirifos puede causar inhibición de la colinesterasa en humanos; eso quiere decir que puede sobreestimular el sistema nervioso causando nauseas , mareos, confusión y, a niveles de exposición muy elevados (por ejemplo accidentes o derrames mayores), parálisis respiratoria y muerte. En el presente, la principal preocupación sobre los usos de formulaciones que contienen clorpirifos, está relacionada con los efectos tóxicos en humanos, especialmente en niños (Landrigan 2001; Szpir 2006; Colborn 2006, Rauh 2006). Un patrón extenso e inusual de defectos de nacimiento, incluyendo defectos en el cerebro, ojos, orejas, paladar, dientes, corazón, pies, pezones y genitales fueron reportados en el estudio anterior de cuatro niños expuestos in utero al clorpirifos (Sherman 1996). Estudios acerca de la exposición en interiores al clorpirifos indican que los niños jóvenes corren riesgos más altos en presencia del pesticida semivolátil de lo que se solía estimar (Davis & Ahmed 1998; Gurunathan et al.1998). El estudio reveló que después de una sola emisión del pesticida realizada por aplicadores certificados en departamentos, el clorpirifos siguió acumulándose en los juguetes de los niños y superficies duras 2 semanas después de la aplicación. Basándose en los hallazgos de este y otros estudios, los niveles de exposición estimados al clorpirifos para niños en interiores son entre 21 y 119 veces superior a la dosis de referencia recomendada de 3μg/kg/día provenientes de todas las fuentes. Por otra parte se comprobó que el clorpirifos es absorbido fácilmente por la piel, y los procesos de descontaminación basados en agua y jabón tienen una baja eficiencia de remoción (Fenske & Lu 1994). Del mismo modo, mientras que la planta municipal de tratamiento de aguas residuales del sudoeste de AySA es sin duda sólo una de muchas fuentes de vertidos en la cuenca Matanza-Riachuelo, es de todos modos un punto significativo. El hecho de que un amplio rango de contaminantes industriales comunes puedan ser identificados, y en algunos casos a concentraciones significativamente elevadas, en el efluente tratado final en el punto de descarga al ambiente acuático, provee una imagen de las inherentes limitaciones de las plantas de tratamiento de aguas residuales convencionales en cuanto al manejo y descontaminación de las aguas residuales de origen industrial. A pesar de que es imposible determinar qué proporción de la carga total de metales y 31 GRL-TN-05-2010 contaminantes orgánicos persistentes dirigidos a la planta de tratamiento desde fuentes industriales están siendo degradados o retenidos en lodos cloacales, es evidente que ni la degradación ni la retención son capaces de prevenir que estos contaminantes primordiales sean descargados en la cuenca, y que contaminen de esta manera, el ambiente río abajo. Al mismo tiempo es probable que una proporción significativa de aquellos contaminantes más resistentes a la degradación se acumulen progresivamente en los residuos generados por la planta de tratamiento, aumentando el peligro potencial de una contaminación más amplia como resultado subsecuente del desecho de estos residuos. Como ya fue explicado previamente, tanto el Parque Industrial Burzaco como la planta de tratamiento sudoeste de AySA son meros casos de estudio que reflejan lo que aparentemente es un problema mucho más amplio, peligroso y general de contaminación química en el agua proveniente de actividades industriales en el Área Metropolitana de Buenos Aires. Juntas, nos permiten ilustrar las consecuencias de vertidos pobremente controlados o incluso sin ningún tratamiento de por medio, de un amplio rango de unidades y/o zonas industriales y, la inhabilidad de las plantas de tratamiento de aguas residuales municipales para manejar de forma eficiente los tóxicos y químicos persistentes industriales, sea cual fuere su origen. Mientras que este estudio solo provee un vistazo limitado de fuentes de contaminación acuática con químicos peligrosos en dos áreas de Buenos Aires, también demuestra la urgente necesidad de una investigación más extensiva y detallada del problema a través de todo el AMBA, con el fin de determinar la escala y grado de severidad total. Dichas investigaciones, junto con iniciativas que apunten a hacer un inventario del corriente uso y liberación de un amplio rango de sustancias peligrosas de industrias locales, deberían proveer las bases para una forma más sustentable de manejo de químicos y protección de recursos acuíferos en el futuro. Si el propósito a largo plazo fuere la protección del ambiente y la salud, es vital establecer un objetivo a cumplirse inmediatamente de “vertido cero” de los compuestos más peligrosos tanto orgánicos como inorgánicos utilizados hoy en día por la industria; implementando en lo posible un reemplazo progresivo de sustancias peligrosas por otras alternativas menos nocivas o preferentemente no-tóxicas. Dichas políticas a las que apuntamos son científicamente comprobables y tecnológicamente posibles; y ya fueron desarrolladas (y están siendo implementadas) en otras partes del mundo, incluyendo zonas de la Unión Europea, Noreste Atlántico (OSPAR) y la región Báltica (HELCOM). 32 GRL-TN-05-2010 Referencias Abb, M.; Heinrich, T.; Sorkau, E. and Lorenz, W. (2009) Phthalates in house dust. Environment International 35(6): 965-970 ACUMAR (2009) Programa de Monitoreo Integrado (PMI) de calidad de agua superficial y sedimentos de la Cuenca Matanza-Riachuelo y de la Franja Costera Sur del Río de la Plata (2009). ACUMAR. Secretaria de Ambiente y Desarrollo Sustentable de la Nación. Argentina Adams, W.J. & Chapman, P.M. (2006) Assessing the hazard of metals and inorganic metal substances in aquatic and terrestrial systems. ISBN: 1420044400. CRC Press Allmyr, M., Adolfsson-Erici, M., McLachlan, M.S. & Sandborgh-Englund, G. (2006a) Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products. Science of Total Environment 372: 87–93 Allmyr, M., McLachlan, M.S., Sandborgh-Englund, G. & Adolfsson-Erici, M. (2006b), Determination of triclosan as its pentafluorobenzoyl ester in human plasma and milk using electron capture negative ionization mass spectrometry. Analytical Chemistry 78 :6542–6546 Alloway, B.J. (1990) Heavy metals in soils. John Wiley and Sons, Inc. New York, ISBN 0470215984 Aso, S., Ehara, H., Miyata, K., Hosyuyama, S., Shiraishi, K., Umano, T. and Minobe, Y. (2005) A twogeneration reproductive toxicity study of butyl benzyl phthalate in rats. Journal of Toxicological Sciences 30(SI): 39-58 ATSDR (1999) Toxicological Profile for mercury. United States Public Health Service, Agency for Toxic Substances and Disease Registry, March 1999 ATSDR (2004) Toxicological Profile for copper. United States Public Health Service, Agency for Toxic Substances and Disease Registry, September 2004 ATSDR (2005) Toxicological profile for nickel. Agency for Toxic Substances and Disease Registry, US Public Health Service, August 2005 ATSDR (2005b) Toxicological profile for zinc, United States Public Health Service, Agency for Toxic Substances and Disease Registry, August 2005 ATSDR (2007) Toxicological profile for lead, United States Public Health Service, Agency for Toxic Substances and Disease Registry, August 2007 ATSDR (2008) Toxicological Profile for cadmium. United States Public Health Service, Agency for Toxic Substances and Disease Registry, September 2008 ATSDR (2008b) Toxicological profile for chromium. United States Public Health Service, Agency for Toxic Substances and Disease Registry, September 2008 Baral, A., Engelken, R., Stephens, W., Farris, J. & Hannigan, R. (2006) Evaluation of aquatic toxicities of chromium and chromium-containing effluents in reference to chromium electroplating industries. Archives of Environmental Contamination and Toxicology 50(4): 496-502 Battaglin, W.A. & Hay, L.E. (1996) Effects of sampling strategies on estimates of annual mean herbicide concentrations in Midwestern Rivers. Environmental Science and Technology 30: 889–896 Blount, B.C., Silva, M.J., Caudill, S.P., Needham, L.L., Pirkle, J.L., Sampson, E.J., Lucier, G.W., Jackson, R.J. & Brock, J.W. (2000) Levels of seven urinary phthalate metabolites in a human reference population. Environmental Health Perspectives 108(10): 979-982 Bryan, G.W. & Langston, W.J. (1992). Bioavailability, accumulation and effects of heavy metals in sediments with special reference to United Kingdom estuaries: a review. Environmental Pollution 76: 89-131 Butte, W. & Heinzow, B. (2002) Pollutants in house dust as indicators of indoor contamination. Reviews in Environmental Contamination and Toxicology 175: 1-46 Calafat, A.M., Ye, X., Wong,L.Y., Reidy, J.A. & Needham, L.L. (2008) Urinary concentrations of triclosan in 33 GRL-TN-05-2010 the U.S. population: 2003–2004. Environmental Health Perspectives 116: 303–307 Canfield, R.L., Henderson, C.R., Cory-Slechta, D.A., Cox, C., Jusko, T.A., Lanphear, B.P. (2003) Intellectual impairment in children with blood lead concentrations below 10 mu g per deciliter. New England Journal of Medicine 348(16): 1517-1526 Carlsson, H., Nilsson, U., Becker, G., and Ostman, C. (1997) Organophosphate flame retardants and plasticizers in the indoor environment: analytical methodology and occurrence. Environmental Science and Technology 31(10):2931-2936 Cempel, M., Nikel, G. (2006) Nickel: A review of its sources and environmental toxicology. Source: Polish Journal of Environmental Studies 15(3): 375-382 Cerejeira, M.J., Viana, P., Batista, S., Pereira, T., Silva, E., Valerio, M.J., Silva, A., Ferreira, M & SilvaFernandes, A.M. (2003) Pesticides in Portuguese surface and ground waters. Water Research 37: 1055– 1063 Colborn, T. (2006) A case for revisiting the safety of pesticides: a closer look at neurodevelopment. Environmental Health Perspectives 114: 10–17 Colon, I., Caro, D., Bourdony, C.J. & Rosario, O. (2000) Identification of phthalate esters in the serum of young Puerto Rican girls with premature breast development. Environmental Health Perspectives 108(9): 895900 Comber, S.D.W., Merrington, G., Sturdy, L., Delbeke, K., van Assche, F. (2008) Copper and zinc water quality standards under the EU Water Framework Directive: The use of a tiered approach to estimate the levels of failure. Science of the Total Environment 403(1-3): 12-22 Coogan, M.A., Edziyie, R.E., Point, T.W. La & Venables,B.J. (2007) Algal bioaccumulation of triclocarban, triclosan, and methyl-triclosan in a North Texas wastewater treatment plant receiving stream. Chemosphere 67 : 1911–1918 Cooper, R.L., Stoker, T.E., Tyrey, L., Goldman, J.M. & McElroy, W.K. (2000) Atrazine disrupts the hypothalamic control of pituitary–ovarian function. Toxicol. Sci. 53:297–307 Dalgaard, M., Nellemann, C., Lam, H.R., Sorensen, I.K. & Ladefoged, O. (2001) The acute effects of mono(2ethylhexyl)phthalate (MEHP) on testes of prepubertal Wistar rats. Toxicology Letters 122: 69-79 Danish EPA (2004). Mass flow analysis of mercury 2001. Environmental project 926. www2.mst.dk/Udgiv/publications/2004/87-7614-287-6/html/helepubl_eng.htm Davis, D.L & Ahmed, A.K. (1998) Exposures from indoor spraying of chlorpyrifos pose greater health risks to children than currently estimated. Environmental Health Perspectives 106(6): 299-301 DeLaune, R.D., Patrick, W.H. & Guo, T. (1998) The redox-pH chemistry of chromium in water and sediment. In Allen, H.E., Garrison, A.W., Luther, G.W., eds, Metals in Surface Waters. Ann Arbor, USA. ISBN:1575040875: 262 pp. Deleebeeck, N.M., De Schamphelaere, K.A., Janssen, C.R. (2008) A novel method for predicting chronic nickel bioavailability and toxicity to daphnia magna in artificial and natural waters. Environmental Toxicology and Chemistry 27(10): 2097–2107 Delpuech, J-M., Gareau, E., Terrier, O. & Fouillet, P. (1998) Sublethal effects of the insecticide chlorpyrifos on the sex pheromonal communications of Trichogramma Brassicae. Chemosphere 36(8): 1775-1785 DHHS (2005) 11th Report on Carcinogens. U.S. Department of Health and Human Services, US Public Health Service, National Toxicology Program EC (1995) Council Directive 95/61/EC of 29 November 1995 amending Annex II to Directive 90/642/EEC 34 GRL-TN-05-2010 relating to the fixing of maximum levels for pesticides in and on certain products of plant origin, including fruit and vegetables. OJ L 292:27-30 EC (2000) Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. OJ L 327: 1–73 EC (2001) Decision No 2455/2001/EC of the European Parliament and of the Council of 20 November 2001 establishing the list of priority substances in the field of water policy and amending Directive 2000/60/EC. OJ L 331: 1-5 EC (2005) Directive 2005/84/EC of the European Parliament and of the Council of 14 December 2005 amending for the 22nd time Council Directive 76/769/EEC on the approximation of the laws, regulations and administrative provisions of the Member States relating to restrictions on the marketing and use of certain dangerous substances and preparations (phthalates in toys and childcare articles). Official Journal of the European Communities L344, 27.12.2005: 40-43 http://eurlex. europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2005:344:0040:0043:EN ECHA (2010) Candidate List of Substances of Very High Concern for Authorisation, publ. European Chemicals Agency (ECHA), 13.01.2010 http://www.precidip.com/data/files/pdf/Candidate_List_of_Substances_of_Very_High_Concern_for_auth ori sation.pdf (accessed 04.05.2010) Ema, M. & Miyawaki, E. (2002) Effects on development of the reproductive system in male offspring of rats given butyl benzyl phthalate during late pregnancy. Reproductive Toxicology 16: 71-76 Fenske, R.A. & Lu, C. (1994) Determination of handwash removal efficiency: incomplete removal of the pesticide Chlorpyrifos from skin by standard handwash techniques. American Industrial Hygiene Association Journal 55(5): 425-432 Freeman, J.L., Beccue, N. & Rayburn, A. L. (2005) Differential metamorphosis alters the endocrine response in anuran larvae exposed to T3 and atrazine. Aquatic Toxicology 75(3): 263-276 Friedmann, A.S. (2002) Atrazine inhibition of testosterone production in rat males following peripubertal exposure. Reproductive Toxicology 16(3): 275-279 Fromme H., Lahrz T., Piloty M., Gebhart H., Oddoy A. & Rüden H. (2004) Occurrence of phthalates and musk fragrances in indoor air and dust from apartments and kindergartens in Berlin (Germany). Indoor Air 14 (3): 188-195 Gallo, M.A. & Lawryk, N.J. (1991) Organic phosphorus pesticides. In: Handbook of pesticide toxicology. [Eds] Hayes, W.J. & Laws, E.R. Vol.2 Classes of pesticides. Academoc Press, Inc. ISBN 0-12-334163-9: 9171123 Ghosh, P.K. & Philip, L. (2004) Atrazine degradation in anaerobic environment by a mixed microbial consortium. Water Research 34: 2277–2284 Giddings, M., Meek, M.E. & Gomes, R. (1994a) Trichlorobenzenes: Evaluation of risks to health from environment exposure in Canada. Environ. Carcin. Ecotox. Revs. C12(2): 517-525 Giddings, M., Meek, M.E. & Gomes, R. (1994b) Tetrachlorobenzenes: Evaluation of risks to health from environment exposure in Canada. Environ. Carcin. Ecotox. Revs. C12(2): 473-481 Giddings, M., Meek, M.E. & Gomes, R. (1994c) Pentachlorobenzene: Evaluation of risks to health from environment exposure in Canada. Environ. Carcin. Ecotox. Revs. C12(2): 435-441 Godt, J., Scheidig, F., Grosse-Siestrup, C, Esche, V., Brandenburg, P., Reich, A., Groneberg, D.A. (2006) The toxicity of cadmium and resulting hazards for human health. Journal of Occupational Medicine and Toxicology 1(22): 1-6 Grande, S. W., Andrade, A. J., Talsness, C. E., Grote, K. & Chahoud, I. (2006) A dose–response study following in utero and lactational exposure to di(2-ethylhexyl)phthalate: effects on female rat reproductive development. Toxicol. Sci. 91: 247–254 35 GRL-TN-05-2010 Gray Jr, L. E. Laskey, J. & Ostby, J. (2006) Chronic di-n-butyl phthalate exposure in rats reduces fertility and alters ovarian function during pregnancy in female Long Evans hooded rats. Toxicol. Sci. 93: 189–195 Gurunathan, S., Robson, M., Freeman, N., Buckley, B., Roy, A., Meyer, R., Bukowski, J. & Lioy, P.J.(1998) Accumulation of chlorpyrifos on residential surfaces and toys accessible to children. Environmental Health Perspectives 106(1): 9-16 Hawkins, T.R., Matthews, H.S. & Hendrickson, C. (2006) Closing the Loop on Cadmium. An Assessment of the Material Cycle of Cadmium in the U.S. The International Journal of Life Cycle Assessment 11(1): 3848 Hellstrom, L., Elinder, C.G., Dahlberg, B.,Lundberg, M., Jarup, L., Persson, B., & Axelson, O. (2001) Cadmium Exposure and End-Stage Renal Disease. American Journal of Kidney Diseases, 38(5), 10011008 Hope, B.K. & Rubin, J.R. (2005) Mercury levels and relationships in water, sediment, and fish tissue in the Willamette Basin, Oregon. Archives of Environmental Contamination and Toxicology 48(3): 367-380 Howdeshell, K. L., Wilson, V. S., Furr, J., Lambright, C. R., Rider, C. V., Blystone, C. R., Hotchkiss, A. K. & Gray Jr, L. E. (2008) A mixture of five phthalate esters inhibits fetal testicular testosterone production in the Sprague Dawley rat in a cumulative dose additive manner. Toxicol. Sci. 105: 153–165 Hua, W., Bennett, E.R. & Letcher, R.J. (2005) Triclosan in waste and surface waters from the upper Detroit River by liquid chromatography-electrospray-tandem quadrupole mass spectrometry. Environment International 31(5):621-630 Hua, W., Bennett, E.R. & Letcher, R.J. ( 2006) Ozone treatment and the depletion of detectable pharmaceuticals and atrazine herbicide in drinking water sourced from the upper Detroit River, Ontario, Canada. Water Research 40(12): 2259-2266 Hutter, H.-P., Wallner, P., Moshammer, H., Hartl, W., Sattelberger, R., Lorbeer, G. & Kundi M. (2005) Blood concentrations of polycyclic musks in healthy young adults. Chemosphere 59(4): 487-492 IARC (1990) Nickel and certain nickel compounds. In: International Agency for Research on Cancer (IARC) monographs on the evaluation of the carcinogenic risk of chemicals to humans. Volume 49; Chromium, Nickel and Welding. ISBN 9283212495 ICPS (International Program on Chemical Safety) (1998) Environmental Health Criteria 209: Flame retardants: Tris(chloropropyl) phosphate and tris(2-chloroethyl) phosphate. Geneva: World Health Organization International Agency for Research on Cancer, IARC (1990) Chromium. In International Agency for Research on Cancer (IARC) monograph; Chromium, Nickel and Welding. IARC monograph, Vol. 49, 677pp. ISBN 9283212495 IPCS (2001) Zinc, Environmental Health Criteria, No. 221, International Programme on Chemical Safety, UNEP/ILO/WHO, ISBN 9241572213 James, M.O., Li, W., Summerlot, D.P., Rowland-Faux, L. & Wood, C.E. (in press) Triclosan is a potent inhibitor of estradiol and estrone sulfonation in sheep placenta. Environment International, In Press, Corrected Proof, Available online 18 March 2009 Jusko, T.A., Henderson Jr., C.R., Lanphear, B.P., Cory-Slechta, D.A., Parsons, P.J., R.L. Canfield (2008) Blood lead concentrations < 10 μg/dL and child intelligence at 6 years of age. Environmental Health Perspectives 116(2): 243-248 Koch, H. M., Preuss, R. & Angerer, J. (2006) Di(2-ethylhexyl)phthalate (DEHP): human metabolism and internal exposure—an update and latest results. Int. J. Androl. 29: 155–165 Landrigan, P.J. (2001) Pesticides and polychlorinated biphenyls (PCBs): an analysis of the evidence that they 36 GRL-TN-05-2010 impair children's neurobehavioral development. Molecular Genetics and Metabolism 73: 11–17 Landrigan, P.J., Claudio, L., Markowitz, S.B., Berkowitz, G.S., Brenner, B.L., Romero, H., Wetmur, G.J.,Matte, T.D., Gore, A.C., Godbold, G.H. & Wolff, M.S. (1999) Pesticides and inner-city children: exposures, risks, and prevention. Environmental Health Perspectives 107(Suppl. 3): 431-437 Liao, Ch-S., Yen, J-H., Wang, Y-Sh. (2006) Effects of endocrine disruptor di-n-butyl phthalate on the growth of Bok choy (Brassica rapa subsp. chinensis). Chemosphere 65: 1715–172 Lin C-J. (2002) The chemical transformations of chromium in natural waters - A model study. Water air and soil pollution 139 (1-4): 137-158 Lin, H., Ge, R.-S., Chen, G.-R., Hu, G.-X., Dong, L., Lian, Q.-Q., Hardy, D.O., Sottas, C.M., Li, X.-K. & Hardy, M.P. (2008) Involvement of testicular growth factors in fetal Leydig cell aggregation after exposure to phthalate in utero. Proc. Natl Acad. Sci. USA 105(20): 7218–7222 Long, E.R., & Morgan, L.G. (1990) The potential for biological effects of sediment sorbed contaminants tested in the National Status and Trends Program. NOAA Technical Memorandumn, NOS OMA 52, NOAA Office of Oceanography and Marine Assessment, Seattle. 220 pp. http://ccma.nos.noaa.gov/publications/tm52.pdf Lovekamp-Swan T. & Davis B.J. (2003) Mechanisms of phthalate ester toxicity in the female reproductive system. Environmental Health Perspectives 111(2): 139-145 Mahaffey, K.R., Clickner, R.P. & Bodurow, C.C. (2004) Blood Organic Mercury and Dietary Mercury Intake: National Health and Nutrition Examination Survey, 1999 and 2000. Environmental Health Perspectives 112(5): 562-570 Martino-Andrade, A. J., Morais, R. N., Botelho, G. G., Muller, G., Grande, S. W., Carpentieri, G. B., Leão, G. M. & Dalsenter, P. R. (2008) Coadministration of active phthalates results in disruption of foetal testicular function in rats. Int. J. Androl., Dec. 2008: 9pp. (DOI 10.1111/j.1365-2605.2008.00939) Meek, M.E., Giddings, M. & Gomes, R. (1994) Monochlorobenzene: evaluation of risks to health from environmental exposure in Canada. Environ. Carcin. Ecotox. Revs. 12(2): 409-415 Mehler, W. T., Schuler, L. J. & Lydy, M.J. (2008) Examining the joint toxicity of chlorpyrifos and atrazine in the aquatic species: Lepomis macrochirus, Pimephales promelas and Chironomus tentans. Environmental Pollution 152(1): 217-224 Metcalf (1995) Insect control technology. In: Kirk-Othmer Encyclopedia of Chemical Technology. [Eds] Kroschwits, J.I. & Home-Grant, M. 4th Edition. Vol.14. Imagine technology to lanthanoides. John Wiley& Sons. Inc. ISBN 0-471-52683-5: 524-602 Mullie, W.C. & Keith, J.O. (1993) The effects of aerially applied fenitrothion and chlorpyrifos on birds in the savannah of northern Senegal. Journal of Applied Ecology 30: 536-550 Mylchreest, E., Sar, M.,Wallace, D.G. & Foster, P.M.D. (2002) Fetal testosterone insufficiency and abnormal proliferation of Leydig cells and gonocytes in rats exposed to di(n-butyl) phthalate. Reproductive Toxicology 16: 19-28 Narotsky, M.G., Best, D.S., Guidici, D.L. & Cooper, R.L. (2001) Strain comparisons of atrazine-induced pregnancy loss in the rat, Reproductive Toxicology 15 : 61–69 NMHSPE (2000) Circular on target values and intervention values for soil remediation. The Netherlands Ministry of Housing, Spatial Planning and the Environment, Amsterdam. http://international.vrom.nl/Docs/internationaal/ annexS_I2000.pdf NRC (National Research Council) (2000) Toxicological risks of selected flame-retardant chemicals. National Academy Press. Washington DC, ISBN 0-309-07047-3, 512p. 37 GRL-TN-05-2010 OSPAR (1998) OSPAR Strategy with Regard to Hazardous Substances, OSPAR Convention for the Protection of the Marine Environment of the North-East Atlantic, OSPAR 98/14/1 Annex 34 Otake,T., Yoshinaga, J. & Yanagisawa, Y. (2001) Analysis of organic esters of plasticizer in indoor air by GCMS and GC-FPD. Environmental Science and Technology 35(15): 3099-3102 Paul, D.C. & Steven, J.L. (2001) Effect of scale on the behavior of atrazine in surface waters. Environmental Science and Technology 35: 648–657 Rauh, V.A., Garfinkel, R., Perera, F.P., Andrews, H.F., Hoepner, L., Barr, D.B., Whitehead, R. Tang, D. & Whyatt, R.W. (2006 ) Impact of Prenatal Chlorpyrifos Exposure on Neurodevelopment in the First 3 Years of Life Among Inner-City Children. Pediatrics 118( 6): e1845-e1859 Rimkus, G.G. (1999) Polycyclic musk fragrances in the aquatic environment. Toxicology Letters 111: 3756 Rodriguez, V.M., Thiruchelvam, M. & Cory-Slechta, D.A. (2005) Sustained exposure to the widely used herbicide atrazine: altered function and loss of neurons in brain monoamine systems. Environmental Health Perspectives 113: 708–715 RSC (1987) The Agrochemicals Handbook. [Eds] Hartley, D. & Kidd, H. Second Edition. The Royal Society Of Chemistry. ISBN 0 85186 416 3 Saint-Fort, R. (1991) Ground water contamination by anthropogenic organic compounds from waste disposal sites: transformation and behaviour. Journal of Environmental Science and Health A26(1): 13-62 Salaberria, I., Hansen, B.H., Asensio, V. Olsvik, P.A., Andersen, R.A. & Jenssen, B.M. (2009) Effects of atrazine on hepatic metabolism and endocrine homeostasis in rainbow trout (Oncorhynchus mykiss).Toxicology and Applied Pharmacology 234 (1): 98-106 Salomons, W. & Forstner, U. (1984) Metals in the hydrocycle. Springer-Verlag, Berlin, Heidelberg, New York, Tokyo, ISBN 3540127550 Sandahl, J.F., Baldwin, D.H., Jenkins, J.J. & Scholz, N. (2007) A sensory system at the interface between urban stormwater runoff and salmon survival. Environmental Science & Technology, 41(8): 2998-3004 Sanders, T., Liu, Y., Buchner, V., Tchounwou, P.B. (2009) Neurotoxic effects and biomarkers of lead exposure: a review. Reviews on Environmental Health 24(1): 15-45 Sherman, J.D. (1996) Chlorpyrifos (Dursban) – associated birth defects: report of four cases. Archives of Environmental Health 51(1): 5-8 SH-SY5Y cells. Toxicology 253( 1-3): 28-35 Silva, M.J., Barr, D.B., Reidy, J.A., Malek, N.A., Hodge, C.C., Caudill, S.P., Brock, J.W., Needham, L.L. & Calafat, A.M. (2004) Urinary levels of seven phthalate metabolites in the U.S. population from the National Health and Nutrition Examination Survey (NHANES) 1999-2000. Environmental Health Perspectives 112(3): 331-338 Slotkin, T.A. (1999) Developmental cholinotoxicants: nicotine and chlorpyrifos. Environmental Health Perspectives 107(Suppl. 1): 71-80 Song, Y. ,. Zhu, L.S, Wang, J., Wang, J.H., Liu, W. & Xie, H. (2009) DNA damage and effects on antioxidative enzymes in earthworm (Eisenia foetida) induced by atrazine.Soil Biology and Biochemistry 41(5): 905-909 Sumner, N.R., Guitart, C., Fuentes, G. & Readman, J.W. (2010) Inputs and distributions of synthetic musk fragrances in an estuarine and coastal environment; a case study. Environmental Pollution 158: 215-222 Swan, S.H., Main, K.M., Liu, F., Stewart, S.L., Kruse, R.L., Calafat, A.M., Mao, C.S., Redmon, J.B., Ternand, C.L., Sullivan, S. & Teague, J.L. (2005) Decrease in anogenital distance among male infants with prenatal phthalate exposure. Environmental Health Perspectives 113(8): 1056-1061 38 GRL-TN-05-2010 Szpir, M. ( 2006) New thinking on neurodevelopment Environmental Health Perspectives 114: A101– A107 Ternes, T.A., Meisenheimer, M., Mcdowell, D., Sacher, F., Brauch, H.-J., Haist-Gulde, B., Preuss, G., Wilme, U. & Zulei-Seibert, N. (2002) Removal of pharmaceuticals during drinking water treatment. Environmental Science and Technology 36: 3855–3863 UNEP (2002) Global Mercury Assessment, United Nations Environment Programme (UNEP) Chemicals, Geneva, Switzerland. Available at; www.chem.unep.ch/mercury US EPA (1997) Agreement reached between EPA and chlorpyrifos pesticide registrants. EPA Press Release. Washington, DC. US Environmental Protection Agency, 6 June 1997 US EPA (2006) Reregistration Eligibility Decision for Chlorpyrifos. US Environmental Protection Agency Office of Pesticide Programs. http://www.epa.gov/pesticides/reregistration/REDs/chlorpyrifos_red.pdf (accessed 05.05.2010) US EPA (2009) New Limits on Pesticide Uses Will Protect Salmon . US Environmental Protection Agency Office of Pesticide Programs. www.epa.gov/pesticides/op/chlorpyrifos/summary.htm. (accessed 05.05.2010) US EPA (2009a) Atrazine Science Reevaluation: Potential Health Impacts. US EPA, Office of Chemical Safety and Pollution Prevention October 7, 2009. http://www.regulations.gov/search/Regs/home.html#documentDetail?R=0900006480a3dabc (accessed 06.05.2010) US EPA (2009b) Atrazine updates. US EPA, Office of Chemical Safety and Pollution Prevention. http://www.epa.gov/pesticides/reregistration/atrazine/atrazine_update.htm (accessed 06.05.2010) van der Burg, B., Schreurs, R., van der Linden, S., Seinen, W., Brouwer, A. & Sonneveld, E. (2008) Endocrine effects of polycyclic musks: do we smell a rat? International Journal of Andrology 31: 188-193 Verstraeten, I.M., Thurman, E.M., Lindsey, M.E., Lee, E.C., & Smith, R.D. (2002) Changes in concentrations of triazine and acetamide herbicides by bank filtration, ozonation, and chlorination in public water supply. Journal of Hydrology 266: 190–208 Victor-Costa, A.B., Bandeira, S.M.C., Oliveira, A.G., Mahecha, G.A.B, Oliveira, C.A. (2010) Changes in testicular morphology and steroidogenesis in adult rats exposed to Atrazine.Reproductive Toxicology 29(3): 323-331 Virtanen, J.K., Voutilainen, S., Rissanen, T.H., Mursu, J., Tuomainen, T., Korhonen, M.J., Valkonen, V., Seppa¨nen, K., Laukkanen, J.A., Salonen, J.T. (2005) Mercury, Fish Oils, and Risk of Acute Coronary Events and Cardiovascular Disease, Coronary Heart Disease, and All-Cause Mortality in Men in Eastern Finland. Arteriosclerosis, Thrombosis and Vascular Biology 25: 228-233 Ware, G.W. (Ed.)(1988a) Chlorobenzene. Rev. Environ. Contam.Toxicol. 106: 37-49 Ware, G.W. (Ed.)(1988b) Ortho-, meta- and para- dichlorobenzene. Rev. Environ. Contam.Toxicol. 106: 51-56 WHO (2004) Chlorobenzenes other than hexachlorobenzene: environmental aspects. Concise international chemical assessment document: 60. ISBN 92 4 153060 X, ISSN 1020-6167, Geneva 2004 WHO, World Health Organisation (1989) Lead; environmental aspects. Environmental Health Criteria 85. ISBN 9241542853 WHO, World Health Organisation (1992) Cadmium. Environmental Health Criteria 135. ISBN 9241571357 William, A.B. & Lauren, E.H. (1996) Effects of sampling strategies on estimates of annual herbicide concentrations in Midwestern rivers Environmental Science and Technology 30: 889–896 Winkelmann, D.A. & Klaine, SJ, (1991) Degradation and bound residue formation of four atrazine metabolites, deethylatrazine, deisopropylatrazine and hydroxyatrazine, in a western Tennessee soil. Environmetal Toxicology and Chemistry 10:347–354 39 GRL-TN-05-2010 World Health Organisation (1989) Mercury. Environmental Health Criteria 86. ISBN9241542861 Yan, R-M., Chiung, Y-M., Pan, C-Y., Liu, J-H. & Liu, P-S. (2008) Effects of dichlorobenzene on acetylcholine receptors in human neuroblastom Brimijoin, S. & Koenigsberger, S. (1999) Cholinesterases in neural development: new findings and toxicologic implications. Environmental Health Perspectives 107(Suppl.1): 59-64 40 GRL-TN-05-2010 Anexo 1. Metodo analítico Análisis para compuestos orgánicos volátiles (VOCs) Método Los VOCs fueron analizados usando un cromatógrafo de gases Agilent 6890 con una columna Rtx-624 (30m, 0.25mm ID, grosor de película de 1.4μm) conectado a un muestreador de espacio de cabeza Agilent 7694 acoplado a un MSD Agilent 5973N operado en modo EI (Ionización por impacto electrónico). El programa de temperatura del horno del cromatógrafo de gases (GC) incluía una temperatura inicial de 35ºC (mantenida durante 4 min), subiendo a 55 ºC a 5ºC/min y luego a 210ºC a 15ºC/min. El gas portador fue el Helio, que fue administrado de a 1ml/min. Para cada muestra, se hizo un sub-muestreo de tres porciones de 10ml y se las colocó en viales de espacio de cabeza de 20ml. Una sub-muestra fue analizada con GC-MS en modo SCAN (monitoreo de iones totales) para identificar la mayor cantidad posible de compuestos volátiles presentes. La identificación de los compuestos se realizó comparando los espectros con la biblioteca Wiley7N, empleando un criterio experto a fin de evitar errores en la identificación. Las dos sub-muestras restantes fueron entonces usadas para un análisis cuantitativo duplicado para aquellos VOCs halogenados (clorados, bromados, mixtos) detectados en las muestras a través del screening. La cuantificación se llevó a cabo en modo SIM (monitoreo selectivo de iones) utilizando un método de calibración externa de 5 puntos. Los VOCs cuantificados en las muestras de agua junto con sus límites de detección y cuantificación se presentan en la Tabla 6. Control de calidad La desviación estándar (DS), desviación estándar relativa (DSR) y los límites de detección (LD) fueron calculados utilizando la información de siete réplicas de una mezcla estándar de los VOCs más frecuentes, conteniendo 1ppb de cada analito. Los límites de cuantificación (LC) fueron determinados como la concentración más baja en la regresión linear usada para cuantificación. También se analizaron una serie de blancos de laboratorio cubiertos en el momento en que tuvo lugar el submuestreo junto a muestras del agua de reactivo ultra pura que se utilizó para la preparación de las soluciones de calibración estándares (o soluciones patrón de calibración). Previo al análisis de las muestras, la curva inicial de calibración para cada compuesto de interés fue inmediatamente verificada, mediante el análisis del patrón de calibración a una concentración cercana al punto medio de concentración para el rango de calibración del GC-MS. La identificación de los compuestos se realizó comparando los espectros con la biblioteca Wiley7N y la de Pesticidas, empleando un criterio experto a fin de evitar errores en la identificación. Además, tanto el espectro como el tiempo de retención de los compuestos aislados de las muestras fueron comparados con aquellos obtenidos durante un análisis GC-MS de mezclas estándar que contenían un rango de bencenos clorados, fenoles y pesticidas, bifenilos policlorados (PCBs), ftalatos, hidrocarburos aromáticos policíclicos (HAPs) e hidrocarburos alifáticos. 41 GRL-TN-05-2010 Compuesto LC, μg/l LD, μg/l DS, μg/l DSR, % r2 Cloroformo 0.3 0.3 0.05 4.5 0.999 Bromoformo 0.5 0.4 0.06 6.6 0.999 Eteno, dicloro0.4 0.4 0.06 5.6 1.000 Eteno, 1,2 dicloro-, cis-* 1.0 1.0 0.20 10.1 0.999 Eteno, tricloro0.4 0.4 0.06 7.1 0.999 Eteno, tretracloro0.3 0.3 0.05 5.1 0.999 Etano, 1,1,1 tricloro0.3 0.3 0.05 4.3 0.999 Etano, 1,2 dicloro-* 1.0 1.0 0.21 9.4 1.000 Etano, 1,1,2,2 tetracloro0.2 0.2 0.04 6.1 1.000 Metano, bromodicloro-* 0.5 0.5 0.09 3.7 0.997 Metano, dibromocloro0.5 0.2 0.03 3.9 0.999 Metano, dicloro0.2 0.2 0.03 4.3 0.999 Metano, tetracloro0.3 0.3 0.05 3.9 0.999 Tabla 6. La desviación estándar (DS), desviación estándar relativa (DSR) y el límite de detección (LD) fueron calculados utilizando las concentraciones de siete réplicas de la mezcla estándar que contenían 1ppb de cada analito. El límite de cuantificación (LC) es la concentración más baja en la regresión linear (r2 – coeficiente de correlación correspondiente) utilizado para la cuantificación. * - se usaron 2ppb de analito. Análisis para compuestos orgánicos extraíbles Preparación Se agregaron, como estándar interno (EI), 20 μg de naftaleno deuterado a cada porción de muestra sujeta a la extracción. Para las muestras de sedimento, se extrajeron aproximadamente 10g de cada muestra (peso mojado), utilizando la técnica de Extracción Acelerada con Solventes (ASE) usando un Dionex ASE-350 con una mezcla de pentano y acetona 3:1, a una temperatura de 100ºC. Las muestras de agua (500ml) fueron preparadas usando la técnica de Extracción en Fase Sólida con un puesto de trabajo automatizado Dionex AutoTrace, y los solventes de elución fueron etil acetato seguido de una mezcla de pentano y tolueno 95:5. Los extractos obtenidos fueron concentrados a un volumen de 3ml con un chorro de nitrógeno limpio previo al análisis. Los procedimientos de limpieza fueron los mismos para los extractos crudos tanto de las muestras de agua como de las de sedimentos. Cada extracto fue agitado con 3ml de alcohol isopropílico y 3ml de reactivo TBA (una mezcla de 3% de tetrabutilamonio hidrógeno sulfato y 20% de sulfito de sodio en agua desionizada), y se dejaron reposar hasta que las fases acuosas y orgánicas quedaron separadas. La fase del pentano fue recolectada y eluída a través de una columna de Forisil, utilizando un eluyente mixto 95:5 de pentano y tolueno, y el extracto limpio fue concentrado a un volumen final de 1ml como antes. Se agregaron 20 μg de bromonaftaleno a cada extracto como segundo EI, previo al análisis GC-MS. Análisis Para el screening de compuestos orgánicos totales, las muestras fueron analizadas usando un Agilent 5890 Series II GC con una columna Restek Rtx-XLB (30m, 0.25mm ID, 0.25 μm de grosor de película) acoplado a un Agilent 5972 MSD operado en modo EI e interfaseado con un sistema de datos Agilent Enhanced Chem Station. El programa de temperatura del horno del cromatógrafo de gases (GC) incluía una temperatura inicial de 35ºC (mantenida durante 2 min), subiendo a 260 ºC a 10ºC/min y luego a 42 GRL-TN-05-2010 320ºC a 6ºC/min (mantenida por 8 min). El gas portador fue el Helio, que fue administrado de a 1ml/min. Control de calidad Se analizó también una serie de blancos de extracción y solvente para asegurar la detección de cualquier contaminación posible resultante del manejo de las muestras en el laboratorio. Análisis para metales y metaloides Preparación Se separó una porción representativa de cada muestra de sedimento y fueron secadas hasta peso constante, homogeneizadas, tamizadas a través de una malla de 2mm, y luego molidas y reducidas a polvo con un mortero. Se digirieron 0.5g de cada muestra con 2ml de ácido clorhídrico concentrado y 8ml de ácido nítrico concentrado, la primer jornada a temperatura ambiente y luego usando la digestión asistida por microondas con un sistema CEM MARS Xpress, con una rampa de temperatura hasta 180ºC en 15 min, seguida de un mantenimiento a 180ºC por 15min más. Luego de ser enfriadas, fueron filtradas y llevadas a 50ml con agua desionizada. Análisis Las muestras preparadas del producto de la digestión fueron analizadas por Espectrometría de Emisión Atómica con Plasma Acoplado por Inducción (ICP-AES) utilizando un espectrómetro simultáneo Varian MPX. Para la calibración de los instrumentos se usaron estándares multi-elementales a concentraciones de 0.5, 1.0, 2.5 y 10mg/l respectivamente, y matrices de muestra correspondientes. Cualquier muestra que excediese el rango de calibración fue diluida acordemente, por duplicado, y reanalizada. El análisis del contenido de mercurio en las muestras se llevó a cabo en forma separada. El mercurio (Hg) se determinó utilizando ICP-AES con generación de vapor frío. El Hg (II) fue reducido a mercurio elemental, Hg (0), haciendo reaccionar la muestra con borohidruro sódico (0.6% w/v), hidróxido de sodio (0.5% w/v) y ácido clorhídrico (10 molar). El vapor de mercurio elemental fue transportado por un chorro de argón hacia el espectrómetro. Se prepararon los dos estándares de calibración, a 10 ug/l y 100 ug/l, con los matrices de muestra correspondientes. Control de calidad Para las muestras de sedimentos, se prepararon dos muestras por duplicado y fueron analizadas para verificar la reproductibilidad del método, junto con el blanco preparado en forma idéntica. Para chequear la eficiencia del método, se prepararon de igual forma, muestras a modo de materiales de referencia certificados (MRC); GBW07311: sedimento de arroyo certificado por el Centro de Análisis Nacional de China para Hierro y Acero, Beijing, China; y LGC6187: metales lixiviables en sedimentos de río certificados por el Laboratorio Químico Gubernamental del Reino Unido. Para las muestras de agua, se prepararon tres muestras completas y cuatro muestras filtradas en duplicado, y fueron analizadas para verificar la reproductibilidad del 43 GRL-TN-05-2010 método, junto con un blanco (10%v/v de ácido nítrico en agua desionizada), y una solución de metales mixtos de 4mg/l a modo de control de calidad, distinta a la de mercurio a 80 μg/l. Todas las muestras control fueron preparadas de igual manera a las muestras. La calibración del ICP-AES fue validada por el uso de estándares de control de calidad a 8mg/l y 0.8mg/l (muestras de sedimentos) o 4mg/l y 0.4mg/l (muestras de agua), preparadas de forma idéntica pero con stocks de reactivos diferentes a los de los estándares de calibración instrumental. Para el análisis de mercurio con generación de vapor frío, la calibración fue validada usando dos estándares de control de calidad (10 ug/l and 80 ug/l), preparadas internamente de diferentes stocks de reactivos. Más detalles sobre los métodos empleados pueden ser provistos a pedido. 44 GRL-TN-05-2010