Anovulación: Diagnóstico y tratamiento
Anuncio

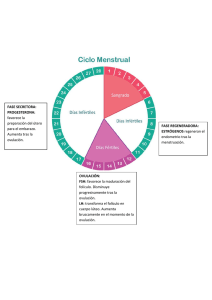
Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento Servicio de Obstetricia y Ginecología Hospital Universitario Virgen de las Nieves Granada ANOVULACIÓN: DIAGNÓSTICO Y TRATAMIENTO. Mª Dolores Moreno Martínez 11 de Marzo de 2010 1.- OVULACIÓN La capacidad reproductiva de la mujer se debe a los cambios cíclicos en la secreción de las hormonas del eje hipotálamo-hipófisis-gónada (ovario) con el objetivo de ovular un ovocito maduro competente para ser fecundado y a los cambios fisiológicos correspondientes que suceden en el sistema reproductor. Este patrón se denomina ciclo ovárico y suele tener entre 20 y 45 días de duración. La maduración ovocitaria sucede durante el período de foliculogénesis a través de la meiosis, que en la mujer es un período excepcionalmente largo al detenerse antes del nacimiento en profase I de la primera división meiótica. Desde este momento y hasta la menopausia, existe un período continúo de atresia folicular, pudiendo estimarse que al alcanzar la pubertad la mujer cuenta tan solo con unos 400.000 folículos en la corteza externa del ovario, de los que tan solo el 0,1% llegarán a completar su desarrollo con ovulación. A la edad de 9-12 años y tras conseguir un adecuado peso corporal (grasa), las hormonas gonadotróficas FSH y LH, producidas en la hipófisis anterior o adenohipófisis tras la liberación pulsátil de GnRH hipotalámica, comienzan a aumentar su secreción y son las encargadas de reactivar la foliculogénesis y con ello el ciclo ovárico entre los 11 y 15 años habitualmente. La sucesión de una serie de eventos perfectamente coordinados entre hipotálamo, hipófisis y el ovario que se van repitiendo en cada nuevo ciclo, asegura dos objetivos principales: el primero, la liberación de un único óvulo Mª Dolores Moreno Martínez / Jorge Fernández Parra -1- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento cada mes y el segundo, la preparación del endometrio uterino para la implantación de un posible óvulo fecundado. En un hipotético ciclo menstrual de 28 días de duración tendríamos que considerar 4 fases: menstruación (entre días 0 y 5); folicular (días 0 al 13); ovulación (días 13 al 14) y lútea (14 al 28). -Menstruación: La menstruación es el sangrado vaginal cíclico debido a la descamación del endometrio cuando no ha tenido lugar embarazo. Durante la menstruación los niveles de estrógenos, progesterona e inhibina son bajos por la regresión del cuerpo lúteo y por la menor capacidad de síntesis de estrógenos por los folículos inmaduros. Los niveles de FSH son altos, mientras que los de LH son bajos. -Fase folicular: Un folículo primordial (inmaduro) llega a convertirse en folículo de De Graff (maduro), capaz de ovular. En esta fase la FSH estimula algunos folículos para progresar a folículos preantrales. La hormona FSH también promueve la proliferación de la granulosa, el aumento de la actividad aromatasa y los niveles de estradiol (entre los días 3 y 7, alcanzando el pico en torno a 300 pg/mL el día 12). El folículo dominante es seleccionado entre los días 5 y 7 (el que tiene mayor número de receptores de FSH y mayor actividad aromatasa), involucionando los otros folículos que habían iniciado el ciclo. -Ovulación: La liberación del ovocito desde el folículo de De Graaf maduro tiene lugar 72 horas después del pico de LH. Durante el aumento de la LH, el folículo preovulatorio se hincha y protruye en el epitelio ovárico. Aparece un estigma o mancha avascular en la superficie del folículo. Se forma una pequeña vesícula en el estigma, la cual termina por romperse permitiendo la expulsión del ovocito junto a algunas células de la granulosa que lo rodean (cúmulo). -Fase lútea: Las células de la teca y la granulosa se reorganizan para formar el cuerpo lúteo (cuerpo amarillo) que da nombre a esta fase. Una vez que el ovocito sale del folículo roto, la LH induce la secreción de progesterona por las células granulosas remanentes ya reorganizadas. La progesterona y el Mª Dolores Moreno Martínez / Jorge Fernández Parra -2- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento estradiol siguen aumentando hasta alcanzar las cifras más altas el día 22, lo cual produce la disminución de los niveles de FSH y LH por feedback negativo. La regresión del cuerpo lúteo tiene lugar los días 24 al 26 con el consiguiente descenso de hormonas sexuales que conduce a la menstruación y producen un feedback positivo hipotalámico que estimula de nuevo a la FSH y LH para iniciar un nuevo ciclo. Estos cambios podríamos reflejarlos en conjunto en el siguiente esquema: Mª Dolores Moreno Martínez / Jorge Fernández Parra -3- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento 2.- ANOVULACIÓN Cualquier alteración en la cadena de acontecimientos fisiológicos antes expuestos conduce a ciclos anovulatorios. La anovulación puede presentarse como un amplio espectro de manifestaciones clínicas, pero el síntoma principal es la amenorrea o ausencia de menstruación. La anovulación no es una enfermedad, si no un signo; de la misma forma que los ovarios poliquísticos son la manifestación de un trastorno mucho más amplio. Debemos diferenciar entre amenorrea primaria -cuando la paciente no ha menstruado a los 16 años, o bien a los 14 asociado a falta de crecimiento o defecto de desarrollo de caracteres sexuales secundarios- y amenorrea secundaria -cuando una paciente con ciclos menstruales deja de tener menstruación durante un intervalo equivalente a un total de al menos tres de los intervalos entre los ciclos anteriores o durante 6 meses. Sin embargo, lo fundamental es establecer el nivel donde tiene lugar el origen de la patología que ocasiona la anovulación dadas las distintas implicaciones que tiene la alteración de cada compartimento y sus distintos esquemas terapéuticos. Las distintas clasificaciones existentes de amenorrea (OMS, Speroff, SEGO, ASRM) son contradictorias, no siempre prácticas para la clínica diaria y en algún caso han quedado obsoletas después de los cambios y consensos que han tenido lugar dentro de la endocrinología ginecológica en los últimos años. Por ello el Grupo de Interés de Endocrinología Ginecológica (GIER) de la Sociedad Española de Fertilidad (SEF) ha planteado una nueva clasificación de las amenorreas, sencilla, útil y práctica a la hora de abordar su estudio y que enlace con esquemas diagnósticos de iguales características que permitan en el menor tiempo posible localizar la patología y realizar un tratamiento. Mª Dolores Moreno Martínez / Jorge Fernández Parra -4- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento Tabla 5. PROPUESTA CLASIFICACIÓN DE AMENORREAS (GIER 2009) orgánica AMENORREA CENTRAL hipotalámica funcional hipofisaria orgánica funcional hiperprolactinemia (*) fallo ovárico AMENORREA GONADAL SOP - endocrinopatías uterina AMENORREA GENITAL vaginal * Conceptualmente entidad hipotálamo o hipofisaria Causas que provocan amenorrea primaria: a) Hipotalámicas: fallo en la producción de GnRH. a. Fallo hipotalámico: hipogonadismo hipogonadotrófico. La histiocitosis X o Síndrome de Hand- Schüller- Christian es una enfermedad provocada por la infiltración y destrucción hipotalámica por parte de los histiocitos, afecta fundamentalmente a niños. Clínicamente se manifiesta como alteraciones visuales, hiperprolactinemia, hipopituitarismo, anovulación, obesidad y alteración del crecimiento. Su diagnóstico es histológico. El tratamiento se realiza con radioterapia y hormona del crecimiento. b. Síndrome de Kallman. Déficit congénito de GnRH que asocia anosmia y amenorrea. c. Idiopático. b) Hipofisarias: reducción en la producción FSH y/o LH. Alteraciones del gen del receptor de GnRH pueden provocar deficiencia de gonadotrofinas. c) Ováricas: a. Síndrome de Turner y disgenesias gonadales. b. Síndrome de feminización testicular. Mª Dolores Moreno Martínez / Jorge Fernández Parra -5- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento c. Endocrinopatías: Hiperplasia suprarrenal congénita: Abarca un grupo de trastornos autosómicos recesivos causados por déficits enzimáticos en la síntesis de cortisol a nivel de la corteza suprarrenal. De mayor a menor frecuencia son: déficit de 21hidroxilasa, déficit de 11-alfa- hidroxilasa y déficit de 3-betahidroxiesteroide deshidrogenasa. d) Genitales: himen imperforado, tabiques vaginales transversos, agenesia de cervix e) Idiopáticas Causas que cursan como amenorrea secundaria: a) Hipotalámicas: Fallo en la producción de GnRH. a. Causas orgánicas: Puede ser debido a tumores, traumatismos o radiación, entre otras causas. Los tumores hipotalámicos pueden dar lugar a lesiones ocupantes de espacio que frecuentemente son supraselares. Estos tumores pueden causar niveles anormalmente bajos de las hormonas pituitarias por compresión del hipotálamo o del tallo hipofisario, dando lugar a pubertad tardía, anovulación y amenorrea. El craneofaringioma es el más frecuente de ellos. Los síntomas dependen del crecimiento tumoral e incluyen alteraciones visuales, disfunción adrenal, hipotiroidismo y diabetes insípida. El diagnóstico requiere técnicas de imagen como TAC o RMN. El tratamiento es quirúrgico con posterior radioterapia. Los traumatismos cerebrales pueden causar daño hipotalámico y secundariamente hipopituitarismo. La presencia de hipeprolactinemia es consecuencia de la lesión traumática de la inhibición dopaminérgica y ayuda a diferenciar el daño hipotalámico del panhipopituitarismo, además de los niveles normales o bajos niveles de otras hormonas pituitarias.El hipotálamo es radiosensible; sin embargo, la pituitaria es relativamente radiorresistente. De este modo la radiación externa cerebral suele provocar alteración de la función hipotalámica. Mª Dolores Moreno Martínez / Jorge Fernández Parra -6- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento b. Causas funcionales (estrés, ejercicio físico intenso y trastornos de la conducta alimentaria con pérdida excesiva de peso IMC<20%) El estrés puede provocar la pérdida de pulsatilidad en la secreción de GnRH a nivel hipotalámico. Se supone que es debido a la acción inhibitoria de las gonadotrofinas provocada por el aumento de ACTH (que promueve la liberación de opiáceos endógenos). El ejercicio físico intenso puede suprimir los ciclos menstruales en mujeres postpubertales, principalmente en aquellas mujeres que practican deportes de resistencia. Al disminuir la actividad o en los periodos de descanso, se restaura el ciclo menstrual normal sin afectar la fertilidad. La influencia del ejercicio, sobre la función menstrual depende de la intensidad del entrenamiento. Las causas son: bajo peso y porcentaje grasa, déficit de energía o estrés físico o emocional. En este grupo de pacientes se han descrito acortamiento de la fase lútea, alteraciones en la secreción de la hormona luteinizante y bajos niveles de estrógenos. En las atletas que presentan amenorrea inducida por el ejercicio se han encontrado niveles de leptina similares a los de prepúberes con pérdida del patrón de secreción diurno. Las consecuencias de la amenorrea inducida por el ejercicio excesivo son similares a las del déficit de estrógenos: mayor riesgo de osteopenia e incluso osteoporosis, atrofia vaginal e infertilidad. El bajo peso en sí mismo no es suficiente para causar amenorrea; numerosos factores relacionados íntimamente con la pérdida profunda de peso son también desencadenantes. El inicio del desarrollo puberal y la aparición de la menarquia están ligados, al menos en parte, a cambios en la relación peso/talla y en la composición del peso corporal, siendo el porcentaje de tejido graso un determinante para el comienzo de la menarquía. Frisch y Mc Arthur sugieren que es necesario al menos el 17% de la grasa corporal para el inicio de la menstruación y al menos el 22% para la periodicidad de los ciclos. La leptina, una hormona secretada en los tejidos adiposos, ha sido recientemente implicada en la patogénesis de las alteraciones menstruales en mujeres con bajo peso. Las mujeres con índice de masa corporal normal tienen un patrón de secreción de leptina diurno, que desaparece cuando hay bajo peso. Mª Dolores Moreno Martínez / Jorge Fernández Parra -7- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento La amenorrea es una de las complicaciones de la anorexia y uno de los criterios necesarios para el diagnóstico del cuadro clínico. Está presente cuando existe una pérdida de peso corporal del 10-15 %, y la recuperación de la menstruación se produce cuando se alcanza aproximadamente el 90 % del peso corporal ideal. Puede ser primaria, asociada a un retraso en la pubertad, o secundaria, con detención o regresión de los caracteres sexuales secundarios. Se han implicado diferentes factores: la disfunción hipotalámica, la pérdida de peso, los esteroides sexuales, el ejercicio físico, los neurotransmisores, la melatonina y la leptina, entre otros. Las mujeres con anorexia muestran unos niveles de FSH y LH similares a los de las niñas prepúberes, además de niveles alterados de ACTH y bajos niveles de T3. Los niveles de gonadotrofinas se correlacionan con el porcentaje de peso ideal y no con la pérdida absoluta de peso. Asimismo las mujeres con bulimia nerviosa padecen irregularidades menstruales y ciclos anovulatorios; la patofisiología de la anovulación es muy similar a la de las pacientes con anorexia aunque los trastornos endocrinos son menores. b) Hipofisarias: a. Causas orgánicas. Panhipopituitarismo o Síndrome de Sheehan. Fue descrito inicialmente en 1939 como necrosis hipofisaria postparto resultante de hemorragia durante el parto o posparto. Se considera la causa más común de hipopituitarismo en mujeres en edad fértil. También puede ser debida a traumatismo. Durante el embarazo, la pituitaria anterior dobla su tamaño y como resultado, la demanda de oxígeno es mayor, y la respuesta a la hipotensión por hemorragia se magnifica. La hipotensión rápida por hemorragia puede interrumpir el retorno venoso de la glándula y como resultado producir la necrosis de la misma. El signo de presentación inicial de panhipopituitarismo suele ser la falta de lactancia después del parto, seguido de la amenorrea, pérdida del vello púbico o axilar, insuficiencia suprarrenal secundaria, la anorexia, letargo y pérdida de peso. Estos síntomas a menudo se retrasan, y el grado de hipopituitarismo varía. El diagnóstico se confirma basándose en la historia clínica y los resultados de las pruebas hormonales: GH, ACTH, prolactina, TSH, LH y FSH, Mª Dolores Moreno Martínez / Jorge Fernández Parra -8- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento que se encuentran en niveles muy bajos. La deficiencia de GH es la más común (90%), seguido por la ACTH (66%), LH / FSH (65%), y la TSH (42%). La participación de la pituitaria posterior es poco frecuente, con diabetes insípida central se presenta en menos del 5% de casos. El tratamiento del síndrome de Sheehan se basa en la sustitución de hormonas en cuestión. En pacientes tratados con gonadotrofinas, la ovulación y el embarazo con éxito final es común. Tratamientos radioterápicos en silla turca. .La irradiación puede provocar un importante grado de disfunción reproductiva y anovulación, los efectos dependen de la dosis. El 70 % de las mujeres sometidas a irradiación craneal presentan irregularidades menstruales. Hipofisectomía: La causa más común de lesión estructural pituitaria es iatrogénica durante la neurocirugía. Otras causas incluyen el trauma del nacimiento, hemorragia intracraneal, la asfixia fetal, y parto de nalgas. Una fractura de la silla turca o fisión del tallo hipofisario puede causar hipopituitarismo. El grado de hipopituitarismo es variable y se manifiesta típicamente dentro de un año después del trauma ocurrido. Muchos pacientes no experimentan síntomas de insuficiencia hipofisaria postraumática durante varias décadas. b. Causas funcionales Hiperprolactinemias. Las pacientes asocian galactorrea, oligomenorrea/amenorrea e infertilidad. La causa más frecuente es la iatrogenia, como efecto secundario a bloqueantes de receptores dopaminérgicos (metoclopramida; domperidona) o inhibidores de la síntesis de dopamina (benserazida). Entre las causas no farmacológicas destacan los tumores del SNC (microprolactinomas) que podría considerarse también una amenorrea hipofisaria de causa orgánica c) Gonadales: a. Fallo ovárico prematuro (causas orgánicas): 1. Idiopático. Mª Dolores Moreno Martínez / Jorge Fernández Parra -9- Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento 2. Radioterapia y/o quimioterapia. 3. Cirugía. 4. Autoinmune. Por el desarrollo de anticuerpos antiovario. b. Ovario poliquístico (causa funcional). Es la causa más frecuente de anovulación (aproximadamente el 80% de los casos). Clínicamente se caracteriza por trastornos menstruales, hiperandrogenismo, hiperinsulinemia y trastornos metabólicos a largo plazo, como diabetes, enfermedad cardiovascular y dislipemias. En la Conferencia de Rótterdam de 2003 se hizo una revisión de los criterios diagnósticos, estableciéndose SOPQ ante al menos dos de los siguientes tres criterios: 1. Oligoanovulación o anovulación 2. Signos clínicos y/ o bioquímicos de hiperandrogenismo y exclusión de otras etiologías (Por ejemplo: Hiperplasia adrenal congénita, tumores secretores de andrógenos, síndrome de Cushing...) 3. Ovarios poliquísticos: Presencia de 12 o más folículos en cada ovario de 2 a 9 mm de diámetro y/o aumento del volumen ovárico por encima de 10 mL. La resistencia a la insulina, independiente de la obesidad, también ha sido descrita en el síndrome de ovarios poliquísticos. Se han propuesto para explicar el exceso de producción de insulina por el páncreas diversos mecanismos: menor afinidad de la insulina por el receptor, disminución del número de receptores de insulina y fracasos postreceptores. Independientemente de la causa, la resistencia a la insulina se observa predominantemente en la periferia, a nivel del músculo esquelético, donde se utiliza el 85-90% de la insulina circulante. La hiperinsulinemia compensatoria contribuye al exceso de andrógenos por estimulación directa de la producción de éstos en la corteza adrenal y por medio de un efecto directo sobre las células de la granulosa y una disminución simultánea de la hormona sexual globulina (SHBG) en la ovarios. El síndrome de ovarios poliquísticos suele asociarse a obesidad centrípeta. En ésta, la distribución del tejido adiposo Mª Dolores Moreno Martínez / Jorge Fernández Parra - 10 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento (cociente cintura-cadera> 0,88) se asocia con un mayor riesgo de hipertensión, diabetes y dislipemia. El hirsutismo se clasifica en idiopático, inducido por drogas, y debido al exceso de andrógenos. La mayoría de los casos de hirsutismo son resultado de una combinación de la producción de andrógenos levemente elevados y mayor sensibilidad de la piel a los andrógenos. Los casos que no son andrógenodependientes (por ejemplo, las causadas por medicamentos o hipertricosis familiar) se diagnostican con facilidad mediante un examen físico. Aproximadamente el 95% de las mujeres con hirsutismo dependiente de andrógenos son por causas suprarrenales y ováricas. Una herramienta clínica que ofrece una evaluación objetiva de la paciente hirsuta es la escala modificada de Ferriman Gallwey propuesta por Hatch. Tiene en cuenta 9 de los 11 sitios originalmente descritos, recibiendo cada uno una puntuación de 0-4 (máximo). Un puntaje de 8 o más se considera significativo. La presencia de hirsutismo, en relación con otros signos de virilización, debe alertar al médico a la posibilidad de tumores productores de andrógenos de origen suprarrenal o los ovarios. d) Otras endocrinopatías: Trastornos tiroideos (causa funcional). Algunas mujeres con hipertiroidismo presentan oligomenorrea. La elevación de las hormonas tiroideas aumenta la producción de SHBG y por tanto sus niveles séricos y la respuesta tisular a estrógenos y testosterona circulantes. Las mujeres con hipotiroidismo a menudo presentan menorragia y metrorragia. Es la causa endocrinológica que con más frecuencia se asocia a anovulación. Estas pacientes presentan niveles reducidos de SHBG y como consecuencia niveles altos de estrógenos y testosterona circulantes. La FSH y LH están también reducidos. Además el hipotiroidismo puede causar alteraciones de la coagulación, como descenso de los factores VII, VIII, IX y XI. En el hipotiroidismo se altera el metabolismo de esteroides, lo que puede conducir a la disfunción del endometrio y a menorragia como síntoma. El hipotiroidismo conduce a mayores niveles de la hormona liberadora de la tiroides y por lo tanto aumento de los niveles de la TSH y la prolactina. e) Idiopáticas Mª Dolores Moreno Martínez / Jorge Fernández Parra - 11 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento 3.- DIAGNÓSTICO El diagnóstico se basará en una exhaustiva historia clínica y una adecuada exploración física. En los antecedentes personales deberemos recoger: • Desarrollo puberal. Debemos preguntar por la edad de menarquía y pubarquia. También debemos comprobar el adecuado crecimiento de la paciente respecto a su edad en el caso de pacientes adolescentes. • Antecedentes ginecológicos y obstétricos: Características de los ciclos (duración, regularidad o irregularidad y cantidad del sangrado); número de embarazos/abortos, complicaciones relacionadas con el parto (previas o post-parto incluidas); antecedentes de legrados u otro tipo de intervenciones ginecológicas. • Vida sexual: número de parejas, antecedentes de enfermedades de transmisión sexual, presencia de coitorragia o coitalgia y métodos anticonceptivos habitualmente empleados. • Datos antropométricos. Es especialmente importante reflejar en la historia el aumento o la disminución reciente en el peso de la paciente así como su IMC. • Enfermedades pasadas. Debemos hacer hincapié en infecciones (especialmente pélvicas), anomalías anatómicas, antecedentes de cirugía pélvica... Es importante reflejar en la historia la presencia de enfermedades malignas (sobre todo leucemias, linfomas de Hodgkin y craneofaringiomas) así como los tratamientos recibidos por este motivo (sobre todo radioterapia y agentes alquilantes). • Medicación actual y pasada. • Antecedentes psiquiátricos. Debemos recoger en la historia los antecedentes de depresión, ansiedad, labilidad emocional y estrés. También debemos preguntar si está recibiendo algún tipo de medicación para estos trastornos. • Debemos preguntar siempre por la presencia de algunos de los siguientes síntomas: cefaleas, trastornos visuales, cambios en el vello corporal, cambios en la tonalidad de la voz y secreción mamaria Mª Dolores Moreno Martínez / Jorge Fernández Parra - 12 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento Respecto a los antecedentes familiares debemos preguntar por la presencia de síntomas semejantes en la madre y/o hermanas de la paciente. En el examen físico es importante la valoración de las mamas (grado de desarrollo, secreción, pigmentación); el abdomen (vello en línea alba, estríasO) y los genitales externos (vello, anomalías anatómicas, masas anexiales). La impresión general de la paciente también puede recoger hallazgos orientadores (presencia de voz grave, obesidad, acné, vellosidad facial, presencia de exoftalmosO) Como exploraciones complementarias que pueden contribuir al diagnóstico tenemos que considerar: • Estudios de laboratorio. En toda mujer con antecedentes de ciclos previos debemos descartar el embarazo. Además de la determinación de β-HCG, debemos solicitar hemograma y bioquímica sanguínea completa (con perfil hepatorrenal). El estudio hormonal debe incluir LH, FSH, relación entre ambas, estradiol, progesterona, TSH, prolactina, testosterona y SHBG. Esta analítica hormonal debe realizarse entre el 2º y el 5º día del ciclo. Unos valores de progesterona >30 nmol/L entre los días 21 a 28 del ciclo confirmarían ovulación. Unos valores al inicio de la fase folicular de FSH <5 UI/L y LH <5 UI/L orientan hacia fallo hipotálamico-hipofisario; valores de FSH superiores a 40 UI/L orientan a fallo ovárico. Valores de LH >10 UI/L al inicio de la fase folicular y de testosterona en cualquier momento >2,4 nmol/L indican SOP. Niveles elevados de prolactina obligan a descartar patología hipofisaria. Ante sospecha clínica de afectación suprarrenal debemos solicitar, además del estudio previamente comentado, progesterona. Niveles elevados cortisol, testosterona, progesterona deben hacer sospechar DHEAs y 17-OH DHEAs, 17-OH hiperplasia suprarrenal. Ante cifras elevadas de cortisol debemos valorar el diagnóstico de un síndrome de Cushing. • Pruebas de imagen. En la exploración ecográfica debemos valorar la presencia de folículos ováricos (así como su número y tamaño), las características del endometrio y la presencia de un posible saco gestacional. Es importante fijarnos en las características del endometrio, ya que las mujeres con anovulación crónica tienen un riesgo elevado de Mª Dolores Moreno Martínez / Jorge Fernández Parra - 13 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento desarrollar de forma precoz hiperplasia y cáncer endometrial, debido a la exposición mantenida y acíclica a estrógenos, por ausencia de progesterona y por una mayor conversión de precursores androgénicos en los tejidos periféricos. Este factor de riesgo puede ser agravado por la presencia de obesidad, hipertensión y diabetes, que se relacionan con cáncer endometrial. La biopsia endometrial estará indicada cuando la historia clínica refleje exposición de largo plazo a estrógenos sin oposición, incluso cuando el espesor endometrial esté comprendido entre 5 y 12 mm. Se debe efectuar siempre que sea >12 mm incluso cuando no se sospeche clínicamente enfermedad. Se recurrirá a otras exploraciones (TAC y/o RMN) según la sospecha diagnóstica (patología hipofisaria, hipotalámica, suprarrenalO) • Igualmente, se solicitarán otros estudios (cariotipo, estudio metabólico de galactosemia, autoanticuerposO) según la sospecha diagnóstica. 4.- TRATAMIENTO El manejo médico de la anovulación es complejo porque implica con frecuencia un enfoque multidisciplinario de la paciente. El primer paso para establecer el tratamiento más apropiado para cada paciente es tener un diagnóstico preciso, aunque en numerosas ocasiones esto no es posible. Es especialmente importante descartar aquellas patologías que pueden plantear graves peligros para la salud inmediata de la paciente. Independientemente del tratamiento específico según la etiología concreta podemos establecer como medidas terapéuticas generales según la presentación clínica: 1. Sangrado agudo secundario a anovulación. El ácido tranexámico vía oral (1 a 1,5g 2 a 3 veces al día), intramuscular (0,5g cada 4 a 6 horas) o intravenosa (0,5 a 1g 2 a 3 veces al día) ha demostrado ser una herramienta eficaz para disminuir este tipo de sangrado. La mayoría de las causas de hemorragia uterina disfuncional responden al tratamiento oral con estrógenos. También se pueden aplicar vía intravenosa Mª Dolores Moreno Martínez / Jorge Fernández Parra - 14 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento (25 mg IV cada 4 horas. Si no se evidencia respuesta tras 12-16 horas, se puede llevar a cabo un legrado hemostático) Si el sangrado no es copioso, suele ser suficiente con dosis de unos 200 mcg/día durante 7 días; continuando con anticonceptivos orales un mínimo de 3 meses. 2. Amenorrea secundaria a anovulación. El objetivo es regular la ovulación, permitiendo la liberación de un único óvulo por ciclo. El tratamiento será diferente según los deseos genésicos de la paciente, pero siempre en primer lugar trataremos el problema de base si es posible. Si tiene deseo gestacional se realizará inducción de la ovulación y si no es así, el tratamiento se enfocará atendiendo al estudio hormonal y la valoración ecográfica ginecológica. Podemos tener las siguientes posibilidades: • Si el estudio hormonal es normal, el tratamiento se debe centrar en aportar progesterona oral de forma cíclica en forma de anticonceptivos para prevenir la hiperplasia endometrial. • Si los niveles de gonadotrofinas son bajos o normales debemos considerar el diagnóstico de hipogonadismo hipogonadotropo con sus distintas posibles etiologías (masa hipotalámica, supresión por ejercicio o por fluctuación en el pesoO). En estas pacientes el tratamiento se debe orientar hacia la causa de la supresión. • Si los niveles de gonadotrofinas están elevados debemos asumir el fallo ovárico. Si la paciente tiene menos de 30 años es necesario realizar un cariotipo que descarte patología cromosómica (síndrome de Morris, premutación síndrome X frágilO). En las pacientes que presenten gónadas masculinas es preciso su retirada quirúrgica por la alta tasa de malignización de las mismas. También se deben considerar el daño ovárico por proceso autoinmune o infeccioso. • Si la TSH o la prolactina están elevadas, habitualmente corrigiendo el defecto primario, la paciente suele reiniciar los ciclos ovulatorios. Mª Dolores Moreno Martínez / Jorge Fernández Parra - 15 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento Tratamiento de causas específicas 1. Alteraciones en el peso A las pacientes que padecen SOP y presenta sobrepeso (IMC >30 Kg/m2) se les debe recomendar la pérdida de peso. Junto con el ejercicio físico, la pérdida de peso (incluso pérdidas de solo el 5% de la masa corporal) reducen los niveles de insulina y de testosterona, mejorando la regularidad de los ciclos menstruales, favoreciendo la ovulación y la posibilidad de embarazo. Las mujeres obesas tienen mayor riesgo de aborto espontáneo. Por otro lado, a las mujeres con bajo peso (IMC <20 Kg/m2) se les debe recomendar la ganancia ponderal y no se debe llevar a cabo tratamiento de fertilidad hasta que no hayan alcanzado los límites de la normalidad. 2. Hiperprolactinemia El tratamiento con bromocriptina es seguro y eficaz. Se inicia con dosis de 1.25 mg por la noche, incrementándose a 2.5 mg. Se deben monitorizar los niveles de prolactina (debemos mantener la dosis que deje la prolactina por debajo de 25ng/mL). Se han descrito como efectos adversos la hipotensión postural, nauseas, vértigo y cefalea; por ello, surgieron alternativas como la cabergolina (el más usado) y la quinagolida (agonistas dopaminérgicos de larga duración y escasos efectos secundarios). La cabergolina es más efectiva y mejor tolerada que la bromocriptina como supresor de la secreción de prolactina, ya que es siete veces más selectiva hacia los receptores D-2. Además, tiene una afinidad mínima para los receptores adrenérgicos, serotoninérgicos o histaminérgicos; y no tiene efecto sobre la secreción de otras hormonas pituitarias como la cortisona, el ACTH, FSH o TSH. Por otro lado, la posibilidad de una sola dosis al día de cabergolina es una ventaja potencial de este fármaco Cuando los niveles de prolactina se normalizan, el 70-80% de las pacientes logran ciclos ovulatorios normales. 3. Hipotiroidismo En el hipotiroidismo la elevación de TSH estimula la secreción de prolactina. El tratamiento sustitutivo con tiroxina normaliza los niveles de TSH y prolactina, Mª Dolores Moreno Martínez / Jorge Fernández Parra - 16 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento eliminando la supresión de la secreción de gonadotrofinas y permitiendo la ovulación. Inducción médica a la ovulación. GnRH pulsatil El tratamiento con hormona liberadora de gonadotropina es el tratamiento más fisiológico y puede ser adecuado para las mujeres que tienen una causa puramente hipotalámica para su amenorrea, por ejemplo las mujeres con amenorrea por bajo índice de masa corporal que han recuperado su peso, pero que todavía no están ovulando. Sin embargo, es un método poco usado. La mujer lleva una pequeña bomba de inyección mecánica que puede ofrecer un pulso de la hormona liberadora de gonadotrofinas por vía subcutánea cada 90 minutos, esto conduce generalmente la ovulación. Las reacciones locales pueden ocurrir en el lugar de inyección. Las tasas de concepción son similares a los de la población normal en torno al 20-30% por ciclo y un 80-90% el uso de 12 meses. Tratamiento antiestrogénico: Clomifeno El clomifeno actúa bloqueando los receptores de estrógenos en la hipófisis que conduce a un aumento de la producción de la hormona folículo estimulante, que estimula el desarrollo de uno o más folículos dominantes. Estos medicamentos sólo pueden utilizarse en condiciones en la que el eje hipotálamo-hipófisis funcione adecuadamente, por ejemplo el síndrome de ovario poliquístico. La administración de citrato de clomifeno como inductor de la ovulación se realiza del siguiente modo: 50 mg al día durante 5 días, iniciando cualquier día del ciclo a partir del 5º día de ovulación; si no hay respuesta, administrar un 2º ciclo de 100 mg al día durante 5 días; comenzando a los 30 días del 1º. Si no se produce ovulación a dicha dosis, repetir el ciclo hasta 3 veces, sin exceder de 100 mg/día. Si en cualquiera de las dosificaciones no hay embarazo, repetir el ciclo hasta un máximo de 6 veces. La inducción de la ovulación con clomifeno debe realizarse sólo en circunstancias en las que se permita el acceso a la monitorización ecográfica del ovario, debido al riesgo de desarrollar múltiples folículos y el riesgo Mª Dolores Moreno Martínez / Jorge Fernández Parra - 17 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento pequeño pero real de síndrome de hiperestimulación ovárica (RCOG). El setenta por ciento de las mujeres con síndrome de ovario poliquístico va a ovular en respuesta a clomifeno, con una tasa de concepción de 40-60% a los seis meses. La incidencia de gemelos es de alrededor de 10% y la de trillizos del 1%. Inhibidores de la aromatasa Impiden la conversión de andrógenos a estrógeno a nivel ovárico, disminuyendo el feed-back negativo y aumentando la producción de FSH, con el posterior crecimiento y maduración folicular. Al mismo tiempo, al aumentar los niveles de andrógeno en el ovario, aumenta la sensibiidad a la FSH. Son el letrozol, el anastrozol y el exemestano. Metformina Cada vez más, los estudios indican que la metformina en dosis de 1500 mg al día puede mejorar la regularidad menstrual mediante la reducción de la insulina y testosterona libre las concentraciones en las mujeres, tanto delgadas como obesas con síndrome de ovario poliquístico que no ovulan. Inyecciones de la hormona folículo estimulante. El tratamiento con hormona folículo estimulante se utiliza en mujeres con anovulación por alteraciones del eje hipotálamo-hipófisis, y para las mujeres con síndrome de ovario poliquístico que no han tenido respuesta al clomifeno. Como las complicaciones más graves de esta terapia son el síndrome de hiperestimulación ovárica y el embarazo múltiple, es esencial que este tratamiento sea supervisado por especialistas en reproducción, con el acceso a la ecografía y centros de atención terciaria. Manejo quirúrgico Las medidas quirúrgicas suelen ser la opción de terapéutica cuando han fallado el tratamiento médico. También para cuadros concretos (macroadenomas hipofisarios cuyo crecimiento provoca síntomas graves). También está indicada Mª Dolores Moreno Martínez / Jorge Fernández Parra - 18 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento la realización de laparotomía exploratoria para neoplasias ováricas o suprarrenales. En el manejo del SOP la cirugía de los ovarios es una de las opciones empleadas, antiguamente se realiza resección cuneiforme del ovario; actualmente y en el mismo escalón terapéutico que las gonadotropinas, una vez que ha fallado el citrato de clomifeno, disponemos de drilling (“taladramiento”) ovárico que consiste en realizar entre 8 y 15 punciones a nivel ováico de 2 a 4mm de profundidad mediante laparoscopia (consiguiendo que hasta el 80% de las pacientes, tras el procedimiento, logren ovulaciones espontáneas). Tiene la misma tasa de éxito que el tratamiento con gonadotropinas y con menor riesgo de gestación múltiple, pero con los riesgos inherentes a una cirugía. A veces, también puede ser necesario la realización de legrados por hemorragias uterinas (incluso puede ser preciso llevar a cabo realizar histerectomías). Otro grupo de pacientes que pueden beneficiarse del tratamiento quirúrgico son aquellas pacientes con obesidad importante que no han respondido a otras medidas para lograr pérdida de peso. La cirugía bariátrica es aquí una opción válida. Valoración multidisciplinar En el manejo de algunas de estas pacientes es imprescindible la colaboración de otros profesionales: • Neurocirugía. Ante microadenomas que no responde al tratamiento médico con bromocriptina o macroadenomas de rápido crecimiento. • Psiquiatría y nutrición. En las pacientes con trastornos de la alimentación. • Endocrinología. En los trastornos suprarrenales (síndrome de Cushing, síndrome de Addison, hiperplasia suprarrenal), diabetes tipo 2, panhipopituitarismo, enfermedad tiroidea refractaria. • Ginecología oncológica o Cirugía. En presencia de masas anexiales o suprarrenales. • Unidad de fertilidad. Mª Dolores Moreno Martínez / Jorge Fernández Parra - 19 - Clases de Residentes 2010 Anovulación: Diagnóstico y tratamiento 5.- BIBLIOGRAFÍA 1. Hernández-Rey A. Emedicine; 2008 Anovulation. [Monografía en Internet]. Medscape: [acceso noviembre 2009]. Disponible en: http://emedicine.medscape.com/article/253190-overview 2. Hamilton-Fairley D, Taylor A. Anovulation. BMJ. 2003; 327: 546-549. 3. Crosignati PG, Bianchedi D, Riccaboni A, Vegetti W. Management of anovulatory infertility. Human Reproduction. 1999; 14 Supl 1: 108-119. 4. Kafy S, Tulandi T. New advances in ovulation induction. Curr Opin Obstet Gynecol. 2007; 19: 248-252. 5. Managing anovulatory infertility. Drug Ther Bull. 2004; 42:28-32. 6. The Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. Jan 2004; 81: 19-25. 7. Frisch RE, McArthur JW. Menstrual cycles: fatness as a determinant of minimum weight for height necessary for their maintenance or onset. Science. 1974; 185: 949-51 8. Muñoz-Calvo MT. Anorexia nervosa: alteraciones del eje hipotálamohipófiso-gonadal. Alteraciones de la densidad mineral ósea y del remodelado óseo [Monografías en internet]; SEEP; 2000 [acceso diciembre 2009]. Disponible en: http://www.seep.es/privado/download.asp?url=/publicaciones/2000TCA/Cap15.pdf 9. Bulent U, Yakin K. Ovulatory disorders and infertility. J Reprod Med. 2006; 51: 267-282. 10. Schneider R. Problemas menstruales comunes en la adolescencia. Diálogo en Pediatría 1992; 6: 11-16. 11. Merck. Endocrinología de la reproducción. Manual Merck [Monografías en internet]; tripod; 1999 [acceso diciembre 2009]. Disponible en: http://manualmerck.tripod.com/MMCap234.htm 12. Female Physiology Before Pregnancy and Female Hormones. Guyton. Textbook of medical physiology. 11ª edi. Londres: Elsevier Saunders. 2006. P1011-1025 13. Anovulación y poliquistosis ovárica. En: Speroff L. Endocrinología ginecológica clínica y esterilidad. 2ªed. Madrid: Lippincott Williams & Wilkins; 2006. p465-499 Mª Dolores Moreno Martínez / Jorge Fernández Parra - 20 -