Teoría
Anuncio
Curso
2009-10
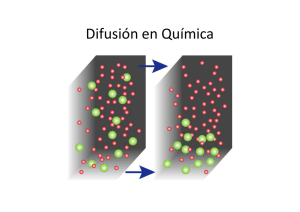
Difusión en Química
D. Reyman
U.A.M.
Curso 2009-10
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Concepto de difusión. Leyes de Fick.
Cuando una sustancia no está homogéneamente distribuida en un
medio, existirá una fuerza impulsora que tenderá a igualar el potencial
químico de esa sustancia en todo el espacio, produciéndose un flujo de
materia desde las zonas de mayor a menor potencial. A este proceso
espontáneo
e
irreversible
se
la
denomina
difusión.
http://upload.wikimedia.org/wikipedia/commons/e/e
b/Diffusion.gif
El potencial químico de un soluto disuelto en una disolución viene dado
por
µ µ RT ln a
a es la actividad del soluto que podremos sustituir por c si trabajamos a
disoluciones muy diluidas.
La fuerza impulsora será:
ln donde i, j, k son
vectores unitarios.
Suponemos que sólo existe cambio en
una coordenada, de manera que
ln El flujo de soluto, J, se define como la
velocidad de transporte de moles de
soluto, n, a través de una superficie de
área unidad, A, situado en una posición
x.
' #
1 #$
" & '
" & )1*
#( ! #% Donde D = LRT/c es un coeficiente que denominamos de difusión que se
determina experimentalmente
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Unidades de D (superficie/tiempo)
+ ,-./-0 '/1 2/ 3
El signo menos indica que la difusión tiende a anular el gradiente. El flujo
es proporcional al gradiente y al coeficiente de difusión. D es una
propiedad intrínseca al sistema, como puede ser la densidad o el calor
específico.
A medida que se va produciendo el proceso de difusión, el gradiente
(fuerza impulsora) va cambiando con el tiempo y por tanto el flujo se irá
haciendo más lento.
Hemos presentado el flujo manteniendo fija una determinada posición
del espacio.
Vamos a estudiar su variación a través de esta
coordenada. Para ello derivaremos J con respecto a x.
#
# 5
" & + 4 56
#( #( Según la ecuación 1
9 (1)
8 :
)2*
#$
#
1 # #% " & ;
<
#( !
#(
donde ! #( es igual elemento diferencial de volumen #=, con lo que
#$
#$
# # #
#% #= " & ;
< ;
<
#( #=
#%
Por ser variables independientes
Como :
>
, teniendo en cuenta (2)
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
#
#
# 5
" & " & + 4 56
#( #% #( #
# 5
" & + 4 5 6 ?/@A$20 '/1 2/ 3
#( #% Esta ecuación indica que el cambio de concentración en un punto x es
proporcional a la curvatura del perfil de concentraciones c(x,t) respecto a la
posición. Antes de resolver la ecuación de difusión, es importante obtener una
comprensión intuitiva de lo que dicen los símbolos. La situación más sencilla
posible, una suspensión de partículas con densidad uniforme en el instante t=0,
figura a. Como c(x) es constante, la 1ª ley de Fick dice que no hay flujo neto.
La situación que la sigue en simplicidad es un gradiente de concentración,
figura b, es un gradiente uniforme de concentración donde dc/dx es
constante igual a la pendiente de la recta. La 1ª ley de Fick dice que hay un
flujo constante. La derivada segunda es la curvatura de la gráfica, que es nula
para la recta mostrada. De esta manera, la difusión mantiene el perfil de la
figura b. A primera vista, esta conclusión puede resultar sorprendente, pero
tiene sentido: cada segundo, el número neto de partículas que entran desde
la izquierda es exactamente igual al número neto que salen hacia la derecha
de manera que c no cambia. La figura c muestra una situación más
interesante. Un sistema de este tipo lo tenemos cuando una vesícula sináptica
se funde con una célula nerviosa liberando bruscamente gran cantidad de
transmisores. La curvatura d2c/dx2, es negativa en las proximidades de x=0 ,
cero en los puntos de inflexión (
) y positiva más allá de estos puntos .Por
consiguiente el flujo está dirigido hacia fuera, de aquí que veamos que la
curva va ensanchándose y disminuyendo en altura en el transcurso del
tiempo.
c
c
x
Figura a
c
x
Figura b
x=0
x
Figura c
Como toda ecuación diferencial, para obtener la solución de la segunda Ley
de Fick, es preciso establecer condiciones de contorno adecuadas al sistema
estudiado. Un primer caso de interés en Química corresponde a una situación
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
en que inicialmente la concentración de un componente es uniforme
c(x,t=0)= c0 para x<0 y c(x,t=0)=0 para x>0.
Figura 2
c0
x=0
La solución de la ecuación de difusión en estas condiciones es
donde
C
(
D1 erf
I )1*
2
2√+%
erf(y) es la denominada función de error que está definida como
O
2
erf)y* 8/5 L exp)x 5 *dx
π
C
)(, %* El comportamiento de la ecuación 1 se muestra en la siguiente figura para
diferentes valores de t.
Otra situación de interés en Química corresponde a la condición de contorno
c(x,t=0)= c0 δ(x-x0)donde δ(x-x0) es la función delta de kronecker. Corresponde
a un sistema que inicialmente tiene una concentración c0 (para x=x0 y a partir
de ahí el soluto se difunde hacia ( Q∞ . La solución de la segunda Ley de Fick
en este caso es
R$S% TUX
VW
/
%8/5
Esta función corresponde a una curva simétrica en x que tiene valores
pequeños cuanto mayor es x.
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
La constante de proporcionalidad se puede evaluar si se estipula la cantidad
total del cuerpo que se difunde por unidad de superficie. Supongamos que es
c0.
C L dx ∞
T∞
R$S% ∞ TUX
VW 2(
L /
%8/5 T∞
Integrales de este tipo están tabuladas.
YT∞ / TZ 2( [\⁄0
∞
U
De acuerdo con esta expresión se obtiene
C 2 R$S% )\+*8/5
C
T U
/ XVW
8/5
2)\+ %*
Que es una función gaussiana que se ensancha a medida que crece t. Esta
función nos informa de cómo están distribuidas las moléculas en el sistema
para un valor determinado del tiempo. De aquí que podamos considerarla
como una función de probabilidad.
Vamos a intentar encontrar una expresión que relacione la distancia
cuadrática media que recorren las partículas en un proceso de difusión (la
distancia media efectiva es siempre cero).
La cantidad de sustancia
elemento dx será c dx
^( 5 _
que después de un tiempo t ha alcanzado el
∞
Y ( 5 2(
1
T U
T∞
L
( 5 / XVW 2(
8/5
C
2)\+%*
T∞
∞
Integral tabulada
^( 5 _ YT∞ ( 5 / TZ 2( ∞
U
2+% )\+%*8/5
2+%
)\+%*8/5
8
5Z
[\⁄0
[^( 5 _ √2+%
En un sistema de tres dimensiones:
^- 5 _ ^( 5 _ ^1 5 _ ^` 5 _ 6+%
Ecuación de Einstein-Smoluchowski que también puede obtenerse por
consideraciones estadísticas a partir de las fluctuaciones que sufren las
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
moléculas en el seno de una disolución, dándonos la distancia promedio que
recorren las moléculas de soluto en un determinado tiempo que sólo depende
del coeficiente de difusión.
¿Cómo es el movimiento de difusión?
Geraniol, fragancia responsable de un perfume tiene M= 154 y una velocidad
media de aproximadamente 220 m s-1.
La difusión se origina por un movimiento térmico desordenado, movimiento
browniano que resulta de las fluctuaciones microscópicas en la presión del
fluido.
Determinación del coeficiente de Difusión.
En gases
Propiedades de en un gas ideal. Teoría cinética.
+ c
Dj k/5 ,T8
Gases
Líquidos
Sólidos
1
1
c def
3
1 √2 \25 ,g9
8 8/5
def "
&
\i
Coeficiente
difusión (D)
≈ 10-1
≈10-5
≈10-20
Distancia
recorrida
(cm) en 60 s
3
0.03
< 10-8
En medios condensados
La ecuación ^lm _ mno permite la medida directa del coeficiente de difusión
y de hecho fue utilizada por Perrin para medir coeficientes de algunos
coloides, simplemente midiendo con un microscopio los desplazamientos al
cabo de un cierto tiempo y promediándolos. Sin embargo, para la mayoría de
los sistemas este método es impracticable.
El método denominado del límite móvil es uno de los métodos que se utilizan
para medir D. Supongamos que tenemos dos compartimentos uno lleno de
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
disolución de una determinada sustancia y el otro sólo con el disolvente. Estos
compartimentos están separados por un tabique permeable (figura 3). Como
consecuencia del gradiente habrá un flujo de sustancia
hacia el
compartimento de menor concentración que cesará cuando las
concentraciones se igualen. Como vimos en el primer caso de interés en
Química, la ecuación )(, %* p
5
q1 erf 5
r
√W
representa este sistema y es
incomoda de usar. Sin embargo, su derivada
concentración) es simplemente una curva gaussiana
p
5)sW *t/U
/
T UX
VW
(el
gradiente
de
la
Figura 3
La altura de la campana,H, (x=0) viene
dado por
"
#
C
&
#( uC
2)\+ %*8/5
Y el árae bajo la curva es simplemente c0, C YT∞ dx !
∞
Combinando estas dos últimas ecuaciones
!
2)\+%*8/5
v
Representando graficamente (A/H)2 frente a t obtendremos una recta de
pendiente 4πD
Con este mismo método se puede también utilizar un disco de vidrio poroso de
grosor, ∆x ,para separar las dos disoluciones de diferente concentración. El
área efectiva del dispositivo se puede obtener calibrando con una sustancia
de conocido coeficiente de difusión.
En este caso se puede utilizar la primera ley de Fick midiendo la cantidad de
materia que es transferida por unidad de área y unidad de tiempo, J.
J = flujo con unidades de mol cm-2 s-1
c2,c1= concentraciones mol cm-3
∆x= anchura del disco
D= coeficiente de difusión cm2 s-1
+
∆
∆(
+ ∆(
5 8
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Si suponemos que D es independiente de la concentración, se puede repetir
el experimento con diferentes concentraciones y extrapolar para c=0.
Métodos ópticos para medir la variación de
la concentración con el tiempo en un
determinado punto de la muestra.
•
•
•
•
Radiactividad
Absorción
Fluorescencia
Índice de refracción
Ej. Proteínas embebidas en una membrana celular pueden difundirse en el
plano de esta membrana. Photobleaching de un grupo cromóforo mediante
un laser potente. Se estudia el retorno de otra proteína vecina al punto donde
se efectuó el impacto laser. Fluorescencia es una técnica más sensible para
seguir el movimiento de las moléculas.
En aquellos casos en los que no se pueda medir el coeficiente de difusión, éste
puede evaluarse a partir de la ecuación de Einstein-Sutherland
+
x
y
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Donde f es el coeficiente de fricción que tiene que ver con el rozamiento de
las moléculas al difundirse. La difusión la presentamos con esta ecuación como
una relación entre fuerzas contrapuestas: el término KT promueve el
movimiento y el término f que se opone a éste.
Efecto de la forma
Si la molécula se comporta como una esfera perfecta de radio r e
impermeable al disolvente, esta fuerza de fricción, f, vendrá dada por la ley
de Stokes:
f 6πηr
En general esta ecuación no se suele cumplir y se suele multiplicar por un
factor de forma de Perrin.
Coeficientes de fricción. Factores de Perrin
Para ciertas formas especiales de partículas no esféricas, es posible calcular
valores de los coeficientes de fricción. En la siguiente tabla se muestran las
relaciones f/f0 donde f0 es el valor de Stokes para una molécula esférica del
mismo volumen.
La molécula no esférica tendrá siempre un mayor
coeficiente friccional que su equivalente esférico, es decir f/fo>0
Perfil
Elipsoide prolate
Elipsoide
oblate
Varilla larga
f/f0
,T8/k ),5 1*8/5
z${, ),5 1*8/5 |
),5 1*8/5
,5/k %0$T8 {),5 1*8/5 |
,5/k )2/3*8/k
ln 2, 0.30
ae
(αβ2)1/3
(α2 β)1/3
5 8/k
3αβ
4
6
2
En estas ecuaciones, P= α/β, donde α es el semieje mayor( o la longitud media
para la varilla) y β es el semieje menor ( o el radio de la varilla). La cantidad
ae es el radio de la esfera igual en volumen al elipsoide o varilla, asi fC 6πηa
La siguiente figura representa la variación f/f0 en función del perfil del elipsoide
P. En esta figura, es destacable la región f/f0 cercana a 1 donde es casi
imposible distinguir entre un elipsoide prolate y oblate.
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
2009
f0
a/b= ½
a/b = 1/10
f/f0=1.042
f/f0=1.458
a/b= 2
f/f0=1.044
a/b = 10
f/f0=1.543
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Efecto de solvatación
Las moléculas de soluto llevan asociadas moléculas de disolvente. El
efecto de la solvatación se tiene en cuenta considerando r como radio
hidrodinámico, que representa el radio de una entidad química
formada por el soluto más una coraza de solvatación (core-shell).
Coeficientes de difusión en diferentes medios a 25ºC, D/10-9 m2s-1
Compuesto Disolvente D
Compuesto
Disolvente D
Iodo
hexano
4.05
Hemoglobina Agua
0.070
Iodo
Cl4C
3.42
Seoalbumina Agua
0.067
Iodo
benceno 2.13
Lisozima
Agua
0.115
Glicina
Agua
1.06
Ribonucleasa Agua
0.131
Glucosa
Agua
0.68
Mioglobina
Agua
0.113
Efecto de la temperatura
Al aumentar la temperatura las interacciones disminuyan y por tanto los
coeficientes de difusión deben aumentar al subir la temperatura.
Superar esta barrera de fricción debe llevar a una variación
exponencial de D con la temperatura como la descrita por la siguiente
ecuación
+ ! exp)/*
Donde A y E sólo tiene significado de parámetros
experimentalmente.
TRANSPORTE
BAJO
SEDIMENTACIÓN.
FUERZAS
ajustables
CENTRÍFUGAS.
Cualquier fuerza que actúe sobre un sistema material es capaz de producir un
transporte de masa en el mismo. La fuerza de gravedad producirá un efecto
sobre cualquier partícula con masa, aunque es una fuerza débil por lo que no
tiene un efecto apreciable sobre la disolución. Sin embargo, si centrifugamos
la disolución, es decir la sometemos a una aceleración angular, podemos
conseguir de una manera fácil someterla a una fuerza muy grande que viene
dada por: F= m a= mω2r, donde r es la distancia desde el eje de rotación y ω
es la velocidad angular en radianes/segundo.
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Vamos a situar a la partícula de masa m en la parte superior de una disolución
y la dejamos caer (ver figura). La velocidad inicial será cero, se acelerará y la
velocidad crecerá. Serán tres la fuerzas que actúan sobre la partícula.:
Fuerza de fricción : Fr= -f vx (f coeficiente de fricción y vx velocidad)
Fuerza de gravitación: F= m g
Fuerza ascensional: Fasc= -m Veρg (Ve es el volumen específico del soluto y ρ
densidad del medio) .
Llegará un momento en el que la partícula alcanzará una velocidad
constante, ese momento ocurre cuando las fuerzas de fricción y ascensional
quedan balanceadas por la fuerza gravitacional.
0= -f vx + m g -m Veρg
v mg )1 Ve ρ*/f
A la relación vx/g se le llama coeficiente de sedimentación, S.
S se mide en Svedberg (S) 1S=10-13 s. Generalmente, la sedimentación no se
utiliza usando la fuerza gravitatoria. En su
lugar, la sedimentación se consigue usando
una centrífuga que se mueve con una
velocidad
angular
ω.
Una
de
las
aplicaciones más importantes
de la
ultracentrifugación es la determinación de
las masas molares de macromoléculas o
coloides en disolución que puede realizarse
mediante el método denominado de
velocidad frontera de sedimentación o bien
por
el
método
de
equilibrio
de
sedimentación.
En el primero de los métodos se utilizan
campos centrífugos del orden de 105veces la
aceleración de la gravedad (105 g). Con
estas
aceleraciones
cualquier
macromolécula sedimenta. En este caso
Siendo
Si D=KT/f
U
?
d
1 =/
.
5y
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
? .
W )8T> *
? .
g9 + )1 =f *
g9
De aquí que la masa molar, M
i ?
+ )1 =f *
Este método exige el concurso de varias técnicas experimentales:
1. Medida del volumen específico
2. Medida del coeficiente de difusión
3. Medida del coeficiente de sedimentación
Una manera de evitar la necesidad de medir D y S, es utilizar el método de
equilibrio de sedimentación. Se utilizan bajas velocidades de rotación. Tras
varias horas, a veces días, de centrifugación se llega a un equilibrio entre la
sedimentación que tiende a llevar partículas hacia el fondo y la difusión que
tiende a homogeneizar la disolución. En estas condiciones no hay flujo neto de
materia, J=0. Es decir, para un sistema en un campo de fuerzas, la condición
de equilibrio es que el potencial total, )-*, sea constante en todas partes. Así,
en presencia de una fuerza centrífuga, el potencial total se define como la
suma del potencial químico y la energía potencial originada por esta fuerza,
U(r).
)-* YC 3 2- . 5 YC - 2- .5
)-* )-* U
5
1
i 5 - 5
2
donde )-* es el potencial que depende de la concentración de soluto.
En el equilibrio, el potencial total debe ser constante en todas partes, por
tanto la condición de equilibrio es
2)-*
2 )-*
0
i 5 22-
Teniendo en cuenta el empuje del principio de Arquímedes y que el potencial
químico se puede expresar como ln , donde es el potencial
estandar
0 2z$ i5 - )1 =/ *
2-
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
2z$ i5 - )1 =/ *
2i
2z$ 2-
5 - )1 =/ *
Esta ecuación también la podemos expresar como
2z$ 12 5 - i)1 =/ *
2 2
De la integración entre el menisco (a) y algún punto r, puede verse que c
depende de r de forma exponencial
5 -i)1 =/ *) - 5 05 *
)-* )0* /(
2
z$
)-*
5 -i)1 =/ *) - 5 05 *
)0*
2
Con una representación de ln c (r) frente a r2 podremos obtener M
¿Cómo obtener S?
Un método para medir el coeficiente de sedimentación es por centrifugación.
En este proceso se sitúa una disolución homogénea en una centrifuga y se
hace girar. Crecimiento de la concentración en las zonas alejadas y reducción
en las zonas próximas.
Figure 35.18a
El plano azul representa el menisco de la disolución antes de la centrifugación.
Conforme se produce la centrifugación este menisco se va trasladando con
respecto al disolvente.
[DIFUSIÓN EN QUÍMICA] Curso 2009-10
Vamos a ilustrar este método con un problema:
Se estudió a 25 ºC la sedimentación de la seroalbúmina bovina (BSA). La
posición inicial del soluto era 5.50 cm del eje de rotación y durante la
centrifugación a 56850 rpm, se desplazó como se indica en la siguiente tabla:
t/s ,
0,
500, 1000, 2000, 3000, 4000, 5000
r/cm , 5.00, 5.55, 5.60, 5.70, 5.80, 5.91, 6.01
Calcular S.
d
?
5-
donde d se puede representar como d Se integra ln 5 ? %
p
2 -5 ?
2%
De la representación de ln frente a t obtenemos S
p
2\ d
Siendo d= nº de ciclos por segundo, de aquí 5,95 10 k S T8 y
S= 5,02 Sv