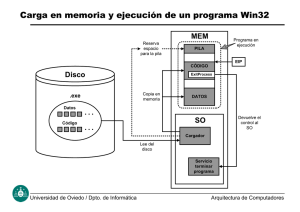
Pila eléctrica - Grupo Comercial Acomee
Anuncio

Pila eléctrica magnitud de los fenómenos eléctricos y poder estudiarlos sistemáticamente. De esta explicación se desprende que cualquiera de los dos nombres serviría para cualquier tipo, pero la costumbre ha fijado la distinción. 2 Historia La primera pila eléctrica fue la llamada pila voltaica, que fue dada a conocer por Volta en 1800 mediante una carta que envió al presidente de la Royal Society londinense. Se trataba de una serie de pares de discos (apilados) de zinc y de cobre (o también de plata), separados unos de otros por trozos de cartón o de fieltro impregnados de salmuera, que medían unos 3 cm de diámetro. Cuando se fijó una unidad de medida para la diferencia de potencial, el voltio (precisamente en honor de Volta) se pudo saber que cada uno de esos elementos suministraba una tensión de 0,75 V aproximadamente, pero ninguno de estos conceptos se conocía entonces. Su apilamiento conectados en serie permitía aumentar la tensión a voluntad, otro descubrimiento de Volta. El invento constituía una novedad absoluta y gozó de un éxito inmediato y muy merecido, ya que inició la era eléctrica en que actualmente vivimos, al permitir el estudio experimental preciso de la electricidad, superando las enormes limitaciones que presentaban para ello los generadores electrostáticos, que son los únicos que existían hasta el momento. Otro tipo más temprano de configuración también utilizada y descrita por Volta para el aparato estaba formada por una serie de vasos con líquido (unos junto a otros, en batería), en los que se sumergían las tiras de los metales, conectando externamente un metal con otro. Varias pilas y baterías (izquierda superior a derecha inferior): dos AA, una D, una batería de handy (walkie-talkie), dos de 9 voltios (PP3), dos AAA, una C, una batería de filmadora casera, una batería de teléfono inalámbrico. Una pila eléctrica o batería eléctrica es el formato industrializado y comercial de la celda galvánica o voltaica. Es un dispositivo que convierte energía química en energía eléctrica por un proceso químico transitorio,[1] tras lo cual cesa su actividad y han de renovarse sus elementos constituyentes, puesto que sus características resultan alteradas durante el mismo. Se trata de un generador primario. Esta energía resulta accesible mediante dos terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo negativo o ánodo y el otro es el polo positivo o cátodo. La estructura fundamental de una pila consiste en dos electrodos, metálicos en muchos casos, introducidos en una disolución conductora de la electricidad o electrolito. Las pilas, a diferencia de las baterías, no son recargables, Inmediatamente empezaron a hacerse por toda Europa aunque según países y contextos los términos pueden iny América innumerables pruebas con diversos líquidos, tercambiarse o confundirse. En este artículo se describen metales y configuraciones, tratando de mejorar las caraclas pilas no recargables. terísticas del aparato original, cosa que pocas veces se consiguió, pero que originó una infinidad de distintos tipos de pilas, de los cuales no ha quedado memoria más que de los más notables. 1 Nombre La pila Daniell, dada a conocer en 1836 y de la que luego se han usado ampliamente determinadas variantes constructivas, está formada por un electrodo de cinc sumergido en una disolución de sulfato de cinc y otro electrodo de cobre sumergido en una disolución concentrada de sulfato de cobre. Ambos electrolitos están separados por una pared porosa para evitar su reacción directa. En esta situación, la tensión de disolución del cinc es mayor que la presión de los iones Zn++ y el electrodo se disuelve, emi- En el castellano ha habido por costumbre llamarla así, mientras que al dispositivo recargable o acumulador, se le ha venido llamando batería. Tanto pila como batería son términos provenientes de los primeros tiempos del estudio de la electricidad, cuando se juntaban varios elementos —en el primer caso uno encima de otro, “apilados”, y en el segundo adosados lateralmente, “en batería”— como se sigue haciendo actualmente, para así aumentar la 1 2 4 CARACTERÍSTICAS, PROPIEDADES Y FORMA DE UTILIZAR LAS PILAS tiendo Zn++ y quedando cargado negativamente, proceso en el que se liberan electrones y que recibe el nombre de oxidación. En la disolución de sulfato de cobre, debido a su gran concentración de iones Cu++ , se deposita Cu sobre el electrodo de este metal que, de este modo, queda cargado positivamente mediante el proceso denominado reducción, que implica la incorporación de electrones. Esta pila presenta una diferencia de potencial de 1,07 a 1,14 V entre sus electrodos. Su gran ventaja respecto a otras de su tiempo fue la constancia del voltaje generado, debido a la elaborada configuración, que facilita la despolarización, y a la reserva de electrolito, que permite mantener su concentración durante más tiempo. La pila Grove (1839) utiliza como despolarizador el ácido nítrico HNO3 . Su diferencia de potencial o fuerza electromotriz es de 1,9 a 2,0 V. Originariamente utilizaba platino para el ánodo, pero Cooper y Bunsen lo sustituyeron luego por carbón. El cátodo era de cinc tratado con mercurio. Fue muy apreciada por su estabilidad y su mayor energía, a pesar del gran inconveniente que representa la emisión de humos corrosivos. El propio Grove elaboró, ese mismo año, una pila que producía energía eléctrica por medio de la recombinación de hidrógeno y de oxígeno, lo que constituye el precedente de los generadores contemporáneos conocidos como pilas de combustible. tá muy atenuado en los productos de finales del siglo XX gracias a la utilización de recipientes de acero inoxidable, pero todavía se produce alguna vez. Importantes en otro sentido han sido las pilas patrón, destinadas a usos de calibración y determinación de unidades, como la pila Clark (1870), de cinc y mercurio, cuya tensión era de 1,457 V, y la pila Weston (1891), de cadmio y mercurio, con 1,018 V. Estas tensiones se miden en vacío, es decir, sin tener ninguna carga externa conectada, y a una temperatura constante de 20 °C. 3 Principio de funcionamiento Aunque la apariencia de cada una de estas celdas sea simple, la explicación de su funcionamiento dista de serlo y motivó una gran actividad científica en los siglos XIX y XX, así como diversas teorías. Las pilas básicamente consisten en dos electrodos metálicos sumergidos en un líquido, sólido o pasta que se llama electrolito. El electrolito es un conductor de iones. Cuando los electrodos reaccionan con el electrolito, en uno de los electrodos (el ánodo) se producen electrones (oxidación), y en el otro (cátodo) se produce un defecto La pila Leclanché, diseñada por Georges Leclanché en de electrones (reducción). Cuando los electrones sobran1868, utiliza una solución de cloruro amónico en la que tes del ánodo pasan al cátodo a través de un conductor se sumergen electrodos de cinc y de carbón, rodeado éste externo a la pila se produce una corriente eléctrica. último por una pasta de dióxido de manganeso y polvo Como puede verse, en el fondo, se trata de una reacción de carbón como despolarizante. Suministra una tensión de oxidación y otra de reducción que se producen simulde 1,5 V y su principal ventaja es que se almacena muy táneamente. bien, pues el cinc no es atacado más que cuando se extrae corriente del elemento. Este tipo de pila sirvió de base para el importante avance que constituyó la pila denominada seca, al que pertenecen prácticamente todas las utilizadas hoy. Los tipos hasta ahora descritos eran denominados húmedos, pues contenían líquidos, que no solo hacían inconveniente su transporte, sino que solían emitir gases peligrosos y olores desagradables. Las pilas secas, en cambio, estaban formadas por un recipiente cilíndrico de cinc, que era el polo negativo, relleno de una pasta electrolítica, y por una barra de carbón en el centro (electrodo positivo), todo ello sellado para evitar fugas. Previamente se había realizado otro tipo de pilas secas, como la de Zamboni (1812), pero eran dispositivos puramente experimentales, que no proporcionaban ninguna corriente útil. La sequedad es relativa, en primer lugar porque un elemento rigurosamente seco no suministraría electricidad alguna, de modo que lo que se encuentra en el interior de las pilas es una pasta o gel, cuya humedad se procura por todos los medios conservar, pero además porque el uso y el paso del tiempo tienden a corroer el contendedor, de modo que la pila puede verter parte de su electrolito al exterior, donde puede atacar a otros metales. Por esta razón se recomienda extraerlas cuando no se utilizan durante mucho tiempo o cuando ya han trabajado mucho. Este inconveniente es- 4 Características, propiedades y forma de utilizar las pilas 4.1 Tensión eléctrica La diferencia de potencial, voltaje o tensión que produce un elemento electroquímico o celda electroquímica viene determinado por la naturaleza de las sustancias de los electrodos y del electrolito, así como por su concentración. Walther Nernst obtuvo el premio Nobel de química de 1920 por haber formulado cuantitativamente y demostrado las leyes que rigen este fenómeno. La conexión de elementos en serie (apilando elementos o poniéndolos en batería) permite multiplicar esta tensión básica cuanto se quiera. Las propiedades puramente eléctricas de una pila se representan mediante el modelo adjunto. En su forma más sencilla, está formado por una fuente de tensión perfecta —es decir, con resistencia interna nula— en serie con un resistor que representa la resistencia interna. El condensador de la versión más compleja es enormemente grande y su carga simula la descarga de la pila. Además de 3 ello, entre los terminales también aparece una capacitan- la realidad es que las pilas se deterioran con el paso del cia, que no suele tener importancia en las aplicaciones de tiempo, aunque no se usen, pues los electrodos resultan corriente continua. atacados en lo que se conoce con el nombre de acción loUna vez fijada la tensión, la ley de Ohm determina la co- cal. Puede considerarse que una pila pierde unos 6 mV rriente que circulará por la carga y consecuentemente el por mes de almacenamiento, aunque depende mucho de trabajo que podrá realizarse, siempre que esté, natural- la temperatura. Actualmente, esto no constituye un promente, dentro de las posibilidades de la pila, que no son blema grave pues, dado el enorme consumo que hay de infinitas, sino que están limitadas fundamentalmente por los tipos corrientes, las que se ofrecen en el comercio son de fabricación reciente. Algunos fabricantes imprimen en el tamaño de los electrodos —lo que determina el tamaño externo de la pila completa— y por su separación. Estos los envases la fecha de caducidad del producto. condicionamientos físicos se representan en el modelo de generador como una resistencia interna por la que pasaría la corriente de un generador ideal, es decir, de uno que pudiese suministrar una corriente infinita al voltaje predeterminado. Conforme la célula se va gastando, su resistencia interna va aumentando, lo que hace que la tensión disponible sobre la carga vaya disminuyendo, hasta que resulte insuficiente para los fines deseados, momento en el que es necesario reemplazarla. Para dar una idea, una pila nueva de las ordinarias de 1,5 V tiene una resistencia interna de unos 350 mΩ, mientras que una vez agotada puede aumentar considerablemente este valor. Ésta es la razón de que la mera medición de la tensión con un voltímetro no sirva para indicar el estado de una pila. En circuito abierto, incluso una pila gastada puede indicar 1,4 V, dada la carga insignificante que representa la resistencia de entrada del voltímetro, pero, si la medición se hace con la carga que habitualmente podría soportar, la lectura bajará a 1,0 V o menos, momento en que esa pila ha dejado de tener utilidad. Las actuales pilas alcalinas tienen una curva de descarga más suave que las antiguas de carbón. Su resistencia interna aumenta proporcionalmente más despacio. 5 Tipos de acumuladores por su naturaleza interna Por lo que a su naturaleza interna se refiere, características electroquímicas, se encuentran habitualmente en el comercio pilas de los tipos que se detallan a continuación. 5.1 Pila común Las pilas secas, de zinc-carbono o pilas comunes están formadas por un recipiente cilíndrico de zinc, que es el polo negativo, relleno de una pasta electrolítica, y por una barra de carbón en el centro (electrodo positivo), todo ello sellado para evitar fugas. Las medidas aproximadas de una pila común son: • Pila de 9 V: 50 mm × 26 mm × 17 mm. • Pila AA: 50 mm de longitud y 14 mm de diámetro. Cuando se necesita una corriente mayor que la que puede Ventajas suministrar un elemento único, siendo su tensión en cambio la adecuada, se pueden añadir otros elementos en la • No se descargan si no están en uso. conexión llamada en paralelo, es decir, uniendo los polos positivos de todos ellos, por un lado, y los negativos, por otro. Este tipo de conexión tiene el inconveniente de que, Desventajas si un elemento falla antes que sus compañeros o se cortocircuita, arrastra irremisiblemente en su caída a todos los • Una pila puede llegar a contaminar 3 000 litros de demás. agua En las características reacciones químicas, las que se producen dentro de una pila son sensibles a la temperatura y, normalmente, se aceleran cuando ésta aumenta, lo que se 5.2 Pilas alcalinas traducirá en un pequeño aumento de la tensión. Más importante es el caso de la bajada, pues cuando se alcanzan En 1866, Georges Leclanché inventa en Francia la pila las de congelación muchas pilas pueden dejar de funcio- Leclanché, precursora de la pila seca (zinc-dióxido de nar o lo hacen defectuosamente, cosa de la que suelen manganeso), sistema que aún domina el mercado mundial advertir los fabricantes. Como contrapartida, si se alma- de las baterías primarias. Las pilas alcalinas (de «alta pocenan las pilas refrigeradas, se prolongará su buen estado. tencia» o «larga vida») son similares a las de Leclanché, pero, en vez de cloruro de amonio, llevan cloruro de sodio o de potasio. Duran más porque el zinc no está expuesto a un ambiente ácido como el que provocan los iones de 4.2 Duración fuera de servicio amonio en la pila convencional. Como los iones se mueLo ideal sería que las reacciones químicas internas no se ven más fácilmente a través del electrolito, produce más produjeran más que cuando la pila esté en servicio, pero potencia y una corriente más estable. 4 5 TIPOS DE ACUMULADORES POR SU NATURALEZA INTERNA Las pilas secas alcalinas son similares a las pilas secas co- Características munes, con las excepciones de que el electrolito es básico (alcalino), porque contiene KOH y la superficie interior El voltaje de una pila alcalina está cerca de 1,5 V. del recipiente de Zn es áspera; esto proporciona un área Usos de contacto mayor. El ánodo está compuesto de una pasta de cinc amalgamaSe utilizan para aparatos complejos y de elevado consumo do con mercurio (total 1 %), carbono o grafito. energético. En sus versiones de 1,5 voltios, 6 voltios y 12 voltios se emplean, por ejemplo, en mandos a distancia • Cinc 14 % (ánodo) (control remoto) y alarmas. • Dióxido de manganeso 22 % (cátodo) • Carbón 2 % 5.3 Pilas alcalinas de manganeso • Mercurio: 0,5 a 1 % (ánodo) Con un contenido de mercurio que ronda el 0,1 % de su peso total, es una versión mejorada de la pila alcalina, en la que se ha sustituido el conductor iónico cloruro de amonio por hidróxido de potasio (de ahí su nombre de alcalina). El recipiente de la pila es de acero, y la disposición del cinc y del óxido de manganeso (IV) (o dióxido de manganeso) es la contraria, situándose el cinc, ahora en polvo, en el centro. La cantidad de mercurio empleada para regularizar la descarga es mayor. Esto le confiere mayor duración, más constancia en el tiempo y mejor rendimiento. Por el contrario, su precio es más elevado. También suministra una fuerza electromotriz de 1,5 V. Se utiliza en aparatos de mayor consumo como: grabadoras portátiles, juguetes con motor, flashes electrónicos. • Hidróxido de potasio (electrolito) • Plástico y lámina 42 % Contiene un compuesto alcalino, llamado hidróxido de potasio. Está compuesta por dióxido de manganeso, MnO2 , hidróxido de potasio (KOH), pasta de cinc (Zn), amalgamada con mercurio (Hg, en total 1 %), carbón o grafito (C). Según la Directiva Europea del 18 de marzo de 1991, este tipo de pilas no pueden superar la cantidad de 0,025 % de mercurio. Descarga El ánodo es de cinc amalgamado y el cátodo es un material polarizador compuesto con base en dióxido de manDurante la descarga, las reacciones en la pila seca alcalina ganeso, óxido de mercurio (II) mezclado íntimamente son: con grafito, y en casos raros, óxido de plata Ag2 O (estos dos últimos son muy costosos, peligrosos y tóxicos), a fin – de reducir su resistividad eléctrica. El electrolito es una Ánodo: Zn (s) + 2 OH (aq) → Zn(OH)2 (s) + – solución de hidróxido potásico (KOH), el cual presenta 2e una resistencia interna bajísima, lo que permite que no se Cátodo: 2 MnO2 (s) + 2 H2 O (l) + 2 e– → 2 tengan descargas internas y la energía pueda ser acumuMnO(OH) (s) + 2 OH– (aq) lada durante mucho tiempo. Este electrolito, en las pilas Global: Zn (s) + 2 MnO2 (s) + 2 H2 O (l) → comerciales se endurece con gelatinas o derivados de la Zn(OH)2(aq) + 2 MnO(OH) (s) celulosa. Este tipo de pila se fabrica en dos formas. En una, el ánodo consta de una tira de cinc corrugada, devanada en espiral de 0,051 a 0,13 mm de espesor, que se amalgama • Respecto a las pilas convencionales entregan más después de armarla. Hay dos tiras de papel absorbente resistente a los álcalis interdevanadas con la tira de papel de potencia y una corriente más estable. cinc, de modo que el cinc sobresalga por la parte superior • Su duración es seis veces mayor que la de la pila de y el papel por la parte inferior. El ánodo está aislado de la cinc-carbono. caja metálica con un manguito de poliestireno. La parte superior de la pila es de cobre y hace contacto con la ti• Resisten mejor el uso constante. ra de cinc para formar la terminal negativa de la pila. La pila está sellada con un ojillo o anillo aislante hecho de Desventajas neopreno. La envoltura de la pila es químicamente inerte a los ingredientes y forma el electrodo positivo. Su mayor costo se deriva de la dificultad de sellar las pilas contra las fugas de hidróxido. Casi todas vienen Ventajas blindadas, lo que impide el derramamiento de los componentes. Sin embargo, este blindaje no tiene duración Este tipo de pilas tiene una duración mayor que las alcalinas. ilimitada. Ventajas 5 Desventajas de las pilas gastadas. Una vez que la envoltura metálica que recubre las pilas se daña, las sustancias químicas se liberan causando contaminación al medio ambiente. Con Este tipo de baterías presenta algunas desventajas: mayor o menor grado, las sustancias son absorbidas por • Una pila alcalina puede contaminar 175 000 litros de la tierra, pudiéndose filtrar hacia las capas freáticas, y de agua, que llega a ser el consumo promedio de agua estas pueden pasar directamente a los seres vivos, entrando con esto en la cadena alimentaria (véase presencia de de toda la vida de seis personas. mercurio en peces). • Cinc, manganeso (Mn), bismuto (Bi), cobre (Cu) y plata (Ag) son sustancias tóxicas, que producen Estudios especializados indican que una micropila de diversas alteraciones en la salud humana. El cinc, mercurio, puede llegar a contaminar 600 000 litros de 12 000 litros y una de óxido de manganeso y cobre son esenciales para la vida, en agua, una de cinc-aire [cita requerida] plata 14 000 litros. cantidades mínimas, y tóxicos en altas dosis. El bismuto y la plata no son esenciales para la vida. Las pilas son residuos peligrosos por lo que, desde el momento en que se empiezan a reunir, deben ser manipuUsos ladas por personal capacitado que siga las precauciones adecuadas empleando todos los procedimientos técnicos Juguetes, tocacintas, cámaras fotográficas, grabadoras, y legales de manipulación de residuos peligrosos. En caso contrario diversas intoxicaciones son posibles, como por linternas, etc. ejemplo el envenenamiento por mercurio. 6 Tipos de pilas por forma y tama8 Véase también ño La distinción entre pilas que utilizan un electrolito y las que utilizan dos, o entre pilas húmedas y secas, son exclusivamente de interés histórico y didáctico, pues todas las pilas que se utilizan actualmente son prefabricadas, estancas y responden a tipos bastante fijos, lo que facilita su comercialización y su uso. Las pilas eléctricas y algunos acumuladores se presentan en unas cuantas formas normalizadas. Las más frecuentes comprenden la serie A (A, AA, AAA, AAAA), A B, C, D, F, G, J y N, 3R12, 4R25 y sus variantes, PP3, PP9 y las baterías de linterna 996 y PC926. Las características principales de todas ellas y de otros tipos menos habituales se incluyen en la tabla siguiente (que también puede verse separadamente). Cabe la posibilidad de utilizar adaptadores, en especial para que las pilas recargables AA se puedan utilizar en aparatos que precisen pilas C y D.[2] Existen unas normas internacionales para la estandarización de los tamaños y voltajes de las pilas para permitir la utilización de aparatos eléctricos a nivel mundial.[3] 7 Pilas y el medio ambiente Los metales y productos químicos constituyentes de las pilas pueden resultar perjudiciales para el medio ambiente, produciendo contaminación química (por ejemplo: envenenamiento por mercurio). Es muy importante no tirarlas a la basura (en algunos países no está permitido), sino llevarlas a centros de reciclado (Reciclaje de pilas y baterías). En algunos países, la mayoría de los proveedores y tiendas especializadas también se hacen cargo • Anexo: Tipos de pila • Generador eléctrico • Batería eléctrica • Energía eléctrica • Pila impolarizable • Pila recargable 9 Referencias [1] Montaje de componentes y periféricos microinformáticos. IFCT0108, en Google libros [2] http://www.pccomponentes.com/energy_sistem_ adaptador_de_baterias_a_tamanos_c_y_d.html [3] Pueden encontrarse datos interesantes sobre los códigos de los distintos fabricantes y sus equivalencias en y en . 10 Enlaces externos • Wikimedia Commons alberga contenido multimedia sobre Pila eléctrica. Commons • Wikcionario tiene definiciones y otra información sobre pila.Wikcionario • El Diccionario de la Real Academia Española tiene una definición para pila. 6 10 ENLACES EXTERNOS • El Diccionario de la Real Academia Española tiene una definición para batería. • Pilas: un enemigo en casa. • Cómo alargar la vida de las baterías. • Encuesta y comentarios sobre baterías. • CEMPRE Uruguay, compromiso empresarial para el reciclaje, página sobre la gestión de pilas y baterías en Uruguay. • Símbolos de pilas. • Cómo usar la pila. • • ¿Cómo saber si una pila o batería está cargada? en YouTube • • Multímetro digital. Comprobación de pilas en YouTube 7 La pila Cu-Ag, un ejemplo de reacción redox. El símbolo electrónico para una batería en un diagrama de circuitos. El mismo se originó como un dibujo esquemático del tipo más temprano de batería, una pila voltaica. Un artefacto para verificar el voltaje de una batería. Una celda voltaica para usar en demostraciones. En este ejemplo las dos semiceldas están conectadas por un puente salino que permite la tansferencia de iones, pero no moléculas de agua. Símbolo de una pila (izquierda); modelo eléctrico simplificado (centro); modelo más elaborado (derecha). 8 Pila alcalina con fuga de su contenido. 10 ENLACES EXTERNOS 9 11 11.1 Origen del texto y las imágenes, colaboradores y licencias Texto • Pila eléctrica Fuente: https://es.wikipedia.org/wiki/Pila_el%C3%A9ctrica?oldid=91832877 Colaboradores: PACO, JorgeGG, Wesisnay, Angus, Paz.ar, Rosarino, Dodo, Triku, Cookie, Tano4595, Murphy era un optimista, Joselarrucea, Gengiskanhg, Xatufan, Schummy, Chewie, Txuspe, Boticario, Deleatur, Soulreaper, Petronas, Xuankar, Airunp, JMPerez, Taichi, Emijrp, Rembiapo pohyiete (bot), Kokoo, OMenda, Guanxito, Platonides, Chobot, Yrbot, BOT-Superzerocool, BOTijo, Mortadelo2005, Lolazar, GermanX, The Photographer, FedericoMP, Maldoror, Chlewbot, Tomatejc, Coppelius, Carlosblh, BOTpolicia, CEM-bot, Gabriel Acquistapace, -jem-, Phósphoros, Andreoliva, Antur, Thijs!bot, ElAbuelo, Mahadeva, REPinolazo, PhJ, LMLM, Isha, AlexXx, VanKleinen, Mansoncc, Muro de Aguas, Hidoy kukyo, Behemot leviatan, Chabbot, Idioma-bot, Pólux, Technopat, Raystorm, DJ Nietzsche, El bart089, Vatelys, Muro Bot, SieBot, Danielba894, PaintBot, Drinibot, Marcelo, Pascow, Cembo123, Ntrrgc, Tirithel, Javierito92, Antón Francho, Maxm~eswiki, Dggionco, Asierba, Eduardosalg, Leonpolanco, Portland, Petruss, Açipni-Lovrij, UA31, Henrik hastalamuerte, Armando-Martin, AVBOT, Tanhabot, Ialad, HQX320, Diegusjaimes, MelancholieBot, Arjuno3, Madalberta, Luckas-bot, Roinpa, ArthurBot, SuperBraulio13, Ortisa, Xqbot, Jkbw, Ricardogpn, Igna, Botarel, Rojasyesid, Halfdrag, RedBot, PatruBOT, CVBOT, Tarawa1943, Nachosan, Foundling, Wikiléptico, Axvolution, EmausBot, Savh, AVIADOR, Allforrous, Espinoza69, Africanus, Guarddon, Alan Black, SUPUL SINAC, Grillitus, JackieBot, Emiduronte, ChuispastonBot, Waka Waka, WikitanvirBot, Mjbmrbot, Diamondland, Raven 547, Pa575to, CocuBot, Hiperfelix, MerlIwBot, Lead holder, DARIO SEVERI, Harpagornis, Elvisor, DanielithoMoya, DLeandroc, Helmy oved, Levanpolca, Zerabat, Rotlink, Addbot, Carlos David Cancino, Jarould, Egis57, AlvaroMolina, ManoloVoctor, Vanessarocio1, Patatarey, Dfgjergu345, Linmariarr y Anónimos: 336 11.2 Imágenes • Archivo:Batteries.jpg Fuente: https://upload.wikimedia.org/wikipedia/commons/3/3b/Batteries.jpg Licencia: Public domain Colaboradores: en:Image:Batteries.jpg Artista original: en:User:Brianiac • Archivo:Batteries_comparison_4,5_D_C_AA_AAA_AAAA_A23_9V_CR2032_LR44_matchstick-vertical.jpeg Fuente: https://upload.wikimedia.org/wikipedia/commons/e/e6/Batteries_comparison_4%2C5_D_C_AA_AAA_AAAA_A23_9V_CR2032_ LR44_matchstick-vertical.jpeg Licencia: CC BY-SA 3.0 Colaboradores: Trabajo propio Artista original: Lead holder • Archivo:Battery_checker.jpg Fuente: https://upload.wikimedia.org/wikipedia/commons/2/26/Battery_checker.jpg Licencia: Public domain Colaboradores: Trabajo propio Artista original: Jason7825 • Archivo:Battery_symbol2.svg Fuente: https://upload.wikimedia.org/wikipedia/commons/2/28/Battery_symbol2.svg Licencia: Public domain Colaboradores: Trabajo propio Artista original: Jacek FH • Archivo:Battery_symbols_and_circuit.png Fuente: https://upload.wikimedia.org/wikipedia/commons/b/b3/Battery_symbols_and_ circuit.png Licencia: CC-BY-SA-3.0 Colaboradores: ? Artista original: ? • Archivo:Commons-emblem-merge.svg Fuente: https://upload.wikimedia.org/wikipedia/commons/8/8b/Commons-emblem-merge.svg Licencia: CC BY-SA 3.0 Colaboradores: • File:Gnome-emblem-important.svg Artista original: GNOME icon artists, Fitoschido • Archivo:Commons-emblem-question_book_orange.svg Fuente: https://upload.wikimedia.org/wikipedia/commons/1/1f/ Commons-emblem-question_book_orange.svg Licencia: CC BY-SA 3.0 Colaboradores: <a href='//commons.wikimedia.org/wiki/File: Commons-emblem-issue.svg' class='image'><img alt='Commons-emblem-issue.svg' src='https://upload.wikimedia.org/wikipedia/ commons/thumb/b/bc/Commons-emblem-issue.svg/25px-Commons-emblem-issue.svg.png' width='25' height='25' srcset='https: //upload.wikimedia.org/wikipedia/commons/thumb/b/bc/Commons-emblem-issue.svg/38px-Commons-emblem-issue.svg.png 1.5x, https://upload.wikimedia.org/wikipedia/commons/thumb/b/bc/Commons-emblem-issue.svg/50px-Commons-emblem-issue.svg.png 2x' data-file-width='48' data-file-height='48' /></a> + <a href='//commons.wikimedia.org/wiki/File:Question_book.svg' class='image'><img alt='Question book.svg' src='https://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Question_book.svg/25px-Question_ book.svg.png' width='25' height='20' srcset='https://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Question_book.svg/ 38px-Question_book.svg.png 1.5x, https://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Question_book.svg/50px-Question_ book.svg.png 2x' data-file-width='252' data-file-height='199' /></a> Artista original: GNOME icon artists, Jorge 2701 • Archivo:Commons-logo.svg Fuente: https://upload.wikimedia.org/wikipedia/commons/4/4a/Commons-logo.svg Licencia: Public domain Colaboradores: This version created by Pumbaa, using a proper partial circle and SVG geometry features. (Former versions used to be slightly warped.) Artista original: SVG version was created by User:Grunt and cleaned up by 3247, based on the earlier PNG version, created by Reidab. • Archivo:ElectrochemCell.png Fuente: https://upload.wikimedia.org/wikipedia/commons/3/39/ElectrochemCell.png Licencia: CC-BYSA-3.0 Colaboradores: Transferido desde en.wikipedia a Commons. Artista original: Alksub de Wikipedia en inglés • Archivo:LeakedBattery_2701a.jpg Fuente: https://upload.wikimedia.org/wikipedia/commons/7/7d/LeakedBattery_2701a.jpg Licencia: CC BY-SA 3.0 de Colaboradores: Trabajo propio Artista original: Túrelio • Archivo:Pila_Cu_Ag.PNG Fuente: https://upload.wikimedia.org/wikipedia/commons/4/40/Pila_Cu_Ag.PNG Licencia: CC-BY-SA-3.0 Colaboradores: Trabajo propio Artista original: Muro de Aguas • Archivo:Wiktionary-logo-es.png Fuente: https://upload.wikimedia.org/wikipedia/commons/0/06/Wiktionary-logo-es.png Licencia: CC BY-SA 3.0 Colaboradores: originally uploaded there by author, self-made by author Artista original: es:Usuario:Pybalo 11.3 Licencia del contenido • Creative Commons Attribution-Share Alike 3.0