Gases-Respiración Externa clase
Anuncio

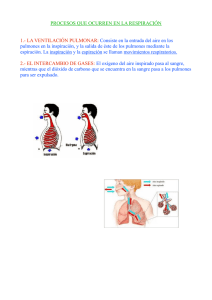
Gases – Respiración Externa Respiración • Interna o Celular • Externa 1 •Respiración Interna o Celular - Común a casi todos los seres vivos - Implica el intercambio de ciertos gases entre el medio y las células. - Utilización de un gas oxidante para la oxidación de compuestos orgánicos. - En la mayoría de las células implica la absorción de O2 y remoción de CO2. - A cargo de las mitocondrias en células eucariotas. • Respiración Externa - Exclusiva de organismos pluricelulares. - Se produce a través de mecanismos que permiten el intercambio de los gases que participan en la respiración interna entre el medio y el organismo. - En el caso de organismos pluricelulares terrestres estos mecanismos finalmente permiten el intercambio de gases entre la atmósfera y los tejidos. 2 Respiración Externa • Ventilación o intercambio de gases entre la atmósfera y los alvéolos pulmonares ETAPAS • Intercambio de O2 y CO2 entre el aire alveolar y la sangre • Trasporte de O2 y CO2 entre los pulmones y los tejidos • Intercambio de O2 y CO2 entre la sangre y los tejidos Órganos de la cavidad torácica 3 Sistema respiratorio Bronquíolo y Alvéolo 4 Vías Aéreas Propiedades y comportamiento de los gases 5 Variables de estado: •Presión = Fuerza / área⊥ P = F/S Unidades: N/m2= Pascal, dina/cm2= Baria, atm, mmHg • Volumen (V): espacio ocupado por la masa gaseosa. Unidades: m3, dm3 ≡ L, cm3 ≡ ml • Temperatura (t o T): relacionada con la energía cinética de las moléculas que constituyen el gas. Unidades: °C (t), K (T) T (K) = 273,16 + t (°C ) • Composición: tipo y cantidad de sustancia en la masa gaseosa. Unidades: mol número de moles = masa/masa molar n= m/Mr Modelo del gas ideal: Leyes •Ley de Boyle-Mariotte a T= cte P.V = cte o P1.V1 = P2.V2= cte (T, m, nat gas) P1.V1/T1 = P2.V2/T2 o •Ley de Charles-Gay Loussac a P= cte V/T = cte o V1/T1 = V2/T2= cte (P, m, nat gas) P.V/T = cte (m, nat gas) 6 Modelo del gas ideal: Leyes • Hipótesis de Avogadro: volúmenes iguales de gases distintos en la mismas condiciones de presión y temperatura tienen el mismo número de moléculas. En particular, si el número de moléculas es NA (se trata de 1 mol de moléculas o sea n=1) y las condiciones de P y T son las normales (CNPT, P = 1 atm y T = 273,16 K), todos los gases ocupan el mismo volumen (volumen molar) de 22, 4 L P.V/T = cte = n.R (Ec. general de estado) Modelo del gas ideal: Leyes • Ley de Dalton de las presiones parciales: en una mezcla de gases, cada gas ejerce su propia presión parcial. La presión parcial de un gas “i” (pi) en una mezcla de gases es la presión que ejercería si estuviese solo (su propio número de moles ni) en las mismas condiciones de volumen y temperatura de la mezcla. para la mezcla: pi = ni . R.T/V donde T y V temperatura y volumen de la mezcla P = n. R.T/V donde P y n son la presión y el número moles totales (n = ∑ ni) de la mezcla Relacionando: pi/P = ni/ n = xi (fracción molar del gas “i”) Sumando las pi: ∑pi = ∑(ni.R.T/V )=(RT/V)· ∑ni =n R.T/V = P p i = xi . P P = ∑ pi La presión total de una mezcla de gases es la suma de las presiones parciales de cada gas de la mezcla 7 Modelo del gas ideal: Leyes • Ley de Amagat de los volúmenes parciales: en una mezcla de gases, cada gas ocupa su propio volumen parcial. El volumen parcial de un gas “i” (Vi) en una mezcla de gases es el volumen que ocuparía si estuviese solo (su propio número de moles ni) en las mismas condiciones de presión y temperatura de la mezcla. Vi = ni.R.T/P donde T y P temperatura y volumen de la mezcla para la mezcla: V = n.R.T/P donde V y n son el volumen y el número de moles totales (n = ∑ ni) de la mezcla relacionando: Vi/V = ni/ n = xi (fracción molar del gas “i”) La fracción en volumen de un componente es la fracción molar del mismo. recordando que el porcentaje volumen en volumen (%V/V) de un componente es el volumen ocupado por ese componente por cada cien volúmenes de mezcla concluimos que: %V/V = Vi/V .100 %V/V = xi . 100 Ley de Henry: solubilidad de gases en líquidos Los gases se disuelven en líquidos. A una dada temperatura, la concentración máxima alcanzada por el gas en la fase líquida (su solubilidad) depende de la presión parcial del gas en la fase gaseosa en contacto con el líquido. Por ejemplo, para el CO2: 8 Constantes de Henry para algunos gases en agua A mayor constante de Henry mayor es la solubilidad del gas en el líquido Ley de Henry: solubilidad de gases en líquidos Entonces, como medida de la concentración de un dado gas en un líquido, podemos hablar directamente de la presión parcial con la que está en equilibrio ese gas en fase gaseosa en contacto con el líquido, a una dada temperatura. ¿Qué significa afirmar que la pCO2 en sangre es de 46 mmHg? La solubilidad de los gases en líquidos disminuye con el aumento de la temperatura y aumenta con el aumento de la presión en fase gaseosa 9 Difusión: Partiendo de un sistema en el cual existen gradientes de presión, y por lo tanto de concentración, de uno o más gases de una solución, la difusión es el proceso por el cual se tiende espontáneamente a uniformar la presión o concentración en toda la extensión de la solución. Las moléculas de los gases difunden espontáneamente desde zonas de mayor presión parcial o concentración a zonas de menor presión parcial o concentración del componente en cuestión. La velocidad de difusión de moléculas en fase gaseosa es mucho mayor que en medios líquidos. La primera ley de Fick es la que describe matemáticamente el proceso de difusión: • Ley de Fick: la cantidad de materia que atraviesa una sección perpendicular a la dirección de movimiento en la unidad de tiempo (velocidad de pasaje) es propocional al gradiente de concentración. El gradiente de concentración (C1-C2/L) es la variación de la concentración con la distancia. m/t = - D. S. (C1- C2)/L donde: m es la masa o número de moles; t el tiempo; S es la superficie; L la distancia entre los puntos 1 y 2 con concentraciones C1 y C2; D coeficiente de difusión. Equivalente de la ley de Fick expresada en presiones parciales: m/t = - K. S. (p1- p2)/L 10 Ventilación Respiramos aire atmosférico La atmósfera es la envoltura gaseosa que rodea a la tierra y ejerce una fuerza (su peso) sobre la superficie terrestre (presión). A nivel del mar y 45° de latitud, la presión es de 760 mmHg ≡ 1 atm y varía con la posición en el globo terraqueo: desciende con la altitud y se incrementa con la latitud. Está compuesta por (%V/V): 20,93 % de O2 0,03 % de CO2 79,04 % de N2 y otros gases inertes Si hay vapor de agua, disminuyen proporcionalmente todos los porcentajes. 11 Medida de la presión atmosférica Patm vacío En condiciones de equilibrio estático, la fuerza ejercida por el peso de la atmósfera sobre la superficie libre del mercurio (presión atmosférica) es equivalente al peso ejercido por la columna de mercurio encerrada en el tubo sobre la superficie del mismo (s) 1 atm = mHg.g/s = δHg.g.VHg/s = = δHg.g.s. hHg/s = δHg.g.hHg= ρHg.h Experiencia de Torricelli 1 atm = 760 mmHg Presiones parciales de los gases atmosféricos (en mmHg) Aire seco Aire saturado con vapor de H2O a 37°C O2 160 139 CO2 0,3 0,3 N2 y otros 600 574 H2O 47 12 Presión transmural (Ptr) Es la diferencia entre la presión en la cavidad de un órgano (Pi) y la exterior ejercida por las estructuras que rodean al órgano (Pe): Ptr = Pi-Pe En los pulmones a la Ptr se la denomina presión transpulmonar (Ptrp) y su valor al final en la espiración tranquila es aproximadamente: Ptrp=Pi (en la cavidad) - Pe (en el espacio pleural) =760 mmHg - 755 mmHg =5 mm Hg En condiciones estáticas la Ptrp es contrarrestada por las fuerzas de retracción elástica del sistema pulmones-tórax. La fuerza de retracción elástica es la que determina la existencia de una presión subatmosférica en la cavidad pleural e incluye 2 componentes principales: • las fuerzas ejercidas por las fibras elásticas del parénquima pulmonar • la tensión superficial en la interfase aire alveolar-alvéolo que, por la geometría alveolar (burbujas de radio pequeño), tiende a colapsar las cavidades alveolares. 13 El aire entra en los pulmones y sale de ellos mediante los movimientos respiratorios que son dos: Inspiración - Espiración Entra aire Sale aire Diafragma e intercostales externos contraídos El volumen torácico aumenta Diafragma e intercostales externos relajados Retracción elástica de los pulmones El volumen torácico disminuye La presión intrapulmonar disminuye La presión intrapulmonar aumenta Inspiración (activa) Espiración (pasiva) Ciclo Respiratorio 14 Volúmenes y Capacidades Respiratorias VRI VRE Distensibilidad de los pulmones y la caja torácica ΔV ΔP = distensibilidad o adaptabilidad Es una medida estática de la retracción pulmonar y del tórax. 15 Factores mecánicos participantes en los movimientos respiratorios Durante los movimientos respiratorios se ponen en juego fuerzas mecánicas para vencer resistencias. Resistencia elástica de los pulmones: fuerza de retracción elástica de las paredes pulmonares. En Inspiración (contracción de músculos inspiratorios) Resistencia opuesta por los tejidos no elásticos: aparece por la fricción de los tejidos que se desplazan durante la inspiración (caja torácica, diafragma, vísceras abdominales). Resistencia al flujo aéreo: fuerza que se opone a la circulación del fluido (aire) y depende de la viscosidad del mismo, de la longitud y área del árbol bronquial. Fuerza elástica: al cesar la fuerza que distendía a los pulmones y al tórax, la propiedad elástica recupera, en forma pasiva, al complejo pulmonestórax a su volumen inicial En Espiración (relajación de músculos Resistencia hística no elástica: al igual que en la inspiración, en la espiración se produce fricción de los tejidos al desplazamiento. La fuerza de recuinspiratorios) peración elástica es la responsable de vencer esta resistencia. Resistencia al flujo aéreo: al igual que en la inspiración existe resistencia a la circulación del aire espirado. 16 Surfactante pulmonar Es una sustancia tensioactiva existente en la fina capa acuosa que tapiza los alvéolos pulmonares. Los componentes mayoritarios son fosfolípidos (88%), proteínas (10%) y otros componentes menores. Los alvéolos pulmonares se comportan como pequeñas burbujas de aire interconectadas sumergidas en el estroma de los pulmones. Esta geometría (esférica) determina la tendencia al colapso, generando una presión superficial resultante que depende de la tensión superficial del fluido que tapiza los alvéolos y del radio de los mismos (Ley de Laplace para geometría esférica): P = 2γ / r donde: P presión superficial resultante, γ tensión superficial y r radio de la esfera rA rB A menor radio mayor es la tendencia al colapso y en consecuencia, a medida que progresa la espiración la tendencia al colapso aumentaría. Además, al estar interconectados, se favorece el colapso de los alvéolos mas pequeños con expansión de los mas grandes. 17 La presencia del surfactante, al disminuir la interacción (cohesión) entre moléculas del agua en la superficie alveolar, disminuye la tensión superficial de la interfase aire-agua haciendo que el esfuerzo (trabajo) respiratorio disminuya. aire Po Sin surfactante agua aire Con surfactante Po agua Como actúa el surfactante durante el ciclo respiratorio? Inspiración: • radio alvealor (r) aumenta → las moléculas del surfactante se expanden (se diluyen en la superficie) → aumento de la tensión superficial (γ). • el aumento de γ es contrarrestado por el incremento del radio alveolar → la presión superficial resultante (P) se mantiene prácticamente constante (Ley de Laplace) Espiración: • radio alveolar (r) disminuye → las moléculas de surfactante se concentran en la superficie → disminuye la tensión superficial (γ) • la disminución de γ antagoniza la tendencia al colapso por disminución del radio alveolar (Ley del Laplace) 18 Resumiendo, la presencia de la sustancia tensioactiva tiene tres efectos: • disminuye γ en todos los alvéolos (independientemente del diámetro) y en consecuencia la presión para mantenerlos abiertos. • permite que alvéolos con diferente diámetro permanezcan abiertos por la misma presión, ya que los de menor diámetro tienen también menor γ y los de mayor diámetro poseen mayor γ. • permite que la presión necesaria para mantener los alvéolos distendidos en espiración (todos tienen menor diámetro que en inspiración), sea menor por disminuir en todos la γ al concentrarse la sustancia tensioactiva. Intercambio de O2 y CO2 entre el aire alveolar y la sangre 19 Composición (%V/V) y presiones parciales (mmHg) del aire inspirado, aire alveolar y aire espirado Aire inspirado aire alveolar aire espirado O2 20,8 13,2 15,2 N2 78,4 75,4 74,9 CO2 0,04 5,2 3,7 H2 0 0,75 6,2 6,2 O2 158 100 116 N2 596 573 569 CO2 0,3 40 28 H2 0 5,7 47 47 %V/V pi El aire inspirado difiere del aire alveolar debido a: • Humidificación en las vías respiratorias hasta saturación con vapor de H20 a 37ºC. • Intercambio rápido de gases respiratorios (cesión o pérdida de O2 y ganancia de CO2) a nivel alveolar (hematosis). El aire espirado difiere del aire alveolar debido a la mezcla con el aire existente en el espacio muerto (fundamentalmente vías respiratorias de conducción) en donde no existe hematosis. Aproximadamente el 30% del volumen corriente constituye el espacio muerto funcional. 20 Composición (%V/V) y presiones parciales (mm Hg) en sangre venosa y sangre arterial Sangre venosa %V/V pi Sangre arterial O2 5,2 13,2 N2 75,4 75,4 CO2 6,1 5,2 H2 0 6,2 6,2 O2 40 ∼100 N2 573 573 CO2 46 40 H2 0 47 47 Hematosis El intercambio de gases respiratorios entre alvéolos y sangre se lleva a cabo por difusión simple a través de la superficie de la membrana alvéolo-capilar, siguiendo el gradiente de concentración o presión parcial de cada uno ellos (Ley de Fick): m/t = - K. S. (p1- p2)/L alvéolo O2 CO2 membrana alvéolo-capilar: •Epitelio alveolar •Membranas basales del epitelio alveolar y capilar •Endotelio capilar glóbulo rojo capilar 21 Transporte de O2 y CO2 en la sangre Transporte de O2: La mayor proporción del O2 en sangre es transportado por la Hemoglobina (Hb) en los glóbulos rojos y la menor proporción disuelta molecularmente en el plasma según la ley de Henry. Proporción del transporte total de O2(%) en Sangre arterial y venosa. disuelto combinado Sangre arterial 1,3% 98,7% Sangre venosa 0,8% 99,2% A nivel de los tejidos donde la pO2 < 40mmHg y el pH es mas bajo (consecuencia del metabolismo tisular), el O2 difunde hacia los tejidos por difusión simple y la Hb cede el O2 no sólo por disminución de la pO2 a ese nivel, sino que además disminuye la afinidad de la Hb por O2 (corrimiento hacia la derecha de la curva de saturación). 22 Transporte de CO2 El CO2 es transportado en sangre : • Disuelto molecularmente (∼7%). • Combinado con las proteínas (Hb y proteínas plasmáticas) como compuestos carbamínicos (∼23%). • Como bicarbonato CO3H- (producido por la elevada actividad de la anhidrasa carbónica erotrocitaria. (∼70%). a nivel pulmonar a nivel tisular En resumen… Alvéolo Circulación venosa Circulación arterial Respiración aeróbica Intercambio de gases respiratorios a nivel de membrana alvéolo capilar y tisular. Se lleva a cabo por difusión simple a favor de gradiente de concentración (presión parcial). 23