INDICADORES DE pH
Anuncio
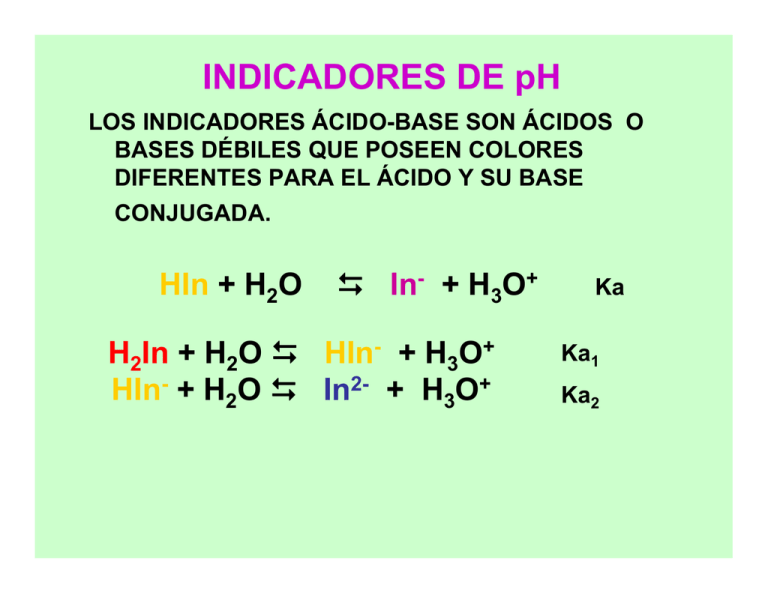
INDICADORES DE pH LOS INDICADORES ÁCIDO-BASE SON ÁCIDOS O BASES DÉBILES QUE POSEEN COLORES DIFERENTES PARA EL ÁCIDO Y SU BASE CONJUGADA. HIn + H2O In- + H3O+ H2In + H2O HIn- + H3O+ HIn- + H2O In2- + H3O+ Ka Ka1 Ka2 RANGO DE VIRAJE HIn + H2O ↔ In- + H3O+ color 1 color 2 Ka = [H3O+] [In-]/[HIn] [H3O+] = Ka [HIn]/[In-] (-log [H3O+]) = (-log Ka) + (log [In-]/[HIn]) pH = pKa + log [In-]/[HIn] (1) RANGO DE VIRAJE HIn + H2O ↔ In- + H3O+ color 1 color 2 [H3O+] = Ka [HIn]/[In-] La concentración de una especie debe ser 10 veces superior a la de la otra especie para que predomine su color. si [In-] = 10 [HIn] predomina el color 2 [In-]/[HIn] = 10 en la eq.(1) pH = pKa + log 10 pH pKa + 1 RANGO DE VIRAJE si [HIn] = 10 [In-] predomina el color 1 [In-]/[HIn] = 1/10 en la eq.(1) pH = pKa + log 1/10 pH pKa - 1 El rango de viraje de un indicador será: pH pKa + 1 predomina el color de la base conjugada pH pKa - 1 predomina el color de la especie molecular TITULACIÓN ÁCIDO FUERTE CON BASE FUERTE Viraje del amarillo de alizarina R Viraje de la fenolftaleína Punto de equivalencia Viraje del azul bromotimol Viraje del azul bromofenol Viraje del violeta de metilo Volumen de NaOH 0.500 M [ml] Titulación de 20.0 ml de HCl con NaOH 0.50 M. En el punto de equivalencia el pH es neutro (pH = 7). TITULACIÓN ÁCIDO DÉBIL CON BASE FUERTE Titulación de 20.0 ml de AcH con NaOH 0.50 M. En el punto de equivalencia el pH > 7. Punto de equivalencia Viraje del azul bromofenol Viraje de la fenolftaleína ½ punto de half equiv pt equivalencia SOLUCIONES BUFFER O REGULADORAS DE pH El pH del agua varía considerablemente cuando se agregan H+ u OH-. Sin embargo, existe un tipo de disoluciones , denominadas reguladoras o buffer, que permiten la adición de H+ u OH- sin que varíe sensiblemente el pH. Las disoluciones reguladoras están formadas por una sal de ácido débil y un ácido débil o bien, una sal de base débil y una base débil. SOLUCIONES BUFFER O REGULADORAS DE pH Las disoluciones reguladoras están formadas por: ácido débil y la base conjugada del ácido Ej.: ácido acético/acetato de sodio HAc/Acbase débil y el ácido conjugado de la base Ej.: amoníaco/cloruro de amonio NH3/NH4+ SOLUCIONES BUFFER O REGULADORAS DE pH ACETATO DE SODIO/ÁCIDO ACÉTICO NaAc/HAc MX/HX Disociación de la sal MX X- + M+ Hidrólisis del anión X- + H2O ↔ HX + OH- Kh Disociación del ácido HX ↔ X- + H+ Ka Kh << Ka La disociación del ácido disminuye por efecto del ión común X- (principio de Le Chatelier) SOLUCIONES BUFFER O REGULADORAS DE pH Ka = [H+] [X- ] / [HX] Ka = [H+] Cbase / Cácido [H+] = Ka Cácido / Cbase - log [H+] = - log Ka + (- log Cácido + log Cbase) pH = pKa + log (Cbase/Cácido) Ka, constante de disociación del ácido Cbase concentración molar de la base conjugada (sal) Cácido concentración molar del ácido Ecuación de HendersonHasselbalch SOLUCIONES BUFFER O REGULADORAS DE pH amoníaco/cloruro de amonio NH3/NH4Cl NH4+ + H2O ↔ NH3 + H3O+ Kh NH3 + H2O ↔ NH4+ + OH- Kb SOLUCIONES BUFFER O REGULADORAS DE pH Kb = [OH-] [NH4+ ] / [NH3] Kb = [OH-] Cácido / Cbase [OH-] = Kb Cbase / Cácido - log [OH-] = - log Kb + (- log Cbase + log Cácido) pOH = pKb + log (Cácido/Cbase) Kb, constante de disociación de la base Cbase concentración molar de la base Cácido concentración molar del ácido conjugado (sal) ACCIÓN REGULADORA Si a un sistema buffer formado por el par ácido/base conjugado HA/A- se le agrega una pequeña cantidad de base fuerte como NaOH, los iones OH- que ésta produce son consumidos completamente por el ácido HA, según: OH- + HA H2O + ASi en lugar de la base fuerte se agrega una pequeña cantidad de ácido fuerte, la base conjugada A- interviene para neutralizar completamente los iones H3O+ producidos por el ácido, según: H3O+ + A- H2O + HA CÓMO ELEGIR UN SISTEMA BUFFER A partir del valor del pKa del ácido de un sistema buffer se puede obtener el intervalo de pH para el cual el sistema tiene capacidad reguladora aceptable. Este rango puede obtenerse teniendo en cuenta que las concentraciones iniciales Ca y Cb del sistema deben ser altas y que la relación entre ellas debe cumplir que, 0,1 < Cb / Ca < 10 CÓMO ELEGIR UN SISTEMA BUFFER Así aplicando la ecuación de Henderson-Hasselbalch, pH = pKa + log (Cbase/Cácido) Si Si Cb / Ca = 0,1 es: pH = pKa + log 0,1 = pKa - 1 Cb / Ca = 10 es: pH = pKa + log 10 = pKa + 1 Cada sistema regulador actúa eficientemente en un intervalo de pH determinado, que se encuentra en el entorno de una unidad del valor de pKa del sistema, es decir: pKa - 1 < pH < pKa + 1 CÓMO ELEGIR UN SISTEMA BUFFER Se prepara una solución disolviendo NH3 (Kb = 1,82 x 10-5) en agua y la sal de su ácido conjugado. a) Escribir la ecuación que indica cómo actúa este sistema para amortiguar el cambio de pH al agregar una pequeña cantidad de base fuerte. b) Indicar el intervalo regulador. CÓMO ELEGIR UN SISTEMA BUFFER a)El agregado de una base fuerte produce el ión OH-, que es neutralizado por el ácido NH4+ : NH4+ + OH- H2O + NH3 b) El intervalo regulador está en el entorno del valor del pKa del sistema en más o menos una unidad. Por lo tanto, para determinar este intervalo debemos calcular el pKa del ácido NH4+. NH4+ + H2O NH3 + H3O+ CÓMO ELEGIR UN SISTEMA BUFFER NH4+ + H2O NH3 + H3O+ Ka =Kw = [NH3] . [H3O+] = 5,6 x 1010 M Kb [NH4+] Por lo tanto el sistema regula en el intervalo de pH correspondiente a: pH = pKa + 1 = - log 5,6 x 10-10 + 1 = 10,25 pH = pKa - 1 = -log 5,6 x 10-10 - 1 = 8,25



