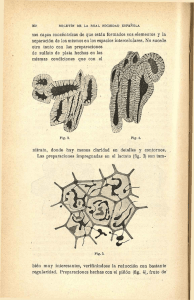
preparaciones farmacéuticas elaboradas con base en productos
Anuncio

1 PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES REGULACIÓN SANITARIA MARÍA CAROLINA DÍAZ JIMÉNEZ MARÍA JOSÉ SUAREZ MORA Pontificia Universidad Javeriana Facultad de Ciencias Jurídicas y Socioeconómicas Santafé de Bogotá D.C. – Colombia 2000 2 PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES REGULACIÓN SANITARIA MARÍA CAROLINA DÍAZ JIMÉNEZ MARÍA JOSÉ SUAREZ MORA Trabajo de Grado Director DOCTOR CAMILO URIBE GRANJA Médico Toxicólogo Pontificia Universidad Javeriana Facultad de Ciencias Jurídicas y Socioeconómicas Santafé de Bogotá D.C. – Colombia 2000 3 PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES REGULACIÓN SANITARIA Pontificia Universidad Javeriana Facultad de Ciencias Jurídicas y Socioeconómicas Santafé de Bogotá D.C. – Colombia 2000 4 RESUMEN El objetivo principal de este trabajo consistió en realizar una investigación seria que significara un aporte para quienes están llamados a regular el sector de los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en los mismos, así como para quienes de alguna u otra forma se interesan en ella. Para estos efectos se estudio la evolución histórica de la medicina natural, su evolución de normativa en nuestro país y la normatividad vigente, se hicieron investigaciones de campo, y se estudio la experiencia de otros países en lo relacionado con la producción, comercialización y consumo de las preparaciones farmacéuticas elaboradas con base en productos naturales. 5 CONTENIDO Pág. INTRODUCCIÓN 1 1. USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS A TRAVÉS DE LA HISTORIA 4 1.1 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LOS PUEBLOS PRIMITIVOS 5 1.2 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LAS CIVILIZACIONES ANTIGUAS 7 1.2.1 Uso de los productos naturales como medicamentos en la civilización mesopotámica 8 1.2.2 Uso de los productos naturales como medicamentos en la civilización egipcia 9 1.2.3 Uso de los productos naturales como medicamentos en el pueblo hebreo 10 1.2.4 Uso de los productos naturales como medicamentos en la civilización china 10 1.2.5 Uso de los productos naturales como medicamentos en la civilización hindú 13 1.2.6 Uso de los productos naturales como medicamentos en la civilización griega 14 1.3 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LA EDAD MEDIA 16 1.4 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN EL RENACIMIENTO 17 1.5 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LA EDAD MODERNA 19 1.6 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN AMÉRICA PRECOLOMBINA 21 1.7 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN COLOMBIA 22 1.7.1 Uso de los productos los primeros pobladores naturales como medicamentos por 22 1.7.2 Los estudios de José Celestino Mutis.- El Siglo XVIII 23 1.7.3 Estudios realizados durante el Siglo XIX 24 1.7.4 La medicina durante el Siglo XX 24 1.7.4.1 El curanderismo como medicina tradicional 25 1.7.4.2 Resurgimiento de las plantas medicinales 26 2. EVOLUCIÓN NORMATIVA 2.1 29 DÉCADA DE 1960 30 2.1.1 Ley 23 de 1962 30 2.1.2 Decreto 1950 de 1964 33 2.2 DECADA DE 1970 38 2.2.1 Ley 28 de 1974 38 2.2.2 Decreto Ley 621 de 1974 38 2.2.3 Decreto 281 de 1975 38 2.2.4 Decreto Ley 981 de 1975 47 2.2.5 Decreto Ley 121 de 1976 48 2.2.6 Decreto 522 de 1976 49 2.2.7 Ley 9 de 1979 51 DECADA DE 1980 58 2.3 2.3.1 Decreto 2333 de 1982 58 6 2.3.2 Decreto Ley 3466 de 1982 58 2.3.3 Decreto 713 de 1984 62 2.3.4 Decreto 2092 de 1986 65 2.4 DECADA DE 1990 73 2.4.1 Ley 10 de 1990 73 2.4.2 Decreto 1524 de 1990 74 2.4.3 Resolución 5078 de 1990 82 2.4.4 Decreto 2780 de 1991 85 2.4.5 Ley 100 de 1993 86 2.4.6 Decreto 2269 de 1993 87 2.4.7 Decreto 374 de 1994 89 2.4.8 Decreto Ley 1290 de 1994 95 2.4.9 Decreto 677 de 1995 97 2.4.9.1 Título I. Disposiciones Generales 98 2.4.9.2 Título II. Del Régimen de las Licencias Sanitarias de Funcionamiento para los establecimientos fabricantes de medicamentos, preparaciones farmacéuticas a base de recursos naturales, cosméticos, productos de aseo, higiene y limpieza y otros productos de uso doméstico 100 2.4.9.3 Título III. Disposiciones Generales del Régimen del Registro Sanitario 102 2.4.9.4 Titulo IV. De los envases, etiquetas, rótulos, empaques, nombres y publicidad 108 2.4.9.5 Título V. Del Control de Calidad 110 2.4.9.6 Título VI. Disposiciones Comunes a los Registros Sanitarios 111 2.4.9.7 Titulo VII. De la revisión oficiosa de los Registros Sanitarios 111 2.4.9.8 Título VIII. Del Régimen de Control y Vigilancia Sanitaria, las medidas sanitarias de seguridad, procedimientos y sanciones 113 7 8 2.4.10 Decreto 936 de 1996 119 2.4.11 Resolución 4536 de 1996 122 2.4.12 Decreto 341 de 1996 126 2.4.13 Decreto 337 de 1998 126 3. MARCO NORMATIVO VIGENTE 130 3.1 FUNDAMENTO CONSTITUCIONAL 131 3.2 MARCO LEGISLATIVO Y REGLAMENTARIO 143 3.2.1 El ejercicio interpretativo para determinar el marco legislativo y reglamentario vigente 145 3.2.1.1 Ley 23 de 1962 145 3.2.1.2 Decreto 1950 de 1964 145 3.2.1.3 Decreto Ley 621 de 1974 147 3.2.1.4 Decreto 281 de 1975 148 3.2.1.5 Decreto Ley 121 de 1976 148 3.2.1.6 Decreto 522 de 1976 149 3.2.1.7 Ley 9 de 1979 149 3.2.1.8 Decreto 2333 de 1982 149 3.2.1.9 Decreto Ley 3466 de 1982 150 3.2.1.10 Decreto 713 de 1984 150 3.2.1.11 Decreto 2092 de 1986 150 3.2.1.12 Ley 10 de 1990 151 3.2.1.13 Decreto 1524 de 1990 151 3.2.1.14 Resolución 5078 de 1990 151 3.2.1.15 Decreto 2780 de 1991 151 9 3.2.1.16 Ley 100 de 1993 152 3.2.1.17 Decreto 2268 de 1993 152 3.2.1.18 Decreto 374 de 1994 152 3.2.1.19 Decreto Ley 1290 de 1994 153 3.2.1.20 Decreto 677 de 1995 153 3.2.1.21 Decreto 936 de 1996 154 3.2.1.22 Resolución 4536 de 1996 del Ministerio de Salud 154 3.2.1.23 Decreto 341 de 1996 154 3.2.1.24 Decreto 337 de 1998 155 3.2.2 Leyes, decretos y resoluciones vigentes 155 3.2.2.1 En lo relacionado con la competencia para definir la política nacional en materia de salud 155 3.2.2.2 En lo relacionado con la organización del Sistema Nacional de Salud 156 3.2.2.3 En lo relacionado con los órganos competentes para ejecutar las políticas formuladas por el Ministerio de Salud en materia de vigilancia sanitaria y control de calidad de las preparaciones farmacéuticas elaboradas con base en productos naturales 156 3.2.2.4 En lo relacionado con la regulación del ejercicio de la profesión de químico farmacéutico 156 3.2.2.5 En lo relacionado con la clasificación, definición y régimen general de los distintos establecimientos farmacéuticos 157 3.2.2.6 En lo relacionado con la elaboración, almacenamiento, transporte y expendio de medicamentos, cosméticos y alimentos 157 3.2.2.7 En lo relacionado con la normalización y metrología 158 3.2.2.8 En lo relacionado con los procedimientos administrativos aplicables por las autoridades sanitarias 158 envase, drogas, 3.2.2.9 En lo relacionado con la idoneidad, calidad, garantías, marcas, leyendas, propaganda, fijación pública de precios y responsabilidad de los productores, expendedores y proveedores de preparaciones farmacéuticas elaboradas con base en productos naturales 158 3.2.2.10 En lo relacionado con la responsabilidad civil y penal de quienes infrinjan las normas sanitarias 159 4. ANÁLISIS DEL PROYECTO DE LEY 139 DE 1997 161 4.1 DE LA MATERIA DEL PROYECTO 161 4.2 DE LA JUSTIFICACION DEL PROYECTO 165 4.3 DEL PODER FÁCTICO DEL PROYECTO Y LA CAPTURA DEL ENTE REGULADOR 167 5. RESULTADOS DE LA INVESTIGACIÓN DE CAMPO 171 5.1 TOXICIDAD vs EFICACIA Y SEGURIDAD DE LAS PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES 176 5.2 EL SECTOR PRODUCTIVO Y DE COMERCIO DE LAS PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN RECURSOS NATURALES 181 5.3 LA LUCHA POR LA LEGALIZACION Y POR UNA REGULACION INDEPENDIENTE 183 6. LA EXPERIENCIA DE OTROS PAISES 191 6.1 PANORAMA GENERAL 191 6.2 REGULACION Y REGISTRO 194 6.3 EL PROGRAMA DE MEDICINA TRADICIONAL ORGANIZACIÓN MUNDIAL DE LA SALUD 6.4 SISTEMAS DE REGULACIÓN EN LOS DIFERENTES PAÍSES 6.4.1 6.4.1.1 En los países africanos Sudáfrica DE LA 196 199 199 200 10 11 6.4.2 En los países americanos 201 6.4.2.1 Argentina 201 6.4.2.2 Canadá 203 6.4.2.3 Estados Unidos de América 204 6.4.3 En los países europeos 207 6.4.3.1 Alemania 209 6.4.3.2 Italia 212 6.4.3.3 Reino Unido 213 6.4.4 En los países asiáticos 213 6.4.4.1 India 214 6.4.4.2 China 215 6.4.4.3 Japón 217 CONCLUSIONES 219 BIBLIOGRAFÍA 225 12 GLOSARIO ADULTERADO: Dícese de la sustancia alimenticia o medicinal que ha sido alterada fraudulentamente. AGENCIAS DE ESPECIALIDADES FARMACÉUTICAS: “Se entiende por agencia de especialidades farmacéuticas el establecimiento dedicado al almacenamiento, promoción y venta de productos fabricados por los laboratorios cuya representación o distribución hayan adquirido. Estos establecimientos cumplirán, en lo pertinente, los requisitos exigidos a los depósitos por el presente Decreto, y su dirección técnica estará a cargo de un farmacéutico en ejercicio legal de la profesión.” Artículo 63, Decreto 1950 de 1960. ALIMENTO: Sustancia que introducida en el organismo sirve para la nutrición de los tejidos o para la producción de calor. ANIMAL: Organismo vivo sensible, que se mueve voluntariamente y es capaz de ingerir y digerir alimentos. BIOQUÍMICO: Relativo a la química de los diversos fenómenos biológicos, de la materia viviente. CALIDAD: Conjunto de cualidades de una persona o cosa.// Importancia, calificación, superioridad, excelencia.// Condición social, civil, jurídica, etc. * COMPONENTE: Parte o elemento constituyente. CONTROL DE CALIDAD: Control activo en el que se observan tanto las fallas de la producción como las oportunidades de mejorar el producto. COSMÉTICO: Que embellece.// Sustancia o preparación con este objeto. CURATIVO: Que sirve para curar, sanar.// Sustancias y materias utilizadas en un tratamiento o método curativo. DEPÓSITOS DE DROGAS: Se consideran como tales “los establecimientos comerciales dedicados exclusivamente a la venta al por mayor, de drogas, 13 alimentos con indicaciones terapéuticas o que reemplacen regímenes alimenticios especiales, productos de tocador, sustancias químicas aplicadas en la industria, materiales de curación, jeringuillas y agujas. También podrán expender aparatos de física, o química que se relacionen con la ciencia y el arte de curar, y en general productos o artículos similares a los anteriores, a juicio de las autoridades de Salud Pública correspondientes. Artículo 54 del Decreto 1950 de 1960. DIAGNÓSTICO: Parte de la medicina que tiene por objeto identificar una enfermedad, fundándose en los síntomas de ésta. DROGA: Primera materia de los medicamentos oficinales o magistrales; medicamento simple. // Sustancia medicamentosa en general. DROGA: “toda sustancia famacológicamente activa, cualquiera que sea su origen y características, que se utilice para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de las enfermedades del hombre o de los animales.” Artículo 1°, Decreto 2092 de 1986. DROGUERÍA: Comercio en drogas.// Botica o farmacia, tienda en que se venden las drogas. 14 EFICACIA: Virtud, actividad, fuerza// Que produce realmente un efecto. ENFERMEDAD: Alteración o desviación del estado fisiológico en una o varias partes del cuerpo, de etiología en general conocida, que se manifiesta por síntomas y signos característicos y cuya evolución es mas o menos previsible. ENVASE: Recipiente en que se envasan los líquidos. // Envoltorio. EXCIPIENTE: Sustancia terapéuticamente inactiva que se emplea en la composición de medicamentos, para darles masa y facilitar su dosificación y administración. FARMACÉUTICO: Relativo a la farmacia.// Persona que profesa o ejerce la farmacia. FARMACIA: Ciencia que tiene por objeto reconocer, recoger y conservar los fármacos simples y preparar los medicamentos compuestos. 15 FARMACIAS – DROGUERÍAS: “establecimientos que se dediquen a la venta de drogas oficinales, de especialidades farmacéuticas, al despacho de fórmulas magistrales y al cuidado y venta de barbitúricos y estuperfacientes, con las limitaciones que la ley impone al respecto.”artículo 10 Ley 23 de 1962 FARMACOGNOSIA: Estudio de las sustancias medicamentosas en su estado natural. FARMACOPEA: Arte de preparar los medicamentos. // Libro oficial que cada Estado redacta periódicamente y que es norma legal para la preparación, dispensación, etc., de los medicamentos. FRAUDULENTO: De fraude. Engañoso. INDICACIÓN TERAPÉUTICA: La derivada de la ciencia y arte de curar o aliviar en el tratamiento de las enfermedades. INDICACIÓN: Conjunto de circunstancias del enfermo que sirven de guía para la aplicación de un tratamiento determinado. 16 LABORATORIOS FARMACÉUTICOS: Se consideran como tales, “los establecimientos industriales que se dedican parcial o totalmente a la fabricación, envase, análisis y control de drogas para empleo industrial y medicinal de medicamentos para uso humano y veterinario, de alimentos con indicaciones terapéuticas, de cosméticos y productos de tocador tales como cremas, afeltas, lociones, ‘ shampoos’ , tintes, fijadores para cabello, lápices labiales y para las cejas, coloretes, polvos, jabones de tocador y medicinales, desodorantes, dentífricos; de productos para usos odontológicos; de pesticidas, tales como insecticidas y rodenticidas, fungicidas; de alimentos o suplementos alimenticios para animales, materiales de curación y quirúrgicos, como algodón hidrófilo, gasas, hilos de sutura, esparadrapo, compresas, vendas enyesadas o nó, y otros productos similares a los indicados en este artículo”. Artículo 36 del Decreto 1950 de 1960 MATERIA FARMACÉUTICA: Compuesto de cuerpos orgánicos o inorgánicos que suministran los medicamentos y parte de la farmacología que estudia su origen, caracteres y constitución. MATERIA PRIMA: Materiales no elaborados producidos por el subsuelo o la agricultura y empleados por la industria para su conversión en artículos de consumo. 17 MEDICAMENTO: Agente o sustancia simple o compuestas que se administra al exterior o al interior con fines terapéuticos. MEDICAMENTO: “toda droga o mezcla de drogas, con o sin adición de sustancias auxiliares, preparada para ser presentada como forma farmacéutica que se utilice para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de las enfermedades del hombre o de los animales.”Decreto 2092 de 1986, artículo 2°. MEDICAMENTO OFICINAL: El que aparece inscrito en alguna de las farmacopéas francesa, norteamericana, británica, alemana o internacional. Decreto 2092 de 1986, artículo 3°. MEDICINA: Arte y ciencia de conocer y tratar las enfermedades, especialmente las internas. MEDICINAL: Que posee cualidades curativas. Relativo a la medicina. MINERAL: Sustancia homogénea inorgánica. 18 NATURAL: Ni artificial ni patológico; que forma parte de la naturaleza. NORMA TECNICA: Documento establecido por consenso y aprobado por un organismo reconocido, que suministra, para uso común y repetido, reglas, directrices y características para las actividades o sus resultados, encaminados al logro del grado óptimo de orden en un contexto dado. Las normas técnicas se deben basar en los resultados consolidados de la ciencia, la tecnología y la experiencia y sus objetivos deben ser los beneficios óptimos para la comunidad. Artículo 2°, literal b. del decreto 2269 de 1993. NUTRICIÓN: Propiedad esencial de los seres vivos que consiste en el doble proceso de asimilación y desasimilación; conjunto de cambios efectuados entre el organismo y el medio que le rodea. NUTRITIVO: Que nutre. PLACEBO. “Sustancia que, careciendo por sí misma de acción terapéutica, produce algún efecto curativo en el enfermo, si esta la recibe convencido de que esa sustancia posee realmente tal acción.” Diccionario de la lengua española. Vigésima Primera Edición. Editorial Espaza Calpe, S.A., Madrid, 1992. Tomo II, página 1616. 19 PLAGUICIDA: Pesticida. Dícese de las sustancias empleadas para controlar odestruir las plagas de animales o plantas. PREVENTIVO: Profiláctico. PRINCIPIO ACTIVO: Constituyente de un fármaco que le confiere las propiedades medicamentosas. PRINCIPIO: Elemento químico.// Sustancia de la que dependen las propiedades de una planta.// Base, origen, razón fundamental. PRODUCTO BIOQUÍMICO: Sustancia que resulta de una operación química biológica artificial o industrial. PRODUCTO: Cuerpo, parte, órganos, etc., originados por la actividad de otro cuerpo, órganos o tejido. PROPIEDAD: Atributo.// Dominio de una cosa, separado del usufructo. 20 QUÍMICA: Ciencia que trata de los elementos, de los compuestos que resultan de su combinación y de las fuerzas y leyes que rigen esta última. RECURSO: Acción de recurrir a una persona o cosa.// Memorial, solicitud.// Medio de subsistencia.// Elemento que sustituye la potencia de una cosa. RÉGIMEN: Regulación metódica de la dieta, medicación y de las disposiciones sanitarias con objeto de conservar o restablecer la salud. REFRIGERACIÓN: Disminución artificial de la temperatura REGISTRO: Asiento que queda de una cosa registrada y cédula que lo acredita. SANITARIO: Relativo a la sanidad.// Relativo a la salud o que la conserva o promueve.// Individuo de un cuerpo de sanidad. SEGURIDAD: Confianza; tranquilidad de una persona procedente de la idea de que no hay ningún peligro que temer.// Evidencia, garantía. 21 SEGURIDAD SOCIAL: Conjunto de leyes, y de los organismos que las palican, que tienen por objeto proteger contra determinados riesgos sociales (accidentes, enfermedad, vejez, etc.) SINTÉTICO: Dícese de lo que pertenece a la síntesis.// Dícese por procedimientos industriales o pro síntesis química. SUSTANCIA: Materia de la que un cuerpo u órgano está formado. TAXONOMÍA: Ciencia de las clasificaciones utilizadas en microbiología, botánica y zoología, que permite agrupar a los seres vivientes de acuerdo con sus características. TOXICIDAD: Calidad de tóxico.// Grado de virulencia de una toxina o veneno microbianos.// Dosis mínima mortal o cantidad menor d una sustancia, capaz de matar un animal de 1 Kg de peso. TÓXICO: Veneno; cualquier sustancia que incorporada al organismo es capaz de producir graves alteraciones orgánicas o funcionales, e incluso la muerte. 22 TRATAMIENTO: Conjunto de medios de toda clase, higiénicos, farmacológicos y quirúrgicos, que se ponen en práctica para la curación o alivio de las enfermedades.// Terapia o terapéutica; método o régimen especial de cura. VEGETAL: Perteneciente a los vegetales: árbol, planta. 23 24 25 INTRODUCCIÓN La regulación sanitaria de las preparaciones farmacéuticas elaboradas con base en productos naturales es un tema sin duda polémico por sus implicaciones estrictamente sanitarias, políticas y económicas. A lo largo de la historia el hombre ha procurado preservar la salud 1 y curar la enfermedad, a través de un sinnúmero de medios, entre los que se cuenta la conocida “medicina natural”, también conocida como “medicina tradicional”. Sin embargo, en esta búsqueda ha cometido enormes errores, e incluso ha atentado contra la propia salud. La preocupación por las implicaciones principalmente sanitarias del consumo de preparaciones farmacéuticas elaboradas con base en productos naturales, ha producido en quienes realizan el presente Trabajo de Grado el deseo de lograr un acercamiento de una manera informal al tema. “Para la Organización Mundial de la Salud es un “estado de completo bienestar físico, mental y social, y no solamente la ausencia de molestias o enfermedades.” LOPEZ PIÑERO, José María. La medicina en la historia. En: Colección Salvat Temas Claves. Tomo 17. Estella (Marcella): Salvat Editores S.A, 1985. p. 4, 5, 8, 9, 16 – 21, 56 y 57. 1 Hace algo mas de dos años fue encontrado un eco al interés aquí manifestado por la materia, en el doctor Camilo Uribe Granja, quien estimuló de manera decidida la realización de una investigación seria que significara un aporte para quienes están llamados a regularla, así como para quienes de alguna u otra forma, se interesan en ella. El convencimiento de que “El Derecho es mucho menos la obra del legislador que el producto constante y espontáneo de los hechos”,2 ha estimulado el estudio de la evolución histórica de la medicina natural; con la invaluable colaboración del doctor Uribe y de la Comisión Revisora de Medicamentos de la República de Colombia, así mismo se estudió su evolución de normativa en Colombia, así como la normatividad vigente; se realizaron también investigaciones de campo, y estudios de la experiencia de otros países en lo relacionado con la producción, comercialización y consumo de las preparaciones farmacéuticas elaboradas con base en productos naturales. La principal dificultad que se afrontó afrontar al realizar esta investigación fue la limitada cantidad de fuentes bibliográficas, así como la escasa imparcialidad de quienes de alguna u otra forma lideran la producción y comercialización de las 2 OSORIO, Angel. 1989. p. 27. El alma de la toga. Buenos Aires: Ediciones Jurídicas Europa - América, Novena Edición, 26 preparaciones farmacéuticas objeto de nuestro estudio, como también de quienes lideran la producción y comercialización de medicamentos de síntesis química. No obstante estas dificultades hay que reiterar que se espera con este trabajo cumplir un objetivo principal: hacer un pequeño aporte a este país al que tanto se le debe. 27 28 1. USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS A TRAVÉS DE LA HISTORIA Desde hace milenios el hombre ha utilizado productos naturales en el tratamiento y cura de las enfermedades. “La mayoría de las veces, las propiedades medicinales de aquellos se descubrieron casualmente y pasaron luego a formar parte de la tradición médica de los pueblos. Así, no solo los miembros de una comunidad sabían que tal o cual infusión era beneficiosa, sino que además algunos de ellos cumplían la función del médico actual, recopilando los datos de sus propiedades y la forma de administración.”3 “Hasta comienzos del siglo XIX, los medicamentos fueron sustancias naturales, principalmente de origen vegetal y, en menor medida, animal y mineral.”4 En el siglo XIX se descubren y aíslan los principios químicos activos de los medicamentos naturales. 3 Guía Médica. Tomo 10. Barcelona: Salvat Editores S.A, 1983. p. 41 –49. 1.1 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LOS PUEBLOS PRIMITIVOS Los pueblos prehistóricos tuvieron un conocimiento considerable de las plantas medicinales y desarrollaron sistemas terapéuticos que combinaban elementos empíricos, racionales, religiosos y mágicos. Hace aproximadamente ochenta mil años, el interés de los pueblos del periodo paleolítico por la flora que los rodeaba, les indujo a grabar en huesos y cornamentas de ciervo una amplia variedad de plantas. En el periodo neolítico, habitantes de los lagos suizos cultivaron doscientos tipos de plantas, muchos de ellos dotados de cualidades medicinales. De igual forma, los artistas magdalenienses que hace unos catorce mil años pintaron las paredes de la cueva de Les Trois Fréres en Ariége, al sudoeste de Francia, incluyeron entre sus dibujos la imagen de un curandero. La enfermedad es tan antigua como la humanidad, y los pueblos prehistóricos no escaparon en absoluto de ella, al dolor y a la muerte. 4 LOPEZ PIÑERO, José María. La medicina en la historia. En: Colección Salvat Temas Claves. Tomo 17. Estella (Marcella): Salvat Editores S.A, 1985. p. 56. 29 El enfoque de estos pueblos frente a la enfermedad y su tratamiento reflejaba la concepción que tenían del mundo, basada en el animismo. Creían que todos los seres poseían un espíritu, que las fuerzas espirituales explicaban todos los fenómenos y que cada suceso era una manifestación de dichos poderes. Puesto que tanto la enfermedad como su tratamiento involucraban este mundo de espíritus, era imprescindible que los especialistas los comprendieran y pudieran controlarlos. Esta necesidad condujo a las sociedades primitivas a exaltar la condición del sacerdote, el brujo y el curandero. A menudo las mencionadas funciones coincidían en una misma persona, pues no siempre resultaba fácil distinguir las fuerzas naturales de las sobrenaturales. La mayoría de las sociedades primitivas creía que la enfermedad era el resultado de la invasión del cuerpo por espíritus malignos, la introducción de un objeto en el interior del mismo o el abandono de los espíritus benéficos. El curandero, tras determinar cual de los poderes malignos era el que estaba actuando, averiguaba el porqué de la invasión del cuerpo o de la pérdida del alma. Las transgresiones de los tabúes debían ser investigadas. Una vez identificada la fuerza espiritual responsable, se podía desterrar el espíritu maligno y eliminar los objetos que se habían introducido misteriosamente en el organismo. 30 El primer paso en el tratamiento era el “rito oral”: el chamán, vestido con un atuendo especial, profería cánticos y ruidos mientras danzaba y se contorsionaba delante del paciente. Después procedía el “rito manual”, que consistía en actos de prestidigitación, pronunciamiento de hechizos, aspiración e ingestión de sustancias para expulsar al espíritu maligno del cuerpo. Predominaba la magia, la manipulación esotérica de la naturaleza por parte de los iniciados en sus misterios, de forma que en éste contexto resulta más apropiado hablar de “materia mágica” que de “materia medica”. 1.2 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LAS CIVILIZACIONES ANTIGUAS Las civilizaciones antiguas se desarrollaron en los valles de los principales ríos de Africa y Asia: en el Nilo y el Tigris-Eufrates hacia el año 4.000 a.C., en el Indo hacia el 3250 a.C., y en el río Amarillo hacia el 1500 a.C. Los pueblos se volvieron más organizados y, en gran medida, más racionales. Sin embargo, las nociones animistas, religiosas y mágicas sobre la enfermedad y su tratamiento no desaparecieron con la invención de la escritura, ni con el progreso del conocimiento y la seguridad. 31 1.2.1 Uso de los productos naturales como medicamentos en la civilización mesopotámica. En la Mesopotamia antigua las artes de la curación eran practicadas por el sacerdote profeta, el exorcista y el sacerdote curandero. Todos eran sacerdotes y todos curanderos, pues para esta civilización la enfermedad era una consecuencia del pecado o la transgresión. Por lo tanto, la curación implicaba una catarsis y una purificación religioso - espiritual. En esta civilización se encontraron miles de tablillas de arcilla entre las cuales figura el primer texto médico conocido, cuya acuñación se remota al año 2100 a.C.5 Este texto enumera treinta elementos distintos de origen animal, mineral y vegetal, muchos de ellos no identificables, y hace referencia a numerosas fórmulas y procesos, como extractos acuosos y oleosos, infusiones de vino, pulverizaciones, ebulliciones, filtraciones y unciones. En total se descubrieron en los escritos doscientos cincuenta remedios de origen vegetal, ciento veinte de origen mineral, y ciento ochenta de otras procedencias. Al parecer las tres cuartas partes de los remedios vegetales combinados por los botánicos de una forma inteligente y metódica, se presentaban en forma de tabletas. Como vehículos se empleaban los aceites, alcoholes, vinos, grasas, miel, leche y cera (en orden de frecuencia). 5 Este texto se encuentra actualmente en el Museo de la Universidad de Pennsylvania, en Philadelphia, Estados Unidos de América. 32 33 1.2.2 Uso de los productos naturales como medicamentos en la civilización egipcia. Nuestro conocimiento de la medicina egipcia deriva en gran parte de once papiros encontrados sobre la materia. El más relevante es el papiro de Ebers, una colección de recetas escrita hacia el 1500 a.C. que contiene ochocientas once prescripciones y menciona unos setecientos fármacos. Dichos remedios comprendían ingredientes de los reinos vegetal, animal y mineral. Los antiguos egipcios utilizaron la coloquíntida, el sehn y el aceite de castor como laxantes. Del reino animal derivaba un gran surtido de órganos y excrementos, entre los que destacan el cerebro de cerdo, la vulva de perra, y las excreciones de mosca y cocodrilo. El alumbre, el cobre y la sal son los únicos minerales que se mencionan de forma repetida en los papiros. La preparación y administración de éstos remedios estaban firmemente enraizadas en las prácticas religiosas y mágicas de la época. El efecto mágico de un remedio no siempre coincidía con su efecto terapeútico, y llegó un momento en el antiguo Egipto en el que la medicina y la magia se separaron. Las fórmulas mágicas fueron desapareciendo progresivamente del tratamiento curativo y con el tiempo los fármacos se convirtieron en la modalidad más popular de tratamiento. 1.2.3 Uso de los productos naturales como medicamentos en el pueblo hebreo. Al igual que los egipcios y los mesopotámicos, los hebreos creían en la intervención de la fuerza divina en la salud y en la enfermedad, pero a diferencia de éstos partían de una concepción monoteísta. Para los hebreos Dios era el único capaz de curar, y a él correspondía el don de curación de los médicos. En la Biblia y en el Talmud se hace referencia al uso que hicieron los hebreos de ciertos remedios vegetales, y especialmente de uno mineral, la sal. Sin embargo, aunque los hebreos en un momento repudiaron la magia y formularon un planteamiento racional de la medicina, durante el periodo apócrifo adoptaron las prácticas babilónicas de utilizar hechizos, amuletos y encantamientos para prevenir y curar las enfermedades. 1.2.4 Uso de los productos naturales como medicamentos en la civilización china. “En todas las partes del mundo, y especialmente en Oriente, se han probado todo tipo de remedios medicamentosos a base de plantas, minerales e incluso de animales, al igual que todo tipo de dietas, con fines terapéuticos.”6 6 http://ocea.es/forem/mto.htm 34 35 Entre los múltiples profesionales que participaban en las artes de la curación sobresalía el fang shih, denominación que se ha traducido por “persona que posee recetas mágicas”. Los primeros textos chinos conocidos sobre remedios datan de los últimos cinco siglos a.C., como el Sehn Nong Ben Zing (El Libro de las hierbas de Sehn Nong), con más de 2000 años de antigüedad. Estas compilaciones siguieron multiplicándose y culminaron en el monumental Pents’ao Kang-mu, del gran naturalista chino Li Shih-chen. Publicada en 1596, tres años después de la muerte del autor. La obra constaba de cincuenta y dos volúmenes y era el resultado de treinta años de trabajo y de viajes por las provincias del país de donde procedían los remedios. El compendio describía más de mil plantas y casi cuatrocientas sustancias animales, además de examinar cerca de once mil cien prescripciones. Aunque predominaban los productos vegetales, los órganos y excrementos de animales eran más numerosos que en los repertorios europeos. Además los chinos hicieron un uso más exhaustivo de los minerales que cualquier otro pueblo de la antigüedad. Los Chinos creían que debía existir un remedio para cada enfermedad y que prácticamente todo podía tener un uso médico. El remedio adecuado daría lugar a la recuperación del paciente, como consecuencia de su capacidad para neutralizar las influencias malignas del entorno. En el trasfondo de estas nociones se encontraba la preocupación filosófica china por las fuerzas vitales y sus equilibrios y desequilibrios. Muchos fármacos de la China actual mantienen notables semejanzas con sus equivalentes de hace siglos. El contenido de estos establecimientos incluye tanto la materia médica de la antigüedad, mayoritariamente vegetal, como una gran cantidad de productos de origen animal. La medicina china tradicional sigue utilizando la materia médica clásica, que ha ejercido una influencia nada despreciable en la civilización moderna. El gingseng, la efedra, la corteza de casia, el ruibarbo y el alcanfor, forman parte de la deuda que tiene contraída Occidente con la antigua China. 1.2.5 Uso de los productos naturales como medicamentos en la civilización hindú. Aun cuando es poco lo que puede afirmarse sobre la medicina hindú en sus primeros tiempos, pues no se ha encontrado ningún documento histórico, puede conjeturarse que en ella convergían planteamientos religiosos, mágicos y empíricos. 36 37 Solo hasta el año 1.500 a. C., en la cultura védica se conocieron los escritos de Characa en donde se mencionan más de dos mil productos distintos de origen vegetal, entre ellos el sándalo, la canela, el jengibre, la pimienta, el acónito y el regaliz, fármacos y especias que habrían de convertirse en la base del comercio con los romanos y que posteriormente desempeñarían un papel importante en la historia. Con el paso de los siglos, el desarrollo del brahamanismo y del budismo influyó en la medicina de Characa y Susruta. Los escritos religiosos de la época no sólo trataban de la meditación y la magia, sino que llegaban a ahondar en la experimentación alquímica. Hacia el año 1400 a.C., apareció a la luz la compilación conocida como Rasaratnasamucchaya. En ella se daba especial importancia al mercurio, y según sus estimaciones, se conocían más de cinco mil preparados con éste y otros metales. La farmacia tradicional hindú habría de verse sometida pronto a las invasiones extranjeras. Conviene destacar que las plantas medicinales hindúes, con su larga tradición védica, nunca sucumbió por entero a la invasión occidental. En el interior del país, en los bazares de las ciudades, los médicos “tradicionales” siguen dominando los antiguos remedios. 38 1.2.6 Uso de los productos naturales como medicamentos en la civilización griega. La medicina griega se preocupó por encontrar la causa natural de la enfermedad y su tratamiento, a pesar de que tenía connotaciones tanto espirituales como estrictamente médicas. El interés en la causalidad natural de la enfermedad era un reflejo de la preocupación de los filósofos - científicos griegos por comprender el mundo de la naturaleza. Hipócrates, nacido hacia el año 460 a.C., propugnó por un enfoque racional y empírico de la medicina, en contraposición con las creencias mágicas y religiosas vigentes. La buena salud, al igual que el bienestar social, dependía para los griegos de la armonía, un principio inherente a todo el pensamiento griego. El mantenimiento de la salud exigía la armonía entre los humores; si uno u otro se encontraba en exceso o en defecto (flema, sangre, bilis amarilla y bilis negra), aparecía la enfermedad. El médico griego utilizaba una gama bastante completa de técnicas terapéuticas y quirúrgicas, entre ellas la fisioterapia y el ejercicio. Eran habituales las sangrías, la escarificación, la aplicación de ventosas, la abrasión y el empleo de sanguijuelas. Más significativos eran los regímenes dietéticos y las drogas medicinales. Aunque en el corpus hipocrático no existe una compilación de la materia médica, los escritos de los médicos de ésta escuela citaban unos doscientos fármacos de origen vegetal, fármacos animales pertenecientes como mínimo a diez filum y una docena de fármacos minerales. Para encontrar una sistematización de la materia médica griega que, en gran medida era de índole botánica, hay que recurrir a otras fuentes, en especial a los trabajos de Diocles, Teofrasto y Dioscórides. Diocles de Caristo fue el más importante de los rhizotomoi (recolectores profesionales de raíces de plantas). Entre los temas de sus escritos, se destaca la botánica médica. La principal guía de plantas medicinales de la antigüedad corresponde a Pedanio Discórides, cuyo trabajo alcanzó el apogeo entre los años 50 a.C. y 70 d.C.. Fue médico de los ejércitos de Nerón, viajó conociendo las hierbas medicinales de extensos territorios y los secretos médicos de dilatados países. Escribió su tratado “Materia Médica” en seis libros que comprenden remedios de los tres reinos de la 39 naturaleza, tanto animales como minerales, y, principalmente vegetales. Durante el Medievo, su obra fue una de las más leídas, quizá aventajada únicamente por la Biblia. 1.3 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LA EDAD MEDIA La Edad Media en Europa Occidental supuso la continuidad de la materia médica clásica, retocada y ampliada por los árabes. A ella se superpusieron los mitos, la magia y la fe. La preparación de aceites, jarabes y ungüentos a base de plantas medicinales constituyó durante toda la Edad Media la piedra angular de la farmacopéa universal. 1.4 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN EL RENACIMIENTO En el siglo XIV aparecen una serie de obras sobre plantas medicinales cuyos autores son miembros de la Escuela de Salerno (centro médico cumbre de la cultura médica mundial); como Perpósito, Platearius y Silvaticus. 40 41 En 1498 d.C. se imprime la primera farmacopéa, y la Botánica que hasta aquel momento había sido patrimonio exclusivo de médicos, boticarios y yerbateros, empieza a estudiarse de forma racional, con la ayuda de los grabados en madera que se realizan de las plantas. Por otro lado, el descubrimiento de América permite que a Europa llegue gran número de plantas y semillas oriundas del Nuevo Mundo. Las expediciones botánicas europeas se incrementan en busca de la flora increíble de la que dan cuenta los escritos de los estudiosos Diego Alvarez de Chanca y Rodrigo Fernández, profesores de ciencias que acompañaron a Colón en su segundo viaje. El nuevo espíritu de la época creó una revolución en la medicina, y su principal impulsor fue Paracelso, quien llegó a cuestionar incluso los principios filosóficos más arraigados, como la teoría de los cuatro elementos aristotélicos. En su lugar, aseguró que el cuerpo humano estaba conformado por cuatro principios inmateriales: combustibilidad, licuabilidad, volatilidad y estabilidad. Esta concepción rechazaba la patología humoral de Galeno, sustituida gradualmente por la teoría de los Paracelsianos, que sostenía una “filosofía química” según la cual la enfermedad era una anomalía localizada, no un desequilibrio de humores. 42 La enfermedad era considerada una manifestación natural química, y por tanto se trataba químicamente. Como resultado de todo esto, las tinturas, extractos y esencias, desempeñaron un papel importante en el arsenal farmacoterapéutico de los paracelsianos, quienes utilizaron un gran número de compuestos metálicos, que presentaban un nuevo enfoque en la terapéutica y a los conferían una justificación esencialmente distinta. Este nuevo planteamiento implicaba no sólo la confianza en las sustancias químicas, sino también en la existencia de un remedio específico para cada enfermedad, bajo el supuesto de que lo similar curaba lo similar (en oposición al concepto galénico de cura por contrarios o alopatía). 1.5 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN LA EDAD MODERNA Durante este periodo, el arte de la alquimia asumió un papel capital en la preparación de medicinas, relegando a un segundo lugar las curaciones naturales. Los avances en el campo de la metalurgia aseguraron los suministros de mercurio, antimonio, plomo, arsénico, hierro, oro, bismuto y zinc; y con todos estos surgieron muchas publicaciones sobre la dispensación de los remedios “modernos” refutando los trabajos de la medicina natural de Dioscórides. Después de muchas confrontaciones entre ambas teorías terapéuticas, hacia el año 1618 d.C., se realizó en Inglaterra una compilación que aceptaba los remedios más recientes como “servidores de la medicina dogmática”, pero basándose en sólo algunos remedios de origen natural. Con el tiempo la industria farmacéutica se ha separado y unido alternativamente con la medicina natural, desarrollándose cada una de ellas, a menudo, como reacción de la una contra la otra. En el siglo XIX surgió el Thomsonianismo, una práctica botánica de la medicina, dirigida por Samuel Thomson, norteamericano, que creó un “sistema con reminiscencias de la patología humoral de Galeno”. Ofrecía remedios vegetales que pretendían ser más suaves y seguros que los poderosos y rudos procedimientos que propugnaban los practicantes de la medicina tradicional. El material médico de los thomsonianos estaba compuesto por unos setenta remedios de origen vegetal eméticos, tés de hierbas, enemas medicinales y baños de vapor. La enorme popularidad del thomsonianismo en los Estados Unidos de América, queda atestiguada por la gran cantidad de personas que compraron sus medicinas, y por las sociedades y convenciones que se realizaron entre 1832 y 1838 d.C.. 43 A mediados del siglo XIX el movimiento se hallaba en declive y sus seguidores se dividieron entre los eclécticos7 y los practicantes reformados de la medicina que sí tenían un alto concepto del papel de los farmacéuticos. La medicina tradicional absorbió lo que consideraba valioso de los remedios thomsonianos y eclécticos. Muchas de las plantas empleadas por los eclécticos8 pasaron a utilizarse de forma general en medicina. La preocupación de los poderes públicos a lo largo del siglo XIX se centró en dos grandes campos: de una parte, el sanitario, dominado por las graves epidemias de enfermedades transmisibles, y de otra, el nacimiento de una primitiva Seguridad Social. La necesidad de una salud colectiva se desarrolló con un planteamiento sanitario, mientras la Seguridad Social atendía preferentemente a la salud individual, que rápidamente se hizo extensiva al núcleo familiar.9 1.6 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN AMÉRICA PRECOLOMBINA Algunas prácticas farmacológicas ejercidas durante la época precolombina fueron el ayuno, la dieta con abstención de alimentos nocivos, y la práctica de baños de vapor. El uso de medicamentos vegetales constituyó una práctica extendida para el tratamiento de las enfermedades leves, pero no siempre se administraban con el propósito debido y muchas veces se desconocía su dosificación y posología. Del enorme caudal de plantas medicinales precolombinas son contadas las que poseen 7 Aceptaban todo aquello que resultara útil, cualquiera que fuera su origen, y rechazaban un gran número de fármacos minerales. 8 Berberis aquifolium y Rhamnus purshiana. 44 una actividad farmacológica y no hay que olvidar por ello que fueron usadas por un pretendido efecto mágico y no por su valor terapéutico. En conclusión, los logros de la medicina precolombina se debieron en gran medida a la integración de sus recursos materiales y espirituales, dentro de la concepción mágico religiosa de la enfermedad. 1.7 USO DE LOS PRODUCTOS NATURALES COMO MEDICAMENTOS EN COLOMBIA 1.7.1 Uso de los productos naturales como medicamentos por los primeros pobladores. Los primeros pobladores del territorio colombiano fabricaron venenos con especies vegetales y los utilizaron como medio para aliviar el sufrimiento físico causado por la fatiga o por la enfermedad.10 Así mismo, fabricaron fumatorios y masticatorios con los que escapaban de la realidad, aliviando, según ellos, de esta forma, las dolencias psíquicas. 9 MESTRE ROSSI, Carlos. El Sistema Sanitario y la Salud. En: Colección Salvat Temas Claves. Tomo 87. Estella (Marcella): Salvat Editores S.A, 1985. p. 7. 10 Estos mismos venenos fueron también utilizados para cazar animales, y en la guerra para defenderse de los enemigos. 45 Era práctica común aplicar enemas y lavados, succionar la piel en la región afectada, aplicar baños en forma ritual o como terapia, aplicar emplastos, masajes y sahumerios con plantas aromáticas o narcóticas. Entre las plantas más empleadas podemos citar la coca o hayo, el yopo, el tabaco, el borrachero y el cacao, que por contener alcaloides o por presentar propiedades diuréticas, purgantes, analgésicas, depurativas, antiespasmódicas y abortivas, eran empleadas para tratar las diferentes enfermedades. Muchas de estas especies se incorporaron a la farmacopea moderna, en tanto que gran parte de los conocimientos indígenas se perdieron definitivamente al producirse la aculturación. 1.7.2 Los estudios de José Celestino Mutis. El Siglo XVIII. Sólo hasta el siglo XVIII, con la llegada de José Celestino Mutis, se produjo un vuelco en la enseñanza y en la práctica de la medicina. En su diario de estudios, Mutis consignó numerosas observaciones sobre las creencias populares y los usos dados a las plantas, descartó las prácticas que consideraba supersticiosas, e incorporó en sus recetas nuevas plantas como la quina, la zarzaparrilla y la ipecacuana (cuyo uso experimentó con éxito). 46 Mutis prefería recetar el menor número de medicamentos de síntesis química, empleando en su lugar plantas, que además de sus propiedades medicinales eran de fácil adquisición y de bajo costo. En sus estudios se vio influenciado por la farmacopea europea, y en lo posible, procuró encontrar una “razón científica”al uso popular, tradicional o indígena de las plantas.11 1.7.3 Estudios realizados durante el Siglo XIX. A finales del siglo XIX, con el nacimiento de la química moderna y de la farmacognosia, se realizaron los primeros estudios fitoquímicos principalmente de las plantas traídas del Viejo Mundo. De la misma época se conocen los trabajos adelantados por naturalistas ingleses sobre la flora de la Amazonía, importantes para la taxonomía y la farmacognosia. 1.7.4 La medicina durante el Siglo XX. Con la influencia de las teorías científicas europeas de principios del siglo XX, la farmacopéa colombiana se inclinó a la preparación de fórmulas magistrales y al empleo de sales y otros productos minerales, restándole importancia a las plantas medicinales que antes habían sido tenidas como remedios eficaces. Poco a poco la medicina tomó el rumbo de la bioquímica, la farmacología, y los medicamentos de síntesis, abandonando definitivamente las plantas. Fueron excepciones a esta tendencia los trabajos de botánica medicinal del doctor Emilio Robledo y del doctor Hernando García Barriga, quien dictaba clases de botánica medica en la Universidad Javeriana. Desde hace 11 Nueva Historia de Colombia. Tomo IV. Bogotá: Editorial Planeta, 1989. p. 159. Las disciplinas que hoy constituyen lo que llamamos “ciencia” fueron introducidas en nuestro país por José Celestino Mutis y por sus 47 más de 40 años se abandonó por completo en la mayor parte de las facultades de “medicina moderna”el estudio de la flora medicinal. Sin embargo, también a comienzos del siglo XX y de manera paralela, comienzó el auge de la homeopatía como ciencia médica eficaz en Europa. Muchos de los científicos colombianos que viajaban al Viejo Mundo se entusiasmaron con esta disciplina terapéutica y utilizaron plantas para la preparación de diluciones y gotas homeopáticas o con reacciones análogas en el cuerpo. Fueron ellos los que mantuvieron vivo el estudio de las plantas medicinales.12 El conocimiento de esta ciencia avanzó significativamente con los trabajos del doctor Richard Evans Schultes, considerado el mayor conocedor de la flora amazónica, atraído principalmente por el estudio de las plantas psicotrópicas, las curares, las alexitéricas y otras plantas medicinales de las etnias selváticas. El doctor García Barriga elaboró un compendio de la flora medicinal en Colombia. 1.7.4.1 El curanderismo como medicina tradicional. Durante mucho tiempo ha existido una red de curanderismo en nuestro país, cuyas raíces han sido identificadas principalmente entre los indígenas kamsaes, inganos y sionas, habitantes del alto y del bajo Putumayo y del alto Caquetá, reconocidos como discípulos y compañeros en la famoso expedición botánica. 48 verdaderos expertos en medicina y botánica, quienes a su vez tienen estrechas relaciones con los sabios médicos de los grupos que habitan en la basta Amazonía. Así mismo, los indígenas de la cordillera, seguramente desde antes de la conquista, han mantenido estrechos lazos con sus vecinos en Ecuador, Nariño, Cauca, Huila y Tolima. Esta extensa red de curanderismo indígena no es cerrada y por el contrario se abre al resto de la población colombiana, incluso con entrenamiento a mestizos. Más aún, el conocimiento tradicional indígena ha quedado plasmado en las poblaciones que a través de la historia han sufrido el proceso de mestizaje racial o cultural. Esta es la única explicación valedera para que, por ejemplo, campesinos de Nariño, Huila, Cundinamarca o Santander tengan conceptos de medicina popular muy similares a los de los indígenas inganos del Valle de Sibundoy, contradiciendo la creencia de que ese bagaje provino de España, como se afirmaba de los conceptos de frío y calor o del uso de purgantes, fundamentos de la terapéutica indígena. 1.7.4.2 Resurgimiento de las plantas medicinales. La organización Mundial de la Salud -OMS- propuso desde 1977, como objetivo del año 2000, el programa “salud para todos”13, y consideró que para tal empeño era preciso incorporar en las estrategias formales de atención primaria en salud las medicinas tradicionales y los 12 Entre estos científicos se destacan Mauro Hernández y el Hermano Daniel González, quienes realizaron análisis fitoquímicos de alguna utilidad terapéutica. 13 También llamado Programa de Medicina Tradicional de la Organización Mundial de la Salud. 49 elementos terapéuticos de reconocida utilidad, como farmacología, fitoquímica, antropología y clínica, tal como se ha venido haciendo en diversos países del mundo.14 Por otra parte, el surgimiento de una conciencia ecológica, especialmente en los países desarrollados, obligó a dirigir las miradas hacia las zonas tropicales caracterizadas por su gran diversidad en flora y fauna. Estos países, movidos por la angustia de una inminente deforestación biológica, étnica y cultural, están promoviendo el estudio de la etnobotánica con el propósito de encontrar plantas de utilidad para el hombre, incluyendo el aspecto terapéutico. En el panorama nacional aparecen otros incentivos para la investigación de nuestra flora medicinal, tales como la búsqueda de materia prima para la elaboración de esencias y medicamentos. Laboratorios como Naturcol y Labfarve, han desarrollado programas para el fomento de la industria nacional de la flora medicinal, mediante la elaboración de extractos, y el procesamiento de plantas medicinales que compitan con los medicamentos de síntesis química. A pesar de éste resurgir, los trabajos que se adelantan evidencian algunos problemas metodológicos condicionados por diferentes factores como la ausencia http://www.who.int/inf-if/en/fact/34.html 50 de marcos teóricos consistentes basados en revisiones bibliográficas nacionales o extranjeras, la dispersión de los trabajos, el aislamiento de los científicos debido a la falta de una red de información moderna y eficiente; en fin, la falta de un marco de referencia que defina en forma consistente lo que significan las plantas medicinales y su utilización. 14 Consultar Capítulo 6: “La experiencia de otros países” de este trabajo. 51 52 2. EVOLUCIÓN NORMATIVA El Estado colombiano, como tantos otros, ha pretendido integrar el sistema sanitario 15 bajo un esquema jurídico operativo que le permita ofrecer a los ciudadanos la posibilidad de ejercer el derecho al disfrute del máximo nivel de salud posible.16 Como reflejo de esto, la regulación sanitaria se ha caracterizado por sus repetidas modificaciones. En un primer momento las normas jurídicas no distinguían entre las preparaciones farmacéuticas de síntesis química y aquellas elaboradas con base en productos naturales. Mas adelante, la fuerza normativa de los hechos generó un cambio, como resultado del cual se diseñó un régimen jurídico especial para las preparaciones farmacéuticas de síntesis química y otro para las preparaciones farmacéuticas elaboradas con base en productos naturales. Aun cuando en la actualidad el régimen sanitario de unas y otras es, en su mayor parte, unificado, algunos sectores están solicitando regresar a un sistema absolutamente dual, que 15 “Integrado por el personal de salud disponible, los procedimientos de formación de este tipo de personal, las instalaciones sanitarias, las asociaciones profesionales, los recursos económicos que por cualquier motivo u origen se pongan a disposición de la salud”. MESTRE ROSSI, Carlos. El Sistema Sanitario y la Salud. En: Colección Salvat Temas Claves. Tomo 87. Estella (Marcella): Salvat Editores S.A, 1985. p. 23. 16 LOPEZ PIÑERO, José María. La medicina en la historia. En: Colección Salvat Temas Claves. Tomo 17. Estella (Marcella): Salvat Editores S.A, 1985. p. 4, 5, 8, 9, 16 – 21, 56 y 57. considere las diferencias prácticas entre unas y otras preparaciones farmacéuticas y que en consecuencia las regule de manera independiente. Con el fin de tener un conocimiento integral del tema objeto de este trabajo, las autoras han estudiado las normas colombianas, expedidas desde la década de 1960, que de alguna u otra manera se relacionan con el mismo. 2.1 DÉCADA DE 1960. 2.1.1 Ley 23 de 1962. En 1962 se expide la Ley 23,17 que regula el ejercicio de la profesión de químico farmacéutico. En ella se establecen los requisitos que deben cumplirse para ejercer dicha profesión,18 se asigna competencia al Ministerio de Salud Pública para certificar sobre el cumplimiento de éstos y se introduce el concepto de función social. En efecto, el artículo 2 de esta ley, señala que “El ejercicio de la química farmacéutica o de la farmacia implica una función social de cuyo cabal desempeño son responsables los profesionales que la ejercen.” (subrayas fuera del texto) 17 18 La Ley 23 de 1962 fue reglamentada en 1964 por el Decreto 1950. El principal requisito es la obtención de un título universitario, expedido por una facultad legalmente autorizada. Sin embargo, en el parágrafo primero de su artículo séptimo, la Ley 23 de 1962, permite que ejerzan esta profesión las personas que tengan experiencia en la materia y obtengan una licencia especial de la Junta de Títulos Farmacéuticos, “En las ciudades o poblaciones donde no haya químico farmacéutico o farmacéuticos con título universitario en número suficiente”. 53 En su artículo 9, la Ley 23 de 1962, ordena que: “Los laboratorios destinados a la fabricación de productos farmacéuticos para uso humano y veterinario, alimentos con envases especiales o que reemplacen regímenes alimenticios usuales, cosméticos, y en general, preparados que puedan afectar la salud, deben estar dirigidos por un químico farmacéutico o farmacéutico con título universitario legalmente registrado e inscrito.”(subrayas fuera del texto) Así mismo, introduce por primera vez el concepto de “farmacia - droguería” que mas tarde es utilizado en las normas que de manera específica regulan la materia sanitaria. En su artículo 10 establece: “Para los efectos de la presente ley se denominan con el nombre de Farmacias - Droguerías aquellos establecimientos que se dediquen a la venta de drogas oficinales, de especialidades farmacéuticas, al despacho de fórmulas magistrales y al cuidado y venta de barbitúricos y estupefacientes, con las limitaciones que la ley impone al respecto.” En su parágrafo agrega: “Toda Farmacia - Droguería para su normal funcionamiento debe estar dirigida por un químico farmacéutico o un farmacéutico titulado o licenciado, en legal ejercicio de su profesión.” Define como depósitos de drogas, los establecimientos destinados exclusivamente a la venta de drogas al por mayor; les permite tener una sección de reenvase y les prohibe la elaboración de productos farmacéuticos. Así mismo, ordena a aquellos 54 depósitos de drogas que cuenten con una sección de reenvase, estar asistidos por un químico farmacéutico.19 Con el fin de proteger la salud pública, la Ley 23 de 1962, prevé la posibilidad de que el Ministerio de Salud (a través de la entonces Subdivisión de Drogas, Alimentos y Cosméticos) revise de oficio o a petición de cualquier persona, las licencias concedidas para la fabricación y venta de productos farmacéuticos, y le otorga expresas facultades para suspenderlas o cancelarlas, e incluso ordenar la congelación de la venta de dichos productos, de considerar que estos ponen en peligro la salud pública.20 Así mismo otorga facultades al Consejo Nacional de Profesiones Médicas y Auxiliares del Ministerio de Salud Pública, para sancionar con la suspensión temporal o cancelación definitiva de la licencia para el ejercicio de la profesión de químico farmacéutico “a quienes encuentre responsables, después de una investigación completa del caso, de falta grave contra la ética profesional en el ejercicio de la farmacia.”21 19 Ley 23 de 1962, artículo 11. 20 Ley 23 de 1962, artículo 12. 21 Ley 23 de 1962, artículo 14. Adicionalmente, en el artículo 16 prevé una sanción complementaria de arresto de 6 meses a 2 años y el decomiso de las mercancías expedidas ilegalmente. En caso de que el infractor sea extranjero, contempla una pena adicional de “expulsión del país”. 55 En cuanto a la responsabilidad de los propietarios, gerentes y farmacéuticos directores de los laboratorios farmacéuticos y de las farmacias - droguerías, la Ley 23 de 1962 señala que éstos son responsables civil y penalmente por la calidad y pureza de los productos que en ellos se elaboran; y que los propietarios, gerentes y farmacéuticos directores de establecimientos donde se expendan drogas y medicamentos “son responsables en los mismos términos anteriores de la calidad y pureza de los productos que expendan si no han tenido el debido cuidado en las condiciones de almacenamiento, si se han abierto los empaques originales o si se han expedido los productos después de la fecha de vencimiento.”22 Así mismo, extiende esta responsabilidad a los gerentes o representantes de casas importadoras o distribuidoras de productos farmacéuticos fabricados en el extranjero, que los importen o vendan.23 2.1.2 Decreto 1950 de 1964. El Decreto 1950 de 1964, reglamentario de la Ley 23 de 1962, establece los requisitos que deben cumplir los establecimientos farmacéuticos para obtener la autorización para su funcionamiento por parte de la Oficina de Control de Drogas y Productos Biológicos del Ministerio de Salud Pública. 24 22 Ley 23 de 1962, artículo 17. 23 Ley 23 de 1962, artículo 18. 56 De acuerdo con este decreto, los establecimientos farmacéuticos se clasifican en:25 a) Laboratorios farmacéuticos: Se consideran como tales, “los establecimientos industriales que se dedican parcial o totalmente a la fabricación, envase, análisis y control de drogas para empleo industrial y medicinal de medicamentos para uso humano y veterinario, de alimentos con indicaciones terapéuticas, de cosméticos y productos de tocador tales como cremas, afeltas, lociones, ‘ shampoos’ , tintes, fijadores para cabello, lápices labiales y para las cejas, coloretes, polvos, jabones de tocador y medicinales, desodorantes, dentífricos; de productos para usos odontológicos; de pesticidas, tales como insecticidas y rodenticidas, fungicidas; de alimentos o suplementos alimenticios para animales, materiales de curación y quirúrgicos, como algodón hidrófilo, gasas, hilos de sutura, esparadrapo, compresas, vendas enyesadas o nó, y otros productos similares a los indicados en este artículo”.26 b) Depósitos de drogas: Se consideran como tales “los establecimientos comerciales dedicados exclusivamente a la venta al por mayor, de drogas, alimentos con indicaciones terapéuticas o que reemplacen regímenes alimenticios especiales, productos de tocador, sustancias químicas aplicadas en la industria, materiales de curación, jeringuillas y agujas. 24 También podrán El artículo 35 concede facultades a las secretarías o direcciones departamentales, distritales, comisariales e intendenciales de salud, para expedir las licencias de instalación y funcionamiento de estos establecimientos farmacéuticos. 25 Decreto 1950 de 1964, artículo 34. 26 Decreto 1950 de 1964, artículo 36. 57 expender aparatos de física, o química que se relacionen con la ciencia y el arte de curar, y en general productos o artículos similares a los anteriores, a juicio de las autoridades de Salud Pública correspondientes.27 c) Agencias de especialidades farmacéuticas: “Se entiende por agencia de especialidades farmacéuticas el establecimiento dedicado al almacenamiento, promoción y venta de productos fabricados por los laboratorios cuya representación o distribución hayan adquirido. Estos establecimientos cumplirán, en lo pertinente, los requisitos exigidos a los depósitos por el presente Decreto, y su dirección técnica estará a cargo de un farmacéutico en ejercicio legal de la profesión.”28 d) Farmacias – droguerías: “Se denominan farmacias – droguerías aquellos establecimientos que se dedican a la preparación de fórmulas magistrales y a la venta al detal de sustancias químicas, drogas oficinales, especialidades farmacéuticas, alimenticias, cosméticos y productos de tocador, insecticidas, rodenticidas y similares, y de utensilios auxiliares de la medicina. También podrán expender artículos de utilidad general compatibles con esta clase de 27 28 Decreto 1950 de 1964, artículo 54. Decreto 1950 de 1964, artículo 63. 58 establecimientos. Al frente de estos establecimientos debe estar un farmacéutico en ejercicio legal de la profesión.29 Este decreto ordena a los laboratorios farmacéuticos contar con una sección de control de calidad o contratar el control de calidad de sus productos con laboratorios de control legalmente establecidos y dirigidos por químicos farmacéuticos.30 Por otra parte, distingue entre productos para cuya venta debe exigirse fórmula médica y aquellos para los que no, y señala que “los productos que exijan fórmula médica no podrán expenderse sino en farmacias –droguerías que funcionen legalmente y previa presentación de la respectiva prescripción.”31 Como una especie de las farmacias – droguerías, el decreto regula las farmacias homeopáticas, considerando como tales aquellas “que se dedican a la tenencia, 29 Decreto 1950 de 1964, artículo 64. Nótese que se presenta una inconsistencia con la definición contenida en la Ley 23 de 1962, pues como arriba se señaló, el artículo 10 de dicha ley define las farmacias – droguerías en términos diferentes. Por ejemplo, según el artículo 10 mencionado, las farmacias – droguerías pueden dedicarse al despacho de fórmulas magistrales, mientras el artículo 64 del Decreto 1950 de 1964 hace referencia a la preparación de fórmulas magistrales (desbordando de esta forma la previsión de la ley que reglamenta); así mismo, en el decreto se extiende el campo de acción de las farmacias – droguerías, de manera que pueden también dedicarse a la venta al detal de especialidades alimenticias, cosméticos, productos de tocador, insecticidas, rodenticidas y similares, y de utensilios auxiliares de medicina, y a expender artículos de utilidad general (desvirtuando así, el espíritu y la literalidad de la Ley 23 de 1962). 30 Decreto 1950 de 1964, artículos 45, 46 y 47. 31 Decreto 1950 de 1964, artículo 84. 59 distribución y venta de preparados de composición y clasificación infinitesimales.”32 Las somete al mismo régimen de las demás farmacias - droguerías. El decreto prohibe la venta al por menor de productos farmacéuticos en las agencias de especialidades farmacéuticas y en los depósitos de drogas, y sanciona penalmente y con multas la venta al público de productos farmacéuticos en establecimientos distintos de los en él regulados. 2.2 DECADA DE 1970 2.2.1 Ley 28 de 1974. Por medio de esta ley, el Congreso de la República confiere facultades extraordinarias al Presidente de la República, para revisar la organización administrativa del Ministerio de Salud Pública. En ejercicio de dichas facultades, se expidieron, entre otros, el Decreto 621 de 1974 y el Decreto 121 de 1976. 2.2.2 Decreto Ley 621 de 1974. En ejercicio de las facultades extraordinarias conferidas por la Ley 28 de 1974, el Gobierno expidió el Decreto 621 de 1974, por 32 Decreto 1950 de 1964, artículo 101. 60 medio del cual se creó el Consejo Asesor para el Licenciamiento de Drogas Biológicas, al que se le asignaron funciones consultivas en la expedición de licencias para la producción y comercialización de drogas y productos biológicos por parte del Ministerio de Salud Pública. 2.2.3 Decreto 281 de 1975. Por medio del Decreto 281 de 1975, “el Ministerio de Salud reglamenta, reuniéndolos en un solo texto legal, variados aspectos de las popularmente llamadas actividades de la salud, con lo cual, entre otros efectos, se persigue poner control a la actividad de ciertas personas y entidades que han venido actuando como ruedas sueltas en asuntos de tanta importancia.”33 En efecto, en él se regula el registro de medicamentos, productos alimenticios, cosméticos, materiales de curación, plaguicidas de uso doméstico, detergentes y otros productos que inciden en la salud. De conformidad con esta norma, se entiende por medicamento, “cualquier principio, farmacológicamente activo de origen mineral, vegetal, animal, sintético, que se utilice en el diagnóstico, prevención o tratamiento de las enfermedades del hombre o de los animales.”34 (subrayas fuera del texto); por producto alimenticio, 33 REVISTA LEGISLACIÓN ECONÓMICA. Publicaciones legales y empresariales. p. 60. 34 No. 5 39. Tomo 46. Bogotá: Legislación económica Ltda. Decreto 281 de 1975, artículo 1°. Este decreto equipara los conceptos de medicamento y droga. En efecto, en su artículo 8° señala que son drogas oficinales las que aparecen inscritas en alguna de las farmacopéas francesa, americana, británica, alemana e internacional, y medicamentos no oficinales, los que corresponden a drogas oficinales a las que se les ha introducido un cambio en su fórmula, su dosis, su técnica de preparación o en otras condiciones establecidas por las mencionadas farmacopéas. Según este artículo, el Ministerio de Salud Pública se reserva la facultad de excluir una o más drogas oficinales para su aceptación en Colombia, previo concepto del Consejo Asesor para el Licenciamiento de Drogas Biológicas. 61 “cualquier sustancia o mezcla de sustancias, destinadas a la nutrición humana, incluyendo las bebidas no alcohólicas y todos los ingredientes o aditivos de dichas sustancias.”35; y por alimentos con indicación terapéutica, “aquellos que, por hacer sido sometidos a procesos que modifican la concentración relativa de los elementos nutritivos de su constitución o la calidad de los mismos, o por incorporación de sustancias ajenas a su composición, adquieren propiedades terapéuticas o dietéticas.”36 (subrayas fuera del texto) En los términos de su artículo 5°, la importación37, exportación, fabricación, transformación y venta de medicamentos, productos alimenticios, cosméticos, y demás productos que inciden en la salud individual o colectiva, requieren registro en el Ministerio de Salud Pública. En su artículo 9°, señala que la importación, exportación y producción en el país de sustancias utilizadas como materia prima en la industria de extractos y en general de los que se utilicen para la elaboración de fórmulas magistrales, requieren autorización previa del Ministerio de Salud Pública y, en caso de que estos productos se expendan al público, requieren además, registro sanitario. 35 Decreto 281 de 1975, artículo 3°. 36 Decreto 281 de 1975, artículo 3, parágrafo. 37 El artículo 87 del Decreto 281 de 1975, prohibe “registrar productos fabricados en países en los cuales no esté reglamentada y controlada la producción y comercio de los mismos.” (subrayas fuera del texto) 62 63 Por otro lado, este decreto faculta al Ministerio de Salud para determinar las sustancias que no podrán ser utilizadas para la elaboración de los productos regulados en él, “por ser tóxicas, por sus efectos colaterales indeseables, o por haberse comprobado científicamente que carecen de utilidad terapéutica.”38 En su sección II, reglamenta lo relativo a las etiquetas, rótulos y empaques de los productos en él regulados. En su artículo 11, señala que dichas etiquetas, rótulos y empaques deben contener presentaciones sencillas que no encarezcan el precio de los productos, y que sean aprobadas por el Ministerio de Salud Pública.39 El Decreto 281 de 1975, distingue entre medicamentos de venta bajo fórmula médica, odontológica o veterinaria, y medicamentos de venta libre. De acuerdo con el artículo 12, le corresponde al Ministerio de Salud Pública, determinar cuáles productos requieren para su venta fórmula médica, odontológica o veterinaria, y cuáles son de venta libre. Señala así mismo, que en los envases, los folletos e insertos de información al público, de los medicamentos que requieren de fórmula no pueden especificarse la posología ni las indicaciones detalladas; que éstas solo pueden anunciarse en publicaciones destinadas exclusivamente a médicos, odontólogos y veterinarios. 38 39 Por su parte, el artículo 14, señala que “Los Decreto 281 de 1975, artículo 10. En este artículo se señalan las expresiones que deben contener las etiquetas, rótulos y empaques de los productos regulados en el Decreto 281 de 1975. medicamentos de venta libre llevarán las indicaciones, posología y manera de usarlos, después de someter el texto correspondiente a la aprobación del Ministerio de Salud Pública.” De conformidad con lo establecido en el artículo 16, el precio máximo de venta al público de los productos regulados en el Decreto 281 de 1975, debe “aparecer bien visible en los empaques exteriores, así como en los envases, ya fuere en las etiquetas o en las leyendas gravadas o impresas en las mismas.” Con respecto a la información y publicidad de los medicamentos, este decreto señala en su artículo 20 que, “Los medicamentos cuya venta requiera fórmula médica, veterinaria u odontológica, sólo podrán anunciarse en publicaciones de carácter científico o en otros medios de comunicación exclusivamente utilizables por médicos, veterinarios u odontólogos, según sea el caso”, y prohibe la propaganda de éstos en la prensa, la radiodifusión, la televisión y en general en los medios de comunicación masiva. En todo caso, de acuerdo con el artículo 22, “La información destinada a médicos, veterinarios y odontólogos y la propaganda permitida, así como sus modificaciones, necesitarán aprobación previa del Ministerio de Salud Pública.”40 Adicionalmente, y de conformidad con lo establecido en el artículo 30, “La propaganda o información para médicos, veterinarios y odontólogos deberá ajustarse a la verdad científica y a las normas que fije el Ministerio de Salud Pública 64 y deberá mostrar tanto los aspectos favorables como los desfavorables del medicamento.” En los términos del artículo 25 de este decreto, no se aceptarán, como nombres para los medicamentos, entre otros, los que se presten a confusión con otros medicamentos; los concernientes a temas religiosos; los que incluyan la palabra doctor; los de pila o apellidos de personas naturales; y los que incluyan palabras que expresen, sugieran o exageren ventajas o efectos de los correspondientes productos. En sus secciones III, IV, V, VI, VII, VIII, IX y X, el Decreto 281 de 1975, regula lo relativo al registro sanitario de los productos en él mencionados. En sus términos, quien desee obtener un registro de dichos productos, debe tramitar la solicitud en el Ministerio de Salud Pública;41 recibida ésta, y si el Ministerio lo considera conveniente, éste puede pedir al solicitante que acompañe 40 De acuerdo con el artículo 23 del Decreto 281 de 1975, le corresponde al Ministerio de Salud Pública revisar periódicamente la propaganda e información de los productos en él regulados, “para determinar si su contenido está conforme con las condiciones del correspondiente registro y con los avances científicos en la materia.” 41 Decreto 281 de 1975, artículo 31. De acuerdo con el artículo 35 del Decreto 281 de 1975, a la solicitud de registro, deben acompañarse, entre otros documentos, el certificado del Ministerio de Salud Pública, que acredite que el laboratorio o industria fabricante están inscritos y tienen capacidad para fabricar el producto, y en caso de que se trate de productos elaborados en el extranjero, certificado expedido por las autoridades sanitarias del país de fabricación, en el que se acredite si el consumo del producto está permitido en el interior de dicho país y si allí su venta es libre o está sujeta a restricciones. 65 trabajos científicos que acrediten la bondad del producto,42 y ordenar que se practiquen análisis del mismo por el entonces Laboratorio Nacional de Salud, y que se someta al concepto del Consejo Asesor para el Licenciamiento de Drogas Biológicas; si los análisis practicados resultan favorables, la solicitud reúne los requisitos establecidos en este decreto, y el Consejo Asesor para el Licenciamiento de Drogas Biológicas emite concepto favorable, en caso de que se haya sometido a su estudio, el Director General de Vigilancia y Control del Ministerio de Salud debe conceder el registro.43 En todo caso, de conformidad con el artículo 52, “Cuando con posterioridad al registro, se comprobare que el producto registrado tiene algún efecto farmacológico que no se tomó en consideración para el otorgamiento –del mismo–, cualquier persona podrá poner el hecho en conocimiento del Ministerio de Salud Pública, el cual después de verificarlo, tomará las providencias a que hubiere lugar.” (subrayas fuera del texto) En este decreto, los registros sanitarios tienen una duración de cinco (5) años, contados desde la fecha de la resolución que los otorga, y pueden renovarse por 42 43 Decreto 281 de 1975, artículo 33. En los términos del artículo 69 del Decreto 281 de 1975, “Toda sustitución, adición, supresión o reducción de ingredientes activos de un producto registrado, así como cualquier modificación cuantitativa o cualitativa de sus fórmulas, hará obligatoria la obtención de un nuevo registro, salvo cuando el Consejo Asesor para el Licenciamiento de Drogas conceptúe previamente y por escrito que no se trata de cambios sustanciales y los autorice expresamente.” 66 periodos iguales, previa solicitud presentada por los titulares, con seis (6) meses de antelación a la fecha de su vencimiento.44 En caso de que el registro se venza y no se presente o se desista de la solicitud de renovación, el producto no puede importarse ni ser fabricado en el país, según sea el caso; y si hay existencias en el mercado, “el Ministerio de Salud Pública dará a los interesados un plazo de seis (6) meses para disponer de ellas; pero si se tratare de un producto nocivo para la salud, a juicio del Ministerio de Salud Pública, se ordenará su decomiso y destrucción inmediata.”45 El artículo 72, autoriza la cesión de registros sanitarios previa solicitud de los interesados, acompañada del documento que instrumente la cesión; de la prueba de la existencia y representación legal del cesionario, si se trata de una persona jurídica; del certificado de inscripción del laboratorio o establecimiento industrial del cesionario (expedido por el Ministerio de Salud Pública); la comprobación de que éste ha contratado la elaboración del producto en un laboratorio autorizado, cuando no lo fabrique él mismo; y el pago de los derechos de publicación en el Diario Oficial. Con el fin de determinar si el producto se ajusta a las condiciones del registro y a las disposiciones legales sobre la materia, este decreto, en su artículo 73, faculta al 44 Decreto 281 de 1975, artículo 53. 45 Decreto 281 de 1975, artículo 55. 67 Ministerio de Salud Pública para ordenar, en cualquier momento, de oficio o a solicitud de cualquier interesado, la revisión del correspondiente registro.46 En su título XI, el Decreto 281 de 1975, establece las sanciones aplicables a quienes infrinjan las disposiciones en él contenidas, a saber: la cancelación del registro;47 el decomiso de los productos;48 la clausura del laboratorio o establecimiento industrial;49 cuatro multas con destino al Fondo Rotatorio de Estupefacientes del Ministerio de Salud;50 y la congelación de la distribución y venta de los productos51. De acuerdo con el artículo 82, la competencia para ordenar las sanciones 46 De acuerdo con el artículo 75 del Decreto 281 de 1975, cuando como resultado de la revisión se comprueba que el producto no cumple con las disposiciones sanitarias vigentes, el Ministerio de Salud cancela el registro. 47 Según el artículo 76 del Decreto 281 de 1975, esta sanción procede cuando se efectúan cambios en el registro sin el cumplimiento de los requisitos reglamentarios; cuando de la revisión de los productos se comprueban violaciones a las disposiciones legales; cuando se considera que el producto carece de los efectos o propiedades que se le atribuían al momento de la expedición del registro; cuando se altera o adultera la composición del producto; cuando se comprueba que el producto se fabrica en un establecimiento diferente al que se tuvo en cuenta para aprobar el registro o su renovación; cuando se utilizan envases, empaques, etiquetas o presentaciones comerciales distintas a las aprobadas por el Ministerio de Salud; cuando el titular ampare con el mismo número de registro otro u otros productos; cuando se utilicen sustancias peligrosas para la salud; y cuando el establecimiento fabricante no reúna las condiciones fijadas en la licencia de funcionamiento. En estos dos últimos casos procede también la clausura del establecimiento. 48 Según el artículo 77 del Decreto 281 de 1975, esta sanción es aplicable también, cuando se configuran las causales de cancelación del registro sanitario. Una vez se encuentra en firme la resolución que ordena el decomiso, los productos deben ser destruidos por la autoridad sanitaria competente, de conformidad con lo ordenado por el artículo 84 del Decreto 281 de 1975, salvo que se trata de productos que no perjudican la salud, caso en el cual deben entregarse a entidades de beneficencia escogidas por la misma autoridad. Por su parte, el artículo 90, ordena al titular del registro reintegrar a las personas afectadas e valor de los productos decomisados. 49 Según el artículo 78 del Decreto 281 de 1975, esta sanción procede, paralelamente con la cancelación del registro, cuando se utilicen sustancias peligrosas para la salud, y cuando el establecimiento fabricante no reúna las condiciones fijadas en la licencia de funcionamiento. 50 Hay lugar a esta sanción, cuando se cometen infracciones como insertar en los envases de los productos de venta bajo fórmula médica, de la posología e indicaciones de los mismos, de conformidad con lo establecido en el artículo 79 del Decreto 281 de 1975. Esta sanción es aplicable, sin perjuicio de las demás sanciones a las que hubiere lugar. 51 El artículo 80 del Decreto 281 de 1975, señala que “De conformidad con la Ley 23 de 1962, el Ministerio de Salud Pública podrá, con o sin notificación previa, ordenar la congelación de la distribución y venta de los productos cuando, a su juicio, fuere necesario proteger la salud pública.” La congelación consiste en poner fuera del comercio, hasta por un (1) mes, el producto, dejándolo en depósito del tenedor o de la autoridad 68 corresponde al Ministerio de Salud y a las Secretarías y Servicios Seccionales de Salud Pública, en el territorio de su jurisdicción, y “su cumplimiento debe hacerse por conducto de las autoridades sanitarias del país”. En los términos del artículo 83, la imposición de las sanciones requiere de un procedimiento previo, en el que se realice una investigación administrativa; se oigan los descargos del presunto infractor; se practiquen las pruebas que resulten procedentes y convenientes; y se decida por medio de resolución motivada; cumpliéndose de esta forma con los principios del debido proceso. 2.2.4 Decreto Ley 981 de 1975. Frente a la necesidad de dotar al Consejo Asesor para el Licenciamiento de Drogas Biológicas de funciones decisorias, en 1975, por medio del Decreto 981, se modificó el nombre de dicho consejo y se estableció que éste, en adelante, se denominaría “Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva”. Este decreto facultó a la mencionada Comisión Revisora para emitir conceptos de carácter obligatorio para el Ministerio de Salud Pública sobre los registros sanitarios y sobre las normas de carácter científico que regularan el registro y control de medicamentos, cosméticos, productos alimenticios, plaguicidas de uso doméstico y demás productos que incidan en la salud individual o colectiva. Así mismo, le otorgó sanitaria competente, y colocando señales de seguridad como bandas y sellos, en los lugares donde se encontraren existencias del producto. 69 facultades para pedir concepto a personas o entidades de reconocida capacidad científica, para el cumplimiento de sus funciones.52 2.2.5. Decreto Ley 121 de 1976. En ejercicio de las facultades extraordinarias conferidas por la Ley 28 de 1974, se expidió el Decreto 121 de 1976, por medio del cual se otorgó competencia al Ministerio de Salud Pública para definir la política nacional en materia de salud, a partir del diagnóstico de la situación del sector y de las políticas generales de desarrollo.53 Así mismo, por medio de este decreto, se creó la Dirección de Vigilancia y Control del Ministerio de Salud Pública, organizada en varias divisiones, una de las cuales era la División de Vigilancia y Control de Productos Bioquímicos, a la que le correspondía el registro de productos, su control de producción y distribución, y los análisis de costos y precios. El Decreto 121 de 976, determinó las personas que en adelante serían miembros de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, 52 Decreto 981 de 1975, artículo 4, por el cual se modifica el artículo 27 del decreto 621 de 1974. 53 Decreto 121 de 1976, artículo 7. 70 Plaguicidas de Uso Doméstico y demás productos que tuvieran incidencia en la salud individual o colectiva.54 2.2.6. Decreto 522 de 1976. Con el fin de aclarar y modificar el sistema implantado en 1975 por el Decreto 281, se expide en 1976 el Decreto 522. Este decreto precisa los conceptos de droga y medicamento, equivocadamente equiparados por el Decreto 281 de 1975. En efecto, en su artículo 1°, señala que “se entiende por droga cualquier principio farmacológicamente activo de origen mineral, vegetal, animal, sintético y semisintético, que se utilice en el diagnóstico, prevención o tratamiento de las enfermedades del hombre o de los animales”, y por medicamento, “cualquier droga o mezcla de drogas preparadas en forma farmacéutica definitiva y listo para ser administrado.” Así mismo, y para evitar que el sector de los alimentos con indicación terapéutica se viera favorecido por la no exigencia explícita del Decreto 281 de 1975 de contar con un registro sanitario, el Decreto 522 de 1976, señala que para la importación, 54 De acuerdo con el mencionado artículo, la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que tuvieran incidencia en la salud individual o colectiva, estaría integrada por el Ministro de Salud o un delegado, quien la presidiría; un médico especializado en farmacología o su suplente, designado por la Academia Nacional de Medicina; un químico farmacéutico especializado en farmacología o su suplente, designados por la Sociedad Colombiana de Químicos Farmacéuticos; un médico especializado en farmacología o su suplente, designados por el Ministro de Salud; un odontólogo especializado en farmacología o su suplente, designados por el Ministro de Salud; un médico veterinario especializado en alimentos o su suplente, designados por el Ministro de Salud; un químico farmacéutico especializado en farmacología, designados por el Ministro de Salud; y el jefe de la División de Vigilancia de Productos Bioquímicos. 71 exportación, fabricación y venta de estos alimentos, se necesita “registro en el Ministerio de Salud”. Por otra parte, en él se detallan especialmente, “los requisitos que deben cumplir las etiquetas y empaques, donde se debe identificar el producto, sus ingredientes, precauciones, posología y contraindicaciones, pero sin señalar las indicaciones, con el fin de evitar la autoformulación. … –y se señala que– “Las muestras médicas o de promoción deberán ser iguales en contenido, presentación y leyendas al producto comercial; el Ministerio de Salud podrá determinar la cantidad de muestras que se destinen a promoción.”55 2.2.7. Ley 9 de 1979. En 1979, con el propósito de codificar y actualizar la legislación sanitaria del país, el Congreso de la República expidió la Ley 9. “En la preparación del proyecto de esta ley intervinieron durante mas de tres años la mayoría de organismos públicos y privados de carácter técnico, docente, agropecuario, asociaciones industriales y demás entidades relacionadas con aspectos sanitarios.”56 REVISTA LEGISLACIÓN ECONÓMICA. No. 565. Tomo 48. Bogotá: Legislación económica Ltda. Publicaciones legales y empresariales. p. 204. 55 72 73 La Ley 9 de 1979 contiene disposiciones sanitarias sobre la elaboración, envase, almacenamiento, transporte y expendio de drogas y medicamentos, cosméticos, materiales de curación, y en general sobre productos que se empleen para el diagnóstico, tratamiento o la prevención de enfermedades. En su título V, Alimentos,57 se establecen las normas a las que deben sujetarse la producción, manipulación, almacenamiento, importación, exportación, comercialización y transporte de los alimentos, así como los establecimientos industriales y comerciales en los que se realice cualquiera de esas actividades.58 En este título se establece la obligatoriedad de obtener licencia sanitaria, expedida por el Ministerio de Salud Pública, para la instalación y funcionamiento de establecimientos industriales y comerciales que produzcan, transformen, manipulen, almacenen, expendan, importen o exporten alimentos y bebidas.59 Así mismo se determinan las características que deben cumplir los equipos y materiales utilizados para el ejercicio de esas actividades; se definen las directrices de la elaboración, proceso y expendio de alimentos y bebidas; se establecen las 56 REVISTA LEGISLACIÓN ECONÓMICA. No. 632. legales y empresariales. p. 86. 57 Tomo 54. Bogotá: Legislación económica Ltda. Publicaciones Hacemos referencia a este título porque existen sectores que pretenden incluir las preparaciones farmacéuticas con base en recursos naturales dentro de la categoría de alimentos. Como se mencionó anteriormente, el Decreto 281 de 1975 reguló el registro sanitario de los denominados en él “alimentos con indicación terapéutica”. 58 Ley 9 de 1979, artículo 243. características básicas de los empaques, envases o envolturas de éstos, así como los parámetros a los que debe sujetarse su publicidad. En lo que respecta a la publicidad de los alimentos y bebidas, la Ley 9 de 1979, en su artículo 272, prohibe la publicidad que haga alusión a propiedades medicinales, preventivas o curativas, nutritivas o especiales que puedan dar lugar a apreciaciones falsas sobre la verdadera naturaleza, origen, composición o calidad del alimento o de la bebida. En caso de que se les “asignen propiedades medicinales, se considerarán como medicamentos y cumplirán, además, con los requisitos establecidos para tales productos”, en dicha ley y sus reglamentaciones.”60 De acuerdo con esta norma, los establecimientos industriales en los que se elaboren alimentos o bebidas deben contar con un laboratorio de control de calidad de sus productos, o contratar dicho control de calidad con laboratorios legalmente establecidos y aprobados por el Ministerio de Salud.61 59 Ley 9 de 1979, artículos 244 y 246. 60 Ley 9 de 1979, artículo 274. Nótese que de esta manera se deroga tácitamente el Decreto 281 de 1975, en cuanto a la existencia de alimentos con indicación terapéutica, pues como quedó expuesto, la Ley 9 de 1979 da a éstos el carácter de medicamentos. 61 Ley 9 de 1979, artículo 286. 74 Para la importación de alimentos y bebidas se establece la necesidad de contar con un certificado del país de origen, expedido por la autoridad sanitaria competente, en el que se certifique su aptitud para el consumo humano. En su título VI, Drogas, Medicamentos, Cosméticos y Similares, la Ley 9 de 1979 establece las disposiciones sanitarias sobre la elaboración, envase o empaque, almacenamiento, transporte y expendio de drogas y medicamentos,62 cosméticos, materiales de curación y alimentos que por haber sido sometidos a procesos que modifican la concentración relativa de sus nutrientes adquieren propiedades terapéuticas. Por medio del artículo 429 de esta ley, el Congreso de la República ordena al Ministerio de Salud reglamentar las normas sobre drogas, medicamentos, cosméticos y similares. Para efectos sanitarios, se establece que todo laboratorio farmacéutico debe funcionar separado de cualquier otro establecimiento destinado a otras actividades.63 62 Aun cuando la Ley 9 de 1979 en este y en otros artículos mencionada de manera separada las drogas y los medicamentos, al momento de regularlos no hace distinción alguna, e incluso puede afirmarse que los equipara. 75 76 Así mismo expresa que “Las normas establecidas para los laboratorios farmacéuticos se aplicarán a todos los establecimientos que utilicen medicamentos, drogas y materias primas necesarias para la fabricación de productos farmacéuticos.”64 En este título, se ordena también a los laboratorios farmacéuticos, contar con una sección que controle la calidad de sus materias primas y productos terminados, o contratar una laboratorio legalmente establecido para el efecto. Con el fin de evitar contaminaciones y facilitar el control y vigilancia, el código sanitario prohibe a los depósitos de drogas elaborar, transformar o reenvasar medicamentos.65 Por otra parte, se ordena al Ministerio de Salud Pública establecer los requisitos que deben reunir las instalaciones de las farmacias – droguerías,66 y la venta de drogas y medicamentos en ellas.67 Así mismo, se prevé la posibilidad de que las drogas y 63 Ley 9 de 1979, artículo 432. 64 Ley 9 de 1979, artículo 435. 65 Ley 9 de 1979, artículo 438. 66 Ley 9 de 1979, artículo 441. 67 Ley 9 de 1979, artículo 442. medicamentos se expendan en establecimientos distintos de las farmacias – droguerías, expresamente autorizados por el Ministerio de Salud. Se establecen así mismo, los requisitos mínimos que deben cumplir los envases, empaques, rótulos y etiquetas de los productos farmacéuticos, y se ordena que “las indicaciones acerca de la posología y las posibles acciones secundarias y contraindicaciones de los productos farmacéuticos deberán incluirse en un anexo que acompañe al producto.”68 En cuanto a los nombres de los productos farmacéuticos, el código sanitario señala que deben ajustarse a términos científicos y proscribe la posibilidad de utilizar “denominaciones estrambóticas y otras que determine la respectiva reglamentación.”69 (subrayas fuera del texto) Como requisito para el registro de marcas de productos farmacéuticos, se establece la necesidad de contar con un informe previo permisible del Ministerio de Salud Pública sobre su aceptación. Así mismo, se establece la posibilidad de cancelación de los registros de marcas de productos farmacéuticos que solicite ese Ministerio. 68 Ley 9 de 1979, artículo 452. 69 Ley 9 de 1979, artículo 453. 77 78 En cuanto al registro de los productos farmacéuticos, se establece que “Todos los medicamentos, drogas, … y todos aquellos productos farmacéuticos que incidan en la salud individual o colectiva necesitan registro en el Ministerio de Salud para su importación, exportación, fabricación y venta.”70 (subrayas fuera del texto) En su título XI, Vigilancia y Control, la Ley 9 de 1979, establece las medidas de seguridad71 y las sanciones a administrativas72 que deben imponerse a las personas que infrinjan las normas sanitarias. Establece también, de manera expresa, que la imposición de dichas sanciones no exime al infractor de la responsabilidad civil o penal, si a ellas hay lugar. En ese mismo título, en su artículo 567 el código sanitario señala que “para la instalación y funcionamiento de todo establecimiento, se requiere licencia sanitaria expedida por el Ministerio de Salud o por la entidad en que éste delegue tal función.” 70 Ley 9 de 1979, artículo 457. 71 En su artículo 576, señala que, con el fin de proteger la salud pública, podrán imponerse las siguientes medidas de seguridad: clausura temporal del establecimiento, total o parcial; la suspensión parcial o total de trabajos o de servicios; el decomiso de objetos y productos; la destrucción o desnaturalización de artículos o productos; y la congelación o suspensión temporal de la venta o empleo de productos y objetos, mientras se toma una decisión definitiva al respecto. Las medidas de seguridad son de inmediata ejecución, tienen carácter preventivo y transitorio, y se aplican sin perjuicio de las sanciones a las que haya lugar. 72 Teniendo en cuenta la gravedad del hecho, y por medio de resolución motivada, en los términos del artículo 577, pueden imponerse las siguientes sanciones: amonestación; multas sucesivas hasta por 10.000 salarios 79 Por último, en su título XII, con el fin de evitar interpretaciones erróneas sobre el carácter de las normas relativas a la salud, que éstas son de orden público, en consecuencia, tienen carácter imperativo, y no pueden ser desconocidas por convenios particulares. 2.3. DECADA DE 1980 2.3.1. Decreto 2333 de 1982. En 1982, se expide el Decreto 2333, por el cual se reglamenta parcialmente el título V de la Ley 9 de 1979, en cuanto a las condiciones sanitarias de las fábricas, depósitos y expendios de alimentos, de los alimentos en tanto tales, de su transporte y su distribución. Este decreto consagra la obligatoriedad del registro sanitario en el Ministerio de Salud Pública, de los alimentos elaborados, envasados o importados.73 2.3.2. Decreto Ley 3466 de 1982. En ejercicio de las facultades extraordinarias concedidas al Presidente de la República por la Ley 73 de 1981 74 para mínimos legales diarios; decomiso de productos; suspensión o cancelación del registro o de la licencia; cierre temporal o definitivo del establecimiento, edificación o servicio respectivo. 73 y El artículo 131 de este decreto señala que “Los productos alimenticios naturales que –no– sean sometidos a ningún proceso de transformación, tales como granos, frutas, hortalizas, verduras y similares que solamente sean empacados, no requieren registro sanitario, … aunque sí están sometidos al control sanitario que ejercen las autoridades sanitarias.” reglamentarla, en 1982 se expide el Decreto 3466, por el cual se dictan normas relativas a la idoneidad, la calidad, las garantías, las marcas, las leyendas, las propagandas y la fijación pública de precios de bienes y servicios, la responsabilidad de sus productores, expendedores y proveedores. En los términos del artículo 14 de este decreto “Toda información que se dé al consumidor acerca de los componentes y propiedades de los bienes y servicios que se ofrezcan al público deberá ser veraz y suficiente. Están prohibidas, por lo tanto, las marcas, las leyendas y la propaganda comercial que no correspondan a la realidad, así como las que induzcan o puedan inducir a error respecto de la naturaleza, el origen, el modo de fabricación, los componentes, los usos, el volumen, peso o medida, los precios, la forma de empleo, las características, las propiedades, la calidad, la idoneidad o la cantidad de los bienes o servicios ofrecidos. “Tratándose de productos … que estén sometidos a registro o licencia legalmente obligatorias75 …, las marcas o leyendas que se exhiban en dichos productos, al igual que toda propaganda que se haga de ellos, deberá corresponder íntegramente a lo registrado o contenido en la licencia …”. (subrayas fuera del texto) 74 Esta ley, conocida comúnmente como Estatuto del Consumidor, “tiene por objeto establecer controles a los procesos de producción, distribución y venta de bienes y servicios, protegiéndose de manera directa el interés del consumidor.” REVISTA LEGISLACIÓN ECONÓMICA. No. 632. Tomo 59. Bogotá: Legislación económica Ltda. Publicaciones legales y empresariales. p. 371. 75 Como es el caso de las preparaciones farmacéuticas. 80 81 Agrega este decreto, en su artículo 17, que “Tratándose de bienes … que por su naturaleza o componentes, sean nocivos para la salud, deberá indicarse claramente y en caracteres perfectamente legibles, bien sea en sus etiquetas, envases o empaques o en un anexo que se incluya dentro de éstos, su nocividad y las condiciones o indicaciones necesarias para su correcta utilización, así como las contraindicaciones del caso. … “Tratándose de productos perecedores (sic), se indicará claramente y sin alteración de ninguna índole, la fecha de su expiración en avisos que se fijen en sitios visibles al público, o en sus etiquetas, envases o empaques, si se trata de productos perecedores (sic) procesados o transformados, envasados o empacados. … “Sin perjuicio de lo anterior, el Gobierno podrá prohibir o someter al cumplimiento de requisitos especiales la propaganda comercial de todos o algunos de los bienes y servicios de que trata el presente artículo.” Por otro lado, el decreto establece la responsabilidad de los productores por la idoneidad y calidad de sus bienes o servicios, señalando que ésta “se determinará de conformidad con los términos y condiciones señalados en el registro o licencia…, teniendo en cuenta las causales de exoneración previstas en el artículo 26”76 Por su parte, el artículo 26 mencionado, señala que las únicas causales de exoneración de dicha responsabilidad, son la fuerza mayor, el caso fortuito, el uso indebido del bien por parte del afectado, o el hecho de un tercero ligado o no al productor mediante relación de trabajo o contractual de cualquier clase, debidamente probados. No obstante lo anterior, las causales de exoneración no tienen aplicación cuando no se haya efectuado el registro u obtenido la licencia que sean legalmente obligatorios y cuando el registro efectuado no se ajuste a las condiciones de calidad e idoneidad determinadas por la autoridad competente.77 (subrayas fuera del texto) El artículo 42 del decreto, asigna competencia a la Superintendencia de Industria y Comercio para “Prohibir o someter al cumplimiento de requisitos especiales la propaganda comercial de todos o algunos de los bienes o servicios que por su naturaleza o componentes sean nocivos para la salud”. 76 Decreto 3466 de 1982, artículo 23. 82 Por último, el artículo 47 del decreto señala que “El régimen especial para determinados bienes y servicios contemplados en el Código Sanitario Nacional (Ley 9 de 1979) continuará vigente en su totalidad, pero serán aplicables a los mismos bienes y servicios las disposiciones del presente decreto que regulan aspectos no previstos en dicho código.” 2.3.3. Decreto 713 de 1984. Por medio del Decreto 713 de 1984, que reglamenta parcialmente la Ley 23 de 1962 78 y el título VI de la Ley 9 de 197979, se regula la actividad farmacéutica. Este decreto se aplica a los establecimientos farmacéuticos que fabriquen, distribuyan o vendan productos farmacéuticos, como laboratorios farmacéuticos, droguerías80, farmacias – droguerías, depósitos de drogas, agencias de especialidades farmacéuticas y similares, a los profesionales y al personal que labora en el campo farmacéutico. 77 Decreto 3466 de 1982, artículo 27. 78 Que regula el ejercicio de la profesión de químico farmacéutico. 79 Que regula lo relacionado con drogas, medicamentos, cosméticos y similares. Este decreto hace referencia a las droguerías como una especie de establecimientos farmacéuticos diferentes de las farmacias – droguerías. Sin embargo, hasta el momento en ninguna norma se había hecho esta diferenciación. Esto genera una confusión, pues el decreto no contiene una definición de esta nueva especie de establecimientos farmacéuticos. En consecuencia, parece acertado considerar la diferenciación como un error de transcripción. 80 83 En su artículo 2, introduce en la regulación sanitaria los conceptos de producto farmacéutico fraudulento y alterado.81 En su artículo 3, prohibe la tenencia de empaques o envases vacíos y de etiquetas, así como la tenencia o la venta de productos farmacéuticos con fecha de vigencia, expiración o caducidad vencida o sin registro sanitario.82 En desarrollo del artículo 17 de la Ley 23 de 1962, este decreto señala que los administradores, propietarios y responsables directos de los establecimientos farmacéuticos que fabriquen, distribuyan, despachen o vendan productos farmacéuticos, son solidariamente responsables civil y penalmente83 de la calidad, pureza y autenticidad de los respectivos productos. En su capítulo II, “de la vigilancia y control de las sanciones”, el Decreto 713 de 1984, establece que las autoridades sanitarias pueden en cualquier momento prevenir a las personas sobre las disposiciones sanitarias y las sanciones que 81 Ya la Ley 9 de 1979, en su artículo 456 había señalado que “Se prohibe la venta y suministro de medicamentos con fecha de caducidad vencida”, y en su título XI había establecido las medidas de seguridad y las sanciones administrativas que deben imponerse a quienes infrinjan las normas sanitarias, sin perjuicio de la responsabilidad civil y penal a las que haya lugar. Así mismo, la Ley 23 de 1962, había establecido el carácter de la responsabilidad de los propietarios, gerentes y farmacéuticos directores de los laboratorios farmacéuticos y las farmacias droguerías, por la “calidad y pureza” de los productos que elaboren o expendan. 82 83 Decreto 713 de 1984, artículo 4. La solidaridad, que jurídicamente es el “Nexo obligatorio común que fuerza a cada uno de dos o mas deudores a cumplir o pagar por la totalidad cuanto les sea exigido por el acreedor o acreedores con derecho a ello” (OSORIO, Manuel. Diccionario de ciencias jurídicas, políticas y sociales. Buenos Aires: Editorial Heliastas S.R.L.., 1981. p. 720), es una figura no admisible en el derecho penal, por ser la acción penal, eminentemente personal. En efecto, “Nadie podrá ser condenado por un hecho punible, si el resultado del cual depende la existencia de éste, no es consecuencia de su acción u omisión.” (artículo 21 del C.P., Decreto Ley 100 de 1980). En consecuencia, en este sentido, el Decreto 713 de 1984 es impropio. 84 conlleva su incumplimiento, con el fin de proteger a la comunidad y lograr que sus actividades se ajusten a ellas.84 Por otra parte, contempla la posibilidad de que los funcionarios competentes para la inspección, vigilancia, control y aplicación de las medidas de seguridad y las sanciones por violación de las normas sanitarias, tengan libre acceso, previa identificación, a los establecimientos farmacéuticos, para examinar las edificaciones, instalaciones, equipos y productos existentes, y determinar si cumplen las disposiciones sanitarias. Establece así mismo, las medidas de seguridad, los procedimientos sancionatorios y las sanciones aplicables a quienes infrinjan las disposiciones sanitarias, en desarrollo de lo previsto en el artículo 576 y concordantes de la Ley 9 de 1979. 2.3.4. Decreto 2092 de 1986. Con el fin de reglamentar los títulos VI y XI de la Ley 9 de 1979, en cuanto a la elaboración, envase, empaque, almacenamiento, transporte y expendio de medicamentos, cosméticos y similares, se expide en 1986 el Decreto 2092. 84 Decreto 713 de 1984, artículo 8. 85 Por medio de este decreto se derogan expresamente los Decretos 281 de 1975 y 522 de 1976.85 El artículo 1° de este decreto, establece por primera vez en la normatividad sanitaria colombiana el concepto de “droga”, y la define como “toda sustancia famacológicamente activa, cualquiera que sea su origen y características, que se utilice para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de las enfermedades del hombre o de los animales.” En su artículo 2°, define medicamento como “toda droga o mezcla de drogas, con o sin adición de sustancias auxiliares, preparada para ser presentada como forma farmacéutica que se utilice para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de las enfermedades del hombre o de los animales.”86 En su artículo 4°, el decreto señala que se consideran productos farmacéuticos “los medicamentos de uso humano, los cosméticos y los alimentos con indicaciones terapéuticas para uso humano.”87 85 Decreto 2092 de 1986, artículo 238. 86 En el artículo 3° del Decreto 2092 de 1986, se define como medicamento oficinal el que aparece inscrito en alguna de las farmacopéas francesa, norteamericana, británica, alemana o internacional; y se señala que el Ministerio de Salud Pública, puede prohibir la producción y comercialización medicamentos no oficinales. 87 De esta forma se revive el concepto de alimentos con indicaciones terapéuticas, previsto en el Decreto 281 de 1975 que, como se expresó anteriormente, fue derogado tácitamente por la Ley 9 de 1979, que dio a este tipo 86 87 Así mismo, en sus artículos 5° y 6°, señala los casos en los que los productos farmacéuticos se consideran fraudulentos o adulterados. Define también los conceptos de productos perecederos, cosméticos, principio activo, excipiente, forma farmacéutica, producto biológico, materia prima, fecha de vencimiento, lote, producto semielaborado, control de calidad, medicamento homeopático, entre otros. En su capítulo II, el decreto regula el registro sanitario de los medicamentos, los cosméticos y las sustancias similares.88 En su artículo 22, señala expresamente que necesitan registro sanitario del Ministerio de Salud Pública, los medicamentos y los cosméticos.89 de alimentos el carácter de medicamentos. En consecuencia, la referencia a los alimentos con indicaciones terapéuticas, contenida en el artículo 4° del Decreto 2092 de 1986 es impropia. 88 Las sustancias similares a las que hace referencia este decreto son los plaguicidas de uso doméstico, los materiales de uso odontológico, los equipos utilizados para la aplicación de medicamentos, y los productos de aseo y limpieza. 89 Para evitar interpretaciones equívocas, el Decreto 2092 de 1986, consagra en su artículo 21, la obligatoriedad del registro sanitario para los medicamentos homeopáticos. 88 En sus artículos 23 y 24, señala los requisitos generales del registro. En sus artículos 25 y 26, indica el procedimiento del registro, y señala que éste será otorgado por el Ministerio productos cumplan de Salud, mediante resolución, cuando los los requisitos establecidos en las normas farmacológicas expedidas o aceptadas por éste, o cuando se trate de productos que aun cuando no los cumplen, requieren registro sanitario de conformidad con el propio decreto, es decir, cuando por ejemplo se trata de medicamentos, cualquiera sea su origen.90 Señala así mismo que “Cuando se pretenda adelantar investigación clínica sobre un producto nuevo o una nueva indicación, el protocolo de investigación o comprobación debe ser aprobado por la Dirección de Investigaciones del Ministerio de Salud.” En su capítulo III, consagra los requisitos especiales para el registro sanitario de medicamentos; las especificaciones que deben cumplir los envases, las etiquetas, los rótulos, los empaques y los nombres de los medicamentos; y señala las funciones de la Comisión Revisora de Productos Farmacéuticos. 90 Dentro de estos estaban incluidos las preparaciones farmacéuticas con base en productos naturales. El Decreto 2092 de 1986, distingue entre medicamentos de venta bajo fórmula médica y medicamentos de venta libre. En su artículo 36, señala que en los envases o empaques de los medicamentos de venta bajo fórmula médica no deben aparecer las indicaciones del producto, aunque sí su posología y contraindicaciones. En cuanto a las etiquetas, rótulos y empaques de productos importados, señala en su artículo 41, que serán aceptados tal como hayan sido establecidos en el país de origen, siempre y cuando contengan el nombre o dirección del importador, la composición, las condiciones de almacenamiento y el número del registro sanitario otorgado por el Ministerio de Salud Pública, favoreciéndolos significativamente frente a los productos nacionales, pues sus etiquetas, rótulos y empaques deben cumplir una serie de requisitos adicionales. En cuanto a los nombres de los medicamentos, prohibe en su artículo 51, aquellos que induzcan a engaño o error; los que sean exagerados; los que se presten a confusión con los nombres de otros productos; los que indiquen expresamente la utilización o indicaciones farmacológicas; los que utilicen nombres de santoral de cualquier religión o secta religiosa, estén vinculados a temas religiosos, de superstición o hechicería; entre otros. 89 Señala también que “Los medicamentos sólo podrán anunciarse o promocionarse en publicaciones de carácter científico o técnico dirigidos al cuerpo médico y odontológico. Prohíbese la propaganda de medicamentos en la prensa, la radiodifusión y en general en cualquier otro medio de comunicación y promoción masiva. Sin embargo los medicamentos de venta libre podrán tener publicidad con la previa aprobación del Ministerio de Salud.”91 En su artículo 56, asigna a la Comisión Revisora de Productos farmacéuticos, las funciones de conceptuar sobre las normas de carácter científico que deben regir para el registro y control de los medicamentos, y demás productos que incidan en la salud individual o colectiva, y sobre los registros propiamente tales de dichos productos. Asigna a los conceptos de la Comisión Revisora de Medicamentos, carácter obligatorio para el Ministerio de Salud.92 En el capítulo IX, del trámite de la solicitud de registro, el decreto señala que se surtirá en la División de Vigilancia de Productos Bioquímicos del Ministerio de Salud, y que ésta determinará si se requieren o no análisis de laboratorio adicionales y el estudio por parte de la Comisión Revisora de Productos Farmacéuticos. Señala también que en caso de que se requiera concepto de la Comisión Revisora de Productos farmacéuticos, y este resultare desfavorable, el solicitante podrá 91 Decreto 2092 de 1986, artículo 53. 90 objetarlo y hacer las observaciones que considere pertinentes dentro de los noventa (90) días siguientes al de notificación de la negativa, para que ésta lo modifique, si lo considera conveniente. Si el concepto resulta positivo, se concederá el registro. En su artículo 117, consagra la responsabilidad solidaria del fabricante y el titular del registro por las violaciones a la ley y a ese decreto. En el capítulo X, señala que el registro sanitario tendrá una duración de 10 años desde la ejecutoria de la resolución que lo otorga y será renovable por periodos iguales. En el capítulo XI, señala que cualquier cambio en el registro deberá ser autorizado por el Ministerio de Salud.93 En su capítulo XII, confiere al Ministerio de Salud la facultad de ordenar en cualquier momento, de oficio o a solicitud de cualquier interesado, la revisión de los registros sanitarios, con el fin de determinar si el producto correspondiente se ajusta a las disposiciones legales. 92 El parágrafo 2 del artículo 56 del Decreto 2092 de 1986, permite a la Comisión Revisora de Productos Farmacéuticos, pedir conceptos a personas o entidades de reconocida capacidad científica, para el cumplimiento de sus funciones. 91 92 En su artículo 147, consagra la posibilidad de que las autoridades sanitarias competentes clausuren, en forma definitiva o temporal, cualquier laboratorio o establecimiento industrial, cuando sus condiciones sanitarias y técnicas incidan desfavorablemente en la calidad de los productos. En su capítulo XVI, asigna competencia al Ministerio de Salud Pública y a las entidades delegadas para ejercer la vigilancia, el control y tomar las medidas de prevención y correctivas necesarias para dar cumplimiento a las disposiciones de ese decreto. En su artículo 169, prevé la posibilidad de que funcionarios del Ministerio de Salud Pública o de las entidades delegadas visiten en cualquier momento las instalaciones en las que se elaboren, almacenen o expendan medicamentos y productos similares, con el fin de tomar muestras y verificar el cumplimiento de dicho decreto. En ese mismo capítulo, señala las medidas sanitarias de seguridad que pueden aplicarse para prevenir o impedir la ocurrencia de hechos que atenten contra la salud pública, y las sanciones en caso de incumplimiento de las normas sanitarias, en desarrollo de lo establecido en los artículos 576 y 577 de la Ley 9 de 1979. 93 Estos cambios pueden referirse al nombre del producto, el laboratorio fabricante, o modificaciones en la forma o fórmula farmacéutica. 93 2.4. DECADA DE 1990 2.4.1. Ley 10 de 1990. En 1990 se expide la Ley 10, por medio de la cual se reorganiza el sistema nacional de salud. Esta ley señala que el Estado interviene en el servicio público de salud, entre otros fines, para “determinar los derechos y deberes de los habitantes del territorio, en relación con el servicio público de salud…”94 Así mismo establece la organización y administración del servicio público de salud, la prestación de servicios de salud por personas privadas, y los aspectos fiscales y tarifarios relacionados con el sector de la salud. En su artículo 8°, establece que la dirección nacional del sistema de salud estará a cargo del Ministerio de Salud, como consecuencia de lo cual, a éste le corresponde “formular las políticas y dictar todas las normas científico – administrativas, de obligatorio cumplimiento por las entidades que integran el sistema.” 2.4.2. Decreto 1524 de 1990. Frente a la necesidad de regular el sector de los “productos naturales” y de las preparaciones farmacéuticas elaboradas con base en 94 Ley 10 de 1990, artículo 1°. éstos, que en opinión de quienes se dedicaban a su producción y comercialización y del propio Ministerio de Salud, debían someterse a una regulación especial, diferente a la de los medicamentos de síntesis química, en 1990 se expide el Decreto 1524. Por medio de este decreto se reglamentan parcialmente los títulos VI y XI de la Ley 9 de 1979, en lo referente a la fabricación, envase o empaque, almacenamiento y expendio, de los productos naturales con usos terapéuticos, utilizados tradicionalmente en forma empírica, y de las preparaciones farmacéuticas elaboradas con base en los mismos.95 El Decreto 1524 de 1990 establece, por primera vez en la normatividad sanitaria colombiana, los conceptos de productos naturales y de preparaciones farmacéuticas elaboradas con base en éstos. En efecto, de acuerdo con su artículo 2°, se entiende por producto natural, “El material de origen vegetal, animal o mineral utilizado tradicionalmente con fines terapéuticos, que ha sido sometido solamente a procesos físicos que faciliten su conservación y empaque.”; y por preparaciones farmacéuticas con base en productos naturales, “Aquellas preparaciones elaboradas con material vegetal, animal o mineral bajo una forma farmacéutica y cuyo empleo se fundamente en usos terapéuticos tradicionales empíricos. Estos productos sólo podrán ser administrados por vía oral o tópica.” 95 Decreto 1524 de 1990, artículo 1. 94 95 Este decreto ordena a los establecimientos que se dedican a fabricar, envasar, empacar, almacenar y expender preparaciones farmacéuticas elaboradas con base en productos naturales, contar con una licencia sanitaria de funcionamiento expedida por el Ministerio de Salud, a través de su Dirección de Vigilancia y Control, para acreditar que cuentan con las condiciones locativas técnicas y sanitarias que garantizan la calidad e inocuidad de los respectivos productos. Ordena así mismo que las preparaciones farmacéuticas con base en productos naturales que se elaboren, envasen, importen y vendan en Colombia, deben contar con un registro sanitario expedido por la mencionada Dirección de Vigilancia y Control del Ministerio de Salud. En sus artículos 3 y 4, señala que los productos con indicaciones terapéuticas, elaborados con material vegetal, animal o mineral, deben registrarse como medicamentos, de acuerdo con lo establecido en el Decreto 2092 de 1990, y que las plantas aromáticas dispensadas en bolsas para la preparación de tisanas o aguas aromáticas deben registrarse como alimentos, de acuerdo con lo el Decreto 2333 de 1982. En su artículo 6°, señala que le corresponde al Ministerio de Salud, mediante resolución, establecer los listados de las plantas medicinales, y de los materiales vegetales, animales o minerales, utilizados tradicionalmente con fines terapéuticos, así como el listado de los usos de éstos, tradicionalmente aceptados. En su capítulo II, establece las condiciones que debe cumplir el cultivo de las plantas, su recolección, lavado, secado, almacenamiento y conservación; así como el almacenamiento y conservación del material animal y vegetal. En desarrollo de lo establecido en el artículo 567 de la Ley 9 de 1979, este decreto, en sus capítulos III, IV, V, VI y VII, regula las licencias sanitarias de funcionamiento; señala que éstas serán expedidas por la Dirección de Vigilancia y Control del Ministerio de Salud; obliga a los establecimientos fabricantes a contar con un químico farmacéutico como director técnico; y establece los requisitos y el trámite de solicitud de dichas licencias sanitarias de funcionamiento.96 En su capítulo VIII, de los registros sanitarios, el Decreto 1524 de 1990, exige para la elaboración y comercialización de preparaciones farmacéuticas con base en 96 En su artículo 20, el Decreto 1524 de 1990, señala que para el trámite de la licencia sanitaria de funcionamiento de un establecimiento fabricante de preparaciones farmacéuticas se debe presentar una solicitud, que debe contener entre otros datos, el nombre del establecimiento, su ubicación, el nombre de su propietario, las formas farmacéuticas que se van a elaborar, envasar y/o empacar, una descripción de los procesos de elaboración de cada producto, y el nombre de sus empleados. 96 productos naturales, un registro sanitario expedido por la Dirección de Vigilancia y Control del Ministerio de Salud o la entidad que haga sus veces. En el parágrafo 1° del artículo 54, contempla un tratamiento diferente para las materias primas utilizadas en la elaboración de dichas preparaciones farmacéuticas, pues señala que “El material vegetal, animal y mineral utilizado en la elaboración de preparaciones farmacéuticas a base de productos naturales con fines terapéuticos, en su estado natural, deshidratado o subdividido y empacado individualmente (no mezclado), podrá ser comercializado mediante autorización expedida por las Secretarías o Servicios Seccionales de Salud o la entidad que haga sus veces, a través de las Jefaturas de Control de Medicamentos… En las etiquetas y empaques no debe aparecer ni indicación ni uso terapéutico alguno.” En su artículo 55, señala que el registro sanitario de las preparaciones farmacéuticas con base en recursos naturales, tradicionalmente utilizadas con fines terapéuticos, puede concederse para: a. Elaborar y vender. b. Importar y vender. c. Importar, empacar y vender. d. Importar, semielaborar y vender. e. Elaborar y exportar. 97 98 En su artículo 56, señala los requisitos generales del registro. Este artículo introduce importantes modificaciones al Decreto 2092 de 1986, al eliminar algunos requisitos en él exigidos para presentar la solicitud de registro sanitario,97 y al introducir como nuevo requisito, el certificado de identificación e inscripción expedidos por el Herbario Nacional, si se trata de plantas. En su artículo 64, somete al estudio de la Comisión Revisora de Productos Farmacéuticos, los productos naturales que no se incluyan en el listado de plantas medicinales expedido por el Ministerio de Salud, de que trata el artículo 6 de ese decreto. Señala que “Cuando la Comisión Revisora deba ocuparse del estudio de Productos Naturales, invitará a dos (2) personas versadas sobre la materia.” En caso de que el concepto de la Comisión Revisora de Productos Farmacéuticos resulte desfavorable, concede al interesado un término de sesenta (60) días calendario, a partir de la fecha de su notificación, para objetarlo y hacer las observaciones que considere pertinentes. De acuerdo con su artículo 66, en caso de que el concepto de dicha comisión no sea objetado, o si habiéndolo sido, ésta lo 97 Algunos de esos requisitos son los siguientes: 1. La composición cuantitativa del producto identificado con nombre genérico y químico y todas las sustancias que de ella forman parte; 2. Las vías de administración; 3. La dosis y frecuencia de administración; 4. Las indicaciones farmacológicas y los usos terapéuticos; 5. Las contraindicaciones; 6. Los efectos secundarios; 7. Las pruebas de estabilidad del producto; 8. La descripción completa de los métodos para valorar cuantitativamente cada uno de los principios activos en el producto terminado; 9. La fecha de expiración; y 10. La información dirigida al cuerpo médico. mantuviere, el Ministerio de Salud negará el registro sanitario y archivará el expediente. En su artículo 70, consagra la responsabilidad del fabricante y del titular del registro, que en sus términos se extiende al mantenimiento de las condiciones sanitarias de los productos desde su fabricación hasta su entrega al consumidor. Por otra parte, disminuye el término de vigencia de los registros sanitarios para este tipo de productos a cinco (5) años,98 a partir de la ejecutoria de la resolución que los otorgue, y contempla la posibilidad de renovarlos por períodos iguales. En su capítulo IX, el Decreto 1524 de 1990, señala que las modificaciones en el registro sanitario deben ser autorizadas por el Ministerio de Salud, y que el fabricante o titular del mismo, está obligado a dar aviso inmediato a dicho Ministerio sobre los efectos secundarios de los productos amparados con el correspondiente registro. En el capítulo X, prohibe los nombres comerciales para identificar productos naturales o preparaciones farmacéuticas elaboradas con base en éstos. Así mismo concede facultades al Ministerio de Salud para que de oficio, o a solicitud del 98 Este mismo término había sido consagrado en el Decreto 281 de 1975 99 interesado, ordene en cualquier momento, mediante resolución, la revisión de un registro, con el fin de que se ajuste a los requerimientos legales. En su capítulo XI, establece los requisitos que debe cumplir el control de calidad de los productos naturales y de las preparaciones farmacéuticas elaboradas con base en ellos. Contempla un control de calidad específico para las materias primas y otro para el producto en proceso, y señala que el Ministerio de Salud podrá en cualquier momento tomar muestras para verificar la calidad de los mismos. En su capítulo XII, señala el contenido de las etiquetas o empaques de estos productos y preparaciones. Este decreto establece un contenido diferente para las etiquetas o empaques de los productos naturales y de las preparaciones farmacéuticas elaboradas con base en éstos, con respecto al que, de acuerdo con el Decreto 2092 de 1986, deben tener los demás medicamentos. En efecto, por ejemplo, no contempla la necesidad de indicar el nombre y ubicación del laboratorio farmacéutico, el número del lote de fabricación, y la frase “consérvese bajo refrigeración o congelación”. En su capítulo XVI, de la publicidad, modifica nuevamente el régimen general de publicidad previsto para los medicamentos en el Decreto 2092 de 1986, pues permite la publicidad de los productos naturales y de las preparaciones 100 farmacéuticas elaboradas con base en los mismos, en los medios masivos de comunicación, previa aprobación de la División de Vigilancia de Productos Bioquímicos del Ministerio de Salud. En este sentido equipara estos productos a los medicamentos de venta libre.99 En su capítulo XV, de la vigilancia, el control, las medidas de seguridad y las sanciones, señala que estos temas se regularán por el Decreto 2092 de 1986, o las normas que lo sustituyan, modifiquen o aclaren. En su artículo 94, señala que “En todo lo no previsto en el presente Decreto para los Registros Sanitarios, se aplicarán supletoriamente las disposiciones consagradas en el Decreto 2092 de 1986, o los que lo modifiquen, adicionen o sustituyan.” Por último, en su artículo 95 concede un plazo de un año, contado a partir de su publicación, para que las personas interesadas se ajusten a las disposiciones contempladas en él. 2.4.3. Resolución 5078 de 1990. En 1990, en cumplimiento de lo establecido en el artículo 8 de la Ley 10 de 1990, y con el fin de adoptar las normas técnico 99 Decreto 2092 de 1986, artículo 53. 101 administrativas en materia de medicinas tradicionales y terapéuticas alternativas, y de crear el Consejo Asesor para la conservación y el desarrollo de las mismas, el Ministerio de Salud expide la Resolución 5078 de 1990. En sus consideraciones, esta resolución señala que “es necesario establecer normas técnicas administrativas que se adecuen al carácter multiétnico y pluricultural de nuestro país y fomentar la interculturalidad, la participación social, la investigación y la interdisciplinariedad en todos los campos, que tienen relación directa o indirecta con las Medicinas Tradicionales y con las Terapéuticas Alternativas.” En su artículo primero, define como culturas médicas tradicionales “el conjunto de conocimientos, creencias, valores, actitudes y comportamientos que se acostumbran ancestralmente en nuestras comunidades, para la prevención, el diagnóstico, el tratamiento y la explicación de las enfermedades.” Define así mismo terapéuticas alternativas, como “el conjunto de procedimientos terapéuticos derivados de las diversas culturas médicas existentes en el mundo, empleados para la prevención, tratamiento, rehabilitación y explicación de las enfermedades.” 102 En su artículo segundo, señala que corresponde al Ministerio de Salud, incentivar la investigación, la recuperación, el respeto y la revalorización de las culturas médicas tradicionales y de las terapéuticas alternativas; brindar información adecuada sobre las distintas concepciones y métodos terapéuticos de las diversas culturas médicas; propiciar los diálogos entre los servicios de salud y la comunidad, con el fin de adecuar los servicios asistenciales a las particularidades culturales y sociales de cada región; diseñar e implementar mecanismos de interacción entre los servicios institucionales de salud, las culturas médicas tradicionales y las terapéuticas alternativas, sin menoscabo de ninguno de ellos, para la prestación de los servicios, especialmente en el primer nivel de atención. En los términos de su artículo sexto, “El Ministerio de Salud, fomentará la realización de eventos en que se examinen las experiencias de desarrollo de las Culturas Médicas Tradicionales y de las Terapéuticas Alternativas, los procesos de fundamentación académicos, de reconocimiento y legitimación social que han tenido lugar, las legislaciones que regulen su ejercicio, así como el uso de productos naturales.” (subrayas fuera del texto) Por medio de esta resolución se crea el Comité Asesor para el Desarrollo de las Culturas Médicas Tradicionales y de las Terapéuticas Alternativas100, y se le asigna 100 De acuerdo con el artículo séptimo de esta resolución, este comité está conformado por el Ministro de Salud, un representante del Instituto Colombiano de Antropología, un representante de cada una de las organizaciones indígenas de carácter nacional, un representante de las agremiaciones de médicos practicantes de las terapéuticas alternativas, un representante de las agremiaciones de homeópatas, un representante de las 103 competencia para proponer las políticas, estrategias y programas para la promoción y el desarrollo de las culturas médicas tradicionales y de las terapéuticas alternativas; proponer las competencias técnicas necesarias para la formación del personal en ese campo, una reglamentación sobre aspectos éticos atinentes al ejercicio de esas disciplinas, y mecanismos de control de calidad de los servicios y de las sustancias terapéuticas empleadas. 2.4.4. Decreto 2780 de 1991. En 1991, por medio del Decreto 2780, se modifica parcialmente el Decreto 2333 de 1982, en lo relacionado con la expedición de licencias sanitarias de las fábricas, depósitos y expendios de alimentos, así como con la expedición, ampliación, modificación, suspención y cancelación de registros sanitarios para la producción, importación, exportación y comercialización de alimentos. 2.4.5. Ley 100 de 1993. En la Ley 100 de 1993, que crea el sistema de seguridad social integral, se adoptan algunas disposiciones que tienen relación con la materia objeto de este trabajo. Por medio de su artículo 245, se crea el Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima, como un establecimiento público del orden facultades de ciencias de la salud, un delegado de la subdirección de servicios asistenciales de la Dirección General Técnica del Ministerio de Salud, y un delegado de la Subdirección de Recursos Humanos de dicho 104 nacional, adscrito al Ministerio de Salud, con personería jurídica, patrimonio independiente y autonomía administrativa, que tiene por objeto ejecutar las políticas en materia de vigilancia sanitaria, control de calidad de medicamentos, alimentos, productos naturales homeopáticos y otros que puedan tener impacto en la salud individual o colectiva. En este artículo, se ordena al Gobierno Nacional reglamentar el régimen de registros y licencias sanitarias, y el régimen de vigilancia sanitaria y control de calidad de los productos cuya vigilancia y control corresponde al Invima. Así mismo, traslada las facultades para la formulación de la política de regulación de precios de los medicamentos que correspondía al Ministerio de Desarrollo Económico,101 para que en adelante esté a cargo de la Comisión Nacional de Precios de Medicamentos, creada por esa misma ley.102 En su artículo 248 numeral 7, el Congreso de la República, de conformidad con lo previsto en el ordinal 10 del artículo 150 de la Constitución Política, revistió de facultades extraordinarias al Presidente de la República para precisar las funciones organismo. 101 De acuerdo con la Ley 81 de 1987. 102 En los términos del parágrafo del artículo 245 de la Ley 100 de 1993, se crea la Comisión de Precios de Medicamentos, como un organismo compuesto, en forma indelegable, por los Ministros de Desarrollo Económico y de Salud, y un delegado del Presidente de la República. 105 del Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima, y proveer su organización básica. 2.4.6. Decreto 2269 de 1993. Por medio del Decreto 2269 de 1993, se organiza el sistema nacional de normalización, certificación y metrología, con el fin “de promover en los mercados la seguridad, la calidad y la competitividad del sector productivo o importador de bienes y servicios y proteger los intereses de los consumidores.” De conformidad con este decreto, las normas técnicas son los documentos establecidos por consenso y aprobados por un organismo reconocido, que suministran para uso común y repetido, reglas, directrices y características para las actividades o sus resultados, encaminados al logro del grado óptimo de orden en un contexto dado. Las normas técnicas se deben basar en los resultados consolidados de la ciencia, la tecnología y la experiencia; y su objetivo corresponde a la obtención de beneficios óptimos para la comunidad.103 Así mismo, este decreto establece que la entidad reconocida por el Gobierno Nacional para la elaboración, adopción y publicación de las normas técnicas 103 Decreto 2269 de 1993, artículo 2 literal b). 106 nacionales y la adopción como tales de las normas elaboradas por otros entes, es el Instituto Colombiano de Normas Técnicas, Icontec. De acuerdo con el artículo 6° de este decreto, el Consejo Nacional de Normas y Calidades puede conferir carácter oficial obligatorio a una norma técnica colombiana, total o parcialmente, cuando contemple aspectos relacionados con materiales, productos o procedimientos que constituyan un riesgo para la seguridad, la protección de la vida y la salud humana, así como la prevención de prácticas que puedan inducir a error. En su artículo 7°, señala que los productos sometidos al cumplimiento de una norma técnica colombiana obligatoria, deben cumplir con ésta independientemente de que se produzcan en Colombia o se importen. Adicionalmente, los productos importados para ser comercializados en Colombia, deben cumplir con las normas técnicas obligatorias en el país de origen. 2.4.7. Decreto 374 de 1994. Con el fin de reglamentar la expedición de las licencias y registros sanitarios de medicamentos, cosméticos, preparaciones farmacéuticas a base de productos naturales, productos homeopáticos, materiales odontológicos e insumos para la salud, se expide en 1994 el Decreto 374. 107 108 Aun cuando este decreto modifica el Decreto 2092 de 1986, en lo relacionado con los medicamentos, y señala que la expedición de los registros sanitarios de las preparaciones farmacéuticas con base en productos naturales se adelantará de acuerdo con la normatividad especial expedida por el Gobierno Nacional,104 a continuación realizaremos una breve exposición de sus principales disposiciones, pues, en los términos del artículo 94 del Decreto 1524 de 1990, en lo no previsto en él se deben aplicar supletoriamente “las disposiciones consagradas en el Decreto 2092 de 1986, o los que lo modifiquen, adicionen o sustituyan.” En su artículo 1°, el Decreto 374 de 1994, señala el carácter de orden público que tienen sus disposiciones, por estar relacionadas con la salud que es un bien de interés público. Para estos efectos establece expresamente que son de orden público las normas “que regulan todas las actividades relacionadas con la producción, procesamiento, importación y exportación de medicamentos, cosméticos, preparaciones farmacéuticas a base de productos naturales, productos homeopáticos, materiales odontológicos e insumos para la salud, así como las condiciones técnico sanitarias y de calidad de los productos sujetos a registro y de los establecimientos que los elaboran.” 104 No obstante esto, en su capítulo cuarto, el Decreto 374 de 1994, señala que, entre tanto, los registros sanitarios de estas preparaciones, se continuarán otorgando con arreglo a las normas legales vigentes sobre la materia, es decir, con arreglo al Decreto 1524 de 1990. Por otra parte, establece expresamente que los medicamentos pueden comercializarse bajo los esquemas de venta libre, y de fórmula médica o control especial.105 En este mismo artículo, el Decreto 374 de 1994, consagra una serie de definiciones que permiten interpretar con mayor claridad las normas sanitarias. Por ejemplo, establece que se entiende por buenas prácticas de manufactura, las normas, procedimientos y procesos de carácter técnico que aseguran la calidad de los productos farmacéuticos; define licencia sanitaria de funcionamiento, como el documento público expedido por el Ministerio de Salud o su autoridad delegada, a un establecimiento farmacéutico o laboratorio que garantiza bajo la responsabilidad del titular, las condiciones técnico sanitarias para la producción o elaboración de medicamentos o cosméticos o productos sujetos a registro sanitario; medicamento, como el “preparado farmacéutico obtenido a partir de principios activos con o sin substancias auxiliares, presentado bajo una forma farmacéutica, que se utilice para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de la enfermedad.”; preparaciones farmacéuticas con base en productos naturales, como aquellas “preparaciones elaboradas con material vegetal, animal o mineral, bajo una forma farmacéutica, cuyo empleo se fundamenta en una tradición de uso terapéutico, y que no se preparan a partir de principios activos aislados. 105 Decreto 374 de 1994, artículo 1. Estos 109 productos sólo podrán ser administrados por vía oral o tópica.”(subrayas fuera del texto); registro sanitario, como el documento público expedido por el Ministerio de Salud o su autoridad delegada, por medio del cual se autoriza a una persona natural o jurídica para producir y/o comercializar un producto, previa verificación de las normas técnico sanitarias; seguridad, como la característica de un medicamento por la cual puede usarse sin mayores posibilidades de causar efectos tóxicos injustificables; y toxicidad, como la capacidad de producir directamente una lesión o daño sobre un órgano o sistema. En los términos del artículo 4° de este decreto, todos los medicamentos, cosméticos, preparaciones farmacéuticas elaboradas con base en productos naturales, productos homeopáticos e insumos para la salud, y todos aquellos productos farmacéuticos que incidan en la salud individual o colectiva, requieren registro sanitario expedido por el Ministerio de Salud o su autoridad delegada, para su importación, exportación, fabricación y venta. En su artículo 5°, establece que “Todos los establecimientos o laboratorios donde se fabriquen, preparaciones procesen o farmacéuticas elaboren medicamentos, drogas, a de naturales, base productos cosméticos, productos homeopáticos, materiales odontológicos e insumos para la salud, requieren para su 110 funcionamiento de licencia sanitaria expedida por el Ministerio de Salud o su autoridad delegada.”106 En su capítulo segundo, regula lo relacionado con las licencias sanitarias de funcionamiento. En él establece que los establecimientos fabricantes de los productos señalados en ese decreto deben ceñirse “a las buenas prácticas de manufactura vigentes, en el caso de los medicamentos, y a las normas técnicas de fabricación, en el caso de los demás productos, expedidas por el Ministerio de Salud.”107 Las licencias se expiden por un término de cinco (5) años, previa visita de inspección, renovables por periodos iguales, cuando el titular ha cumplido con los requisitos exigidos para su expedición. Si el Ministerio de Salud, en ejercicio de sus facultades de inspección, vigilancia y control, o su autoridad delegada, encuentra posteriormente que el titular ha incumplido con las condiciones técnico sanitarias y las normas legales vigentes, procederá a aplicar las medidas sanitarias y sanciones a las que haya lugar.108 106 En su artículo 6°, el decreto permite al Ministerio de Salud delegar la expedición de licencias sanitarias de funcionamiento y registros sanitarios en las direcciones seccionales y distritales de salud, que demuestren disponer de los recursos tecnológicos y humanos para realizar esta función. 107 Decreto 374 de 1994, artículo 8. De conformidad con el artículo 9° de este decreto, el interesado en obtener una licencia sanitaria de funcionamiento debe solicitar a cualquiera de las entidades acreditadas por el Ministerio de Salud, la certificación sobre el cumplimiento de las buenas prácticas de manufactura vigentes o de las normas técnicas de fabricación, según sea el caso. 108 Decreto 374 de 1994, artículo 11. 111 112 En su capítulo tercero, regula lo relacionado con los registros sanitarios de medicamentos. En él distingue entre registros sanitarios para medicamentos incluidos en las normas farmacológicas establecidas por el Gobierno Nacional, y registros sanitarios para medicamentos nuevos109. Para la expedición del registro sanitario de los medicamentos contenidos en las normas farmacológicas, es necesario contar con una evaluación farmacéutica110 y con una evaluación legal111. En los términos del artículo 18, éstos registros pueden expedirse bajo las modalidades de fabricar y vender; importar y vender; importar, envasar y vender; importar, semielaborar y vender; fabricar y exportar; y semielaborar y exportar. 109 Según el artículo 1° del Decreto 374 de 1994, se entiende por medicamento nuevo, “aquel cuyo principio activo no ha sido incluido en el Manual de Normas Farmacológicas, o aquel que, estando incluido en ellas, corresponda a nuevas combinaciones, a dosis fija, o a nuevas indicaciones, nuevas formas farmacéuticas, modificaciones que impliquen cambios en la farmacocinética, cambios en la vía de administración o en las condiciones de comercialización. Incluye también las sales o ésteres no contemplados en los textos reconocidos científicamente.” 110 De acuerdo con el artículo 15 del Decreto 374 de 1994, la evaluación farmacéutica “tiene por objeto conceptuar sobre la idoneidad técnica del fabricante, del proceso de fabricación y de la calidad del producto.” La evaluación farmacéutica es realizada por entidades acreditadas por el Ministerio de Salud. Estas pueden visitar la planta de producción para verificar los aspectos y efectuar los controles de calidad que consideren pertinentes. Si el resultado de la evaluación es negativo, el interesado debe realizar las acciones recomendadas por la entidad competente y solicitar una nueva evaluación. 111 De acuerdo con el artículo 18 del Decreto 374 de 1994, “la evaluación legal comprende el estudio jurídico de la documentación que se acredita por parte del interesado para la concesión del registro y su conformidad con las normas legales que regulan dichas materias.” Dentro de los requisitos exigidos para esta evaluación está el de adjuntar un certificado expedido por la Superintendencia de Industria y Comercio en el que conste que la marca no está registrara ni solicitada por un tercero, o en caso de que el titular sea un tercero, autorización para el uso de la misma. Para el registro sanitario de los medicamentos nuevos, debe contarse, al igual que en el caso anterior, con una evaluación farmacéutica y con una evaluación legal, y adicionalmente con una evaluación farmacológica.112 En los términos del artículo 24 de este decreto, para obtener el registro de medicamentos importados, éstos deben cumplir con los mismos requisitos de calidad exigidos a los productos de fabricación nacional. En cuanto a la información y publicidad de los medicamentos, el decreto señala que toda la información científica, promocional o publicitaria relacionada con medicamentos, debe efectuarse con arreglo a las condiciones del registro sanitario y a las normas técnicas y legales vigentes. Señala también que los titulares del registro y los directores científicos y técnicos son responsables de las modificaciones y transgresiones en el contenido de los materiales objeto de promoción o publicidad, y de las consecuencias que de ello se deriven para la salud individual o colectiva. 112 La evaluación farmacológica, según el artículo 21 del Decreto 374 de 1994, “Comprende el procedimiento mediante el cual, la autoridad sanitaria se forma un juicio sobre la utilidad, conveniencia y seguridad de un medicamento. La evaluación farmacológica es función privativa de la ‘ Comisión Revisora’ establecida por el Ministerio de Salud según las normas vigentes. Esta comisión debe analizar y conceptuar teniendo en cuenta las siguientes características del producto: eficacia, seguridad, dosificación, indicaciones, contraindicaciones, interacciones y advertencias, relación beneficio – riesgo, toxicidad, farmacocinética, condiciones de comercialización y restricciones especiales.” 113 Por último, en su capítulo sexto, el Decreto 374 de 1994, establece las disposiciones aplicables para determinar la responsabilidad de los titulares y fabricantes de los productos en él regulados, las medidas sanitarias de seguridad, los procedimientos y las sanciones correspondientes. 2.4.8. Decreto Ley 1290 de 1994. En 1994, por medio del Decreto Ley 1290, en ejercicio de las facultades extraordinarias conferidas por el numeral 7 del artículo 248 de la Ley 100 de 1993,113 con el fin de centralizar la ejecución de las políticas formuladas por el Ministerio de Salud en materia de vigilancia sanitaria y de control de calidad de los productos señalados en el artículo 245 de la Ley 100 de 1993, entre los que se encuentran los medicamentos, los productos naturales y homeopáticos, se organiza el Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima.114 El artículo 4° de este decreto, asigna competencia al Invima para controlar y vigilar la calidad y seguridad de los productos establecidos en el artículo 245 de la Ley 100 de 1993 arriba mencionado, durante todas las actividades asociadas con su producción, importación, comercialización y consumo; expedir las licencias sanitarias de funcionamiento y los registros sanitarios, así como la renovación, 113 El artículo 248 de la Ley 100 de 1993 dispone: “De conformidad con lo previsto en el ordinal 10 del artículo 150 de la Constitución Política, revístase al Presidente de la República de precisas facultades extraordinarias por el término de seis (6) meses, contados desde la fecha de publicación de la presente Ley para: … 7. Precisar las funciones del Invima y proveer su organización básica. Facúltase al Gobierno Nacional para efectuar los traslados presupuestales necesarios que garanticen el adecuado funcionamiento de la entidad.” 114 Creado por medio del artículo 245 de la Ley 100 de 1993. 114 ampliación, modificación y cancelación de los mismos; identificar y evaluar las infracciones a las normas sanitarias y procedimientos establecidos, y adelantar las investigaciones que sean del caso; aplicar las medidas de seguridad sanitaria y las sanciones que sean de su competencia; adelantar, cuando se considere conveniente, las visitas de inspección y control a los establecimientos productores y comercializadores de los productos señalados en el artículo 245 de la Ley 100 de 1993;115 autorizar la publicidad que se dirija a promover la comercialización y consumo de los productos establecidos en dicho artículo; y otorgar visto bueno a la importación y exportación de los productos de su competencia, previo cumplimiento de los requisitos establecidos en las normas vigentes. De conformidad con este decreto, la dirección del Invima está a cargo de una junta directiva y de un director general.116 Por otra parte, este decreto confiere el carácter de órgano consultivo del Invima, a la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, creada por el Decreto 981 de 1975.117 115 Como arriba se mencionó, entre éstos productos se encuentran los medicamentos, los productos naturales y homeopáticos. 116 117 Decreto 1290 de 1994, artículo 5°. De acuerdo con el artículo 10 del Decreto 1290 de 1994, la Comisión Revisora conserva las funciones señaladas en las disposiciones legales vigentes, entre las que se cuenta la emisión de conceptos para la expedición, ampliación o modificación de registros sanitarios, relacionados con los productos establecidos en el artículo 245 de la Ley 100 de 1993. 115 116 2.4.9. Decreto 677 de 1995. En desarrollo del Decreto Ley 1290 de 1994, y con el fin de reglamentar el régimen de registros y licencias, control de calidad y vigilancia sanitaria de medicamentos, cosméticos, preparaciones farmacéuticas a base de recursos naturales, entre otros, en lo relativo a su producción, procesamiento, envase, expendio, importación, exportación y comercialización, se expide en 1995 el Decreto 677.118 Este decreto está organizado en ocho títulos, a saber, disposiciones generales y definiciones; régimen de las licencias sanitarias de funcionamiento para los establecimientos fabricantes de medicamentos, preparaciones farmacéuticas a base de recursos naturales, cosméticos, productos de aseo, higiene y limpieza y otros productos de uso doméstico; disposiciones generales del régimen del registro sanitario; envases, etiquetas, rótulos, empaques, nombres y publicidad; control de calidad; disposiciones comunes a los registros sanitarios; revisión oficiosa de los registros sanitarios; y régimen de control y vigilancia sanitaria, medidas sanitarias de seguridad, procedimientos y sanciones. 2.4.9.1 Titulo I. Disposiciones Generales. En este título se definen las preparaciones farmacéuticas elaboradas con base en recursos naturales, como “aquellas producidas a base de recursos naturales que tradicionalmente han sido utilizados en forma empírica con fines terapéuticos y a través de este uso y por la sustentación bibliográfica, se consideran eficaces y seguros.” (subrayas fuera del texto) Se definen también, como buenas prácticas de manufactura, “las normas, procesos y procedimientos de carácter técnico que aseguran la calidad de los medicamentos, los cosméticos y las preparaciones farmacéuticas a base de recursos naturales.” (subrayas fuera del texto) En lo relativo a las preparaciones farmacéuticas elaboradas con base en recursos naturales el decreto es rico en definiciones. Por ejemplo, define centro de acopio de recursos naturales, establecimiento distribuidor de preparaciones farmacéuticas y recursos naturales; establecimiento expendedor de preparaciones farmacéuticas y recursos naturales; establecimiento fabricante de preparaciones farmacéuticas a base de recursos naturales; estado bruto de los recursos naturales; excipiente, lista básica de recurso natural de uso medicinal; preparaciones farmacéuticas a base de farmacéutica a base de recursos naturales; recursos modificaciones en las naturales; preparación preparación farmacéutica a base de recursos naturales, de uso bajo prescripción médica; y recurso natural. 118 De conformidad con lo dispuesto en el artículo 148 del Decreto 677 de 1995, por medio de este decreto se modifica en lo pertinente el Decreto 2092 de 1986, y se derogan expresamente los Decretos 713 de 1984, 1524 117 118 En este título el decreto señala la competencia del Ministerio de salud para establecer las políticas en materia sanitaria de los productos en él señalados, del Instituto Nacional de Medicamentos y Alimentos, Invima, para la ejecución de las políticas de vigilancia sanitaria y control de calidad, y de las entidades territoriales, a través de las direcciones seccionales, distritales o municipales de salud, para ejercer la vigilancia y control sanitarios.119 En desarrollo del numeral 9 del artículo 4°120 y del artículo 21121 del Decreto 1290 de 1994, el artículo 5 del Decreto 677 de 1995, permite al Invima, autorizar a las entidades públicas, una vez verificada su idoneidad técnica, científica y administrativa, para realizar estudios técnicos, inspecciones y comprobaciones analíticas necesarias, previas al otorgamiento de los registros sanitarios y las licencias de funcionamiento. 2.4.9.2 Título II. Del Régimen de las Licencias Sanitarias de Funcionamiento para los establecimientos fabricantes de medicamentos, preparaciones farmacéuticas a base de recursos naturales, cosméticos, de 1990 y 374 de 1994, y las demás disposiciones que le sean contrarias. 119 Decreto 677 de 1995, artículo 3°. 120 De acuerdo con esta norma, corresponde al Invima “Promover, apoyar y acreditar instituciones para la realización de evaluaciones farmacéuticas y técnicas, así como laboratorios de control de calidad, asesorarlos y controlar su operación de acuerdo con las normas vigentes, sin perjuicio de lo que en materia de control deban adelantar las entidades territoriales.” 121 De acuerdo con el artículo 21 del Decreto 1290 de 1994, “El Invima adelantará, excepcionalmente, los estudios técnicos requeridos para la expedición de los registros sanitarios.” productos de aseo, higiene y limpieza y otros productos de uso doméstico. En su artículo 6°, el decreto señala que los establecimientos fabricantes de los productos a los que él hace referencia, deben contar con una licencia sanitaria de funcionamiento expedida por el Invima o la autoridad delegada por éste. Para estos efectos, dichos establecimientos deben ceñirse a las buenas prácticas de manufactura, en el caso de los medicamentos y de las preparaciones farmacéuticas a base de recursos naturales. Para obtener la licencia sanitaria de funcionamiento, el interesado debe solicitar al Invima o a la entidad acreditada, la certificación del cumplimiento de las buenas prácticas de manufactura, que implica una visita de inspección a las instalaciones del establecimiento, en todos los eventos, a diferencia de lo previsto en el Decreto 374 de 1994 en el que esta visita era facultativa. Si en la visita se establece que el establecimiento no cumple con las buenas prácticas de manufactura, el interesado debe realizar las acciones recomendadas por el Invima o la entidad acreditada, según sea el caso, y solicitar una nueva certificación de cumplimiento, para lo cual debe realizarse una nueva visita de inspección. Si el resultado de la nueva visita es positivo, se expide la certificación. Expedida la certificación y pagados los derechos de expedición y publicación respectivos, el Invima se pronuncia sobre la expedición de la licencia sanitaria de funcionamiento.122 122 En los términos del artículo 10 del Decreto 677 de 1995, las licencias sanitarias de funcionamiento tienen una vigencia de diez (10) años, a partir de la notificación del acto administrativo por el que se conceden. No obstante esto, si en ejercicio de las facultades de inspección, vigilancia y control, la autoridad sanitaria 119 120 2.4.9.3 Título III. Disposiciones Generales del Régimen del Registro Sanitario. De conformidad con el artículo 13 del Decreto 677 de 1995, la producción, importación, exportación, procesamiento, envase, empaque, expendio y comercialización de medicamentos y preparaciones farmacéuticas a base de recursos naturales, requieren registro sanitario expedido por el Instituto nacional de Vigilancia de Medicamentos y Alimentos, Invima, o por la autoridad sanitaria delegada. El registro sanitario puede otorgarse en las modalidades de fabricar y vender;123 importar y vender; importar, envasar y vender; importar, semielaborar y vender; y semielaborar y vender. El registro tiene una vigencia de diez (10) años, contados a partir de la ejecutoria del acto administrativo por medio del cual se otorga.124 El capítulo I de este título, regula el registro sanitario de los medicamentos. competente encuentra, posteriormente, que el establecimiento no cumple con las condiciones técnicas y sanitarias y las normas legales vigentes, aplicará las medidas de seguridad y las sanciones a que haya lugar. 123 De acuerdo con el parágrafo 1° del artículo 14 del Decreto 677 de 1995, la modalidad de fabricar y vender comprende de por sí la posibilidad de exportar. De esta manera se modifica lo previsto en el artículo 18 del Decreto 374 de 1994, pues en él se preveía la necesidad de obtener un registro sanitario independiente para la modalidad de fabricar y vender y otro para la modalidad de fabricar y exportar. 124 Decreto 677 de 1995, artículo 16. De conformidad con el artículo 18 de este decreto, las modificaciones de los registros sanitarios requerirán en todos los casos de acto administrativo previo, expedido por el Invima o la autoridad delegada. El capítulo II, regula el registro sanitario de las preparaciones farmacéuticas a base de recursos naturales, derogando de esta forma la regulación anterior, contenida en el Decreto 1524 de 1990. De conformidad con el artículo 32 del Decreto 677 de 1995, los requisitos y trámite del registro sanitario son diferentes, según se trate de preparaciones farmacéuticas elaboradas con base en recursos naturales incluidos en la lista básica oficialmente aceptada, y aquellas elaboradas con recursos naturales que no lo están.125 En los términos del parágrafo de este artículo, las preparaciones farmacéuticas elaboradas a base de recursos naturales incluidos en la lista básica aceptada, que al momento de su expedición estuvieran siendo comercializadas sin tener registro, debían adecuarse a lo previsto en el capítulo II al que estamos haciendo referencia, en un término no mayor de dieciocho (18) meses; y las preparaciones farmacéuticas a base de recursos naturales no incluidos en la lista básica, debían adecuarse a lo en él previsto en un término no mayor de seis (6) meses, contados a partir de la vigencia del decreto, es decir, a partir del 28 de abril de 1995, fecha en la que fue publicado. Si vencido ese plazo los productores, importadores o comercializadores habían 125 no radicado la solicitud de registro sanitario De acuerdo con el artículo 2 del Decreto 677 de 1995, la “Lista básica de recurso natural de uso medicinal: Es el listado de recursos naturales de uso medicinal, aprobado por el Ministerio de Salud con criterios de seguridad y eficacia.” 121 correspondiente, las autoridades sanitarias competentes quedaban facultadas para imponerles las medidas de seguridad y las sanciones previstas en él. De acuerdo con el artículo 33 del decreto, el Ministerio de Salud debe actualizar la lista básica de recursos naturales y los usos aceptados, y el listado de los que tienen una toxicidad comprobada o son potencialmente tóxicos. La lista se revisará y modificará periódicamente en forma automática, cuando se acepte un nuevo recurso natural o se rechace uno ya aceptado o una modificación de uso, previo concepto de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva. Para la expedición del registro sanitario de este tipo de preparaciones farmacéuticas debe contarse con una evaluación farmacéutica y una evaluación legal. La evaluación farmacéutica tiene por objeto conceptuar sobre la capacidad técnica del fabricante del proceso de fabricación y de la calidad del producto.126 La evaluación legal comprende el estudio jurídico de la documentación aportada por el interesado 126 Decreto 677 de 1995, artículo 35. Si se trata de plantas, para estos efectos el interesado debe presentar, entre otra información, un certificado de inscripción y clasificación botánica del recurso natural utilizado, expedido por uno de los herbarios oficialmente reconocidos. De acuerdo con el artículo 37, el procedimiento para la evaluación farmacéutica de estas preparaciones es el mismo previsto para los medicamentos, y consiste fundamentalmente en la evaluación de la información presentada por el solicitante, de acuerdo con los requisitos en él previstos, por parte del Invima o la entidad autorizada, la visita potestativa del Invima o la entidad autorizada a la planta de producción para verificar la información, tomar muestras para análisis y control de calidad. En caso de que la evaluación farmacéutica resulte negativa, el solicitante debe realizar las acciones recomendadas y presentar una nueva solicitud. Si resulta positiva, el Invima o la entidad delegada debe comunicarlo por escrito al solicitante. 122 para la concesión del registro y su conformidad con las normas legales que regulan la materia.127 El trámite del registro sanitario de las preparaciones farmacéuticas elaboradas con base en recursos naturales incluidos en la lista básica oficialmente aceptada, es el mismo previsto para el registro sanitario de los medicamentos.128 Es decir, el interesado debe solicitar al Invima la realización de la evaluación farmacéutica; posteriormente debe presentar al Invima o la autoridad delegada la solicitud de registro, acompañada del resultado de la evaluación farmacéutica, y la documentación técnica y legal previstas en el decreto. Si es del caso, el Invima o la autoridad delegada puede solicitar la complementación o aclaración de la información presentada; a continuación el Invima o la autoridad delegada deben conceder o negar el registro sanitario por medio de acto administrativo. El trámite del registro sanitario de las preparaciones farmacéuticas a base de recursos naturales no incluidos en la lista básica oficialmente aceptada, requiere además una evaluación de la sustentación histórica de los recursos utilizados.129 Esta evaluación “Comprende el procedimiento mediante el cual la autoridad sanitaria se forma un juicio sobre la utilidad, conveniencia y seguridad del recurso 127 Decreto 677 de 1995, artículo 38. La información que debe presentar el interesado para la evaluación legal es la misma que debe presentar el interesado para la expedición de un registro sanitario de medicamentos. 128 Decreto 677 de 1995, artículo 39. 129 Decreto 677 de 1995, artículo 40. 123 natural a ser utilizado en una preparación farmacéutica.”130 La evaluación para la sustentación histórica es función privativa de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva, la cual, para todos los efectos, debe citar a expertos en el área, designados por el Invima. La mencionada evaluación debe adelantarse teniendo en cuenta la eficacia, seguridad, uso tradicional, dosificación, indicaciones, contraindicaciones, interacciones y advertencias del respectivo recurso. Para emitir el concepto técnico correspondiente, la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva cuenta con un plazo de cuatro (4) meses a partir de la solicitud. Durante este plazo puede requerir por una sola vez al solicitante para que complemente la información presentada o para que aporte estudios adicionales que le permitan formarse un juicio sobre la utilidad, seguridad o conveniencia del recurso natural que se utilizará en estado bruto o en una preparación farmacéutica.131 Si el resultado de la sustentación histórica es positivo y, en consecuencia, la mencionada Comisión Revisora emite concepto favorable para que el recurso natural sea utilizado en estado bruto o en preparaciones farmacéuticas, éste pasará a formar parte de la lista básica. 130 Decreto 677 de 1995, artículo 41. 124 En los términos del artículo 44 del decreto, cuando se trate de registros sanitarios para importar y vender; importar, envasar y vender; o importar, semielaborar y vender, preparaciones farmacéuticas a base de recursos naturales incluidos en la lista básica oficial, debe contarse con una evaluación técnica realizada por el Invima132 y con una evaluación legal; y si se trata de preparaciones farmacéuticas a base de recursos naturales no incluidos en la lista básica oficial, debe contarse además con una evaluación de sustentación histórica.133 Los productos importados deben cumplir los mismos requisitos de calidad exigidos a los productos de fabricación nacional.134 En cuanto a los recursos naturales de uso medicinal en estado bruto deshidratados, sin forma farmacéutica y empacados individualmente (no mezclados) el decreto permite su comercialización con el número de la licencia sanitaria de funcionamiento, es decir, no exige para estos efectos contar con registro sanitario específico. En las etiquetas y empaques correspondientes, prohibe incluir indicaciones o usos terapéuticos.135 131 Decreto 677 de 1995, artículo 42. 132 Para esta evaluación el interesado debe presentar la misma documentación requerida para la evaluación farmacéutica y especificar la calidad de las materias primas, del producto en proceso y del producto terminado, y debe acompañar copia de las etiquetas de envases y empaques, certificado de venta libre del producto expedido por la autoridad sanitaria competente del país de origen o certificación en la cual conste que el producto no es objeto de registro sanitario o autorización similar, porque no es de interés sanitario, y autorización expresa del fabricante al importador para solicitar el registro sanitario a su nombre, utilizar la marca y/o comercializar el producto, según sea el caso. 133 El tema está regulado en los artículos 44 y 45 del Decreto 677 de 1995. 134 Decreto 677 de 1995, artículo 45 parágrafo 3°. 135 Decreto 677 de 1995, artículo 46. 125 126 2.4.9.4 Titulo IV. De los envases, etiquetas, rótulos, empaques, nombres y publicidad. En el capítulo II de este título, se regula lo relacionado con las preparaciones farmacéuticas elaboradas con base en recursos naturales. Los envases de este tipo de preparaciones farmacéuticas, de conformidad con el artículo 80, deben cumplir con los mismos requisitos establecidos para los envases de medicamentos. En consecuencia, deben estar fabricados con materiales que no produzcan reacción física o química con el producto y que no alteren su potencia, calidad y pureza, y deben estar protegidos en su tapa por un sistema de seguridad que se rompa al abrirlos; otorgar el registro. el Invima debe aprobar los envases al momento de El decreto prohibe expresamente, el expendio de estas preparaciones farmacéuticas en envases distintos de los aprobados por el Invima.136 Las etiquetas y empaques de las preparaciones farmacéuticas elaboradas con base en recursos naturales, deben corresponder al contenido y naturaleza de éstas y contener el nombre común y científico de la preparación; la forma farmacéutica; la composición cualitativa y la expresión cuantitativa en peso del recurso natural utilizado; el número del registro sanitario; la posología; el nombre del establecimiento fabricante; el nombre del director técnico; el contenido neto del envase; 136 el número del lote; el uso aprobado; Esto se encuentra regulado en los artículos 69 a 71 del Decreto 677 de 1995. las contraindicaciones y advertencias; las condiciones de almacenamiento y la fecha de vencimiento; las leyendas pertinentes (“manténgase fuera del alcance de los niños”, “si los síntomas persisten, consulte a su médico”, “no consumir dosis superiores a las indicadas, “usar bajo supervisión médica durante el embarazo”); y la información adicional que a juicio del Invima sea conveniente. Los productos importados deben llevar las mismas leyendas que los nacionales, en idioma español, y el nombre del importador. La información científica, promocional o publicitaria de las preparaciones farmacéuticas elaboradas con base en recursos naturales, debe corresponder a las condiciones del registro sanitario y a las normas técnicas y legales vigentes. Para ésto no se requiere autorización del Invima. En todo caso, los titulares del registro sanitario son responsables de cualquier transgresión en el contenido de los materiales de promoción y publicidad, y de las consecuencias que de ello se deriven para la salud individual o colectiva. 2.4.9.5 Título V. Del Control de Calidad. Las materias primas, los productos en proceso y los productos terminados de las preparaciones farmacéuticas elaboradas con base en recursos naturales están sujetos a estrictos controles de calidad, que son responsabilidad del titular del registro y del fabricante. El Decreto 677 de 1995, señala los respectivos procesos de control, y faculta al Invima para 127 tomar muestras de tales preparaciones farmacéuticas o del material utilizado como materia prima, para verificar su calidad.137 2.4.9.6 Título VI. Disposiciones Comunes a los Registros Sanitarios. Para la expedición del registro sanitario no es necesario la presentación de muestras del producto; sin embargo, el Invima puede exigirlas en cualquier momento o tomarlas del mercado para los análisis pertinentes.138 Los titulares de los registros sanitarios que pretendan retirar sus productos del mercado, deben informarlo al Invima, con seis (6) meses de anticipación, so pena de la aplicación de las sanciones sanitarias previstas en el decreto.139 De conformidad con este título, las preparaciones farmacéuticas elaboradas con base en recursos naturales de uso bajo prescripción médica, sólo pueden expenderse en farmacias - droguerías, o en establecimientos legalmente autorizados por la autoridad sanitaria competente.140 137 Decreto 677 de 1995, artículo 90. 138 Decreto 677 de 1995, artículo 92. 139 Decreto 677 de 1995, artículo 94. 140 Decreto 677 de 1995, artículo 98. 128 2.4.9.7 Titulo VII. De la revisión oficiosa de los Registros Sanitarios. De acuerdo con el artículo 100 del Decreto 677 de 1995, el Invima puede ordenar en cualquier momento la revisión de un producto amparado con registro sanitario con el fin de determinar si se ajusta a las condiciones en las que se otorgó el registro y a las disposiciones sobre la materia; actualizar, de acuerdo con los avances científicos y tecnológicos, las especificaciones y metodologías analíticas aprobadas en los registros; y tomar medidas inmediatas cuando se conozca información nacional o internacional sobre los efectos secundarios o contraindicaciones en los respectivos productos, detectados durante la comercialización del mismo, que pongan en peligro la salud de quienes los consumen. Para estos efectos, el Invima debe ordenar, mediante resolución motivada, la revisión de oficio de los productos amparados con registro sanitario, previo concepto de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva. La resolución “debe comunicarse a los interesados con el fin de que presenten los estudios, justificaciones técnicas, plan de cumplimiento o los ajustes que consideren del caso, dependiendo de las razones que motiven la revisión”. El Invima puede realizar los análisis del producto que considere procedentes, solicitar informes, conceptos de expertos en la materia, información de autoridades sanitarias de otros países, y cualquier otra medida que considere del caso y tenga relación con las circunstancias que generan la revisión. Con base en lo anterior, y previo concepto de la mencionada Comisión Revisora, el Invima 129 adopta la decisión del caso, mediante resolución motivada que debe notificarse personalmente a los interesados. Si de la revisión se desprende que pueden existir conductas violatorias de las normas sanitarias, el Invima debe adoptar las medidas e iniciar los procesos sancionatorios que considere procedentes. 2.4.9.8 Título VIII. Del Régimen de Control y Vigilancia Sanitaria, las medidas sanitarias de seguridad, procedimientos y sanciones. En este título, desarrollado por medio de los artículos 102 a 145, se reglamenta la Ley 9 de 1979 en lo relativo al control y vigilancia sanitaria, las medidas sanitarias de seguridad, las sanciones y procedimientos correspondientes. En los términos del artículo 102, los titulares de licencias de funcionamiento y registros sanitarios son responsables por la veracidad de la información suministrada y del cumplimiento de las normas sanitarias, así como por “los efectos adversos sobre la salud individual o colectiva que pueda experimentar la población usuaria de los productos, por –la– transgresión de las normas y/o condiciones establecidas”(sic). El artículo 103, otorga competencia al Ministerio de Salud, al Instituto Nacional de Medicamentos y Alimentos, Invima, a las direcciones seccionales y distritales de salud, o a las entidades que hagan sus veces, para ejercer la inspección, vigilancia 130 y control de los establecimientos y productos objeto de regulación en el decreto; para adoptar las medidas de prevención y correctivas necesarias para dar cumplimiento a lo establecido en él y en las demás disposiciones sanitarias aplicables; y para adoptar las medidas sanitarias de seguridad, adelantar los procedimientos y aplicar las sanciones a las que haya lugar. Las medidas sanitarias de seguridad que pueden adoptar las autoridades arriba señaladas, son la clausura temporal, total o parcial, del establecimiento; suspensión total o parcial de actividades o servicios; productos; la el decomiso de objetos o la destrucción o desnaturalización de objetos o productos; y la congelación o suspensión temporal de la venta o empleo de productos y objetos, mientras se toma una decisión definitiva al respecto. Las medidas sanitarias de seguridad tienen por objeto prevenir o impedir que la ocurrencia de un hecho o la existencia de una situación atenten o pongan en peligro la salud individual o colectiva, y se aplican sin perjuicio de las sanciones a las que haya lugar. Para estos efectos, las autoridades sanitarias pueden actuar de oficio o a solicitud de cualquier persona.141 Las autoridades sanitarias sólo pueden imponer sanciones, previo cumplimiento del procedimiento establecido en los artículos 111 y siguientes del decreto. El procedimiento sancionatorio puede iniciarse de oficio o a solicitud o información de 141 Decreto 677 de 1995, artículos 104 a 110. 131 cualquier funcionario público; por denuncia o queja debidamente fundamentada presentada por cualquier persona; o como consecuencia de haber sido aplicada una medida sanitaria de seguridad. El denunciante puede intervenir en el curso del procedimiento para auxiliar al funcionario competente, designado para adelantar la respectiva investigación. Si los hechos materia del procedimiento sancionatorio pueden ser constitutivos de delito, el funcionario que adelante el procedimiento sancionatorio, debe ponerlos en conocimiento de las autoridades penales competentes, acompañando copia de las actuaciones surtidas. La existencia de un proceso penal o civil, no da lugar a la suspensión del procedimiento sancionatorio previsto en el Decreto 677 de 1995. El procedimiento sancionatorio se sujeta a las normas del debido proceso, y en consecuencia, se respeta el derecho de defensa.142 Se consideran circunstancias agravantes de una infracción sanitaria, los efectos dañosos del hecho infractor de las normas sanitarias; cometer la falta sanitaria para ocultar otra; rehuir la responsabilidad o atribuírsela sin razones a otro u otros; e infringir varias disposiciones sanitarias con la misma conducta. Son circunstancias atenuantes, el no haber sido sancionado anteriormente o no haber sido objeto de medida sanitaria de seguridad; procurar por iniciativa propia resarcir el daño causado, antes de la iniciación del procedimiento sancionatorio; e informar la falta 142 Decreto 677 de 1995, artículos 111 a 121. El debido proceso encuentra su fundamento constitucional en el artículo 29 de la Constitución Política de 1991, de conformidad con el cual: “El debido proceso se aplicará a toda clase de actuaciones judiciales y administrativas. “Nadie podrá ser juzgado sino conforme a leyes preexistentes al acto que se le imputa, ante juez o tribunal competente y con observancia de la plenitud de las formas propias de cada juicio… “Toda persona se presume inocente, mientras no se le haya declarado judicialmente culpable. Quien sea sindicado tiene derecho a la defensa; … a un debido proceso público, sin dilaciones injustificadas; a presentar pruebas, y a controvertir las que se alleguen en su contra; a impugnar la sentencia condenatoria, y a no ser juzgado dos veces por el mismo hecho. “Es nula, de pleno derecho, la prueba obtenida con violación del debido proceso.” 132 voluntariamente a las autoridades sanitarias, antes de que se produzca el daño a la salud individual o colectiva.143 Las sanciones deben imponerse mediante resolución motivada, expedida por la autoridad sanitaria competente, que debe notificarse personalmente al afectado o a su representante legal o apoderado, para que pueda interponer los recursos de reposición y apelación procedentes.144 Las sanciones pueden consistir en amonestación, multas, decomiso, suspensión o cancelación del registro sanitario o de la licencia sanitaria de funcionamiento, o en el cierre temporal o definitivo del establecimiento, laboratorio farmacéutico o edificación.145 El cumplimiento de las sanciones, no exime al infractor de la ejecución de las obras o medidas sanitarias ordenadas por la autoridad sanitaria competente. La amonestación “consiste en la llamada de atención que se hace por escrito, a quien ha violado cualquiera de las disposiciones sanitarias sin que dicha violación 143 Decreto 677 de 1995, artículo 122. 144 Decreto 677 de 1995, artículo 124. 133 implique riesgo para la salud o la vida de las personas y tiene por finalidad hacer ver las consecuencias del hecho, de la actividad o de la omisión y tendrá como consecuencia la conminación.”146 (sic) La multa “consiste en la sanción pecuniaria que se impone a una persona natural o jurídica por la ejecución de una actividad u omisión de una conducta que acarrea la violación de las disposiciones sanitarias vigentes.”147 El decomiso de los productos “consiste en su incautación definitiva cuando se compruebe que no cumple las disposiciones sanitarias y con ello se atente contra la salud individual o colectiva.148 La suspensión y la cancelación de la licencia sanitaria de funcionamiento o del registro sanitario, según sea el caso, consisten en la privación temporal o definitiva, respectivamente, de los derechos conferidos por la licencia o el registro, por 145 Decreto 677 de 1995, artículo 125. Este artículo desarrolla el Decreto - Ley 1290 de 1994. 146 Decreto 677 de 1995, artículo 126. De acuerdo con el artículo 127, son competentes para amonestar el Invima o la dirección de salud delegada o la entidad que haga sus veces. 147 Decreto 677 de 1995, artículo 128. De acuerdo con el artículo 129, según la naturaleza y calificación de la falta, la autoridad sanitaria competente, por medio de resolución motivada puede imponer multas hasta por la suma de diez mil (10.000) salarios mínimos legales diarios vigentes al momento de dictarse la resolución. 148 Decreto 677 de 1995, artículo 131. En los términos de los artículos 132 y 133, el decomiso debe ordenarse por la autoridad sanitaria competente, mediante resolución motivada; de la diligencia de decomiso se debe levantar un acta, que en copia se debe entregar a la persona a cuyo cuidado se encontraban los bienes decomisados. 134 haberse incurrido en conductas contrarias a las normas sanitarias.149 A partir de la ejecutoria de la resolución por medio de la cual se impone la suspensión o cancelación de la licencia sanitaria, no pueden desarrollarse actividades en el establecimiento o laboratorio farmacéutico, y en el evento de suspensión o cancelación del registro sanitario, no puede fabricarse ni comercializarse el producto bajo ninguna condición. El cierre temporal o definitivo del establecimiento o laboratorio farmacéutico, consiste en poner fin a las actividades que en ellos se desarrollan, por la existencia de hechos o conductas contrarias a las normas sanitarias, y puede referirse a todo el establecimiento o un área determinada del mismo.150 El cierre definitivo implica la cancelación de la licencia sanitaria de funcionamiento, y el cierre parcial implica que la licencia sanitaria no ampara el área afectada, hasta que no se modifiquen las condiciones que dieron origen a la medida. En los términos del artículo 145 de este decreto, las entidades oficiales deben poner a disposición de las autoridades sanitarias correspondientes, de oficio o a solicitud de éstas, las pruebas relacionadas con conductas, hechos u omisiones que estas últimas estén investigando. 149 Decreto 677 de 1995, artículos 134 y 135. establecerse hasta por el término de un (1) año. Dependiendo de la gravedad de la falta, la suspensión puede 135 136 2.4.10 Decreto 936 de 1996. En ejercicio de las facultades conferidas por el numeral 2° del artículo 7° del Decreto Ley 1290 de 1994, se expide el Decreto 936 de 1996, por el cual se aprueba el Acuerdo 008 de la junta directiva del Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima, que modifica la composición y funciones de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva. La expedición del Acuerdo 008 mencionado, obedeció a la necesidad de que la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico, y demás productos que incidan en la salud individual o colectiva, pudiera conceptuar sobre los productos sometidos a la vigilancia y control sanitario de Invima, de acuerdo con lo dispuesto en el artículo 245 de la Ley 100 de 1993.151 El artículo 2° de este acuerdo, crea las salas especializadas de medicamentos y productos biológicos, de alimentos y bebidas alcohólicas, y de insumos para la salud y productos varios, y las faculta para “estudiar y conceptuar los ajustes, las 150 151 Decreto 677 de 1995, artículo 140. Por medio del artículo 245 de la Ley 100 de 1993, se crea el Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima, como un establecimiento público del orden nacional, adscrito al Ministerio de Salud, con personería jurídica, patrimonio independiente y autonomía administrativa, que tiene por objeto ejecutar las políticas en materia de vigilancia sanitaria, control de calidad de medicamentos, alimentos, productos naturales, homeopáticos, y otros que puedan tener impacto en la salud individual o colectiva. modificaciones y actualizaciones relacionadas con los aspectos científicos, tecnológicos y de normalización”, correspondientes a cada sala. En sus artículos 3°152 y 12 a 19, el Decreto 936 de 1996, establece la forma de designar a los miembros de cada una de las salas especializadas, y las funciones correspondientes a ellas.153 En su artículo 7°, el decreto señala que “La comisión revisora es un órgano asesor, sus decisiones o recomendaciones en caso de no ser acogidas por la dirección general del Invima, serán sometidas a instancia del comité directivo del Invima.” 152 De conformidad con el artículo 3° del Decreto 936 de 1996, las salas especializadas de la Comisión Revisora, estarán constituidas por un número impar de miembros, expertos en cada área, designados por períodos de dos (2) años. No pueden ser miembros de estas salas, las personas vinculadas a la industria de los productos de que trata el artículo 245 de la Ley 100 de 1993, ni las vinculadas a éstas por parentesco de primer grado de consanguinidad, segundo de afinidad o primero civil. 153 De conformidad con el artículo 12 del Decreto 936 de 1996, la sala especializada de alimentos está compuesta por cinco (5) miembros escogidos de ternas presentadas por la Sociedad Colombiana de Ciencia y Tecnología de Alimentos, la Sociedad Colombiana de Nutrición, y la Sociedad Colombiana de Toxicología; un representante escogido de terna conformada por la Asociación Colombiana de Facultades de Ingeniería de Alimentos, la Sociedad Colombiana de Químicos Farmacéuticos y la Sociedad Colombiana de Medicina Veterinaria y Zootecnia; y un representante del Ministerio de Salud designado por el Ministro de Salud. De acuerdo con el artículo 13 del Decreto 936 de 1996, corresponde a esta sala, entre otras funciones, conceptuar sobre las normas de carácter técnico – científico que rijan el registro sanitario, la vigilancia y el control de los alimentos y demás productos de su competencia que puedan tener impacto en la salud individual o colectiva. Por su parte, el artículo 14 del Decreto 936 de 1996, señala que la sala especializada de medicamentos está compuesta por un médico especializado en medicina clínica designado por el Consejo Superior de Instituciones Médicas, un médico o químico farmacéutico especializado en farmacología designado por el Ministerio de Salud, un médico o químico farmacéutico especializado en toxicología designado por la Sociedad Colombiana de Toxicología y la Asociación Colombiana de Toxicología y Farmacodependencia, un químico farmacéutico especializado en farmacología designado por la Sociedad Colombiana de Químicos Farmacéuticos, y un médico o químico farmacéutico especializado en farmacología designado por la Asociación Colombiana de Farmacología. En los términos del artículo 15 del Decreto 936 de 1996, corresponde a la sala especializada de medicamentos, entre otras funciones, llevar a cabo las evaluaciones farmacológicas de los medicamentos nuevos en el país; llevar a cabo la evaluación de la sustentación histórica de las preparaciones farmacéuticas con base en recursos naturales, no incluidos en la lista básica de productos naturales; hacer las recomendaciones necesarias para garantizar una actualización de esta lista; llevar a cabo las evaluaciones que resulten científicamente pertinentes en el proceso de aprobación para su uso, de los productos de su competencia, mientras el país adopta legislaciones permanentes al respecto; proponer la actualización de los requisitos exigidos por el Invima 137 138 Las mencionadas salas, para el cumplimiento de sus funciones, pueden invitar a personas particulares, servidores públicos o a miembros de entidades de reconocida capacidad científica, a sus reuniones, quienes tienen en la respectiva reunión voz, pero no voto; así como consultar a expertos a nivel nacional o internacional, con el fin de complementar la información que ellas consideren necesaria.154 Los conceptos emitidos por los miembros de cada sala, deben ser presentados por escrito, a fin de que se cuente con los antecedentes de cada decisión.155 2.4.11 Resolución 4536 de 1996. En cumplimiento de lo establecido en el artículo 79 del Decreto 677 de 1995,156 y con el fin de reglamentar la publicidad de los medicamentos, se expide en 1996 la Resolución 4536. dentro del proceso de expedición de registro sanitario de los productos farmacéuticos; modificaciones a los procedimientos de vigilancia y control de calidad de los productos de su competencia. 154 Decreto 936 de 1996, artículo 8°. 155 Decreto 936 de 1996, artículo 9°. 156 y proponer El artículo 79 del Decreto 677 de 1995 dispone: “Toda información científica, promocional o publicitaria sobre los medicamentos, deberá ser realizada con arreglo a las condiciones del registro sanitario y a las normas técnicas y legales previstas en el presente decreto. “Los titulares del registro serán responsables de cualquier transgresión en el contenido de los materiales de promoción y publicidad, y de las consecuencias que ello pueda generar en la salud individual o colectiva. “Será función del Invima velar por el cumplimiento de lo aquí previsto, teniendo en cuenta la reglamentación que para el efecto expida el Ministerio de Salud. “Parágrafo 1°. Los medicamentos sólo podrán anunciarse o promocionarse en publicaciones de carácter científico o técnico, dirigidos al cuerpo médico y odontológico. Prohíbese la propaganda de medicamentos en la prensa, la radiodifusión, la televisión, y en general, en cualquier otro medio de comunicación y promoción masiva. Esta prohibición no cobijará a los medicamentos de venta libre. “Parágrafo 2°. En la información o propaganda dirigida al cuerpo médico u odontológico, deberán especificarse las acciones, las indicaciones, usos terapéuticos, contraindicaciones, efectos colaterales, riesgos de administración, los riesgos de farmacodependencia y las otras precauciones y advertencias, sin omitir ninguna de las que figuren en la 139 En el artículo primero de esta resolución, se establecen las definiciones de medicamentos de venta sin fórmula médica y publicidad, en los siguientes términos: (i) Medicamentos de venta sin fórmula médica o populares, son “aquellos productos farmacéuticos que el consumidor puede adquirir sin la mediación del prescriptor y están destinados a la prevención o al tratamiento, alivio de síntomas, signos o enfermedades leves, que son reconocidas adecuadamente por los pacientes y en ciertas enfermedades crónicas, previo entrenamiento y consentimiento por parte del o de los médicos tratantes.” (ii) Publicidad: “es el conjunto de medios empleados para dar a conocer y hacer apreciar las virtudes y ventajas de los medicamentos ofrecidos en venta.” literatura científica o fueren conocidas por los fabricantes. “Parágrafo 3°. La publicidad e información sobre medicamentos deberá ceñirse a la verdad y, por consiguiente, no podrán exagerarse las bondades que pueda ofrecer su uso. “Parágrafo 4°. Prohíbese la publicidad de medicamentos cuando: a. Contraríe las normas generales aplicables en materia de educación sanitaria, nutrición o terapéutica; b. Exprese verdades parciales que induzcan a engaño o error; c. Impute, difame, cause perjuicios o comparación peyorativa para otras marcas, productos, servicios, empresas u organismos. “Parágrafo 5°. Las listas de precios y los almanaques no podrán llevar las indicaciones y los usos de los productos, cuando estos sean de venta bajo fórmula médica. “Parágrafo 6°. Los titulares de registros sanitarios que incurran en alguna de las conductas aquí descritas, serán (sic) sujetos a las medidas y sanciones previstas en el presente Decreto.” De acuerdo con esta resolución, toda publicidad de medicamentos en medios de comunicación masiva 157, debe ser autorizada previamente por el Invima o la autoridad delegada para el efecto. La solicitud es tramitada por el Comité de Publicidad de Medicamentos del Invima, quien debe pronunciarse dentro de los quince (15) días hábiles siguientes.158 “La publicidad e información de los medicamentos debe ceñirse a la verdad y, por consiguiente no pueden exagerarse las bondades que pueda ofrecer su uso.”159 (subrayas fuera del texto) En los términos del artículo séptimo de esta resolución, se prohibe la publicidad de los medicamentos en los siguientes casos: (i) Cuando contraríe las normas generales aplicables en materia de educación sanitaria, nutrición o terapéutica; (ii) Cuando exprese verdades parciales que induzcan a engaño o error. 157 Como cine, radio, televisión y prensa. 158 Resolución 4536 de 1996, artículo tercero. 159 Resolución 4536 de 1996, artículo sexto. 140 (iii) Cuando impute, difame, cause perjuicios o comparación peyorativa para otras marcas, productos, servicios, empresas u organismos. (iv) Cuando tenga por objeto la promoción de los medicamentos de venta bajo fórmula médica, bajo el sistema de premios. (v) Cuando tenga por objeto la promoción de medicamentos de venta bajo fórmula médica en publicaciones distintas a las de carácter científico o técnico, dirigidas al cuerpo médico y odontológico. Así mismo, esta resolución permite la publicidad de los medicamentos de venta libre, sólo para los productos con registro sanitario vigente. La publicidad dirigida al cuerpo médico y odontológico debe especificar las acciones, indicaciones, usos terapéuticos, contraindicaciones, efectos colaterales y advertencias. Por su parte, la publicidad dirigida a los droguistas de medicamentos de venta bajo fórmula médica debe restringirse a informar sobre las casas fabricantes y sus formas farmacéuticas, pero no sus usos y contraindicaciones, con el fin de que éstos no receten a los clientes.160 160 Resolución 4536 de 1996, artículo octavo. 141 142 Los titulares de registros sanitarios que incumplan lo dispuesto en esta resolución están sujetos a la aplicación de las medidas sanitarias de seguridad y sanciones previstas en el Decreto 677 de 1995. 2.4.12 Decreto 341 de 1996. Por medio del Decreto 341 de 1996, se modifica el parágrafo del artículo 32 del Decreto 677 de 1995, ampliando en doce (12) meses mas el plazo en él concedido a los productores, comercializadores e importadores de preparaciones farmacéuticas elaboradas con base en recursos naturales incluidos en la Lista Básica Aceptada, para solicitar al Invima o a su autoridad delegada, el registro sanitario correspondiente. 2.4.13 Decreto 337 de 1998. En 1998, se expide el Decreto 337, con el fin de regular la producción, envase, expendio, importación, exportación y comercialización de las preparaciones farmacéuticas elaboradas con base en recursos naturales, y ampliar el plazo establecido en el Decreto 341 de 1996. En su artículo 2°, el decreto define las preparaciones farmacéuticas elaboradas con base en recursos naturales, como “el producto medicional (sic) empacado y etiquetado, cuyos ingredientes activos están formados por cualquier parte de los recursos naturales de uso medicinal o asociaciones de éstos, en estado bruto o en forma farmacéutica y que se utilizan con fines terapéuticos. Si el recurso natural de uso medicional (sic) se combina con sustancias activas, inclusive constituyentes aislados y químicamente definidos, no considerarán (sic) preparaciones farmacéuticas con base en recursos naturales. “Los componentes provenientes de un recurso natural que ha sido procesado y obtenido en forma pura, no será clasificado (sic) como preparación farmacéutica con base en recursos naturales (sic), sino como medicamento (sic).” (subrayas fuera del texto) Este decreto ordena la selección, almacenamiento y conservación de los recursos naturales utilizados en las preparaciones farmacéuticas con base en recursos naturales en condiciones sanitarias que garanticen su calidad.161 Ordena también que el cultivo de los recursos naturales utilizados en este tipo de preparaciones farmacéuticas se realice de acuerdo con las buenas practicas de cultivo y la reglamentación que sobre el particular expidan los ministerios de Salud, Agricultura y Medio Ambiente, y las recomendaciones que para el efecto dicte de la Organización Mundial de la Salud, OMS.162 161 Decreto 337 de 1998, artículo 3. 143 Así mismo, señala las condiciones generales a las que debe sujetarse la recolección, lavado, secado y almacenamiento de los recursos naturales utilizados en preparaciones farmacéuticas.163 En su artículo 12, clasifica las preparaciones farmacéuticas con base en recursos naturales, así: (i) Preparaciones farmacéuticas con base en recursos naturales que se catalogan como medicamentos, y que por lo tanto se someten a la regulación legal de los mismos. (ii) Alimentos con base en recursos naturales presentados en formas farmacéuticas aceptados por la Comisión Revisora, sin indicación terapéutica. Los cataloga como alimentos y se someten a la regulación legal de los mismos. (iii) Productos farmacéuticos elaborados con base en recursos naturales utilizados como cosméticos. Los cataloga como cosméticos y los somete a la reglamentación legal de los mismos. 162 Decreto 337 de 1998, artículos 4 y 5. 163 Decreto 337 de 1998, artículos 78, 9, 10 y 11. 144 Por medio del artículo 13 de este decreto, se conforma un comité asesor del Ministerio de Salud, para formular las recomendaciones sobre la inclusión o exclusión de recursos naturales en la lista básica aceptada, a la que hace referencia el artículo 1° del Decreto 677 de 1995.164 La coordinación técnica de este comité corresponde a la Subdirección de Servicios Farmacéuticos y de Laboratorios del Ministerio de Salud. 164 El comité está integrado por el subdirector de servicios farmacéuticos y de laboratorios del Ministerio de Salud, quien lo preside; un representante del Colegio Nacional de Químicos Farmacéuticos de Colombia; un representante de la Federación Médica Colombiana; un representante de la Sociedad Colombiana de Toxicología; un representante de las agremiaciones de productores, comercializadores e importadores de preparaciones farmacéuticas con base en recursos naturales, escogido de la terna que presenten conjuntamente dichas agremiaciones al Ministerio de Salud; un representante de los herbarios oficiales que funcionan en el país; un representante de la Asociación de Facultades de Química Farmacéutica; y un representante de las universidades que adelanten programas científicos, orientados a la producción y a la utilización de preparaciones farmacéuticas con base en recursos naturales, escogido de la terna que presenten conjuntamente al Ministerio de Salud. 145 146 3. MARCO NORMATIVO VIGENTE Es importante poner de presente que el ejercicio interpretativo para establecer el marco normativo vigente de la regulación sanitaria de las preparaciones farmacéuticas elaboradas con base en productos naturales, debe ceñirse a las reglas de interpretación legal contenidas en el artículo 10 del Código Civil; 165 en el capítulo IV, interpretación de la ley;166 y en el capítulo VI, derogación de las leyes,167 de ese mismo código. 165 De conformidad con lo establecido en el artículo 10 del Código Civil, sustituido por el artículo 5 de la Ley 57 de 1887 “Cuando haya incompatibilidad entre una disposición constitucional y una legal, preferirá aquella. “Si en los códigos que se adoptan se hallaren algunas disposiciones incompatibles entre sí, se observarán en su aplicación las reglas siguientes: 1ª) La disposición relativa a un asunto especial prefiere a la que tenga carácter general; 2ª) Cuando las disposiciones tengan una misma especialidad o generalidad, y se hallen en un mismo código, preferirá la disposición consignada en el artículo posterior. … 166 Este capítulo comprende los artículos 25 a 32 del Código Civil. Los artículos que hacen referencia a la interpretación doctrinal (la que, en términos del artículo 26, hacen los jueces, los funcionarios públicos y los particulares, en la aplicación de las leyes a los casos particulares) son los siguientes: “artículo 27. Cuando el sentido de la ley se claro, no se desatenderá su tenor literal a pretexto de consultar su espíritu. Pero bien se puede, para interpretar una expresión oscura de la ley, recurrir a su intención o espíritu, claramente manifestados en ella misma o en la historia fidedigna de su establecimiento.” “artículo 28. Las palabras de la ley se entenderán en su sentido natural y obvio, según el uso general de las mismas palabras; pero cuando el legislador las haya definido expresamente para ciertas materias, se les dará a éstas su significado legal.” “artículo 29. Las palabras técnicas de toda ciencia o arte, se tomarán en el sentido que les den los que profesan la misma ciencia o arte; a menos que aparezca claramente que se han tomado en sentido diverso.” “artículo 30. El contexto de la ley servirá para ilustrar el sentido de cada una de sus partes, de manera que haya entre ellas la debida correspondencia y armonía…” 167 Este capítulo comprende los artículos 71 y 72 del Código Civil, cuyo texto es el siguiente: “artículo 71. La derogación de las leyes podrá ser expresa o tácita. Es expresa cuando la nueva ley dice expresamente que deroga la antigua. Es tácita cuando la nueva ley contiene disposiciones que no pueden conciliarse con las de la ley anterior. La derogación de una ley puede ser total o parcial.” “artículo 72 . La derogación tácita deja vigente en las leyes anteriores, aunque versen sobre la misma materia, todo aquello que no pugna con las disposiciones de la nueva ley.” 147 3.1. FUNDAMENTO CONSTITUCIONAL “El derecho a la salud está incluido como uno de los derechos humanos básicos en los textos constitucionales modernos de todos los países. En forma similar, las leyes desarrollan la efectividad del ejercicio de este derecho y lo protegen con normas sancionadas.”168 Sin embargo, para llegar a ello, fue necesario un reconocimiento pleno de los derechos humanos en su concepción mas amplia.169 En la Constitución Política de 1991, “norma que regula la expedición y relación de todas las normas que componen el ordenamiento jurídico, indica la autoridad que las expide, el procedimiento y la materia objeto de regulación, … –y– sirve de marco de validez a las demás normas jurídicas,”170 encontramos el soporte de la regulación sanitaria colombiana. 168 MESTRE ROSSI, Carlos. El Sistema Sanitario y la Salud. En: Estella (Marcella): Salvat Editores S.A, 1985. p. 7. Colección Salvat Temas Claves. Tomo 87. 169 El artículo 25 de la Declaración Universal de Derechos Humanos, redactada por la Asamblea General de la Organización de Naciones Unidas en 1948, señala que “Toda persona tiene derecho a un nivel de vida adecuado que le asegure, así como a su familia, la salud y el bienestar y, en especial, la alimentación, el vestido, la vivienda, la asistencia médica y los servicios sociales necesarios; …”. En el Congreso de Constitución de la Organización Mundial de la Salud, celebrado el 7 de abril de 1948, se expresó: “1. La aspiración de todos los pueblos es el goce máximo de salud para todos los ciudadanos. 2. La salud es el estado de absoluto bienestar físico, mental y social, sin distinción de religiones, credos políticos o clases sociales. 3. Todo hombre tiene derecho a conservar su salud y, en caso de que enferme, a poseer los medios para curarse.” La Declaración Americana de los Derechos y Deberes del Hombre, aprobada en la IX Conferencia Internacional Americana, en Santafé de Bogotá, D.C., República de Colombia, el 2 de mayo de 1948, señala que “Artículo XI. Toda persona tiene derecho a que su salud sea preservada por medidas sanitarias y sociales, relativas a la alimentación, el vestido, la vivienda y la asistencia médica, correspondientes al nivel que permitan los recursos públicos y los de la comunidad.” 170 CHARRY, Juan Manuel. Sistema Normativo de la Constitución de 1991. En: Monografías Jurídicas 85. Centro de Investigaciones Jurídicas del Colegio Mayor de Nuestra Señora del Rosario. Santafé de Bogotá: Editorial Temis S.A., 1993. p. 1. En su preámbulo, que “incorpora, mucho mas allá de un simple mandato específico, los fines hacia los cuales tiende el ordenamiento jurídico; … la motivación política de toda la normatividad; los valores que –la– Constitución aspira a realizar y que trasciende la pura literalidad de sus artículos,”171 señala que uno de los fines del Estado Colombiano es “asegurar a sus integrantes la vida, la convivencia, el trabajo, la justicia, la igualdad, el conocimiento, la libertad y la paz, dentro de un marco jurídico, democrático y participativo que garantice un orden político, económico y social justo.” “El preámbulo da sentido a los preceptos constitucionales y señala al Estado las metas hacia las cuales debe orientar su acción.”172 En su título I, la Constitución establece los principios fundamentales del Estado Colombiano. El artículo 1, señala que Colombia es un estado social de derecho, democrático, participativo y pluralista, fundado en el respeto a la dignidad humana,173 en el trabajo, la solidaridad y la prevalencia del interés general. 171 Corte Constitucional. Sentencia C-479. Alejandro Martínez Caballero. 6 de agosto de 1992. 172 6 de agosto de 1992. M.P. Corte Constitucional. Sentencia C-479. Alejandro Martínez Caballero. M.P. José Gregorio Hernandez Galindo y José Gregorio Hernandez Galindo y 148 149 En términos de la Corte Constitucional, el estado social de derecho, desde el punto de vista cuantitativo, bajo el esquema del estado bienestar,174 “puede ser definido como el estado que garantiza los estándares mínimos de salario, alimentación, salud, habitación, educación, asegurados a todos los ciudadanos bajo la idea de derecho y no simplemente de caridad.”175 (subrayas fuera del texto) Desde el punto de vista cualitativo, bajo el tema de estado constitucional democrático, el estado es la respuesta jurídico-política derivada de su actividad intervencionista, que se manifiesta, entre otras cosas, en “la consagración de un catálogo de principios y derechos fundamentales que inspiran toda la interpretación y el funcionamiento de la organización política.”176 En el estado social de derecho pierde la importancia sacramental el texto legal, y adquiere importancia la justicia material. 173 El principio de respeto a la dignidad humana tiene especial relevancia, pues parte de la premisa de que el hombre es un fin en sí mismo. 174 El estado bienestar surgió a principios del siglo IXX en Europa, como respuesta a las demandas sociales, el movimiento obrero, las reivindicaciones populares provenientes de las revoluciones rusa y mexicana, y coincidió con la llamada época del New Deal en los Estados unidos de Norteamérica. 175 Corte Constitucional. Sentencia T-406. 5 de junio de 1992. M.P. Ciro Angarita Barón. 176 Corte Constitucional. Sentencia T-406. 5 de junio de 1992. M.P. Ciro Angarita Barón. Los principios a que hace referencia este artículo, deben inspirar la producción y aplicación de la totalidad de las normas jurídicas en Colombia, incluidas, claro está, las sanitarias. En su artículo 2, la Constitución establece como fines esenciales del estado “servir a la comunidad, promover la prosperidad general y garantizar la efectividad de los principios, derechos y deberes - consagrados en ella - … y asegurar la convivencia pacífica y la vigencia de un orden justo.” Agrega que “Las autoridades de la República están instituidas para proteger a todas las personas residentes en Colombia, en su vida, honra, bienes, creencias y demás derechos y libertades, y para asegurar el cumplimiento de los deberes sociales del Estado y de los particulares.” Esta finalidad, en consecuencia, debe inspirar a las autoridades sanitarias en todas sus actuaciones. Con toda razón se ha dicho que nuestra Constitución es de carácter programático, pues aun cuando en la práctica es bastante complicado lograr la efectividad de todas sus disposiciones, establece el fundamento y finalidad del estado. La relación entre los fines que consagra y su consecución “depende, por lo general, de una elección política que le corresponde preferencialmente al legislador.”177 177 Corte Constitucional. Sentencia T-406. 5 de junio de 1992. M.P. Ciro Angarita Barón. Sin 150 embargo, la enunciación de esos valores, no debe ser entendida como la manifestación de un deseo o de un querer sin incidencia normativa, sino como un conjunto de propósitos que debe informar la vida del Estado. En el estado social del derecho, los derechos fundamentales adquieren una dimensión objetiva, con una fuerza vinculante entre el estado y los particulares y entre éstos últimos entre sí. En consecuencia, el estado, en su función de producir normas jurídicas, debe dar eficacia a estos derechos fundamentales. En su artículo 7, la Constitución reconoce y protege la diversidad étnica y cultural. Sin embargo, cuando el reconocimiento de grupos culturales con tradiciones, prácticas y ordenamientos jurídicos diversos, choca con la eficacia de los derechos fundamentales, en especial del derecho a la vida y a la salud, el estado debe hacer prevalecer estos últimos. En su título II, de los derechos, las garantías y los deberes, la Constitución contempla un catálogo de derechos. Dentro de los derechos fundamentales consagrados en la Constitución, tienen una especial relevancia para el tema objeto de este trabajo, el derecho a la vida, a la 151 integridad personal, a la salud, y al libre desarrollo de la personalidad. “La autoridad estatal está constitucionalmente obligada a no hacer cosa alguna que destruya o debilite el contenido esencial de esos derechos, y a crear las condiciones indispensables para que tengan cabal observancia y cumplimiento.”178 El derecho a la vida, consagrado en el artículo 11, es el presupuesto necesario para el ejercicio de los demás derechos. La Constitución consagra también el derecho a la igualdad como fundamental. En su artículo 13 expresa que “Todas las personas nacen libres e iguales ante la ley, recibirán la misma protección y trato de las autoridades y gozarán de los mismos derechos, libertades y oportunidades sin ninguna discriminación …” En virtud de esto, los casos semejantes deben tratarse de la misma manera y los diferentes de manera diferente. Por lo acá señalado, al momento de expedir la normatividad sanitaria y de aplicarla, deben tenerse en cuenta las diferencias existentes entre los productos farmacéuticos naturales y los de síntesis química. Así mismo, y en virtud del derecho fundamental a la igualdad, todas las personas tienen derecho a decidir el tipo de productos farmacéuticos que utilizan en la prevención y tratamiento de sus enfermedades, al tiempo que el Estado tiene la 178 Corte Constitucional. Sentencia T-102. 10 de marzo de 1996. M.P . Carlos Gaviria Díaz. 152 obligación de proporcionarles certeza sobre la calidad, eficacia y seguridad de aquellos productos entre los que pueden ejercer este derecho de escogencia. Con el fin de asegurar la justicia en las decisiones judiciales y administrativas, la Constitución consagra en su artículo 29 el derecho al debido proceso. Por lo tanto, nadie puede ser procesado sino conforme a leyes preexistentes al acto que se le imputa, por una autoridad competente, y observando la plenitud de las formas legales. Como principios del debido proceso consagra también el derecho a la defensa y la presunción de inocencia. Según la Corte Constitucional, “Toda infracción merecedora de reproche punitivo tiene una misma naturaleza, como idénticas son las consecuencias, no obstante provengan de una autoridad administrativa o jurisdiccional o que tengan origen en las diferencias formales de los trámite rituales.”179 (subrayas fuera del texto). En consecuencia, la aplicación de las sanciones a aquellos que infrinjan las normas sanitarias, deben sujetarse a los principios del debido proceso. En el capítulo 2 de este título, de los derechos sociales, económicos y culturales, el Constituyente hace referencia a la salud en los siguientes términos: 179 Corte Constitucional. Sentencia T-521. 19 de septiembre de 1992. M.P. Alejandro Martinez Caballero. 153 154 “Artículo 49. La atención de la salud y el saneamiento ambiental son servicios públicos a cargo del estado. Se garantiza a todas las personas el acceso a los servicios de promoción, protección y recuperación de la salud. “Corresponde al Estado organizar, dirigir y reglamentar la prestación de servicios de salud a los habitantes y de saneamiento ambiental conforme a los principios de eficiencia, universalidad y solidaridad. También, establecer las políticas para la prestación de servicios de salud por entidades privadas, y ejercer su vigilancia y control. … “Toda persona tiene el deber de procurar el cuidado integral de su salud y la de su comunidad.” (subrayas fuera del texto) En palabras de la Corte Constitucional, el derecho a la salud constituye “un predicado inmediato del derecho a la vida, de manera que atentar contra la salud de las personas equivale a atentar contra su propia vida”.180 En reiterada jurisprudencia la Corte Constitucional “ha sostenido que el derecho a la salud no es fundamental y, en principio, no es amparable por vía de tutela. Sin embargo, también ha sostenido que este derecho puede ser objeto de amparo constitucional, 180 Corte Constitucional. Sentencia T-484. 11 de agosto de 1992. M.P. Fabio Morón Díaz. cuando su vulneración o amenaza signifiquen vulneración o amenaza para un derecho constitucional de carácter fundamental, generalmente los derechos a la vida (art. 11 superior) y a la integridad personal (art. 12 ibídem).”181 No obstante lo anterior, algunos doctrinantes, e incluso magistrados del Consejo de Estado y de la Corte Constitucional, consideran que la salud no es un derecho fundamental por estar incluido en el capítulo 2 del título II de la Carta, que trata ‘ de los derechos sociales, económicos y culturales’ , y no en el capítulo 1 de ese mismo título que trata de los derechos fundamentales.182 Es importante resaltar que, en su carácter programático, el artículo 49 mencionado, garantiza a todas las personas el acceso a los servicios de promoción y recuperación de la salud, y que en términos de la Organización Mundial de la Salud, la mayor parte de la población mundial depende de la medicina tradicional para los cuidados primarios de la salud, y la fuerza de trabajo representada en los practicantes de este tipo de medicina es un recurso potencialmente importante para prestar cuidados a la salud.183 181 Corte Constitucional. Sentencia T-260. 27 de mayo de 1998. M.P. Fabio Morón Díaz. Por ejemplo el magistrado Ernesto Ariza Muñoz, quien señaló en su salvamento de voto a la sentencia proferida en Sala Plena por el Consejo de Estado, el 16 de marzo de 1992. 182 183 Ver capítulo VII de este trabajo, la experiencia de otros países. 155 En el capítulo 3 de este mismo título, de los derechos colectivos y del ambiente, la Constitución confiere al legislador la función de regular el control de calidad de bienes y servicios ofrecidos y prestados a la comunidad, así como la información que debe suministrarse al público en su comercialización.184 Señala expresamente que “Serán responsables, de acuerdo con la ley, quienes en la producción y en la comercialización de bienes y servicios, atenten contra la salud, la seguridad y el adecuado aprovisionamiento de consumidores y usuarios.” (subrayas fuera del texto). En consecuencia, corresponde al legislador y solo a él, establecer las sanciones aplicables a quienes realicen conductas que vulneren o pongan en peligro la salud.185 En este mismo capítulo, la Constitución, en su artículo 84, señala que “Cuando un derecho o una actividad hayan sido reglamentados de manera general, las autoridades públicas no podrán establecer ni exigir permisos, licencias o requisitos adicionales para su ejercicio. En el título VI, de la rama legislativa, capítulo III, de las leyes, el Constituyente asigna competencia al Congreso de la República para hacer las leyes, y por medio 184 Artículo 78 de la Constitución Política. Algunas conductas que vulneran o ponen en peligro la salud son la producción y comercialización de preparaciones farmacéuticas adulteradas o fraudulentas. 185 156 de ellas interpretar, reformar y derogar las leyes; expedir códigos en todos los ramos de la legislación y reformar sus disposiciones; expedir las normas a las cuales debe sujetarse el gobierno para el ejercicio de las funciones de inspección y vigilancia señaladas en la Constitución; y revestir hasta por seis (6) meses al Presidente de la República de facultades extraordinarias para expedir normas con fuerza de ley, cuando la necesidad lo exija o la conveniencia pública lo aconseje.186 En el título VII, de la rama ejecutiva, capítulo I, del Presidente de la República, el Constituyente señala que, “Corresponde al Presidente de la República como Jefe de Estado, Jefe de Gobierno y Suprema Autoridad Administrativa: … 11. Ejercer la potestad reglamentaria, mediante la expedición de los decretos, resoluciones y órdenes necesarios para la cumplida ejecución de las leyes.”187 Mas adelante, en el título XII del régimen económico y de la hacienda pública, el artículo 333 señala que la actividad económica y la iniciativa privada son libres, dentro de los límites del bien común, y que pueden ejercerse sin necesidad de permisos previos o requisitos, salvo expresa autorización de la Ley.188 Así mismo, por esta razón, solo la ley puede restringir el ejercicio de actividades como la producción y comercialización de preparaciones farmacéuticas elaboradas con base en productos naturales. 186 Artículo 150 numerales 1°, 2°, 8°, 10 de la Constitución Política. 187 Artículo 189 numeral 11 de la Constitución Política. 157 158 Aun cuando muchas otras normas de nuestra Constitución, si no todas de alguna u otra manera, son también fundamento del tema objeto de este trabajo, consideramos conveniente, con el fin de lograr una mayor claridad en la exposición, tan solo exponer las que de manera directa hacen referencia al mismo, como en efecto lo hicimos. 3.2. MARCO LEGISLATIVO Y REGLAMENTARIO Como se señaló en el capítulo II, evolución normativa, de este trabajo, las leyes, decretos y resoluciones relacionadas con el tema objeto de este trabajo, que se han expedido desde 1960 hasta la fecha, que se relacionan con el tema objeto de estudio, son, en orden cronológico, las siguientes: Ley 23 de 1962, Decreto 1950 de 1964, Ley 28 de 1974, Decreto Ley 621 de 1974, Decreto 281 de 1975, Decreto Ley 981 de 1975, Decreto Ley 121 de 1976, Decreto 522 de 1976, Ley 9 de 1979, Decreto 2333 de 1982, Decreto Ley 3466 de 1982, Decreto 713 de 1984, Decreto 2092 de 1986, Ley 10 de 1990, Decreto 1524 de 1990, Resolución 5078 de 1990 del Ministerio de Salud, Decreto 2780 de 1991, Ley 100 de 1993, Decreto 2269 de 1993, Decreto 374 de 1994, Decreto Ley 1290 de 188 Recuérdese que la Ley 9 de 1979 consagra la posibilidad de exigir licencias sanitarias, y de contar con un registro sanitario en el Ministerio de Salud para producir, comercializar, importar o exportar preparaciones 1994, Decreto 677 de 1995, Decreto 936 de 1996, Resolución 4536 de 1996 del Ministerio de Salud, Decreto 341 de 1996, y Decreto 337 de 1998. Con el fin de hacer más simple la determinación de las normas vigentes relacionadas con la regulación sanitaria de las preparaciones farmacéuticas elaboradas con base en recursos naturales, debe establecerse en primer lugar la prelación normativa de aquellas expedidas desde 1960, de acuerdo con lo expuesto en el capítulo II, evolución normativa de este trabajo. Las leyes expedidas desde 1960, relacionadas con el tema, son: La Ley 23 de 1962, el Decreto Ley 621 de 1974, el Decreto Ley 981 de 1975, el Decreto Ley 121 de 1976, la Ley 9 de 1979, el Decreto Ley 3466 de 1982, la Ley 10 de 1990, la Ley 100 de 1993, y el Decreto Ley 1290 de 1994. Los decretos expedidos desde 1960, relacionados con el tema son: el Decreto 1950 de 1964, el Decreto 281 de 1975, el Decreto 522 de 1976, el Decreto 2333 de 1982, el Decreto 713 de 1984, el Decreto 2092 de 1986, el Decreto 1524 de 1990, el Decreto 2780 de 1991, el Decreto 2269 de 1993, el Decreto 374 de 1994, el Decreto 677 de 1995, el Decreto 936 de 1996, el Decreto 341 de 1996, y el Decreto 377 de 1998. farmacéuticas. 159 Las resoluciones más importantes, expedidas desde 1960, relacionadas con el tema, son: la Resolución 5078 de 1990 y la Resolución 4536 de 1996, ambas del Ministerio de Salud. 3.2.1 El ejercicio interpretativo para determinar el marco legislativo y reglamentario vigente. A continuación se expondrá el ejercicio interpretativo que ha servido de base para concluir cuál es el marco legislativo y reglamentario vigente del régimen sanitario de las preparaciones farmacéuticas elaboradas con base en productos naturales. 3.2.1.1 Ley 23 de 1962. Esta ley, que regula el ejercicio de la profesión de químico farmacéutico, no ha sido derogada ni expresa ni tácitamente por otra norma jurídica. En consecuencia, se encuentra vigente. 3.2.1.2 Decreto 1950 de 1964. Este decreto, reglamentario de la Ley 23 de 1962, se encuentra parcialmente vigente. (i) En cuanto a los requisitos que deben cumplir los establecimientos farmacéuticos para obtener la autorización para su funcionamiento, fue derogado tácitamente por la Ley 9 de 1979 y por el Decreto 677 de 1995. 160 (ii) En cuanto a la clasificación y definición de los distintos establecimientos farmacéuticos. En este punto, es importante tener en cuenta que, como se anotó en el capítulo II, evolución normativa, de este trabajo, se presenta una inconsistencia en la definición de farmacia – droguería contenida en el Decreto 1950 de 1964, pues ésta excede el contenido de la definición contenida en la Ley 23 de 1962. En consecuencia, y por tener esta última un carácter superior, prima la definición contenida en ella. (iii) En cuanto a la obligatoriedad para los laboratorios farmacéuticos de contar con una sección de control de calidad o contratar el control de calidad de sus productos con laboratorios de control legalmente establecidos, continúa vigente y está complementada por el artículo 90 del Decreto 677 de 1995. (iv) En cuanto a la limitación de que los productos bajo fórmula médica se expendan únicamente en farmacias – droguerías que funcionen legalmente, y previa presentación de la respectiva prescripción se encuentra vigente. (v) En cuanto a la prohibición de la venta al por menor de productos farmacéuticos en las agencias farmacéuticas y en los depósitos de drogas se encuentra vigente. 161 162 3.2.1.3 Decreto Ley 621 de 1974. El Decreto Ley 621 de 1974, por medio del cual se creó el Consejo Asesor para el Licenciamiento de Drogas Biológicas, fue modificado por el Decreto Ley 981 de 1975, que estableció como nuevo nombre de dicho consejo, el de Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, y la facultó para emitir conceptos obligatorios para el Ministerio de Salud sobre los registros sanitarios y sobre las normas de carácter científico que regularan el registro y control de los productos que inciden en la salud individual o colectiva. Posteriormente, el Decreto Ley 121 de 1976 modificó la composición de dicha comisión; y en 1994, el Decreto Ley 1290 le atribuyó el carácter de órgano consultor del Invima, señaló que conservaría las facultades y estructura consagradas en las disposiciones vigentes, y que, en todo caso, su composición y funciones podrían ser modificadas por la junta directiva del Invima. Por último, por medio del Decreto 936 de 1996, se aprobó el Acuerdo 008 de la junta directiva del Invima, que modificó la composición y funciones de la mencionada Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva. En consecuencia, el Decreto Ley 621 de 1974 se encuentra vigente con las modificaciones introducidas por el Decreto Ley 981 de 1975, el Decreto Ley 1290 de 1994 y el Decreto 936 de 1996.189 3.2.1.4 Decreto 281 de 1975. Este decreto, por medio del cual se regulaban variados aspectos de las actividades relacionadas con la salud, fue derogado expresamente por el Decreto 2092 de 1986. 3.2.1.5 Decreto Ley 121 de 1976. Este decreto, por medio del cual se otorgaron facultades al Ministerio de Salud para definir la política nacional en materia de salud y se determinó la composición de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, se encuentra parcialmente vigente. (i) En cuanto a las facultades otorgadas al Ministerio de Salud para definir la política nacional en materia de salud, se encuentra vigente. 189 Nótese que no se hace referencia a la modificación introducida por el Decreto Ley 121 de 1976, porque éste, en lo que regula la composición y funciones de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, fue tácitamente derogado por el Decreto Ley 1290 de 1994 y por el Decreto 936 de 1996. 163 (ii) En cuanto a la composición y funciones de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, fue derogado tácitamente por el Decreto 1290 de 1994 y por el Decreto 936 de 1996. 3.2.1.6 Decreto 522 de 1976. El Decreto 522 de 1976, por medio del cual se aclara y modifica el Decreto Ley 281 de 1976, fue derogado expresamente, por el Decreto 2092 de 1986. 3.2.1.7 Ley 9 de 1979. Esta ley, por medio de la cual se codifica y actualiza la legislación sanitaria, se encuentra vigente en su totalidad. 3.2.1.8 Decreto 2333 de 1982. El Decreto 2333 de 1982, reglamentario de la Ley 9 de 1979 en cuanto al sector de alimentos, fue modificado por el Decreto 2780 de 1991, en lo relativo a la expedición de licencias sanitarias, depósitos y expendios de alimentos, así como a la expedición, ampliación, suspensión y cancelación de registros sanitarios para la producción, importación, exportación y comercialización de los mismos. En consecuencia, se encuentra parcialmente vigente. 164 3.2.1.9 Decreto Ley 3466 de 1982. Este decreto, por medio del cual se dictan normas sobre idoneidad, calidad, garantías, marcas, leyendas, propaganda, fijación pública de precios y responsabilidad de los productores, expendedores y proveedores de bienes y servicios, se encuentra vigente en su totalidad. En sus propios términos, es aplicable en lo relativo a las preparaciones farmacéuticas elaboradas con base en productos naturales, en cuanto no contradiga las normas especiales que regulan dicha materia. 3.2.1.10 Decreto 713 de 1984. Este decreto, reglamentario de la Ley 23 de 1962 y de la Ley 9 de 1979, por medio del cual se regula la actividad farmacéutica, fue derogado expresamente por el Decreto 677 de 1995. 3.2.1.11 Decreto 2092 de 1986. Este decreto, por medio del cual se reglamenta la Ley 9 de 1979 en cuanto a la elaboración, envase, empaque, almacenamiento, transporte y expendio de medicamentos, cosméticos y similares, fue derogado tácitamente por el Decreto 374 de 1994, a su vez derogado por el Decreto 677 de 1995, que regulan íntegramente la materia. 3.2.1.12 Ley 10 de 1990. Esta ley, por medio de la cual se reorganiza el sistema nacional de salud, se encuentra vigente en su totalidad. 165 166 3.2.1.13 Decreto 1524 de 1990. El Decreto 1524 de 1990, por medio del cual se regula la fabricación, envase, empaque, almacenamiento y expendio de productos naturales con usos terapéuticos y de las preparaciones farmacéuticas elaboradas con base en éstos, fue derogado expresamente por el Decreto 677 de 1995. 3.2.1.14 Resolución 5078 de 1990. La Resolución 5078 de 1990, por medio de la cual se adoptan normas técnico administrativas en materia de medicinas tradicionales y terapéuticas alternativas y se crea el consejo asesor para la conservación y desarrollo de éstas, se encuentra vigente. 3.2.1.15 Decreto 2780 de 1991. Por medio de este decreto se modifica parcialmente el Decreto 2333 de 1982, en lo relacionado con la expedición de licencias sanitarias de fábricas, depósitos y expendios de alimentos, y con la expedición, ampliación, modificación, suspensión y cancelación de registros sanitarios para la producción, importación, exportación y comercialización de los mismos. Este decreto se encuentra vigente en su totalidad. 3.2.1.16 Ley 100 de 1993. Los artículos 245 y 248, numeral 7, de la Ley 100 de 1993, relacionados con el tema objeto de este trabajo, agotaron sus objetivos. En efecto, por medio del artículo 245 mencionado, se creó el Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Invima, y en ejercicio de las facultades extraordinarias conferidas por el numeral 7 del artículo 248, se expidió el Decreto Ley 1290 de 1994, por medio del cual se centraliza la ejecución de las políticas formuladas por el Ministerio de Salud en materia de vigilancia sanitaria y control de calidad de los productos señalados en el artículo 245 de la Ley 100 de 1993. 3.2.1.17 Decreto 2268 de 1993. Este decreto, por medio del cual se organiza el sistema nacional de normalización, certificación y metrología, se encuentra vigente en su totalidad. 3.2.1.18 Decreto 374 de 1994. Este decreto fue derogado expresamente por el Decreto 677 de 1995. Por medio de él se reglamentaba la Ley 9 de 1979, en cuanto al régimen de licencias y registros sanitarios de medicamentos, cosméticos, preparaciones farmacéuticas elaboradas con base en productos naturales, productos homeopáticos, materiales odontológicos e insumos para la salud. 3.2.1.19 Decreto Ley 1290 de 1994. El Decreto Ley 1290 de 1994, por medio del cual se centraliza la ejecución de las políticas formuladas por el Ministerio de Salud en materia de vigilancia sanitaria y control de calidad de los productos 167 señalados en el artículo 245 de la Ley 100 de 1993, se encuentra vigente en su totalidad. 3.2.1.20 Decreto 677 de 1995. El Decreto 677 de 1995, por el cual se reglamenta el régimen de registros y licencias, control de calidad y vigilancia sanitaria de medicamentos, cosméticos, preparaciones farmacéuticas elaboradas con base en productos naturales, entre otros, se encuentra vigente parcialmente. En efecto, en lo relacionado con la producción, envase, expendio, importanción, exportación y comercialización de preparaciones farmacéuticas elaboradas con base en productos naturales fue derogado tácitamente por el Decreto 337 de 1998, que regula íntegramente la materia.190 En lo demás el Decreto 677 de 1995 se encuentra vigente. 3.2.1.21 Decreto 936 de 1996. Este decreto, por medio del cual se aprueba el Acuerdo 008 de la junta directiva del Invima, que modifica la composición y funciones de la Comisión Revisora de Medicamentos, Cosméticos, Productos Alimenticios, Plaguicidas de Uso Doméstico y demás productos que incidan en la salud individual o colectiva, se encuentra vigente. 190 Debe tenerse en cuenta que el Decreto 677 de 1995, con anterioridad a la expedición del Decreto 337 de 1998, había sido modificado por el Decreto 341 de 1996, que ampliaba el plazo para solicitar el registro sanitario, concedido a los productores, comercializadores e importadores de preparaciones farmacéuticas elaboradas con base en productos naturales incluidos en la Lista Básica Aceptada. 168 169 3.2.1.22 Resolución 4536 de 1996 del Ministerio de Salud. Esta resolución, por medio de la cual se reglamenta el Decreto 677 de 1995 en lo relacionado con la publicidad de los medicamentos, se encuentra vigente. 3.2.1.23 Decreto 341 de 1996. El Decreto 341 de 1996, modificatorio del Decreto 677 de 1995, por medio del cual se amplía el plazo concedido a los productores, comercializadores e importadores de preparaciones farmacéuticas elaboradas con base en productos naturales incluidos en la Lista Básica Aceptada, para solicitar el registro sanitario, fue a su vez modificado por el Decreto 337 de 1998. El plazo contenido en este decreto y ampliado por el Decreto 337 de 1998 se extinguió. En consecuencia, este decreto no se encuentra vigente por haberse agotado en su propósito. 3.2.1.24 Decreto 337 de 1998. Este decreto, por medio del cual se regula la producción, envase, expendio, importación, exportación y comercialización de las preparaciones farmacéuticas elaboradas con base en productos naturales y se amplía el plazo establecido en el Decreto 341 de 1996 se encuentra parcialmente vigente. En efecto, el plazo concedido a los productores, comercializadores e importadores de preparaciones farmacéuticas elaboradas con base en productos naturales incluidos en la Lista Básica Aceptada, para solicitar el registro sanitario, expiró. En consecuencia, en lo pertinente no se encuentra vigente. 3.2.2 Leyes, decretos y resoluciones vigentes. Hecho el ejercicio interpretativo descrito en la sección anterior, es preciso determinar cuáles son las leyes, decretos y resoluciones relacionadas con el régimen sanitario de las preparaciones farmacéuticas elaboradas con base en recursos naturales, que se encuentran vigentes. 3.2.2.1 En lo relacionado con la competencia para definir la política nacional en materia de salud. Se encuentra vigente el Decreto Ley 121 de 1976. 3.2.2.2 En lo relacionado con la organización del Sistema Nacional de Salud. Se encuentra vigente la Ley 10 de 1990. 170 3.2.2.3 En lo relacionado con los órganos competentes para ejecutar las políticas formuladas por el Ministerio de Salud en materia de vigilancia sanitaria y control de calidad de las preparaciones farmacéuticas elaboradas con base en productos naturales. Las normas vigentes son la Ley 100 de 1993, el Decreto Ley 1290 de 1994, el Decreto 936 de 1996, parcialmente los Decretos 621 de 1974 y 981 de 1975, en los términos indicados anteriormente en este capítulo, y la Resolución 5078 de 1990 del Ministerio de Salud, en cuanto a la creación y funciones del Consejo Asesor para la Conservación y Desarrollo de las Medicinas Tradicionales y Terapeúticas Alternativas. 3.2.2.4 En lo relacionado con la regulación del ejercicio de la profesión de químico farmacéutico. Las normas vigentes son la Ley 23 de 1962 y, parcialmente el Decreto 1950 de 1964, en los términos indicados anteriormente en este capítulo. 3.2.2.5 En lo relacionado con la clasificación, definición y régimen general de los distintos establecimientos farmacéuticos. Decreto 1950 de 1964. La norma vigente es el 171 3.2.2.6 En lo relacionado con la elaboración, envase, almacenamiento, transporte y expendio de drogas, medicamentos, cosméticos y alimentos. Se encuentran vigentes las siguientes normas. (i) La ley 9 de 1979, o Código Sanitario, que contiene las disposiciones sanitarias generales. (ii) El Decreto 2333 de 1982, con las modificaciones introducidas por el Decreto 2780 de 1991, reglamentario de la Ley 9 de 1979, en lo relativo al sector de los alimentos. (iii) Los decretos 677 de 1995 y 337 de 1998, reglamentarios de la Ley 9 de 1979, en lo relativo al sector de las preparaciones farmacéuticas elaboradas con base en productos naturales. No obstante esto, el Decreto 677 de 1995, también regula lo relacionado con los medicamentos, cosméticos y demás productos que incidan en la salud individual o colectiva, excluidos los alimentos. Así mismo, la Resolución 4536 del Ministerio de Salud, reglamenta el Decreto 677 de 1995, en lo relativo a la publicidad de los medicamentos. 172 3.2.2.7 En lo relacionado con la normalización y metrología. La norma vigente es el Decreto 2268 de 1993. 3.2.2.8 En lo relacionado con los procedimientos administrativos aplicables por las autoridades sanitarias. La norma aplicable es el Código Contencioso Administrativo.191 3.2.2.9 En lo relacionado con la idoneidad, calidad, garantías, marcas, leyendas, propaganda, fijación pública de precios y responsabilidad de los productores, expendedores y proveedores de preparaciones farmacéuticas elaboradas con base en productos naturales. Se encuentran vigentes el Decreto 677 de 1995, y en lo no establecido específicamente en éste, el Decreto Ley 3466 de 1982. 3.2.2.10 En lo relacionado con la responsabilidad civil y penal de quienes infrinjan las normas sanitarias. En lo que hace referencia a la responsabilidad civil, las normas vigentes son los artículos 2341 a 23460 del Código civil. 191 Decreto Ley 01 de 1984. 173 En lo que hace referencia a la responsabilidad penal, se encuentran vigentes los artículos 203 y 206 del Código Penal.192 El artículo 203 del Código Penal, ubicado dentro del capítulo tercero, “de los delitos contra la salud pública”, tipifica el delito de violación de medidas sanitarias en los siguientes términos: “El que viole medida sanitaria adoptada por la autoridad competente para impedir la introducción o propagación de una epidemia, incurrirá en prisión de seis meses a tres años.” El artículo 206, tipifica el delito de corrupción de alimentos y medicinas así: “El que envenene, contamine o altere producto o sustancia alimenticia o medicinal, incurrirá en prisión de uno (1) a cinco (5) años. “En la misma pena incurrirá el que suministre producto o sustancia de los mencionados en este artículo. “La pena se aumentará hasta en la mitad, si el que suministre fuere el mismo que la elaboró, envenenó, contaminó o alteró.” 192 Decreto Ley 100 de 1980. 174 175 4. ANALISIS DEL PROYECTO DE LEY 139 DE 1997 Como reflejo del afán por regular la medicina natural en nuestro país, cursa en la Comisión Séptima de Cámara de Representantes del Congreso de la República de Colombia, desde el 27 de noviembre de 1997, el Proyecto de Ley 139 de 1997 “por el cual se promueve y reglamenta el uso e industrialización de la flora medicinal”, proyecto que ha sido modificado en dos oportunidades.193 4.1 DE LA MATERIA DEL PROYECTO En palabras del Senador TITO RUEDA GUARIN, autor del proyecto, “La iniciativa tiene por finalidad crear desde el punto de vista legal las condiciones humanas, científicas, técnicas e institucionales que den lugar a un desarrollo económico y social acorde con el cultivo e industrialización de la flora medicinal en Colombia, en busca de nuevas fuentes de empleo, al igual que un mejor aprovechamiento de los recursos agrícolas que tradicionalmente han sido utilizados como medicamentos 193 Los ponentes de este proyecto son los representantes a la Cámara Leonor González Mina y José Maya Burbano. menores, pero que ahora se desea poner al servicio de la sociedad colombiana con una reglamentación precisa en cuanto a utilización, medios técnicos, normas ambientales y de salud... “La aprobación del proyecto abriría paso a la apertura de laboratorios especializados en el tratamiento del uso terapéutico de las plantas colombianas, situación que contribuiría a emplear en el sector privado a un gran número de personas (científicos, técnicos y mano de obra) conocedores del sector agroindustrial con resultados ampliamente positivos para la salud de los colombianos.”194 Tal era el interés del autor del proyecto, que en la segunda versión del mismo, publicada en la Gaceta del Congreso número 79, de fecha 22 de mayo de 1998, se incluían las siguientes definiciones: “1. Concertación. En virtud del cual las decisiones y actividades de sector se fundamentarán en acuerdos, para asumir responsabilidades, esfuerzos y recursos entre los diferentes agentes comprometidos, tanto del sector estatal como del sector privado nacional e internacional para el logro de los objetivos comunes que beneficien al sector naturista, (cultivadores, exportadores). (Sic. / Subrayas fuera del texto) productores, expendedores, 176 177 … “3. Descentralización. En virtud del cual el fomento de la Industrialización de la Flora Medicinal es responsabilidad de los diferentes niveles del Estado en sus áreas de competencia y se desarrolla por las empresas privadas y estatales, según sus respectivos ámbitos de acción. Sic. (Subrayas fuera del texto). … “7. Protección al consumidor. Con miras al cabal desarrollo de la Industrialización de la Flora Medicinal, el consumidor será objeto de protección específica por parte de las entidades públicas y privadas.” (Subrayas fuera del texto).195 Sin desconocer el loable interés de promover el empleo a través de la industrialización de lo que el proyecto denomina “flora medicinal colombiana”, consideramos que el tema de la medicina natural, de tan grande trascendencia en la salud, no puede disgregarse en normas que por un lado regulen la industrialización de los productos, y otras que regulen sus incidencias sobre la salud. 194 De aprobarse este proyecto, sin duda esto sucedería, pues la ley resultante Apartes de la comunicación del Senador TITO RUEDA GUARIN al Senador AMILKAR ACOSTA, Presidente del Senado, de fecha 18 de noviembre de 1997; publicada en la Gaceta del Congreso número 498, de fecha 27 de noviembre de 1997, p. 4. regularía la industrialización, y la Ley 9 de 1979 y las normas que la desarrollan e implementan, regularían el tema desde la perspectiva de su incidencia sobre la salud. Esto no tiene sentido, teniendo en cuenta que la industrialización quedaría regulada por una Ley de la república, y el tema de la incidencia del uso de la medicina natural sobre la salud, que actualmente se encuentra regulado en el Decreto 677 de 1995, que sin duda alguna es aún más importante, quedaría regulado por normas de categoría inferior. Es así como el Proyecto de Ley 139 de 1997 olvida el objetivo que debería ser el principal: la protección de la salud. Resulta tan cierta es esta afirmación, que el Artículo 7 del proyecto señala que “Los productos herbarios acondicionados para su ingestión o uso externo, serán de venta libre al público en almacenes herbarios, tiendas naturistas o similares, pero podrán también venderse en las droguerías, a fin de que se hallen a disposición del medico que los prescriba por formulación.”, desconociendo que los productos naturales pueden también tener efectos tóxicos secundarios. La exposición de motivos publicada en la Gaceta del Congreso número 498 del 27 de noviembre de 1997,196 destaca expresamente la absurda prevalencia de la industria sobre la salud cuando señala que “si no se presume toxicidad197 … daría 195 Esto claramente constituye un verdadero exabrupto, pues en lugar de proteger al consumidor, y su salud, lo que se pretende proteger, a su costa, es la industria. 196 En esta Gaceta se publicó la primera versión del Proyecto de Ley 139 de 1997. 178 lugar al desarrollo de una industria auténtica, con lo que, así fueran menores, alternativas o auxiliares las acciones de las plantas, se disminuiría la dependencia total en que el país se encuentra al respecto, con relación a las naciones altamente industrializadas del mundo”. 4.2 DE LA JUSTIFICACION DEL PROYECTO En la comunicación por medio de la cual el Senador TITO RUEDA GUARIN, hizo entrega del proyecto al Presidente del Senado con el fin de que se debatiera y aprobara como ley de la República, y en las distintas versiones del mismo 198, el autor justificaba la presentación de éste como una herramienta para emplear … a gran número de personas (científicos, técnicos y mano de obra conocedores del sector agroindustrial”)199; y señalaba que “la industrialización de las Flora Medicinal se considera por su enorme potencial económico esencial para el desarrollo del país”200. En nuestro concepto la justificación arriba transcrita no resulta suficiente para desconocer la jerarquía normativa preexistente. 197 198 Refiriéndose a las preparaciones farmacéuticas con base en productos naturales. Publicadas en las siguientes ediciones de la Gaceta del Congreso: 22 de mayo de 1998 y 255 del 6 de noviembre de 1998. 199 Como lo expondremos en el 498 del 27 de noviembre de 1997, 79 del Apartes de la comunicación del Senador TITO RUEDA GUARIN al Senador AMILKAR ACOSTA, Presidente del Senado, de fecha 18 de noviembre de 1997; publicada en la Gaceta del Congreso número 498, de fecha 27 de noviembre de 1997, p. 4. 200 Ponencia para el Primer Debate al Proyecto de Ley 139 de 1997 Cámara, publicada en la Gaceta del Congreso número 79 del 22 de mayo de 1998. 179 capítulo sobre el marco normativo vigente, la Ley 9 de 1979 regula la materia sanitaria en Colombia, y a ella deben sujetarse todas las demás normas que se refieran al tema, por ejemplo las que promuevan y reglamenten el “uso e industrialización de la flora medicinal”. Así mismo consideramos que no debe existir una ley que en aras de proteger un sector de la economía, ponga en peligro la salud, que es persé un bien jurídico de superior categoría a los intereses económicos. Es un hecho que detrás de la producción de una norma jurídica hay una gran cantidad de intereses. Sin embargo, la existencia de estos intereses no es y no puede ser razón suficiente para desconocer la jerarquía de las normas jurídicas, con todas las implicaciones que genera su desconocimiento. No tiene sentido regular en una isla lo que es un continente. En otras palabras, no tiene sentido sacar del continente de la regulación de los productos medicinales, las preparaciones farmacéuticas elaboradas con base en productos naturales, y menos sentido tiene dar a la regulación de las segundas una jerarquía jurídica superior a la de los primeros. El ordenamiento jurídico debe ser coherente y eficaz, no puede ser una simple sumatoria de normas sin directriz. “El derecho no es norma sino conjunto coordinado de normas.”201 201 BOBIO, Norberto. 1994. p. 142. Teoria General del Derecho. Santafé de Bogotá: Editorial Temis S.A. Segunda Edición, 180 181 Una Ley como la que se pretende expedir sería una ley que no cumpliría con la característica de generalidad de las normas jurídicas, pues disgrega el sector de la medicina natural del de la medicina en general, con el fin de proteger la industria de las preparaciones farmacéuticas elaboradas con base en productos naturales. 4.3 DEL PODER FÁCTICO DEL PROYECTO Y LA CAPTURA DEL ENTE REGULADOR Sin duda alguna el proyecto pretende modificar la realidad mas que regularla sin desconocerla.202 En palabras del propio Senador TITO RUEDA GUARIN, ponente del proyecto, la aprobación del mismo “abriría paso a la apertura de laboratorios especializados en el tratamiento del uso terapéutico de las plantas colombianas, situación que contribuiría a emplear en el sector privado a un gran número de personas (científicos, técnicos y mano de obra) conocedores del sector agroindustrial con resultados ampliamente positivos para la salud de los colombianos”. 202 “Tanto en las investigaciones técnicas como en las empíricas se pone en cuestión el grado en que la regulación ha logrado los objetivos para los que se ha promulgado”. (Stephen Breyesr y Paul MacAvoy, REGULATION AND DEREGULATION). La afirmación del Senador resulta a todas luces pretensiosa pues el proyecto, lejos de incentivar el uso de las preparaciones medicinales con base en productos naturales (que es lo que en últimas permite el crecimiento de una industria), aumenta el tamaño del Estado y la burocracia al crear varios órganos estatales que según algunos miembros de la propia Comisión Revisora de Medicamentos no tienen sentido práctico, como el Organismo de Vigilancia y Control de Productos Herbarios (artículo 1 – Número de Inscripción del Proceso de Acondicionamiento), la Dependencia de Plantas Medicinales y Recursos Naturales del Ministerio de Agricultura (artículo 11), el Comité Nacional de Plantas Medicinales (artículo 12) y el Centro Colombiano de Herbología (artículo 15).203 Del articulado del proyecto se deduce sin mayor dificultad que es grande el poder de quienes están interesados en proteger esta industria. El mismo artículo 10 de la última versión del proyecto, publicada en la Gaceta del Congreso de la República de Colombia número 255, de fecha 6 de noviembre de 1998, señala que “Los productos naturales de origen herbario tendrán un Número de Inscripción del Proceso de Acondicionamiento, NIPA, el cual será otorgado a cada productor una sola vez, por cada proceso de acondicionamiento de cada planta, por el Organismo de Estado Encargado, con la aprobación del Comité Nacional de Plantas Medicinales”, artículo que se modificó para atemperar el impacto que causaba su 203 Texto Definitivo al Proyecto de Ley 139 de 1997 Cámara, publicado en la gaceta del Congreso número 255 del 6 de noviembre de 1998. 182 redacción inicial al discriminar tan explícitamente a los productos farmacéuticos de síntesis química.204 Aún cuando el registro “por una sola vez” m i plica un menor desgaste del Estado, en Colombia no existe una infraestructura para revisar de oficio, periódicamente, la eficacia y seguridad de todos los productos farmacéuticos registrados. En efecto, la función de vigilancia y control por parte de las autoridades públicas resulta muchas veces insuficiente. Adicionalmente no encontramos una razón para crear un organismo nuevo, paralelo a la Comisión Revisora de Medicamentos, que se encargue del registro de estos productos, pues en un tema de tanta trascendencia como la salud, el registro de preparaciones farmacéuticas, se trate de aquellas elaboradas con base en productos naturales o de aquellas resultantes de una síntesis química, debe ser unificado, responder a un mismo criterio. 204 La redacción inicial del proyecto de ley era la siguiente: “Los productos naturales de origen herbario no requieren registro sanitario por parte del Ministerio de Salud. Ellos tendrán un número de inscripción que 183 184 5. RESULTADOS DE LA INVESTIGACION DE CAMPO En opinión de quienes defienden ciegamente la medicina natural “los profesionales de la medicina convencional,... se consideran dueños de la verdad.”205 En todo caso, lo cierto es que “La tecnología ha permitido identificar cuáles son las sustancias químicas útiles de las plantas, a fin de proceder a su aislamiento, purificación y elaboración sintética. Sin embargo, los tratamientos con plantas medicinales siguen utilizándose en aquellas regiones del mundo donde el elevado costo de los medicamentos y la falta de información científica hacen que los pueblos continúen con sus antiguas tradiciones.”206 No debe olvidarse que la complejidad de la elaboración de los medicamentos químicos ha obligado a la industria a realizar importantes inversiones económicas, a equivale a la licencia de acondicionamiento, venta y exportación, el cual será otorgado por el Organismo del Estado Encargado ...” 205 Jaramillo, Arcesio. La Medicina del Siglo XXI, Curaciones naturales. Santa Fe de Bogotá: Intermedio Editores. Círculo de Lectores S.A., 1995. p. xiii y xiv. 206 Guía Médica. Tomo 10. Barcelona: Salvat Editores S.A, 1983. p. 48. crear grandes laboratorios y a desarrollar extensas redes comerciales, que a su vez han conducido a la aparición de fuertes intereses que estimulan el consumo de medicamentos. Dadas las limitaciones de tiempo y acceso a la información en territorios diferentes a la ciudad de Santafé de Bogotá, D.C., este trabajo de campo se circunscribe a la Capital de la República de Colombia. PREFERENCIA DE UN SECTOR DE LA POBLACION POR LA UTILIZACION DE PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES. En opinión de Augusto Leyva Samper, profesor de medicina de la Universidad Nacional de Colombia, “la medicina bionergética y otras medicinas alternativas son la mejor opción para brindar servicios médicos al pueblo colombiano, cuya gran mayoría no está en capacidad de pagar los altos costos de la medicina convencional. Exactamente lo mismo pasa en otros países latinoamericanos.”207 En la actualidad, la producción y el uso de productos naturales, cada vez cuentan con mayor cantidad de consumidores y aceptación, ya que creen haber encontrado 185 en aquellos una alternativa con menores costos económicos y más “segura y saludable”, pues están convencidos de que los productos naturales no son tóxicos y no tienen efectos secundarios. 208 Otro aspecto de gran importancia que ha promovido el consumo de medicamentos naturales, es la creencia popular de que éstos tienen la facultad de sanar enfermedades que hasta ahora la medicina tradicional no ha podido curar, sólo controlar. "El cáncer por ejemplo, comenta Eduardo Cuellar,209 puede ser curado con la caléndula y no trae secuelas como sí lo hace una quimioterapia. Y no sólo eso, las esencias naturales no tienen efectos secundarios, no contienen preservativos, nada de químicos, tienen un efecto rápido, se pueden combinar, no tienen manipulación especial y son muy económicos". Las preparaciones farmacéuticas con base en productos naturales elaboradas siguiendo las buenas prácticas de manufactura y dosificados por un médico especialista, pueden llegar a tener un gran valor terapéutico. "Sin embargo hay personas sin escrúpulos, que están vendiendo productos con base en extractos naturales sin ningún control de calidad. Yo pienso que esas personas están prostituyendo la industria, exactamente igual a la mujer que está en la esquina 207 Jaramillo, Arcesio. La Medicina del Siglo XXI, Curaciones naturales. Santa Fe de Bogotá: Intermedio Editores. Círculo de Lectores S.A., 1995. p. xv. 208 CARDENAS. Fundamentos de Farmacología en terapéutica, Santafé de Bogotá. 3ª edición. Balcázar impresores, 1996. p. 1. 209 Esta persona se presenta al público como experta en “magia natural”, y atiende consultas en Santafé de Bogotá, D.C.. 186 vendiendo su cuerpo, son situaciones reprochables. ¿Cuál es el problema de esos productos? No se sabe su procedencia, control de calidad, cómo se sabe si esa semilla es lo que es. La basura se puede conseguir en cualquier parte" dice Juan David Piñeros, antiguo representante legal de LABFARVE.210 Por su parte, algunos expertos en farmacología alopática, afirman que la gran acogida que estos productos tiene entre la población se debe a su efecto placebo. “Si, la gente cree que lo que le dan le va a curar el insomnio y la convencen de eso; se toma las gotas que le dan, y puede dormir esa noche. Lo que no sabe la gente es que quien se las ha recetado o vendido ha ejercido tal poder sobre ella que la ha convencido de que las gotas le van a producir el efecto por ella buscado. Incluso, hace algunos meses dieron un documental en Discovery Channel en el que se explicaban los resultados de una investigación sobre el efecto real de los medicamentos homeopáticos, que tienen mucho mas fundamento científico que los naturistas, en el que afirmaba que la cura de enfermedades con este tipo de medicamentos obedece mas a un placebo que a cualquier efecto real; la gente está convencida de que se va a curar y se cura.”211 210 LABFARVE (Laboratorio Farmacéutico Vegetal) es uno de los laboratorios farmacéuticos dedicados a la fabricación de preparaciones farmacéuticas elaboradas con base en productos naturales más importantes de Colombia. 211 La persona que hizo esta afirmación es muy conocida en el campo de la farmacología en Colombia y prefiere no comprometer su nombre. Por esta razón nos solicitó no revelar su identidad. 187 Juan David Piñeros afirma que "esto no es así; la gente compra los productos por su fácil accesibilidad y no sólo eso, porque se dan (sic) cuenta del valor terapéutico de dichos productos, son efectivos. Hay muchas personas que no los consumen por que no reconocen su valor. Efecto placebo es sentirse que se está tomando algo para mejorarse y en el momento en que no se lo está tomando cree que no se ha mejorado, siendo que ya se tomó la dosis necesaria para mejorarse." Por otra parte, Eduardo Cuellar, el experto en magia natural, considera que las personas lo consultan porque tienen problemas sentimentales, de salud que saben que él puede resolver. Afirma: "esto es cuestión de que si yo estoy en armonía con el cosmos, así la otra persona no crea, la sanación, se da. El responsable soy yo. Yo recomiendo el medicamento o hago un ritual con la planta necesaria. Es cuestión de saber las propiedades de las plantas y así sé que le sirve y qué no le sirve. Con la voluntad yo estoy trabajando, yo activo energías con mi fuerza de voluntad". Eduardo no cree en el efecto placebo, pues considera que la gente lo busca por su capacidad de curación, sus conocimientos y la efectividad de sus medicamentos en corto tiempo. Muchas personas que practican la llamada “medicina natural”, aseguran tener las curas para enfermedades “incurables” por la medicina tradicional. Por ejemplo, Rodrigo Escallón212 afirma haber desarrollado “terapias contra el cáncer y el sida, 212 Esta persona se presenta al público como “médico naturista”, y tiene su consultorio en Santafé de Bogotá, D.C., donde además expende “medicamentos naturistas de origen animal, vegetal y mineral”. 188 utilizando jarabes que reducen el dolor y jamas dejan las secuelas que puede dejar una quimioterapia.” Desde hace algún tiempo Escallón supo de las experiencias de los indígenas del Alto Putumayo con los tumores cancerígenos. “Los Chamanes de la región utilizaban para la reducción de tumores dos plantas de la zona (aún no clasificadas), las cuales resultaban muy efectivas para el control del cáncer. A estas plantas sumó anamú, borojó, llantén y calaguala, vegetales que arrojaron resultados positivos en el tratamiento de cáncer. vegetales nació el Escavit".213 De los extractos de estos Los tratamientos que Escallón ha realizado para combatir el Sida, consisten en el fortalecimiento del sistema inmunológico con una planta peruana, llamada, uña de gato. 5.1 TOXICIDAD vs EFICACIA Y SEGURIDAD DE LAS PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN PRODUCTOS NATURALES Debe tenerse en cuenta que “El papel central de los medicamentos herbarios dentro de la medicina tradicional ha sido reconocido en numerosas oportunidades por la Organización Mundial de la Salud.”214 213 CROMOS. Ciencia, Salud y Tecnología. Marzo 18 de 1996. MONCAYO, Javier Enrique y PIÑEROS, Marión. Informe Final “Definición de criterios para el control de productos de medicina natural”. Santa Fe de Bogotá: Octubre de 1996. p. 3. 214 189 Las plantas medicinales tienen “una utilidad terapéutica (por eso se llaman productos fitoterapéuticos), en consecuencia, poseen uno o varios principios activos que son sustancias químicas producidas en el metabolismo intermediario de la planta y que tienen una actividad farmacológica, y por ende, toxicológica"215. Algunos productos naturales son altamente tóxicos.216 S in embargo, algunos como Eduardo Cuéllar, experto en magia natural, insisten en negar esta característica: "Así sean fuertes contraindicaciones. los componentes de las Hay algunas plantas que sí. plantas, éstas no tienen Si se pasa de la dosis, puede afectar la disminución de la vista. Es manejar dosis, se manejan gramos y hojas, edad de la persona, tipo de alimentación, se tienen en cuenta el signo zodiacal, la posición de la luna." Sostiene también, de manera contradictoria que, aunque algunas plantas contengan veneno y sean altamente tóxicas, curan y no generan daños en el organismo, en los siguientes términos: "yo me preparo espiritualmente en un día determinado y en una hora, determino cuál es el objetivo que quiero lograr, los elementos y la posición astral. Me uno al macro - cosmos, pido permiso a la Divinidad a través del Mantra y manejo lo elemental de cualquier planta. La planta se entrega yo le pido que sane, y cura. Cualquier planta me hace bien. Por ejemplo el borrachero tiene unas propiedades impresionantes, la utilizan para desdoblarse. Pero como sé que es altamente tóxica lo cojo en menguante cuando toda la fuerza está menguada, en luna llena o creciente está puro con toda la 215 CARDENAS. Fundamentos de Farmacología en terapéutica, Santafé de Bogotá. 3ª edición. impresores, 1996. p. 1. 216 Por ejemplo, la cicuta, el curare y la pata de asno, entre otros. Balcázar 190 fuerza. Hay plantas con las que uno tiene que ser más precavido", afirma, Eduardo. En palabras de Antonio Mejía, biólogo, "es más difícil saber la acción de las plantas que la de los productos de síntesis química, puesto que estos tienen un mecanismo de acción aislado, tienen una acción específica, en cambio, las plantas son un conjunto de componentes. No todas las plantas son inocuas hay plantas muy tóxicas." Agrega Antonio Mejía, "por tales motivos nuestro laboratorio (LABFARVE), tiene un gran control en el cultivo, recolección, producción y fabricación de los productos naturales. Se hace una clasificación de las plantas en tóxicas y no tóxicas, se analiza la composición química, luego se hace una prueba en ratones. Por ejemplo, cuando se va a analizar un medicamento tranquilizante, se ponen los ratones a mirar varios huecos, en el momento en que los ratones dejen de verlos todos y se concentren en unos pocos, se percibe la acción del medicamento. Se establece un índice terapéutico, el margen de seguridad y qué dosis se puede dar. Nosotros hacemos varios tipos de estudios para determinar la toxicología en los productos naturales. De igual forma, si se encuentran compatibles dos plantas, las mezclamos para crear un producto nuevo, o también con minerales, como el Carbono.” 191 192 “Aquí se siguen todos los pasos legales, que permiten ver la eficiencia, los riesgos y efectos, la calidad y dosificación de cada uno de los productos" comenta Miguel Pombo, Ingeniero Químico de LABFARVE. Paradójicamente, los propios “hierbateros”, consideran que la venta de las preparaciones farmacéuticas elaboradas con base en productos naturales en las calles sin ningún control es una irresponsabilidad. Eduardo Cuellar, el experto en magia natural, afirma: "yo recomiendo una señora en Paloquemao,217 que tiene en cuenta el corte de las plantas. Por ejemplo, subí a un bus, ahí vendían un aclarador de dientes y ese famoso aclarador contiene ácido. No estoy de acuerdo con eso.". La farmacología vegetal es una herramienta más que tiene el médico, que según María Eugenia Avila, Química Farmacéutica de LABFARVE, "Prácticamente no existen efectos secundarios en los productos elaborados con extracto natural, son muy moderados, tampoco tienen contraindicaciones. Con esto no estoy diciendo que es mejor usar estos medicamentos que los de síntesis química. Creo que un médico debe conocer productos de síntesis vegetal. medicamentos son complementarios. Las dos clases de No estoy diciendo que los productos de síntesis vegetal van a sustituir medicamentos de cuidados intensivos. La medicina 217 Esta es una plaza de mercado ubicada en Santafé de Bogotá, D.C. moderna tiene adelantos como por ejemplo la Penicilina, ésta no tiene remplazo; las hormonas en los anticonceptivos son irremplazables". Todos coinciden en el poder curativo de las plantas, al igual en los efectos que puede ocasionar un medicamento basado en extractos naturales mal dosificado. Y aunque algunos estudiosos de las plantas luchan por tener un registro sanitario, a otros no les preocupa, pues con registro o sin él los medicamentos se siguen comercializando. 5.2 EL SECTOR PRODUCTIVO Y DE COMERCIO DE LAS PREPARACIONES FARMACÉUTICAS ELABORADAS CON BASE EN RECURSOS NATURALES “En Colombia el sector dedicado a la producción de medicamentos con base en recursos naturales tiene una tradición histórica que puede remontarse mas de 50 años atrás. Sin embargo, el auge del sector se ha dado de manera especialmente importante en los últimos diez años.”218 De acuerdo con el Informe Final “Definición de Criterios para el Control de Productos de Medicina Natural” presentado por Jorge Enrique Moncayo y Marión 218 MONCAYO, Javier Enrique y PIÑEROS, Marión. Informe Final “Definición de criterios para el control de productos de medicina natural”. Santa Fe de Bogotá: Octubre de 1996. p. 5. 193 Piñeros a la Comisión Revisora de Productos Farmacéuticos en octubre de 1996, en el sector productivo de las preparaciones farmacéuticas con base en recursos naturales puede diferenciarse claramente un “sector formal”y uno “informal”.219 Según este informe, el sector formal se caracteriza por una constitución legal de las personas jurídicas dedicadas a la producción de estas preparaciones farmacéuticas; su cumplimiento con las obligaciones tributarias; una producción planificada; utilización de mano de obra calificada y organizada; intelectual; altos índices de inversión; la protección de la propiedad la formación de agremiaciones para la defensa de los intereses sectoriales; una administración técnico - científica; una organización financiera estructurada, con acceso al crédito y planificación presupuestal; y unos mercados planificados e investigados. Por su parte, el sector informal se caracteriza por estar representado en sociedades de hecho, no cumplimiento de las obligaciones tributarias; una producción irregular; mano de obra familiar e informal; intelectual; ausencia de protección de la propiedad bajos índices de inversi ón; asociaciones incipientes, sin personería jurídica, centradas en intereses particulares; una administración empírica; acceso al crédito y manejo financiero coyuntural; difícil y ausencia de mercados planificados, que implican una relación directa con el consumidor. 219 El grado de formalidad es determinado en este informe por la inscripción en el registro mercantil de la Cámara de Comercio. 194 195 Para 1996, tan solo 314 establecimientos de comercio cumplían con su obligación de registro mercantil, y de esos, el 47% no tenía número de identificación tributaria, en consecuencia, no tributaba. En consecuencia “Solo el 14% de los establecimientos están inscritos en Cámara de Comercio.”220 Paralelamente, se expenden productos en domicilios. 5.3 LA LUCHA POR LA LEGALIZACION Y POR UNA REGULACION INDEPENDIENTE Las asociaciones colombianas de naturistas, luchan por la legalizar la fabricación y el uso de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, evitando así que la medicina natural sea desplazada por la medicina convencional. “Por ejemplo, los productos vegetales que no están permitidos por el Invima para que sean comercializados, se empacan como un recurso natural semiprocesado, no como una preparación farmacéutica, para poderlos vender de la misma forma que las aguas aromáticas”, afirma uno de los entrevistados, quien prefiere que no se revele su identidad. Agrega también que “aunque existe un marco legal para la industria de los productos naturales, su consumo y distribución han sido limitados, ya que según éste, se les impide hacer publicidad, hacer mezclas entre plantas, incluir marcas que identifiquen los productos y sólo se admiten 61 plantas para que sean comercializadas. "En el Decreto 677 de 1995 mediante el cual (sic) se intentó resumir la reglamentación de productos muy diversos en una sola norma y se deroga la norma que independientemente regía la elaboración, comercialización, consecución de registros y licencias y aspectos varios de la industria de los productos elaborados a base de recursos naturales.221 A pesar de existir un capítulo independiente para la regulación de nuestros productos, los requisitos para la consecución de licencias sanitarias de funcionamiento y de los registros remite a los capítulos referente a medicamentos y por definición no somos medicamentos. No perteneciendo a esa gama de productos, la norma es igual para todos".222 Esta situación a complicado la consecución de los registros sanitarios para los diversos productos naturales. Sin embargo, otros como Eduardo Cuellar, el experto en magia natural, consideran innecesario el registro sanitario pues "esos los prepara uno, son de vida corta y no tienen preservativos, entonces para qué registro?".223 Por su parte, miembros de las diferentes asociaciones naturistas, proponen establecer un marco legal 220 MONCAYO, Javier Enrique y PIÑEROS, Marión. Informe Final “Definición de criterios para el control de productos de medicina natural”. Santa Fe de Bogotá: Octubre de 1996. p. 10. 221 La norma derogada es el Decreto 1524 de 1990. Consúltese capítulo 3. Evolución Normativa, de este trabajo. 222 223 FENAT. Federación Naturista Colombiana. Carta al Ministerio de Salud. 1997 Este comentario de Eduardo Cuellar hace referencia a las preparaciones farmacéuticas elaboradas con base en productos naturales. 196 absolutamente independiente, que no se rija bajo las normas de los medicamentos farmacéuticos, pues de esta forma, en opinión de ellos, se está limitando la posibilidad de entrar en el mercado y de desarrollar la industria.224 "Yo estoy de acuerdo con la venta de dichos medicamentos siempre y cuando tengan una investigación, un control de calidad, su registro sanitario. Claro que prefiero quedarme con un producto conocido, que se saben cuáles son sus contraindicaciones. En algunos casos consumir medicamentos en base de productos naturales es arriesgado. Usted ve un medicamento natural y siempre dice: contraindicaciones, ninguna conocida, ahí dice eso, yo no sé hasta donde sea cierto" comenta Emilio Quintero, químico farmacéutico de LAFARVE. Según el biólogo Antonio Mejía, el estudio de los medicamentos de síntesis química es muy diferente y más complejo al de las plantas medicinales, ya que los medicamentos de síntesis química sólo comprometen los receptores específicos para una molécula en particular. "No deberían medirnos con la misma regla, es mejor tener una legislación independiente y que nos juzguen por lo que somos. Los estudios deben ser rigurosos pero de acuerdo a las posibilidades de la industria de productos naturales, puesto que en algunos casos la tecnología para llevar a cabo los estudios es costosa para las instituciones, más aún para los laboratorios que no 224 El Decreto 337 de 1998, actualmente vigente, regula la producción, envase, expendio, importación, exportación y comercialización de las preparaciones farmacéuticas elaboradas con base en productos naturales. Sin embargo, en lo no previsto en él se aplican las disposiciones contenidas en el Decreto 677 de 1995. 197 cuentan con esta infraestructura. Nuestras armas son la ciencia y la investigación, no el dinero, ni los métodos violentos". Aunque no haya una reglamentación que permita la libre comercialización y el uso de las plantas medicinales (situación que permite y estimula la venta clandestina de dicho mercado y también amenaza la salud de los consumidores), no se pueden dejar en el olvido dichas prácticas culturales que buscaban el bien común. Sin embargo, el Estado como ente encargado de la preservación, recuperación y promoción de la salud, ejerce sus funciones para protegerla, controlando y regulando la calidad de la producción, fabricación y conservación de los medicamentos. Teniendo en cuenta, también, que la Organización Mundial de la Salud en la declaración de Alma Ata, de 1978, permite usar los recursos naturales, como una alternativa que brinda salud, mediante el uso racional de las plantas medicinales: "Existe la venta de productos obtenidos de plantas, a través de farmacias o droguerías, los cuales han tenido su respectivo Registro Sanitario legal. Estos medicamentos son el resultado de una alta tecnología de laboratorios farmacéuticos que han hecho las investigaciones preclínicas y clínicas adecuadas".225 Según el informe final de Definición de Criterios para el Control de productos de Medicina Natural, mencionado, muchas preparaciones farmacéuticas elaboradas con base en productos naturales comercializadas carecen de un adecuado control 225 CARDENAS. Fundamentos de Farmacología en terapéutica, Santafé de Bogotá. 3ª edición. impresores, 1996. p. 715. Balcázar 198 farmacéutico y no están en la lista básica de productos admitidos por el Invima. "El listado agrupa más de 800 productos de diferentes tipos, primando aquellos con nombres comerciales que no permiten establecer los componentes del mismo. Del total sólo 168 son claramente identificables como productos terapéuticos con base en recursos naturales herbarios. De estos, el 75% están por fuera de la lista de productos admitidos por el Invima. El listado se sometió al análisis de un herbólogo experto para determinar la toxicidad posible de los productos ofrecidos. La calificación fue de alta toxicidad para el 2% de los productos, y toxicidad media para el 12%. El 86% restante fue considerado de toxicidad nula".226 Muchos de estos productos se están vendiendo clandestinamente debido a que carecen de un registro sanitario, "favoreciendo – así - el desarrollo de un mercado alterno con características francamente criminales. Se conocen sectores de la ciudad dedicados a la distribución de productos adulterados, que están inundando el mercado, restando calidad y credibilidad hacia el naturismo."227 En la actualidad, los laboratorios de fármacos vegetales están realizando un convenio con las comunidades indígenas, a través del Instituto Alexander Von Humboldt, para estudiar cómo se realiza la extracción y el manejo de los productos naturales dentro de un desarrollo sostenible "el estudio es pertinente hacerlo 226 MONCAYO, Javier Enrique y PIÑEROS, Marión. Informe Final “Definición de criterios para el control de productos de medicina natural”. Santa Fe de Bogotá: Octubre de 1996. p. 12. 227 Ibidem. p. 14. 199 directamente con ellos, puesto que ésta es una tradición milenaria en las comunidades indígenas. Además de tenerlas en cuenta se protegen así sus raíces culturales" comenta Antonio Mejía. Además, según este biólogo, “la idea es fomentar la producción de los medicamentos con extracto natural para crecer la industria en el País y lograr poner los productos en el extranjero, teniendo en cuenta la biodiversidad de Colombia.” De igual manera se deben tener las medidas de control necesarias en la producción y fabricación de los medicamentos naturales, que según la entrevista hecha a un químico farmacéutico, citada en el Informe Final Definición de Criterios para el Control de Productos de Medicina Natural, tantas veces mencionado, "muchas de las exigencias planteadas por el Invima para la expedición de registros sanitarios no guardan relación de proporcionalidad con los riesgos inherentes al proceso productivo. Teniendo en cuenta de que (sic) en el proceso de producción no se está realizando un proceso de síntesis de moléculas nuevas, las medidas de control podrían incrementarse a través de procesos de concertación con cultivadores y proveedores de materia prima (para el control de uso de insecticidas, provisión de las especies correctas) y definición de normas básicas para cada uno de los pasos involucrados en el proceso de producción.” 200 Este químico, según da cuenta el mencionado informe, “Considera que los controles que deben mantenerse hacen relación al control microbiológico de la materia prima y a la comprobación cromatográfica de los compuestos trazadores. Considera que la identificación y cuantificación de productos activos refleja un abordaje reduccionista no aplicable a la composición bioquímica de las plantas"228. Con un control en la calidad de la producción de medicamentos naturales, en cuanto a recolección, cultivo, concentración, secado y vencimiento de la materia prima, se garantiza la eficiencia del producto, pues no consiste en recoger cualquier planta, lavarla, envasarla y venderla "pues de este modo ni siquiera se garantizan las concentraciones apropiadas de los principios activos. Accidentes letales se han producido por consumo de plantas supuestamente medicinales, sin el adecuado control farmacéutico"229. Según Antonio Mejía, la calidad de un vegetal se inicia en el cultivo, teniendo en cuenta los abonos, el contenido y la calidad, las condiciones climáticas y el corte. De acuerdo con el informe final “Definición de Criterios para el Control de Productos de Medicina Natural”, de Javier Enrique Moncayo y Marión Piñeros, presentado a la 228 229 Ibid. p. 18 CARDENAS. Fundamentos de Farmacología en terapéutica, Santafé de Bogotá. 3ª edición. impresores, 1996. p. 719. Balcázar 201 Comisión Revisora de Medicamentos en octubre de 1996, el mercado de las preparaciones farmacéuticas con base en recursos naturales “parece utilizar lógicas y criterios de validación diferentes a los admitidos en los círculos técnico científicos oficiales, y definir las posibles rutas y caminos de acercamiento entre sus actores y el Estado”. 202 203 6. LA EXPERIENCIA DE OTROS PAISES 6.1 PANORAMA GENERAL El crecimiento de la población en los países en desarrollo y el creciente interés de las naciones industrializadas por los efectos de los productos naturales con propiedades medicinales en los organismos humano y animal, han conducido a una importante expansión de la utilización éstos y de las preparaciones farmacéuticas elaboradas con base en ellos; expansión que a su vez ha generado una preocupación por la seguridad y eficacia de su uso, que ha pretendido ser respaldada con regulaciones normativas. La Organización Mundial de la Salud230 ha sido el escenario más importante para la discusión del tema.231 En su seno, los países miembros han compartido sus experiencias en la formulación de políticas al rededor de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, y en la presentación de medidas para su regulación y registro. 230 “La Organización Mundial de la Salud (OMS) o World Health Organization (WHO) es un organismo especializado de la ONU con sede en Ginebra, cuyo objetivo primordial es la promoción de la salud mundial, desarrollando a estos efectos servicios consultivos y técnicos. La Asamblea Mundial es su organismo supremo, constituido por los delegados de todos los países miembros.” MESTRE ROSSI, Carlos. El Sistema Sanitario y la Salud. En: Colección Salvat Temas Claves. Tomo 87. Estella (Marcella): Salvat Editores S.A, 1985. p. 18. 231 A través de su programa de medicina tradicional, la OMS presta un soporte a los estados miembros en sus esfuerzos por formular políticas nacionales sobre el tema, estudiar el potencial de los usos las plantas medicinales y sus productos, su seguridad y eficacia. La finalidad última de este programa es educar e informar al público sobre las prácticas tradicionales de la salud. 204 Para este organismo 232 el término “medicina tradicional”233 implica aproximaciones a la salud a partir de las tradiciones de cada país. La Organización Mundial de la Salud reconoce que los productos naturales, en especial las plantas medicinales, son los más antiguos productos para el cuidado de la salud, y que son importantes para la investigación farmacológica y el desarrollo de los medicamentos, pues los elementos constitutivos de aquellos se utilizan directamente como agentes terapéuticos, como materia prima para la síntesis de medicamentos, y como modelo para la producción de componentes farmacológicos activos. La Asamblea Mundial de la Salud ha reconocido que la mayor parte de la población mundial depende de la medicina tradicional para los cuidados primarios de la salud, y que la fuerza de trabajo representada en los practicantes de ésta es un recurso potencialmente importante para prestar dichos cuidados. La medicina tradicional ha mantenido su popularidad en un número importante de países asiáticos. En China, por ejemplo, las preparaciones herbarias alcanzan entre un 30% y un 50% del total del consumo de medicinas. En 1993 el total de ventas de medicinas herbarias en ese país superó los dos y medio billones de dólares 232 http://www.who.int/inf-if/en/fact/34.html (US$2.52’ ’ ) de los Estados Unidos de Norteamérica. En Japón, entre 1974 y 1989, se incrementó quince veces la venta de preparaciones herbarias medicinales, mientras la venta de productos farmacéuticos de síntesis química se incrementó tan sólo dos punto seis veces. Japón tiene el más alto consumo per cápita de medicinas herbarias a nivel mundial. Durante la década 1980 – 1990, se incrementó de manera especial el interés en la medicina tradicional y alternativa en muchos países desarrollados. Un tercio de los americanos adultos ha usado un tratamiento alternativo y un 74% de la población del reino Unido está de acuerdo en incluir la medicina tradicional dentro del marco de trabajo del Servicio Nacional de Salud. Un estudio de los estados miembros de la Unión Europea en 1991, identificó el uso aproximado de mil cuatrocientos medicamentos herbarios. No obstante lo anterior, sólo los controles legislativos de algunos países a la producción, comercialización y consumo de los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en éstos, han respondido a un modelo estructurado. En todo caso existe una creciente preocupación, tanto en los países desarrollados como en los países en vía de desarrollo, por establecer regulaciones y sistemas de registro seguros y eficaces. 233 En la práctica este término comprende la acupuntura, la atención tradicional de nacimientos, la sanación mental y la medicina herbaria. 205 206 Con el fin de facilitar el intercambio de las experiencias nacionales en la formulación de políticas sobre los productos utilizados por la medicina tradicional, su regulación y registro, el programa de medicina tradicional de la Organización Mundial de la Salud preparó un documento que describe las experiencias de cincuenta y dos países miembros. Mas adelante se presentará un resumen de algunas de las experiencias más significativas. 6.2 REGULACION Y REGISTRO La regulación jurídica de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, varía en los diferentes países. Mientras en algunos existe una regulación específica para éstos, en otros están contemplados como medicamentos, como alimentos, como cosméticos, o simplemente no están cobijados por ningún tipo de regulación. Algunos de los criterios utilizados para determinar el tipo de regulación aplicable a los productos naturales con propiedades medicinales y a las preparaciones farmacéuticas elaboradas con base en éstos, son su descripción en las farmacopéas y mografías, las solicitudes frente a las autoridades sanitarias para que les sean reconocidos sus efectos terapéuticos y la inclusión de ingredientes sujetos a regulación. 207 Teniendo en cuenta lo anterior, pueden distinguirse sistemas legislativos que contemplan una legislación unificada para todo tipo de productos medicinales;234 sistemas que contemplan una legislación específica e independiente para los productos naturales con propiedades medicinales y para las preparaciones farmacéuticas elaboradas con base en los mismos; y sistemas que contemplan una legislación específica para medicamentos de síntesis química, y en los que los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en los mismos no están sujetos a ningún tipo de control sanitario.235 6.3 EL PROGRAMA DE MEDICINA TRADICIONAL DE LA ORGANIZACIÓN MUNDIAL DE LA SALUD Reconociendo la importancia de los productos naturales en el cuidado primario de la salud, en 1978 la Organización Mundial de la Salud, en la declaración de Alma – Alta, recomendó la inclusión de los mismos en las políticas sanitarias nacionales y en las medidas regulatorias. 234 Bien se trate de medicamentos de síntesis química o de productos naturales con propiedades medicinales y de preparaciones farmacéuticas elaboradas con base en éstos. 235 Sin duda los dos primeros sistemas son mas apropiados que el tercero, pues en ellos se establece un régimen de licencia previa que cuenta con autoridades que determinan los componentes de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, realizan pruebas de seguridad y eficacia antes de que sean comercializados, y la mayor parte de las veces se obliga a los tenedores de las licencias correspondientes a reportar las posibles reacciones adversas. 208 En desarrollo de dicha recomendación, el programa de medicina tradicional de la Organización Mundial de la Salud ha procurado facilitar la integración de la medicina tradicional en los sistemas de cuidado de la salud, promover el uso racional de las medicinas tradicionales a través del desarrollo de guías técnicas y del establecimiento de estándares internacionales sobre el tema, y estableciendo sistemas de información. En 1989, a través de la resolución WHA42.43, la Asamblea Mundial de la Salud solicitó a los estados miembros preparar una evaluación sobre sus sistemas de medicina tradicional, con el fin de establecer un inventario sistemático de las plantas medicinales utilizadas por los practicantes de dicha medicina y la población en general, para así introducir medidas regulatorias y de control de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en los mismos, sus cualidades, eficacia y efectos secundarios. El programa recomienda a los países miembros tener claridad sobre las características farmacéuticas de los productos, realizar análisis de estabilidad y contar con estudios toxicológicos del uso independiente y combinado de los mismos. Con base en esto, ha preparado una lista de productos para facilitar el trabajo a las autoridades regulatorias, los cuerpos científicos y la industria, y para el establecimiento de bases futuras de clasificación de los productos naturales con características farmacéuticas que se acomoden a la interacción cultural. 209 Los principales objetivos del programa consisten en lograr el reconocimiento de la medicina tradicional como parte integral de los sistemas nacionales de salud, la cooperación entre la medicina moderna y la medicina tradicional, la promoción racional del uso de productos naturales con propiedades medicinales y de preparaciones farmacéuticas elaboradas con base en éstos, la introducción de sistemas de seguridad que garanticen la tramitación de quejas, la promoción de estudios y el desarrollo de medidas regulatorias. En este programa, la Organización Mundial de la Salud ha recomendado a los países miembros establecer un comité nacional de expertos que constituya una autoridad apropiada para identificar los pasos y planes necesarios para formular una política nacional en esta área y su posterior desarrollo, y que monitoree las diferentes fases de su implementación. El comité debe establecer una lista de medicinas herbarias, preparar una guía sobre los requisitos para su registro, crear un sistema nacional de licencias, reportar las reacciones adversas y proponer métodos eficaces de comunicación y cooperación con los respectivos ministerios de salud. El criterio de selección de las medicinas herbarias debe ser seguro, eficaz y responder a las necesidades de salud de la población.236 236 El programa reconoce que muchas de las plantas medicinales deben ser objeto de estudios científicos. Con base en la lista de plantas medicinales de cada país, se debe establecer una política sobre su cultivo, producción, procesamiento, comercialización y preservación de la flora nacional.237 Las investigaciones deben diferenciar entre plantas medicinales con una extensa y documentada experiencia y aquellas cuyo uso tradicional aún no ha sido establecido. De acuerdo con los parámetros establecidos por la Organización Mundial de la Salud estos estudios deben tener en cuenta la experiencia tradicional, tanto médica como etnológica,238 y deben contener las características botánicas de las plantas, las características químicas de sus componentes, un sumario de sus aplicaciones, sus características farmacológicas, su posología, las posibles contraindicaciones y precauciones y los efectos potencialmente adversos. 6.4 SISTEMAS DE REGULACIÓN EN LOS DIFERENTES PAÍSES239 A continuación se hará una breve exposición de la experiencia en la utilización de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, en los países más representativos de cada continente. 237 El Decreto 337 de 1998, expedido por el Ministerio de Salud de la República de Colombia, regula la producción, envase, expendio, importación, exportación y comercialización de las preparaciones farmacéuticas elaboradas con base en productos naturales y traza las directrices que deben orientar las políticas de cultivo, comercialización y preservación de los productos naturales con propiedades medicinales. 238 239 Incluido en WHO/TRM/91.4. La información que aparece en esta sección ha sido tomada en su mayor parte de http://www.who.int/infif/en/fact/34.html 210 211 6.4.1 En los países africanos. 6.4.1.1 Sudáfrica. En Sudáfrica la mayor parte de la población consulta a curanderos tradicionales con relativa frecuencia. Los médicos modernos son escasos, frente a la gran cantidad de curanderos. Las medicinas tradicionales están incluidas en la sección de política de drogas del Programa de Reconstrucción y Desarrollo del Gobierno. Los objetivos de este programa son proveer información apropiada a los curanderos tradicionales y a los profesionales de la salud, entrenarlos en la utilización de productos naturales con propiedades medicinales y de preparaciones farmacéuticas elaboradas con base en éstos, promover el uso de medicinas tradicionales seguras, efectivas y de alta calidad, y apoyar el desarrollo industrial del sector.240 El comercio de los productos naturales con propiedades medicinales en crudo, está completamente desregulado. No obstante esto, la comercialización de las preparaciones farmacéuticas elaboradas con base en éstos, debe estar precedida de su registro en el Consejo de Control de Medicinas, que para estos efectos verifica si la 240 Felhaber T, Gericke N. TRAMED. Final Narrative Report: 1 June 1994 - 30 April 1996. Traditional Medicines Programme at the University of Cape Town, 1996. Unpublished. Citado en http://www.who.int/infif/en/fact/34.html. preparación está de acuerdo con los estándares internacionales de eficacia y seguridad.241 6.4.2 En los países americanos 6.4.2.1 Argentina. En Argentina las plantas medicinales se encuentran disponibles a través de diferentes canales de distribución, de los cuales, sólo las farmacias, las herboristerias y las industrias farmacéuticas deben estar dirigidas por farmacéuticos o químicos farmacéuticos, de acuerdo con la Ley de Drogas y Farmacopea Nacional. Las herboristerias están autorizadas para vender drogas vegetales pero no mezclas, y las personas que cultivan plantas medicinales deben contar con la autorización del Ministerio de Salud.242 Antes de 1993, en Argentina no existía un control específico para la recolección secado, conservación y pulverización de las plantas medicinales. A pesar de que las herboristerías estaban controladas en la ley, la venta de plantas medicinales a través de otros canales de distribución estaba completamente descontrolada, con lo que plantas potencialmente tóxicas se encontraban en el mercado con facilidad; a pesar de que los métodos (farmaconósticos) estaban descritos en la Farmacopea Nacional Argentina, no se indicaban métodos para la determinación de los principios activos; 241 Los estándares farmacéuticos deben guardar concordancia con los establecidos en la farmacopéa de los Estados Unidos y en la farmacopéa británica. 212 no había definiciones oficiales de qué se consideraba una planta medicinal y qué no, por lo que algunas plantas que eran usadas como alimentos estaban incluidas en la farmacopea. Tampoco eran claros los requisitos que debían cumplirse para solicitar el registro de medicamentos elaborados con base en plantas medicinales. En noviembre de 1993, el Ministerio de Salud de la Provincia de Buenos Aires expidió una regulación que estableció la obligación de registrar las materias primas de las preparaciones farmacéuticas elaboradas con base en productos naturales. Según esta regulación, la solicitud de registro debe expresar el nombre de la planta, la parte de la planta utilizada, el principio activo, y las indicaciones terapéuticas de la misma. En el caso de mezcla de hierbas, debe también demostrarse el beneficio de la combinación. El Certificado expedido por el Laboratorio Central de Salud es válido por 5 años, y la prórroga debe ser solicitada al menos treinta días antes de la fecha de expiración.243 En Argentina, el registro de medicamentos y alimentos está centralizado en el Instituto Nacional de Farmacología y Bromatología. 6.4.2.2 Canadá. Los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en éstos, están regulados como 242 Salvidia M, Bandoni AL. Plantas Medicinales: Antecedentes para su Normalización en Argentina. Acta Farm Bonaerense 1987; 6(3): 195-206. Citado en http://www.who.int/inf-if/en/fact/34.html. 243 Provincia de Buenos Aires, Ministerio de Salud y Acción Social. Reglamentación para el Registro y Comercialización de Hierbas Medicinales. Boletin Farmacéutico Bonaerense, Noviembre 1993,11-12. 213 medicamentos en Canadá, y por lo tanto, están sujetos a la Ley y Reglamento de Medicamentos y Alimentos. Antes de asignar un registro o número de identificación de medicamento, se requiere el escrutinio de su composición. El 13 de agosto de 1987, luego de una larga discusión entre las partes interesadas y los expertos, la Oficina Canadiense de Protección de la Salud, expidió una carta de información que contenía una lista de hierbas consideradas peligrosas o que requerían etiquetas de prevención. Se reportó que ciertos productos podían ser vendidos como alimentos, como medicamentos e incluso como cosméticos, dependiendo de sus propiedades y de la forma de su utilización. Algunos productos naturales con propiedades medicinales y algunas preparaciones farmacéuticas elaboradas con base en éstos fueron aceptados como medicamentos sobre la base del conocimiento y de las prescripciones cuantitativas del ingrediente activo, y se contempló la posibilidad de que fueran utilizados para los cuidados primarios de la salud. Así mismo, fueron registrados sobre la base de referencias bibliográficas, lógicas, farmacológicas y racionales, que incluyen los usos tradicionales verificados que no han sido sustituidos por investigaciones y estudios recientes. Por otra parte, estableció mecanismos para incrementar el control y vigilancia de éstos, una vez se encontraran en el mercado. 214 215 El 5 de enero de 1990, la Oficina de Protección de la Salud expidió otra carta informativa para aclarar la política de sobre las medicinas herbales, delinear los requisitos regulatorios y determinar el trámite de las solicitudes de registro de éstos. Estableció que los factores determinantes para determinar si un producto herbal podía considerarse como alimento o como medicamento, eran la actividad farmacológica de sus ingredientes y el propósito para el cual era utilizado. Así mismo, clasificó los productos medicinales herbales en dos grupos principales, a saber: productos contenidos en farmacopeas y principales obras de referencia farmacológica y productos que han recibido relativamente poca atención en la literatura científica y por lo tanto pueden no ser bien conocidos en Canadá. Los primeros son revisados de la misma manera que otros productos farmacéuticos y se encuentran ampliamente disponibles en el mercado de prescripción o como medicamentos de venta libre. 6.4.2.3 Estados Unidos de América. En los Estados Unidos de América, el uso de productos naturales con propiedades medicinales y de preparaciones farmacéuticas elaboradas con base en éstos, es menos generalizado que en la mayoría de las naciones desarrolladas. Esto parece obedecer a que su distribución se ha limitado principalmente a las tiendas de alimentos dietéticos, que son frecuentadas sólo por una porción pequeña de la población.244 Desde finales de la década de 1930, cuando se expidió la Ley de Alimentos, Cosméticos y Medicamentos, la Administración de Drogas y Alimentos (FDA) ha regulado como drogas cualquier producto que se registre para tratar, curar, mitigar o impedir una enfermedad. La mayoría de los productos naturales con propiedades medicinales se regulan en los Estados Unidos de América como alimentos o aditivos alimentarios, aunque muchos son usados como medicinas populares. Los productos naturales con propiedades medicinales teóricamente son reconocidos como seguros (GRAS), cuando expertos calificados lo confirman.245 Desde 1976, la regulación civil para el mercado alimentario de salud establece que los alimentos, incluyendo los productos vegetales y los suplementos dietéticos, no son medicamentos. Esta regulación ordenó a la Administración de Drogas y Alimentos (FDA) elaborar monografías sobre suplementos dietéticos, vitaminas, minerales y productos naturales de origen vegetal.246 En 1990, el Congreso Federal aprobó la Ley de Alimentación, Rotulación y Educación (NLEA), que ordenó que todos los productos alimenticios debía contar con una rotulación sobre sus nutrientes, y que la Administración de Drogas y Alimentos (FDA) debía establecer los criterios para aprobar las etiquetas de los alimentos. 244 Kuipers SE, Farnsworth NR, Fong HMS, Segelman AB. Herbal Medicines - A Continuing World Trend. Presentation at the 1st World Federation of Proprietary Medicine Manufacturers Asia Pacific Regional Meeting, Jakarta. Unpublished. Citado en http://www.who.int/inf-if/en/fact/34.html. 245 246 Ibidem. Ibidem. 216 217 En octubre de 1994, la Ley de Suplementos Dietéticos, Educación y Salud reconoció que los suplementos dietéticos han demostrado ser útiles para prevenir enfermedades crónicas y por lo tanto ayudan a limitar costos a largo plazo de salud pública. Las yerbas y otros productos botánicos, las vitaminas y los minerales son incluidos desde entonces dentro del grupo de los suplementos dietéticos presentados en cápsulas, tabletas, y líquidos, entre otras formas. Los suplementos dietéticos no requieren aprobación pre-mercado por parte de la Administración de Drogas y Alimentos (FDA). Por otra parte, permite incluir en las etiquetas de los suplementos dietéticos, declaraciones sobre beneficios relativos a deficiencias en la administración clásica. La expedición de la ley de la Ley de Suplementos Dietéticos, Salud y Educación, en octubre de 1994, ha acelerado el reconocimiento y ha aumentado la importancia de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en los mismos en el mercado americano, permitiendo su comercialización como suplementos dietéticos, siempre que existan datos para demostrar que son seguros. Las oportunidades, sin embargo, para comercializar propiedades preparaciones productos naturales farmacéuticas con elaboradas con base medicinales en los y mismos de las como medicamentos es baja, pues en la actualidad la Administración de Drogas y Alimentos (FDA) como evidencia de eficacia, aportes bibliográficos, y por el contrario, exige ensayos controlados aleatorizados.247 247 Marwick C. Growing Use of Medicinal Botanicals Forces Assessment by Drug Regulators. JAMA 1995;273:607609. Citado en http://www.who.int/inf-if/en/fact/34.html. 218 6.4.3 En los países europeos. La Unión Europea ha desarrollado una red legislativa comprensiva para facilitar el movimiento libre de mercancías, capital, servicios y personas entre los países miembros. Según Directivas 65/65/CEE248 y 75/318/CEE,249 los productos farmacéuticos requieren aprobación antes de comercializarse. Los requisitos para la documentación de calidad, seguridad, y eficacia, así como los informes de expertos se establecen en la Directiva 91/507/CEE.250 La Directiva 75/318/CEE, citada, en su artículo 39, ordena a los estados miembros determinar, en un periodo no mayor de 12 años,251 los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en éstos, que cumplen los requerimientos establecidos en las Directivas 65/65/CEE y 75/318/CEE. Teniendo en cuenta que el término mencionado se ha prorrogado en varias oportunidades, a continuación se hará una descripción del régimen de transición de algunos de los países miembros de la Unión. 248 Council Directive 65/65/EEC of 26 January 1965 on the approximation of provisions laid down by law, regulation or administrative action relating to proprietary medicinal products. Official Journal of the European Communities nE 22 of 9 February 1965. Citado en http://www.who.int/inf-if/en/fact/34.html. 249 Council Directive 75/318/EEC of 20 May 1975 on the approximation of the laws of Member States relating to analytical, pharmacotoxicological and clinical standards and protocols in respect of the testing of proprietary medicinal products. Official Journal of the European Communities nE L 147 of 9 June 1975. Citado en http://www.who.int/inf-if/en/fact/34.html. 250 Commission Directive 91/507/EEC of 19 July 1991 modifying the Annex to Council Directive 75/318/EEC on the approximation of the laws of Member States relating to analytical, pharmacotoxicological and clinical standards and protocols in respect of the testing of medicinal products. Official Journal of the European Communities nE L. 270/32 of 26 September 1991. Citado en http://www.who.int/inf-if/en/fact/34.html. 251 Contados a partir del 1 de enero de 1977, y que posteriormente se extendió hasta el 30 de abril de 1990. 219 Para lograr el movimiento libre de medicinas dentro del mercado común de la Unión Europea, y la centralización para la autorización de su venta, se ha implantado un sistema de reconocimiento mutuo para las decisiones de autorización de venta.252 Este "procedimiento descentralizado" prevé, por regla general, que la aprobación de un producto por una autoridad nacional es suficiente para la inscripción subsiguiente en otros estados miembros. Si se presentan diferencias en la evaluación hecha por diferentes autoridades nacionales, la decisión es adoptada por una autoridad de la Unión Europea que, en el supuesto de un resultado negativo, puede invalidar la primera inscripción. La armonización de evaluación científica se considera una condición precedente para el ajuste de decisiones diferentes de autorización comercial, particularmente en el campo de fitomedicinas, en el que hay tradiciones y puntos de vista nacionales diferentes.253 La Cooperativa Científica Europea sobre Fitoterapia (ESCOP) se fundó en 1989, con el objeto de establecer criterios armonizados para la evaluación de fitomedicinas, para la investigación científica de apoyo y para contribuir a la aceptación de la fitoterapia a un nivel europeo.254 Los criterios para la selección de plantas medicinales y la preparación de SPCS redactados por el Comité Científico son 252 Council Directive 93/39/EEC of 14 June 1993 amending Directives 65/65/EEC, 75/318/EEC and 75/319/EEC in respect of medicinal products. Official Journal of the European Communities nE L 214 of 24 August 1993. Citado en http://www.who.int/inf-if/en/fact/34.html. 253 Quality of Herbal Remedies. In: The Rules governing Medicinal Products in the European Community, Vol. III. Guidelines on the quality, safety and efficacy of medicinal products for human use. Luxembourg: Office for Official Publications of the European Communities, 1989. Citado en http://www.who.int/inf-if/en/fact/34.html. principalmente su importancia en países europeos y su inclusión en la Farmacopea Europea o en alguna Farmacopea Nacional. 6.4.3.1 Alemania. Las preparaciones farmacéuticas elaboradas con base en productos naturales representan una fracción importante del mercado farmacéutico alemán. Según un estudio realizado por el Allensbach255 entre la población alemana, en junio de 1989, un 58% de la población había utilizado productos naturales con propiedades medicinales o preparaciones farmacéuticas elaboradas con base en éstos, el 44% de ellos dentro del año anterior, y las preparaciones farmacéuticas elaboradas con base en productos naturales eran consideradas por la mayoría de los encuestados más inofensivas con respecto a los medicamentos de síntesis química.256 En Alemania las preparaciones farmacéuticas elaboradas con base en productos naturales son, en el principio, reembolsables por el sistema de seguro de salud a menos que se encuentran específicamente excluidas (por ejemplo los laxantes y las sustancias con una evaluación negativa por la Comisión Europea). 254 European Phytotelegram. Sixth issue. - August 1994. Citado en http://www.who.int/inf-if/en/fact/34.html. 255 Die junge Generation wendet sich den Naturheilmitteln zu. Allensbacher Berichte, Nr. 17 (1989). http://www.who.int/inf-if/en/fact/34.html. 256 Ibidem. Citado en 220 El Instituto Federal para Drogas y Dispositivos Médicos, Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), es desde 1994 el responsable del registro de los medicamentos, previa comprobación de su calidad, seguridad y eficacia. Los criterios para la inscripción son fijados tanto por directivas europeas, como la Guía sobre la Calidad de Remedios Herbarios y la Farmacopea Europea, y por directivas nacionales. Las medicinas o los grupos de medicinas que no representen un riesgo directo o indirecto para la salud de los hombres y de los animales no requieren autorización para su venta, según la sección 36 de la Ley de Medicamentos. Para asegurar su calidad, seguridad y eficacia, cada producto medicinal que se remita a este procedimiento debe cumplir exactamente con una monografía de autorización comercial normalizada, publicada por el Ministerio de Salud. Las monografías incluyen requerimientos analíticos de prueba y también los textos para etiquetas y envase los folletos (279 monografías de autorizaciones comerciales normalizadas se han publicado, principalmente para tés herbarios).257 En agosto de 1994, entró en vigor la Quinta Enmienda de la Ley Alemana de Medicinas. Esta enmienda prevé la posibilidad de demostrar la eficacia de las preparaciones farmacéuticas elaboradas con base en productos naturales mediante la sustentación de su uso tradicional que se encuentren dentro de los productos 221 considerados seguros en la Unión. Sin embargo, deben ser etiquetadas como "tradicionalmente usadas”. 6.4.3.2 Italia. El 8 de enero de 1981, la Autoridad Italiana de Salud expidió una directiva nacional que clasifica las preparaciones elaboradas con base en productos naturales en preparaciones farmacéuticas y en alimentos. Las preparaciones clasificadas como alimentos no pueden tener indicaciones terapéuticas y no necesitan de registro sanitario; pero la Autoridad Italiana de Salud debe aprobar el contenido de la etiqueta; pueden ser vendidas fuera de las farmacias, en las llamadas "erboristerias" (herboristerías); los "erboristas" (quienes atienden en las "erboristerias") no pueden hacer recomendaciones sobre el uso de los productos herbarios, ni preparar mezclas de éstos. Por el contrario, las clasificadas como preparaciones farmacéuticas están sometidas al régimen general de las medicinas; en consecuencia están sujetas a su registro sanitario y solo pueden ser vendidas en farmacias, por ejemplo, en "erboristerias". La directiva contiene dos listas anexas, una para plantas medicinales que sólo se pueden vender en farmacias, y una segunda lista de plantas que pueden venderse fuera de las farmacias. 257 Keller K. Pflanzliche Arzneimittel - rechtlicher Status und offene Forschungsfragen. Forschungsmagazin der Johannes Gutenberg Universität Mainz, Sonderausgabe Naturheilkunde 1992;59-68. Citado en 222 223 6.4.3.3 Reino Unido. Los requerimientos del sistema de licenciamiento de medicamentos en el Reino Unido están contemplados en la parte II de la Ley de Medicinas de 1968. Sin la licencia apropiada es un delito fabricar, vender, abastecer, exportar o importar una medicina en el Reino Unido, excepto cuando se trata de plantas sometidas únicamente a procesos de secado, compresión o pulverización; plantas comercializadas bajo su nombre botánico; y plantas comercializadas sin la recomendación terapéutica escrita. Sin embargo, las mezclas de plantas con propiedades medicinales está prohibida. La Agencia de Medicinas Controladas ha exigido que las etiquetas de los productos mencionados incluyan las siguientes declaraciones: "un remedio herbario tradicionalmente usado para curar los síntomas de..." y "si los síntomas persisten consulte a su médico". Las mencionadas excepciones fueron modificadas por la Orden de Venta Detallista o Abastecimiento de Remedios Herbarios, con el propósito de controlar el uso de plantas potencialmente tóxicas, retirándolas de la categoría de venta libre y limitando las rutas permitidas para su administración. http://www.who.int/inf-if/en/fact/34.html. 224 6.4.4 En los países asiáticos. 6.4.4.1 India. El uso tradicional de preparaciones farmacéuticas elaboradas con base en productos naturales hace parte del folklor hidú. La mayoría de quienes practican la medicina natural formulan y dispensan sus propias recetas. En este país los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en los mismos se rigen por la Ley de Drogas y Cosméticos de 1940 y las Reglas de Cosméticos y Drogas de 1945, que regulan la importación, fabricación, distribución y venta de medicamentos y cosméticos. En 1959, el Gobierno de la India reconoció los sistemas hindúes tradicionales de medicina y reformó la Ley de Drogas y Cosméticos para incluir en ella los productos naturales con propiedades medicinales y las preparaciones farmacéuticas elaboradas con base en los mismos. La producción de éstas requiere de una licencia previa expedida por la Autoridad de Control de Narcóticos del Estado. Se han constituido comités específicos con funciones consultivas, para asistir al gobierno en la expedición de normas relacionadas con las preparaciones farmacéuticas elaboradas con base en productos naturales y para preparar la farmacopea correspondiente. gobierno hindú desarrolló En 1993, un comité experto nombrado por el directivas sobre la seguridad y la eficacia de preparaciones farmacéuticas elaboradas con base en productos naturales y propuso limitar las licencias de su fabricación a los productos que cumplieran las fórmulas establecidas en los libros específicamente autorizados para el efecto. 6.4.4.2 China. El descubrimiento de materiales medicinales en los tiempos antiguos ha estado ligado a la vida y trabajo de la población china y a sus condiciones naturales de vida. La Constitución de la China Popular establece que la medicina tradicional y la moderna pueden ser desarrolladas simultáneamente. A finales de 1995 había cerca de 2.552 hospitales con 276.000 camas, dedicados a la medicina tradicional. La mayoría de los hospitales chinos tienen un departamento de medicina tradicional. Las ventas totales de preparaciones farmacéuticas elaboradas con base en productos naturales, manufacturadas en China, alcanzó 17.6 millones de Yuans, un 213% superior a la suma de 1990. La edición de 1990 de la farmacopea china incluye 784 artículos sobre medicamentos naturales chinos. Las monografías describen la fuente de las sustancias usadas, las prescripciones, métodos de preparación, identificación, examen, extracción, efectos y principales indicaciones, así como los métodos de uso, dosis, precauciones, etc. 225 Legalmente, las preparaciones farmacéuticas elaboradas con base en productos naturales son consideradas como productos con requisitos especiales de calidad, seguridad, eficacia, y rotulación especial de etiquetas para el mercadeo, y están sometidos a la Ley de Administración de Medicamentos, que exige su registro sanitario. Dicha ley establece que el Estado debe fomentar el desarrollo de la medicina moderna y tradicional, así como proteger los productos naturales con propiedades medicinales y estimular su cultivo. Así mismo exige a las empresas dedicadas a la producción de preparaciones farmacéuticas elaboradas con productos naturales, estar asistidas por farmacéuticos familiarizados con las propiedades de tales productos, registrados en una oficina de salud. De acuerdo con esta ley, el Ministerio de la Salud Pública puede restringir o prohibir la exportación de productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, si hay poco abastecimiento en el mercado local. El artículo 31 establece que la venta de plantas medicinales recientemente descubiertas o introducidas del exterior no está permitida a menos que se apruebe por la oficina de salud de la respectiva provincia, región o municipio. La aprobación de nuevos medicamentos y su licencia respectiva, son expedidas por el Ministerio de la Salud Pública, una vez se comprueba su eficacia y seguridad. 226 Estas características se establecen previo estudio de una documentación completa sobre su procesamiento, sus propiedades, pruebas de toxicidad aguda, carcinogénica, mutagénica o reproductiva, su calidad y estabilidad. 6.4.4.3 Japón. Las medicinas tradicionales han sido usadas efectivamente en la sociedad japonesa por más de 1.000 años. En Japón la medicina de la antigua China o Kampo es la mas popular. En este país el consumo per cápita de medicinas herbarias es el más alto del mundo. Desde 1961, casi la totalidad de la población japonesa está cubierta por el Seguro Nacional de Salud (NHI), que cubre las medicinas y tratamientos Kampo. Según una muestra estadística, en 1989 el 45% de los medicamentos vendidos en el Japón correspondían a productos naturales en estado bruto o presentados en forma farmacéutica. El conocimiento popular japonés indica que las medicinas chinas tradicionales son seguras. En la evaluación de eficacia de los medicamentos kampo por parte de las autoridades sanitarias, tienen incluso mayor importancia los “hechos empíricos o experiencia”, que a la acción farmacológica de cada ingrediente. 227 228 Sin embargo, el control de calidad de los medicamentos kampo se ha incrementado desde mediados de la década de 1980, cuando la Oficina de Asuntos Farmacéuticos expidió una nueva regulación, fijando estándares para la producción y la calidad de éstos. Desde entonces, el Ministerio de Salud japonés utiliza tres sistemas principales para recopilar datos sobre reacciones adversas de los medicamentos, que consisten en el monitoreo de hospitales; el monitoreo de Farmacias, que recolectan datos de reacciones adversas de drogas vendidas “sobre el mostrador”; y el reporte de reacciones adversas por parte de los productores. 229 CONCLUSIONES En las diferentes edades de la historia de la humanidad se han utilizado productos naturales de los reinos vegetal, mineral y animal, para tratar, curar e incluso prevenir las enfermedades. La mayor parte de las veces las propiedades medicinales de dichos productos se descubrieron casualmente, y este conocimiento se incorporó en las culturas de los pueblos, transmitiéndose de generación en generación. A partir de la edad moderna, la industria farmacéutica química se ha unido y separado alternativamente con la industria farmacéutica natural. En Colombia, los primeros pobladores utilizaron productos naturales principalmente de origen vegetal para tratar y curar enfermedades físicas y psíquicas. En el siglo XVIII, José Celestino Mútis realizó extensos estudios sobre las propiedades medicinales de las plantas encontradas en el país, así como sobre los usos populares de las mismas en el tratamiento y cura de las enfermedades. En el siglo XIX, como en el resto del mundo, nació en Colombia la química moderna. A comienzos del siglo XX, la farmacopea colombiana restó importancia a las plantas medicinales, bajo la influencia de teorías científicas europeas entonces en boga. Actualmente países desarrollados, países en vía de desarrollo y organizaciones internacionales como la Organización Mundial de la Salud, reconocen la importancia de las preparaciones farmacéuticas elaboradas con base en productos naturales, especialmente en el cuidado primario de la salud. Como reflejo del afán del estado colombiano de integrar el sistema sanitario bajo un esquema jurídico operativo que le permita ofrecer a los ciudadanos la posibilidad de ejercer el derecho al disfrute del máximo nivel de salud posible, la regulación sanitaria nacional ha sido objeto de repetidas modificaciones. En efecto, desde 1960 y hasta la fecha, se han expedido 4 leyes, 5 decretos leyes, 14 decretos reglamentarios y un sinnúmero de resoluciones relacionadas, de alguna u otra manera con la regulación sanitaria de las preparaciones farmacéuticas elaboradas con base en productos naturales. 230 Hasta 1990, la regulación sanitaria colombiana no distinguía entre medicamentos de síntesis química y preparaciones farmacéuticas elaboradas con base en productos naturales. Sin embargo en ese año, como resultado del crecimiento de este último sector, el Ministerio de Salud consideró importante establecer reglas específicas que regularan la fabricación, envase, empaque, almacenamiento y expendio de los productos naturales con propiedades medicinales utilizados tradicionalmente en forma empírica, y de las preparaciones farmacéuticas elaboradas con base en los mismos. Como resultado de esto se expidió el Decreto 1524 de 1990, que estableció normas menos exigentes que las que regulaban el sector de los medicamentos de síntesis química. Frente a la necesidad de unificar la reglamentación del régimen de registros, licencias, control de calidad y vigilancia sanitarios de medicamentos, cosméticos y preparaciones farmacéuticas elaboradas con base en productos naturales, entre otros, que hasta entonces se encontraba disperso en diferentes normas, se expide en 1995 el Decreto 677. Teniendo en cuenta que las normas en él establecidas para los productores, preparaciones importadores, farmacéuticas exportadores elaboradas con base y en comercializadores productos de naturales resultaban bastante exigentes frente a la normatividad anterior, se dio un plazo a los mismos para cumplir sus disposiciones. Sin embargo, los representantes de las asociaciones naturistas ejercieron gran influencia sobre las autoridades encargadas de regular el tema, con el fin de que se regresara a un sistema dual. Por esta razón, el plazo contenido en el Decreto 677 de 1995 fue prorrogado en dos 231 oportunidades. Finalmente, después de arduos trabajos de la Comisión Revisora de Productos Farmacéuticos y del Ministerio de Salud, se expidió el Decreto 337 de 1998 que contiene normas especiales sobre la producción, envase, expendio, importación, exportación y comercialización de las preparaciones farmacéuticas elaboradas con base en productos naturales, pero que remite en lo no previsto en él a la regulación general de los medicamentos, contenida en el Decreto 677 de 1995. Aun cuando algunos sectores afirman que las verdaderas propiedades medicinales de las preparaciones farmacéuticas elaboradas con base en productos naturales corresponden a un efecto placebo, y otros aseguran que no tienen efectos tóxicos y que su efectividad es aun mayor que la de los medicamentos de síntesis química, estas preparaciones farmacéuticas tienen gran aceptación entre la población de los diferentes países. En Colombia, la mayor parte de sus consumidores han encontrado en ellas una alternativa con menores costos económicos, mas saludable y efectiva que los medicamentos de síntesis química. Sin embargo, se ha logrado establecer que los productos naturales con propiedades medicinales en estado bruto o presentados en forma farmacéutica pueden tener efectos altamente tóxicos. 232 En nuestro país, en el sector productivo de las preparaciones farmacéuticas elaboradas con base en productos naturales se diferencia un sector formal, que cumple con las normas sanitarias sobre la materia y las normas tributarias, utiliza mano de obra calificada y tiene una organización financiera estructurada; y un sector informal que no cumple con ninguna de estas características. Aun cuando la actual normatividad jurídica colombiana resulta teóricamente adecuada para regulación de la producción y comercialización de los productos naturales con propiedades medicinales y de las preparaciones farmacéuticas elaboradas con base en éstos, la realidad supera la capacidad de control y vigilancia del estado. Prueba de ello es la producción y comercialización de una gran cantidad de dichos productos y preparaciones farmacéuticas sin un adecuado control de calidad, que constituye un mercado clandestino al margen de la normatividad. La regulación de la producción y comercialización al interior de los países, así como su exportación, es esencial. La cooperación internacional y la coordinación de los países permitirá cada vez salvaguardar su uso eficaz y seguro. Los controles legislativos sobre el tema no envuelven un modelo estructurado. Los países han adoptado distintas aproximaciones para su licenciamiento, producción y comercio, con el fin de asegurar su seguridad, cualidades y eficacia. 233 El sistema sanitario de cada país debe respetar las actitudes y preferencias de la población sobre las modalidades asistenciales, y permitir el uso de los recursos habilitados para el logro de la salud de la colectividad. La formulación de las políticas estatales sobre el tema debe tener en cuenta la posibilidad de ampliación de las coberturas de salud, las condiciones de calidad y seguridad de los productos, la libertad de expresiones culturales arraigadas en la comunidad y las posibilidades de producción y comercialización a nivel nacional e internacional. 234 235 BIBLIOGRAFIA ARCINIÉGAS, Germán. Historia de la Medicina en Colombia. Volumen 1. Santa Fe de Bogotá: Universidad Militar Nueva Granada, 1996. p. 82 a 85. COWER, David L. y HELFAND, William H. Historia de la Farmacia. Madrid: Ediciones Doyma. Edición Española, 1990. p. 59 a 245. CARDENAS. Fundamentos de Farmacología en Terapéutica. Santafé de Bogotá: Balcázar impresores. 3ª edición, 1996. p. 1. DIAZ, Elías. La Sociedad entre el Derecho y la Justicia. Estella (Marcella): Colección Salvat Temas Claves. Tomo 73. Salvat Editores S.A., 1985. p. 38, 39, 42 y 43. DICCIONARIO DE LA LENGUA ESPAÑOLA. Vigésima Primera Edición. Madrid: Editorial Espaza Calpe, S.A., 1992. 236 DICCIONARIO MÉDICO. 3° Edición. Manuales Salvat. Barcelona: Salvat Editores, 1990. FUNDAMENTOS DE FARMACOLOGÍA TERAPÉUTICA. Tercera Edición. GACETA DEL CONGRESO DE LA REPÚBLICA DE COLOMBIA. Número 255. GACETA DEL CONGRESO DE LA REPÚBLICA DE COLOMBIA. Número 498. GACETA DEL CONGRESO DE LA REPÚBLICA DE COLOMBIA. Número 79. GARCÍA BARRIGA, Hernando. Primer Simposio sobre plantas medicinales. Universidad Javeriana. Santa Fe de Bogotá, D.C., 1994. p. 19 a 33. GUERRA, Francisco. La Medicina precolombina. Ediciones de Cultura Hispánica Quinto Centenario, 1990. p. 233 a 234. 237 GUÍA MEDICA. Tomo 10. Barcelona, Salvad Editores, S.A., 1983. p. 48 a 53. JARAMILLO, Arcesio. La Medicina del Siglo XXI, Curaciones naturales. Santa Fe de Bogotá: Intermedio Editores. Círculo de Lectores S.A., 1995. p. xiii a xvi. LARGE, Raimundo J. Medicina Natural. Las Plantas Medicinales. Madrid: Edisan S.A., 1987. p. 6 a 13. LOPEZ PIÑERO, José María. La Medicina en la Historia. Colección Salvat Temas Claves. Tomo 17. Estella (Marcella): Salvat Editores S.A., 1985. p. 4, 5, 8, 9, 16 – 21, 56 y 57. MESTRE ROSSI, Carlos. El Sistema Sanitario y la Salud. Colección Salvat Temas Claves. Tomo 87. Estella (Marcella): Salvat Editores S.A., 1985. p. 4-7, 19, 22, 23. NUEVA HISTORIA DE COLOMBIA. Tomo IV. Bogotá: Editorial Planeta, 1989. p. 159. OSORIO, Manuel. Diccionario de Ciencias Jurídicas, Políticas Y Sociales. Buenos Aires: Editorial Heliastas S.R.L.., 1981. p. 720. REVISTA LEGISLACIÓN ECONÓMICA. No. 539. Tomo 46. Bogotá: Legislación económica Ltda. Publicaciones legales y empresariales. p. 160. REVISTA LEGISLACIÓN ECONÓMICA. No. 565. Tomo 48. Bogotá: Legislación económica Ltda. Publicaciones legales y empresariales. p. 204. REVISTA LEGISLACIÓN ECONÓMICA. No. 632. Tomo 54. Bogotá: Legislación económica Ltda. Publicaciones legales y empresariales. p. 86. REVISTA SEMANA. Publicación del 27 de abril de 1998. Santa Fe de Bogotá Publicaciones Semana., 1998. p. 73 y 74. TEXTOS CONSULTADOS EN INTERNET: http://ocea.es/forem/mto.htm http://www.who.int/inf-if/en/fact/34.html 238 239 http://www.who.int/medicines/docs/Pagespublications/Traditionalpub.htm http://www.anmat.gov.ar/farmaco.html http://www.medical-devices-net.com/d9342eng.htm http://www.europarl.eu.int/dg4/factsheets/es/1_2_1.htm