hidratos de carbono
Anuncio
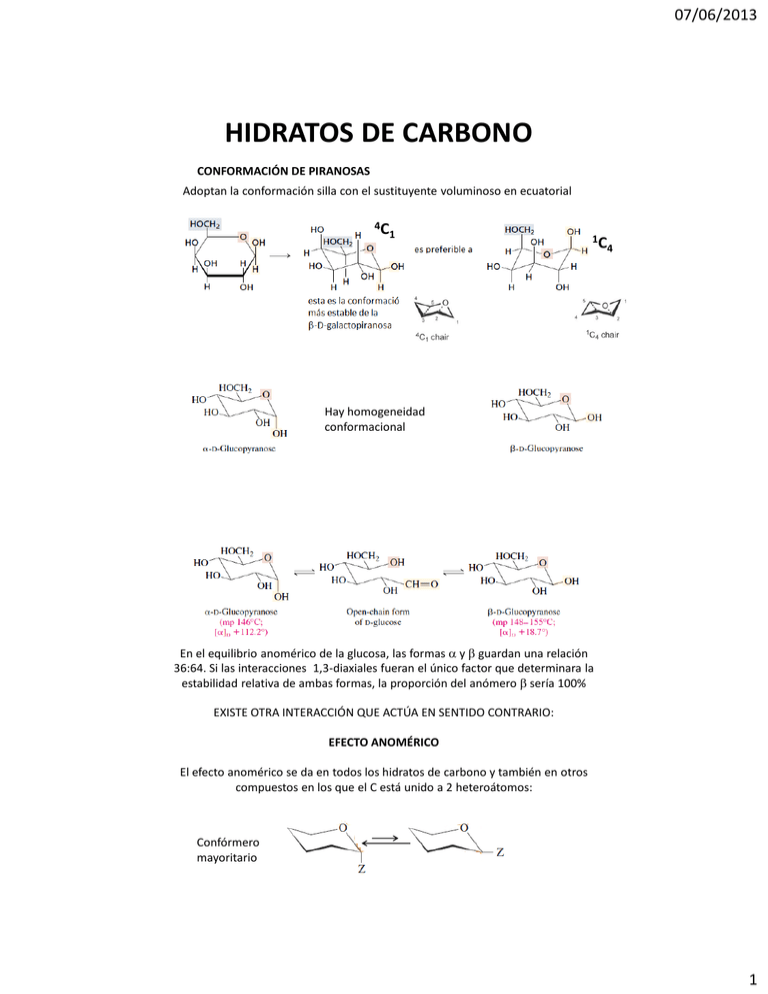
07/06/2013 HIDRATOS DE CARBONO CONFORMACIÓN DE PIRANOSAS Adoptan la conformación silla con el sustituyente voluminoso en ecuatorial 4C 1 1C 4 Hay homogeneidad conformacional En el equilibrio anomérico de la glucosa, las formas y guardan una relación 36:64. Si las interacciones 1,3-diaxiales fueran el único factor que determinara la estabilidad relativa de ambas formas, la proporción del anómero sería 100% EXISTE OTRA INTERACCIÓN QUE ACTÚA EN SENTIDO CONTRARIO: EFECTO ANOMÉRICO El efecto anomérico se da en todos los hidratos de carbono y también en otros compuestos en los que el C está unido a 2 heteroátomos: Confórmero mayoritario 1 07/06/2013 EFECTO ANOMÉRICO: Se explicó por primera vez en 1955 Edward (1955) lo describió como el efecto dipolar que se genera sobre los enlaces C-O. Si los dipolos están paralelos se origina una repulsión, si los dipolos están opuestos, se compensan Lemieux (1962) lo llamó “efecto orejas de conejo”. Los pares de electrones de ambos O se repelen en el anómero . En el esto no sucede. O O O 2 2 O R R Análisis de los rotámeros: modelos y pizarrón! MANOSA: El efecto anomérico explica por qué, en el equilibrio, la proporción del anómero 0. En general también depende de la configuración del C-2 -D-Manp 31 % 2 interacciones gauche entre O 1 interacción gauche C/O -D-Manp 69 % 1 interaccion gauche entre O 1 interacción gauche C/O Efecto anomérico favorable 2 07/06/2013 El efecto anomérico es más intenso en solventes no polares, en los que es más dificil la estabilización por solvatación. También es más intenso a mayor polaridad del sustituyente anomérico: Halógenos > AcO- > MeO- > HO F OAc O O F AcO AcO Influye en la conformación!!! OAc OAc D-xilosa OAc CHO HO H HO H H OH OH OH OHO OH O H OH CH2OH D-idosa HO OH OH HO OH OH 2 interacciones diaxiales OH/OH Efecto anomérico favorable 2 interacciones diaxiales CH2OH/H 4 OH ecuatoriales No existe homogeneidad conformacional: encontramos ambas sillas en el equilibrio 3 07/06/2013 Conformación de furanosas 3-4 kcal / mol 3T 2 E3 O O Barrera de interconvensión conformacional baja: NO HAY homogeneidad conformacional Las conformaciones predominantes ubican: •sustituyente anomérico cuasi axial •Cadena lateral cuasi-ecuatorial H HO HO H HO R H H CHO OH H H OH CH2OH H O OCH3 OH HC OH Metil -Dgalactopiranósido OH CH2OH OCH3 H3CO H H O HO HO R = CH(OH)CH2OH 1T OH O OH CH2OH Dos representaciones posibles de la conformación 0 4 07/06/2013 HIDRATOS DE CARBONO – REACCIONES a) con ácidos (ver heterociclos) H HO H CHO OH H OH CH2OH O CHO b) con bases Epimerización: cambia la configuración del C-2!!! 5 07/06/2013 Reacción de oxidación con Tollens, Fehling o Benedict Ác. Aldónicos (monocarboxílicos) Tollens: Ag(NH3)2 / HO- /H2O Agº (espejo) Fehling: Cu2+(tartato) / HO- /H2O Cu2O (espejo rojo) Benedict: Cu2+(tartato) / HO- /H2O Cu2O Las cetosas también dan positivo, pues en medio alcalino isomerizan a las aldosas correspondientes. AZÚCARES REDUCTORES 6 07/06/2013 ALGUNOS AZÚCARES NO REDUCTORES: Oxidación con bromo Acidos aldónicos Reacción fácil de hacer, no hay sobreoxidación Los ácidos aldónicos existen en equilibrio con sus lactonas: éster intramolecular OH HO O O OH - H2O 1,4-lactona OH OH O OH OH O 1,5-lactona OH 7 07/06/2013 Oxidación con ácido nítrico: obtención de ác. aldáricos Es una oxidación más enérgica Dependiendo de la estereoquímica de los C y de las condiciones (pH) pueden formarse mono y dilactonas O COOH HO O O HO O O OH O O O OH OH HO COOH OH D-glucaro-1,4-lactona D-glucaro-6,3-lactona OH D-glucaro-1,4:6,3-dilactona Ácidos urónicos O O OH COOH OH C-6 COOH OAc OH O OAc OAc OAc OH OAc MnO4K / acetona OAc OAc OH OAc 1 CH2OH OH OH OTr CH2OCPh3 O TrCl / Py OH OH OH OH Ac2O, Py O OH O H+ OAc OAc OH OAc 1 OAc O COOH COOH HO O OH OH OH OH HO O OH O O OH OH Son biológicamente importantes, se encuentran en muchos polisacáridos de interés biológico: heparinas, pectinas, etc. OH OH D-glucurono-6,3-lactona 8 07/06/2013 Ruptura oxidativa H H OH OH + H H HIO4 O O OH O H I O O H O Dioles vecinales H H HO H H CHO OH H OH OH CH2OH 5 HIO4 O OH + HO HIO4 H 1 CH2O IO4- O OHHO O 5 HIO4 3 HCOOH 2 CH2O 1 CO2 CH2O CH2OH HO O CH2OH O HO H H OH H OH CH2OH 5 HCOOH + H2O + IO3- OCH3 O T bajas, t cortos O O OHHO luego O OCH3 OCH3 O O El número de moles de HIO4 consumido será igual al número de enlaces C-C que se han roto. Esta reacción ha sido muy útil para elucidación estructural. La velocidad de la reacción es mayor si los HO se encuentran en cadenas laterales 9 07/06/2013 Reducción a alditoles HO HO HO H HO H H O OH OH CHO OH NaBH 4 H o H2, Ni OH OH CH2OH H HO H H CH2OH OH H OH OH CH2OH Alditol Sorbitol o glucitol CH2OH O HO H H OH H OH CH2OH NaBH 4 H HO H H CH2OH OH H OH OH CH2OH D-sorbitol + HO HO H H CH2OH H H OH OH CH2OH D-manitol Condensación de grupo carbonilo con derivados nitrogenados 10 07/06/2013 H HO H H CHO OH PhNHNH2 H OH EtOH, calor OH CH2OH H HC N NHPh OH HO H H OH H OH CH2OH HC N NHPh H OH 2 PhNHNH2 HO H EtOH, calor H OH H OH CH2OH H HC N NH--Ph .. HO H H OH H OH OH CH2OH - PhNH2 HC N NHPh N NHPh + HO H H OH H OH CH2OH PhNH2 HC NH H HO H H .. O H OH OH CH2OH OSAZONA HC HO H H N N H OH OH CH2OH NPh H NHPh HIDRATOS DE CARBONO – REACCIONES Construcción gradual de monosacáridos de cadena mas larga: Síntesis de Kiliani Fisher Adición de HCN para dar una cianhidrina. Se obtienen dos estereoisómeros. Reducir el nitrilo de manera controlada para generar un aldehído. 11 07/06/2013 Degradación de Ruff Degradación de Ruff Fe3+ + H2O2 . COOH H OH OOH [O] - e, -H+ Mecanismo radicalario: Fe2+ + . OOH O . C O H O H H O CO2 Da R% bajos porque porque los productos pueden a su vez, oxidarse. 12 07/06/2013 Configuración de glucosa: la prueba de Fisher Única suposición: el enantiómero dextrorrotatorio del gliceraldehído, tenía configuración DClave 1: Por degradación de Ruff de Glc y Man se obtiene D-(-)-Ara Clave 2: Por degradación de Ruff la D-(-)-Ara da la D-(-)-eritrosa (aldotetrosa). El tratamiento de D-(-)-eritrosa con HNO3 da un –ac. Aldárarico OI → MESO Posibilidades: CHO OH OH CH2OH COOH OH OH COOH COOH CHO HO HO OH CH2OH OH COOH OI Entonces las D-eritrosa debe ser CHO OH OH CH2OH Y la D-Ara puede ser OA CHO OH OH OH CH2OH CHO HO OH OH CH2OH Clave 3: La oxidación con HNO3 de la D-Ara da un ác. aldárico OA. Por lo tanto: CHO COOH HO D-Ara debe ser OH OH CH2OH HNO 3 HO OH OH COH y no CHO OH HNO 3 OH OH CH2OH COOH OH OH OH COOH OA OI Clave 4: Fisher sintetizó a partir de D-Glc otra aldosa en la que se interconvertían las funciones de los C-4 y C-6 CH2OH OH CHO OH HO HO OH OH CH2OH OH OH CHO CH2OH CHO HO HO HO HO OH OH CHO OH OH CH2OH Iguales!! Queda determinada la configuración de C-2 de Glc y Man Con el mismo tipo de análisis Fisher determinó la configuración relativa de todas las pentosas y hexosas 13 07/06/2013 CHO OH OH CH2OH D-eritrosa K-F OI meso CH2OH CH2OH OH OH CH2OH OH OH CH2OH D-ribosa D-arabinosa HNO 3 HNO 3 OA 14


