51 3.3 TAXONOMÍA DEL AGENTE CAUSAL DEL
Anuncio

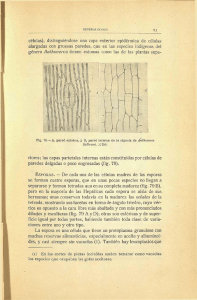
ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA 3.3 TAXONOMÍA DEL AGENTE CAUSAL DEL CARBÓN DE LA PAPA Gastón Muñoz V. Rafael Galdames G. Orlando Andrade V. Al agente causal del carbón de la papa se le considera integrante de un grupo de hongos particular denominados genéricamente como carbones ("smuts" en inglés). El término carbones delimita la organización y estrategia de vida de un grupo de hongos y no corresponde a un concepto taxonómico. A pesar que el concepto fue acuñado en referencia a parásitos de plantas, muchos de estos hongos causantes de carbones presentan fases saprofíticas. Figura 3.20 Esquema del ciclo de vida de los carbones (Ustilaginomycetes). En la figura 3.20 se presenta un esquema del ciclo de vida de un carbón. En estos hongos el cuerpo o soma está compuesto de células haploides y micelio dicariótico. El primero, en algunas especies, puede producir crecimiento levaduriforme, mientras que el micelio dicariótico es usualmente parasítico y casi sin excepción sobre especies angiospermas. El micelio es ramificado, a menudo desarrolla haustorios dentro de las células del hospedero y normalmente no induce síntomas de su presencia en las plantas. Esto último ocurre después de la formación de las esporas (clamidosporas, teliosporas o ustilosporas), las que representan los órganos de diseminación y resistencia. Las esporas se forman en una cavidad del hospedero denominada soro, constituido por tejido del hospedero, 51 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA una masa de esporas y en algunos casos, células de tejido fúngico modificado. Los carbones producen una amplia variedad de síntomas en sus hospederos, desarrollando soros de aspecto variable en diferentes órganos: raíces, tallos, hojas, inflorescencias, flores, anteras, ovarios. Las esporas pueden ser simples, en pares o agregadas en grupos variables (aglomerado de esporas o "spore-balls") y más o menos persistentes pudiendo germinar e infectar a sus hospederos después de 13-15 años, en el caso de algunos ustilaginomycetes. La germinación de las esporas diploides produce un promicelio (basidio o ustidio), que luego de divisiones meióticas del núcleo genera esporidias haploides (basidiosporas) u, ocasionalmente, hifas haploides. Posteriormente, ocurre una fusión celular (plasmogamia), restaurando el estado dicariótico generándose el micelio parasítico. La infección de los carbones puede ser localizada, restringida a un cierto órgano o parte del hospedero o generalizado (sistémico). Las plantas infectadas usualmente no son distinguibles de las sanas hasta que se forman las esporas. 3.3.1 Sistema de clasificación de los carbones Se estima que existirían alrededor de 1200 especies de hongos considerados carbones, distribuidos en alrededor de 50 géneros. El sistema de clasificación de los carbones ha ido variando con el tiempo tomando en cuenta diversos aspectos o caracteres que permiten la diferenciación o agrupamiento de los mismos. Inicialmente, se consideraban características identificables visualmente tales como: color, tamaño, forma y ornamentación de las esporas, esterilidad de las células, estructura de los aglomerados de esporas, estructura del soro y tipo de germinación de las esporas. El esquema de clasificación actualmente aceptado fue propuesto por Bauer, Oberwinkler y Vánky en 1997 (Fig. 3.21) y se ha desarrollado en base a caracteres ultra estructurales tales como interacciones celulares con el hospedero, características del poro septal, modalidad de desarrollo de las esporas y forma de las paredes de las mismas. De este modo, se considera que los carbones han evolucionado en dos clases de la división Basidiomycota: Ustilaginomycetes y Urediniomycetes, siendo la primera la clase donde se presenta el mayor número de hongos causantes de carbones. En la actualidad y con el objeto de comprender mejor la diversidad de especies, no sólo se toma en cuenta la taxonomía, sino también información filogenética, ecológica e incluso paleontológica. En este contexto la filogenia molecular o la reconstrucción de la historia evolutiva de los individuos basados en las diferencias de la secuencia nucleotídica de determinados genes, ha contribuido a corroborar los sistemas de clasificación propuestos en bases a caracteres fenotípicos y, a su vez, han propuesto nuevas relaciones en algunas especies. 52 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA Figura 3.21 Esquema del sistema de clasificación taxonómica de hongos que involucra a los carbones hasta llegar a la familia Glomosporiaceae que agrupa al género Thecaphora. Entre paréntesis se mencionan géneros conocidos de hongos clasificados en esos grupos (adaptado de Bauer, Oberwinkler y Vánky, 1997; y Bauer, Begerow, Oberwinkler, Piepenbring y Berbee, 2001). Dentro de las secuencias utilizadas para analizar las relaciones filogenéticas entre los Ustilaginomycetes se encuentra la región 5' del gen nuclear de la subunidad ribosomal grande (LSU). Dicha secuencia presenta regiones conservadas entre los hongos. Esto ha permitido diseñar partidores de PCR, tales como los indicados en la Fig. 3.22A, que permiten amplificar dicha región desde prácticamente cualquier hongo (Fig. 3.22B). Al mismo tiempo, la región LSU presenta variaciones que permiten establecer la lejanía o proximidad evolutiva con otros hongos. Una vez amplificado, el fragmento es secuenciado para obtener el orden de las bases nucleotídicas del mismo (Fig. 3.22C). La secuencia es entonces utilizada en el análisis filogenético, el que nos describe la historia evolutiva que tienen los organismos analizados. Para esto, inicialmente se establece un alineamiento de las secuencias de los individuos incluidos en el estudio, que evidencian zonas de la secuencia donde hay similitudes y diferencias respecto al resto de las analizadas. En base a esta comparación se calculan las distancias genéticas entre ellos, lo cual se representa finalmente a través de un gráfico o árbol filogenético. En el ejemplo de la Fig. 3.22D, la posición de cada individuo está relacionada con el resto en base a una distancia evolutiva. Así, los individuos I2 e I3 forman un grupo independiente, diferente pero relacionado con I1. Estos tres, a su vez, son diferentes estando menos relacionados con I4. 53 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA Figura 3.22 Región genómica y etapas involucradas en el análisis filogenético de hongos Ustilaginomycetes. A. Estructura de los genes nucleares que codifican proteínas de las unidades ribosomales, SSU unidad ribosomal pequeña; ITS, región espaciadora interna transcrita; LSU; subunidad ribosomal mayor; IGS, región espaciadora intergénica. NL1 y NL2 son los partidores que amplifican parte de la región 5' de LSU utilizada en el análisis. B. Separación electroforética de los productos de la amplificación de PCR utilizando los partidores NL1 y NL2 de cuatro individuos. La flecha indica la migración del fragmento de la región LSU obtenido. C. Ejemplo de la obtención de la secuencia nucleotídica de la banda amplificada y análisis de comparación mediante Blast. D. Ejemplo de un dendograma producto del análisis filogenético el cual se realiza utilizando los programas ClustalX y MEGA2.1. Los análisis filogenéticos basados en la región LSU han contribuido a establecer las relaciones evolutivas entre los Ustilaginomycetes. El ordenamiento obtenido mediante esta vía ha sustentado, para la gran mayoría de las especies, el actual sistema de clasificación propuesto para los Ustilaginomycetes (Fig. 3.21). En el sistema actual, el género Thecaphora forma parte de la familia Glomosporiaceae, el que se ubica en el orden de los Ustilaginales, subclase Ustilaginomycetidae (Fig. 3.21) posición que comparte con los géneros Glomosporium y Tothiela. La familia Glomosporiaceae es un buen ejemplo de la dinámica que ocurre en las clasificaciones. Esta familia agrupa los géneros Thecaphora, Sorosporium y Glomosporium ya que los antecedentes disponibles señalaban que los tres géneros estaban relacionados entre si, sin grandes diferencias morfológicas. En 1997, Sorosporium saponariae fue incorporado al género Thecaphora, renombrándolo como T. saponariae, mientras que en 1994 54 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA Glomosporium amaranthi fue redefinido como T. amaranthi. En todo caso, se considera que el género Thecaphora no representa un grupo naturalmente homogéneo, puesto que la forma de germinación es altamente variable entre las especies. 3.3.2 Estudios para establecer la posición taxonómica del agente causal del Carbón de la Papa Hasta el año 2001, la posición taxonómica del fitopatógeno no era clara. La primera descripción del agente causal de la enfermedad fue realizada por Barrus y Muller en 1943 y al año siguiente, Barrus describió el hongo denominándolo como Thecaphora solani Barrus. Las características más relevantes descritas estaban relacionadas con las esporas, las que formaban agregados firmes de 2 a 8 esporas, de aspecto rugoso en su superficie, color café oscuro y aspecto polvoriento. Estas características son propias del género Thecaphora, cuyo representante tipo es la especie T. seminis-convolvuli (Figs. 3.23C y D). Sin embargo, se omitió una descripción de las características del hongo en latín, formalidad fundamental para revindicar la aceptación de una nueva especie, lo que significó a los autores que se invalidara la denominación propuesta. En 1972, O'Brien y Thirumalachar reexaminaron el hongo describiendo diferencias con respecto a otras especies descritas hasta ese entonces para el género Thecaphora, particularmente el desarrollo del soro locular y la facilidad de separar los agregados de esporas. Basado en dichas diferencias propusieron un nuevo género Angiosorus solani Thirum & O'Brien, cumpliendo con la descripción formal en latín. No obstante, un carácter importante para establecer taxonómicamente el género, como es el modo de germinación de las esporas, no fue descrito en ninguno de los trabajos. Posteriormente en 1988, Mordue y Vanky analizaron las descripciones sobre el fitopatógeno resaltando el hecho que Angiosorus solani no presentaba características diferenciales con otras Thecaphora. Sin embargo, no existían a esa fecha nuevos estudios que ayudaran a esclarecer esta situación. El año 2001 se inició en el Centro de Investigación INIA-Carillanca, Temuco, Chile, un trabajo de investigación que permitiera aportar nuevas evidencias con respecto a la posición taxonómica del fitopatógeno. 3.3.3 Análisis morfológicos y estructurales Los aspectos morfológicos de las teliosporas aisladas de tumores y agallas de la zona norte y sur tales como color, disposición y tamaño de las teliosporas concordaban con lo descrito previamente siendo similar a lo reportado para otras especies de Thecaphora (Figs. 3.23A, B). Sin embargo, se constató que las teliosporas no podían ser desagregadas. 55 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA De hecho, la adhesión parece ser bastante fuerte ya que una suspensión de teliosporas agitada a alta velocidad en presencia de perlas de vidrio no logra la liberación de las ustilosporas. Tampoco se logra tal separación cuando se ejerce presión sobre teliosporas dispuestas sobre dos portaobjetos. Ambos hechos están de acuerdo con lo descrito por Barrus. El análisis ultraestructural de la superficie de las teliosporas realizado mediante microscopia de barrido mostró una superficie rugosa y la presencia de una pared divisoria entre las ustilosporas (Fig. 3.23B). Tales características están presentes en T. seminis-convolvuli (Fig. 3.23D) evidenciándose una relación con el género Thecaphora. Una característica importante para la clasificación de los carbones es el desarrollo del proceso germinativo. Para estudiar esto, las teliosporas fueron sembradas en placas de agar sólo con agua o con medio nutritivo malta-levadura y observadas bajo microscopio para detectar la aparición de las estructuras germinativas. En la mayoría de las veces, el hongo en estudio desarrolló micelio septado (Fig. 3.24 A y B) similar a lo descrito para T. seminis-convolvuli (Fig. 3.24C). Figura 3.23 Comparación morfológica y estructural de teliosporas de T. solani (A y B) y T. seminisconvolvuli. (C y D). A y C muestran el aspecto al microscopio óptico de aglomerados de teliosporas, mientras que B y D muestra el aspecto de las superficie de las mismas visto mediante microscopia electrónica de barrido. (Figuras C y D reproducidas de: K. Vánky. 1998. Mycol. Res. 102(5):513-526) 56 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA Figura 3.24 Comparación del proceso germinativo observado en teliosporas de T. solani (A y B) y T. seminis-convolvuli (C). (Figura C reproducida de: M. Woronin. 1881. Naturf. Ges. 12:559-587). 3.3.4 Análisis filogenético basados en la región LSU La posibilidad de obtener cultivos puros del hongo en laboratorio permitió obtener biomasa desde donde se extrajo ADN genómico. A partir de este ADN se pudo amplificar la secuencia LSU y realizar un análisis filogenético tal como se describe en la Fig. 3.22. De este modo, utilizando los aislamientos indicados en el Cuadro 3.2 y los partidores NL1 y NL4 (Fig. 3.22A) fue amplificado un fragmento de la región 5` LSU mediante PCR. Para todos los aislados se amplificó un sólo fragmento de ADN de alrededor de 660 pb (pares de bases). Cada fragmento fue clonado y secuenciado, verificándose que todos ellos tenían la misma secuencia nucleotídica. Esto indica que todos los aislamientos analizados, colectados de diversos lugares, hospederos e incluso tipo de tejido fúngico (Cuadro 3.2), corresponden al mismo hongo. La secuencia obtenida fue comparada en la base de datos del NCBI (National Center for Biotechnology Information) usando el algoritmo Blast, encontrándose que presentaba homología con la misma región ribosomal de otros hongos Ustilaginomycetes. La similitud más alta se obtuvo con las secuencias de las únicas tres especies de Thecaphora cuya región LSU es conocida (T. amaranthi, T. saponariae y T. seminis-convolvuli). Esto indica una estrecha relación genética con dicho género. Para realizar el análisis filogenético, la secuencia obtenida fue alineada con secuencias LSU de hongos Ustilaginomycetes y Exobasidiomycetes (indicadas en la Fig. 3.25) utilizando el programa ClustalX. Basado en este alineamiento, el análisis filogenético se realizó mediante el método de "neighbor-joining" usando el programa MEGA2.1 resultando en un dendograma cuya topología se muestra en la Fig. 3.25. Este resultado muestra claramente que T. solani se agrupa junto a las otras especies de Thecaphora para las cuales se conoce la secuencia LSU, evidenciando definitivamente una estrecha relación genética con dicho género. 57 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA Por otro lado, es importante mencionar que el análisis filogenético muestra al género Thecaphora más cercano al orden de los Urocistales y alejado de los Ustilaginales. Esto se contrapone a lo establecido en el actual sistema de clasificación basado en caracteres ultra estructurales donde Thecaphora, como miembro de la familia Glomosporiaceae, es parte del orden Ustilaginales (Fig. 3.21). Es necesario incorporar más secuencias de otros miembros de la familia para clarificar esta discrepancia entre el análisis taxonómico y el filogenético. Por lo tanto y por el momento, se valida lo descrito en la Fig. 3.21. Cuadro 3.2 Aislamientos de Thecaphora solani utilizados para amplificar la región LSU para análisis filogenéticos. Aislamiento Tipo celular Hospedero Región Ts-5 Ts-15 Ts-16 Ts-21 Ts-21 Ts-22 Ts-23 teliosporas micelio micelio teliosporas micelio teliosporas teliosporas S. tuberosum S. tuberosum S. tuberosum S. tuberosum IV IV VIII IX Datura stramonium1 Solanum furcatum2 IV IV 1: chamico; 2: tomatillo. Figura 3.25 Dendograma del análisis filogenético basado en al región LSU de 26 secuencias de LSU rDNA correspondientes a hongos ustilaginomicetes. En cada nodo se presentan los valores de bootstrap mayores a 50%, lo cual indica que tal nodo es significativo. La barra indica los cambios esperados por sitio. 58 ANTECEDENTES HISTÓRICOS, DIAGNÓSTICO Y EPIDEMIOLOGÍA CONCLUSIONES Los estudios realizados han contribuido a establecer la real posición taxonómica del agente causal del carbón de la papa. Los datos aportados muestran que el fitopatógeno presenta similitudes morfológicas y ultra estructurales con el género Thecaphora. Esta relación está sólidamente respaldada por los análisis filogenéticos basados en la región LSU. Por lo tanto, la descripción inicial de Barrus estaría correcta y el patógeno debiera ser llamado T. solani Barrus. Finalmente, hay que hacer notar que T. solani es la única especie del género Thecaphora capaz de desarrollarse en la zona radical de su hospedero. Así, esta especie presenta características fitopatológicas propias, cuyo mecanismo de acción es aún desconocido. El poder elucidar este mecanismo aportará a una mejor comprensión de la enfermedad y por ende a elaborar mejores estrategias de control. LITERATURA CONSULTADA Barrus, M. F. 1944. A Thecaphora smut on potatoes. Phytopathology 34:712-714. Barrus, M. F., and A. Muller. 1943. An Andean disease of potato tubers. Phytopathology 33:1086-1089. Bauer, R., D. Begerow, F. Oberwinkler, M. Piepenbring, and M.L. Berbee. 2001. In McLaughlin, McLaughlin, Lemke (eds.) The Mycota p. 57-83. VII Part B. Systematics and Evolution.. Springer-Verlag, Belin Heidelberg. Alemania. Bauer, R., F. ,Oberwinkler, and K. Vánky. 1997. Ultrastructural markers and systematics in smut fungi and allied taxa. Can. J. Bot. 75:1273-1314. Begerow, D., R. Bauer, and F. Oberwinkler. 1997. Phylogenetic studies on nuclear large subunit ribosomal DNA sequences of smut fungi and related taxa. Can. J. Bot. 75:2045-2056. Mordue, J. E. 1988. Thecaphora solani. CMI descriptions of pathogenic fungi and bacteria Nº966. Mycopathologia 103:177-178. Piepenbring, M. and Bauer, R. 1995. Noteworthy germinations of some Costa Rican Ustilaginales. Mycol. Res. 99:853-858. Vánky, K. 1988. Taxonomical studies on ustilaginales III. Mycotaxon 69: 93-115. Vánky, K. 1998. A survey of the spore-ball-forming smut fungi. Mycol. Res. 102: 513 526. Webster, J. 1980. Introduction to fungi. 669 p. 2th ed. Cambridge University Press, Cambridge, UK. 59