SOLUCIONES II (PROPIEDADES COLIGATIVAS)
Anuncio
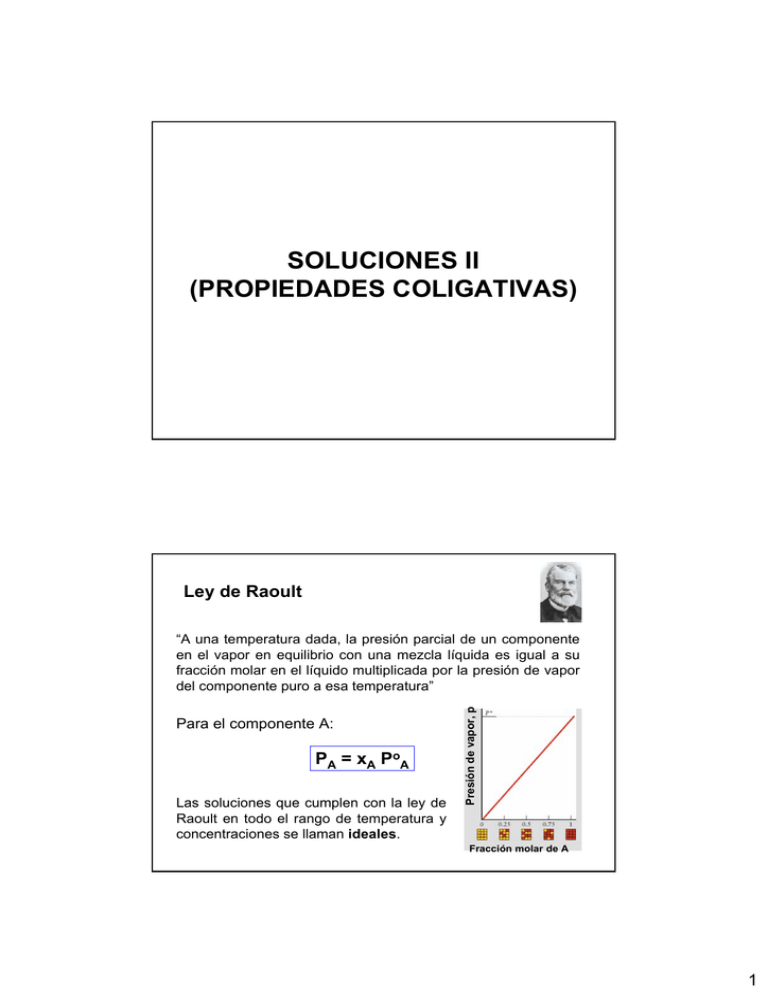
SOLUCIONES II (PROPIEDADES COLIGATIVAS) Ley de Raoult Para el componente A: PA = xA PoA Las soluciones que cumplen con la ley de Raoult en todo el rango de temperatura y concentraciones se llaman ideales. Presión de vapor, p “A una temperatura dada, la presión parcial de un componente en el vapor en equilibrio con una mezcla líquida es igual a su fracción molar en el líquido multiplicada por la presión de vapor del componente puro a esa temperatura” Fracción molar de A 1 PA = PAo ⋅ x A Presión de vapor del solvente PA° Pendiente = PAo 0 0 1 XA solvente XB soluto 1 0 Soluciones ideales Son aquellas que cumplen la ley de Raoult en todo el rango de temperatura y concentración Su calor de disolución (o mezcla) es cero y no experimentan cambio de volumen cuando se mezclan sus componentes en estado líquido (volúmenes aditivos). Las soluciones reales se aproximan al comportamiento ideal cuando son diluidas y el soluto y el solvente tienen tamaños semejantes y experimentan interacciones intermoleculares similares. 2 Para una mezcla de A y B volátiles P = PA + PB PA = xA PoA PB = xB PoB P = xA PoA + xB PoB Si el soluto B es no volátil: P = xA PoA Propiedades coligativas: - Dependen del número de partículas de soluto disueltas. - No dependen de la naturaleza de dichas partículas. Para soluciones con solutos no volátiles: •Descenso de la presión de vapor Propiedades coligativas •Aumento del punto de ebullición •Descenso del punto de congelación •Presión osmótica En principio vamos a considerar solutos no disociables. 3 Descenso de la presión de vapor “El descenso relativo de la presión de vapor de una solución de un componente no volátil, con respecto a la presión de vapor del solvente puro A, es igual a la fracción molar del soluto B en la solución”. Se deriva directamente de la Ley de Raoult. Ley de Raoult: PA = x APAo PA : presión de vapor de la solución PAo − PA = PAo (1 − x A ) PAo − PA PAo = xB PAo : presión de vapor del solvente puro xA = nA n A + nB fracc. molar del solvente xB = nB n A + nB fracc. molar del soluto Descenso de la presión de vapor Presión de vapor en el equilibrio solvente puro Presión de vapor en el equilibrio solución La presión de vapor es menor! El descenso de la presión de vapor tiene origen entrópico 4 El factor entrópico favorece menos la vaporización del solvente en la solución que en caso del solvente puro. Al añadir el soluto el desorden de la fase condensada es relativamente mayor que el del líquido puro, lo que produce una disminución de la tendencia a adquirir el desorden característico de la fase vapor. ΔS > 0 Solvente Solución Curvas de equilibrio líquido- vapor Descenso de la presión de vapor Presión de vapor Po Solvente puro P Solución Temperatura To 5 Ejercicio: Calcule la presión de vapor de agua a 90°C para una solución preparada disolviendo 5,00 g de glucosa (C6H12O6) en 100 g de agua. La presión de vapor del agua pura a esa temperatura es de 524 mmHg. Consecuencias del descenso de la presión de vapor: Presión de vapor L S Solvente puro Solvente sólido puro Punto triple de la solución Punto triple del solvente Solución Te (temp de ebullición Tf (temp de fusión de la solución) de la solución) Teo (temp de Tfo (temp de ebullición fusión del del solvente) solvente) ΔTc Descenso crioscópico Temperatura ΔTe Aumento ebulloscópico 6 Aumento ebulloscópico El punto de ebullición de un solvente en una solución es mayor que para el solvente solo. Esto es consecuencia del descenso de la presión de vapor. Aumento ebulloscópico Descenso de la presión de vapor Presión de vapor Po Solvente puro P Solución Aumento del punto de ebullición Temperatura To T puntos de ebullición normales 7 Descenso de la presión de vapor (Ec de Clausius- Clapeyron para la solución) Presión de vapor Po Solvente puro ln P Solución Aumento del punto de ebullición Temperatura To P P o =− ΔHv ⎛ 1 1 ⎞ − ⎟ ⎜ R ⎝ To T ⎠ ΔHv =− R T ⎛ T − To ⎞ ⎜ ⎟ ⎜ T To ⎟ ⎝ ⎠ T ≈ To T To ≈ (To)2 (Para soluciones diluidas) P/Po = 1 - xB (Ley de Raoult) Reemplazando: ln(1 − xB ) = − ΔHv ΔTe R ( T o )2 Para soluciones diluidas: ln(1- xB) ≈ - xB (desarrollo en series de Taylor; nos quedamos con el primer término) xB = ΔHv ΔTe R ( T o )2 ⇒ ΔTe = R(T o )2 xB Δ Hv 8 xB = Fracción molar: xB ≈ Molalidad: ΔTe = nB n A + nB nB mB / MB = n A m A / MA nA: número de moles de solvente NB: número de moles de soluto mA: masa de solvente mB: masa de soluto MA: masa molar de solvente MB: masa molar de soluto 1000 mB m= MB m A R(T o )2 xB Δ Hv xB = ΔTe = (T − T o ) = ΔTe = (T − T o ) = (solución diluida: nB << nA) mB MA 1000 M =m A m A MB 1000 1000 R(T o )2 MA m ΔHv 1000 R(T o )2 MA m ΔHv 1000 Ke: constante ebulloscópica. Depende sólo del solvente. Unidades: °C/m. m: molalidad de la solución Para una solución diluida ideal de un soluto no disociable: ΔTe = T – To = Ke m ¿Por qué se expresa el ΔT en fc. de la molalidad? 9 Descenso crioscópico El punto de congelación del solvente en una solución es menor que el del solvente puro. Esto también es consecuencia del descenso de la presión de vapor. Descenso crioscópico Tc Tco ΔTc ΔTc=To-T congela el solvente puro 10 ΔTc = (T o − T ) = R(T o )2 MA m ΔHf 1000 Kc: constante crioscópica. Depende sólo del solvente. Unidades: °C/m. m: molalidad de la solución Para una solución diluida ideal de un soluto no disociable: ΔTc = To – T = Kc m Deducción completa: libro “Elementos de Química- Física”, S. Glasstone Ejercicios: 1) El agregado de 0,24 g de azufre a 100 g del solvente CCl4 disminuye el punto de congelación del solvente en 0,28 °C. ¿Cuál es la masa molar y la fórmula molecular del azufre? Kc (CCl4)= 29,8 K.Kg/mol Temp. de congelación (CCl4) = -23°C 2) ¿Cuántos gramos de etilenglicol (un anticongelante muy usado; CH2OHCH2OH) se deben adicionar a 37,8 g de agua para dar un punto de congelación de -0,150°C? 11 En general Kc > Ke ⇒ el descenso crioscópico es más importante que el aumento ebulloscópico. Solvente Kc Ke ácido acético benceno nitrobenceno fenol agua (unidades: °C/m) Aplicación muy importante de ambas (sobre todo del descenso crioscópico): determinación de masas moleculares de compuestos. Trabajo Práctico: Determinación de la masa molecular de la urea por el método del descenso crioscópico. 12 Temperatura (no a escala) Curva de enfriamiento para una sustancia pura Tiempo (no a escala) Curvas de enfriamiento 13 Ósmosis Movimiento neto de solvente a través de una membrana semipermeable desde una solución más diluida hacia una más concentrada. Proceso espontáneo Solución diluida Solución concentrada membrana semipermeable Una membrana semipermeable permite el pasaje del solvente y no de los solutos. Ósmosis Solución más concentrada Membrana semipermeable Permite sólo el paso de moléculas del solvente Solvente Solución menos concentrada Presión osmótica tiempo Menor conc. de solvente del lado de la solución ⇒ pasa con menor frecuencia a través de la membrana Membrana Mayor conc. de solvente del lado del solvente puro ⇒ pasa con menor frecuencia a través de la membrana 14 Presión osmótica inicial Dispositivo para medir π solvente solución Presión osmótica π= δgh equilibrio π Solvente puro Solución Membrana semipermeable solvente solución Presión osmótica Si aplicamos una presión π se impide el pasaje de solvente Solución Membrana semipermeable Solvente puro (o SC más diluida) Membrana semipermeable (p. ej. de celofán) 15 Presión osmótica πV = nRT (misma forma que la ecuación del gas ideal) ⎛n⎞ π = ⎜ ⎟RT ⎝V⎠ π = CRT Molaridad Aplicación importante: determinación de masas moleculares (especialmente para solutos en bajas concentraciones y moléculas con altas masas moleculares, como macromoléculas). Ejercicio: Calcular la masa molar de la insulina si una solución que contiene 20,0 mg de ésta en 5,00 mL de solución presenta una presión osmótica de 12,5 mmHg a 300 K. 16 Clasificación de las soluciones (con respecto a una solución de referencia) Solución isotónica: igual presión osmótica. Solución hipotónica: menor presión osmótica. Solución hipertónica: mayor presión osmótica. Glóbulos rojos membrana semipermeable Solución isotónica (misma π que los fluidos intracelulares de los glóbulos) Solución hipotónica (menor π) (entra agua y puede causar la ruptura: hemólisis) Solución hipertónica (mayor π) (sale agua: crenación) 17 Ósmosis reversa • Inversión del flujo normal de solvente a través de una membrana semipermeable •Se aplica superior a π una Se aplica una presión mayor que π aquí… presión •Este proceso se utiliza para purificación de agua (desalinización) π … el agua fluye desde la solución más concentrada a través de la membrana (al revés que en la ósmosis). solvente solución solvente solución Soluciones de electrolitos i= (electrolito) Propiedad coligativa experimental (no electrolito) Propiedad coligativa teórica factor “i” de vant´Hoff i= ΔP ΔP teor = ΔTc ΔTc ΔTe = i k e m; Δπ = i cRT; teor = ΔTe ΔTe teor = Π Π teor ΔTc = i k c m ΔP = i ΔPteor i≥1 18 Relación entre factor i y grado de disociación Para un electrolito AxBy que se disocia AxBy → x A + y B Grado de disociación (α): α= i −1 α= ν −1 ν=x+y ndisociados niniciales • Si el soluto no se disocia: i=1, α=0 • Si está completamente disociado: i=ν ⇒ α=1 • Si no está completamente disociado: 1<i<ν ⇒ 0 <α<1 Valores del factor i para electrolitos que se disocian completamente (i=ν): (en realidad suelen ser un poco más bajos debido a la interacción de pares iónicos) 19 Deducción de la relación entre i y α x Az+ + y Bz- AxBy Para una molalidad m: ndisociados = α m nº de moles de Az+ = m x α nº de moles de Bz- = m y α nno disociados = (1- α)m (por cada 1000 g de SV) mtotal = m(1- α) + m x α + m y α = m [1 + α (x + y - 1)] ν=x+y mtotal = m [1 + α (ν - 1)] ΔTc = Kc mtotal ΔTc = Kc m [1 + α (ν - 1)] ΔTc ΔTc = = i = 1 + α(ν − 1) teor K c m ΔTc α= i −1 ν −1 Ejercicio Calcular la temperatura de congelamiento de las siguientes soluciones acuosas: i)0,2 m de Li2SO4 ii)0,1 m de AcH (ácido acético) cuyo grado de disociación es 4,1%. Dato: Kc = 1,86 °C/m 20







