Capítulo 17
Anuncio

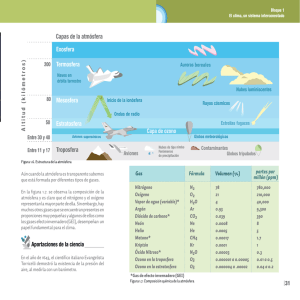
Capítulo 17 La química de la atmósfera El capítulo 17 es de aplicación, en él se estudian muchos de los conceptos cubiertos previamente y se aplican a la química de la atmósfera. Al terminar este capítulo, el estudiante podrá: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. Listar y dar la composición aproximada por volumen de los cuatro gases más importantes en el aire seco al nivel del mar. Nombrar las cuatro regiones de la atmósfera, en orden, empezando por el nivel mayor e indica los componentes mayores de cada uno. Describir la capa de ozono, indicar su importancia para la vida en la tierra y discutir la importancia de clorofluorocarbonos en su destrucción. Definir el protocolo de Montreal y hacer pensar en su importancia para la capa de ozono. Mencionar la importancia de los volcanes para cambiar los modelos meteorológicos. Identificar las diversas partes del ciclo de carbono. Describir el efecto de invernadero. Sugerir cómo se forma y la polaridad del dióxido de carbono y la formación del agua en cada una de estas moléculas IRactivas. Demostrar cómo el efecto de invernadero y la revolución industrial contribuyen al recalentamiento mundial. Discutir por qué se esperara que la lluvia no contaminada tenga un pH menor que siete. Listar dos fuentes de SO2. Discutir cómo SO2 se convierte a SO3 en la atmósfera. Escribir la reacción química que convierte SO3 a ácido sulfúrico. Localizar en un mapa de Estados Unidos dónde se esperaría la lluvia para tener el pH más alto y más bajo y discutir por qué. Escribir la fórmula química para la caliza y cal viva y describir cómo se usa la cal viva para reducir las emisiones de SO2 del humo de las chimeneas. Definir “esmog” y explique la importancia del esmog fotoquímico. Sugerir cómo los automóviles contribuyen a la formación del esmog fotoquímico. Describir las reacciones dentro de un convertidor catalítico que reduzca la formación del esmog fotoquímico. Discutir tres contaminantes domésticos significantes y sus efectos en la salud humana. 17.1 La atmósfera terrestre Las cuatro zonas de la atmósfera son: a) troposfera, la capa más cercana a la superficie de Tierra b) estratosfera donde se encuentra la capa de ozono c) mesosfera, “la media capa” entre la estratosfera y termosfera d) termosfera o ionosfera, la capa más alta la la El autor señala que el porcentaje de agua en la atmósfera puede variar grandemente. Puede ser útil a estas alturas discutir con los estudiantes sobre la humedad relativa. La humedad relativa simplemente es la proporción real presente de vapor de agua en el aire comparado con la presión de vapor saturada de agua a la temperatura de interés. Esta proporción normalmente se expresa como un porcentaje. El punto de rocío es la temperatura a que un volumen de aire alcanza la saturación cuando se enfría. Por consiguiente, cuando la temperatura alcanza el punto de rocío, se formará la niebla. 17.2 Los fenómenos en las capas externas de la atmósfera La Aurora boreal, (luces del norte), y la aurora austral (luces del sur), son el resultado de altas partículas de energía colisionando con moléculas y átomos en la atmósfera superior. Estas colisiones producen la formación de especies químicas excitadas que emiten luz cuando ellas pierden esta energía adicional. En este capítulo el autor discute el misterio del resplandor de los transbordadores espaciales. Él señala que a través de un experimento sin relación, a bordo del transbordador espacial Discovery, se determinó que el óxido nítrico es el que produce este resplandor. Éste es otro ejemplo de que en la ciencia, las respuestas a las preguntas pueden aparecer inesperadamente. 17.3 Disminución del ozono en la estratosfera La reacción de CFC para disminuir la capa de ozono es un ejemplo clásico de una reacción de la cadena que tiene etapa(s) de inicio, etapa(s) de propagación y etapa(s) de terminación. Por ejemplo, CFCl3 + hν → CFCl2 + Cl etapa de inicio Cl + O3 → Cl + O 2 Cl + O → Cl + O 2 etapa de propagación Cl + CFCl2 → CFCl3 Cl + Cl → Cl 2 etapa de terminación Puesto que hay una fuente continua de luz, CFCl3 y Cl2 se pueden partir y comenzar la reacción en cadena de todos los otros nuevamente. Está claro por qué se firmó el protocolo de Montreal. 17.4 Los volcanes Un volcán activo es una contaminación tremenda al medioambiente. Él descarga varios gases, incluyendo CO2, HCl, HF, y H2 S. Él también produce partículas de materia que pueden ser llevadas alrededor del mundo dependiendo del poder de la erupción. 17.5 El efecto invernadero El efecto de invernadero es el calor entrampado cerca de la superficie de la Tierra por gases, particularmente CO2. Se sugiere que el calor del sol que se entrampa cerca de la Tierra es mas semejante al vidrio en un invernadero. A mayor concentración de CO2, mayor espesor del "vidrio" entonces más calor se retiene. La evidencia parece indicar que la combustión de combustibles fósiles y la deforestación de grandes regiones de tierra tienen ventaja para un incremento en el nivel de CO2. 17.6 La lluvia ácida La conversión de azufre en combustibles fósiles a SO2 y SO3 y la reacción de estos compuestos para formar H2SO4 resulta en lo que se conoce como lluvia ácida. Puesto que ambos SO2 y H2SO4 pueden reaccionar con CaCO3, muchas de las estatuas famosas y edificios alrededor del mundo han sido dañados. Los esfuerzos se están dirigiendo en bajar el SO2 producido por el azufre quitando de los combustibles fósiles antes de que ellos se quemen, quemando combustibles fósiles que naturalmente contienen menos azufre, y quitando SO2 de las descargas de combustión. 17.7 El esmog fotoquímico El esmog fotoquímico se forma por la reacción de la luz solar con contaminantes formados por la descarga automovilística. Parece irónico que la destrucción del ozono sea una preocupación en la atmósfera superior cuando es un problema de contaminación en áreas donde el esmog fotoquímico existe. El uso de convertidores catalíticos ha disminuido el problema y existe la evidencia de que próximamente pueden ser concluidos estudios que controlen el esmog. 17.8 Contaminación doméstica Dependiendo en la región del país en que uno vive, es posible que la casa de uno, edificios de oficinas y escuelas están siendo infiltrados por gas radón. Existe la controversia considerable sobre los efectos de salud del radón y su decadencia de productos. Actualmente, el EPA recomienda que la acción terapéutica se tome si el nivel de radiactividad debido al radón excede cuatro pico curies por litro de aire. El monóxido de carbono es un contaminante doméstico común y que causa varias muertes por año. Este gas desplaza el oxígeno en la sangre y se puede acumular causando la muerte con el tiempo. Relativamente los detectores económicos de CO, más semejantes a los detectores de humo, están comercialmente disponibles para proteger contra la acumulación de CO. Por último, el formaldehído puede ser un problema especialmente en áreas donde la nueva construcción se ha completado o la nueva carpeta ha sido instalada. Desafortunadamente, algunos individuos se sensibilizan al formaldehído, esto significa que la presencia de cantidades sumamente pequeñas puede causar reacciones alérgicas severas. Algunos nuevos edificios de oficinas han quedado vacíos por un largo periodo para permitir que por medio de los sistemas de ventilación se baje la concentración de formaldehído a niveles aceptables.