copiar
Anuncio
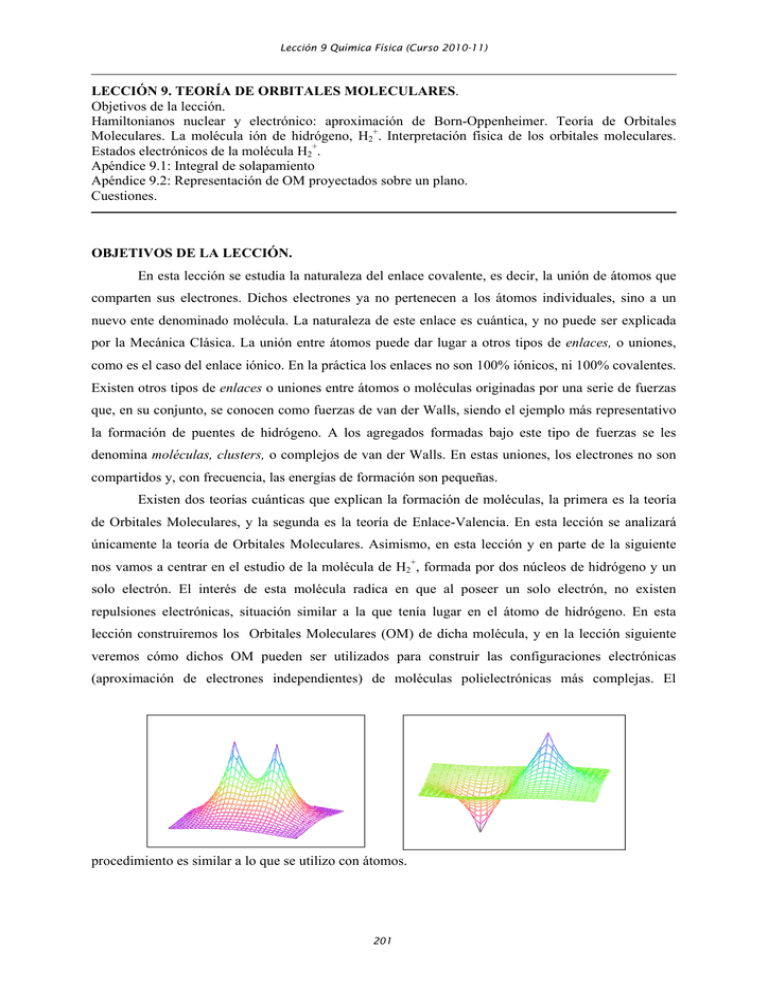
Lección 9 Química Física (Curso 2010-11) LECCIÓN 9. TEORÍA DE ORBITALES MOLECULARES. Objetivos de la lección. Hamiltonianos nuclear y electrónico: aproximación de Born-Oppenheimer. Teoría de Orbitales Moleculares. La molécula ión de hidrógeno, H2+. Interpretación física de los orbitales moleculares. Estados electrónicos de la molécula H2+. Apéndice 9.1: Integral de solapamiento Apéndice 9.2: Representación de OM proyectados sobre un plano. Cuestiones. OBJETIVOS DE LA LECCIÓN. En esta lección se estudia la naturaleza del enlace covalente, es decir, la unión de átomos que comparten sus electrones. Dichos electrones ya no pertenecen a los átomos individuales, sino a un nuevo ente denominado molécula. La naturaleza de este enlace es cuántica, y no puede ser explicada por la Mecánica Clásica. La unión entre átomos puede dar lugar a otros tipos de enlaces, o uniones, como es el caso del enlace iónico. En la práctica los enlaces no son 100% iónicos, ni 100% covalentes. Existen otros tipos de enlaces o uniones entre átomos o moléculas originadas por una serie de fuerzas que, en su conjunto, se conocen como fuerzas de van der Walls, siendo el ejemplo más representativo la formación de puentes de hidrógeno. A los agregados formadas bajo este tipo de fuerzas se les denomina moléculas, clusters, o complejos de van der Walls. En estas uniones, los electrones no son compartidos y, con frecuencia, las energías de formación son pequeñas. Existen dos teorías cuánticas que explican la formación de moléculas, la primera es la teoría de Orbitales Moleculares, y la segunda es la teoría de Enlace-Valencia. En esta lección se analizará únicamente la teoría de Orbitales Moleculares. Asimismo, en esta lección y en parte de la siguiente nos vamos a centrar en el estudio de la molécula de H2+, formada por dos núcleos de hidrógeno y un solo electrón. El interés de esta molécula radica en que al poseer un solo electrón, no existen repulsiones electrónicas, situación similar a la que tenía lugar en el átomo de hidrógeno. En esta lección construiremos los Orbitales Moleculares (OM) de dicha molécula, y en la lección siguiente veremos cómo dichos OM pueden ser utilizados para construir las configuraciones electrónicas (aproximación de electrones independientes) de moléculas polielectrónicas más complejas. El procedimiento es similar a lo que se utilizo con átomos. 201 Lección 9 Química Física (Curso 2010-11) HAMILTONIANOS NUCLEAR Y ELECTRÓNICO: APROXIMACIÓN DE BORN-OPPENHEIMER. El hamiltoniano no relativista de una molécula de S átomos y N electrones puede escribirse como: H 2 2 2 S N 2 Z e 2 N j1 e 2 2 N 2 S 1 Z Z e i 2m i 1 R j 2 i 1 rij 1 m 2 1 1 i 1 ri S (9.1) Donde, los subíndices de letras griegas indican átomos, y los de latinas electrones. Así, Rαβ, indica distancia internuclear, rij, distancia entre electrones, y riα, entre núcleos y electrones. Los 5 términos de H indican respectivamente, energías cinéticas de núcleos, de electrones, repulsión entre núcleos, atracción entre electrones y núcleos, y repulsión entre electrones. Para la molécula de H2+, el hamiltoniano puede escribirse como: H 2 2 2 2 2i2 e 2 e 2 e 2 2 m 2 m 2m R r1 r1 (9.2) Donde R = Rαβ = Rα - Rβ, y todas las distancias deben estar referidas a un centro de coordenadas prefijado (ver Figura 9.1). En general el hamiltoniano de cualquier molécula puede escribirse como : H TN Te V (9.3) donde TN, representa la energía cinética de los núcleos, Te, la de los electrones y V , todas las energías potenciales de interacción. r1" r1$ R H" H$ Figura 9.1 Los núcleos, al ser más pesados que los electrones, se moverán más lentamente, por ello, en una primera aproximación puede suponerse que los núcleos están fijos. En esto se basa, precisamente, la aproximación de Born-Oppenheimer, que supone que TN << Te, por lo que inicialmente puede despreciarse TN. En cualquier caso los núcleos se mueven, como queda de manifiesto por la existencia de las espectroscopias de vibración y rotación, aunque más lentamente que los electrones. Teniendo en cuenta lo anterior, se define el hamiltoniano electrónico como H e Te V H e e U e (9.4) A las soluciones de He, se les suele designar por U, o Ee (energía electrónica), para no confundirla con E, o energía total de la molécula (solución de H), aunque luego eliminaremos esta nomenclatura. Las soluciones de He, dependen de R, es decir de la distancia entre los núcleos, ya que 202 Lección 9 Química Física (Curso 2010-11) V depende de R, pero al suponer que los núcleos no se mueven dicha distancia, R, es un parámetro constante. Sin embargo, en realidad los núcleos se mueven, aunque mucho más lentamente que los electrones, por lo que ha de resolverse He para diferentes valores de R, hasta obtener un mínimo de energía. El tipo de dependencia de U(R) con R, es semejante al mostrado en la Figura 9.2. La molécula se forma siempre que exista dicho mínimo de energía. Nuestro objetivo en la siguiente pregunta será obtener una expresión aproximada para U(R). Figura 9.2 Una vez conocida U(R), el Hamiltoniano nuclear se define como: 2 2 2 2 U(R) H N N E N N (9.5) 2 m 2 m donde ψN, y EN, son la función de onda, y la energía nuclear. La energía y función de onda total de la H N TN U(R) molécula serán Ne y E E e E N U(R) E N (9.6) El hamiltoniano nuclear, puede resolverse introduciendo un cambio de coordenadas semejante al utilizado con el átomo de hidrógeno. Así, se define la distancia relativa entre núcleos como, R = Rα Rβ, y la posición del centro de masas, RM =(mαRα +mβRβ)/M, donde M = mα + mβ, y μ = mαmβ/(mα + mβ). Con este cambio HN, puede escribirse como: 2 R M 2 2R (9.7) HN U(R) TM R M T R U(R) H t R M H (R) 2 M 2 Por lo que este hamiltoniano nuclear, a su vez, puede dividirse en dos, uno que da cuenta del 2 movimiento del centro de masa de la molécula, Ht = TM, y otro que depende del movimiento relativo entre los dos núcleos, Hμ = Tμ + U(R). Las soluciones de ambos hamiltonianos independientes, serán de la forma; Htψt = Etψt, y Hμψμ = Eμψμ, por lo que: N t y E N E t E (9.8) El primer Hamiltoniano Ht, es idéntico al de una partícula que solo posee energía cinética, y sus soluciones son las del sistema: partícula en una caja de potenciales de paredes infinitas. El otro hamiltoniano Hμ = Tμ + U(R), es muy parecido al del átomo de hidrógeno, de hecho si se cumpliera que U(R) = e2/R, este Hamiltoniano sería idéntico al del hidrógeno. Sin embargo, al depender la 203 Lección 9 Química Física (Curso 2010-11) energía potencial solo de R, y no de las coordenadas angulares y , es posible aplicar el método de separación de variables, de forma que las soluciones de Hμψμ = Eμψμ, podrán escribirse como ψμ =F(R)Y(,). Las funciones Y(,), son los armónicos esféricos, ya que la dependencia con las coordenadas y , es la misma que en el átomo de hidrógeno. De hecho, esta función da cuenta de la rotación de la molécula Y(,) = ψr. Sin embargo, la función F(R) es muy compleja, si bien cuando R Re, en las proximidades de mínimo de energía, U(R) tiene la forma de una parábola, U(R) cte(R-Re)2, como se muestra en la Figura 9.2. Es decir, la forma de la energía potencial es semejante a la de un oscilador armónico, luego, en las proximidades de equilibrio, F(R) = ψv, donde ψv, son las funciones de onda del sistema oscilador armónico. Por lo tanto cuando R Re, r v y E E r E v (9.9) Lejos de la posición de equilibrio, la situación es más compleja y las energías de vibración y rotación no son separables. Estas relaciones nos permiten escribir de forma aproximada, que la función de onda, y la energía total de la molécula son e vr t y E Ee Ev Er Et (9.10) Es decir, la energía de la molécula puede ser separada en sus diferentes componentes (electrónica, vibracional, rotacional y traslacional), y estos pueden ser analizados de forma individual. Aunque hay que recalcar que esto es una aproximación que a veces no se cumple. A partir de ahora nos centraremos en el estudio de He. 204 Lección 9 Química Física (Curso 2010-11) LA TEORÍA DE ORBITALES MOLECULARES (OM). Esta teoría se debe a Mulliken y Hund (1928). La teoría se basa en suponer lo siguiente: 1) Cada electrón lleva asociado una función ψ, que se denomina orbital molecular tal que: -ψ es policéntrico -El producto ψ* ψdτ, representa la probabilidad de encontrar al electrón. 2) Se supone que cada OM está relacionado con ciertos números cuánticos, los cuales gobiernan la energía, y forma del orbital. Dado que se desconocen los verdaderos números cuánticos, utilizaremos los procedentes de la aproximación de electrones independientes. 3) La energía electrónica de la molécula es la suma de las energías de los OM ocupados, menos la energía de repulsión entre los electrones, la cual solo puede obtenerse aplicando métodos aproximados. 4) Cada electrón lleva asociado un spin s = ½, con dos posibles valores de ms = ±1/2. 5) La configuración electrónica de la molécula se determina calculando la energía de los OM, e introduciendo los electrones por orden creciente de energía, con tal de no violar el principio de exclusión de Pauli, y de seguir la regla de máxima multiplicidad de Hund. En cualquier caso, como sucedía en átomos, las configuraciones electrónicas no son los niveles de energía de la molécula. 6) Dado que desconocemos la forma de los OM, inicialmente se utilizan funciones aproximadas que se construyen mediante el método de Ritz o CLOA (combinación lineal de orbitales atómicos). N j ciji (9.11) i 1 donde los i, son las denominadas funciones de base. En la versión más simplificada del método se utilizan tantas funciones como átomos (N = nº átomos de la molécula), y los i serán los orbitales del átomo de hidrógeno. Los coeficientes ci,j, se calculan minimizando la energía de acuerdo al método variacional. 7) Los OM son monoelectrónicos, y representan la parte espacial de orbital, por lo que deben multiplicarse por una función de spin, + y -. La función de onda total de una molécula polielectrónica debe ser antisimétrica con respecto al intercambio de dos electrones, y se construye a partir de los anteriores OM, de forma semejante a como se hizo con átomos. Para ello se utilizan determinantes de Slater (aproximación de electrones independientes) 1 1 1 1 1 1 2 1 1 1 1 2 2 1 2 2 2 2 2 n! 0 (9.12) Esta función, es la función de orden cero que se utiliza a continuación, en la teoría de perturbaciones, de variaciones, o mediante el método de Hartree, para obtener energías y funciones de onda mejoradas. 205 Lección 9 Química Física (Curso 2010-11) LA MOLÉCULA IÓN DE HIDRÓGENO H2+ . Esta molécula está formada por dos núcleos de hidrógeno (H1 y H2, ver Figura 9.3), separados una distancia, R, y un electrón situado a las distancias r1 y r2, de cada uno de los anteriores núcleos. z 2 r1 r2 Figura 9.3 R H1 y N H2 x En unidades atómicas, el hamiltoniano electrónico de esta molécula es: 2 1 1 1 (9.13) H 2 R r1 r2 La ecuación de Schrödinger correspondiente (Hψ = Eψ), no tiene solución, por lo que debemos aplicar el método variacional, usando como función de prueba los OM construidos mediante el método CLOA: c11 c 2 2 (9.14) en principio, podemos suponer que 1 = 2 = 1s, que tienen, en unidades atómicas, la forma: e r1 e r2 (9.15) 1 2 la energía aproximada será * Hd C12 H1,1 2C1C 2 H1,2 C 22 H 2,2 (9.16) E 2 2 * d C1 S1,1 2C1C2S1,2 C2S2,2 donde se ha utilizado la nomenclatura Hi, j H j,i *i H jd *j Hi d Si, j S j,i *i jd *j i d (9.17) Evidentemente, S1,1 = S2,2 =1. Se denomina integral de solapamiento a S1,2 = S2,1 = S. Esta integral representa el grado en el que los dos OA han solapado, así, si R = 0, S = 1, y si R = ∞, S = 0, luego C12 H1,1 2C1C 2 H1,2 C 22 H 2,2 N C 2C1C 2S C D A continuación, aplicamos el principio variacional, según el cual E/Ci = 0, luego E 2C1H1,1 2C2 H1,2 D N 2C1 2C 2S 0 C1 D2 E 2 1 2 2 (9.18) (9.19) Reordenando, dividiendo por 2/D, sacando factor común C1 y C2, y sabiendo que E = N/D, podemos escribir: C1 H1,1 E C2 H1,2 ES 0 un desarrollo idéntico con E/C2 = 0, conduce a una ecuación equivalente que es: 206 (9.20) Lección 9 Química Física (Curso 2010-11) C1 H1,2 ES C2 H 2,2 E 0 (9.21) Este es un sistema de ecuaciones lineales y homogéneas (ecuaciones seculares), las cuales, para que tengan soluciones en C1 y C2, diferentes de las triviales, deben cumplir que el determinante de sus coeficientes (determinante secular) debe ser cero. H1,1 E H1,2 ES 2 2 2 2 0 H1,1 E H1,2 ES E ES H1,2 ES H 2,2 E (9.22) donde se ha supuesto que H1,1 = H2,2, y donde, para simplificar hemos llamado α = H1,1 = H2,2, o integral de Coulomb, y β = H1,2, o integral de resonancia. La expresión anterior conduce a dos soluciones que llamaremos E+ y E-. E ES E 1 S E 1 S (9.23) si sustituimos E+ en las ecuaciones seculares, y desarrollamos cualquiera de las dos ecuaciones, sabiendo que α, β y S, son diferentes de cero, se obtiene que C1 = C2. Es decir, a la energía E+ le corresponde una función de onda ψ+ = C1(1+2). Cuando en las ecuaciones seculares se utiliza la solución E-, se llega a la conclusión que la única solución diferente de la trivial es cuando C1 = -C2, por lo que a E- le corresponde la función de onda ψ. = C1(1-2). Normalizando para ψ+. d 1 C 2 2 1 1 2 d C12 2 d d 2 d C 2 2S 2 1 2 2 1 2 2 1 por lo que despejando C1, y operando de la misma forma con ψ-, se obtiene: 2 1 C1 1 con E 1 S 2 1 S 2 1 S C1 1 2 1 S 1 2 con 2 1 S E 1 S (9.24) (9.25) Para resolver el problema, necesitamos conocer cuánto valen las integrales α, β, y S, y para resolver estas integrales se necesita usar coordenadas elípticas. En la Figura 9.4, se ilustra este sistema de coordenadas. z electrón r1 H1 r2 R x H2 N Figura 9.4 207 y Lección 9 Química Física (Curso 2010-11) Se supone a la molécula situada a lo largo del eje z, de forma que el centro de coordenadas coincida con el punto equidistante entre los núcleos (R/2). Las coordenadas en este sistema se denominan; μ, υ, y . Estas se definen como: r1 r2 R 1 r1 r2 R 1 1 2 0 (9.26) La coordenada, , coincide con la utilizada en coordenadas esféricas con el mismo nombre. En las definiciones anteriores se indican el espacio de existencia de cada una de estas coordenadas. Fijémonos en la coordenada μ, tanto en la Figura 9.4 como en su definición en la ecuación anterior. Cuando el electrón se encuentra en cualquier punto situado en la línea interior que une los núcleos, μ = 1. De hecho esta coordenada no puede tomar valores inferiores a 1, ya que r1 y r2, siempre son positivos. Si el electrón se encuentra en cualquier otro punto μ > 1, de forma que μ → ∞, cuando r1 y r2 tienden a infinito. La coordenada υ → 0, cuando r1 y r2 → ∞. Los valores máximos, y mínimos de esta coordenada se encuentran cuando el electrón está situado a lo largo del eje z. En efecto, si el electrón está situado en la parte positiva del eje z, r1 – r2 = -R, luego υ = -1. Cuando está situado hacia la parte negativa del eje z, entonces: r1 – r2 = R y por lo tanto υ = 1. En el apéndice 9.1, se muestra como se aplican estas coordenadas para resolver la integral de solapamiento. El resultado que se obtiene es: R2 S 12 d e R 1 R 3 (9.27) Obsérvese que S =1, cuando R= 0, y, S → 0, cuando R → 0. Experimentalmente, la molécula de H2+, tiene un mínimo de energía para R= 2 u.a.d. = 20.59 = 1.18 Å. A dicha distancia S = 0.58. La integral S no tiene unidades. Operando de forma similar, se resuelven las integrales de Coulomb, α, y de resonancia, β (ambas tienen unidades de energía), obteniéndose: 1 R 2R E1s e R (9.28) 1 E1S S 1 R e R R (9.29) En la Figura 9.5, se representa α – E1s (línea azul). La curva obtenida es siempre una cantidad positiva, es decir, la integral de Coulomb, α, es siempre mayor que la energía de un orbital atómico ls, y por lo tanto, esta integral no es capaz de explicar la disminución de energía que se observa experimental cuando se forma la molécula. La integral α, disminuye rápidamente con la distancia R, de hecho para la distancia de equilibrio de la molécula, se observa que α – E1s 0. Una buena aproximación en el estudio de moléculas complejas es suponer que α E1s, es decir, en general la integral de Coulomb se iguala a la energía del orbital atómico de partida. En la Figura 9.5, se representa también la integral de resonancia β, en función de la distancia 208 Lección 9 Química Física (Curso 2010-11) R, observándose que dicha integral posee un mínimo a distancias intermedias. En gran medida, β es la responsable de la formación del enlace. 0.5 (R) -E1s 0 (R) 0.5 0 5 R 10 Figura 9.5 Substituyendo las expresiones de α, β, y S, en las expresiones de la energía (ecuación 9.25, se obtiene para ψ+: 1 2R R 1 1 1 R e 1 R e R E E1s 1 S R R2 1 e R 1 R 3 y para ψ-, se obtiene: 1 2R R 1 1 1 R e 1 R e R E E1s 1 S R R2 1 e R 1 R 3 (9.30) (9.31) Las representaciones de E+ y E-, se muestran en la Figura 9.6, en la forma E-E1s. E-(R) 0.2 0 E+(R) 0 R 5 10 Figura 9.6 Como puede observarse, E- no presenta mínimo, es decir, la energía es siempre mayor o igual que la de los átomos por separado. Sin embargo, E+, muestra un mínimo a distancias intermedias 209 Lección 9 Química Física (Curso 2010-11) indicando de esta forma la formación de la molécula. Dicho mínimo está situado a una distancia, R = 2.493 u.a.d. =1.445 D (a0 = 0.58 D). Además para dicho valor de distancia, E-E1s = -0.06483 u.a.E. = 1.808 e.V. Experimentalmente, la molécula de H2+, muestra un mínimo de energía para R = 2 u.a.d.= 1.16 D siendo E+ - E1s = 2.79 e.V (energía de formación de la molécula). El valor obtenido (1.808 e.V.) representa el 65% de la energía ex`perimental. Físicamente, cuando dos núcleos de hidrógeno se aproximan y comparten un electrón, los átomos quedan atrapados en un pozo de energía potencial de profundidad E+ - E1s. Los resultados pueden mejorarse de forma significativa, utilizando el método variacional. Así, si en vez de orbitales 1s, empleamos funciones de onda con la forma: 3 / 2 r e (9.32) siendo λ, un parámetro ajustable, con respecto al cual minimizamos la energía, E/λ = 0, se obtiene que la energía es mínima para λ = 1.24, siendo para dicho mínimo, R = 2.02 u.a.d. = 1.2 D y que E+E1s = - 2.35 e.V., lo que representa el 85% de la energía real de la molécula. Utilizando funciones más complejas, pueden mejorarse aun más los resultados. 210 Lección 9 Química Física (Curso 2010-11) INTERPRETACIÓN FÍSICA DE LOS ORBITALES MOLECULARES Para representar ψ+ o ψ-, se necesitaría un espacio de 5 dimensiones, los valores de x, y, z, correspondientes a la posición del electrón, la distancia entre núcleos, R, y la quinta dimensión para representar ψ. Naturalmente esto es imposible. Una posibilidad, es representar la proyección de la función ψ sobre un plano, por ejemplo el x, z (el eje de la molécula se supone dirigido a lo largo del eje z), a R = constante, eligiéndose el valor de R, que corresponde al mínimo de energía del orbital molecular (OM). De esta forma, ψ puede representarse en la coordenada y. Esta representación es la que se muestra en la parte superior de la Figura 9.7. La función ψ+, es siempre positiva, mientras que ψ-, cambia de signo. En esta representación, los máximos de la curva corresponden a las posiciones donde están situados los núcleos. R+ R- (R+)2 (R-)2 (R+)2 (R-)2 Figura 9.7 La probabilidad de encontrar a los electrones viene dada por ψ2dτ. En coordenadas elípticas, el elemento de volumen es función del valor de las coordenadas, dτ = r1r2Rdμdυd (ver ecuación 9.34, en el apéndice 9.1), como sucedía en coordenadas esféricas. Si elegimos R constante, la función probabilidad es proporcional a ψ2r1r2. Estas funciones son las que se representa, también en el centro de la Figura 9.7. En estos casos, la probabilidad se hace cero cuando r1, o r2, son cero, es decir, en las posiciones ocupadas por los núcleos. Para ψ+, la probabilidad está fundamentalmente en la región comprendida entre los núcleos, mientras que para ψ-, dicha probabilidad esta fundamentalmente en la región externa a la posición de los núcleos. En la parte inferior de la Figura 9.7, se muestran también las funciones de probabilidad como curvas de nivel proyectadas sobre el plano x-z. En la Figura 9.8, se muestra también la representación de ψ2r1r2, para ψ+ (línea roja), y ψ(línea azul), a lo largo del eje z, es decir a lo largo del eje de la molécula. 211 Lección 9 Química Física (Curso 2010-11) r1r2 r1r2 Figura 9.8 4 3 2 1 H1 0 x (D) 1 2 3 4 H2 Es posible realizar un tipo de representación del OM tridimensional, dibujando superficies que encierren una cierta fracción, por ejemplo el 90%, de la probabilidad de encontrar al electrón. Este tipo de representación se muestra asimismo en la Figura 9.9. R+ RFigura 9.9 La energía de los OM depende de R. Aunque, es más frecuente utilizar diagramas de energía a R = cte. El valor de R que se utiliza, es el correspondiente al mínimo de energía de ψ+, además, en estos diagramas se suele representar también la energía de los orbitales atómicos (OA) de partida. En la Figura 9.10, se muestra un diagrama donde se esquematizan ambos tipos de representaciones, energía en función de la distancia, a la izquierda, y energía a distancia constante, a la derecha. Figura 9.10 A ψ+, se le denomina OM enlazante, debido a que contribuye a la formación del enlace, y a ψ, OM antienlazante, ya que, no solo no contribuye sino que se opone a la formación del enlace, dando lugar a una situación energética inestable. Para R = cte, siempre se observa que |E+ - E1s| < |E- - E1s|. 212 Lección 9 Química Física (Curso 2010-11) Por último, podríamos pensar que, dado que ψ+ y ψ-, son soluciones aproximadas, la solución ψ- no es válida, ya que realmente no explica la formación de la molécula. Es decir, se podría pensar que ψ- aparece únicamente como una solución matemática sin sentido físico, ya que el electrón no se coloca en dicho OM, al oponerse a la formación del enlace. Hay que indicar sin embargo, que ψ- si tiene sentido físico, en realidad, las dos combinaciones ψ+ y ψ- son necesarias para explicar la formación del enlace, y existe evidencia de que, en determinadas ocasiones, los electrones pueden colocarse en dichos OM antienlazantes. Realmente ψ+ y ψ-, corresponden a dos situaciones reales que se producen cuando dos átomos se aproximan, o bien tiene lugar una interferencia constructiva entre los OA de partida, o bien la interferencia es destructiva. De la misma forma que se han construido OM a partir de combinar orbitales atómicos (OA) 1s, se pueden construir OM a partir de combinar otros OA, así, 2s, 2p, etc. Trabajando de esta forma se pueden obtener una serie de OM enlazantes y antienlazantes, por cada combinación lineal, como se muestra en la Figura 9.11. Figura 9.11 Los OA que se combinan deben cumplir ciertos requisitos, para que los OM que se obtengan den lugar a mínimos de energía próximos a los experimentales. Estos requisitos son: 1) Los OA deben solapar lo máximo posible, es decir, el valor de la integral de solapamiento S, a la distancia de enlace de la molécula, debe ser alto. El valor de la integral de solapamiento depende de muchos factores, uno de ellos es que los OA tengan tamaños semejantes. En moléculas homonucleares dicho requisito se cumple con AO idénticos, por lo que este es el criterio que se utiliza en este caso. En moléculas heteronucleares este requisito se cumple, en general, con OA diferentes que hay que analizar en cada caso particular. 2) Los OA que se combinan, deben poseer energía del mismo orden de magnitud. Matemáticamente puede demostrarse que cuando la diferencia entre las energías de los OA que se combinan es muy grande, las energías de los OM que se forman coinciden prácticamente con la de los 213 Lección 9 Química Física (Curso 2010-11) dos OA de partida. Además, el tamaño de un orbital es proporcional a su energía, por lo que si las energías son muy diferentes, los tamaños también lo serán, y el solapamiento tenderá a cero. Por lo tanto, para la molécula de H2+, y en general para todas las moléculas diatómicas homonucleares, la forma más efectiva de construir OM es combinando OA idénticos. El problema surge, a la hora de denominar a los OM que se obtienen, ya que, en principio, no disponemos de números cuánticos propios de moléculas (trabajamos con funciones aproximadas). La forma de denominar a los OM se basa en la forma o simetría que poseen. En la Figura 9.11, se ilustra el procedimiento que se describe a continuación. x z + 1s + z 1s g 1s x z + 1s z - u 1s z 1s x - + z g2p z u 2p 2pz 2pz x + + - - z 2px z 2px - + + - + + z g 3d z u 3d 3dz 2 3dz 2 x z + - - + 3dxz + - z y x - + 3dx2-y2 3dxz + - z - + g 3d 3dx2-y2 Fi 1 Figura 9.11 -Si el orbital es invariante con respecto a la rotación sobre el eje de la molécula (eje z), se denomina a dicho orbital, . - Si el orbital posee un plano nodal que incluye al eje de la molécula, se denomina . - Si el OM posee dos planos nodales que incluyen el eje de la molécula, se denomina , etc. Como subíndice se utiliza la letra g o u. Este símbolo, indica si el OM es invariante (g) o 214 Lección 9 Química Física (Curso 2010-11) cambia de signo (u) cuando se realiza una inversión sobre el centro de simetría de la molécula. Los OM enlazantes son; σg, πu, δg, u, etc. mientras que los OM antienlazantes son σu, πg, δu, g, etc. En moléculas diatómicas heteronucleares, que no poseen centro de simetría, y por tanto no poseen carácter g o u, se suele indicar el carácter enlazante o antienlazante del OM colocando un asterisco sobre los OM antienlazantes. Por último, se suele indicar también el OA de partida detrás del símbolo del OM. Aunque esto no es necesario, utilizándose en su defecto un número de orden que precede a cada orbital de la misma simetría. En la figura 9.11, se muestran algunos ejemplos de estos tipos de simetría, indicando los orbitales atómicos de procedencia del OM. La unión de orbitales ns, conduce a dos OM, uno σgns y otro σuns. La unión de los tres orbitales np, suponiendo que el eje de aproximación entre los núcleos es el eje z, conduce a 6 OM, 3 enlazantes y 3 antienlazantes, que son σgnpz y σunpz, y los 4 orbitales πunpx, πunpy, πgnpx y πgnpy. Hay que indicar que los OM πunpx y πunpy, son degenerados. Como norma general, todos los orbitales π son degenerados. Por último la unión entre los orbitales d, conduce a 10 OM, 5 enlazantes y 5 antienlazantes, estos son, dos sigma, σgndz2 y σunpz2, 4 π, πundxz, πundyz, πgndxz y πgndyz. y 4 orbitales δ, que son δg3dx2y2, δg3dxy, δu3dx2-y2 y δu3dxy. Como sucedía con los orbitales π, los orbitales δ también son siempre degenerados. En la Figura 9.12, se esquematizan los OM formados en cada caso. Figura 9.12 Los OM enlazantes, poseen mínimos de energía, mientras que los antienlazantes no. El esquema de la Figura 9.12 es cualitativo, es decir, no se representa la energía relativa de cada uno de los orbitales, entre otras cosas porque la energía depende de la distancia R entre los núcleos, y cuando se tiene en cuenta esta dependencia, se observan que existen entrecruzamientos entre las energías de los diferentes orbitales moleculares. En el apéndice 9.2, se muestra la representación de la proyección sobre el plano X-Z de algunos orbitales moleculares, tal como se hizo en la figura 9.7 para los orbitales σgns y σuns. 215 Lección 9 Química Física (Curso 2010-11) ESTADOS ELECTRÓNICOS DE LA MOLÉCULA H2+ El hamiltoniano electrónico de la molécula H2+ tiene solución analítica, aunque es muy compleja. Dicha solución se obtiene resolviendo el hamiltoniano en coordenadas elípticas. Con estas coordenadas es posible efectuar separación de variables, tal como se hizo en el caso del átomo de hidrógeno. De esta forma las soluciones pueden escribirse como = M(μ)N()(). Cada coordenada lleva asociada un número cuántico; En concreto, las funciones M(μ) y N() son muy complejas, y solo pueden expresarse en forma de desarrollos en series, observándose que estas funciones están cuantizadas, aunque no es posible deducir la existencia de números cuánticos sencillos, es decir no aparecen n y ℓ como sucedía en el átomo de hidrógeno. Sin embargo, la función () es: 1 2 eim (9.33) siendo m = 0, ±1, ±2, ±3, etc. El número cuántico m, coincide con el número cuántico mℓ, del hidrógeno, y de hecho dicho número puede relacionarse con la proyección sobre el eje de la molécula, del momento angular orbital. Sin embargo, y a diferencia de lo que ocurría en átomos, la energía del OM, depende de m2. Por dicha razón, se utiliza una nomenclatura diferente para este número cuántico, se denomina λ = |m| = 0, 1, 2, 3, etc. Pese a no disponerse de soluciones analíticas generales y sencillas, de la función = M(μ)N()() es posible deducir dos propiedades de dichas soluciones. En primer lugar, se observa que cuando λ = 0, 1, 2, 3, etc, los orbitales moleculares poseen simetría, , π, δ, … etc., utilizándose por ello el correspondiente símbolo de simetría para indicar el valor del número cuántico λ. Por esta razón, los orbitales son no degenerados, ya que para ellos λ = 0. Pero el resto de los orbitales son siempre dos veces degenerados, ya que les corresponden dos valores de m, así para orbitales π, m = ± 1, siendo λ =|m| = 1, para orbitales δ, m = ± 2, siendo λ =|m| = 2, etc. En segundo lugar se observa que las funciones N() poseen simetría, es decir que N() = ± N(-). Esta propiedad implica la existencia de centro de simetría en la molécula. Al existir centro de simetría, los OM deben ser simétricos o antisimétricos con respecto a una inversión realizada sobre el centro de simetría, es decir, (x,y,z) =±(-x,-y-z). Los simétricos, o pares con respecto a esta inversión se denominan gerade, o g, los que son impares se denominan ungerade, o u. Las propiedades de la función N() son muy parecidas a las de los armónicos esféricos. 216 Lección 9 Química Física (Curso 2010-11) APÉNDICE 9.1: INTEGRAL DE SOLAPAMIENTO El paso de coordenadas elípticas, a cartesianas se efectúa mediante las siguientes relaciones. x R 2 2 11 2 cos y R 2 2 11 2 sen z R 2 rr R 4r r R3 2 2 ddd 1 2 ddd donde 2 2 122 d 8 2 R Con estas definiciones vamos a determinar la integral de solapamiento: S 12 d 1 r1 r2 1 R R 3 R 2 e d e d e 2 ddd 8 1 2 R 2 R3 2 d e d d 8 0 1 1 (9.34) (9.35) la integral en , vale 2π y la integral en μ, debe ser resuelta antes de resolver la integral en υ, además μ y υ, son coordenadas independientes, para resolver la integral en μ, hay que tener en cuenta que n az z e dz t n! at a2t2 antn e 1 at a n 1 2! n! (9.36) luego e R 1 2 d e 2 1 R d e R d 2 2 1 2 R R 2 2 R e 1 R e 3 R 2 R (9.37) por lo tanto S 12 d 1 1 2R 3 2 R R 2 2 R R 3 R 2 R2 e 1 R e d e 1 R 3 d 8 1 R 3 2 R 4 2 1 R 1 R 3 R 4 1 R2 2 R 2 R 2 R R2 R 2 d e 3 1 R e 1 R e 1 R R 1 2 3R 2 6 3 4 R (9.38) Otras integrales de solapamiento valen: 4R 2 R 3 R 4 R H H d e 1 R 2s 1 2s 2 9 9 45 H H d e 2p 1 2p R 2 2R 2 R 3 1 R 5 15 (9.39) Operando de forma similar, se resuelven las integrales de Coulomb, α, y de resonancia, β, obteniéndose: 1 R 2R E1s e R 1 E1S S 1 R e R R 217 (9.40) (9.41) Lección 9 Química Física (Curso 2010-11) APÉNDICE 9.2: Representación de OM proyectados sobre un plano. De igual forma a como se han representados las proyecciones de los OM σg1s y σu1s sobre un plano (X-Z), en la Figura 9.7, se pueden representar otras combinaciones lineales de orbitales atómicos. En la siguiente figura, se muestra este tipo de representación para los OM σgnpz y σunpz, así su probabilidad. Se supone que el eje de la molécula es el eje Z. OM enlazante g pz g pz 2 OM antienlazante u pz u pz 2 Figura 9.13 Eje Z molecular g pz u pz 2 2 Posiciones de los nucleos En la siguiente figura se muestra la representación de los OM πupx, y πgpx OM antienlazante OM enlazante g px u px u px p 2 g 2 x Figura 9.14 Eje X Eje X Eje Z molecular u px p 2 g x Posiciones de los nucleos 218 2 Lección 9 Química Física (Curso 2010-11) Por último, en la siguiente figura se muestra la representación de los OM πudxz y πgdxz. En estos casos solo se representan como curvas de nivel, dada la complejidad que muestran las curvas de superficie. OM antienlazante OM enlazante g dxz u dxz Eje X udxz 2 Eje X d Eje Z molecular Posiciones de los nucleos 219 g xz 2 Figura 9.15 Lección 9 Química Física (Curso 2010-11) CUESTIONES 1) Las funciones N ns ns y N ns ns representan dos orbitales moleculares de una molécula diatómica homonuclear. Describir brevemente las propiedades de dichos orbitales, indicando las principales diferencias existentes entre ellos. 2) Supóngase una molécula diatómica homonuclear, orientada a lo largo del eje x. Indicar como se denominan y dibujar de forma aproximada, y esquemática, los siguientes orbitales moleculares: N 2py 2py N 2px 2px N 2s 2s 3) Supóngase la molécula de ión hidrógeno (H2+). Indicar, comentándolas brevemente, si son ciertas o no las siguientes afirmaciones. a) En la molécula no existe repulsión interelectrónica. b) La función N 1s H A 1s H B , es la función de onda exacta del estado fundamental de la molécula. c) En el Hamiltoniano electrónico de la molécula, la distancia internuclear es constante, y por lo tanto la energía electrónica no depende de dicha distancia. d) El Hamiltoniano nuclear no depende de la energía electrónica. 4) En la siguiente figura se muestran 11 orbitales moleculares de la molécula ión de hidrogeno, construidos a partir de orbitales atómicos idénticos. En la imagen mostrada de estos orbitales, la molécula no se modifica de posición, correspondiendo esta a la que se muestra en el recuadro superior izquierdo. 6 1 2 3 4 5 7 8 9 10 11 Figura 9.16 Identifica, asignado la correspondiente simetría, todos los orbitales de la figura anterior. 220






