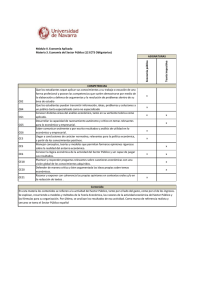
CUALIFICACIÓN PROFESIONAL Laboratorio de análisis clínicos
Anuncio

CUALIFICACIÓN PROFESIONAL Familia Profesional Nivel Código Versión Situación Actualización Fecha 11/5/2012 10:23:24 Página 1 de 42 Informe INCUAL-Intranet Laboratorio de análisis clínicos Sanidad 3 SAN124_3 5 RD 1087/2005 Competencia general Realizar estudios de análisis clínicos en muestras biológicas humanas, siguiendo los protocolos normalizados de trabajo, actuando bajo normas de calidad, seguridad y medioambientales, bajo la supervisión correspondiente, colaborando con el facultativo e interpretando y valorando los resultados técnicos, para que sirvan de soporte a la prevención, al diagnóstico, al control de la evolución, al tratamiento y a la investigación. Unidades de competencia UC0371_3: Realizar análisis de bioquímica clínica en muestras biológicas humanas. UC0373_3: Realizar análisis hematológicos y genéticos en muestras biológicas humanas y procedimientos para obtener hemoderivados. UC0369_3: Gestionar una unidad de un laboratorio de análisis clínicos. UC0370_3: Realizar los procedimientos de las fases preanalítica y postanalítica en el laboratorio clínico. UC0372_3: Realizar análisis microbiológicos e identificar parásitos en muestras biológicas humanas. UC0374_3: Realizar técnicas inmunológicas de aplicación en las distintas áreas del laboratorio de análisis clínicos. Entorno Profesional Ámbito Profesional Desarrolla su actividad profesional en el sector sanitario, en organismos e instituciones del ámbito público y en empresas privadas, en el área del laboratorio de análisis clínicos, en diagnóstico, tratamiento, gestión, e investigación. Actúa como trabajador dependiente, pudiendo ser el organismo o institución de tamaño pequeño, mediano o grande. Su actividad profesional esta sometida a regulación por la Administración sanitaria estatal. Sectores Productivos Sector sanitario: Laboratorios de diagnóstico clínico de centros de salud: atención primaria y comunitaria. Laboratorios de los centros hospitalarios: servicios de microbiología, hematología y hemoterapia, bioquímica, inmunología, genética, farmacia hospitalaria y laboratorios de los servicios de medicina y cirugía experimental. Laboratorios extra-hospitalarios: de apoyo al diagnóstico clínico, de seguimiento y control de alteraciones analíticas y de análisis preventivos en medicina de empresa. Banco de sangre: intra o extrahospitalario. Centros de reproducción asistida. Laboratorios de referencia. Laboratorios de institutos anatómico-forenses. Laboratorios de Institutos de toxicología. Laboratorios de análisis de clínicas veterinarias. Laboratorios de centros de experimentación animal. Fecha 11/5/2012 10:23:24 Página 2 de 42 Informe INCUAL-Intranet Otros sectores: Laboratorios de investigación y de universidades. Laboratorios de industria alimentaria, farmacéutica, cosmética y otras industrias con laboratorios de investigación de muestras biológicas. Ocupaciones y puestos de trabajo relevantes Técnico superior en laboratorio de diagnóstico clínico. Técnico especialista en laboratorio. Ayudante técnico en laboratorio de investigación y experimentación. Ayudante técnico en laboratorio de toxicología. Delegado comercial de productos hospitalarios y farmacéuticos. Formación Asociada ( 990 horas ) Módulos Formativos MF0371_3: Análisis bioquímicos en muestras biológicas humanas.(240 h) MF0373_3: Hematología, banco de sangre y genética.(240 h) MF0369_3: Gestión de una unidad de un laboratorio de análisis clínicos.(30 h) MF0370_3: Fases preanalítica y postanalítica clínicas.(120 h) MF0372_3: Análisis microbiológicos e identificaciones parasitológicas en muestras biológicas humanas.(240 h) MF0374_3: Inmunología clínica aplicada.(120 h) Fecha 11/5/2012 10:23:24 Página 3 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 1 Realizar análisis de bioquímica clínica en muestras biológicas humanas. Nivel 3 Código UC0371_3 Realizaciones profesionales y criterios de realización RP 1: Preparar las muestras, los materiales, instrumentos y equipos del laboratorio, en función de las técnicas a realizar. CR 1.1 El material adecuado se selecciona en función de la muestra y de la determinación a realizar. CR 1.2 Para cada tipo de muestra y determinación a realizar se seleccionan y efectúan si fuese necesario las operaciones previas: centrifugación, homogeneización u otras, para su posterior análisis. CR 1.3 Las diluciones adecuadas en las muestras y reactivos que lo requieran, se realizan en las condiciones definidas en los protocolos de trabajo. CR 1.4 Los materiales, los instrumentos y los equipos se encuentran disponibles y operativos en el momento que se necesiten. CR 1.5 Los reactivos, los patrones y los controles de calidad se preparan siguiendo los protocolos establecidos por el servicio. CR 1.6 El nivel de los reactivos, los calibradores, los controles y las muestras, se comprueban, así como su ubicación en las bandejas, verificando que se corresponden con el listado de trabajo. CR 1.7 La calibración y los controles diarios de los equipos asignados, se realizan siguiendo los protocolos. CR 1.8 Las operaciones necesarias para el mantenimiento de los equipos, se efectúan y registran siguiendo los protocolos correspondientes a cada equipo. RP 2: Realizar las determinaciones analíticas de bioquímica general solicitadas con más frecuencia en procedimientos ordinarios y en procedimientos de laboratorio de urgencias, con los equipos y las técnicas disponibles en el servicio. CR 2.1 El listado de trabajo se corresponde con las muestras problema. CR 2.2 La calibración se realiza siguiendo los protocolos establecidos. CR 2.3 Los controles de calidad se comprueba que son correctos por cada serie analítica y, en caso contrario, se repite la determinación y se informa al responsable del área. CR 2.4 La determinación analítica de compuestos metabólicos y de iones, se realiza por el método disponible en cada laboratorio. CR 2.5 Los valores obtenidos en las muestras se comprueba que son coherentes y, en caso contrario, se repite la determinación y se informa al responsable del área. CR 2.6 La determinación del pH y de gases en sangre, se realiza según el protocolo. CR 2.7 Las medidas de osmolalidad plasmática o urinaria se realizan en caso de necesidad, y de disponer de un osmómetro. CR 2.8 Los recuentos citológicos y los análisis bioquímicos de líquidos biológicos se realizan según los protocolos establecidos. RP 3: Realizar determinaciones analíticas para la detección de drogas de abuso y la monitorización de fármacos. CR 3.1 Los listados de trabajo se corresponden con las muestras problema. CR 3.2 Los equipos automáticos están calibrados y los resultados de los controles dentro del rango de valores. CR 3.3 Los niveles de decisión: cut off, están definidos conforme a lo especificado por el responsable del área. CR 3.4 Las técnicas de cribado o de confirmación, se realizan en función de sí se quiere cuantificar o no. CR 3.5 La determinación de fármacos en las muestras solicitadas, se realiza utilizando los equipos de diagnóstico disponibles en el laboratorio. CR 3.6 Los equipos automáticos están calibrados y los resultados de los controles dentro del rango de valores. CR 3.7 La evolución de los niveles terapéuticos se comprueba con el sistema informático de monitorización de fármacos del laboratorio RP 4: Realizar análisis electroforéticos para la separación de proteínas y de otras sustancias, y su posterior cuantificación. CR 4.1 El listado de trabajo se corresponde con las muestras problemas. CR 4.2 Los equipos de electroforesis y los materiales se preparan en función de la técnica electroforética utilizada. Fecha 11/5/2012 10:23:24 Página 4 de 42 Informe INCUAL-Intranet CR 4.3 La electroforesis de proteínas en las muestras, se realiza según el protocolo de trabajo establecido. CR 4.4 La separación de las distintas fracciones electroforéticas, se comprueba que es correcta para su posterior cuantificación. CR 4.5 Las técnicas de inmunoelectroforesis, inmunofijación e isoelectroenfoque, se realizan según los criterios establecidos en el laboratorio. CR 4.6 La técnica electroforética adecuada se aplica, para la separación de hemoglobinas, lipoproteínas, enzimas y otros parámetros de utilidad clínica, según los criterios fijados en el laboratorio. CR 4.7 El mantenimiento específico, adecuado para cada equipo se realiza, notificándose cualquier incidencia. RP 5: Realizar técnicas cromatográficas para la separación de analitos y su posterior cuantificación. CR 5.1 El listado de trabajo se corresponde con las muestras problemas. CR 5.2 Los equipos se preparan adecuadamente, en función de las técnicas a realizar: cromatografía de gases, cromatografía líquida de alta resolución y otras. CR 5.3 La cromatografía se realiza según el protocolo de trabajo al uso. CR 5.4 La separación de las distintas fracciones del cromatograma se comprueba que es correcta para su posterior cuantificación. CR 5.5 La técnica cromatográfica adecuada se aplica, de acuerdo a los criterios establecidos en el laboratorio y los equipos disponibles. CR 5.6 El mantenimiento específico, adecuado para cada equipo se realiza, notificándose cualquier incidencia. RP 6: Realizar análisis de hormonas, de marcadores tumorales y otros, mediante técnicas inmunológicas. CR 6.1 El listado de trabajo se corresponde con las muestras problema. CR 6.2 El equipo se prepara adecuadamente para el análisis, realizándose la calibración, analizándose los controles y realizándose el mantenimiento. CR 6.3 La técnica a utilizar se elige en función de la muestra y del equipo disponible en el servicio. CR 6.4 Se cumple con los requisitos de operador de RIA cuando se utilizan técnicas isotópicas, identificándose de forma precisa los riesgos y el manejo de las mismas. CR 6.5 Los portaobjetos con los cortes de tejidos o tipos celulares, los anticuerpos marcados y los reactivos a utilizar se encuentran a temperatura ambiente. CR 6.6 Las distintas preparaciones se observan al microscopio de fluorescencia, efectuando los ajustes de intensidad de luz y la utilización de filtros adecuados, en función de la técnica a realizar. CR 6.7 El protocolo se sigue correctamente para la realización de las técnicas de aglutinación, inhibición de la hemoaglutinación, de búsqueda de antígenos o de anticuerpos. RP 7: Realizar el análisis cualitativo y el cuantitativo de orina, con los equipos y procedimientos disponibles en el servicio. CR 7.1 Los listados de trabajo se corresponden con las muestras problema. CR 7.2 El equipo para el análisis químico básico semicuantitativo de orina se prepara adecuadamente. CR 7.3 Las orinas para el análisis químico básico semicuantitativo se analizan, mediante espectrofotometría de reflexión por química seca. CR 7.4 El análisis del sedimento urinario se realiza conforme al protocolo del laboratorio, los resultados se contrastan con los del análisis semicuantitativo y se registran. CR 7.5 El análisis de orina cuantitativo se realiza mediante la técnica elegida por el responsable del área, de acuerdo al el equipo disponible en el laboratorio. CR 7.6 Las orinas remitidas que correspondan a una solicitud determinada de recogida: 8, 12, o 24 horas, se registran, anotándose su volumen y separándose alícuotas para su posterior análisis. CR 7.7 Los cálculos urinarios se analizan según los protocolos específicos y en función de las características del servicio. RP 8: Realizar estudios de patología molecular con utilización de técnicas de amplificación de ácidos nucleicos, mediante la reacción en cadena de la polimerasa (PCR), siguiendo los criterios establecidos. CR 8.1 La extracción de ADN de la muestra se realiza según el protocolo establecido. CR 8.2 Las precauciones necesarias se adoptan, para evitar la contaminación de muestras y reactivos, conforme a lo especificado en el protocolo. CR 8.3 El ADN se desnaturaliza para obtener las cadenas separadas. CR 8.4 El material genético se analiza al finalizar la PCR. CR 8.5 Las distintas bandas de ADN se identifican, mediante la utilización de patrones adecuados. CR 8.6 La separación electroforética del material obtenido y su visualización se realiza, mediante el protocolo establecido. CR 8.7 La hibridación de ácidos nucleicos se realiza, utilizando el tipo de marcaje más adecuado y disponible. Fecha 11/5/2012 10:23:24 Página 5 de 42 Informe INCUAL-Intranet RP 9: Manejar grandes sistemas automáticos del área de bioquímica. CR 9.1 Se realizan calibraciones y se procesan controles, antes de comenzar el trabajo. CR 9.2 El sistema informático del laboratorio está en comunicación con el analizador y transmite las peticiones solicitadas. CR 9.3 Los listados de trabajo se elaboran, preparándose los sueros para ser colocados en el analizador. CR 9.4 El correcto funcionamiento del analizador se controla, solucionándose las incidencias. CR 9.5 Los resultados de los controles se comprueban y, si están fuera de rango, se realizan las repeticiones de acuerdo a lo descrito en el protocolo de trabajo, transmitiéndose, a continuación, los resultados al sistema informático del laboratorio. CR 9.6 Se controla en los equipos modulares o analizadores en serie (IPM) el correcto funcionamiento así como la colocación y retirada de muestras. CR 9.7 Se registra cualquier incidencia, antes, durante y después del proceso. CR 9.8 Las operaciones necesarias para el mantenimiento de los equipos se efectúan y registran, siguiendo los protocolos fijados. RP 10: Efectuar el control de calidad, interno y externo, de los parámetros analizados en el área de trabajo. CR 10.1 Los controles en cada área se procesan conforme a lo especificado en los protocolos de trabajo. CR 10.2 Los datos de rangos, número de lote y fecha de caducidad de control, se introducen correctamente en el sistema informático del laboratorio (SIL) y en el equipo de medida correspondiente. CR 10.3 Los resultados de los controles de cada serie analítica, se registran y se analizan conforme a las reglas control que se hayan establecido en el servicio. CR 10.4 Se elabora un informe mensual con los resultados de cada control, en el que se debe incluir la media, la desviación estándar, y el coeficiente de variación. CR 10.5 Las muestras del control externo se procesan periódicamente como una muestra más en cada área del servicio, para realizar el preceptivo control de calidad de los resultados. Contexto profesional Medios de producción Reactivos químicos y biológicos diversos. Material básico de laboratorio (pipetas, matraces, gradillas, tubos, portaobjetos, cubreobjetos u otras.). Pipetas automáticas. Materiales desechables variados (pipetas, puntas de pipetas automáticas, tubos u otras.). Material de seguridad (guantes, mascarillas, batas). Recipientes para recogida de residuos biológicos. Centrífugas. Microcentrífugas. Frigoríficos. Agitadores. Baños termostáticos. Estufas. Balanzas. Microscopios ópticos. Microscopio de fluorescencia. pH-metro. Destiladores de agua. Equipos automáticos de química clínica. Fotómetro de llama. Equipo de electrodos selectivos. Absorción atómica. Equipos de gases y pH sanguíneos. Osmómetro. Lector de reflexión de tiras de orina. Equipos automáticos de inmunoquímica. Equipos de electroforesis. Equipos de cromatografía. Fotómetro. Espectrofotómetro. Termociclador. Transiluminador UV. Equipos fotográficos. Equipos automáticos para la reacción en cadena de la polimerasa (PCR). Equipos de Turbidimetría y nefelometría. Equipos automáticos para enzimoinmunoanálisis (EIA). Campanas de bioseguridad de flujo laminar. Sistemas informáticos de gestión. Libros de registro Productos y resultados Resultados analíticos bioquímicos. Informes analíticos. Registro de incidencias. Información utilizada o generada Normas para el control de calidad. Listados de trabajo. Normas de seguridad. Protocolos técnicos. Folletos de equipos diagnósticos. Manuales de manejo de los distintos equipos.Protocolos normalizados de trabajo. Fichas clínicas. Bibliografía especializada de consulta. Fecha 11/5/2012 10:23:24 Página 6 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 2 Realizar análisis hematológicos y genéticos en muestras biológicas humanas y procedimientos para obtener hemoderivados. Nivel 3 Código UC0373_3 Realizaciones profesionales y criterios de realización RP 1: Preparar los materiales, los instrumentos, los equipos y las muestras, en función de las técnicas a realizar. CR 1.1 Los materiales, los instrumentos y los equipos se encuentran disponibles y operativos, en el momento en el que se necesitan. CR 1.2 Los reactivos, los calibradores, los controles y las muestras, se preparan siguiendo los protocolos establecidos, ubicándose en las bandejas y comprobándose que se corresponden con el listado de trabajo. CR 1.3 La calibración y los controles diarios de los equipos asignados, se realiza siguiendo los protocolos de trabajo establecidos. CR 1.4 Se seleccionan y efectúan, para cada tipo de muestra y de determinación a realizar, si fuese necesario, las operaciones previas: centrifugación, homogeneización u otras, para su posterior análisis. CR 1.5 Las operaciones de desfibrinación, de concentración de leucocitos, hemolizados, etc., se realizan mediante las técnicas adecuadas, en las determinaciones que así lo requieran. CR 1.6 El material empleado no desechable se limpia y ordena, conforme a las normas del laboratorio. RP 2: Realizar tinciones sanguíneas y de médula ósea, para identificación morfológica de elementos celulares. CR 2.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos de trabajo específicos. CR 2.2 Los frotis sanguíneos y de médula ósea se realizan, se fijan por el método adecuado y quedan dispuestos para el proceso de tinción. CR 2.3 Las distintas tinciones solicitadas se realizan, según los procedimientos establecidos para cada técnica. RP 3: Realizar técnicas de hematimetría y recuentos celulares automáticos y manuales, en muestras de sangre periférica y médula ósea. CR 3.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos. CR 3.2 La selección de técnicas y de equipos para hematimetría se realiza, en función del tipo de muestra y del parámetro a analizar. CR 3.3 Los resultados que se obtienen de velocidad de sedimentación y los recuentos celulares son coherentes, informándose o repitiéndose la determinación, según proceda. CR 3.4 La fórmula leucocitaria se realiza por diferenciación morfológica con el microscopio, cuando es necesario. RP 4: Manejar grandes sistemas automáticos del área de hematología y genética. CR 4.1 Las calibraciones se realizan, procesándose los controles antes de comenzar el trabajo. CR 4.2 El sistema informático del laboratorio se comunica con el analizador y transmite peticiones. CR 4.3 Los listados de trabajo se elaboran, preparándose la sangre, el suero, el plasma u otras muestras para ser colocados en el analizador. CR 4.4 El correcto funcionamiento del analizador se controla, solucionándose las incidencias. CR 4.5 Los resultados de los controles se comprueban, realizándose las repeticiones de acuerdo a lo descrito en el protocolo de trabajo, y transmitiéndose, a continuación, los resultados al sistema informático de laboratorio. CR 4.6 Se controla el correcto funcionamiento en los equipos modulares, así como la colocación y la retirada de las muestras. CR 4.7 Cualquier incidencia se registra antes, durante y después del proceso. RP 5: Realizar técnicas de estudio de hemostasia y de coagulación según las determinaciones solicitadas. CR 5.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos. CR 5.2 Los estudios de hemostasia se realizan por la técnica adecuada a las determinaciones solicitadas y características del paciente o usuario. CR 5.3 Los coagulómetros automáticos se configuran para realizar las determinaciones solicitadas. CR 5.4 Las determinaciones se realizan en el orden indicado en los listados de trabajo. CR 5.5 Las determinaciones de control de tratamiento anticoagulante se realizan según protocolo. RP 6: Realizar técnicas inmunohematológicas según las determinaciones solicitadas. Fecha 11/5/2012 10:23:24 Página 7 de 42 Informe INCUAL-Intranet CR 6.1 La correspondencia entre los listados de trabajo y las muestras problema se comprueba, según los protocolos de trabajo específicos. CR 6.2 La determinación manual o automática de todos los grupos sanguíneos solicitados se realiza, según el protocolo establecido por el servicio. CR 6.3 Las técnicas para escrutinio de anticuerpos irregulares y para la detección de antiglogbulinas se realizan en las muestras que se solicite. CR 6.4 Las pruebas cruzadas se realizan y se verifican por el método de confirmación. RP 7: Preparar y distribuir hemoderivados en un banco de sangre. CR 7.1 Las bolsas de sangre recibidas se comprueba que están correctamente identificadas. CR 7.2 A las muestras piloto de las bolsas de sangre recibidas se les realizan las determinaciones analíticas de control, para su aceptación o rechazo. CR 7.3 Las bolsas de sangre aceptadas se etiquetan, anotando los datos inmunohematológicos. CR 7.4 Las centrífugas, se encuentran dispuestas, realizándose correctamente la separación del plasma y de los hematíes, en los tiempos y a las temperaturas requeridas. CR 7.5 Los diversos hemoderivados se obtienen, utilizando la metodología y la tecnología disponibles en el banco de sangre correspondiente. CR 7.6 Los hemoderivados obtenidos se registran y almacenan según el protocolo específico de trabajo, de forma que estén en condiciones idóneas hasta su distribución. CR 7.7 Los hemoderivados se distribuyen según las peticiones cursadas y se actualizan los ficheros de existencias. RP 8: Realizar técnicas de obtención y de amplificación de ácidos nucleicos mediante la reacción en cadena de la polimerasa (PCR), siguiendo los criterios establecidos. CR 8.1 La extracción de ADN de la muestra se realiza según el protocolo establecido. CR 8.2 Las precauciones necesarias se adoptan para evitar la contaminación de las muestras y de los reactivos. CR 8.3 El ADN se desnaturaliza para obtener las cadenas separadas. CR 8.4 Al finalizar la PCR se obtiene suficiente material genético. CR 8.5 Las distintas bandas de ADN se identifican mediante la utilización de patrones adecuados. CR 8.6 La separación electroforética del material obtenido se realiza, al igual que su visualización mediante el protocolo establecido. RP 9: Realizar cariotipos por métodos convencionales siguiendo los protocolos del servicio. CR 9.1 El tratamiento y el procesamiento de las muestras tales como: sangre periférica, médula ósea líquido amniótico, explantes, cordón, se realiza según sus características y en estrictas condiciones asépticas. CR 9.2 El cultivo se realiza durante el tiempo y en las condiciones que indiquen en los protocolos. CR 9.3 Las fases del sacrificio se siguen de forma estricta, consiguiéndose preparaciones cromosómicas en disposición de aplicar las técnicas de observación e identificación. CR 9.4 Las extensiones a partir del cultivo, así como las tinciones, se realizan según la técnica apropiada, obteniéndose los diferentes tipos de bandeado cromosómico. CR 9.5 Las microfotografias y las ampliaciones se realizan, se recorta la foto, los cromosomas se emparejan y ordenan según plantilla. CR 9.6 El resultado se anota en la ficha correspondiente, registrándose y archivándose los resultados. RP 10: Realizar técnicas de estudio de análisis de genes. CR 10.1 Las distintas fases de las técnicas de hibridación "in situ" con fluorescencia (FISH), se realizan siguiendo escrupulosamente los protocolos. CR 10.2 Los métodos de análisis directo: Single Strand Conformation Polymorphism (SSCP), Conformational sensitive gel electroforesis (CSGE) y otros, para la detección de mutaciones se realizan de acuerdo a los protocolos del servicio. CR 10.3 Las distintas fases de la técnica PLFR para detección de polimorfismo de longitud de fragmentos de restricción (aislamiento de ADN, obtención de fragmentos de restricción, Southern Blot y detección de las bandas) se realizan según protocolos. Contexto profesional Medios de producción Reactivos químicos y biológicos diversos. Material básico de laboratorio (pipetas, matraces, gradillas, tubos, portaobjetos, cubreobjetos, etc.). Materiales desechables variados (asas, frascos, tubos de cultivo celulares, pipetas, etc.). Pipetas automáticas. Material de seguridad (guantes, mascarillas, batas). Recipientes para Fecha 11/5/2012 10:23:24 Página 8 de 42 Informe INCUAL-Intranet recogida de residuos biológicos. Centrífugas. Microcentrífugas. Frigoríficos. Agitadores. Baños termostáticos. Estufas. Balanzas. Microscopios ópticos. Microscopio de fluorescencia. pHmetro. Destiladores de agua. Agitadores rotatorios. Microscopio invertido. Equipos automáticos de inmunoquímica. Equipos de electroforesis. Fotómetros. Espectrofotómetro. Termociclador. Transiluminador UV. Equipos automáticos para PCR. Equipos automáticos para enzimoinmunoanálisis (EIA). Campanas de bioseguridad de flujo laminar. Equipos automáticos de tinción. Velocidad de sedimentación. Coagulación. Hematimetría. Citómetro de flujo. Equipos prensabolsas. Armarios conservadores de bolsas de sangre y hemoderivados. Sistemas informáticos de gestión. Libros de registro. Productos y resultados Extensiones sangre y médula ósea. Bolsas de sangre y hemoderivados. Informes de resultados analíticos hematológicos. Informes de banco de sangre. Gráficas de poblaciones leucocitarias, gráficas de control calidad. Resultados analíticos. Informes analíticos. Cariotipos. Registro de incidencias. Información utilizada o generada Listados de trabajo. Fichas clínicas. Protocolos técnicos. Manuales de manejo de los distintos equipos. Normas para el control de calidad. Normas de Seguridad. Bibliografía especializada de consulta. Fecha 11/5/2012 10:23:24 Página 9 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 3 Gestionar una unidad de un laboratorio de análisis clínicos. Nivel 3 Código UC0369_3 Realizaciones profesionales y criterios de realización RP 1: Gestionar los ficheros de pacientes o usuarios de un servicio sanitario en función de las necesidades de atención y la tecnología disponible. CR 1.1 Se selecciona un sistema de gestión de base de datos adecuado para el control de la actividad. CR 1.2 Se colabora, con el experto informático, en la configuración más idónea de la base de datos para integrar la información remitida o/y generada sobre los pacientes o usuarios. CR 1.3 Las bases de datos de pacientes o usuarios se actualizan periódicamente, incorporando datos sobre pruebas diagnósticas o exploratorias especificas. CR 1.4 Se realizan volcados de seguridad con la información digitalizada y se clasifican todos los documentos para su localización. CR 1.5 Las peticiones de pruebas analíticas, se comprueban y registran según los Protocolos Normalizados de Trabajo (PNTs ) en vigor. CR 1.6 Se conocen y aceptan el documento de seguridad sobre protección de datos, conforme establece la ley de protección de datos. RP 2: Realizar la citación de pacientes o usuarios, según las características del laboratorio, manteniendo un trato cordial y personalizado. CR 2.1 Se informa correctamente sobre el lugar, fecha, horario y preparación previa requerida. CR 2.2 Se comunica si hubiese, las modificaciones surgidas respecto a fechas y horario. CR 2.3 Se conocen y aplican los requerimientos necesarios para recepción de peticiones médicas de las distintas entidades sanitarias. CR 2.4 Se atiende al paciente y a sus acompañantes de una forma cordial y personalizada, informándoles sobre el proceso de realización de pruebas específicas. RP 3: Gestionar el almacenamiento, la reposición y la adquisición del material fungible y el instrumental utilizado en el área de trabajo. CR 3.1 Se establecen las cantidades mínimas necesarias de producto a partir de las cuales debe reponerse de inmediato. CR 3.2 El pedido se realiza si es necesario, conforme a las normas establecidas. CR 3.3 La solicitud de productos y la recepción de los mismos se registran según las normas establecidas. CR 3.4 El material necesario se distribuye a cada área de trabajo, asegurándose el nivel adecuado de existencias, cualitativa y cuantitativamente. CR 3.5 Se negocia con los proveedores las condiciones de compra, conforme a las instrucciones del servicio. CR 3.6 Se programa el trabajo de forma que permita cumplir con los plazos de entrega, satisfacer las necesidades de asistencia y optimizar al máximo los recursos materiales disponibles. RP 4: Colaborar en la programación y mantenimiento de los equipos, interpretando la información científica y técnica de aparatos y procedimientos de utilización de los mismos, de manera que se posibilite la ejecución de las actividades propias del área de trabajo. CR 4.1 Se establece el plan de mantenimiento de primer nivel y de nivel especializado, fijando los plazos de revisión y el personal responsable de llevarlo a cabo. CR 4.2 Las fichas de mantenimiento de equipos y sistemas de gestión se diseñan basándose en las especificaciones del fabricante. CR 4.3 Las revisiones de primer nivel de los equipos y de los sistemas de medida se ajustan a los plazos previstos para que estén operativos siempre que se necesiten. CR 4.4 La información e instrucciones se formulan de forma: clara, concisa, precisa, con un orden secuencial lógico, de fácil comprensión para el personal que van a utilizarlas. CR 4.5 Se comprueba que en la información para la realización de una técnica analítica, figura: fundamento, muestras a utilizar, material y equipos, descripción detallada del procedimiento (tiempos, temperatura, etc.) y observaciones concretas en función de la técnica que se realice. RP 5: Procesar la información manejando los datos disponibles en el sistema informático, coordinando conexiones informáticas con otros centros o laboratorios. CR 5.1 Se selecciona un sistema de gestión de base de datos adecuado para el control de la actividad. Fecha 11/5/2012 10:23:24 Página 10 de 42 Informe INCUAL-Intranet CR 5.2 Se configura la base de datos para almacenar la información sobre clientes, citaciones, exploraciones, informes, reparaciones e inventario. CR 5.3 Se realiza en el programa informático informes estadísticos para elaborar resúmenes de actividades del servicio, conforme se haya organizado por los responsables. CR 5.4 Se comunican resúmenes diarios de actividad para cotejar posibles incidencias. CR 5.5 Se comprueba que todas las solicitudes del paciente han sido terminadas y validadas por los responsables para emitir el informe. CR 5.6 Se transmite por medios informáticos listados con la identificación de las peticiones y órdenes de trabajo a laboratorios de apoyo y de referencia. CR 5.7 La información se recibe por vía informática de laboratorios de referencia o de otros centros. RP 6: Colaborar en la programación del servicio y el seguimiento del plan de prevención de riesgos. CR 6.1 Se optimizan recursos materiales, sin afectar a la calidad final del resultado. CR 6.2 La programación permite cumplir con los plazos de entrega y satisfacer las necesidades de asistencia. CR 6.3 Se conocen los riesgos asociados a cada área de trabajo. CR 6.4 Se actúa adecuadamente ante una emergencia y/o accidente laboral en el laboratorio. CR 6.5 Se conoce el proceso de recogida de residuos biológicos. RP 7: Colaborar en la facturación en aquellos servicios que lo requieran, en centros de titularidad privada. CR 7.1 Los volantes de petición analítica se revisan para comprobar que estén cumplimentados adecuadamente, conforme a lo exigido por cada entidad aseguradora. CR 7.2 Las relaciones y listados de cada proveedor se elaboran conforme a lo especificado en los protocolos. CR 7.3 Se comprueba que todas las facturas cumplen con los requisitos legales. RP 8: Colaborar en el desarrollo de la garantía de calidad en la realización de las pruebas analíticas. CR 8.1 Los protocolos de trabajo de los procesos asignados se revisan y adaptan periódicamente. CR 8.2 Cada proceso y actuación se registra conforme a lo que se indica en los protocolos. CR 8.3 Colaborar en el desarrollo y cumplimiento de las normas de calidad para la acreditación del servicio conforme a las normas de calidad ISO específicas (Norma EN-ISO 15189). Contexto profesional Medios de producción Libros de registro. Archivos. Ficheros. Redes locales. Equipos informáticos. Sistemas informáticos de gestión del laboratorio de análisis clínicos. Conexión Internet e intranet. Productos y resultados Pedidos de reactivos, materiales y equipos. Informes analíticos. Resumen de actividades. Listados de citación de pacientes. Listados de facturación. Información utilizada o generada Solicitudes analíticas. Historias y fichas clínicas. Protocolos técnicos de trabajo. Normas de mantenimiento de equipos. Normas para el control de calidad. Normas de seguridad. Albaranes. Facturas. Volantes de sociedades médicas. Normativa comunitaria, estatal y en su caso autonómica sobre: Ley General de Sanidad Ordenación de las profesiones sanitarias Protección de datos de carácter personal. Prevención de riesgos laborales, así como su reglamento y normas de aplicación. La autonomía del paciente y derechos y obligaciones en materia de información y documentación clínica. Cohesión y calidad del Sistema Nacional de Salud. Normativa Internacional sobre Estandarización de los Laboratorios de Análisis Clínicos. (Norma EN-ISO 15189) Fecha 11/5/2012 10:23:24 Página 11 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 4 Realizar los procedimientos de las fases preanalítica y postanalítica en el laboratorio clínico. Nivel 3 Código UC0370_3 Realizaciones profesionales y criterios de realización RP 1: Colaborar en la obtención y recogida de muestras biológicas para su posterior análisis. CR 1.1 Los materiales para la toma de muestras son los adecuados y están en cantidad suficiente para la realización del trabajo diario. CR 1.2 El manual de toma de muestras se consulta ante cualquier duda que surja previamente a la recogida. CR 1.3 Los recipientes se identifican, antes de la obtención y recogida de la muestra, con el soporte y el código utilizados en el servicio y se comprueba que coinciden con el volante de solicitud del análisis. CR 1.4 Al paciente o usuario se le informa adecuadamente sobre la técnica de recogida de muestra, y éste recibe en todo momento un trato adecuado. CR 1.5 Las muestras biológicas humanas se obtienen y recogen según los protocolos establecidos, bajo la supervisión del facultativo. CR 1.6 La muestra se distribuye en los recipientes adecuados conforme a los protocolos. CR 1.7 Las muestras se organizan para su envío al hospital, clínica o laboratorio. RP 2: Identificar las muestras biológicas a su llegada al laboratorio según los criterios establecidos. CR 2.1 Las muestras recibidas de las diversas áreas hospitalarias, periféricas y/o de otros centros, se comprueba que cumplen las normas de obtención y recogida, de conservación, transporte e identificación unívoca con los correspondientes volantes de solicitud. CR 2.2 Las muestras, se comprueba que son apropiadas en sus condicionantes predefinidos (anticoagulantes, conservantes, recipientes, tiempo transcurrido) así como en su volumen, comprobando que es suficiente para las determinaciones. CR 2.3 Los datos de identificación se verifican para cada paciente o usuario y muestra. CR 2.4 La identificación de las muestras se válida con el soporte y el código empleados en el laboratorio. RP 3: Registrar las muestras biológicas según los criterios establecidos. CR 3.1 Los volantes de petición se registran anotando los datos de identificación y las determinaciones solicitadas. CR 3.2 La solicitud de petición y las muestras correspondientes a ella se comprueba que están identificadas de manera correcta con el código del laboratorio. CR 3.3 Se remiten las peticiones registradas, mediante conexión informática a las distintas secciones del laboratorio. RP 4: Preparar las muestras para su análisis y las listas de trabajo para los diferentes laboratorios o áreas. CR 4.1 Para cada tipo de muestra y de determinación a realizar se seleccionan y efectúan, si fuese necesario, las operaciones previas para las analíticas (centrifugación, homogeneización u otras). CR 4.2 Las diluciones estipuladas, en las muestras y reactivos que lo requieran, se realizan en las condiciones definidas en los protocolos de trabajo. CR 4.3 El agua utilizada cumple los requisitos de calidad química necesaria. CR 4.4 Los listados de trabajo de las distintas áreas de laboratorio se elaboran con el sistema informático, o en su caso, de forma manual. CR 4.5 Las muestras se ordenan según las hojas de trabajo de cada área. RP 5: Distribuir las muestras en las diferentes áreas de trabajo, registrando las incidencias, para el seguimiento de garantía de calidad en el laboratorio de análisis clínico. CR 5.1 La distribución de listados y de muestras se realiza en el menor plazo de tiempo posible y, en caso contrario, se mantienen en las condiciones de temperatura, humedad y atmósfera adecuada a cada tipo de muestra y de determinación a realizar. CR 5.2 No se distribuye ninguna muestra sin identificar y en condiciones no óptimas para su análisis. CR 5.3 Las muestras que en algunas áreas de trabajo no van a ser procesadas en el día se almacenan adecuadamente. CR 5.4 El manejo del transporte y del flujo de muestras de los sistemas modulares, se controla según los protocolos. CR 5.5 Las incidencias que surjan en este proceso se registran conforme se especifica en el manual de calidad, para ser analizadas por el servicio, de acuerdo con el criterio de la mejora continua. RP 6: Almacenar las muestras procesadas según las normas establecidas, organizando el área de trabajo al finalizar la tarea. Fecha 11/5/2012 10:23:24 Página 12 de 42 Informe INCUAL-Intranet CR 6.1 Las muestras recién procesadas en el área de trabajo se recogen y preparan para su almacenamiento en frigorífico o congelador, según se especifique en cada área del laboratorio y/o el servicio. CR 6.2 Se realiza el registro de las muestras almacenadas para su fácil localización si fuera preciso. CR 6.3 Al terminar el trabajo se encarga de que en su área, todo quede dispuesto, en orden y limpio para una próxima utilización. CR 6.4 El orden de los frigoríficos y congeladores empleados para almacenar muestras, materiales y reactivos se revisa según criterios del servicio. CR 6.5 Las muestras que se especifiquen se desechan según criterios del servicio. Contexto profesional Medios de producción Reactivos químicos y biológicos diversos. Material básico de laboratorio (pipetas, matraces, gradillas, tubos, portaobjetos, cubreobjetos u otros). Pipetas automáticas. Materiales desechables variados (pipetas, puntas de pipetas automáticas, tubos u otros). Material de seguridad (guantes, mascarillas, batas). Recipientes para especímenes (tubos, frascos, vasos u otros.). Etiquetas codificadas. Material de toma de especímenes. Recipientes para recogida de residuos biológicos. Centrífugas. Frigoríficos. Agitadores. Baños termostáticos. Estufas. Balanzas Microscopios ópticos. Microscopio de fluorescencia. pHmetro. Destiladores de agua. Equipos modulares de distribución de muestras. Sistemas informáticos de gestión. Redes locales. Programa informático de gestión de laboratorio. Libros de registro. Productos y resultados Atención al paciente o usuario. Especímenes. Muestras clasificadas y ordenadas. Listados de trabajo. Registro de incidencias. Información utilizada o generada Solicitud analítica. Datos de identificación. Datos de codificación. Protocolos técnicos de trabajo. Catálogo de pruebas. Normativa comunitaria, estatal y en su caso autonómica sobre prevención de riesgos laborales, así como su reglamento y normas de aplicación. Normativa Internacional de Estandarización de los Laboratorios de Análisis Clínicos. (Norma EN-ISO 15189). Manual de toma de muestras para el laboratorio clínico de la Administración sanitaria estatal. Fecha 11/5/2012 10:23:24 Página 13 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 5 Realizar análisis microbiológicos e identificar parásitos en muestras biológicas humanas. Nivel 3 Código UC0372_3 Realizaciones profesionales y criterios de realización RP 1: Preparar los materiales, los instrumentos y los equipos utilizados en las diferentes secciones del laboratorio de microbiología, en función de las técnicas y de las determinaciones a realizar. CR 1.1 La desinfección se realiza diariamente con los productos y métodos adecuados. CR 1.2 La esterilización del material que lo precisa, se realiza con las técnicas disponibles, efectuándose el control del proceso. CR 1.3 El material esterilizado se coloca y conserva adecuadamente, para mantener las condiciones de esterilidad. CR 1.4 Los materiales, los instrumentos y los equipos se encuentran disponibles y operativos, en el momento que se necesitan. CR 1.5 El material contaminado se deshecha en los contenedores específicos dispuestos a tal fin en el laboratorio. RP 2: Procesar las diferentes muestras para su análisis bacteriológico utilizando los medios de cultivo, las condiciones de incubación y las pruebas de identificación adecuadas. CR 2.1 Se seleccionan y efectúan para cada tipo de muestra y de determinación a realizar, las operaciones previas (centrifugación, homogeneización, u otras), para su posterior análisis. CR 2.2 La siembra de la muestra a analizar se realiza en la forma adecuada, cumpliendo las normas específicas destinadas a evitar contaminaciones. CR 2.3 Los medios de cultivo se utilizan en función de la muestra y de los microorganismos a estudiar, incubándose a la temperatura y atmósfera adecuadas, durante el tiempo necesario, observando que el crecimiento que se obtiene es el esperado. CR 2.4 Las tinciones están bien realizadas y permiten el estudio microscópico de la muestra. CR 2.5 Las pruebas bioquímicas de identificación individuales, con sistemas multiprueba o con sistemas automatizados, se seleccionan y realizan, en función del microorganismo y de las características del laboratorio, de forma que permitan la identificación del microorganismo. CR 2.6 La identificación de determinadas bacterias se realiza mediante sondas de hibridación específicas según los protocolos de trabajo específicos. RP 3: Estudiar la sensibilidad de las bacterias a diferentes antimicrobianos. CR 3.1 El perfil antibiótico se selecciona en función del tipo de microorganismo a estudiar y conforme a los protocolos del laboratorio. CR 3.2 El antibiograma se realiza según la técnica disponible en el laboratorio. CR 3.3 Los resultados obtenidos son fiables desde el punto de vista cualitativo y/ o cuantitativo, permitiendo aplicar la terapia antimicrobiana adecuada. RP 4: Aislar e identificar micobacterias con las técnicas adecuadas, utilizando la tecnología disponible. CR 4.1 Se comprueba la correspondencia entre los listados de trabajo y las muestras problema. CR 4.2 Las muestras que lo requieran, se fluidifican y descontaminan correctamente. CR 4.3 Las tinciones bacilo ácido alcohol resistente (BAAR) se realizan adecuadamente y permiten el estudio microscópico de la muestra. CR 4.4 Los cultivos se revisan periódicamente para evidenciar signos de crecimiento. CR 4.5 La identificación se realiza mediante pruebas bioquímicas o sondas de hibridación específicas según los protocolos de trabajo, permitiendo un alto porcentaje de fiabilidad en la identificación. CR 4.6 Se trabaja, en todo momento, en campana de bioseguridad y con estrictas condiciones de seguridad. RP 5: Realizar análisis micológicos utilizando las técnicas adecuadas, en función de la muestra a analizar. CR 5.1 La correspondencia entre los listados de trabajo y las muestras problema se comprueba, siguiendo los protocolos establecidos. CR 5.2 El examen microscópico en fresco se realiza siempre como prueba fundamental en el diagnóstico. CR 5.3 Los medios de cultivo y las condiciones de incubación que se utilizan son los idóneos, en función de la muestra y el hongo a estudiar. CR 5.4 Las pruebas de identificación se seleccionan y realizan, de forma que permiten la identificación del hongo específico. CR 5.5 Las pruebas de sensibilidad antifungica se realizan según la técnica disponible en el laboratorio. Fecha 11/5/2012 10:23:24 Página 14 de 42 Informe INCUAL-Intranet RP 6: Realizar pruebas parasitológicas utilizando las técnicas adecuadas, en función de la muestra a analizar. CR 6.1 La correspondencia entre los listados de trabajo y las muestras problema se comprueba, siguiendo los protocolos establecidos. CR 6.2 Se colabora con el parasitólogo en el examen macroscópico de las muestras que lo requieran. CR 6.3 Las técnicas de concentración de muestras de heces para la observación de huevos y quistes, se realizan según los protocolos de trabajo del laboratorio. CR 6.4 Las extensiones y las tinciones para la observación de parásitos hemáticos y de parásitos en heces se realizan adecuadamente, y permiten el estudio microscópico de la muestra. RP 7: Realizar técnicas de cultivos celulares para el diagnóstico de enfermedades víricas, según los protocolos establecidos. CR 7.1 Las muestras que lo requieran se procesan adecuadamente, antes de la inoculación de los agentes en los cultivos. CR 7.2 Los cultivos se examinan periódicamente, para evidenciar el crecimiento viral y las posibles contaminaciones. CR 7.3 Las condiciones de cultivo: pH, temperatura, nutrientes, etc., se mantienen durante todas las fases del mismo. CR 7.4 Se trabaja, en todo momento, en condiciones de rigurosa esterilidad para evitar contaminaciones. RP 8: Realizar pruebas serológicas manuales y semiautomáticas mediante la técnica más adecuada. CR 8.1 La correspondencia entre los listados de trabajo y las muestras problema se comprueba, siguiendo los protocolos establecidos. CR 8.2 Los sueros problema se diluyen adecuadamente con solución salina, en las técnicas que así lo requieran. CR 8.3 Se elimina la actividad del complemento en los sueros que lo requieran de acuerdo a la técnica a realizar. CR 8.4 Los resultados obtenidos en las técnicas de aglutinación y otras, se interpretan correctamente, de forma visual o con la ayuda de óptica de aumento. CR 8.5 Las distintas preparaciones se observan al microscopio de fluorescencia, efectuando los ajustes de intensidad de luz y la utilización de filtros adecuados, en función de la técnica a realizar. CR 8.6 El resto de técnicas solicitadas: inmunoanálisis, Western Blot, inmunoelectroforesis, fijación del complemento u otras, se realizan según los protocolos establecidos. RP 9: Manejar grandes sistemas automáticos en serología. CR 9.1 Las calibraciones se realizan y se procesan los controles antes de comenzar el trabajo. CR 9.2 El sistema informático del laboratorio está en comunicación con el analizador y transmite las peticiones. CR 9.3 Los listados de trabajo se elaboran, y se preparan los sueros para ser colocados en el analizador. CR 9.4 El correcto funcionamiento del analizador se controla y se solucionan las incidencias. CR 9.5 Los resultados de los controles se comprueban, realizándose las repeticiones de acuerdo a lo descrito en el protocolo de trabajo, y transmitiéndose, a continuación, los resultados al sistema informático de laboratorio. CR 9.6 Se controla el correcto funcionamiento en los equipos modulares, así como la colocación y la retirada de las muestras. CR 9.7 Cualquier incidencia se registra antes, durante y después del proceso. RP 10: Realizar técnicas de amplificación de ácidos nucleicos mediante la reacción en cadena de la polimerasa (PCR), siguiendo los criterios establecidos. CR 10.1 La extracción de ADN de la muestra se realiza según el protocolo establecido. CR 10.2 Las precauciones necesarias se adoptan para evitar la contaminación de las muestras y los reactivos. CR 10.3 El ADN se desnaturaliza para obtener las cadenas separadas. CR 10.4 Al finalizar la reacción en cadena de la polimerasa (PCR) se obtiene suficiente material genético. CR 10.5 Las distintas bandas de ADN se identifican, mediante la utilización de patrones adecuados. CR 10.6 La separación electroforética del material obtenido y su visualización, se realiza mediante el protocolo establecido. Contexto profesional Medios de producción Reactivos químicos y biológicos diversos. Material básico de laboratorio (pipetas, matraces, gradillas, tubos, portaobjetos, cubreobjetos, mecheros u otras). Materiales desechables variados (asas, frascos y tubos de cultivo celulares, pipetas u otras). Pipetas automáticas. Material de seguridad (guantes, mascarillas, batas). Recipientes para recogida de residuos biológicos. Centrífugas. Microcentrífugas. Frigoríficos. Agitadores. Fecha 11/5/2012 10:23:24 Página 15 de 42 Informe INCUAL-Intranet Baños termostáticos. Estufas. Balanzas. pHmetro. Destiladores de agua. Microscopios ópticos. Microscopio de fluorescencia. Microscopio invertido. Turbidímetros. Equipos automáticos de tinción, de identificación, de sensibilidad a antimicrobianos. Equipos para incubación de hemocultivos y micobacterias. Sistemas de incubación en anaerobiosis, CO2 y atmósfera microaerófila. Equipos de electroforesis. Espectrofotómetro. Termociclador. Transiluminador UV. Equipos automáticos para PCR. Nefelómetro. Equipos automáticos para enzimoinmunoanálisis (EIA). Sistemas automáticos para serología. Equipos fotográficos. Campanas de bioseguridad de flujo laminar. Sistemas informáticos de gestión. Libros de registro Productos y resultados Resultados analíticos microbiológicos. Informes de resultados analíticos microbiológicos. Registro de incidencias. Información utilizada o generada Listados de trabajo. Fichas clínicas. Protocolos técnicos. Manuales de manejo de los distintos equipos. Normas para el control de calidad. Normas de Seguridad. Protocolos normalizados de trabajo. Bibliografía especializada de consulta. Fecha 11/5/2012 10:23:24 Página 16 de 42 Informe INCUAL-Intranet UNIDAD DE COMPETENCIA 6 Realizar técnicas inmunológicas de aplicación en las distintas áreas del laboratorio de análisis clínicos. Nivel 3 Código UC0374_3 Realizaciones profesionales y criterios de realización RP 1: Preparar los materiales, los instrumentos, los equipos y las muestras, en función de las técnicas a realizar. CR 1.1 Los materiales, los instrumentos y equipos, se encuentran disponibles y operativos en el momento que se necesitan. CR 1.2 El nivel de los reactivos, de los calibradores, de los controles y de las muestras, se comprueba, así como su ubicación en las bandejas y si se corresponden con el listado de trabajo. CR 1.3 La calibración y los controles diarios de los equipos asignados, se realizan siguiendo los protocolos. CR 1.4 Para cada tipo de muestra y de determinación a realizar, se seleccionan y efectúan, si fuese necesario, las operaciones previas: centrifugación, homogeneización, etc., para su posterior análisis. CR 1.5 Las diluciones en las muestras y reactivos que lo requieran, se realizan en las condiciones definidas en los protocolos de trabajo. CR 1.6 El material empleado no desechable se limpia y ordena, conforme a las normas del laboratorio. RP 2: Realizar diversas técnicas inmunoquímicas para el aislamiento, la caracterización y la cuantificación de proteínas. CR 2.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos. CR 2.2 Las técnicas de inmunoelectroforesis e inmunofijación se realizan, según los criterios establecidos en el laboratorio. CR 2.3 La cromatografía se realiza según el protocolo de trabajo y se comprueba que la separación de las distintas fracciones del cromatograma es correcta para su posterior cuantificación. CR 2.4 La preparación y manejo del nefelómetro se realiza según los protocolos específicos de trabajo. CR 2.5 El Western Blot para caracterización de antígenos o estudio de especificidades de anticuerpos se realiza, según los procedimientos normalizados disponibles. CR 2.6 El resto de técnicas inmunoquímicas disponibles en el servicio, se realizan según protocolos. RP 3: Realizar técnicas de obtención y amplificación de ácidos nucleicos mediante la reacción en cadena de la polimerasa (PCR), siguiendo los protocolos normalizados de trabajo para estudios de patología molecular. CR 3.1 La extracción de ADN de la muestra se realiza según el protocolo establecido. CR 3.2 Las precauciones necesarias se adoptan para evitar la contaminación de muestras y reactivos. CR 3.3 El ADN se desnaturaliza para obtener las cadenas separadas. CR 3.4 Al finalizar la PCR se obtiene suficiente material genético y se analiza según los protocolos. CR 3.5 Las distintas bandas de ADN se identifican mediante la utilización de patrones adecuados. CR 3.6 La separación electroforética del material obtenido y su visualización se realizan mediante el protocolo establecido. RP 4: Realizar técnicas para el diagnóstico de enfermedades autoinmunes. CR 4.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos de trabajo establecidos. CR 4.2 La detección y caracterización de autoanticuerpos no organoespecíficos se realiza con las técnicas y equipos disponibles en el servicio. CR 4.3 La detección y caracterización de autoanticuerpos organoespecíficos se realiza con las técnicas y equipos disponibles en el servicio. RP 5: Realizar técnicas para el diagnóstico de alergias e hipersensibilidad. CR 5.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos de trabajo establecidos. CR 5.2 La detección de inmunoglobulinas específicas frente a diversos alergenos y frente a principios activos de medicamentos, se realiza utilizando las técnicas y los equipos disponibles en el servicio, siguiendo los protocolos establecidos. CR 5.3 Los equipos automáticos están calibrados y los resultados de los controles dentro del rango de los valores asignados. RP 6: Realizar técnicas específicas para el estudio de subpoblaciones linfocitarias. Fecha 11/5/2012 10:23:24 Página 17 de 42 Informe INCUAL-Intranet CR 6.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos fijados. CR 6.2 Los marcadores de membrana a analizar y los anticuerpos monoclonales correspondientes, se eligen según la patología a estudiar. CR 6.3 La incubación con los fluorocromos se realiza en oscuridad y el resto de las fases, antes de introducir la muestra en el citómetro, se realiza según el protocolo de trabajo específico. CR 6.4 La preparación y el manejo del citómetro de flujo se realiza según el protocolo establecido. RP 7: Realizar cultivos celulares para estudios de funcionalidad celular. CR 7.1 El tratamiento y el procesamiento de las muestras se realiza según sus características y en estrictas condiciones asépticas. CR 7.2 Los cultivos se examinan periódicamente durante todo el proceso, controlando el pH, la temperatura, los nutrientes, etc., según los protocolos específicos. CR 7.3 El análisis de la proliferación celular se realiza mediante estimulación con mitógenos y otras técnicas. CR 7.4 Cuando se utilizan técnicas isotópicas se cumple con los requisitos de operador de RIA, y se identifican bien los riesgos y el manejo de las mismas. CR 7.5 La congelación de células para su conservación y almacenamiento, se realiza teniendo en cuenta la viabilidad del cultivo y la fase de crecimiento, usando agentes y técnicas de crioprotección. CR 7.6 Se trabaja, en todo momento, en condiciones de rigurosa esterilidad para evitar contaminaciones. RP 8: Realizar técnicas de determinación de antígenos HLA con diversas aplicaciones en el laboratorio. CR 8.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos. CR 8.2 La técnica a utilizar: serológica, bioquímica, de genotipaje, se elige en función de los equipos disponibles en el servicio, siguiendo escrupulosamente los procedimientos normalizados de trabajo. RP 9: Realizar técnicas de reacciones antígeno-anticuerpo para el diagnóstico microbiológico y hematológico, según las determinaciones solicitadas. CR 9.1 La correspondencia entre los listados de trabajo y las muestras problema, se comprueba según los protocolos. CR 9.2 La actividad del complemento se elimina en los sueros que así lo requieran, según la técnica a realizar. CR 9.3 Las técnicas solicitadas: aglutinación, inmunoensayos, Western Blot, inmunoelectroforesis, inmunofluorescencia u otras., tanto para detectar antígenos como anticuerpos se realizan según los protocolos establecidos. CR 9.4 La determinación manual o automática de todos los grupos sanguíneos solicitados, se realiza según el protocolo establecido por el servicio. CR 9.5 Las técnicas para escrutinio de anticuerpos irregulares y para la detección de antiglobulinas, se realizan en las muestras que se soliciten. CR 9.6 Las pruebas cruzadas se realizan y se verifican por el método de confirmación. RP 10: Manejar grandes sistemas automáticos utilizados en las diversas áreas de laboratorio para detectar antígenos y/o anticuerpos. CR 10.1 Las calibraciones se realizan y se procesan los controles antes de comenzar el trabajo, transmitiendo, a continuación, los resultados al sistema informático del laboratorio. CR 10.2 El sistema informático del laboratorio está en comunicación con el analizador y transmite las peticiones. CR 10.3 Los listados de trabajo se elaboran, preparándose los sueros para ser colocados en el analizador. CR 10.4 El correcto funcionamiento del analizador se controla, solucionándose las incidencias. CR 10.5 En los equipos modulares o analizadores en serie (IPM) se controla el correcto funcionamiento, así como la colocación y retirada de muestras. CR 10.6 Cualquier incidencia se registra antes, durante y después del proceso. Contexto profesional Medios de producción Reactivos químicos y biológicos diversos. Material básico de laboratorio tales como: pipetas, matraces, gradillas, tubos, portaobjetos, cubreobjetos. Pipetas automáticas. Material de seguridad (guantes, mascarillas, batas). Recipientes para recogida de residuos biológicos. Centrífugas. Microcentrífugas. Frigoríficos. Agitadores. Baños termostáticos. Estufas. Balanzas. Microscopios ópticos. Microscopio de fluorescencia. pHmetro. Destiladores de agua. Agitadores rotatorios. Microscopio invertido. Equipos automáticos de inmunoquímica. Equipos de electroforesis. Espectrofotómetro. Termociclador. Transiluminador UV. Equipos automáticos para PCR. Equipos de inmunoblots. Nefelómetro. Equipos automáticos para EIA. Equipos Fecha 11/5/2012 10:23:24 Página 18 de 42 Informe INCUAL-Intranet automáticos de tinción. Campanas de bioseguridad de flujo laminar. Citómetro de flujo. Sistemas informáticos de gestión. Libros de registro. Productos y resultados Resultados analíticos inmunológicos. Informes de resultados analíticos inmunológicos. Resultados analíticos microbiológicos. Informes de resultados analíticos microbiológicos. Resultados analíticos hematológicos. Informes de resultados analíticos hematológicos. Registro de incidencias. Información utilizada o generada Listados de trabajo. Fichas clínicas. Protocolos técnicos. Manuales de manejo de los distintos equipos. Normas para el control de calidad. Normas de Seguridad. Protocolos normalizados de trabajo. Bibliografía especializada de consulta. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 19 de 42 Informe INCUAL-Intranet 1 Análisis bioquímicos en muestras biológicas humanas. 3 MF0371_3 Realizar análisis de bioquímica clínica en muestras biológicas humanas. 240 Capacidades y criterios de evaluación C1: Analizar las técnicas empleadas en el laboratorio de bioquímica para separar, detectar y cuantificar constituyentes de muestras biológicas humanas. CE1.1 Explicar la clasificación de las técnicas empleadas en el laboratorio de bioquímica clínica. CE1.2 Describir las técnicas bioquímicas de separación de moléculas: centrifugación, electroforesis y cromatografía. CE1.3 Identificar las técnicas electroquímicas: métodos potenciométricos y amperometricos y su aplicación en el laboratorio de bioquímica clínica. CE1.4 Citar las técnicas basadas en los métodos de detección de la radiación electromagnética: métodos ópticos de análisis molecular: espectrofotometría de absorción molecular, espectrofluorometría, turbidimetría, nefelometría y fotometría de reflectancia. CE1.5 Citar las técnicas basadas en los métodos de detección de la radiación electromagnética: métodos ópticos de análisis atómico: fotometría de llama, y espectroscopia de absorción atómica. CE1.6 Reconocer las técnicas de inmunoquímica con reactivos sin marcar y marcados. CE1.7 Identificar técnicas de biología molecular en el laboratorio de bioquímica clínica. C2: Describir los materiales, los instrumentos y los equipos habituales del laboratorio de bioquímica. CE2.1 Describir el material auxiliar básico necesario en función de equipos. CE2.2 Indicar los conceptos de calibrador y control, su función y condiciones de uso en el laboratorio de bioquímica. CE2.3 Describir tipos de reactivos, procedimientos de preparación y cantidad necesaria a emplear. CE2.4 Describir los equipos e instrumentos del laboratorio de bioquímica. C3: Analizar los métodos cualitativos y cuantitativos de analitos en solución en muestras biológicas humanas. CE3.1 Definir el concepto de linealidad entre dos parámetros. CE3.2 Explicar la diferencia entre prueba basal y prueba funcional, señalando sus indicaciones y procedimientos de selección. CE3.3 Explicar el concepto de perfil o batería de pruebas enumerando las más significativas. CE3.4 Relacionar los resultados con las posibles patologías que pudieran asociarse. CE3.5 Realizar las gráficas de calibración e interpolación de resultados. C4: Realizar técnicas de bioquímica basadas en métodos de detección de la radiación electromagnética, en la detección de potenciales eléctricos y otros, empleando los equipos y reactivos en función del parámetro a determinar. CE4.1 Explicar los principios físicos de la interacción de la radiación electromagnética con la materia y sus aplicaciones en la cuantificación de analitos. CE4.2 Describir el fenómeno de absorción y de emisión de energía por moléculas en solución, al ser excitadas por la radiación electromagnética. CE4.3 Explicar la Ley de Lambert-Beer y sus aplicaciones en mediciones a punto final, dos puntos y cinéticas. CE4.4 Describir los fundamentos básicos de las técnicas analíticas de osmometría, indicando las aplicaciones en el laboratorio de bioquímica clínica. CE4.5 Explicar los procedimientos de realización de técnicas de amplificación de ácidos nucleicos mediante la reacción en cadena de la polimerasa (PCR), siguiendo los protocolos establecidos y sus aplicaciones. CE4.6 Explicar la ecuación de Nernst en potenciometría analítica y los tipos de electrodos: vidrio y selectivos, indicando sus aplicaciones analíticas. CE4.7 Realizar determinaciones analíticas basadas en la detección de la radiación electromagnética y en la medida de potenciales eléctricos y otras. C5: Realizar en el laboratorio de bioquímica, técnicas de separación de moléculas, empleando los equipos y reactivos en función del parámetro a determinar. CE5.1 Explicar las técnicas de separación de moléculas en función de su carga eléctrica, su punto isoeléctrico, su tamaño, su peso molécular y otros, enumerando sus aplicaciones analíticas. Fecha 11/5/2012 10:23:24 Página 20 de 42 Informe INCUAL-Intranet CE5.2 Seleccionar los equipos y los reactivos en función de la técnica y el parámetro a determinar, identificando los valores de referencia a utilizar. CE5.3 Realizar electroforesis de componentes de una mezcla efectuando la posterior cuantificación de las fracciones resultantes. CE5.4 Realizar separación de moléculas mediante técnicas cromatográficas. CE5.5 Realizar separación de moléculas mediante técnicas de centrifugación. C6: Realizar los métodos de determinación de analitos del metabolismo de los principios inmediatos y de otros componentes metabólicos. CE6.1 Realizar las determinaciones bioquímicas relacionadas con el metabolismo de los hidratos de carbono, y los métodos empleados para su determinación. CE6.2 Realizar las determinaciones bioquímicas relacionadas con el metabolismo de los lípidos y lipoproteínas, y los métodos empleados para su determinación. CE6.3 Realizar las determinaciones bioquímicas relacionadas con el metabolismo de las proteínas y productos finales del metabolismo y los métodos empleados para su determinación. CE6.4 Aplicar los métodos de estudio enzimático. CE6.5 Describir las magnitudes bioquímicas relacionadas con el metabolismo del calcio y fósforo, purinas, y otros componentes metabólicos. C7: Realizar en el laboratorio de bioquímica, el análisis cualitativo y cuantitativo de muestras de orina, así como el estudio del sedimento. CE7.1 Describir las características normales de una muestra de orina, enumerando las determinaciones analíticas. CE7.2 Indicar los equipos y reactivos en función de la técnica y parámetro a determinar, identificando los parámetros de referencia a utilizar. CE7.3 Explicar las características microscópicas del sedimento urinario distinguiendo las patológicas de las no patológicas. CE7.4 Explicar el concepto de aclaramiento y la eliminación de una sustancia a su paso por el riñón. CE7.5 Seleccionar los equipos y los reactivos en función de la técnica y parámetro a determinar, identificando los valores de referencia. CE7.6 Realizar análisis físico-químicos, microscópicos y bioquímicos de muestras de orina. CE7.7 Realizar la determinación de sustancias excretadas en orina de: 8, 12 y 24 horas. CE7.8 Realizar análisis de cálculos urinarios, siguiendo los protocolos establecidos. C8: Analizar los métodos de análisis cualitativo y cuantitativo de otras muestras biológicas humanas. CE8.1 Describir las características de muestras de: heces, semen, liquido cefalorraquídeo (LCR), jugo gástrico, líquidos serosos, amniótico, sinovial y otros. CE8.2 Explicar las técnicas de análisis cualitativo y cuantitativo de las muestras biológicas anteriores. CE8.3 Seleccionar los equipos y reactivos en función de la técnica y parámetro a determinar, identificando los valores de referencia. CE8.4 Realizar análisis bioquímicos de muestras de heces y semen. C9: Analizar el proceso de automatización y los grandes sistemas automáticos. CE9.1 Describir la automatización en las fases preanalítica, analítica y postanalítica. CE9.2 Indicar las ventajas y los inconvenientes de la automatización. CE9.3 Explicar la labor del técnico en el control, manejo y mantenimiento de los equipos modulares. C10: Analizar técnicas inmunológicas de aplicación en el laboratorio de bioquímica, para la determinación de: Marcadores tumorales, hormonas, fármacos, drogas de abuso y otros. CE10.1 Enumerar los principales marcadores y los métodos utilizados para su detección teniendo en cuenta la especificidad y la sensibilidad. CE10.2 Realizar análisis de hormonas en el laboratorio de bioquímica utilizando la técnica, equipos o sistemas automáticos disponibles en el laboratorio. CE10.3 Describir el protocolo y técnica de determinación de: marcadores tumorales, hormonas, fármacos, drogas de abuso y otros en el laboratorio. CE10.4 Realizar análisis de: marcadores tumorales, hormonas, fármacos, drogas de abuso y otros en el laboratorio de bioquímica utilizando la técnica y equipos o sistemas automáticos disponibles en el laboratorio. CE10.5 Explicar los métodos de determinación de anticuerpos no organoespecíficos. CE10.6 Reconocer los patrones de inmunofluorescencia en sueros que contienen anticuerpos antinucleares: ANA y su aplicación en el diagnóstico. CE10.7 Realizar la determinación de anticuerpos organoespecíficos mediante las técnicas disponibles en el laboratorio. Fecha 11/5/2012 10:23:24 Página 21 de 42 Informe INCUAL-Intranet Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C4 respecto a CE 4.7; C5 respecto a CE 5.3, CE 5.4 y CE 5,5; C7 respecto a CE CE7.6, CE7.7 y CE 7.8; C8 respecto a CE 8.4; C9 respecto a CE 9.1, CE9.2 y CE 9.3; C10 respecto a CE 10.2, CE10.4, CE 10.6 y CE 10.7. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Finalizar el trabajo en los plazos establecidos. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Emplear tiempo y esfuerzo en ampliar conocimientos e información complementaria para utilizarlos en su trabajo. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Actuar con rapidez en situaciones problemáticas y no limitarse a esperar. Demostrar flexibilidad para entender los cambios. Demostrar resistencia al estrés, estabilidad de ánimo y control de impulsos. Respetar los procedimientos y normas internas de la empresa. Habituarse al ritmo de trabajo de la empresa. Contenidos Principios generales de bioquímica clínica y control de calidad en el laboratorio de bioquímica. Principios generales de bioquímica clínica: Semiología y valor semiológico de las determinaciones bioquímicas. Sensibilidad diagnóstica, especificidad diagnóstica y prevalencia. Curvas de rendimiento diagnóstico. Teoría de los valores de referencia. Control de calidad en el laboratorio de bioquímica: Control de calidad interno y externo en la fase analítica. Valores de referencia Estadística de laboratorio. Técnicas de separación de moléculas. Centrifugación. Electroforesis y técnicas relacionadas. Cromatografía. Medida de analitos por métodos de detección de la radiación electromagnética. Interacción de la radiación con la materia. Ley de Lambert-Beer. Concepto de linealidad. Tipos de medida: punto final, dos puntos y cinética. Fotometría y espectrofotometría: tipos y utilidades. Espectrofluorometría. Fotometría de llama. Absorción atómica. Turbidimetría y nefelometría. Refractometría de líquidos. Fotometría de reflectancia: química seca. Electroquímica. Medición del pH. Valoraciones ácido-base. Soluciones tampón. Ecuación de Nernst. Métodos potenciometricos y amperometricos. Tipos de electrodos. El electrodo de vidrio para determinación del pH. Electrodos selectivos. Fecha 11/5/2012 10:23:24 Página 22 de 42 Informe INCUAL-Intranet Otras técnicas de análisis. Osmometría. Inmunoanálisis. Técnicas de biología molecular. Amplificación del DNA mediante PCR. Hibridación de ácidos nucleicos. Determinaciones para analizar el metabolismo básico de principios inmediatos: hidratos de carbono, lípidos y proteínas y otros componentes metabólicos. Metabolismo hidrocarbonado. Determinaciones. Patrones de alteración. Metabolismo lipídico y de lipoproteínas. Determinaciones. Patrones de alteración. Metabolismo proteico. Determinaciones. Patrones de alteración proteica. Metabolismo intermediario. Determinaciones. Patrones de alteración de estos metabolitos. Vitaminas. Tipos y aplicaciones. Enzimología diagnóstica. Estudio enzimático: características, fisiología y cinética enzimática. Descripción de enzimas analizados en diagnóstico clínico. Metodología del análisis de enzimas en fluidos biológicos. Patrones de alteración enzimática. Estudio del equilibrio hidroelectrolítico y ácido-base. Fisiopatología del equilibrio hidroelectrolítico (EHE) y del equilibrio ácido-base (EAB). Determinación de iones tales como: Na, K, Cl, Ca, P. Patrones de alteración del EHE. Determinación de pH y gases en sangre arterial. Patrones de alteración de gases en sangre. Evaluación de la función respiratoria. Estudio de: la orina, de otros líquidos corporales y de las heces. Estudio de la orina. Fisiopatología de la orina. Determinación de sustancias eliminadas por orina: cualitativas y cuantitativas (orina de: 8, 12 y 24 horas). Análisis del sedimento urinario. Evaluación de la función renal: urea, creatinina y aclaramientos. Osmolalidad y pruebas funcionales. Estudio bioquímico de otros líquidos corporales. Líquido cefalorraquídeo. Líquido seminal. Líquido sinovial. Líquidos serosos: pleurales, pericárdicos y peritoneales. Estudio de las heces. Características organolépticas de las heces. Determinación de sustancias eliminadas por heces: digestión de principios inmediatos. Síndromes de malabsorción. Técnicas analíticas relacionadas con el estudio de las heces. Estudio de la función: hepática, endocrina y estudios especiales. Estudio de la función hepática. Fisiopatología hepática. Determinaciones analíticas asociadas a la función hepática. Patrones de alteración hepática. Estudio de la función endocrina. Fisiopatología hormonal. Estudio de hormonas. Determinaciones analíticas para el estudio de la función endocrina. Patrones de alteraciones hormonales. Estudios especiales. Monitorización de fármacos terapéuticos. Detección de drogas de abuso. Diagnóstico y seguimiento de neoplasias: marcadores tumorales. Análisis de cálculos urinarios, biliares, salivares y otros. Embarazo y neonatología. Estudio del semen y pruebas de fecundación. Automatización y novedades tecnológicas y metodológicas en el laboratorio de bioquímica clínica. Descripción de grandes sistemas automáticos y su manejo. Tipos y fundamentos de medida. Utilidad y Fecha 11/5/2012 10:23:24 Página 23 de 42 Informe INCUAL-Intranet aplicaciones. Parámetros de contexto de la formación Espacios e instalaciones: Aula polivalente de al menos 2 m² por alumno. Laboratorio de análisis clínicos de 60 m². Laboratorio de microscopía de 60 m². Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de realizar análisis de bioquímica clínica en muestras biológicas humanas, que se acreditará mediante la forma siguiente: Formación académica de Licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 24 de 42 Informe INCUAL-Intranet 2 Hematología, banco de sangre y genética. 3 MF0373_3 Realizar análisis hematológicos y genéticos en muestras biológicas humanas y procedimientos para obtener hemoderivados. 240 Capacidades y criterios de evaluación C1: Realizar, en el laboratorio de hematología, el análisis cuantitativo de la sangre utilizando procedimientos manuales o automáticos. CE1.1 Explicar los parámetros a analizar en relación con la serie eritroide (número de eritrocitos, hemoglobina, hematocrito) y los índices calculados a partir de los mismos. CE1.2 Explicar los elementos formes susceptibles de ser cuantificados y las técnicas más adecuadas para cada uno de ellos, enumerando los rangos de referencia. CE1.3 Describir los equipos y reactivos en función de la técnica y el parámetro a determinar. CE1.4 Realizar recuentos de hematíes en cámara y determinaciones de hemoglobina y hematocrito. C2: Analizar, morfológicamente y cualitativamente, los elementos formes de la sangre y de la médula ósea, por diferentes técnicas. CE2.1 Explicar la hematopoyesis y el funcionalismo leucocitario, eritrocitario y plaquetario. CE2.2 Explicar las tinciones utilizadas para la identificación y estudio de los elementos formes de la sangre. CE2.3 Realizar tinciones con los procedimientos habituales. CE2.4 Diferenciar los leucocitos según clasificaciones funcionales, morfológicas, tintoriales o inmunológicas. CE2.5 Describir marcadores de poblaciones linfocitarias. CE2.6 Analizar las técnicas utilizadas para preparación y tinción de médula ósea. C3: Analizar las técnicas para estudiar la hemostasia mediante comprobación del adecuado funcionamiento del proceso o determinación de sus componentes individuales. CE3.1 Describir las distintas fases de la hemostasia y los métodos para evaluar su función. CE3.2 Describir los mecanismos de la coagulación normal: vía intrínseca, vía extrínseca y los métodos para su evaluación. CE3.3 Describir el mecanismo de fibrinolisis y el control de la misma, así como los métodos para su evaluación. CE3.4 Enumerar y describir los análisis que permiten el control de tratamientos anticoagulantes, en función del tipo y dosis del mismo. CE3.5 Describir los procedimientos automatizados (coagulómetros) en función de la técnica y parámetro a determinar, identificando los rangos de referencia. CE3.6 Realizar técnicas de valoración de hemostasia, empleando métodos y equipos adecuados. C4: Analizar los procedimientos de obtención, de fraccionamiento y de utilización de la sangre en el banco de sangre. CE4.1 Explicar los procedimientos de obtención de sangre a partir de donantes sanos para utilizar con fines terapéuticos. CE4.2 Explicar los componentes sanguíneos que es posible obtener a partir de una unidad de sangre total, relacionándolos con las situaciones en las que van a ser utilizados. CE4.3 Explicar las técnicas de fraccionamiento, manual o automático, de una unidad de sangre en función de los componentes que se deseen obtener. CE4.4 Describir los procedimientos de leucoaféresis o plaquetoaféresis, mencionando sus ventajas e inconvenientes respecto a otros sistemas de fraccionamiento. CE4.5 Explicar los sistemas de conservación, estabilidad y aditivos a añadir de cada uno de los componentes sanguíneos obtenidos por fraccionamiento de una unidad. CE4.6 Enumerar y describir los procedimientos de identificación, control y reconocimiento de los hemoderivados conservados en un banco de sangre. C5: Analizar los procedimientos utilizados en el banco de sangre para garantizar la compatibilidad de los componentes sanguíneos de donante y receptor. CE5.1 Explicar las técnicas de determinación del grupo sanguíneo sérico y eritrocitario del sistema AB0 y del factor Rh. CE5.2 Explicar las técnicas para la determinación de la compatibilidad entre sangre de donante y de receptor. Fecha 11/5/2012 10:23:24 Página 25 de 42 Informe INCUAL-Intranet CE5.3 Enumerar y describir otros sistemas sanguíneos identificando los casos prácticos en los que sea necesario su conocimiento. CE5.4 Realizar determinación de grupo sanguíneo del sistema AB0 y determinación del factor Rh. C6: Analizar las técnicas de extracción y amplificación de ácidos nucleicos (PCR y variantes) y sus aplicaciones en estudios hematológicos y genéticos. CE6.1 Identificar la secuencia de realización de la técnica y los reactivos utilizados. CE6.2 Describir los procesos de obtención de ácidos nucleicos de diferentes muestras biológicas. CE6.3 Esquematizar el proceso de amplificación y los sistemas de detección. CE6.4 Relacionar la extrema importancia de la ausencia de contaminaciones con el correcto desarrollo de la técnica. CE6.5 Enumerar las diversas aplicaciones de la PCR y variantes en estudios hematológicos y genéticos. C7: Analizar los métodos de análisis del cariotipo humano y sus aplicaciones. CE7.1 Describir los puntos clave para un eficaz desarrollo de la técnica. CE7.2 Explicar los distintos tipos de tinciones cromosómicas. CE7.3 Diferenciar las características del cariotipo convencional y de los cariotipos moleculares, pintado de cromosomas (cariotipo multicolor). C8: Analizar las técnicas y los métodos habitualmente utilizados en estudios genéticos. CE8.1 Enumerar los tipos más habituales de técnicas de hibridación "in situ " con fluorescencia (FISH) utilizadas en estudios de citogenética molecular y sus aplicaciones. CE8.2 Describir las técnicas mas frecuentemente utilizadas para la detección de mutaciones y polimorfismos indicando las limitaciones de las mismas y las fases clave para una correcta realización. CE8.3 Analizar la importancia de localizar y describir los cambios en la secuencia del ADN responsables de un cambio fenotípico determinado. C9: Analizar el proceso de automatización y la utilización de grandes equipos automáticos de análisis en los laboratorios de hematología y genética. CE9.1 Identificar la secuencia de pasos básicos necesaria para una correcta utilización de estos sistemas. CE9.2 Reconocer los resultados de los controles detectando las anomalías en los mismos. CE9.3 Describir las diferentes formas de transmisión de resultados. CE9.4 Establecer las bases para una correcta solución de incidencias y el registro de las mismas. CE9.5 Explicar la labor del profesional de laboratorio en control, manejo y mantenimiento de los equipos modulares. C10: Describir el proceso que garantice la calidad de los parámetros analizados en los laboratorios de hematología, genética y banco de sangre. CE10.1 Explicar el concepto de muestra control, control de calidad interno y control de calidad externo. CE10.2 En un supuesto práctico para determinaciones cuantitativas realizar controles de una serie analítica, registrando los resultados y analizándolos. CE10.3 Explicar el proceso de control de calidad analítico en las determinaciones cualitativas. Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C1 respecto a CE1.4.; C2 respecto a CE2.3 y CE2.4; C3 respecto a CE3.6; C4 respecto a CE4.6; C5 respecto a C5.4; C9 respecto a CE9.1, CE9.2, CE9.3, CE9.4 y CE9.5; C10 respecto a CE10.2. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Finalizar el trabajo en los plazos establecidos. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Emplear tiempo y esfuerzo en ampliar conocimientos e información complementaria para utilizarlos en su trabajo. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos. Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Fecha 11/5/2012 10:23:24 Página 26 de 42 Informe INCUAL-Intranet Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Actuar con rapidez en situaciones problemáticas y no limitarse a esperar. Demostrar flexibilidad para entender los cambios. Demostrar resistencia al estrés, estabilidad de ánimo y control de impulsos. Respetar los procedimientos y normas internas de la empresa. Habituarse al ritmo de trabajo de la empresa. Contenidos Laboratorio de hematología, genética y banco de sangre. Instrumentación básica. Laboratorio de hematología, genética y banco de sangre. Características generales. Secciones. Instrumentación básica. Microscopios: fundamentos, propiedades ópticas y elementos. Tipos de microscopía: campo luminoso, campo oscuro, luz ultravioleta, fluorescencia, contraste de fases y de transmisión electrónica. Equipos automáticos en el laboratorio de hematología: contadores hematológicos, citómetro flujo, coagulómetro y otros. Composición y funciones de la sangre. Origen y formación de las células sanguíneas: hematopoyesis. Características morfológicas de las células sanguíneas. Fisiopatología de la serie eritrocitaria. Recuento de hematíes. Metabolismo del hierro y de la hemoglobina. Valor hematocrito e índices eritrocitarios. Trastornos cuantitativos y cualitativos del sistema eritrocitario: anemias, alteraciones morfológicas, trastornos de membrana. Alteraciones inmunológicas del sistema eritrocitario: anemias hemolíticas. Pruebas analíticas para el diagnóstico y seguimiento de los trastornos eritrocitario. Fisiopatología de la serie leucocitaria. Recuento de leucocitos. Diferenciación de las distintas líneas de la serie leucocitaria. Técnicas histoquímicas e inmunológicas para identificación leucocitaria. Trastornos de la serie leucocitaria. Leucemias. Pruebas para el diagnóstico y seguimiento de trastornos leucocitarios. Fisiopatología de las plaquetas. Recuento de plaquetas. Alteraciones morfológicas. Alteraciones funcionales de las plaquetas. Pruebas analíticas para el diagnóstico y seguimiento de los trastornos del sistema plaquetario. Fisiopatología de la hemostasia. Estudio de hemostasia primaria, proceso de la coagulación y fibrinolisis. Alteraciones de la coagulación. Alteraciones de la fibrinolisis. Pruebas analíticas para el diagnóstico y seguimiento de los trastornos de la hemostasia. Control tratamiento anticoagulantes orales. Inmunohematología. Estudio de los grupos sanguíneos humanos y su identificación: sistema AB0, sistema Rh, otros antígenos y anticuerpos eritrocitarios. Técnicas de determinación. Fecha 11/5/2012 10:23:24 Página 27 de 42 Informe INCUAL-Intranet Banco de sangre. Organización y función. Concepto de unidad de sangre y fases en el proceso de obtención. Procedimientos y técnicas empleadas en el banco de sangre: Preparación y selección de componentes y derivados sanguíneos. Técnicas de conservación sangre. Dispensación de sangre y hemoderivados. Pruebas pretransfusionales, tipificación AB0/Rh, detección de anticuerpos. Determinación de anticuerpos inesperados. Reacción transfusionales. Conceptos básicos de Genética. Estructura del material genético. Estructura del cromosoma. Mutaciones y polimorfismos. Cariotipo humano. Alteraciones cromosómicas: Numéricas (aneuploidias, poliploidias). Estructurales (delecciones, duplicaciones, inversiones, etc.). Estudios genéticos. Aplicaciones de los estudios genéticos en el diagnóstico y prevención de enfermedades. Aplicaciones de los estudios genéticos en el diagnóstico prenatal, estudios de esterilidad e infertilidad, pruebas de paternidad y medicina legal y forense. Técnicas para el estudio de cromosomas humanos. Técnicas de Biología molecular utilizadas en los estudios genéticos. Automatización, novedades tecnológicas, metodológicas y control de calidad en el laboratorio de hematología, genética y banco de sangre. Automatización. Descripción de grandes sistemas automáticos y su manejo. Utilidad y aplicaciones. Control de Calidad. Control de calidad de la fase analítica. Control interno y control externo. Parámetros de contexto de la formación Espacios e instalaciones: Aula polivalente de al menos 2 m² por alumno. Laboratorio de análisis clínicos de 60 m². Laboratorio de microscopía de 60 m². Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de realizar análisis hematológicos de muestras biológicas humanas y procedimientos para obtener hemoderivados, que se acreditará mediante la forma siguiente: Formación académica de licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 28 de 42 Informe INCUAL-Intranet 3 Gestión de una unidad de un laboratorio de análisis clínicos. 3 MF0369_3 Gestionar una unidad de un laboratorio de análisis clínicos. 30 Capacidades y criterios de evaluación C1: Analizar la estructura organizativa del sector sanitario y de su ámbito concreto de trabajo. CE1.1 Definir los rasgos fundamentales del sistema sanitario en España señalando las particularidades del sistema público y privado de asistencia. CE1.2 Describir las características del laboratorio de análisis clínicos en el sistema sanitario, analizando sus funciones y dependencias. CE1.3 Analizar las analogías y diferencias entre los laboratorios de análisis clínicos de la red pública y privada. CE1.4 Analizar las funciones y competencias de este profesional sanitario en las diferentes secciones del Laboratorio. C2: Diferenciar los tipos de documentación utilizada en un laboratorio de análisis clínicos. CE2.1 Explicar el significado y estructura de una historia clínica tipo, describiendo la secuencia lógica para guardar documentos y pruebas diagnósticas. CE2.2 Interpretar documentos de citación señalando el procedimiento adecuado para realizarla, en función de los diferentes tipos de servicios o unidades de diagnóstico. CE2.3 Describir los documentos utilizados en el laboratorio de análisis clínicos para realizar operaciones de compra y facturación de servicios. CE2.4 Especificar los documentos y los códigos utilizados para realizar el registro de documentos sanitarios, precisando los mecanismos de circulación de la documentación en las instituciones sanitarias. CE2.5 Interpretar las instrucciones del funcionamiento y mantenimiento de aparatos, así como de la realización de técnicas. CE2.6 Analizar publicaciones científicas, seleccionando lo más relevante, para adaptarse a las innovaciones científicas y tecnológicas del sector. CE2.7 Interpretar la legislación vigente en materia de protección de datos, de derechos y obligaciones en materia de información y de documentación clínica. C3: Manejar aplicaciones informáticas relacionadas con la gestión de un laboratorio de análisis clínicos. CE3.1 Describir las diferentes utilidades de los sistemas informáticos de gestión de laboratorio, identificando y determinando las características de cada área o unidad. CE3.2 Describir los datos del paciente o usuario, que son necesarios introducir en la base de datos del sistema informático de laboratorio. CE3.3 Utilizar aplicaciones informáticas de gestión en el laboratorio. CE3.4 Habituarse al ritmo de trabajo del servicio cumpliendo los objetivos de rendimiento diario definidos. C4: Explicar las diferentes técnicas de almacenamiento, distribución y control de existencias en un laboratorio de análisis clínicos. CE4.1 Explicar los métodos y condiciones de almacenamiento y conservación de productos y materiales de laboratorio en función del tipo y características del material. CE4.2 Explicar los métodos de control de existencias y de la realización del inventario de materiales. CE4.3 Describir los procedimientos generales de distribución de material a las distintas áreas de trabajo. CE4.4 Realizar un informe de inventario de existencias, identificando las necesidades de reposición, emisión de órdenes de pedido, condiciones de distribución, conservación y almacenamiento C5: Confeccionar listas de pedidos y facturas, en función de las necesidades del laboratorio. CE5.1 Efectuar las órdenes de pedido, en función de las necesidades del laboratorio. CE5.2 Determinar los datos mínimos que debe contener una factura. CE5.3 Realizar los cálculos necesarios para determinar el importe total y el desglose correcto, cumpliendo las normas fiscales vigentes. CE5.4 Confeccionar adecuadamente la factura, incluyendo todos los requisitos legales. C6: Analizar la normativa vigente sobre seguridad, higiene y prevención de riesgos, de aplicación en su ámbito profesional. CE6.1 Describir los factores y situaciones de riesgo para la salud y la seguridad en las áreas de trabajo. Fecha 11/5/2012 10:23:24 Página 29 de 42 Informe INCUAL-Intranet CE6.2 Relacionar las medidas preventivas utilizadas en el laboratorio, con los medios de prevención establecidos por la normativa. CE6.3 Describir las normas sobre simbología, situación física de señales, alarmas, equipos contra incendios, y equipos de primeros auxilios. C7: Analizar el proceso de atención al paciente o usuario y colaborar con los compañeros en la realización de procedimientos y aplicación de normas internas del servicio, mostrando en todo momento una actitud de respeto hacia pacientes y compañeros. CE7.1 Explicar el proceso de atención y prestación del servicio relacionando las fases y operaciones con los recursos humanos y materiales necesarios. CE7.2 Identificar los factores que determinan la calidad de la atención y prestación del servicio. CE7.3 Explicar el proceso de preparación del paciente o usuario para la prestación del servicio. CE7.4 Mostrar en todo momento una actitud de respeto hacia los pacientes, compañeros, procedimientos y normas internas de la empresa. C8: Planificar el programa de garantía de calidad para la realización de las pruebas analíticas. CE8.1 Identificar los protocolos de trabajo para la realización de las pruebas analíticas. CE8.2 Identificar los factores que determinan la calidad del proceso analítico. CE8.3 Describir los recursos humanos y materiales destinados a garantizar la calidad del proceso analítico CE8.4 Identificar las desviaciones del proceso analítico y la forma de solucionarlas. CE8.5 Organizar y ejecutar la intervención de acuerdo a las instrucciones recibidas, con criterios de calidad y seguridad, aplicando los procedimientos específicos de la empresa. CE8.6 Evaluar la calidad del laboratorio en función de los datos suministrados por el control de calidad externo. Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C2 respecto a CE2.2, CE2.4 y CE2.5; C3 respecto a CE3.1, CE3.3 y CE3.4; C5 respecto a CE 5.1; CE 5.3 y CE 5.4; C7 respecto a CE 7.4; C8 respecto a CE 8.4, CE 8.5 y CE 8.6. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Proponer alternativas con el objetivo de mejorar resultados. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos Demostrar interés por el conocimiento amplio de la organización y sus procesos. Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Adaptarse a situaciones o contextos nuevos. Respetar los procedimientos y normas internas. Habituarse al ritmo de trabajo de la empresa. Contenidos Organización sanitaria. Estructura del sistema sanitario público y privado en España. Salud pública y comunitaria. Indicadores de salud. El laboratorio de análisis clínico en el sistema sanitario y funciones de este profesional en el laboratorio. Conceptos fundamentales de economía sanitaria y calidad en la prestación del servicio del laboratorio de análisis clínicos. Legislación vigente aplicada al ámbito de esta actividad. Seguridad, higiene y prevención de riesgos en el laboratorio de análisis clínicos. Fecha 11/5/2012 10:23:24 Página 30 de 42 Informe INCUAL-Intranet Normativa legal vigente en materia de seguridad e higiene en el trabajo. Riesgos físicos, químicos y biológicos en el desempeño de la actividad profesional. Medidas de prevención y protección en las diferentes áreas de trabajo. Señalización relativa a seguridad e higiene. Equipos de protección y seguridad. Eliminación de los residuos biológicos en el laboratorio clínico. Actuación de emergencia ante un accidente biológico. Gestión del laboratorio de análisis clínicos. Gestión de existencias. Inventarios. Almacén sanitario. Productos sanitarios. Equipos. Gestión de compras. Hoja de pedido. Albarán. Factura. Obligaciones tributarias. Proceso de prestación del servicio. Atención al paciente o usuario en la prestación del servicio: Técnicas de comunicación y atención al paciente. Normativa vigente relativa a la atención del paciente. Documentación clínica y no clínica. Tipos de documentos, utilidades, aplicaciones y criterios de cumplimentación. Procedimientos de tramitación y circulación de documentos. Modelos de historias clínicas de pacientes. Recomendaciones contenidas en la legislación vigente en materia de documentación y protección de datos. Libros y documentos administrativos. Medios informáticos. Equipos informáticos. Sistema informático de gestión de un laboratorio de análisis clínico. Redes informáticas. Internet y sus aplicaciones. Requerimientos de protección de datos. Garantía de calidad en el laboratorio de análisis clínico. Garantía de calidad y planificación del control de calidad. Control de calidad interno y externo. Evaluación de la calidad en el laboratorio. Legislación vigente aplicable a la garantía de calidad. Parámetros de contexto de la formación Espacios e instalaciones: Aula de gestión de 45 m². Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de gestionar una unidad de un laboratorio de análisis clínicos, que se acreditará mediante la forma siguiente: Formación académica de licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 31 de 42 Informe INCUAL-Intranet 4 Fases preanalítica y postanalítica clínicas. 3 MF0370_3 Realizar los procedimientos de las fases preanalítica y postanalítica en el laboratorio clínico. 120 Capacidades y criterios de evaluación C1: Identificar el proceso de análisis de muestras biológicas humanas. CE1.1 Describir las fases implicadas en el análisis de muestras biológicas humanas. CE1.2 Enumerar los distintos tipos de muestras biológicas en los que es posible efectuar determinaciones analíticas. CE1.3 Citar los estudios (hematológicos, bioquímicos, microbiológicos, genéticos, inmunológicos) que pueden realizarse a partir de una muestra biológica humana. C2: Analizar el proceso de recepción y de distribución de muestras biológicas humanas. CE2.1 Justificar las normas de calidad y las características de las muestras para que puedan ser procesadas adecuadamente. CE2.2 Relacionar cada muestra con el recipiente donde debe ser recogida, así como con los aditivos necesarios para su correcto procesamiento, en función de los parámetros a determinar. CE2.3 Describir los métodos de identificación (numérico, barras y colores) de pacientes y muestras. CE2.4 Establecer los criterios de exclusión y de rechazo de las muestras recibidas. C3: Identificar las técnicas de obtención de muestras no sanguíneas en función de las características del paciente o usuario y de las determinaciones analíticas solicitadas. CE3.1 Enumerar e identificar el instrumental utilizado en la toma de muestras. CE3.2 Describir los criterios de calidad en la toma de muestras, para asegurar un correcto procesamiento de las mismas. CE3.3 Explicar los procedimientos para la obtención de distintas muestras que pueden ser recogidas directamente por el paciente o usuario (orina, heces, esputo y semen), especificando, de forma clara y concisa, el procedimiento y el recipiente de transporte. CE3.4 Distinguir los métodos para la obtención de muestras que deben ser realizados por el personal del laboratorio tales como exudados, frotis, heridas, identificando el procedimiento y el recipiente de transporte. CE3.5 Describir los criterios para manipular y procesar las muestras obtenidas por procedimientos invasivos o quirúrgicos tales como: líquido cefalorraquídeo ( LCR), abscesos, líquidos peritoneales. CE3.6 Precisar los criterios de asepsia local y de tratamiento farmacológico a tener en cuenta en la toma de muestras, sobre todo para estudios microbiológicos y parasitarios. C4: Analizar las técnicas de toma de muestras sanguíneas en función de las características del paciente o usuario y de las determinaciones analíticas solicitadas. CE4.1 Enumerar las localizaciones anatómicas donde sea posible efectuar una toma de muestra sanguínea. CE4.2 Explicar las diferentes técnicas de toma de muestras sanguíneas, describiendo sus posibilidades de utilización, ventajas e inconvenientes. CE4.3 Enumerar y relacionar el material de toma de muestras con las diferentes técnicas utilizadas. CE4.4 Establecer la utilización de anticoagulantes y aditivos, en función de la determinación analítica solicitada y de las características de cada uno de ellos. CE4.5 Realizar en un modelo anatómico el proceso de extracción de muestras sanguíneas. C5: Ejecutar las operaciones de preparación de reactivos y muestras para su posterior análisis. CE5.1 Explicar la finalidad, los fundamentos, los equipos y parámetros de control, de las operaciones físico-químicas utilizadas en la preparación de muestras (homogeneización, centrifugación, filtrado y pesaje). CE5.2 Explicar el fundamento y el procedimiento de realización de disoluciones. CE5.3 Realizar disoluciones y diluciones correctamente en el laboratorio. CE5.4 Centrifugar en el laboratorio muestras de sangre y de orina para obtener sus diferentes fracciones. C6: Analizar los procesos que aseguren la calidad y la estabilidad de las muestras biológicas humanas. CE6.1 Identificar la estabilidad de las muestras obtenidas, relacionándola con las características de conservación y el tiempo de demora en la realización del análisis. Fecha 11/5/2012 10:23:24 Página 32 de 42 Informe INCUAL-Intranet CE6.2 Explicar las condiciones de preparación, de transporte y de conservación de las muestras en la fase preanalítica, en función del tipo de muestra, de la distancia, del tiempo estimado de trayecto, de las condiciones climatológicas y de la demora estimada para la realización del análisis. CE6.3 Relacionar tiempos y condiciones de conservación de las muestras hasta su eliminación con el tipo de muestra y la determinación solicitada. Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C2 respecto a CE2.2, CE 2.3 y CE 2.4; C3 respecto a CE 3.1 y CE 3.3., CE 3.4; C4 respecto a CE 4.4.y CE 4.5; C6 respecto a CE 6.2 y CE 6.3. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Proponer alternativas con el objetivo de mejorar resultados. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos Demostrar cordialidad, amabilidad y actitud conciliadora y sensible a los demás. Tratar al paciente con cortesía, respeto y discreción Demostrar interés y preocupación por atender satisfactoriamente las necesidades de los pacientes Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Actuar con rapidez en situaciones problemáticas y no limitarse a esperar. Demostrar resistencia al estrés, estabilidad de ánimo y control de impulsos. Respetar los procedimientos y normas internas de la empresa. Habituarse al ritmo de trabajo de la empresa. Contenidos Materiales, equipos básicos, y técnicas básicas utilizadas en un laboratorio de análisis clínicos en la fase preanalítica. Materiales y equipos básicos. Equipos básicos de laboratorio. Reactivos químicos y biológicos. Material volumétrico. Material de seguridad. Limpieza del material. Tipos de materiales. Técnicas básicas. Medidas de masa y volumen. Preparación de disoluciones y diluciones. Modo de expresar la concentración. Filtración. Centrifugación. Muestras biológicas humanas: manipulación, procesamiento, conservación y transporte de las mismas. Tipos de muestras. Sustancias analizables. Análisis cualitativo y cuantitativo. Determinación analítica. Perfil analítico. Batería de pruebas. Errores más comunes en la manipulación. Prevención en la manipulación de la muestra. Características generales del procesamiento de muestras en función de las mismas. Requisitos mínimos para el procesamiento de la muestra. Conservación y transporte de las muestras. Normativas en vigor del transporte de muestras. Muestras de sanguíneas. Características generales de la sangre. Anatomía vascular. Tipos de muestras sanguíneas: Venosa, arterial y capilar. Recomendaciones preanalíticas. Técnicas de extracción sanguínea. Anticoagulantes. Obtención Fecha 11/5/2012 10:23:24 Página 33 de 42 Informe INCUAL-Intranet de una muestra de sangre para estudio: citológico, de coagulación, serológico, bioquímico y microbiológico. Prevención de errores y manejo de las complicaciones más comunes en la extracción de una muestra de sangre. Sustancias o elementos analizables a partir de una muestra sanguínea. Muestras de orina. Anatomía y fisiología del sistema genitourinario. Características generales de la orina. Obtención de una muestra de orina para estudio: Rutinario, cuantificación de sustancias o elementos formes y microbiológico. Prevención de errores más comunes en la manipulación de una muestra de orina. Sustancias o elementos formes analizables en una muestra de orina. Otras muestras: fecales y seminales. Anatomía y fisiología del sistema gastrointestinal. Características generales de las heces. Obtención de una muestra de heces para estudio: Rutinario, cuantificación de sustancias o elementos formes y microbiológico. Prevención de errores más comunes en la manipulación de una muestra de heces. Sustancias o elementos formes analizables en una muestra de heces. Anatomía y fisiología del sistema reproductor. Características generales del semen. Obtención de una muestra de semen para estudio: Rutinario, cuantificación de sustancias o elementos formes y microbiológico. Prevención de errores más comunes en la manipulación de una muestra de semen. Sustancias o elementos formes analizables en una muestra de semen. Muestras que no pueden ser recogidas directamente por el paciente y muestras obtenidas mediante procedimientos invasivos o quirúrgicos. Muestras de tracto respiratorio inferior: TRI. Recuerdo de anatomía y fisiología del aparato respiratorio. Características generales de las muestras del T.R.I. Obtención de una muestra del tracto respiratorio inferior para estudio microbiológico. Prevención de errores más comunes en la manipulación de una muestra del T.R.I. Sustancias o elementos formes analizables en una muestra del T.R.I. Exudados para análisis microbiológico-parasitológico: Exudados del tracto respiratorio superior: T.R.S. faríngeos, nasofaríngeos y nasales. Exudados conjuntivales. Exudados óticos: oído externo y oído medio. Exudados genitales: uretrales, vaginales, endocervicales y balanoprepuciales. Muestras cutáneas para el estudio de micosis: Piel, pelo y uñas. Muestras obtenidas mediante procedimientos invasivos o quirúrgicos. Líquido cefalorraquídeo (LCR); abscesos, jugo gástrico, líquido ascítico, líquido articular, etc. Características generales de las muestras citadas. Prevención de errores más comunes en la manipulación de las muestras. Sustancias analizables a partir de cada muestra. Parámetros de contexto de la formación Espacios e instalaciones: Aula polivalente de al menos 2 m² por alumno. Laboratorio de análisis clínicos de 60 m². Laboratorio de microscopía de 60 m². Fecha 11/5/2012 10:23:24 Página 34 de 42 Informe INCUAL-Intranet Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de realizar los procedimientos de las fases preanalítica y postanalítica en el laboratorio clínico, que se acreditará mediante la forma siguiente: Formación académica de licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 35 de 42 Informe INCUAL-Intranet 5 Análisis microbiológicos e identificaciones parasitológicas en muestras biológicas humanas. 3 MF0372_3 Realizar análisis microbiológicos e identificar parásitos en muestras biológicas humanas. 240 Capacidades y criterios de evaluación C1: Analizar los conceptos de desinfección y de esterilización y su relación con los procedimientos realizados en el laboratorio de microbiología. CE1.1 Definir los diferentes tipos y sistemas de esterilización. CE1.2 Manejar correctamente en el laboratorio los aparatos disponibles: autoclave, horno para esterilizar el material. CE1.3 Identificar las normas de seguridad que deben aplicarse durante la manipulación de muestras biológicas: Establecer los requisitos para trabajar en un ambiente estéril. Manipular en condiciones adecuadas el material biológico objeto de estudio. Utilizar y conservar correctamente las cabinas de seguridad biológicas. CE1.4 Definir los diferentes tipos de residuos y el procedimiento de eliminación de cada uno de ellos. C2: Describir los diferentes grupos de microorganismos susceptibles de ser recuperados a partir de muestras biológicas humanas. CE2.1 Explicar las características diferenciales de bacterias, hongos, parásitos y virus, relacionándolo con los procedimientos utilizados en el laboratorio para su aislamiento e identificación. CE2.2 Diferenciar las características morfológicas, culturales, tintoriales, bioquímicas y de sensibilidad, de cada una de las especies más importantes de los grupos susceptibles de ser recuperados, a partir de muestras biológicas humanas. C3: Explicar las técnicas de aislamiento, de identificación y de recuento de microorganismos, utilizadas en el laboratorio de microbiología. CE3.1 Especificar las técnicas de observación microscópica utilizadas habitualmente en un laboratorio de microbiología: examen en fresco, tinción de Gram, tinción de Ziehl e inmunofluorescencia directa. CE3.2 Describir los medios de cultivo o técnicas de recuperación más apropiadas para cada muestra o microorganismo objeto de estudio, identificando las condiciones físico-químicas de incubación que aseguren el óptimo aislamiento de los mismos. CE3.3 Reconocer las técnicas de inoculación, siembra y aislamiento de bacterias, hongos y levaduras relacionándolas con el tipo de muestra y microorganismo a aislar. CE3.4 Explicar los procedimientos de identificación y recuento de microorganismos en función del tipo de microorganismo aislado, describiendo las características morfológicas típicas de las unidades formadoras de colonias (UFC). CE3.5 Identificar las diferentes pruebas de sensibilidad a antimicrobianos o antifúngicos indicando las baterías de antimicrobianos y antifungicos más apropiadas para cada grupo de microorganismos. CE3.6 Describir las técnicas utilizadas mas frecuentemente en el diagnóstico parasitológico. C4: Realizar, en el laboratorio de microbiología, técnicas de aislamiento, de identificación y de recuento de microorganismos, empleando los reactivos y equipos disponibles en función del parámetro a determinar. CE4.1 Realizar técnicas de observación microscópica. CE4.2 Aplicar técnicas de inoculación, siembra e incubación de microorganismos. CE4.3 Realizar el aislamiento y posterior recuento de colonias (UFC). CE4.4 Identificar los microorganismos. CE4.5 Realizar antibiogramas de difusión y dilución y antifungigramas. CE4.6 Planificar un esquema básico de procesamiento de una muestra de orina para análisis bacteriológico. C5: Analizar las técnicas de cultivos celulares utilizadas en el diagnóstico de las enfermedades víricas. CE5.1 Describir los materiales y reactivos utilizados. CE5.2 Detallar los tipos de líneas celulares utilizadas mas frecuentemente. CE5.3 Diferenciar las distintas fases del proceso. CE5.4 Explicar el concepto de efecto citopático y describir los tipos más habituales. CE5.5 Indicar la forma de identificar el crecimiento viral en ausencia de efecto citopático: Hemadsorción, neutralización u otras. C6: Analizar los métodos serológicos utilizados en el diagnóstico y el seguimiento de las enfermedades Fecha 11/5/2012 10:23:24 Página 36 de 42 Informe INCUAL-Intranet infecciosas. CE6.1 Establecer los criterios de infección aguda, crónica o en evolución para una determinada enfermedad infecciosa, relacionándolos con los métodos serológicos de identificación. CE6.2 Explicar el fundamento de las técnicas basadas en reacciones antígeno-anticuerpo para el estudio cuantitativo o cualitativo de anticuerpos específicos: técnicas de precipitación, aglutinación, inmunoensayos, Western Blot etc. CE6.3 Describir los equipos y reactivos en función de la técnica y parámetro a determinar, identificando los rangos de referencia a utilizar CE6.4 Realizar, en el laboratorio, los métodos serológicos manuales o semiautomatizados utilizados en el diagnóstico de enfermedades infecciosas. CE6.5 En casos prácticos de detección de antígenos o anticuerpos: Realizar técnicas de IFI y observar las preparaciones en el microscopio de fluorescencia. Realizar pruebas de aglutinación en porta. Realizar técnicas de EIA en tubo y microplaca. C7: Analizar las técnicas de extracción y amplificación de ácidos nucleicos (PCR) utilizadas en el diagnóstico de enfermedades infecciosas. CE7.1 Identificar la secuencia de realización de la técnica y los reactivos utilizados. CE7.2 Describir los procesos de obtención de ácidos nucleicos de diferentes muestras biológicas. CE7.3 Esquematizar el proceso de amplificación y los sistemas de detección. CE7.4 Relacionar la extrema importancia de la ausencia de contaminaciones con el correcto desarrollo de la técnica. CE7.5 Describir la utilidad para detectar agentes infecciosos que están en pequeña concentración o afectan a un número muy reducido de células. CE7.6 Enumerar la utilidad para detectar agentes patógenos que no pueden cultivarse por diversas causas. C8: Analizar el proceso de automatización y la utilización de grandes equipos automáticos de análisis en el laboratorio de serología. CE8.1 Identificar la secuencia de pasos básicos necesaria para una correcta utilización de estos sistemas. CE8.2 Reconocer los resultados de los controles detectando las anomalías en los mismos. CE8.3 Describir las diferentes formas de transmisión de resultados. CE8.4 Establecer las bases para una correcta solución de incidencias y el registro de las mismas. CE8.5 Explicar las funciones del profesional del laboratorio en el control, manejo y mantenimiento de los equipos modulares. C9: Describir el proceso que garantice la calidad de los parámetros analizados en los diversos análisis microbiológicos. CE9.1 Explicar el concepto de cepa control, control de calidad interno y control de calidad externo. CE9.2 En un supuesto práctico de determinaciones cuantitativas: realizar controles de una serie analítica, registrando los resultados y analizándolos. CE9.3 Explicar el proceso de control de calidad analítico en las determinaciones cualitativas. Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C1 respecto a CE 1.3 y CE 3.4; C4 respecto a CE 4.1, CE4.2, CE 4.3, CE 4.4, CE4.5 y CE 4.6; C5 respecto a CE5.3; C6 respecto a CE 6.1, CE6.2 y CE6.5; C9 respecto a CE9.2. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Finalizar el trabajo en los plazos establecidos. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Emplear tiempo y esfuerzo en ampliar conocimientos e información complementaria para utilizarlos en su trabajo. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Fecha 11/5/2012 10:23:24 Página 37 de 42 Informe INCUAL-Intranet Actuar con rapidez en situaciones problemáticas y no limitarse a esperar. Demostrar flexibilidad para entender los cambios. Demostrar resistencia al estrés, estabilidad de ánimo y control de impulsos. Respetar los procedimientos y normas internas de la empresa. Habituarse al ritmo de trabajo de la empresa. Contenidos El Laboratorio de microbiología. Control de calidad. Automatización y novedades tecnológicas y metodológicas en el laboratorio de microbiología. Características generales. Secciones. Materiales, aparatos y procedimientos específicos del laboratorio de microbiología. Tipos y sistemas de esterilización. Tipos de residuos y su eliminación. Normas de seguridad en el laboratorio de microbiología. Control de calidad en el laboratorio de microbiología. Control de la fase analítica: Cepas control: controles interno y externo. Descripción de grandes sistemas automáticos y su manejo. Utilidad y aplicaciones. Microbiología clínica. Fundamentos. Flora habitual de la especie humana. Principales microorganismos implicados en procesos infecciosos humanos. Protocolos de trabajo según el tipo de muestra: tracto urinario, tracto genital, tracto intestinal, tracto respiratorio, fluidos estériles y de secreciones contaminadas. Toma, transporte y procesamiento de muestras para análisis bacteriológico. Bacterias implicadas en procesos infecciosos humanos. Cocos gram positivos y gram negativos. Bacilos gram positivos y gram negativos. Micobacterias. Anaerobios. Otras bacterias. Medios de cultivo y técnicas de siembra para análisis bacteriológico. Medios de cultivo para crecimiento y aislamiento primario de bacterias. Características del crecimiento de microorganismos. Características y clasificación de los medios de cultivo. Descripción de los medios de cultivo más habituales. Preparación de medios de cultivo. Técnicas de siembra para análisis bacteriológico. Técnicas de inoculación. Técnicas de aislamiento. Recuentos celulares bacterianos. Observación de microorganismos. Técnicas de observación en fresco. Observación de preparaciones teñidas. Tipos de tinciones: simples, diferenciales y estructurales. Descripción de las tinciones más habituales. Identificación de bacterias de interés clínico y pruebas de sensibilidad antimicrobiana. Identificación de bacterias de interés clínico. Pruebas de identificación. Sistemas comerciales y automatizados. Técnicas de biología molecular. Pruebas de susceptibilidad antimicrobiana. Clasificación de las sustancias antimicrobianas. Técnicas de realización de las pruebas de susceptibilidad antimicrobiana. Conceptos relacionados: sensibilidad, resistencia, concentración mínima inhibitoria (CMI), concentración mínima bactericida (CMB). Interpretación de los antibiogramas. Fecha 11/5/2012 10:23:24 Página 38 de 42 Informe INCUAL-Intranet Hongos implicados en procesos infecciosos humanos. Toma y transporte de muestras. Características generales. Clasificación. Diagnóstico de laboratorio: examen directo, cultivo, identificación y antifungigrama. Protozoos y helmintos. Toma y transporte de muestras. Características generales. Clasificación. Diagnóstico de laboratorio: observación, concentración, tinciones cultivo e identificación. Virus. Toma y transporte de muestras. Características generales. Clasificación. Técnicas de cultivo celular y aislamiento viral: Medios de cultivo. Líneas celulares. Técnicas. Observación de cultivos. Detección de proliferación viral. Diagnóstico de laboratorio (inmunológico, molecular, etc.). Diagnóstico serológico y mediante técnicas de biología molecular, de las enfermedades infecciosas. Técnicas de análisis basadas en las reacciones antígeno-anticuerpo. Aglutinación. Precipitación. Técnicas de fijación de complemento. Inmunoanálisis: radioinmunoanálisis, enzimoinmunoanálisis y fluoroinmunoanálisis. Inmunofluorescencia. Western Blott. Otras técnicas. Técnicas de biología molecular. Técnicas de extracción y amplificación de ácidos nucleicos. (PCR) RT-PCR. Otras técnicas. Parámetros de contexto de la formación Espacios e instalaciones: Aula polivalente de al menos 2 m² por alumno. Laboratorio de análisis clínicos de 60 m². Laboratorio de microscopía de 60 m². Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de realizar análisis microbiológicos e identificar parásitos en muestras biológicas humanas, que se acreditará mediante la forma siguiente: Formación académica de licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes. MÓDULO FORMATIVO Nivel Código Asociado a la UC Duración horas Fecha 11/5/2012 10:23:24 Página 39 de 42 Informe INCUAL-Intranet 6 Inmunología clínica aplicada. 3 MF0374_3 Realizar técnicas inmunológicas de aplicación en las distintas áreas del laboratorio de análisis clínicos. 120 Capacidades y criterios de evaluación C1: Analizar el origen, las características y los mecanismos de respuesta del sistema inmunitario. CE1.1 Describir las características del sistema inmunitario y los mecanismos y tipos de respuesta inmunológica. CE1.2 Definir antígeno, anticuerpo, inmunidad celular e inmunidad humoral. CE1.3 Identificar la reacción antígeno-anticuerpo y las analogías y diferencias entre lo que sucede "in vivo" y las reacciones "in vitro". C2: Describir las técnicas inmunoquímicas que se realizan en el laboratorio para aislar, caracterizar y cuantificar proteínas. CE2.1 Analizar las aplicaciones que el aislamiento, caracterización y cuantificación de proteínas tiene en el diagnóstico por el laboratorio de diversas patologías. CE2.2 Explicar las principales técnicas y métodos utilizados, entre otras: IE, Western Blot, EIA, técnicas moleculares. C3: Analizar las técnicas de extracción y de amplificación de ácidos nucleicos (PCR y variantes) y sus múltiples aplicaciones. CE3.1 Identificar la secuencia de realización de la técnica y los reactivos utilizados. CE3.2 Describir los procesos de obtención de ácidos nucleicos de diferentes muestras biológicas. CE3.3 Esquematizar el proceso de amplificación y los sistemas de detección. CE3.4 Relacionar la extrema importancia de la ausencia de contaminaciones con el correcto desarrollo de la técnica. CE3.5 Enumerar las diversas aplicaciones de la PCR y variantes en la actualidad y las posibilidades en un futuro próximo. C4: Describir la autoinmunidad y las técnicas habitualmente utilizadas para su estudio. CE4.1 Explicar el concepto de autoinmunidad. CE4.2 Describir las principales enfermedades autoinmunes y su relación con los anticuerpos característicos. CE4.3 Citar los reactivos y las técnicas utilizadas en el laboratorio para el estudio de los autoanticuerpos. CE4.4 Reconocer los patrones de inmunofluorescencia en sueros que contienen anticuerpos antinucleares: ANA y su aplicación en el diagnóstico. CE4.5 Realizar la determinación de anticuerpos órgano y no organoespecíficos mediante las técnicas disponibles en el laboratorio. C5: Analizar el fenómeno de hipersensibilidad y las técnicas de laboratorio utilizadas en los estudios de alergias. CE5.1 Describir el concepto de hipersensibilidad. CE5.2 Enumerar los distintos tipos de hipersensibilidad. CE5.3 Explicar la hipersensibilidad. CE5.4 Reconocer las técnicas mas utilizadas en la actualidad en el estudio de alergias. CE5.5 Indicar los equipos y reactivos en función de la técnica y parámetro a determinar, identificando los rangos de referencia a utilizar. CE5.6 Manejar equipos automáticos utilizados en esta área de diagnóstico. C6: Describir la metodología utilizada en el estudio de subpoblaciones linfocitarias y en la caracterización funcional de células relevantes del sistema inmune. CE6.1 Describir los principios técnicos de funcionamiento, los componentes de los citómetros de flujo y su aplicación en el estudio de subpoblaciones linfocitarias. CE6.2 Analizar el fenómeno y técnicas de estudio de la de proliferación celular. CE6.3 Describir los materiales y reactivos utilizados en la realización de cultivos celulares y los tipos de líneas celulares utilizadas mas frecuentemente. CE6.4 Diferenciar las fases de los procesos de mantenimiento, expansión y congelación de líneas celulares. CE6.5 Reconocer la importancia de trabajar en todo momento en condiciones de rigurosa esterilidad. Fecha 11/5/2012 10:23:24 Página 40 de 42 Informe INCUAL-Intranet C7: Reconocer los antígenos HLA, las técnicas de determinación y las diversas aplicaciones en el laboratorio. CE7.1 Describir el complejo principal de histocompatibilidad y los HLA. CE7.2 Relacionar los mecanismos de rechazo en transplantes y las enfermedades relacionadas con los antígenos de histocompatibilidad. CE7.3 Enumerar los reactivos y las técnicas utilizadas en el laboratorio para el estudio de los HLA. CE7.4 Indicar los equipos y los reactivos en función de la técnica y parámetro a determinar, indicando los rangos de referencia a utilizar. C8: Analizar la aplicación de las diversas técnicas antígeno-anticuerpo en el diagnóstico microbiológico y hematológico. CE8.1 Explicar los criterios de infección aguda, crónica o en evolución para una determinada enfermedad infecciosa, relacionándolos con los métodos serológicos de identificación. CE8.2 Explicar el fundamento de las técnicas basadas en reacciones antígeno-anticuerpo para el estudio cuantitativo o cualitativo de antígenos y anticuerpos específicos: técnicas de precipitación, aglutinación, inmunoensayos, Western Blot, etc. CE8.3 Definir título de anticuerpos. CE8.4 En casos prácticos de detección de antígenos o anticuerpos: Realizar técnicas de IFI y observar las preparaciones en el microscopio de fluorescencia. Realizar pruebas de aglutinación en porta. Realizar técnicas de EIA en tubo y microplaca. CE8.5 Explicar las técnicas de determinación del grupo sanguíneo sérico y eritrocitario del sistema AB0 y del factor Rh. CE8.6 Realizar determinación de grupo sanguíneo del sistema AB0 y determinación del factor Rh. C9: Analizar el proceso de automatización y la utilización de grandes equipos automáticos de análisis. CE9.1 Identificar la secuencia de pasos básicos necesaria para una correcta utilización de estos sistemas. CE9.2 Reconocer los resultados de los controles detectando las anomalías en los mismos. CE9.3 Describir las diferentes formas de transmisión de resultados. CE9.4 Establecer las bases para una correcta solución de incidencias y el registro de las mismas. CE9.5 Explicar la labor del profesional en el control, manejo y mantenimiento de los equipos modulares. C10: Describir el proceso que garantice la calidad de los parámetros analizados en las diversas técnicas inmunológicas. CE10.1 Explicar el concepto de muestra control, control de calidad interno y control de calidad externo. CE10.2 En un supuesto práctico para determinaciones cuantitativas realizar controles de una serie analítica, registrando los resultados y analizándolos. CE10.3 Explicar el proceso de control de calidad analítico en las determinaciones cualitativas. Capacidades cuya adquisición debe ser completada en un entorno real de trabajo C2 respecto a CE2.2; C3 respecto a CE 3.1, CE3.2 y CE 3.3; C4 respecto a CE 4.4 y CE 4.5; C5 respecto a CE 5.5 y CE 5.6; C6 respecto a C6.3; C7 respecto a CE7.3; C8 respecto a CE8.4 y CE8.6; C9 respecto a CE91, CE 9.2, CE9.3, CE9.4 y CE9.5; C10 respecto a CE 10.2. Otras capacidades: Responsabilizarse del trabajo que desarrolla y del cumplimiento de los objetivos. Demostrar un buen hacer profesional. Finalizar el trabajo en los plazos establecidos. Mantener el área de trabajo con el grado apropiado de orden y limpieza. Demostrar cierto grado de autonomía en la resolución de contingencias relacionadas con su actividad. Emplear tiempo y esfuerzo en ampliar conocimientos e información complementaria para utilizarlos en su trabajo. Aprender nuevos conceptos o procedimientos y aprovechar eficazmente la formación utilizando los conocimientos adquiridos. Participar y colaborar activamente en el equipo de trabajo. Comunicarse eficazmente con las personas adecuadas en cada momento, respetando los canales establecidos en la organización. Compartir información con el equipo de trabajo. Interpretar y ejecutar instrucciones de trabajo. Trasmitir información con claridad, de manera ordenada, estructurada, clara y precisa. Actuar con rapidez en situaciones problemáticas y no limitarse a esperar. Fecha 11/5/2012 10:23:24 Página 41 de 42 Informe INCUAL-Intranet Demostrar flexibilidad para entender los cambios. Demostrar resistencia al estrés, estabilidad de ánimo y control de impulsos. Respetar los procedimientos y normas internas de la empresa. Habituarse al ritmo de trabajo de la empresa. Contenidos Sistema inmunitario. Características generales. Tipo y mecanismos de respuesta inmunitaria. Antígenos y determinantes antigénicos. Inmunidad celular. Órganos y tejidos linfoides. Células del sistema inmune. Inmunidad humoral. Anticuerpos. Inmunoglobulinas. Sistema del complemento. Reacciones antígeno-anticuerpo. Complejo principal de histocompatibilidad. Características bioquímicas y genéticas. Función del MHC. Clases de antígenos de histocompatibilidad y enfermedades asociadas. Inmunodeficiencias. Tipos: primarias y secundarias. Autoinmunidad. Objetivos. Enfermedades autoinmunes. Anticuerpos órganoespecíficos y no organoespecíficos. Reacciones de hipersensibilidad. Fundamentos. Tipos. Estudio de alergias. Técnicas inmunológicas. Reacciones de aglutinación y precipitación. Técnicas de Inmunoelectroforesis. Inmunoensayos (FIA, EIA, RIA). Inmunofluorescencia. Técnicas de Inmunoelectroblot. Turbidimetría y nefelometría. Otras técnicas. Técnicas de Biología Molécular. Aislamiento de DNA, RNA, Técnicas de PCR, RT-PCR, etc. Técnicas para estudios de células relevantes del sistema inmune. Caracterización estructural: estudios de subpoblaciones linfocitarias mediante citometría de flujo. Caracterización funcional: Cultivos celulares. Obtención de líneas celulares. Mantenimiento y expansión de líneas celulares. Congelación de células. Automatización, novedades tecnológicas, metodológicas y control de calidad en el laboratorio de Fecha 11/5/2012 10:23:24 Página 42 de 42 Informe INCUAL-Intranet inmunología. Automatización. Descripción de grandes sistemas automáticos y su manejo. Utilidad y aplicaciones. Control de Calidad. Control de calidad de la fase analítica. Control interno y control externo. Parámetros de contexto de la formación Espacios e instalaciones: Aula polivalente de al menos 2 m² por alumno. Laboratorio de análisis clínicos de 60 m². Laboratorio de microscopía de 60 m². Perfil profesional del formador o formadora: 1. Dominio de los conocimientos y las técnicas relacionadas con la capacidad de realizar técnicas inmunológicas de aplicación en las distintas áreas del laboratorio de análisis clínicos, que se acreditará mediante la forma siguiente: Formación académica de licenciado relacionada con este campo profesional. 2. Competencia pedagógica acreditada de acuerdo con lo que establezcan las Administraciones competentes.