Ciclo celular, regulación del crecimiento celular, cinética de
Anuncio

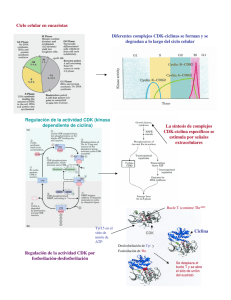
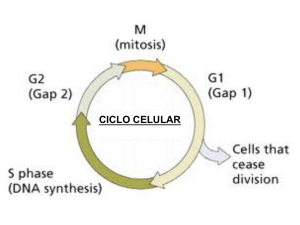
Ciclo celular, regulación del crecimiento celular, cinética de proliferación celular Dr. Hernán G. Farina Universidad Nacional de Quilmes Laboratorio de Oncología Molecular Etapas de la fase M Se pueden distinguir tres tipos de microtúbulos en el huso mitótico: los microtúbulos polares, que se solapan en la línea media del huso; los microtúbulos cinetocóricos, que se adhieren al cinetocoro especializado que forma el centrómero de cada cromosoma duplicado; y los microtúbulos astrales, que parten en todas las direcciones desde los centrosomas. La DNA polimerasa actúa como una enzima autocorrectora que elimina sus propios errores de polimerización a medida que avanza por el ADN. Regulación del ciclo celular Kinasas heterodiméricas que controlan el ciclo celular: Subunidades reguladoras: Ciclinas que aumentan y disminuyen en fase con el ciclo celular Sus subunidades catalíticas se denominan kinasas dependientes de ciclinas (Cdk) porque carecen de actividad kinasa a no ser que se asocien con una ciclina. Cada subunidad catalítica Cdk puede asociarse con diferentes ciclinas y la ciclina asociada determina que proteínas serán fosforiladas por el complejo Cdk-ciclina. La degradación de las ciclinas comienza poco después del inicio de la anafase. La secuenciación de cDNA codificadores de varias ciclinas mitóticas de diversos eucariontes ha demostrado que todas las proteínas codificadas poseen una secuencia homóloga, cerca del extremo N-terminal, denominada caja de destrucción. Regulación de las concentraciones de ciclinas mitóticas Al inicio de la mitosis el MPF fosforila residuos de serina específicos en las tres láminas nucleares y así se produce la despolimerización de estas. La despolimerización de las proteínas láminas produce la desintegración de la malla que es la lámina nuclear, lo que contribuye a la ruptura de la envoltura nuclear. El MPF fosforila proteínas que integran el complejo condensina. Este complejo fosforilado es capaz de inducir superenrrollamientos en el ADN. La fosforilación de proteínas asociadas a los microtúbulos por parte del MPF es probable que sea necesaria para generar los cambios en la dinámica microtubular que traen como consecuencia la formación del huso mitótico y los ásteres. La función de la cohesina es regulada por el inhibidor de la anafase. Conforme las células entran en anafase, este inhibidor es poliubiquitinizado por el APC y degradado por el proteasoma. Como consecuencia se permite separar las cromátides hermanas hacia los polos opuestos. La fosforilación de la cadena liviana de la miosina inhibe su interacción con la proteína miosina para la formación del anillo contractil. La actividad de todos los complejos Cdk-ciclina de mamífero parece ser regulada por fosforilación y desfosforilación. Las células de mamífero expresan varios inhibidores de kinasas dependientes de ciclinas que contribuyen al control del ciclo celular. Estos se agrupan en dos clases; los de la familia CIP (proteínas inhibidoras de Cdk) que fijan e inhiben todos los complejos de ciclinas, y Cdk 1, 3, 4 y 6 (ej.: p21, p27 y p57); y los de la familia INK4 (inhibidores de kinasa 4) que fijan e inhiben sólo los complejos Cdk4-ciclinaD y Cdk6-ciclinaD (ej.: p16). Etapas en las cuales los puntos de control pueden detener el paso a través del ciclo celular. El daño del ADN debido a la radiación o a la modificación química, impide que las células que están en G1 entren en la fase S y que las células en G2 entren en mitósis. El ADN no replicado impide la entrada en la mitosis. Los defectos en la formación del huso mitótico o en la fijación de los cinetocoros a los microtúbulos del huso impiden la activación del sistema de poliubiquitinización del APC, que conduce a la degradación del inhibidor de la anafase. En consecuencia, las células no entran en la anafase hasta que todos los cinetocoros estén unidos a los microtúbulos del huso HPV Virus DNA doble cadena Genoma = 8 kilobases 6 proteínas tempranas E1 Replicación y control transcripcional E2 E4: Formación de estructuras tipo Filamentos intermedios E5: Inhibe la acidificación de los endosomas y desciende la expresión de MHC clase 1 E6 Interrumpen el control del ciclo celular E7 2 Proteínas Tardías L1 Proteínas de la capside L2 Funciones de E6 HDM2 E6 p16INK4αα E6-AP E6-AP E6 p53 p21 p53 E1 E3 Ubiquitina p53 pRB p53 26 S CiclinaD1 Aumenta los niveles de p21 Reparación del DNA Regulación del ciclo Celular Detención en G1 Ciclina/CDKs Apoptósis Regula la transcripción de HDM2 = homólogo de E6AP p53 E7 CDKs PCNA E2F Ciclina E CR1 CR2 E7 P pRB P pRB Ciclina A pRB pRB pRB 26S p21 pRB E2F Progresión el cilco celular PCNA Ciclina E CR1 Ciclina A p53 E7 CR2 CR1 CDK-2 Ciclina E CR2 E7 p27 P P p27 CR1 CR2 E7 p27 p27 26S Regulación de p27 P P Otras funciones de E7 Interacciona con varias proteínas: H1 Kinasa M2 Piruvato Kinasa Proteína del nucleosoma que forma parte del complejo Histona desacetilasa, Mi2B -E7 = Eliminación de pRB y p27 Activa Cicline E y A AP-1 (factor de transcripción) y Síntesis de ciclinas Inactivación de p21cip-1 y p27kip-1 Aumenta la integración de DNA foráneo al genoma celular E6 + E7 = Eliminación de p53, p21, y p27 Aumenta la sensibilidad a carcinógenos químicos La fosforilación de E7 por casein kinasa 2, produce la transición G1-S, debido a la regulación alterada de ciclina E. CiclinaE/CDK2 es el regulador clave de la iniciación de la fase S. Inhibe la activación del promotor IFN-β β Inhibe la expresión de los genes inducibles por IFN-α α Progresión del ciclo celular CIGB-300 Impairs the CK2-Phosphorylation on the HPV E7 Transforming Protein Concept of CIGB-300: Impairment the CK2 phosphorylation on its substrates by out-competing the enzyme Selected Binders -Systemic administration of a peptide that impairs the protein kinase (CK2) phosphorylation reduces solid tumor growth in mice. Perera Y, Farina HG, Hernández I, Mendoza O, Serrano JM, Reyes O., Gomez DE, Gomez RE, Acevedo BE, Alonso DF, Perea SE. Int J Cancer. 2008 Jan 1;122(1):57-62. ISSN. 0020-7136. United States. -CIGB-300, a novel proapoptotic peptide that impairs the CK2 phosphorylation and exhibits anticancer properties both in vitro and in vivo. S.E. Perea, O. Reyes, I. Baladron, Y. Perera, H. Farina, J. Gil, A. Rodriguez, D. Bacardi, J.L. Marcelo, K. Cosme, M. Cruz, C. Valenzuela, P.A. López-Saura, Y. Puchades, J.M. Serrano, O. Mendoza, L. Castellanos, A. Sanchez, L. Betancourt, V. Besada, R. Silva, E. López, V. Falcón, I. Hernández, M. Solares, A. Santana, A. Díaz, T. Ramos, C. López, J. Ariosa, L.J. González, H. Garay, D. Gomez, R. Gomez R, D.F. Alonso, H. Sigman, L. Herrera, B. Acevedo. Molecular and Cellular Biochemistry, 316: 163-167, 2008. ISSN. 0300-8177. Netherlands. -Anticancer peptide CIGB-300 binds to nucleophosmin/B23, impairs its CK2-mediated phosphorylation, and leads to apoptosis through its nucleolar disassembly activity. Yasser Perera, Hernán G. Farina, Jeovanis Gil, Arielis Rodriguez, Fernando Benavent, Lila Castellanos, Roberto E. Gómez, Boris E. Acevedo, Daniel F. Alonso, and Silvio E. Perea. Mol Cancer Ther 2009;8(5),1189-1196. ISSN 1535–7163. Philadelphia, EE.UU. 1 0.5 Proof of concept with synthetic peptide clon24 clon22 clon18 clon15 clon14 clon12 clon6 clon10 0 clon5 Random cyclic peptide phage library 1.5 clon4 Biopanning 2 clon1 LNDSSEEEDEICK2 phosphoaceptor site PC89 CRIII control CRII CIGB-300 P15 Tat cpp HPV-16 E7 phosphorylation (relative levels) CRI Relative levels of phosphorylation HPV E7 as a CK2 Substrate Model 2 1.5 1 0.5 0 Control CIGB-300 Tat Perea et al, Cancer Res, 2004 Important Features on the Mechanism of Action of CIGB-300 Cell: 40X (30 sec) Pharmacology Nucleolus:100X (30 min) CIGB-300 linked to fluorescein Pull-down in vivo with CIGB- Colocalization of CIGB-300 with B23/NPM 300 biotynilated In vivo Phosphorylation of B23/NPM by CK2 In h ib ic io n d e la F o s f o r ila c in d e B 2 3 ( % ) CIGB-300 rapidly penetrates inside tumor cells and accumulates at the nucleolus 120 100 80 Once at the nucleolus, CIGB-300 physically conteracts with B23/NPM and impairs its CK2-mediated phosphorylation B23/NPM 60 40 20 0 TBB 100 µM CIGB-300 50µM CIGB-300 100µM CIGB-300 F20-2 100 µM F20-2 200 µM 200µM Tratamiento Western Blot Connection with cell proliferation 1 APOPTOSIS 2 CIGB-300 CIGB-300 induces nucleolar disambly thus impairing the ribosomal biogenesis Non-drug Colocalization of Fibrillarin + B23/NPM 3 4 1 2 3 4 Disambly stages Perera et al, Mol Cancer Ther, 2009