tema 7: reacciones químicas
Anuncio
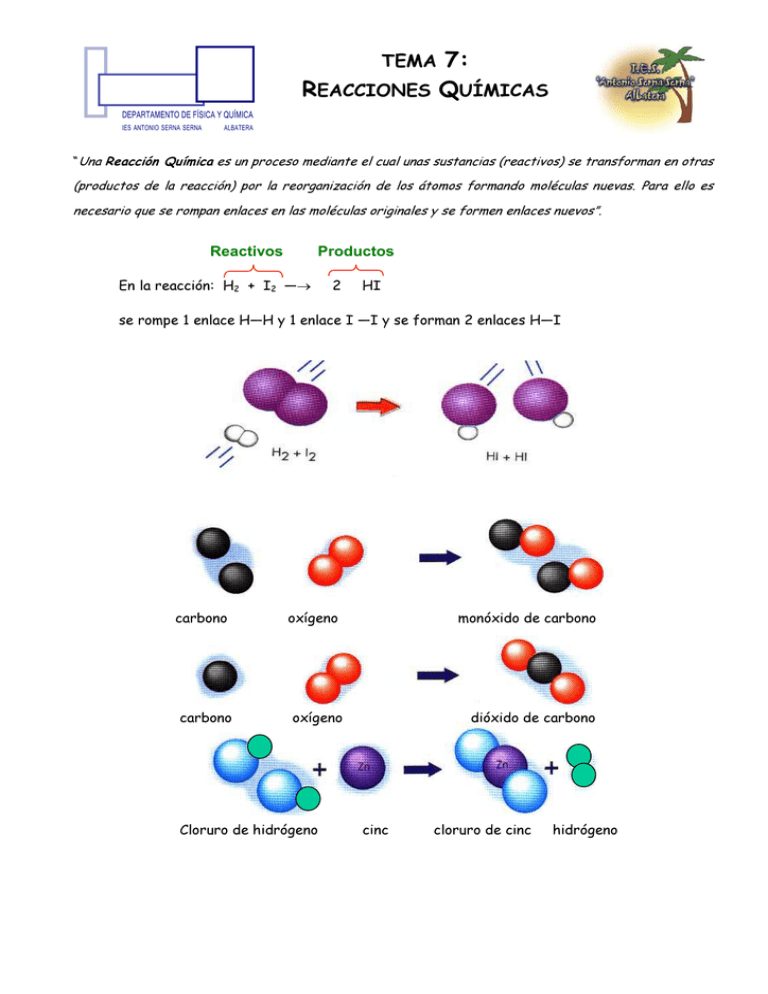
TEMA 7: REACCIONES QUÍMICAS “Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando moléculas nuevas. Para ello es necesario que se rompan enlaces en las moléculas originales y se formen enlaces nuevos”. Reactivos Productos En la reacción: H2 + I2 —→ 2 HI se rompe 1 enlace H—H y 1 enlace I —I y se forman 2 enlaces H—I carbono carbono oxígeno monóxido de carbono oxígeno Cloruro de hidrógeno dióxido de carbono cinc cloruro de cinc hidrógeno 1- AJUSTE DE UNA REACCIÓN QUÍMICA El número de átomos de cada elemento tiene que ser igual en los reactivos y en los productos. Se llama ajuste a la averiguación del número de moles de reactivos y productos. ¡CUIDADO! En el ajuste nunca pueden cambiarse los subíndices de las fórmulas de reactivos o productos. MÉTODOS DE AJUSTE: 1. Tanteo (en reacciones sencillas). 2. Algebraicamente (en reacciones más complejas) resolviendo un sistema de ecuaciones. Ejemplo: Ajustar la siguiente reacción: HBr +Fe → FeBr3 + H2 Sean a, b, c y d los coeficientes (número de moles) de los respectivos reactivos y productos. a HBr + b Fe → c FeBr3 + d H2 H) a = 2d Br) a = 3c Fe) b = c Sea d = 1; entonces a = 2, c = 2/3 y b = 2/3 Multiplicando todos los valores por 3 obtenemos los coeficientes: a = 6, b = 2, c = 2 y d = 3. Por tanto la ecuación ajustada será: 6 HBr +2 Fe → 2 FeBr3 + 3 H2 Ejercicio A: Ajusta las siguientes ecuaciones químicas por el método de tanteo: a) C3H8 + O2 → CO2 + H2O; b) Na2CO3 + HCl → Na Cl + CO2 + H2O; c) PBr3 + H2O → HBr + H3PO3; d) CaO + C → CaC2 + CO; e) H2SO4 + BaCl2 → BaSO4 + HCl. Ejercicio B: Ajusta las siguientes ecuaciones químicas por el método algebraico: a) KClO3 → KCl + O2 b) HCl + Al → AlCl3 + H2 c) HNO3 + Cu → Cu(NO3)2 + NO + H2O 2- ESTEQUIOMETRÍA DE UNA REACCIÓN QUÍMICA 2 Es la proporción en moles en la que se combinan los distintos reactivos y en la que se forman los distintos productos de la reacción. Una vez determinado el número de moles de reactivos y productos (ajuste de la reacción) se pueden realizar distintos tipos de cálculos tal y como veremos a continuación: MnO2 + 4 HCl Mn Cl2 + Cl2 + 2 H2O 2.1-CÁLCULOS MASA - MASA El dato está expresado en gramos y la incógnita la piden también en gramos. ¿Cuántos gramos de MnCl2 se obtienen cuando reaccionan 7,5 g de ácido clorhídrico? 7,5 g de HCl 1 mol de HCl 36,5 g de HCl 1 mol de MnCl2 4 moles de HCl 126,0 g de MnCl2 = 1 mol de MnCl2 6,5 g de MnCl2 2 . 2 - CÁLCULOS MASA - VOLUMEN El dato está expresado en gramos y la incógnita, por ser un gas, piden su volumen en litros ¿Qué volumen de cloro se obtendrá cuando reaccionen 7,5 g de ácido clorhídrico? a. Si se mide en c. n. b. Si se mide a 1,5 atm y 50 0 C a) Cálculo del volumen de Cl2 medido en c.n. 7,5 g de HCl 1mol de HCl 36,5 g de HCl 1mol de Cl2 4 moles de HCl Factor leído en la ecuación ajustada 22, 4 l de Cl2 = 1,2 litros de Cl2 1mol de Cl2 Esta relación se puede usar únicamente cuando el gas esté medido en c. n. b) Cálculo del volumen de Cl2 medido a 1,5 atm y 50 0 C Primero se calcula el número de moles de producto y a continuación se usa la ecuación de los gases: 7,5 g de HCl nRT V= = P 1mol de HCl 36,5 g de HCl 1mol de Cl2 = 0,051moles de Cl2 4 moles de HCl atm.l 323 K K.mol = 1,5 atm 0,051moles.0,082 0,901L = 901 cm3 3 2.3-CÁLCULOS VOLUMEN - VOLUMEN N2 (g) + 3 H2 (g) ---------- > 2NH3 (g) Si las sustancias consideradas están en fase gaseosa la relación establecida por la ecuación ajustada puede considerarse relación en volumen, siempre que los gases estén medidos en las mismas condiciones de P y T (volúmenes iguales de gases diferentes, medidos en las mismas condiciones de P y T contienen el mismo número de moles) Calcular los litros de amoniaco que se obtendrán cuando reaccionan 0,5 L de H2 (se supone que ambos gases están medidos a igual P y T) 0,5L H2 2 LNH3 = 0,333 L NH3 3 L H2 2.4- CÁLCULOS CON RENDIMIENTO DISTINTO DEL 100% Lo más frecuente es que, debido a razones diversas, a la hora de la realización práctica de una reacción química las cantidades obtenidas sean distintas de las calculadas teóricamente. Se define el rendimiento de la reacción como: ren dim iento (% ) = gramos reales ⋅ 100 gramos teóri cos El nitrato de plomo (II) reacciona con el yoduro potásico para dar un precipitado amarillo de yoduro de plomo (II). a) Planterar y ajustar la ecuación correspondiente al proceso b) Cuando se hacen reaccionar 15,0 g de nitrato de plomo (II) se obtienen 18,5 g de yoduro de plomo (II) ¿Cuál es el rendimiento del proceso? Pb (NO3)2 + a) Ecuación ajustada: 2 KI Pb I2 + 2 KNO3 b) Gramos de yoduro de plomo (II) que deberían obtenerse teóricamente: 15,0 g de Pb (NO3 )2 1mol de Pb (NO3 )2 331,2 g de Pb (NO3 )2 1mol de PbI2 1mol de Pb (NO3 )2 461,0 g de PbI2 1mol de PbI2 = 20,9 g de PbI2 Cálculo del rendimiento: r= 18,5 gramos de PbI 2 reales ⋅ 100 = 88,5% 20,9 gramos de PbI 2 teori cos El ácido sulfúrico reacciona con 10,3 g de zinc para dar sulfato de zinc e hidrógeno 4 a) Planterar y ajustar la ecuación correspondiente al proceso b) Calcular la cantidad de sulfato de zinc obtenida si el rendimiento para el proceso es de un 75 % H2SO4 + Zn ZnSO4 + H2 a) Cantidad de sulfato de zinc obtenida 10,30 gde Zn 1mol de Zn 1mol de ZnSO4 65,4 gde Zn 1mol de Zn 161,5 gde ZnSO4 1mol de ZnSO4 75,0 gde ZnSO4 reales = 19,1gde ZnSO4 reales 100,0 gde ZnSO4 teóricos 2.5- PROCESOS CON REACTIVO LIMITANTE A la hora de llevar a cabo una reacción química puede suceder que uno de los reactivos esté en exceso, entonces la reacción transcurrirá mientras exista algo del otro reactivo. Una vez que éste se acaba la reacción se para, quedando el exceso del primero sin reaccionar. El reactivo que al agotarse hace que la reacción se detenga se denomina reactivo limitante. Los cálculos se efectúan considerando las cantidades que reaccionan. Una mezcla de 100 g disulfuro de carbono y 200 g de cloro (gas) se pasa a través de un tubo de reacción caliente produciéndose la reacción: CS2 + 3 Cl2 CCl4 + S2Cl2 Calcular la cantidad de S2Cl2 que se obtendrá Como dan cantidades para ambos reactivos,vemos si están en cantidades estequiométricas (justas): 100 g CS2 1mol CS2 = 1,31mol CS2 76,2 g CS2 200 g Cl2 1mol Cl2 = 2,82 moles Cl2 71,0 g Cl2 Como (según se lee en la ecuación química) 1 mol de CS2 reacciona con 3 moles de Cl2, para reaccionar con 1,31 moles de CS2 se necesitarían: 1,31 x 3 = 3,93 moles de Cl2. Por tanto, como sólo existen 2,82 moles de Cl2: Reactivo en exceso (no reacciona todo) : CS2 Reactivo limitante (se agota, reacciona todo) : Cl2 A la hora de efectuar los cálculos ha de tenerse presente que parte del CS2 quedará sin reaccionar. Por tanto ha de usarse, el reactivo limitante (reacciona totalmente) para realizar los cálculos: Usando el reactivo limitante: 2,82 mol Cl2 1mol S2 Cl2 3 mol de Cl2 135 g S2 Cl2 1mol S2 Cl2 = 126,9 g S2 Cl2 5 2.6- REACTIVOS IMPUROS Si los reactivos que se emplean en la reacción no son puros ha de tenerse en cuenta el dato de pureza y realizar los cálculos sólo con la parte de la muestra que reacciona. Ejemplo: Al calentar el óxido de mercurio (II) se descompone en oxígeno (gas) y mercurio metálico. Calcular la cantidad de mercurio metálico que podremos obtener al descomponer 20,5 g de un óxido del 80 % de pureza. 2 HgO 2 Hg + O2 Parte de la muestra no es HgO. Por eso hablamos de “óxido” cuando nos referimos a la muestra impura 20,5 g de óxido 80 g de HgO 100 g de óxido 1mol HgO 216,8 g HgO 2 mol Hg 2 mol HgO 216,6 g Hg 1mol Hg = 15,2 g Hg Factor que convierte los gramos de muestra en gramos de Hg O Determinación de la pureza de un reactivo Basándonos en la cantidad de productos obtenidos (o de reactivos que reaccionan) se puede establecer la pureza de un reactivo o su contenido en determinada sustancia (riqueza) Ejemplo: Una muestra impura de 50,0 g de zinc reacciona con 53,7 g de ácido clorhídrico. Calcular el % de zinc presente en la muestra (riqueza) Zn + 2 HCl ZnCl2 + H2 La cantidad de zinc presente en la muestra se puede calcular a partir del ácido consumido suponiendo que las impurezas no reaccionan con el ácido: 53,7 g HCl 1mol HCl 36,5 g HCl 1mol Zn 2 mol HCl 65, 4 g Zn 1mol Zn = 48,1 g Zn El cálculo de la pureza se reduce a calcular un tanto por ciento: Pureza (% ) = gramos sus tan cia pura 48,5 g de Zn ⋅ 100 = ⋅ 100 = 96,2% gramos muestra 50 g de muuestra 2.7- REACTIVOS EN DISOLUCIÓN (MOLARIDAD) 6 Lo común es que los reactivos que se utilicen se encuentren en forma de disolución acuosa y que se trabaje directamente con cantidades de disolucíon y no de soluto: Ejemplo: Se hacen reaccionar 6,5 g carbonato cálcico con ácido clorhídrico 1,5 M. Calcular la cantidad de ácido 1,5 M necesario para que se produzca la reacción completa. CaCO3 + 2 HCl 6,5 g de CaCO3 1mol CaCO3 100,1 g CaCO3 CaCl2 + 2 mol HCl 1mol CaCO3 CO2 + H2O 1000 cm3 disolución = 86,7 cm3 disolución 1,5 mol HCl Este factor permite transformar moles de HCl (soluto) en volumen de disolución usando la definición de molaridad. 2.8-REACTIVOS EN DISOLUCIÓN (TANTO POR CIENTO EN MASA) Una forma muy corriente de expresar la concentración de una disolución es en tanto por ciento en peso (masa). Si se pretende operar con volumen de disolución es preciso, además, conocer la densidad de la disolución Ejemplo: Se hacen reaccionar 4,5 g de zinc con ácido clorhídrico del 35% en peso y 1,18 g/cm3 de densidad. Calcular el volumen de ácido necesario para que se produzca la reacción completa. 2 H Cl 4,5 g Zn 1 mol Zn 65,37 g Zn 2 mol HCl 1 mol Zn + Zn 36,5 g HCl 1 mol HCl Zn Cl2 + 100,0 g ácido 35,0 g HCl H2 1 cm3 ácido 1,18 g ácido = 12,2 cm3 ácido (disolución) El dato de densidad permite convertir gramos (masa) en cm3 (volumen) de disolución Factor que convierte moles de HCl en gramos de HCl 3- EUsando NERGÍAlaEN LAS REACCIONES QUÍMICAS definición de concentración en tanto por ciento en peso se puede En todas las reacciones químicas se en produce un intercambio energético con el medio (normalmente en convertir gramos de HCl (soluto) gramos de ácido (disolución) forma de calor) debido a que la energía almacenada en los enlaces de los reactivos es distinta a la almacenada en los enlaces de los productos de la reacción. E REACCIÓN =E PRODUCTOS –E REACTIVOS 7 Si en la reacción se desprende calor ésta se denomina “exotérmica” y si se consume calor se denomina “endotérmica”. Si ∆EREACCIÓN > 0 EPRODUCTOS > EREACTIVOS, se absorbe calor ⇒ endotérmica Si ∆EREACCIÓN < 0 EPRODUCTOS < EREACTIVOS, se desprende calor ⇒ exotérmica Ejemplos de reacciones termoquímicas Reacción endotérmica: 2 HgO (s) +181,6 kJ → 2 Hg (l) + O2 (g) Se puede escribir: 2 HgO (s) → 2 Hg (l) + O2(g); ∆ER = 181,6 kJ Reacción exotérmica: C (s) + O2 (g) → CO2 (g) +393,5 kJ Se puede escribir: C (s) + O2 (g) → CO2 (g); ∆ER = –393,5 kJ 4- TEORÍA DE LAS COLISIONES Para que se produzca una reacción química es necesario: 1º) que los átomos o moléculas posean la energía cinética suficiente para que al chocar puedan romperse los enlaces de los reactivos (energía de activación). 2º) que el choque posea la orientación adecuada para que puedan formarse los Energía enlaces nuevos. Energía de activación productos reactivos reactivos productos 8 Energía de reacción 1. Calcular el volumen de dióxido de carbono que se obtiene de la combustión de 150 g de etanol (C2H6O) a la temperatura de 45 ºC y a la presión de 1,2 atmósferas . 2. Tenemos la reacción: Zn + HCl → ZnCl2 + H2 a) Ajústala b) ¿Qué masa de HCl se precisará para reaccionar con 15 g de Zn c) y qué masa de ZnCl2 se formará suponiendo un rendimiento del 75 %? ¿Qué volumen de H2 se obtendrá: d) en condiciones normales; e) a 12 atmósferas y 150 ºC. 3. El hierro es atacado por el ácido clorhídrico formándose cloruro de hierro (II) y desprendiéndose hidrógeno en forma de gas. a) Qué masa de HCl se necesitara para hacer desaparecer 40 g de Fe? b) ¿Cuántos moles de cloruro de hierro (II) se formarán? c) ¿Qué volumen de hidrógeno se desprenderá en condiciones normales? 4. Al quemar gas metano (CH4) con oxígeno (O2) se obtiene dióxido de carbono y vapor de agua. a) ¿Qué masa de CO2 se formará al quemar 80 g de metano? b) ¿qué volumen de O2 en condiciones normales se precisará para ello? c) ¿qué volumen de vapor de agua se obtendrá a 10 atm y 250 ºC? 5. Ajusta la reacción: NO2 + H2O → HNO3 + NO b) ¿Qué volumen de NO (g), medido a 1’5 atm y 80 ºC de temperatura, se desprenderá en, a partir de 4 moles de NO2 sabiendo que el rendimiento de la misma es del 75 %? 6. El carbono y el agua reaccionan entre sí formando monóxido de carbono e hidrógeno gaseoso. a) Calcula la masa de carbono necesario para obtener 3 L de H2 en condiciones normales b) y el volumen de monóxido de carbono que se formará también en condiciones normales. 7. Al quemar gas butano (C4H10) en aire se obtiene como productos dióxido de carbono y vapor de agua. a) Escribe y ajusta la reacción química; b) Calcula la masa de oxígeno que se necesita para la combustión de 20 g de butano; c) calcula el volumen de dióxido de carbono que se desprenderá a 600 mm Hg y 300ºC. 8. 20 g de una sustancia A reaccionan con 35 g de una sustancia B formándose 40 g de una sustancia C y 15 g de una sustancia D. ¿Qué masas de C y D se obtendrán al hacer reaccionar 8 g de A con 12 g de B? ¿Cuál es el reactivo limitante? 9. En la reacción de combustión de la pirita [FeS2] se produce óxido de hierro (III) y dióxido de azufre. a) Determina el reactivo limitante si se mezclan 3 moles de FeS2 y 10 moles de oxígeno. b) ¿Cuántos moles de óxido de hierro (III) y dióxido de azufre se formarán? c) Se hacen reaccionar 100 g de FeS2 con 5 moles de oxígeno ¿Qué masa de óxido de hierro (III) se formará y qué volumen de dióxido de azufre se desprenderá en condiciones normales? 10. ¿Qué volumen de ácido clorhídrico 0,2 M se necesitará para neutralizar 40 ml de hidróxido de potasio 0,5 M? 11. ¿Qué volumen de dióxido de azufre a 30ºC y 1 atm se desprenderá al aire al quemar una tonelada de carbón que contiene un 0,5 % de azufre? 9 12. Se añaden 2,5 cm3 de una disolución 1,5 M de nitrato de magnesio sobre una disolución con suficiente cantidad de hidróxido de sodio con lo que se forma un precipitado de hidróxido de magnesio. ¿Cuál será la masa de dicho precipitado? 13. Se añaden 5 cm3 de ácido clorhídrico 0,8 M sobre una determinada cantidad de carbonato de calcio desprendiéndose dióxido de carbono, cloruro de calcio y agua. ¿Qué volumen del mismo a 1,2 atm y 50ºC obtendremos si se consume todo el ácido? 14. Determina la fórmula molecular de un insecticida formado por C, H y Cl si en la combustión de 3 g de dicha sustancia se han obtenido 2,72 g de CO2 y 0,55 g de H2O y su masa molecular es de 290 g/mol. 15. Una muestra impura de 50 g de Zinc metal reaccionan con 129 cc de un ácido clorhídrico de densidad 1,19 g/cc y que contiene 35% en peso de ácido clorhídrico. Calcula la pureza en Zinc de la muestra. 16. Una mezcla de 100 kg de CS2 y 200 kg de Cl2 se pasa a través de un tubo de reacción, y calentando se produce la reacción: CS 2 + 3 Cl 2 → CCl 4 + S 2 Cl 2 . Indica: a) ¿Cuál es el reactivo que no reacciona completamente? b) La cantidad de este reactivo que no reacciona c) El peso de S2Cl2 que se obtiene 17. En la reacción del carbonato de calcio con ácido clorhídrico se utiliza una caliza del 92% de riqueza. ¿Qué cantidad de caliza se necesita para obtener 250 kg de cloruro de calcio? Si el ácido utilizado es del 70% de riqueza y densidad 1,42 g/cc ¿cuántos ml de este ácido serán necesarios? 18. Se desea determinar la pureza de un ácido acético comercial. Para ello se diluyen 60 g del mismo y a la disolución obtenida se le añaden 50 g de CaCO3, produciéndose la reacción: CH 3COOH + CaCO3 → Ca (CH 3COOH ) 2 + CO2 + H 2 O Cuando cesa el desprendimiento de CO2 se observa que quedan 2 g de carbonato de calcio sin reaccionar. Calcula la pureza del ácido acético comercial en tanto por ciento en peso 19. Un recipiente contiene una mezcla de hidrógeno y nitrógeno con el 70% en volumen del primero de ellos y presión total de 1 atm. a) ¿Cuál es la presión parcial de cada gas? b)Escribe y ajusta la reacción química de síntesis del amoniaco c) ¿Cuál es el reactivo limitante? 20. Se tratan 200 g de carbonato de calcio del 80% de pureza con una disolución 4 Molar de HCl. Calcular el volumen de la disolución de este ácido que es necesario para reaccionar completamente con todo el carbonato de calcio. ¿Qué volumen de dióxido de ccarbono se obtiene, medido a 15ºC y 750 mm de Hg de presión, sabiendo que en la reacción se obtienen también cloruro de calcio y agua? El rendimiento de la reacción es del 80% 21. El hidrógeno se puede obtener de forma sencilla a partir de hidruro de calcio, según la reacción: Hidruro de calcio + agua → Hidróxido de calcio + Hidrógeno a) Escribe y ajusta la reacción b) Si partimos de 50 g de hidruro de calcio y de 50 g de agua ¿Cuál de las dos sustancias quedará en exceso? ¿Cuántos gramos sobran? c) Si se quiere recoger el hidrógeno obtenido en una botella a la presión de 10 atm y 27ºC ¿qué volumen deberá tener la botella? 22. Para la reacción : 4 FeS 2 + 11 O2 → 8 SO2 + 2 Fe2 O3 : a) Calcula los gramos de óxido de hierro que se obtienen si se parte de de 1000 gramos de FeS2 de 80% de pureza b) Calcula el volumen de aire, de 21% de riqueza en oxígeno, que se precisa medido en c.n 10 23. El tetracloruro de carbono, junto con el cloroformo y otros productos se forma en la reacción entre el metano con el cloro. La ecuación química del proceso es: CH4 (g) + Cl2 (g) → CCl4 (l) + HCl En una planta industrial se obtuvieron 164 toneladas de CCl4, al hacer reaccionar 24 t de CH4 con cloro en exceso. Determina el rendimiento de la reacción 24. Uno de los productos blanqueadores clorados más populares es una disolución acuosa de hipoclorito de sodio, NaClO (aq). La forma más frecuente de obtener esta sustancia es la siguiente: Na OH (aq) + Cl2 (g) → NaCl (aq) + NaClO (aq) + H2O (l) Halla la masa de hipoclorito de sodio que se obtendrá al hacer reaccionar 5000 l de cloro, medidos a 755 mmHg y 27ºC, con una disolución de hidróxido de sodio en exceso, si el rendimiento de la reacción es del 90%. 25. El óxido de nitrógeno (I) , se produce en la descomposición del nitrato de amonio: NH4NO3 (s) → N2O (g) + 2 H2O (l) Determina el volumen de N2O que se podrá obtener, medido a 765 mmHg y 17ºC, al descomponer 225 g de una muestra de NH4NO3 del 90% de riqueza en masa si el rendimiento de la transformación es del 80% 26. En el análisis de una muestra impura de cloruro de sodio se tomó una masa de 4g y se disolvió en agua hasta un volumen de 100ml. 25 ml de esta disolución se hicieron reaccionar con suficiente nitrato de plata, obteniéndose 2,21 g de cloruro de plata. Determina la riqueza en cloruro de sodio de la muestra inicial 27. El sulfato de amonio (NH4)2SO4 , reacciona con una disolución de hidróxido de sodio liberándose amoniaco. La ecuación química es la siguiente: (NH4)2SO4 + NaOH → Na2SO4 + NH3 +H2O Determina el volumen de amoniaco, medido en condiciones normales, al añadirle a 13,2 gramos de sulfato de amonio 50 ml de disolución de hidróxido de sodio 1 M. 28. La combustión de un gramo de una sustancia orgánica constituída exclusivamente por C, H y O origina 0,977 g de CO2 y 0,2 g de H2O. Determina la fórmula molecular de esta sustancia sabiendo que su peso molecular es 90. 29. Se sabe que un determinado compuesto sólo contiene carbono, hidrógeno y oxígeno. La combustión completa de una muestra de 0,0215 g del mismo origina 0,0431 g de CO2 y 0,0175 g de agua. ¿Cuál es la fórmula empírica del compuesto? 30. La densidad de un compuesto gaseoso formado por C, H y O a 250 mmHg y 300ºC es de 0,617 g/l. Al quemar 10 g de compuesto se obtienen 11,4 l de dióxido de carbono medidos a 25ºC y 738 mmHg y 8,18 g de agua. Averigua la fórmula molecular del compuesto. 11
