Leer - Asociación Educar
Anuncio

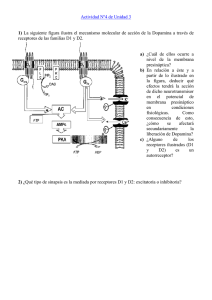
ASOCIACION EDUCAR TRABAJO FINAL TRANSMISIÓN SINAPTICA CURSO CAPACITACIÓN DOCENTE EN NEUROCIENCIAS POR: DR. HÉCTOR D. COLON SANTIAGO CAGUAS, PUERTO RICO Transmisión sináptica La transmisión de información constituye una de las funciones fundamentales del sistema nervioso. Dicha transmisión de información se basa en la comunicación entre las neuronas que se realiza fundamentalmente mediante la transmisión sináptica que, en la gran mayoría de las sinapsis, es de naturaleza química, aunque también existe un tipo de comunicación intercelular exclusivamente eléctrico. Las moléculas responsables de la transmisión de información en las sinapsis químicas se denominan neurotransmisores. Los neurotransmisores, que pueden ser excitadores o inhibidores, se liberan en unas estructuras especializadas denominadas sinapsis en las cuales existen unas zonas activas de secreción donde se localiza la maquinaria molecular necesaria para producir la secreción exocitótica del neurotransmisor en respuesta a cambios en los niveles de calcio intracelular. Como resultado de la secreción de neurotransmisores se producen cambios en las propiedades eléctricas de la neurona postsináptica que producen la propagación de la señal y, en último término, la transmisión de información. Introducción La discusión existente a finales del siglo XIX y comienzos del siglo XX entre la teoría reticular de Camilo Golgi y la teoría neuronal de Santiago Ramón y Cajal tuvo una continuación posterior cuando se comenzaron a estudiar los mecanismos mediante los cuales se producía la transmisión de la información de unas neuronas a otras, es decir, los procesos de comunicación interneuronal. Las implicaciones de esta discusión eran claras: si existía una continuidad física entre las células nerviosas era entonces posible que existiera una transmisión directa de información entre las neuronas mediante un mecanismo eléctrico. Al contrario, si Cajal estaba en lo cierto, existiría un espacio físico entre las neuronas que no podría ser recorrido por una señal eléctrica y se necesitaría alguna otra señal que cruzara dicho espacio. El concepto de sinapsis fue acuñado por Sherrington para definir las zonas especializadas de contacto entre las neuronas donde tiene lugar la transmisión de información en el sistema nervioso. Por tanto, durante las primeras décadas del siglo XX hubo una gran polémica entre los partidarios de las sinapsis eléctricas, que serían aquellas en las que la transmisión de información se debía a procesos exclusivamente eléctricos, y los partidarios de las sinapsis químicas en las que los fenómenos de naturaleza eléctrica en las neuronas postsinápticas eran desencadenados por la liberación de una sustancia química, denominada neurotransmisor, desde las terminaciones nerviosas presinápticas. Sinapsis eléctricas Por sinapsis eléctricas entendemos aquellas sinapsis en las que la transmisión de información se produce mediante el paso de corriente eléctrica de una célula a otra. Dado que el paso de corriente eléctrica de una neurona a otra es la señal responsable de la transmisión de información, es, por tanto, necesario que exista una continuidad entre el citoplasma de las células entre las que se establece la sinapsis. Dicha continuidad se logra gracias a la existencia de unos pequeños poros o uniones en hendidura (gap-junctions) entre las células. Estos poros están formados por unas proteínas denominadas conexinas, que se unen en grupos de seis unidades funcionales formando un poro denominado conexón, que es la estructura a través de la cual se produce el paso de los iones que conducen la información. Un hecho importante es que este paso de información es bidireccional a diferencia de lo que ocurre en las sinapsis químicas donde la transmisión de información es unidireccional. Se han descrito un gran número de conexinas utilizando técnicas de Biología Molecular (al menos 10 secuencias homólogas en el ratón) y su distribución tisular es muy amplia incluyendo tanto tejido no excitable (hígado, riñón, estómago, páncreas y corazón) como tejido neuronal. En conjunto, las propiedades de las sinapsis eléctricas serían las siguientes: –Una distancia corta entre las membranas presinápticas y postsinápticas (alrededor de 3 nm). –Continuidad física entre los citoplasmas de ambas células. –Ausencia de retraso sináptico, es decir, el tiempo que transcurre desde que se estimula la célula presináptica hasta que aparece una respuesta postsináptica. –Las unidades que forman los canales de comunicación (conexones) se denominan conexinas. –El mecanismo de transmisión de la información se realiza a través de la corriente iónica. –La dirección de transmisión de la información es, generalmente, bidireccional, aunque existen sinapsis eléctricas rectificadoras, esto es, capaces de conducir corriente iónica en una dirección pero no en la opuesta. La función fisiológica de estas sinapsis consiste en generar respuestas muy rápidas implicando a un gran número de unidades. El ejemplo típico lo constituye el coletazo rápido de huida que realizan ciertos peces, como el pez dorado. Sinapsis químicas Los primeros experimentos que sugirieron que existía neurotransmisión química fueron realizados en 1904 por un estudiante de medicina, T.R. Elliot, quien observó la existencia de una gran similitud entre las acciones que ejercía la aplicación de adrenalina exógena y la estimulación de los nervios adrenérgicos. No obstante, no fue hasta 1921 cuando los experimentos de Otto Loewi demostraron, sin lugar a dudas, la existencia de un proceso de neurotransmisión química. Utilizando un sistema en el que un corazón aislado de rana era prefundido con una solución nutricia procedente de otro corazón, Loewi demostró que cuando se estimulada el nervio vago del primer corazón se producía una disminución tanto en la fuerza de contracción como en la frecuencia cardiaca del mismo y que, al cabo de unos segundos, esos mismos efectos se producían en el segundo corazón cuyo nervio vago no había sido estimulado. La correcta interpretación de Loewi indicaba que una sustancia, responsable del efecto observado, estaba siendo liberada en el primer corazón, llegando al segundo, donde ejercía su efecto. Posteriormente, el concepto de neurotransmisión química se expandió debido especialmente al trabajo de Dale y Gaddum. La muestra algunas de las características que poseen las sinapsis químicas y que las diferencian de las sinapsis eléctricas. Estas propiedades son las siguientes: –Existe una sustancia química que es la responsable de la transmisión de información que recibe el nombre de neurotransmisor químico. –La transmisión de información es unidireccional y va desde la neurona presináptica a la célula postsináptica. –La distancia existente entre la parte presináptica y postsináptica se denomina hendidura sináptica y oscila entre 30 y 400 nm. –Existe siempre un retraso sináptico desde que comienza la estimulación de la parte presináptica hasta que aparece un efecto en la célula postsináptica. Entre los procesos que contribuyen a la aparición del retraso sináptico se encuentran: la entrada del ión calcio en la terminación nerviosa presináptica, los procesos de exocitosis que conllevan la secreción del neurotransmisor, la difusión del neurotransmisor en la hendidura sináptica y la interacción del neurotransmisor con los receptores postsinápticos. Podemos clasificar las sinapsis químicas, desde un punto de vista funcional, en dirigidas y no dirigidas. Sinapsis químicas dirigidas Las sinapsis químicas dirigidas son aquellas en las que existe una estrecha aposición entre las partes presinápticas y postsinápticas. La hendidura sináptica suele medir menos de 100 nm y el retraso sináptico es corto (como máximo de unos cuantos milisegundos). Es el tipo de sinapsis más abundante en el sistema nervioso central y suele generar estímulos cortos y muy selectivos. Estas sinapsis pueden clasificarse también en dos grupos: –Periféricas. Cuando están situadas fuera del sistema nervioso central. Son las sinapsis que forman los nervios somáticos que inervan la musculatura esquelética voluntaria. –Centrales. Se localizan en el interior del sistema nervioso central. A su vez, las sinapsis centrales pueden clasificarse atendiendo a criterios morfofuncionales y topográficos: –Según criterios morfológicos y funcionales: a)Sinapsis Gray tipo I: sinapsis con abundantes proyecciones densas presinápticas y vesículas secretoras redondas. Suelen ser sinapsis excitadoras. b)Sinapsis Gray tipo II: sinapsis con pocas proyecciones densas presinápticas y vesículas secretoras ovaladas. Suelen ser sinapsis inhibidoras. –Según criterios topográficos. Dependiendo de la parte de la neurona postsináptica donde se produzca la sinapsis se pueden clasificar del siguiente modo: a) Axosomática: sinapsis sobre el cuerpo neuronal. b) Axodendrítica: sinapsis sobre las dendritas. c) Axoaxónica: sinapsis sobre el axón. Sinapsis químicas no dirigidas Las sinapsis químicas no dirigidas son aquellas en las que existe una cierta distancia entre las terminaciones nerviosas que contienen el neurotransmisor y las células efectoras. Un ejemplo son las sinapsis típicas del sistema nervioso vegetativo, tanto adrenérgico como colinérgico, que al ser estimuladas, producen una respuesta difusa y generalizada de diversos órganos. Mecanismos de transmisión sináptica Cuando se estudian los mecanismos implicados en los procesos de transmisión sináptica podemos dividirlos en aspectos presinápticos, mecanismos de liberación del neurotransmisor y aspectos postsinápticos. Aspectos presinápticos En un botón sináptico se encuentran localizadas una serie de estructuras básicas necesarias para secretar el neurotransmisor en respuesta a un estímulo. Dichas estructuras básicas serían éstas: vesículas secretoras, que almacenan el neurotransmisor; mitocondrias, que proporcionan la energía necesaria para que la secreción tenga lugar; canales iónicos, que son responsables de los cambios en la permeabilidad a diferentes iones que condicionan la excitabilidad de la terminación nerviosa y, en último extremo, relacionado con la secreción del neurotransmisor, la existencia de unas zonas de mayor densidad en la membrana presináptica que son las denominadas zonas activas de liberación en las que se produce la secreción del neurotransmisor. Vamos a referirnos brevemente a la estructura de las vesículas secretoras, de los canales iónicos y de las zonas o sitios activos. Estructura de las vesículas secretoras Al observar un botón sináptico al microscopio electrónico se puede apreciar que las terminaciones presinápticas se caracterizan por la presencia de unas pequeñas estructuras redondeadas con un tamaño de unos 200 nm que al ser purificadas coemigran en gradientes de sacarosa con el neurotransmisor. Estas estructuras reciben el nombre de vesículas o gránulos secretores y contienen en su interior el neurotransmisor. Al estudiar la estructura de las vesículas secretoras se observa la existencia de dos tipos de componentes: de membrana, que le confieren una serie de propiedades relacionadas con el proceso secretor, y solubles que se encuentran en el interior de la vesícula y que van a ser secretados al exterior mediante un proceso de exocitosis. Vamos a referirnos brevemente a cada uno de estos componentes. La función fisiológica de una vesícula secretora consiste en almacenar el neurotransmisor para protegerlo de las enzimas que lo degradarían en el citoplasma y secretarlo en un proceso denominado exocitosis, mediante el que se vierte el contenido soluble de la vesícula al exterior de la neurona. A la hora de determinar qué estructuras mínimas requeriría una membrana vesicular para cumplir su función fisiológica llegaríamos a la conclusión de que, al menos conceptualmente, serían necesarias muy pocas proteínas: –Un sistema de captación que permitiera incorporar el neurotransmisor al interior de la vesícula. –Un receptor que permitiera a la vesícula situarse y anclarse en la inmediata vecindad de las zonas activas de secreción. –Un receptor que permitiera a la vesícula fusionarse con las zonas activas de la membrana plasmática y secretar su contenido al exterior. Si se compara esta estructura teórica con la estructura real que posee la vesícula secretora mejor conocida, que es el gránulo cromafín de la médula adrenal, que es capaz de almacenar y secretar catecolaminas en respuesta a diversos estímulos, veríamos que las tres estructuras que hemos deducido arriba se encuentran como tales en su membrana. Esta membrana vesicular posee un sistema de captación de catecolaminas que consta de una proteína transportadora (con gran afinidad para noradrenalina, adrenalina y dopamina) y una Vo ATPasa transportadora de protones que genera el gradiente eléctrico y químico necesario para que se produzca la captación de catecolaminas. Junto a estas dos estructuras, el mecanismo necesario para almacenar el neurotransmisor se completa con un transportador de nucleótidos (fundamentalmente ATP) necesario para acoplarse con las catecolaminas en el interior de la matriz soluble del gránulo cromafín. La capacidad de la vesícula secretora de reconocer las zonas de anclaje y, posteriormente, fusionarse en los lugares de exocitosis le viene conferida al gránulo cromafín por una serie de proteínas, a las que nos referiremos en mayor detalle más adelante, que forman genéricamente parte de lo que se denomina v-SNARE dentro del complejo SNAP-SNARE. Las proteínas más importantes asociadas a los gránulos cromafines responsables de estos procesos son sinaptotagmina, sinaptobrevina, rabfilina y rab. Junto a estos requerimientos básicos, la membrana de una vesícula secretora puede contener otras proteínas como enzimas necesarias para la síntesis del neurotransmisor, enzimas capaces de procesar péptidos, citocromos, etc., que no son críticos para su función fisiológica, pero que incrementan enormemente la capacidad de la vesícula de transmitir información. Los componentes solubles de una vesícula secretora van a ser liberados durante el proceso de exocitosis. Incluyen el neurotransmisor clásico y algunas otras moléculas, generalmente péptidos, que van a ser coliberadas con el neurotransmisor y que van a ejercer acciones neuromoduladoras sobre la función de esa u otras sinapsis. En los gránulos cromafines de la médula adrenal junto a las catecolaminas (adrenalina y noradrenalina), que serían el equivalente de los neurotransmisores clásicos, se encuentran y liberan ATP, varios péptidos como metioninaencefalina y leucina-encefalina, endotelinas y algunas proteínas como la enzima dopamina β hidroxilasa (que convierte la dopamina en noradrenalina) y las cromograninas, nos permiten deducir una función importante de las vesículas secretoras como es el procesado de péptidos. En la secuencia de la cromogranina A, al igual que en la de otros precursores que existen en el interior de las vesículas secretoras, están contenidos varios péptidos que se liberan en el interior del gránulo gracias a cortes en posiciones específicas por la acción de ciertas peptidasas. Dichos péptidos son secretados al exterior dónde ejercen acciones tanto a nivel local como a distancia. Canales iónicos El proceso fisiológico de liberación del neurotransmisor desde una terminación nerviosa presináptica implica que dicha terminación nerviosa sufra una despolarización. Los tipos de canales iónicos activados por voltaje que pueden estar presentes en una terminación nerviosa han sido descritos en el capítulo 6 en mayor detalle y aquí se citan brevemente: –Canales de Na+. Estos canales son los responsables de la propagación del potencial de acción hacia las terminaciones nerviosas. Son muy permeables al Na+ y unas 10 a 15 veces menos permeables al K+. –Canales de K+. Estos canales son responsables de la repolarización que sigue al potencial de acción. Son muy permeables al K+ y muy poco a otros iones. –Canales de Ca2+. Estos canales son responsables de la entrada de Ca2+ que da lugar a la secreción de neurotransmisor. Existen varios tipos de canales de Ca2+ responsables de la secreción en diversos sistemas. Nos referiremos a ellos más adelante. –Canales de Cl-. Los canales para el Cl- ejercen una acción inhibidora sobre la secreción en determinadas sinapsis. Zonas activas de secreción Al estudiar las terminaciones nerviosas con microscopía electrónica se observó que las vesículas más próximas a la membrana plasmática se concentran en una serie de zonas en las que se observan unas estructuras marcadamente electrodensas. Posteriormente, utilizando ω-conotoxina GVIA, marcada radiactivamente, que es un ligando específico para el subtipo N de canales de Ca2+ activados por voltaje, se observó que en las terminaciones nerviosas colinérgicas que inervan el músculo esquelético de la rana, los canales de Ca2+ tipo N están situados en la proximidad de las vesículas secretoras. Esta colocalización es muy importante, pues garantiza la eficiencia del Ca2+ que entra, tras una despolarización, en la terminación nerviosa, para inducir secreción al incrementar la concentración de Ca2+ libre en la proximidad de las vesículas secretoras. Aunque la colocalización de canales de Ca2+ y vesículas secretoras en terminaciones nerviosas sugiere la existencia de zonas activas de secreción, la demostración de las mismas se obtuvo en un experimento que realizó Wightman y que se esquematiza en la. Utilizando dos electrodos de carbono, de aproximadamente una micra de diámetro, fue situándolos en diversas posiciones en la superficie de una célula cromafín mientras estimulaba la misma mediante otro electrodo. Observó que en algunas posiciones de registro solamente uno de los dos electrodos era capaz de registrar la corriente de oxidación producida por las catecolaminas liberadas localmente en respuesta a la estimulación. La interpretación de este experimento consistió en proponer que la liberación de neurotransmisor no ocurría por igual en toda la superficie celular, sino que existían una serie de zonas activas donde se producía la secreción. Mecanismos de liberación del neurotransmisor La liberación de los neurotransmisores es un proceso que depende directamente de la entrada de Ca2+ al interior de la célula y de un incremento en la concentración de Ca2+ libre en las proximidades de los sitios activos de exocitosis. El papel primordial que juega el ión Ca2+ en el proceso secretor se demostró en 1961 cuando Douglas y Rubin observaron que al prefundir glándulas adrenales bovinas con acetilcolina, que es el neurotransmisor fisiológico en dicha sinapsis, solamente se producía secreción de catecolaminas cuando existía Ca2+ en el medio extracelular. Utilizando un abordaje experimental diferente, Ricardo Miledi, en 1973, observó que únicamente se podían registrar potenciales postsinápticos, en la sinapsis gigante del calamar, si se inyectaba el ión Ca2+, pero no cualquier otro ión, en la neurona presináptica. Estos datos iniciales sobre la forma en la que se produce la secreción fueron confirmados cuando se dispuso de sondas fluorescentes (las iniciales fueron QUIN-2 y FURA-2) que permitieron seguir los niveles de Ca2+ intracelular en respuesta a un estímulo que producía la secreción de neurotransmisor. Utilizando estas sondas se observó que siempre que se aplicaba un estímulo existía un aumento en la concentración de Ca2+ libre en el interior de la célula secretora. Dado que parece necesario un aumento en la concentración de Ca2+ libre intracelular para producir secreción, la siguiente pregunta es: ¿cómo entra el Ca2+ en el interior de la célula secretora? La respuesta es que el Ca2+ entra a través de los canales de Ca2+ activados por voltaje, que son unos complejos proteicos formados por cinco subunidades: α1, que forma el poro y sirve para su clasificación, α2, β, γ y δ. Clasificación de los canales de Ca2+ activados por voltaje Existen diversos tipos de canales de Ca2+ activados por voltaje que pueden participar en el proceso secretor. A la hora de clasificarlos se puede hacer en función del umbral de activación, es decir, el potencial de membrana de la célula a partir del cual se observa corriente a través de esos canales. En función del umbral de activación podemos clasificarlos en dos grupos: –Canales de bajo umbral. Son los canales denominados tipo T, que se activan a potenciales de membrana más positivos que –70mV, aunque sufren una inactivación por pulsos cortos en un rango de potenciales entre –100 y –60mV. Su conductancia es pequeña (de unos 8 pS) y son resistentes al bloqueo con el ión Cd2+, pero muy sensibles al bloqueo con Ni2+. Molecularmente, dependiendo de su localización, se correlacionan con los siguientes subtipos de subunidad α1: G (Cav3.1), H (Cav3.2) o I (Cav3.3). –Canales de alto umbral. Se activan a partir de potenciales de membrana de –40 mV. Existen varios tipos de estos canales iónicos que desempeñan un papel importante en los procesos secretores. Vamos a referirnos ahora a algunas de sus propiedades: a) Canal de tipo L. No se inactiva en la escala de tiempo de milisegundos. Tiene un potencial umbral en torno a –10 mV y un pico de actividad a 5 mV. Su conductancia está en torno a 25 pS. Es sensible a fármacos del tipo de las dihidropiridinas (nifedipina, nitrendipina, etc.) y se acopla a la secreción en células neuroendocrinas como la liberación de catecolaminas en células cromafines bovinas y a la liberación de insulina en células β pancreáticas. Molecularmente, se corresponde con las subunidades α1S (Cav1.1), α1C (Cav1.2), α1D (Cav1.3) y α1F (Cav1.4). b) Canal de tipo N. Recibe esta nomenclatura porque es especialmente abundante en las terminaciones nerviosas tanto periféricas como centrales. Es un canal que se inactiva en la escala de tiempo de milisegundos y que tiene una conductancia en torno a 13 pS. Farmacológicamente es muy sensible a una toxina, ω-conotoxina GVIA, que se extrae de un caracol marino (Conus geographus). Este canal está implicado en la secreción de neurotransmisores tanto a nivel central (hipocampo, corteza cerebral, etc.) como periférico (terminaciones nerviosas adrenérgicas y colinérgicas). Su correlato molecular es la subunidad α1B (Cav2.2). c) Canal tipo P/Q. Se describió inicialmente en las células de Purkinje del cerebelo, de las que toma el nombre. Es un canal muy sensible (se bloquea a concentraciones inferiores a 10 nM) a una toxina (ω-agatoxina IVA) obtenida de la araña Agelenopsis aperta. Molecularmente, se corresponde con la subunidad α1A (Cav2.1). Este canal participa en la secreción de neurotransmisores en las sinapsis centrales. d) Canal de tipo R. Es una corriente residual que permanece cuando en presencia de la combinación de ω-conotoxina GVIA, dihidropiridina y ω-agatoxina IVA, se estimula la neurona por encima de –40 mV. Molecularmente, se cree que este canal contiene una subunidad α1E (Cav2.3) Exocitosis Podríamos resumir el proceso secretor en una terminación nerviosa en una serie de pasos: –Un potencial de acción invade la terminación nerviosa. –La terminación nerviosa se despolariza. –Se abren canales de Ca2+ activados por voltaje. –Se incrementa la permeabilidad al Ca2+ y la concentración intracelular de Ca2+ libre. –Se produce la secreción de neurotransmisor. –La concentración de Ca2+ intracelular vuelve a valores basales. –Se elimina el neurotransmisor de la hendidura sináptica. –Se reciclan las vesículas secretoras. En este apartado vamos a estudiar la relación que existe entre el aumento en la concentración de Ca2+ libre y la secreción de neurotransmisor. Para comprender el mecanismo molecular implicado en el proceso de fusión de las membranas de la vesícula secretora con la membrana plasmática es necesario conocer la escala temporal en la que se produce el proceso de secreción. El retraso sináptico se sitúa alrededor de 2 ms e incluye los procesos ya mencionados de despolarización de la terminación nerviosa, entrada de Ca2+, difusión del Ca2+ hacia las zonas activas, exocitosis, difusión del neurotransmisor a través de la sinapsis, interacción con receptores postsinápticos y aparición de un potencial postsináptico. En cambio, en células neuroendocrinas, el tiempo que transcurre desde que se produce el estímulo hasta que se libera el neurotransmisor es de unos 200 ms. Por otra parte, se ha estimado que el tiempo necesario para que se produzca la transferencia de una molécula de fosfato por una cinasa en una reacción de fosforilación es de unos 12 ms, mientras que la eliminación de una molécula de fosfato por una fosfatasa requiere unos 33 ms. Estos datos sugieren que el mecanismo molecular de la exocitosis se debe, sobre todo en el caso de la secreción rápida de neurotransmisor en las terminaciones nerviosas, donde el retraso sináptico es de unos 2 ms, a cambios conformacionales de diversas proteínas que forman parte del complejo de anclaje y fusión entre las vesículas secretoras y la membrana plasmática. El proceso de exocitosis puede dividirse en dos mecanismos: anclaje (docking) de las vesículas próximas a los lugares de exocitosis y fusión entre las membranas vesicular y plasmática. La definición de anclaje puede realizarse desde tres puntos de vista diferentes: –Morfológico. Se definen como ancladas las vesículas que están localizadas junto a la membrana plasmática en la proximidad de los lugares activos de secreción. –Funcional. Las vesículas ancladas serían aquellas que van a ser secretadas en primer lugar. –Molecular. Viene definido por la formación de un complejo de proteínas que fijan la vesícula a los lugares activos de secreción. El fenómeno de anclaje requiere la localización de las vesículas sinápticas en la zona activa de la terminación nerviosa. Tras el anclaje, las vesículas secretoras están unidas físicamente a la membrana, pero, gran parte de ellas, no son competentes para secretar. De hecho, la entrada de calcio produce la liberación de una pequeña fracción de las vesículas. Existe una serie de proteínas que contribuyen a la formación del complejo de anclaje como la proteína de la membrana vesicular como rab3a que pertenece a la familia de las GTPasas y que se cree que participa en el tráfico de membranas en las células. Otras proteínas implicadas son las proteínas que forman el complejo 7S donde se va a iniciar el proceso de fusión: como parte de la vesícula secretora, sinaptobrevina y sinaptotagmina (receptor v-SNARE), y por parte de la membrana plasmática, SNAP-25 y sintaxina 1a (receptor t-SNARE) (figura 7.6). Por fusión se conoce el proceso por el cual las membranas de las vesículas secretoras y la membrana plasmática se unen y, como consecuencia, se produce el proceso de exocitosis. La fusión es un proceso muy rápido que requiere del uso de técnicas especiales para ser detectada. Actualmente, la técnica más utilizada debido a su gran sensibilidad y resolución temporal es la determinación de los cambios en la capacitancia celular que acompañan al proceso secretor, al incorporarse la superficie de las vesículas secretoras a la superficie celular total durante la exocitosis. Para comprender mejor el escenario en el cuál se produce la secreción de neurotransmisor, fijémonos en el esquema de la figura 7.6 que representa los componentes moleculares del proceso de exocitosis. En este proceso juegan un papel muy importante dos proteínas citosólicas que son α-SNAP y NSF que es una proteína con capacidad de hidrolizar ATP y sensible a Netilmaleimida (propiedad que le confiere su nombre de factor sensible a N-etilmaleimida). Estas dos proteínas forman el complejo denominado SNAP, representado en la figura 7.6. Junto a estas proteínas, existen otras (sinaptotagmina y sinaptobrevina) en la membrana de la vesícula secretora que forman uno de los receptores para SNAP denominado v-SNARE. Por su parte, en la membrana plasmática existen otras dos proteínas (SNAP-25 y sintaxina 1a), que forman el correspondiente receptor para SNAP, denominado t-SNARE. La interacción entre las proteínas que forman parte del complejo SNAP-SNARE desempeña un papel clave en los procesos de exocitosis. En la proximidad de las vesículas ancladas en las zonas activas se encuentran también localizados canales de Ca2+ activados por voltaje, ya que una de las proteínas que forman el complejo de anclaje 7S (sintaxina) se une también a los canales de Ca2+. Esta característica de la sintaxina incrementa enormemente la eficacia de la sinapsis, ya que la entrada de Ca2+ a través de los canales activados por voltaje se produce precisamente allí donde se encuentran las vesículas secretoras. ¿Cómo comienza el proceso de exocitosis? Desde el punto de vista molecular, el proceso de exocitosis comienza mediante la entrada del ión calcio. Se cree que el sensor de calcio que inicia el proceso es la proteína sinaptotagmina I que posee dos dominios C2 con capacidad para fijar calcio y fosfolípidos. Esto hace que la sinaptotagmina I se desplace de su unión al complejo 7S. Posteriormente, la proteína NSF se une a este complejo formando otro denominado 20S. Se cree que el proceso de fusión comienza tras la hidrólisis de una molécula de ATP por NSF que, al mismo tiempo, promueve la disociación del complejo 20S. Utilizando la técnica de los cambios en la capacitancia se ha estudiado la secreción de un único gránulo secretor en mastocitos del mutante de ratón beige que contienen un número muy pequeño de gránulos secretores de gran tamaño. En este modelo de secreción se ha observado que al comienzo de la fusión entre las membranas vesicular y plasmática se produce la apertura de un poro de fusión de pequeño tamaño, a través del cual existe ya liberación del producto de secreción; es el fenómeno conocido como ‘kiss and run’. Sorprendentemente, hasta que el poro de fusión alcanza un tamaño crítico el proceso secretor es reversible. Aunque a nivel molecular aún no están totalmente establecidas las interacciones entre las diversas proteínas que participan en el proceso secretor, sí parece claro que la hipótesis SNAP- SNARE es capaz de explicar el mecanismo molecular de la exocitosis. Una confirmación de esta hipótesis viene del trabajo realizado con las toxinas tetánica y botulínica. Se sabía desde hace mucho tiempo que estas dos toxinas producían un bloqueo en la secreción de acetilcolina. Cuando se han realizado estudios a nivel molecular sobre las acciones de estas toxinas se ha visto que la toxina tetánica y la botulínica de los serotipos B, D, F y G son capaces de romper enlaces peptídicos en las moléculas de sinaptobrevina entre el enlace peptídico Gln76-Phe77. Por otra parte, el serotipo C de la toxina botulínica es capaz de realizar la misma función sobre la molécula de sintaxina mientras que los serotipos A y E de la misma toxina lo hacen con la proteína SNAP-25. Estos resultados indican que el efecto de estas toxinas bloqueando la secreción del neurotransmisor se debe a una acción peptidasa específica sobre ciertas proteínas del complejo SNAP-SNARE. Eliminación del neurotransmisor de la hendidura sináptica Una vez liberado el neurotransmisor, éste interactúa con receptores postsinápticos como veremos más adelante en este capitulo produciendo un efecto. No obstante, la estimulación sucesiva de estos receptores puede dar lugar a una desensibilización de los mismos y, por tanto, a una inhibición funcional de esa sinapsis. Por ello, el neurotransmisor liberado debe ser eliminado de la hendidura sináptica. La eliminación del neurotransmisor de la hendidura sináptica constituye el mecanismo fisiológico por el cual cesa la acción del neurotransmisor. Existen tres mecanismos básicos por los cuales un neurotransmisor puede ser eliminado de una sinapsis: difusión, metabolismo y re-captación en la terminación nerviosa. La difusión es el mecanismo responsable de la eliminación de una fracción del neurotransmisor. No obstante, al ser las hendiduras sinápticas en muchas sinapsis unos espacios físicamente limitados, sólo constituye un mecanismo de gran importancia en la eliminación de los neurotransmisores peptídicos. Otro aspecto que hay que considerar es el metabolismo del neurotransmisor. Las enzimas necesarias para degradar algunos neurotransmisores se encuentran localizadas en las proximidades de la sinapsis. El ejemplo más conocido lo constituye la enzima acetilcolinesterasa que es capaz de degradar rápidamente la acetilcolina liberada de las terminaciones nerviosas colinérgicas en la unión neuromuscular y que limita a unos cuantos milisegundos la duración de acción de la acetilcolina. Si tenemos en cuenta que el receptor nicotínico muscular se desensibiliza rápidamente por la presencia continuada de acetilcolina dando lugar a un bloqueo de la contracción y, por consiguiente, a una parálisis muscular (tal y como ocurre en la intoxicación con insecticidas organofosforados que son inhibidores del enzima acetilcolinesterasa), podemos comprender el papel imprescindible que desempeña esta enzima en el mantenimiento de la funcionalidad de la unión neuromuscular. La acción de la acetilcolinesterasa sobre la acetilcolina desdobla esta enzima en ácido acético y colina. Esta degradación va acoplada, en las terminaciones nerviosas colinérgicas a un sistema de captación específico para colina que la reincorpora a la terminación nerviosa colinérgica y permite su reutilización en la síntesis de acetilcolina. Por último, la recaptación es probablemente el mecanismo más utilizado para la eliminación de los neurotransmisores de las hendiduras sinápticas. En las terminaciones presinápticas de un gran número de sinapsis existen una serie de proteínas estructurales de la membrana que muestran una gran afinidad por el neurotransmisor y que son capaces de eliminarlo muy eficientemente de la hendidura sináptica. En general, estos transportadores utilizan el gradiente de Na+ existente a ambos lados de la membrana plasmática como la fuerza motriz para realizar la captación. No obstante, existen algunas excepciones como en el caso del GABA, que requiere también Cl(transportadores dependientes de Na+ y Cl-) o en le caso de los transportadores de aminoácidos excitadores que requieren también K+ (transportadores dependientes de Na+ y K+). Una vez recaptado, sin metabolizar, puede reincorporarse rápidamente a vesículas secretoras que se encuentran en la terminación nerviosa para su posterior secreción. La existencia de este tipo de transportadores fue descrita inicialmente en las terminaciones nerviosas adrenérgicas, en las que se encargan de la terminación fisiológica de la acción del neurotransmisor. El bloqueo del sistema de recaptación específico de noradrenalina en las terminaciones nerviosas adrenérgicas es el mecanismo de acción de determinadas sustancias terapéuticas (antidepresivos tricíclicos) o de abuso (cocaína). Destino de las vesículas secretoras tras la exocitosis Si no existiese un mecanismo que antagonizara el incremento de la superficie en la terminación nerviosa, que se produce tras la exocitosis de un gran número de vesículas, nos encontraríamos con un gran incremento en el tamaño de dichas terminaciones nerviosas. Esto no ocurre, salvo en el caso en el que la secreción sea inducida, en ausencia de Ca2+ extracelular, por ciertas toxinas como la a-latroxina (que es un veneno de la araña viuda negra). El mecanismo que es capaz de eliminar de la membrana plasmática de la terminación nerviosa el exceso de membrana incorporada mediante la exocitosis de las vesículas secretoras se denomina endocitosis y es, en general, dependiente de Ca2+. El mecanismo por el que se produce la endocitosis es común, aunque el destino final de la membrana endocitada puede variar. El proceso de endocitosis, en las terminaciones nerviosas, comienza mediante el recubrimiento de la membrana de la vesícula secretora que acaba de sufrir exocitosis con una proteína denominada clatrina y la separación de dicha vesícula de la membrana plasmática. En esta última fase se requiere la presencia de una GTPasa denominada dinamina, que desempeña un papel importante, ya que el bloqueo de la acción de esta proteína en Drosophila hace que desaparezcan las vesículas secretoras. Posteriormente a la endocitosis, la vesícula secretora puede seguir tres vías diferentes. Mediante el reciclado las vesículas se liberan de su recubrimiento de clatrina y pueden ser funcionales otra vez como vesículas secretoras, ya que las proteínas de membrana necesarias para el anclaje, fusión y captación del neurotransmisor no han sido afectadas. Es el mecanismo más común. Otro mecanismo es el de la transcitosis. Las membranas vesiculares forman grandes vacuolas desde donde se dirigen hacia otras zonas de la terminación nerviosa. Sólo parece tener importancia en situaciones de sobreestimulación no fisiológica de la terminación nerviosa. Por último, hay que considerar el proceso a través de la vía constitutiva. Parte de las membranas recuperadas de la terminación nerviosa recubierta de clatrina son dirigidas hacia los lisosomas localizados en el cuerpo neuronal, donde son degradados en sus componentes para ser reutilizados posteriormente en síntesis de novo. Aspectos postsinápticos La interacción entre un neurotransmisor y sus receptores específicos desencadena una serie de cambios en la célula postsináptica que pueden ser de dos tipos: bioquímicos y eléctricos. Los cambios de naturaleza bioquímica suelen ser más frecuentes en células de origen no neuronal. Un ejemplo lo representa la activación de receptores β-adrenérgicos por noradrenalina, en células hepáticas, que da lugar a un incremento en los niveles de AMP cíclico. En cambio, en neuronas o células secretoras, los cambios que producen los neurotransmisores a través de su unión a receptores específicos son, con cierta frecuencia, de naturaleza eléctrica. A continuación nos vamos a centrar en los cambios eléctricos que se producen como consecuencia de la acción del neurotransmisor, ya que existe en este libro un capítulo específico dedicado a las sinapsis que generan cambios en los mensajeros intracelulares. Vamos a estudiar los cambios eléctricos que se producen en dos tipos de sinapsis: periféricas y en el sistema nervioso central. Sinapsis periféricas Las sinapsis periféricas se caracterizan porque, generalmente, una única neurona presináptica realiza un contacto sináptico con la neurona postsináptica o la célula efectora. En el caso de las sinapsis cuya activación genera una respuesta eléctrica en la célula efectora, están implicados un tipo específico de canales iónicos que son los canales operados por ligando, descritos en otros capítulos. Como consecuencia de la interacción del neurotransmisor con su receptor específico, se va a producir un cambio de permeabilidad a determinados iones, que en el caso del receptor nicotínico para acetilcolina de la célula muscular estriada o de la célula cromafín de la médula adrenal son Na+ y K+, lo que va a producir un cambio en el potencial de membrana de reposo de la célula postsináptica con la aparición de un potencial postsináptico (figura 7.7). Cuando la liberación de neurotransmisor es más intensa, el tamaño del potencial postsináptico se incrementa hasta que llega un momento en el que es capaz de disparar un potencial de acción y propagar la señal a lo largo de la célula postsináptica (figura 7.7). Como consecuencia de esta propagación se va a producir la contracción muscular (en el caso de la sinapsis en la unión neuromuscular) y la secreción de catecolaminas en la sinapsis entre el nervio esplácnico y la célula cromafín de la médula adrenal. Sinapsis en el sistema nervioso central En el sistema nervioso central la situación es mucha más compleja, puesto que una única neurona puede recibir un gran número de sinapsis, tanto excitadoras como inhibidoras, en diversas partes de su estructura. Las sinapsis centrales podríamos clasificarlas desde el punto de vista funcional en dos grandes grupos: excitadoras e inhibidoras. Las sinapsis excitadoras son aquellas en las cuales la interacción entre el neurotransmisor y su receptor va a dar lugar a un potencial postsináptico excitador (aquel que desplaza el potencial de membrana de la célula postsináptica hacia valores menos negativos). En este caso se dice que el neurotransmisor es excitador. En el sistema nervioso central existe un gran número de neurotransmisores excitadores, pero probablemente el más abundante y el que tiene unas funciones fisiológicas más importantes es el glutamato que está implicado en procesos que van desde el aprendizaje y memoria hasta la lesión neuronal producida en situaciones de isquemia. En general, la interacción de un neurotransmisor excitador con su receptor produce un aumento en la permeabilidad a los iones Na2+ o Ca2+ en la célula postsináptica. Tal y como se dijo anteriormente, la morfología de las sinapsis excitadoras coincide con lo que se ha llamado tipo Gray I. Las sinapsis inhibidoras son aquellas en las que la activación del receptor postsináptico por el neurotransmisor va a dar lugar a un potencial postsináptico inhibidor (el potencial de membrana se hace más negativo). El prototipo de neurotransmisor inhibidor en el sistema nervioso central es el aminoácido GABA. Generalmente, las sinapsis inhibidoras generan los potenciales postsinápticos inhibidores mediante un incremento en la permeabilidad al ión Cl-. Morfológicamente corresponden con las sinapsis tipo Gray II. Actividad funcional La actividad funcional de una neurona (liberación de neurotransmisor en sus terminaciones sinápticas) y, por tanto, su capacidad de transmitir información, viene determinada por la interacción entre todas las sinapsis excitadoras e inhibidoras que recibe en su estructura. Tomando un modelo cajaliano de neurona podríamos decir que el árbol dendrítico está especializado como la zona receptora de la neurona, el axón es la zona conductora y las terminaciones nerviosas constituyen la zona transmisora. La figura 7.4 indica cuáles son los posibles tipos de sinapsis que pueden establecerse en el sistema nervioso central y que básicamente son axodendríticas, axosomáticas y axoaxónicas. Vamos a referirnos brevemente a cada una de ellas desde el punto de vista funcional. Las sinapsis axodendríticas suelen ser excitadoras y producen despolarización de las dendritas. Esta despolarización se desplaza hacia el soma neuronal mediante dos mecanismos diferentes; propagación de un potencial de acción o conducción electrotónica que consiste en transmitir pasivamente, a través de los electrólitos intracelulares, la despolarización sufrida, pero sin generar potenciales de acción. Las sinapsis axosomáticas suelen ser inhibidoras y ejercen una acción reguladora sobre la propagación de la despolarización generada en las dendritas. Esta acción tiene una gran importancia, puesto que la zona crítica para disparar un potencial de acción está localizada al comienzo del axón. Las sinapsis axoaxónicas ejercen una acción moduladora de la actividad neuronal a nivel presináptico. Dicha acción moduladora puede ser de dos tipos: – Inhibición presináptica. La activación de una sinapsis inhibidora (figura 7.8.A) localizada sobre una terminación nerviosa excitadora hace que el potencial de membrana alcance valores más negativos, con lo que se requerirá un estímulo mucho más intenso para alcanzar los valores de potencial de membrana requeridos para activar canales de Ca2+ activados por voltaje y producir la liberación del neurotransmisor. – Facilitación presináptica. En este caso se activa presinápticamente una sinapsis excitadora (figura 7.8.B)localizada sobre una terminación nerviosa excitadora. Esto hace que el potencial de membrana de la terminación se acerque al valor umbral para la activación de los canales de Ca2+ activados por voltaje, con lo que será más fácil inducir la liberación del neurotransmisor. Hay otros dos aspectos importantes de la funcionalidad de una sinapsis, que son la fatigabilidad y la potenciación postetánica. Por fatigabilidad se entiende el fenómeno por el cual tras una estimulación repetitiva de una sinapsis excitadora, la respuesta postsináptica disminuye marcadamente y puede llegar a desaparecer. Existen tres mecanismos que podrían estar implicados en la fatigabilidad neuronal: un descenso marcado en la cantidad de neurotransmisor existente en las terminaciones nerviosas presinápticas, desensibilización de los receptores postsinápticos y acumulación progresiva de iones Ca2+ en la neurona postsináptica que activarían canales de K+ que podrían hiperpolarizar la célula postsináptica. Por facilitación postetánica se entiende el fenómeno que se produce cuando, tras una estimulación intensa y repetida de una neurona, se produce un período de reposo y la siguiente estimulación tras ese período de reposo da lugar a una gran liberación de neurotrasmisor. El mecanismo de producción de esta facilitación parece depender de una acumulación progresiva de iones Ca2+ en el interior de dicha neurona. Conclusiones La comunicación neuronal se realiza a través de las sinapsis, que pueden ser de dos tipos: eléctricas, en las que no hay retraso sináptico, y químicas, más abundantes y que implican la liberación de un mediador químico denominado neurotransmisor. La neurotransmisión implica la liberación del contenido soluble de las vesículas secretoras a la hendidura sináptica mediante exocitosis, que implica diversos componentes: componentes de la vesícula secretora, que contienen proteínas específicas para el anclaje y fusión de la vesícula (SNAP), y componentes de la membrana plasmática, que incluyen proteínas específicas para iniciar la fusión con la vesícula secretora (SNARE) –localizadas en zonas activas de secreción– y canales de calcio activados por voltaje. Finalmente, existen cuatro tipos de sinapsis: excitadoras, inhibidoras, centrales y periféricas.