Reactividad del eje hipota´lamo-hipofisario
Anuncio

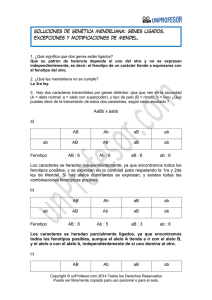
ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Psiq Biol. 2010;17(1):6–11 Psiquiatrı́a Biológica www.elsevier.es/psiquiatriabiologica Original Reactividad del eje hipotálamo-hipofisario-adrenocortical: un mecanismo que es la base de las asociaciones entre 5-HTTLPR, estrés y depresión$ Ian H. Gotlib a,b,, Jutta Joormann b,c, Kelly L. Minor b y Joachim Hallmayer c a b c Department of Psychology, Stanford, Estados Unidos Department of Psychology, Stanford University, Standford, Estados Unidos Department of Psychiatry and Behavioral Sciences, University of Miami, Miami, Estados Unidos I N F O R M A C I Ó N D E L A R T Í C U L O Palabras clave: Depresión Reactividad del eje HHA Riesgo de depresión Gen transportador de la serotonina Estrés R E S U M E N Fundamento: Las pruebas recientes indican que los individuos que son homocigotos para el alelo corto (s) en la región promotora del gen transportador de la serotonina se caracterizan por mayores tasas de depresión y otras enfermedades psiquiátricas en función de la exposición a niveles crecientes de acontecimientos estresantes de la vida que aquellos con una o dos copias del alelo largo (l). A pesar de la fiabilidad de esta asociación, se desconoce el mecanismo por el que el polimorfismo confiere un riesgo de psicopatologı́a en presencia de estrés. El presente estudio se diseñó para examinar la hipótesis de que los individuos homocigotos para el alelo s se caracterizan por una mayor reactividad biológica al estrés que aquellos con una o 2 copias del alelo l. Métodos: Se genotipificó y expuso a una tarea de laboratorio estandarizada relacionada con el estrés a niñas con un alto (n = 25) y bajo riesgo (n = 42) de depresión en virtud de la presencia o ausencia de antecedentes familiares del proceso. La concentración de cortisol se evaluó antes y después del estresor y durante un perı́odo de restablecimiento prolongado. Resultados: Las niñas homocigotas para el alelo s produjeron niveles mayores y más prolongados de cortisol como respuesta al estresor que aquellas con un alelo l. Conclusiones: Los hallazgos del presente estudio indican que el polimorfismo 5-HTTLPR se asocia con la reactividad biológica al estrés, que puede aumentar la vulnerabilidad a la depresión frente a los acontecimientos estresantes de la vida. & 2010 Publicado por Elsevier España, S.L. HPA axis reactivity: A mechanism underlying the associations among 5-HTTLPR, stress, and depresión A B S T R A C T Keywords: Depression HPA-axis reactivity Risk for depression Serotonin transporter gene Stress $ Background: Recent evidence indicates that individualswhoare homozygous for the short (s) allele in the promoter region of the serotonin transporter gene have higher rates of depression and other psychiatric disorders as a function of exposure to increasing levels of stressful life events than do individuals who have one or two copies of the long (l) allele. Despite the reliability of this association, the mechanism by which this polymorphism confers risk for psychopathology in the presence of stress is not understood. This study was designed to examine the formulation that individuals who are homozygous for the s allele are characterized by a greater biological reactivity to stress than are their counterparts who have one or two copies of the l allele. Methods: Girls at high (n_25) and low (n_42) risk for depression by virtue of the presence or absence of a family history of this disorder were genotyped and exposed to a standardized laboratory stress task. Cortisol levels were assessed before the stressor, after the stressor, and during an extended recovery period. Results: Girls who were homozygous for the s allele produced higher and more prolonged levels of cortisol in response to the stressor than did girls with an l allele. Conclusions: These findings indicate that the 5-HTTLPR polymorphism is associated with biological stress reactivity, which may increase susceptibility to depression in the face of stressful life events. & 2010 Published by Elsevier España, S.L. Publicado previamente en: Biological Psychiatry 2008; 63: 847–851 Autor para correspondencia. Correo electrónico: [email protected] (I.H. Gotlib). 1134-5934/$ - see front matter & 2010 Publicado por Elsevier España, S.L. doi:10.1016/j.psiq.2010.01.002 ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. I.H. Gotlib et al / Psiq Biol. 2010;17(1):6–11 El trastorno depresivo mayor (TDM) es uno de los más frecuentes y debilitantes de todos los trastornos psiquiátricos1. La elevada cronicidad y recurrencia de la depresión, combinada con su prevalencia significativa, pérdida personal y costes sociales hacen indispensable que identifiquemos los factores que intervienen en el inicio de esta enfermedad. Los hallazgos constantes de que los antecedentes familiares de depresión son una de las más potentes variables pronósticas de su desarrollo han propiciado que los investigadores examinaran la herencia de esta entidad. De hecho, en la actualidad, hay pruebas considerables a partir de las investigaciones efectuadas en gemelos, adopciones y árboles genealógicos y a partir de los estudios de ligamiento de todo el genoma, que indican una contribución genética significativa a esta enfermedad2. Sin embargo, es importante mencionar que la mayorı́a de individuos con antecedentes familiares positivos de depresión no la desarrollan. Por lo tanto, las teorı́as más contemporáneas concernientes al papel de los genes en su inicio no postulan que los genes afecten directamente a la depresión; sino que son explı́citamente de diátesis-estrés, que postulan que la vulnerabilidad genética interacciona con los principales estresores de la vida para producir depresión3. Debido a la importancia del sistema de la serotonina en la depresión y a la eficacia de los inhibidores selectivos de la recaptación de serotonina en su tratamiento, no es sorprendente que los investigadores que examinan esta hipótesis hayan prestado atención al gen transportador de la serotonina (5-HTT) (SLC6A4) y, en particular, a un polimorfismo en la región promotora de este gen (5-HTTLPR). Se ha demostrado que los alelos corto (s) y largo (l) en él afectan a las tasas transcripcionales del gen 5-HTT4. Quizás de modo más destacado, recientemente, Caspi et al5 encontraron que los individuos con una o dos copias del alelo s del polimorfismo 5-HTTLPR manifestaban mayores niveles de sı́ntomas depresivos, mayores tasas de depresión diagnosticable y más suicidios en función de la exposición a niveles crecientes de acontecimientos estresantes de la vida que aquéllos homocigotos para el alelo l. En la actualidad, varios investigadores6–8 han reproducido los resultados de Caspi et al5. Sin embargo, a pesar del número de pruebas cada vez mayor de que el gen 5-HTT modera la asociación entre el estrés vital y la depresión, los mecanismos subyacentes de esta moderación apenas se conocen. Los hallazgos de la investigación efectuada en animales sugieren que uno de los posibles mecanismos incluye el constructor de la reactividad al estrés. Por ejemplo, Li et al9 encontraron que, en ratones con una disminución o ausencia de la función de este gen, se observaban mayores aumentos de hormona adrenocorticotropa (ACTH), una hormona de estrés, como respuesta a éste que en animales de control de la misma camada. También se dispone de pruebas indirectas de la participación de la reactividad al estrés a partir de estudios efectuados en seres humanos. Kendler et al10 encontraron que los individuos con los 2 alelos s en 5-HTTLPR tenı́an más probabilidades de experimentar depresión como respuesta a los )acontecimientos habituales, que solo entrañaban una mı́nima amenaza* y formularon la hipótesis de que este polimorfismo genético produce una mayor sensibilidad a la influencia de los acontecimientos estresantes. Quizás como reflejo de esta )sensibilidad*, los investigadores han encontrado que, comparado con individuos que poseen, como mı́nimo, un alelo l en la región promotora del gen 5-HTT, aquellos homocigotos para el alelo s manifiestan una mayor activación de la amı́gdala como respuesta a los estı́mulos amenazadores11,12. Coincidiendo con esta formulación de )reactividad al estrés*, los investigadores han encontrado que el cortisol, un indicador fiable del funcionamiento del eje hipotálamo-hipofisario-adrenocortical (HHA) y de la reactividad al estrés, no solo tiene un componente herditario13 sino que también aumenta en un 40–60% de adultos con un diagnóstico de TDM14. De hecho, se ha postulado que la 7 hipercortisolemia da lugar a la pérdida de neuronas hipocámpicas, lo que, a su vez, se ha propuesto que interviene en la patogenia de la depresión15. Dada la investigación que se acaba de describir, es posible que los individuos deprimidos, muchos de los cuales probablemente son )portadores de un alelo s* en 5-HTTLPR5 se caractericen por hipercortisolemia no solo porque se han expuesto a un )mayor* número de acontecimientos vitales estresantes que los individuos no deprimidos16 sino también porque, desde un punto de vista biológico, son )más reactivos* a los factores estresantes. De hecho, los resultados de un metaanálisis reciente indican que los pacientes con TDM presentan mayores niveles de cortisol después de la exposición a un estresor que los individuos sin depresión17. La hipótesis de que los portadores del alelo s son biológicamente más reactivos al estrés que los individuos homocigotos para el alelo l podrı́a explicar tanto el hallazgo de Caspi et al5 de una mayor probabilidad de desarrollar depresión frente a los acontecimientos estresantes entre los portadores s como el hallazgo de Kendler et al10 de la importancia de los acontecimientos que representan una escasa amenaza en la predicción del inicio de depresión. El presente estudio se diseñó en parte para examinar esta hipótesis. Para garantizar que tenı́amos participantes en el estudio que podrı́an llegar a desarrollar un episodio de depresión, evaluamos el genotipo y la reactividad al estrés en niñas en riesgo alto y bajo de este trastorno en virtud de la presencia o ausencia de antecedentes familiares de depresión recurrente18. En función de los estudios publicados que se acaban de revisar, predijimos que aquellas homocigotas para el alelo s del polimorfismo 5-HTTLPR manifestarı́an una producción de cortisol mayor y más prolongada como respuesta al estresor de laboratorio que aquéllas con uno o dos alelos l. Material y métodos Participantes Las participantes fueron 67 niñas de 9 – 14 años de edad sin trastorno actual o previo de eje I. De ellas, 42 niñas tenı́an madres biológicas sin trastorno actual o previo de eje I (hijas en bajo riesgo [CTL]), y 25 tenı́an madres biológicas con antecedentes de episodios recurrentes de TDM durante la vida de su hija (hijas en riesgo elevado). Las participantes se reclutaron a través de anuncios exhibidos en numerosos lugares de la comunidad local (por ejemplo a través de boletines en Internet, tablones de anuncios en la universidad y supermercados) y a través del Department of Psychiatry and Behavioral Sciences de la Standford University. Las respuestas de las madres a la entrevista telefónica proporcionaron la información de la selección inicial. Este cribado por teléfono estableció que tanto las madres como las hijas hablaban inglés con soltura y que las hijas tenı́an 9–14 años de edad. Dicha entrevista también se usó para identificar a las madres con probabilidades de no tener antecedentes psiquiátricos o de cumplir los criterios de depresión recurrente durante la vida de su hija, y las hijas con probabilidades de no presentar un trastorno psiquiátrico previo o actual. Se invitó a asistir al laboratorio para la administración de entrevistas más extensas a las parejas madre e hija, consideradas probablemente candidatas a la participación. Evaluación de la depresión y la psicopatologı́a Entrevistas Diferentes entrevistadores con experiencia administraron a todas las madres e hijas entrevistas clı́nicas estructuradas para ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 8 I.H. Gotlib et al / Psiq Biol. 2010;17(1):6–11 diagnosticar la presencia de, como mı́nimo, dos episodios diferentes de depresión en las madres TDM desde el nacimiento de sus hijas (structured clinical interview, [SCID, ‘entrevista clı́nica estructurada’] para el DSM-IV-TR)19 y la ausencia de psicopatologı́a durante la vida en las hijas (kiddie schedule for affective disorders and schizophrenia [K-SADS])20 y en las madres de control (SCID). Para evaluar el funcionamiento de las hijas se administró el K-SADS, tanto a las hijas como a las madres, y ambas informantes tenı́an que referir la ausencia de un trastorno de eje I previo o actual en la hija. Para evaluar la fiabilidad intervalorador, un valorador independiente con experiencia, enmascarado al miembro del grupo, evaluó aleatoriamente el 10% de entrevistas SCID y K-SADS-PL (versión Present and Lifetime). En todos los casos, los diagnósticos de episodios depresivos previos en las madres, ausencia de antecedentes de episodios depresivos en las madres y ausencia de trastorno de eje I actual o previo en las niñas se correspondieron con el diagnóstico establecido por el entrevistador original, k =1,00. Las participantes elegibles fueron invitadas a regresar al laboratorio al cabo de una semana de la entrevista para tomar parte en la tarea de estrés, y se obtuvieron muestras de saliva para los análisis de ADN. Cuestionarios Las hijas completaron la versión de 10 ı́tems del children’s depression inventory (CDI-S)21, una escala autoevaluada de sintomatologı́a depresiva para niños de 8–17 años de edad. Las madres completaron el Beck depression inventory-II (BDI)22, una escala autoevaluada de 21 ı́tems de la gravedad de los sı́ntomas depresivos. Inteligencia verbal Se administró a las hijas la sección de vocabulario de la subprueba verbal de la escala de inteligencia de Wechsler para niños, tercera edición23, para garantizar que cualquier diferencia de grupo como respuesta al estresor no estarı́a en función de las diferencias de la capacidad intelectual. Obtención de las muestras para análisis del cortisol y tarea de estrés Se solicitó a las participantes que no comieran ni bebieran nada (excepto agua) en la hora previa a su llegada al laboratorio y durante los procedimientos experimentales. Se las instruyó para que permanecieran en reposo y se relajaran durante 30 min. Se les permitió que leyeran revistas y escucharan música y se obtuvieron muestras de saliva justo antes de proporcionarles las instrucciones para la tarea. Acto seguido, se sometieron a una sesión de laboratorio, de 15 min de duración, durante la que un experimentador las sometió a estrés y, a intervalos regulares, se obtuvieron muestras de saliva para determinación del cortisol. Más especı́ficamente, las hijas completaron una tarea de sustracciones seriadas de 3 min, en la que se les proporcionaron instrucciones para que, empezando por 400, restaran de 7 en 7 con tanta rapidez y precisión como les fuera posible. Si cometı́an un error, el experimentador las interrumpı́a y les indicaba que volvieran a empezar. Se interrumpió a las hijas que se desenvolvieron con rapidez y facilidad a través del procedimiento y se les indicó que, empezando por 4.000, restaran de 17 en 17. Después de la tarea, se administró a las hijas la Ewart social competence interview, de 12 min24, una entrevista semiestructurada desarrollada para inducir estrés y excitación emocional en adolescentes, abordando detalles de las situaciones vitales estresantes. Durante el paradigma de estrés de laboratorio, de cada niña, se obtuvieron muestras de saliva utilizando Salivettess (Sarstedt, Nümbrecht, Alemania): una muestra inmediatamente antes de proporcionar las instrucciones para la tarea y tres a los 15, 30 y 45 min después del inicio del estresor. Estos tiempos de obtención de la muestra se basan en los hallazgos metaanalı́ticos que indican que la respuesta pico del cortisol tiene lugar 21–40 min después del inicio del estresor agudo y que el restablecimiento completo de los valores basales se produce al cabo de 41–60 min25. Después del estresor de laboratorio (es decir, durante la obtención de las dos muestras finales), las participantes visionaron una cinta de vı́deo neutra sobre el parque nacional de Denali. Como media, la primera muestra se obtuvo a las 12:15 de la tarde; los grupos no difirieron en las horas de obtención de las muestras, t (65)o1. Las muestras de saliva se almacenaron en un congelador de arcón hasta que se transportaron a un congelador a -20 1C, localizado en el General Clinical Research Center de la Standford University, donde se conservaron hasta que se efectuaron los radioinmunoanálisis. Las muestras se analizaron junto con las de control para el error interanálisis, y se incluyeron las muestras de control para evaluar la variabilidad. Se absorbió un mı́nimo de 2 ml de saliva lı́quida en un pequeño rollo de algodón y se exprimió a través de un tubo de plástico en un vial estéril (Salivettes Sarstedt sin el dispositivo de conservantes). El cortisol se analizó mediante reactivos de inmunoanálisis de luminiscencia usando el equipo comercial de Immuno-Biological Laboratories (Hamburgo, Alemania). Se estableció la sensibilidad del análisis en 0,015 mg/dl (o 0,414 nmol/l). En las tres muestras combinadas de saliva de los controles bajo, medio y alto, la variación intraanálisis se calculó como promedio en un 2,78, 10,45 y 4,79%, respectivamente. Los valores medios de los controles bajo, medio y alto fueron de 0,054, 0,228 y 0,863 mg/dl, respectivamente. Los coeficientes interanálisis de las variaciones de los controles bajo, medio y alto fueron de 10,9, 10,5 y 5,5%, respectivamente. Genotipificación Para genotipificar a las hijas, se obtuvo saliva utilizando el equipo Oragene (DNA Genotek, Ottawa, Ontario, Canadá), un sistema de )todo en uno* para la obtención, conservación, transporte y purificación del ADN de la saliva. El ADN extraı́do mediante este método es de calidad elevada y permite una elevada tasa de eficacia de la genotipificación26; de hecho, en nuestro laboratorio la producción de ADN es 20 mg. Para generar fragmentos de 484 bp o 528 bp se usaron los cebadores (iniciadores) de oligonucleótidos que flanqueaban la región polimórfica ligada a 5-HTT27 y las posiciones correspondientes al nucleótido -1.416 a 1.397 (stpr5, 50 -GGC GTT GCC GCT CTG AAT GC) y -910 a -888 (stpr3, 50 -GAG GGA CTG AGC TGG ACA ACC AC) de la región reguladora de flanqueo de 50 del gen 5-HTT. Los productos de la reacción en cadena de la polimerasa se sometieron a electroforesis a través de gel de poliacrilamida al 5% (cociente acrilamida/bisacrilamida9:1) a 60 V durante 60 min. Resultados Caracterı́sticas de las participantes En la tabla 1 se presentan las caracterı́sticas demográficas y clı́nicas de los grupos de alto riesgo (RIES) y CTL. No hubo diferencias significativas de grupo en la edad, t (65)o1, proporción de niñas posmenárquicas, x2 (1,67)o1, puntuaciones de vocabulario WISC, t (57) = 1,56, etnicidad, x2 (1,67)o1 o años de estudios de las madres, x2 (1,66) = 1,76, todas las p 40,05; el grupo CTL se caracterizó por un mayor porcentaje de madres casadas, x2 (1,66)= 12,58, p o0,01. El grupo de niñas RIES obtuvo ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. I.H. Gotlib et al / Psiq Biol. 2010;17(1):6–11 0,15 0,10 0,05 Toda la muestra (n.1) Bajo riesgo (n.1) Alto riesgo (n.1) s/s s/l l/l 19 34 14 11 20 11 8 14 3 m in 45 30 de de és és és pu es D pu es D Genotipo m re ta la de la de An te s Tabla 2 Recuentos de genotipo en los grupos de bajo y alto riesgo in 0,00 ta re a BDI: Beck depression inventory (II); CDI: children’s depression inventory; WISC: escala de inteligencia de Wechsler para niños. 0,20 a 12,16 (1,70) 55 43,52 (7,19) 72 44 72 3,04 (2,45) 9,08 (9,01) 51,29 (6,35) pu 11,76 (1,51) 43 44,10 (5,22) 81 85 85 1,13 (1,45) 2,41 (3,51) 48,23 (8,01) es Alto riesgo s/s s/l l/l 0,25 D Edad hija, media (DE) Pospuberales, % Edad madre, media (DE) Blancas, % Casadas, % Estudios universitarios, % Puntuación CDI hijas, media (DE) Puntuación BDI madre, media (DE) Puntuación WISC hija, media (DE) Bajo riesgo 0,30 Concentración media de cortisol (µg/dl ± EEM) Tabla 1 Información demográfica de las participantes de bajo y alto riesgo 9 Tiempos de obtención de las muestras puntuaciones ligera pero significativamente mayores en la CDI-S que las niñas CTL, t (61) =3,87, p o0,01; no obstante, es importante mencionar que en ambos grupos se identificó una puntuación muy inferior a la de corte recomendada de 821. Además, aunque no cumplieron los criterios diagnóstico de TDM actual, las madres de las niñas del grupo RIES obtuvieron puntuaciones significativamente más altas en el BDI II que las de las niñas del grupo CTL, t (62) =4,17, p o0,01. Por último, aunque ninguna de las madres tenı́a un diagnóstico actual de trastorno de eje I, además del TDM, 6 del grupo RIES habı́an recibido un diagnóstico de trastorno previo: 2 de trastorno obsesivocompulsivo, una de trastorno de estrés postraumático, una de trastorno de pánico y fobia social y una de fobia especı́fica/ bulimia nerviosa. Genotipo y riesgo de depresión En la tabla 2 se presentan las frecuencias del alelo 5-HTTLPR para los grupos de bajo y RIES. En las poblaciones de raza blanca la frecuencia del alelo s es de alrededor de 0,40; las frecuencias de genotipo se encuentran en equilibrio de Hardy-Weinberg. Aunque parece ser que una proporción mayor del grupo RIES que del CTL tienen como mı́nimo una copia del alelo s, ambos grupos de hijas no difirieron significativamente en su distribución de genotipo, x2 (2)= 1,91, p 40,05. En consecuencia, combinamos a las participantes en un grupo de bajo y RIES en el examen de los efectos del genotipo sobre la reactividad al estrés. Genotipo y reactividad al estrés En el perı́odo basal y durante la sesión de estrés, diversas muestras de saliva con valores atı́picos de cortisol sesgaron positivamente los datos, incluso después de la transformación logarı́tmica y de otro tipo. Por consiguiente, excluimos del análisis estas muestras con valores atı́picos. Estos se definieron como los valores 1,5 veces 4lı́mites intercuartil para un punto dado de la obtención de la muestra. Los datos se analizaron utilizando análisis de la varianza de diseño mixto con el grupo y el momento de obtención de la muestra como principales factores. Efectuamos un control para los efectos de la edad y los efectos de la hora del Figura 1. Reactividad al estrés por genotipo. dı́a en que se administró la tarea de estrés, al igual que para las variables demográficas y clı́nicasd. Los análisis adicionales se efectuaron utilizando un área incremental bajo la curva (AUCI), un ı́ndice que evalúa el aumento de los niveles hormonales desde el perı́odo basal en una serie de determinaciones31. Examinamos los patrones de reactividad al estrés en función del genotipo (fig. 1). Las hijas homocigotas para el alelo s mostraron un aumento pronunciado de la producción de cortisol durante y después de la exposición al estresor. En comparación, las hijas con al menos una copia del alelo l mostraron una ligera disminución de la producción de cortisol durante la sesión de estrés. Este patrón diferencial de respuesta se refleja en una interacción significativa del genotipo y el tiempo en la tendencia lineal, F (2,63)= 4,30, p o0,05, y en la tendencia cuadrática, F (2,63)=3,51, p o0,05. Lo que es más importante todavı́a, esta interacción siguió siendo significativa después de un control para el estado conyugal de la madre y las puntuaciones BDI, edades de las participantes y puntuaciones CDI, y hora del dı́a en la que se administró la tarea de estrés. Estas diferencias en la respuesta y restablecimiento del cortisol asociadas al genotipo están respaldadas adicionalmente por una diferencia significativa en el AUCI, un ı́ndice que evalúa el aumento de los niveles de cortisol desde el perı́odo basal en una serie de determinaciones31, F (2,63)=4,26, p o0,05, lo que refleja la elevada producción de cortisol como respuesta al estrés en las hijas homocigotas para el alelose. d Los tres grupos de genotipos no difirieron con respecto a las variables demográficas. Aunque no emparejamos los grupos especı́ficamente con respecto al momento del ciclo menstrual en el que se evaluó el cortisol, los tres grupos no difirieron con respecto a la proporción de niñas pre y posmenarquia, X2 (4,67)o 1, y los resultados de los estudios con seres humanos son desiguales con respecto a la posible asociación de la reactividad del cortisol con la fase del ciclo menstrual28–30. Dado que los 3 grupos tampoco difirieron con respecto a la hora del dı́a en la que se obtuvo la muestra para determinación del cortisol, F (2,63)o 1, es poco probable que el momento de evaluación durante el ciclo menstrual pueda explicar las diferencias en su reactividad entre los tres grupos de genotipos. e Recientemente, se ha encontrado que las variantes funcionales del alelo l, designadas como lA y lG confieren niveles diferentes de expresión del gen transportador: los alelos lG y s parecen tener niveles comparables de expresión del gen transportador de serotonina, y en ambos los niveles son más bajos que en el alelo lA32,33. Decidimos conducir nuestro análisis principal clasificando a las participantes en tres grupos genéticos basados en los alelos s y l, con independencia de los subtipos lA y lG (es decir, l/l, l/s y s/s) porque pocos estudios hasta la fecha han investigado los subtipos de l y, por lo tanto, este análisis permite ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 10 I.H. Gotlib et al / Psiq Biol. 2010;17(1):6–11 Discusión El patrón de hallazgos descrito en el presente estudio proporciona tanto una explicación para los resultados de los estudios que documentan asociaciones entre el genotipo, exposición al estrés y probabilidad de depresión como una extensión de los conocimientos sobre la relación entre el polimorfismo 5-HTTLPR y la reactividad al estrés. Desde hace décadas, los investigadores saben que la exposición a estresores vitales de gravedad aumenta la probabilidad de depresión posterior35. Sin embargo, también sabemos que muchos individuos que experimentan estrés vital no desarrollan la enfermedad. Aborda este problema un número creciente de estudios publicados que, entre individuos con al menos una copia del alelo s del polimorfismo 5-HTTLPR con la exposición creciente a acontecimientos vitales estresantes, demuestran mayores tasas de depresión que entre aquéllos que son homocigotos para el alelo l. En particular, Kendler et al10 encontraron que los individuos con dos copias del alelo s tuvieron más probabilidades que aquéllos con dos alelos l de experimentar depresión como respuesta a )acontecimientos habituales, poco amenazadores*. Aunque, en función de estos datos, estos autores formularon la hipótesis de que este polimorfismo genético produce una mayor sensibilidad a la influencia de los acontecimientos estresantes que, a su vez, aumenta la probabilidad de depresión, no pudieron examinar explı́citamente esta hipótesis con sus datos. Los hallazgos presentados en este artı́culo demuestran por primera vez en una muestra de individuos jóvenes que la reactividad al estrés biológico podrı́a ser un mecanismo decisivo subyacente de la asociación entre el gen transportador de la serotonina y la exposición a acontecimientos estresantes en el aumento del riesgo de depresión36. Aunque los investigadores han reconocido la relación entre el sistema serotoninérgico y la depresión, solo recientemente han prestado tención a la relación entre la serotonina y el estrés. De hecho, en la actualidad, varias lı́neas de evidencia sugieren que el sistema serotoninérgico desempeña un importante papel en la regulación de la actividad del eje HHA. Por ejemplo, los investigadores han documentado la participación de la neurotransmisión serotoninérgica tanto en la activación como en el retrocontrol del eje37. Más especı́ficamente, en animales, los investigadores han demostrado que la serotonina activa el eje estimulando el factor liberador de corticotropina, lo que desencadena la liberación de ACTH, y estimula la secreción de corticoesteroides38. Se ha encontrado que la serotonina aumenta el retrocontrol negativo del cortisol. Además, como ya hemos mencionado previamente, los ratones sin el gen del transportador de la serotonina manifiestan un aumento de la respuesta del eje HHA al estrés agudo9. Por último, Barr et al39 examinaron la influencia interactiva de la variación en la región promotora del gen transportador de la serotonina y una condición de crianza en las respuestas endocrinas al estrés en crı́as de macacos rhesus. (footnote continued) las comparaciones con un número mayor de estudios publicados. No obstante, también clasificamos a las participantes en tres grupos que se acoplaban más estrictamente a los niveles de expresión de 5-HTT: 1) individuos heterocigotos para el alelo largo que confiere la mayor expresión del gen transportador de 5-HT (expresión elevada: lA/lA); 2) individuos con una copia del alelo s o una expresión reducida del alelo largo y una copia del alelo lA (lA/s o lA/lG) y 3) individuos con dos copias del alelo s o un alelo s y la expresión reducida del alelo largo (baja expresión: s/s o s/lG). Se ha documentado que el alelo lG se comporta de modo comparable al alelo s de baja expresión34. Los resultados del análisis de la reactividad al estrés con esta agrupación son comparables a los documentados en el presente estudio: una interacción significativa grupo por tiempo en la tendencia lineal, F (2,61)= 5,93, po 0,01, y, en la tendencia cuadrática, F (2,61)= 3,69, p o0,05. A partir del primer autor del presente estudio está disponible un gráfico de esta interacción. Estos investigadores encontraron que los animales con una copia del alelo s criados por otros animales presentaron mayores niveles de ACTH durante la separación que tanto los animales l/l como aquellos con un alelo s criados por la madre, lo que indica que la variación del gen transportador de la serotonina afecta a la actividad del eje HHA y que la influencia de 5-HTTLPR en las respuestas hormonales durante el estrés está modulada por la experiencia precoz. Merece la pena mencionar que, en el presente estudio, aunque las hijas portadoras del alelo s/l y l/l en los polimorfismos fueron menos reactivas al estrés que las homocigotas portadoras del alelo s, no difirieron significativamente entre sı́; es decir, las hijas s/l no fueron más reactivas que las l/l. En general, en los estudios sobre la interacción del genotipo con los antecedentes de estrés vital de gravedad se ha encontrado una función escalonada, en la que ser portador de un alelo s se asocia con mayor riesgo de depresión que poseer dos alelos l, y ser homocigoto para el alelo s confiere el mayor riesgo5. La presente investigación es el primer estudio que examina los niveles de cortisol como respuesta a un estresor de laboratorio en función del genotipo. En comparación con los acontecimientos vitales graves acumulativos, podrı́a ser que un estresor individual de laboratorio fuera demasiado leve, transitorio y circunscrito para desencadenar la producción de cortisol en individuos l/l y s/l pero suficiente para provocar una respuesta entre las participantes portadoras de s/s. Por esta razón, en individuos que son homocigotos para el alelo s el umbral para la producción de cortisol como respuesta al estrés podrı́a ser más bajo que en los demás. De hecho, esta hipótesis coincide con el hallazgo de Kendler et al10 de que los individuos con dos copias del alelo s tuvieron más probabilidades de experimentar depresión como respuesta a lo que consideraban )acontecimientos habituales, poco amenazadores*. Para examinar esta hipótesis más explı́citamente, serı́an inestimables estudios diseñados para manipular de modo paramétrico el nivel de estrés. Como conclusión, en este estudio hemos demostrado que la reactividad biológica al estrés es un mecanismo verosı́mil que es la base de la asociación entre el genotipo y la exposición al estrés vital en la predicción del inicio de la depresión. Un notable punto fuerte en este estudio es que los resultados no están confundidos por los antecedentes de depresión; de hecho, ninguna de las participantes habı́a experimentado un trastorno previo de eje I. Será importante seguir a esta muestra para examinar la utilidad del genotipo, los antecedentes familiares y la reactividad al estrés en la predicción del desarrollo del trastorno. Los resultados del presente estudio destacan la importancia de la relación entre el polimorfismo 5-HTTLPR y el funcionamiento del eje HHA en la inducción de un trastorno emocional. Por lo tanto, es decisivo que los investigadores continúen trabajando para dilucidar la naturaleza de esta asociación de modo que podamos desarrollar programas y procedimientos que prevengan la incidencia de enfermedades psiquiátricas en los individuos en alto riesgo. Financiación La presente investigación se financió con becas de la National Alliance for Research in Schizophrenia and Affective Disorders y el National Institute of Mental Health (MH74849). Los autores desean expresar su agradecimiento a Kirsten Gilbert por su ayuda en el reclutamiento y organización de las participantes en el estudio. Conflicto de intereses Los autores declaran no tener ningún conflicto de interés. ARTICLE IN PRESS Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. I.H. Gotlib et al / Psiq Biol. 2010;17(1):6–11 Bibliografı́a 1. Gotlib IH, Hammen CL, editors. Handbook of Depression. New York: Guilford Press; 2002. 2. Levinson DF. The genetics of depression: A review. Biol Psychiatry. 2006;60:84–92. 3. Firk C, Markus CR. Serotonin by stress interaction: A susceptibility factor for the development of depression? J Psychopharmacol. 2007 doi:10.1016/ j.psiq.2010.01.002. 4. Lesch KP, Bengel D, Heils A, Sabol SZ, Greenberg DB, Petri S. Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region. Science. 1996;274:1527–31. 5. Caspi A, Sugden K, Moffitt TE, Taylor A, Craig IW, Harrington H, et al. Influence of life stress on depression: Moderation by a polymorphism in the 5-HTT gene. Science. 2003;301:386–9. 6. Kim J-M, Stewart R, Kim S-W, Yang S-J, Shin I-S, Kim Y-H, et al. Interactions between life stressors and susceptibility genes (5-HTTLPR and BDNF) on depression in Korean elders. Biol Psychiat. 2007 doi:10.1016/ j.psiq.2010.01.002. 7. Zalsman G, Huang YY, Oquendo MA, Burke AK, Hu XZ, Brent DA. Association of a triallelic serotonin transporter gene promoter region (5-HTTLPR) polymorphism with stressful life events and severity of depression. Am J Psychiatry. 2006;163:1588–93. 8. Kaufman J, Yang BZ, Douglas-Palumberi H, Houshyar S, Lipschitz D, Krystal JH, et al. Social supports and serotonin transporter gene moderate depression in maltreated children. Proc Natl Acad Sci U S A. 2004;101:17316–21. 9. Li Q, Wichems C, Heils A, Van de Dar LD, Lesch K-P, Murphy DL. Reduction of 5-HT1A binding sites in 5-HT transporter knockout mice. J Pharmacol Exp Ther. 1999;291:999–1007. 10. Kendler KS, Kuhn JW, Vittum J, Prescott CA, Riley B. The interaction of stressful life events and a serotonin transporter polymorphism in the prediction of episodes of major depression. Arch Gen Psychiatry. 2005;62:529–35. 11. Hariri AR, Drabant EM, Munoz KE, Kolachana BS, Mattay VS, Egan MF. A susceptibility gene for affective disorders and the response of the human amygdala. Arch Gen Psychiatry. 2005;62:146–52. 12. Pezawas L, Meyer-Lindenberg A, Drabant EM, Verchinski BA, Munoz KE, Kolachana BS. 5-HTTLPR polymorphism impacts human cingulate- amygdala interactions: A genetic susceptibility mechanism for depression. Nature Neurosci. 2005;8:828–34. 13. Federenko IS, Nagamine M, Hellhammer DH, Wadhwa PD, Wüst S. The heritability of hypothalamus pituitary adrenal axis responses to psychosocial stress is context dependent. J Clin Endocrinol Metab. 2004;89:6244–50. 14. Parker KJ, Schatzberg AF, Lyons DM. Neuroendocrine aspects of hypercortisolism in major depression. Horm Behav. 2003;43:60–6. 15. Sapolsky RM. The possibility of neurotoxicity in the hippocampus in major depression: A primer on neuron death. Biol Psychiatry. 2000;48:755–65. 16. Hammen CL. Stress and depression. Ann Rev Clin Psychology. 2005;1:293–319. 17. Burke HM, Davis MC, Otte C, Mohr DC. Depression and cortisol responses to psychological stress: Ameta-analysis. Psychoneuroendocrinology. 2006;30:846–56. 18. Williamson D, Birmaher B, Axelson D, Ryan N, Dahl R. First episode of depression in children at low and high familial risk for depression. J AmAcad Child Psychiatry. 2004;43:291–7. 19. First MB, Gibbon M, Spitzer RL, Williams JBW. Structured Clinical Interview for DSM-IV Axis I Disorders: Clinician Version. Washington, DC: American Psychiatric Press; 1997. 11 20. Kaufman J, Birmaher B, Brent D, Rao U, Flynn C, Moreci P, et al. K-SADS-PL: Initial reliability and validity data. J Am Acad Child Adol Psychiatry. 2000;39:980–8. 21. Kovacs M. The Children’s Depression Inventory Manual. New York: MultiHealth Systems; 1992. 22. Beck AT, Steer RA, Brown GK. Manual for the Beck Depression Inventory—II. San Antonio, TX: Psychological Corporation; 1996. 23. Wechsler D. WISC-III: Wechsler Intelligence Scale for Children—3rd Edition Manual. San Antonio TX: Psychological Corporation; 1991. 24. Ewart CK, Jorgensen RS, Suchday S, Chen E, Matthews KA. Measuring stress resilience and coping in vulnerable youth: The Social Competence Interview. Psychol Assess. 2002;14:339–52. 25. Dickerson SS, Kemeny ME. Acute stressors and cortisol responses: A theoretical integration and synthesis of laboratory research. Psychol Bull. 2004;130:355–91. 26. Rylander-Rudqvist T, Hakansson N, Tybring G, Wolk A. Quality and quantity of saliva DNA obtained from the self-administrated Oragene method: A pilot study on the cohort of Swedish men. Cancer Epidemiol Biomarkers Prev. 2006;15:1742–5. 27. Heils A, Teufel A, Petri S, Stöber G, Riederer P, Bengel D, et al. Allelic variation of human serotonin transporter gene expression. J Neurochem. 1996;66:2621–4. 28. Marinari KT, Leshner AI, Doyle MP. Menstrual cycle status and adrenocortical reactivity to psychological stress. Psychoneuroendocrinology. 1976;1:213–8. 29. Abplanalp JM, Livingston L, Rose RM, Sandwisch D. Cortisol and growth hormone responses to psychological stress during the menstrual cycle. Psychosom Med. 1977;39:158–77. 30. Kirschbaum C, Kudielka BM, Gaab J, Schommer NC, Hellhammer DH. Impact of gender, menstrual cycle phase, and oral contraceptives on the activity of the hypothalamus-pituitary-adrenal axis. Psychosom Med. 1999;61:154–62. 31. Pruessner JC, Kirschbaum C, Meinlschmid G, Hellhammer DH. Two formulas for computation of the area under the curve represent measures of total hormone concentration versus time-dependent change. Psychoneuroendocrino. 2003;28:916–31. 32. Neumeister A, Hu XZ, Luckenbaugh DA, Schwarz M, Nugent AC, Bonne O. Differential effects of 5-HTTLPR genotypes on the behavioral and neural responses to tryptophan depletion in patients with major depression and controls. Arch Gen Psychiatry. 2006;63:978–86. 33. Wendland JR, Martin BJ, Kruse MR, Lesch KP, Murphy DL. Simultaneous genotyping of four functional loci of human SLC6A4, with a reappraisal of 5HTTLPR and rs25531. Mol Psychiatry. 2006;11:224–6. 34. Hu X, Oroszi G, Chun J, Smith TL, Goldman D, Schuckit MA. An expanded evaluation of the relationship of four alleles to the level of response to alcohol and the alcoholism risk: Neurobiological, behavioral, and environmental relations to drinking. Alcohol Clin Exp Res. 2005;29:8–16. 35. Brown G, Harris T. Social Origins of Depression. London: Tavistock; 1978. 36. Porter RJ, Gallagher P, Watson S, Young AH. Corticosteroid-serotonin interactions in depression: A review of the human evidence. Psychoneuroendocrino. 2004;173:1–17. 37. O’Hara R, Schroder CM, Mahadevan R, Schatzberg AF, Lindley S, Fox S, et al. Serotonin transporter polymorphism, memory and hippocampal volume in the elderly: Association and interaction with cortisol. Mol Psychiatry. 2007;12:544–55. 38. Fuller RW. Serotonin receptors involved in regulation of pituitaryadrenocortical function in rats. Behav Brain Res. 1996;73:215–9. 39. Barr CS, Newman TK, Shannon C, Parker C, Dvoskin RL, Becker ML, et al. Rearing condition and rh5-HTTLPR interact to influence limbichypothalamicpituitary-adrenal axis response to stress in infant macaques, 2004.