Documento 526184
Anuncio

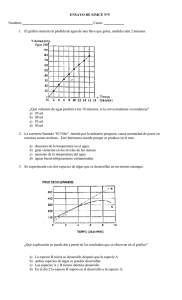
INSTITUTO ABDÓN CIFUENTES SAN FELIPE Prof. Jenny Arévalo Salgado QUÍMICA ELECTIVO 3º MEDIO I. 1a) b) c) LABORATORIO TERMOQUIMICA Determinar la entalpía de combustión de algunos combustibles ej. (etanol, parafina, petróleo, metanol ) Determinar la capacidad calorífica del calorímetro. Medir el calor liberado por una masa conocida de combustible. Calcular el calor de reacción o poder calorífico del combustible. Procedimientos a) Medir exactamente 400 ml de H2O corriente con una probeta y vertirla a un vaso de pp de 500 ml. b) Medir y anotar la T del H2O. c) Pesar el mechero de vidrio con su contenido. Anotar. d) Montar el experimento. e) Agitar el H2O suavemente con el termómetro hasta que se produzca un aumento del T del orden de 10º C. Anotar el valor exacto. Ej. 9,5 ; 10,8º C, etc. f) Apagar rápidamente el mechero y pesarlo nuevamente con su contenido. g) Este procedimiento se efectúa tres veces, cambiando siempre el agua y limpiando el hollín del vaso. Materiales. Balanza , termómetro; vaso de pp 500 ml ; probeta ; mechero de vidrio ; trípode ; combustibles. CUESTIONARIO. a) Determinación de la capacidad calorífica del calorímetro. Se utiliza acetona como patrón, cuyo H de combustión es de 30767 J/gr. Al quemar la acetona se liberan (m) gr x 30767 J/g, los cuáles son absorbidos por el calorímetro. b) CAPACIDAD CALORÍFICA = m ( gr ) x 30767 J / gr T ( ºC ) Cálculo del calor liberado por el combustible. en J / ºC Calor liberado por combustible = Calor absorbido por calorímetro. c) Cálculo del H de combustión: H combustión = calor liberado J ( J / gr ) Masa de combustible quemado H comb = calor liberado J . P M gr / mol m/gr en J / mol. d) Compare los valores de H obtenidos y determine cuál es el mejor combustible en cuanto a poder calorífico. e) Busque los valores bibliográficos y compárelos. II. LEY DE LA ADITIVIDAD DEL CALOR DE HESS. INTRODUCClÓN: En toda reacción química hay de alguna manera asociado a ella un tipo de energía, en otras palabras, todo cambio químico a asociado a un cambio energético. Este cambio generalmente se manifiesta de calor, y cuando se mide la cantidad de energía asociada a un cambio químico, lo que se mide son los efectos que causa tal cantidad de calor. En el presente experimento, trataremos de demostrar que la cantidad de energía total asociada a un cambio químico es igual a la suma de las energías parciales que conforman dicho cambio (Ley de Hess) OBJETIVO: Comprobar experimentalmente la Ley de Actividad del Calor de Hess. MATERIALES Y REACTIVOS 2 matraces Erlenmeyer de 250 ml; 1 vaso de pp de 100 ml; 1 termómetro 0 – 100°C balanza sensibilidad 0,l gr. - 1 probeta de 100 ml, vidrio de reloj - hidróxido de sodio ácido clorhídrico. ACTIVIDADES REACCIONES I: Pese un matraz, luego agregue l00 ml de H 2O destilada, pese el matraz y su contenido y mida la temperatura, anote sus datos en la tabla N 1. Pese 2 gr. de NaOH aproximadamente Y agréguelos al matraz, agite lentamente con el termómetro y registre la máxima temperatura alcanzada. REACCIÓN II: Pese un matraz. luego agregue 100 ml de H Cl (0,25 mol/L, pese el matraz y su contenido, mida la temperatura y registre los datos obtenidos. Pese aproximadamente 2 gr. de NaOH y agréguelos a la solución. Agite y registre la máxima temperatura alcanzada en la disolución. 1 REACClÓN III: Pese un matraz, luego agregue 50 ml de HCI 0,5 mol/L, pese el matraz y su contenido. Prepare 50 ml, de NaOH 0,5 mol/L. Espere que las temperaturas de las soluciones sean iguales y proceda a mezclar. Registre la máxima temperatura alcanzada. C=Q/m t Qt = Qu + Qd Donde: Qt = cantidad de calor Qu = cantidad de calor absorbido Qd = calor de disolución m = masa t = variación de temperatura C = calor específico calor específico vidrio 0,2 cal/ C gr. agua : 1 cal/gr. C REACCIÓN I REACCIÓN II REACCIÓN III Masa matraz _________ Masa matraz _________ Masa H O _________ Masa HCI _________ Masa NaOH _________ Masa NaOH _________ TH O _________ Temperatura HCl _________ T máxima _________ T Máxima _________ Variación de T _________ Variación de T _________ Masa matraz _________ Masa solución HCl _________ Masa solución NaOH _________ T HCl _________ T Na OH _________ T mezcla _________ Variación de T _________ CUESTIONARIO l. Representa por medio de ecuaciones químicas cada una de las reacciones. 2. Para cada una de las reacciones determine la cantidad de calor asociada a un mol de NaOH. 3. Escriba la ecuación para cada reacción, indicando en cada caso la cantidad de calor liberado. 4. ¿ Por qué es necesario esperar que la temperatura de ambas soluciones sean iguales antes de realizar la mezcla en la reacción III? 5. A partir de los datos obtenidos ¿cómo se puede demostrar la Ley de Hess? 6. Qué conclusiones puede Inferir a partir de sus resultados? III. RELACION ENTRE REACCION QUIMICA Y ENERGIA INTRODUCCION La guía experimental pretende destacar a través de algunas actividades, que la energía, capacidad para realizar un trabajo, está presente en toda reacción química ya sea en forma de energía calórica, luminosa, eléctrica. Existen reacciones que absorben energía, denominadas Reacciones Endergónicas y otras que liberan energía llamadas Reacciones Exergónicas. Se pretende lograr con esta experiencia que el alumno sea capaz de relacionar las reacciones químicas como fuente de energía con situaciones de la vida diaria, tales como fotosíntesis, respiración, transformación de los alimentos en el organismo, combustiones, erupciones volcánicas, etc. OBJETIVOS ESPECIFICOS Al final del experimento el alumno será capaz de: l. Reconocer que hay reacciones que liberan energía calórica, luminosa o eléctrica y que hay reacciones que absorben esos mismos tipos de energía. 2. Comprobar que existen reacciones exergónicas que necesitan energía de activación. MATERIALES Mechero seis tubos de ensayo, gradilla espátula pajuela de escoba vaso de precipitado de 100 mL ampolleta de 1,5 volts batería de 9 volts pipeta parcial alambre de timbre 2 barras de grafito manguera transparente (30 cm) soporte universal ácido nítrico concentrado ácido sulfúrico concentrado alcohol etílico cobre en láminas magnesio en cintas permanganato de potasio clorato de potasio dióxido de manganeso nitrato de plata yoduro de potasio agua destilada cloruro de sodio fenoftaleína y almidón 2 PROCEDIMIENTO EXPERIMENTAL Parte I a. Coloque un tubo de ensayo en una gradilla, agregue 1 mL de ácido nítrico concentrado, con los dedos toque las paredes del tubo. Enseguida introduzca 1 trocito de cobre, en plena reacción toque con cuidado nuevamente las paredes del tubo. Anote las observaciones. b. Coloque con sumo cuidado en un tubo de ensayo 1 mL de ácido sulfúrico concentrado v agregue lentamente por las paredes 1 mL de alcohol etílico y por último algunos cristales (punta de espátula) de permanganato de potasio. Observe y anote. c) Coloque en un vaso de precipitado 50 mL de ácido sulfúrico diluido (1:6 v/v), enseguida introduzca una lámina de cobre y un trozo de cinta de magnesio en espiral conectados ambos metales con alambre de timbre a una ampolleta de 1,5 volts. Anote sus observaciones. Parte II a. Introduzca 10 mL de solución de nitrato de plata en un tubo de ensayo. Agregue 1 mL de solución de cloruro de sodio. Reparta el contenido del tubo en dos tubos de ensayo. Deje uno de ellos expuesto a la luz y el otro en la oscuridad (envuélvalo en papel calco). Después de 20 minutos observe y anote. c. Prepare una solución acuosa de ioduro de potasio y llene con ella un trozo de manguera en forma de U. Agregue en uno de los extremos de la manguera 5 gotas de solución de fenoftaleína. Anote sus observaciones. Luego, agregue en el otro extremo 5 gotas de solución de almidón. Observe. Lave muy bien la manguera y llénela otra vez de solución de ioduro de potasio. Por cada extremo de ella sumerja sendas barras de grafito conectadas mediante alambre de timbre a una batería de 9 volts, Después de 3 minutos retire las barras. Agregue 5 gotas de solución de fenoftaleína en el polo negativo y 5 gotas de solución de almidón en el polo positivo. Observe y anote. Parte III Existe un grupo de reacciones exergónicas que necesita de un aporte inicial de energía para comenzar y luego continuar por sí solas. Sobre un trípode con rejilla coloque en una tapa metálica una punta de espátula de clorato de potasio y otra de azúcar. Caliente a la llama un alambre sostenido con una pinza de madera y cuando está al rojo vivo toque con él la mezcla y apenas se inflame apártelo de la misma. 3 CUESTIONARIO Parte I a. ¿Qué observó? b. ¿Hay absorción o liberación de energía? c. ¿Cómo llamaría a la energía que se manifiesta en esta reacción? d. ¿Qué tienen en común las reacciones? e. ¿Qué es una reacción exergónica? Parte II a) ¿Hubo reacción? b) ¿Absorbe o libera energía cada reacción? c) ¿Qué forma de energía requieren? d) ¿Qué tienen en común las tres reacciones" e) ¿Qué es una reacción endergónica? Parte III a) ¿Qué necesita la reacción para comenzar? b) ¿Una vez que se retira el alambre, sigue la reacción? c) ¿Hay liberación de energía? d) ¿Qué es una reacción exergónica con energía de activación? e) ¿Cómo clasificaría las reacciones químicas teniendo en cuenta las distintas formas de energía? BIBLIOGRAFIA R. Espinosa, T. Meruane y A. Labarca, "Química Texto Guía para el Profesor, Primer Año de Enseñanza Media". Ed. Universitaria, Santiago de Chile, 1970, pp. 20-22, 36-42 IV. GUIA DE LABORATORIO N° 1 CONCEPTOS BÁSICOS DE TERMODINAMICA Y REACTIVIDAD QUIMICA TERCERO MEDIO ELECTIVO Este laboratorio corresponde a una evaluación coef. 2 (DE UNA SERIE DE LABORATORIOS AL MENOS 2), siga las indicaciones y responda todas las preguntas que se le realizan en esta guía y trasládelas al informe que debe entregar en la fecha que la profesora le asignará. MATERIALES QUE DEBE TRAER DE CASA: Un trozo de poliestireno (espuma expandida) (tamaño para envolver un matraz) Un trocito de papel de aluminio (tamaño para cubrir la yema de un dedo) Paño de limpieza Fosforos Mascarilla Hielo (cantidad una taza grande) Hojas cuadriculadas para confeccionar informe y responder preguntas 1. Discutir conceptos termodinámicos elementales y aplicarlos a situaciones simples: Introducción: idea de que la termodinámica es una disciplina de naturaleza general, que es aplicable al estudio de los cambios que ocurren en una amplia variedad de sistemas y situaciones. Procedimiento: a) Ponga en el mesón de trabajo tres matraces con 50 mL de agua cada uno, luego a uno de ellos ponle un tapón, al segundo también ponle un tapón y además cúbrelo con un trozo de espuma expandida, el tercero permanece igual. Ahora observa y discute con tus compañeros realizando las anotaciones acerca de : clasificar y caracterizar, de acuerdo a los intercambios de materia y energía entre el sistema y su entorno, los sistemas propuestos como cerrado, abierto y aislado. 2. Indagar acerca de cómo distinguir entre un sistema aislado y no aislado, para lo cual se realizan experimentos simples: Experimento 1: Distinción entre un sistema aislado y otro sin aislar: Procedimiento: 1. Verter en dos vasos la misma cantidad de agua a 60-70 ° C. Uno de los vasos está aislado con una lámina de poliestireno, espuma, corcho u otro material aislante, y el otro sin aislar. Insertar un termómetro en el líquido contenido en cada uno de los recipientes. 4 2. 3. 4. 5. 6. 7. Predecir lo que esperan observar cuando se mide la temperatura a distintos tiempos. Medir la temperatura del agua luego que ha transcurrido un par de minutos (tiempo “cero”) y luego cada 5 minutos, agitando primero brevemente el líquido. Anotar. Tabular sus mediciones y debatir acerca de sus observaciones e intentar explicarlas. Después de 15 minutos interrumpir las mediciones y las analizan. Contrastar los resultados obtenidos con sus predicciones e intentar explicarlas. Tratar de fundamentar por qué se esperó un par de minutos luego de verter el agua en los vasos, antes de comenzar a realizar las mediciones. ¿Qué hubiese sucedido si se midiera la temperatura en forma inmediata? ¿Sería acertado proceder así? ¿Por qué? 3. Efecto de una pared aislante sobre la transmisión del calor. Procedimiento: 1. Se protegen la yema del dedo índice con un trozo de una lámina delgada de poliestireno expandido o espuma de poliuretano y tocan un vaso de precipitados con agua a 80-90°C. 2. Cuidadosamente, tocar el vaso por un instante muy breve con el dedo sin proteger. Discutir lo siguiente ¿Qué concluyen? ¿A qué se debe la diferencia observada? ¿Sería lo mismo proteger el dedo con papel de aluminio? ¿Qué característica diferencia al metal de esos materiales? Anotar. 3. Proponer diversos sistemas, definir sus características y las del entorno correspondiente a cada uno de aquéllos y clasificarlos como cerrados, aislados o abiertos. 4. Explicar el significado preciso de esos conceptos y que esta clasificación se basa en las propiedades del límite o pared del sistema. 5. Dar ejemplos de procesos e intentar caracterizarlos en relación al cambio de algunas de las propiedades del sistema. Anotar 6. Enumerar las propiedades que permiten caracterizar un sistema cualquiera. Anotar 4. Definición del estado termodinámico de un sistema en términos de sus propiedades. Procedimiento: 1. Disponer un vaso graduado de 250 mL con una cierta masa de agua (por ej. 125 g) a temperatura ambiente. 2. Disolver en el agua 0,5 g de sal común. 3. Determinar la temperatura y volumen de la solución. Anotar 4. Luego calentar hasta aproximadamente 60oC y determinan nuevamente su temperatura y volumen. ¿cuál es el sistema? 5. Determinar las propiedades que especifican los estados inicial y final del sistema y el proceso a que éste fue sometido. 6. Debatir en torno al asunto tratando de determinar cuál es la temperatura, presión, volumen y concentración de la solución. 7. Realizar dibujos, indicando los valores de estas propiedades. 8. Determinar la masa de unos 25 g de hielo (con una precisión de 0,1 g) y agregarlo a la solución. Una vez que el sólido ha fundido por completo, agitar y determinar el valor de las variables que especifican el estado del nuevo sistema (P, V, T, c). 9. Indagar sobre el proceso que ha tenido lugar luego de la adición del trozo de hielo. ¿Qué propiedades han cambiado? ¿Ha variado la concentración de la solución? ¿Por qué? Otros ejemplos, responder: 10. Una ampolla de vidrio sellada con alcohol en su interior, ¿qué tipo de sistema es? 11. ¿Qué tipo de sistema es un vaso de agua? 12. ¿Cuál es el entorno del sistema solar? 13. Si se perfora un recipiente metálico cerrado que contiene un líquido, ¿en qué tipo de sistema se convierte? 14. ¿Es el cuerpo humano un sistema aislado, cerrado o abierto? ¿Cuál es su entorno?: 15. ¿Cuál será el proceso que ocurre a un trozo de hierro a temperatura ambiente, cuando se introduce en la hielera que se encuentra a -10 o C? 16. ¿Qué proceso ocurre cuando se coloca un cristal de sulfato de cobre en agua? (Si es posible, realizan el experimento en un tubo de ensayo, utilizando un pequeño cristal de CuSO4 x 5H2O). 17. ¿Cuáles son los estados inicial y final, y cuál es el proceso que ha tenido lugar? 18. Qué le sucede, respecto del volumen, a un líquido cuando se calienta? 19. ¿Cómo podrían demostrar experimentalmente el efecto que predicen? (recuerden, por ejemplo, en qué se basa el uso del termómetro). 20. 21. 22. 23. Es importante que noten que en estos experimentos la única variable cuyo valor se mantiene constante es la presión a la que está sometido el sistema, que es aproximadamente una atmósfera. Esto no es siempre así, para lo cual consideraremos otras situaciones, por ejemplo, las siguientes: • El aire en el interior de un neumático. • El butano en un cilindro de gas licuado. • El agua a ebullición contenida en una olla a presión. • Agua contenida en un recipiente abierto ubicado sobre la cima del monte Aconcagua. Expliquen cada una de ellas. Este Trabajos también incluye la índole valórica, por ejemplo, sobre la importancia de la termodinámica para el ser humano. Responda: a. - ¿En qué ámbito se aplica? b. - ¿Para qué sirve? 5 c. - ¿En qué profesiones u oficios es importante saber termodinámica? d. - ¿A qué problemas ambientales se puede aplicar preferentemente la termodinámica? 6