Tema 4: La Estratosfera λσχ λ λφ=λ ,,z q j
Anuncio
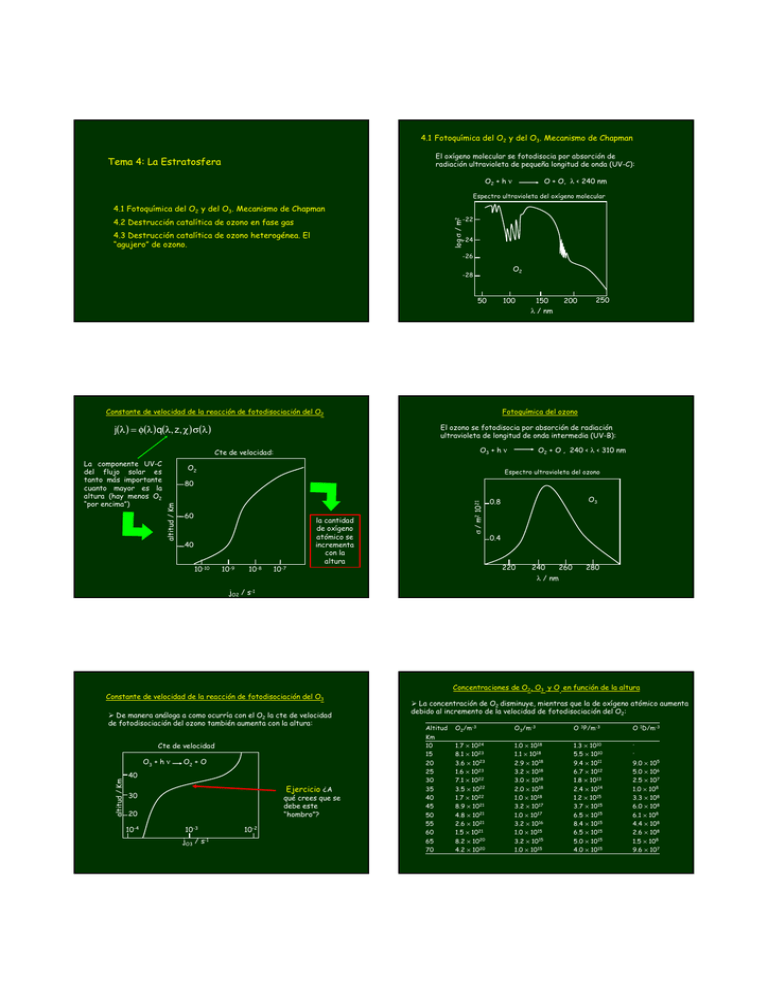
4.1 Fotoquímica del O2 y del O3. Mecanismo de Chapman El oxígeno molecular se fotodisocia por absorción de radiación ultravioleta de pequeña longitud de onda (UV-C): Tema 4: La Estratosfera O2 + h ν O + O, λ < 240 nm Espectro ultravioleta del oxígeno molecular 4.1 Fotoquímica del O2 y del O3. Mecanismo de Chapman log σ / m2 -22 4.2 Destrucción catalítica de ozono en fase gas 4.3 Destrucción catalítica de ozono heterogénea. El “agujero” de ozono. -24 -26 O2 -28 50 100 Constante de velocidad de la reacción de fotodisociación del O2 j(λ ) = φ(λ ) q(λ, z, χ ) σ(λ ) 200 250 Fotoquímica del ozono El ozono se fotodisocia por absorción de radiación ultravioleta de longitud de onda intermedia (UV-B): O3 + h ν Cte de velocidad: O2 O2 + O , 240 < λ < 310 nm Espectro ultravioleta del ozono 60 σ / m2 1021 80 altitud / Km La componente UV-C del flujo solar es tanto más importante cuanto mayor es la altura (hay menos O2 “por encima”) 150 λ / nm la cantidad de oxígeno atómico se incrementa con la altura 40 10-10 10-9 10-8 O3 0.8 0.4 220 10-7 240 260 280 λ / nm jO2 / s-1 Concentraciones de O2, O3 y O en función de la altura Constante de velocidad de la reacción de fotodisociación del O3 De manera análoga a como ocurría con el O2 la cte de velocidad de fotodisociación del ozono también aumenta con la altura: Cte de velocidad altitud / Km O3 + h ν O2 + O 40 Ejercicio ¿A qué crees que se debe este “hombro”? 30 20 10-4 10-3 jO3 / s-1 10-2 La concentración de O2 disminuye, mientras que la de oxígeno atómico aumenta debido al incremento de la velocidad de fotodisociación del O2: Altitud Km 10 15 20 25 30 35 40 45 50 55 60 65 70 O2/m-3 O3/m-3 O 3P/m-3 O 1D/m-3 1.7 × 1024 8.1 × 1023 3.6 × 1023 1.6 × 1023 7.1 × 1022 3.5 × 1022 1.7 × 1022 8.9 × 1021 4.8 × 1021 2.6 × 1021 1.5 × 1021 8.2 × 1020 4.2 × 1020 1.0 × 1018 1.1 × 1018 2.9 × 1018 3.2 × 1018 3.0 × 1018 2.0 × 1018 1.0 × 1018 3.2 × 1017 1.0 × 1017 3.2 × 1016 1.0 × 1015 3.2 × 1015 1.0 × 1015 1.3 × 1010 5.5 × 1010 9.4 × 1011 6.7 × 1012 1.8 × 1013 2.4 × 1014 1.2 × 1015 3.7 × 1015 6.5 × 1015 8.4 × 1015 6.5 × 1015 5.0 × 1015 4.0 × 1015 - 9.0 × 105 5.0 × 106 2.5 × 107 1.0 × 108 3.3 × 108 6.0 × 108 6.1 × 108 4.4 × 108 2.6 × 108 1.5 × 108 9.6 × 107 1 Mecanismo de Chapman Reacción O2 + h ν O+O j2 = jO2 O3 + h ν’ O2 + O j3 = jO3 O + O2 + M O + O3 No todas las reacciones del mecanismo de Chapman tienen la misma importancia relativa: cte. velocidad O3 + M O2 + O2 O2 + h ν O+O v1 = j2 [O2] v1 ≈ 1 m-3 s-1 k3 = 2.0×10-17 exp(-2280/T) m3 s-1 O3 + h ν’ O2 + O v2 = j3 [O3] v2 ≈ 1012 m-3 s-1 Muy rápidos v3 = k2 [O] [O2] [M] v3 ≈ 1010 m-3 s-1 en comparación O + O2 + M UV-C j2 O + O3 k3 O k2 O2 M UV-C j2 k2 s-1 Mecanismo simplificado (ignorando reacción entre O y O3): O2 + h ν O+O v1 = j2 [O2] O3 + h ν’ O2 + O v2 = j3 [O3] O + O2 + M O3 M* UV-B v4 ≈ m-3 velocidad de reacción es tan pequeña en comparación? j3 O2 M v4 = k3 [O] [O3] 10-13 Ejercicio ¿Por qué esta k3 O O2 + O2 O3 Aplicación de la aproximación de estado estacionario +O O3 + M M* UV-B O2 a h=15 Km y T=273 K k2 = 5.6×10-46 (-300/T)2.36 m6 s-1 +O O2 Diapositivas anteriores O3 + M v3 = k2 [O] [O2] [M] d [O3 ] = − j3 [O3 ] + k 2 [O ][O2 ][M ] = 0 dt j3 Aplicaremos la aproximación de estado estacionario al ozono: en condiciones estacionarias la concentración de ozono se mantiene constante: d [O3 ] =0 dt [O 3 ]e = k2 [O 2 ][M ][O ] j3 Disminuye con la altura aumenta con la altura Se forma una capa de máxima concentración a altura intermedia 4.2 Destrucción catalítica de ozono en fase gas 50 Concentraciones observadas Altura / Km 40 Teoría de Chapman [O 3 ]e = k2 [O 2 ][M ][O ] j3 1) Compuestos de hidrógeno: HOx 30 20 10 0 Existen una serie de moléculas (tanto antropogénicas como de origen natural) que catalizan las reacciones de destrucción de ozono 2) Compuestos de nitrógeno: NOx existen procesos de destrucción del ozono no considerados en la teoría de Chapman 0.5 1.0 Densidad de O3 / m-3 × 1019 3) Halógenos: Clx, Brx,... Por ser procesos de catálisis, concentraciones muy bajas de catalizador pueden producir la destrucción de ingentes cantidades de ozono 1.5 2 OH y HO2 catalizan la destrucción de O3 Mecanismos generales en fase gas: Estratosfera superior Estratosfera superior (30-50 Km) (más concentración de O) X + O3 XO + O XO + O2 X + O2 O3 + O Estratosfera inferior (18-25 Km) (menos concentración de O) 2 O2 X + O3 XO + O3 XO + O2 X + 2 O2 2 O3 3 O2 OH + O3 HO2 + O O3 + O OH + O3 HO2 + O3 2 O2 2 O3 H2 O + h ν Mecanismo principal: 3 O2 H + OH, λ < 200 nm (por encima de 40 Km) O(1D) 2 OH CH4 + O(1D) CH3 + OH Sólo el oxígeno singlete puede producir OH Procedente de la fotolisis del ozono NO y NO2 catalizan la destrucción de O3 HO2 + O2 OH + 2 O2 Producción de radical OH H2 O + También existen mecanismos mixtos que involucran varias especies Estratosfera inferior HO2 + O2 OH + O2 Compuestos halogenados, Cl, Br, F también catalizan la destrucción de O3 Mecanismo principal: Cl + O3 ClO + O2 NO2 + O2 ClO + O Cl + O2 NO2 + O NO + O2 O3 + O 2 O2 O3 + O 2 O2 NO + O3 Producción de Clx Producción de NOx La fuente principal en la estratosfera es la oxidación de óxido nitroso: N2O + O(1D) 2 NO Evidencia experimental del efecto de compuestos clorados en la destrucción del ozono: La principal fuente es antropogénica a partir de compuestos clorofluorocarbonados (CFC). Son sustancias muy estables (larga vida media) que terminan acumulándose en la estratosfera, donde sufren fotólisis. CFCs = CnFxCl4n-x CF2Cl2 + h ν CF2Cl + Cl, (λ<215 nm) Formación de moléculas “reservorio” De manera simultánea a los ciclos catalíticos vistos en las diapositivas anteriores, también tienen lugar en la estratosfera reacciones que eliminan sustancias activas en la destrucción de ozono HO2 + HO2 H2O2 + O2 NO2 + ClO + M ClONO2 + M NO2 + BrO + M BrONO2 + M NO2 + OH + M HNO3 Cl + CH4 HCl +M + CH3 Moléculas reservorio Cuando los catalizadores forman parte de moléculas reservorio no contribuyen a la destrucción de ozono. Por ese motivo, una destrucción de las moléculas reservorio implica la liberación de catalizadores activos, y por tanto, un destrucción más acusada de ozono. 3 Resumen de la química y fotoquímica estratosférica O3 Mediciones realizadas en 1985-87 demostraron la existencia de un descenso estacional de la concentración columnar de ozono en la Antártida: O2 Radicales: OH, NO, Cl, Br, HO2, NO2, ClO, BrO Reservorios: HOCl N2O5 ClONO2 BrONO2 Lluvia ácida emisiones estratosfera troposfera Superficie 180o W 6 Oct. 1987 30 28 Agosto 1986 29 Agosto 1987 20 20 10 10 50 Para explicar este fenómeno se elaboró una teoría global que involucraba factores químicos, fotoquímicos y meteorológicos: Formación de vórtices polares en invierno: 16 Oct. 1986 30 H2O2 HNO3 HCl HF Altitud / Km O2 Gases emitidos: NO2, CH4, CFC’s, Halones, CH3Br, H2 O 4.3 Destrucción catalítica de ozono heterogénea. El “agujero” de ozono Absorción de UV 100 P(O3) / nb 150 50 100 150 P(O3) / nb Aspecto de estas nubes estratosféricas polares: Aire confinado a muy baja temperatura. Formación de nubes estratosféricas polares (PSCs) Altitud = 18 Km T<196 K N 0o W Cl inactivo Luz del Sol en primavera HNO3 HCl ClONO2 HOCl N2O5 Estratosfera Troposfera H2O, HNO3 Cl inactivo ClO + 2 Cl2O2 3- Formación de ClOx H2 O 2- Activación de Clx Reacciones en fase gas Vórtice polar aislado, a –80 oC Cl2 + hν 2 Cl HOCl + hν OH + Cl Cl + O3 ClO + O2 ClONO2 Abundancia 1- Formación de nubes estratosféricas polares Cl Activo HCl 4- Destrucción catalítica del ozono ClO + ClO Cl2O2 Cl2O2 + hν 2 Cl + O2 Cl + O3 ClO + O2 Cl2, HOCl 9 Km Otoño Invierno Primavera Temperatura Oscuridad Reacciones de superficie Verano Formación de superficies (PSC´s) Evolución del vórtice polar 4 Tamaño del agujero de ozono en la Antártida: Concentración de cloro en la estratosfera: Aplicación del protocolo de Montreal (1989) http://toms.gsfc.nasa.gov/eptoms/ep_v8.html http://ozonewatch.gsfc.nasa.gov/ 11 de Septiembre de 2006 5


![CFCl3 + hv → C˙FCl2 + Cl˙ [1]](http://s2.studylib.es/store/data/004556689_1-43a22359c51c0bc280f9bf9610a7da3d-300x300.png)
