Trastornos hereditarios del metabolismo del tensioactivo pulmonar
Anuncio
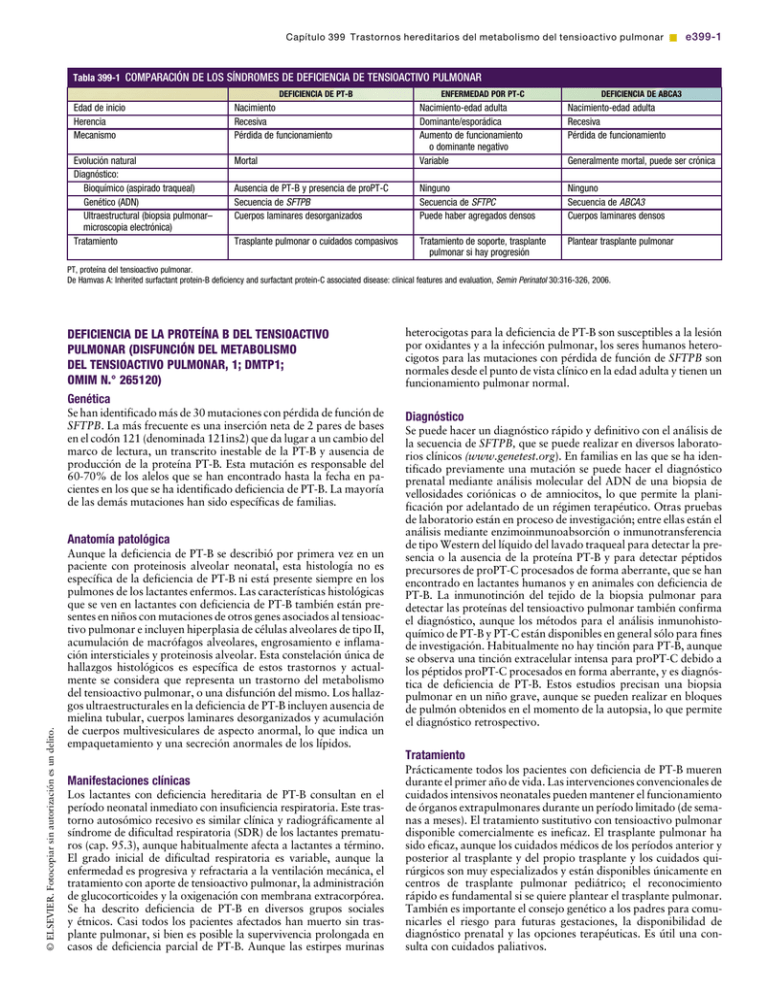
Capítulo 399 Trastornos hereditarios del metabolismo del tensioactivo pulmonar & e399-1 Tabla 399-1 COMPARACIÓN DE LOS SÍNDROMES DE DEFICIENCIA DE TENSIOACTIVO PULMONAR DEFICIENCIA DE PT-B Edad de inicio Herencia Mecanismo Nacimiento Recesiva Pérdida de funcionamiento Evolución natural Diagnóstico: Bioquímico (aspirado traqueal) Genético (ADN) Ultraestructural (biopsia pulmonar– microscopia electrónica) Tratamiento ENFERMEDAD POR PT-C DEFICIENCIA DE ABCA3 Mortal Nacimiento-edad adulta Dominante/esporádica Aumento de funcionamiento o dominante negativo Variable Nacimiento-edad adulta Recesiva Pérdida de funcionamiento Generalmente mortal, puede ser crónica Ausencia de PT-B y presencia de proPT-C Secuencia de SFTPB Cuerpos laminares desorganizados Ninguno Secuencia de SFTPC Puede haber agregados densos Ninguno Secuencia de ABCA3 Cuerpos laminares densos Trasplante pulmonar o cuidados compasivos Tratamiento de soporte, trasplante pulmonar si hay progresión Plantear trasplante pulmonar PT, proteína del tensioactivo pulmonar. De Hamvas A: Inherited surfactant protein-B deficiency and surfactant protein-C associated disease: clinical features and evaluation, Semin Perinatol 30:316-326, 2006. DEFICIENCIA DE LA PROTEÍNA B DEL TENSIOACTIVO PULMONAR (DISFUNCIÓN DEL METABOLISMO DEL TENSIOACTIVO PULMONAR, 1; DMTP1; OMIM N.° 265120) heterocigotas para la deficiencia de PT-B son susceptibles a la lesión por oxidantes y a la infección pulmonar, los seres humanos heterocigotos para las mutaciones con pérdida de función de SFTPB son normales desde el punto de vista clínico en la edad adulta y tienen un funcionamiento pulmonar normal. Genética Se han identificado más de 30 mutaciones con pérdida de función de SFTPB. La más frecuente es una inserción neta de 2 pares de bases en el codón 121 (denominada 121ins2) que da lugar a un cambio del marco de lectura, un transcrito inestable de la PT-B y ausencia de producción de la proteína PT-B. Esta mutación es responsable del 60-70% de los alelos que se han encontrado hasta la fecha en pacientes en los que se ha identificado deficiencia de PT-B. La mayoría de las demás mutaciones han sido específicas de familias. © ELSEVIER. Fotocopiar sin autorización es un delito. Anatomía patológica Aunque la deficiencia de PT-B se describió por primera vez en un paciente con proteinosis alveolar neonatal, esta histología no es específica de la deficiencia de PT-B ni está presente siempre en los pulmones de los lactantes enfermos. Las características histológicas que se ven en lactantes con deficiencia de PT-B también están presentes en niños con mutaciones de otros genes asociados al tensioactivo pulmonar e incluyen hiperplasia de células alveolares de tipo II, acumulación de macrófagos alveolares, engrosamiento e inflamación intersticiales y proteinosis alveolar. Esta constelación única de hallazgos histológicos es específica de estos trastornos y actualmente se considera que representa un trastorno del metabolismo del tensioactivo pulmonar, o una disfunción del mismo. Los hallazgos ultraestructurales en la deficiencia de PT-B incluyen ausencia de mielina tubular, cuerpos laminares desorganizados y acumulación de cuerpos multivesiculares de aspecto anormal, lo que indica un empaquetamiento y una secreción anormales de los lípidos. Diagnóstico Se puede hacer un diagnóstico rápido y definitivo con el análisis de la secuencia de SFTPB, que se puede realizar en diversos laboratorios clínicos (www.genetest.org). En familias en las que se ha identificado previamente una mutación se puede hacer el diagnóstico prenatal mediante análisis molecular del ADN de una biopsia de vellosidades coriónicas o de amniocitos, lo que permite la planificación por adelantado de un régimen terapéutico. Otras pruebas de laboratorio están en proceso de investigación; entre ellas están el análisis mediante enzimoinmunoabsorción o inmunotransferencia de tipo Western del líquido del lavado traqueal para detectar la presencia o la ausencia de la proteína PT-B y para detectar péptidos precursores de proPT-C procesados de forma aberrante, que se han encontrado en lactantes humanos y en animales con deficiencia de PT-B. La inmunotinción del tejido de la biopsia pulmonar para detectar las proteínas del tensioactivo pulmonar también confirma el diagnóstico, aunque los métodos para el análisis inmunohistoquímico de PT-B y PT-C están disponibles en general sólo para fines de investigación. Habitualmente no hay tinción para PT-B, aunque se observa una tinción extracelular intensa para proPT-C debido a los péptidos proPT-C procesados en forma aberrante, y es diagnóstica de deficiencia de PT-B. Estos estudios precisan una biopsia pulmonar en un niño grave, aunque se pueden realizar en bloques de pulmón obtenidos en el momento de la autopsia, lo que permite el diagnóstico retrospectivo. Tratamiento Manifestaciones clínicas Los lactantes con deficiencia hereditaria de PT-B consultan en el período neonatal inmediato con insuficiencia respiratoria. Este trastorno autosómico recesivo es similar clínica y radiográficamente al síndrome de dificultad respiratoria (SDR) de los lactantes prematuros (cap. 95.3), aunque habitualmente afecta a lactantes a término. El grado inicial de dificultad respiratoria es variable, aunque la enfermedad es progresiva y refractaria a la ventilación mecánica, el tratamiento con aporte de tensioactivo pulmonar, la administración de glucocorticoides y la oxigenación con membrana extracorpórea. Se ha descrito deficiencia de PT-B en diversos grupos sociales y étnicos. Casi todos los pacientes afectados han muerto sin trasplante pulmonar, si bien es posible la supervivencia prolongada en casos de deficiencia parcial de PT-B. Aunque las estirpes murinas Prácticamente todos los pacientes con deficiencia de PT-B mueren durante el primer año de vida. Las intervenciones convencionales de cuidados intensivos neonatales pueden mantener el funcionamiento de órganos extrapulmonares durante un período limitado (de semanas a meses). El tratamiento sustitutivo con tensioactivo pulmonar disponible comercialmente es ineficaz. El trasplante pulmonar ha sido eficaz, aunque los cuidados médicos de los períodos anterior y posterior al trasplante y del propio trasplante y los cuidados quirúrgicos son muy especializados y están disponibles únicamente en centros de trasplante pulmonar pediátrico; el reconocimiento rápido es fundamental si se quiere plantear el trasplante pulmonar. También es importante el consejo genético a los padres para comunicarles el riesgo para futuras gestaciones, la disponibilidad de diagnóstico prenatal y las opciones terapéuticas. Es útil una consulta con cuidados paliativos. e399-2 & Parte XIX El aparato respiratorio ALTERACIONES DEL GEN DE LA PROTEÍNA C DEL TENSIOACTIVO PULMONAR (DISFUNCIÓN DEL METABOLISMO DEL TENSIOACTIVO PULMONAR, 2; DMTP2; OMIM N.° 610913) ENFERMEDAD POR MUTACIONES DE ABCA3 (DISFUNCIÓN DEL METABOLISMO DEL TENSIOACTIVO PULMONAR, 3; DMTP3; OMIM N.° 610920) La proteína C del tensioactivo pulmonar (PT-C) es una proteína muy hidrófoba de bajo peso molecular que, junto a PT-B, incrementa las propiedades reductoras de la tensión superficial de los fosfolípidos del tensioactivo pulmonar. Procede del procesamiento proteolítico de una proteína precursora de mayor tamaño (proPT-C). Las mutaciones recesivas de ABCA3 se describieron por primera vez en lactantes que consultaban con dificultad respiratoria mortal en el período neonatal, aunque actualmente se han identificado en lactantes mayores y niños con neumopatía intersticial. Hay una elevada heterogeneidad alélica: se han identificado más de 150 mutaciones dispersas en todo el gen, la mayoría de las cuales son específicas de familia. Una mutación de sentido alterado que produce la sustitución de glutamina por valina en el codón 292 (E292V) está presente en aproximadamente el 0,4% de la población general y se ha identificado, asociada a otra mutación de ABCA3, en niños con insuficiencia respiratoria neonatal grave y en niños mayores con neumopatía intersticial. Se desconoce la frecuencia de las mutaciones y de la enfermedad, aunque las mutaciones de ABCA3 pueden contribuir a una proporción elevada de neumopatías mortales no explicadas en lactantes a término y de neumopatías intersticiales en niños mayores. Se han identificado mutaciones de ABCA3 en diversos grupos sociales y étnicos. Genética Se han identificado más de 35 mutaciones de SFTPC con expresión dominante asociadas a neumopatías agudas y crónicas en pacientes cuya edad variaba desde recién nacidos hasta adultos. Aproximadamente el 55% de estas mutaciones se origina espontáneamente y producen enfermedad esporádica, aunque el resto son hereditarias. Una sustitución de isoleucina por treonina en el codón 73 (denominada I73T) es responsable del 25-35% de los casos identificados hasta la fecha. Se piensa que las mutaciones de SFTPC dan lugar a la producción de proPT-C con un plegado inadecuado que se acumula dentro de la célula alveolar de tipo II y produce lesión celular. Se desconoce la frecuencia de las mutaciones y de la enfermedad debida a mutaciones de SFTPC, aunque es probable que sea baja. Las mutaciones se han identificado en distintos grupos sociales y étnicos. Anatomía patológica El estudio anatomopatológico del tejido pulmonar de pacientes con mutaciones de SFTPC se encuadra en la categoría de trastornos del metabolismo del tensioactivo pulmonar, con hiperplasia de las células alveolares de tipo II y engrosamiento e inflamación del intersticio. La inmunotinción puede mostrar agregados de proPT-C, aunque está disponible sólo para fines de investigación. Manifestaciones clínicas Las manifestaciones clínicas de los pacientes con mutaciones de SFTPC son bastante variables. Algunos pacientes consultan el momento del nacimiento con síntomas, signos y hallazgos radiográficos típicos de SDR. Otros consultan en fases posteriores de la vida, desde el comienzo de la lactancia hasta bien entrada la edad adulta, con inicio gradual de insuficiencia respiratoria, hipoxemia, retraso del desarrollo y datos de neumopatía intersticial en la radiografía de tórax. La edad y la gravedad de la enfermedad pueden variar incluso en familias con una misma mutación. La evolución natural también es bastante variable, de forma que algunos pacientes mejoran espontáneamente o con tratamiento, algunos tienen insuficiencia respiratoria persistente y otros progresan hasta el punto de precisar un trasplante pulmonar. Esta variabilidad de la gravedad y la evolución de la enfermedad aparentemente no se correlacionan con la mutación específica, lo que dificulta la evaluación exacta del pronóstico. Diagnóstico El secuenciado de SFTPC, la única prueba diagnóstica definitiva, está disponible en laboratorios clínicos. El tamaño relativamente pequeño del gen facilita dicho análisis, que es bastante sensible, aunque como la mayoría de las mutaciones de SFTPC son mutaciones de sentido alterado puede ser difícil distinguir las mutaciones que producen enfermedad de las variantes de secuencia infrecuentes pero benignas. Tratamiento No se dispone de ningún tratamiento específico para la neumopatía por mutaciones de SFTPC. Se han probado los abordajes terapéuticos utilizados para las neumopatías intersticiales, como el uso de quinolonas y corticoides, aunque no se han evaluado sistemáticamente. La variabilidad de la evolución natural dificulta las predicciones del pronóstico. Se reserva el trasplante pulmonar a los pacientes con insuficiencia respiratoria progresiva y refractaria que por lo demás cumplen los criterios de trasplante pulmonar independientemente del diagnóstico. Es importante el consejo genético para definir los riesgos para gestaciones futuras. Genética Anatomía patológica La anatomía patológica pulmonar de los lactantes con mutaciones de ABCA3 se clasifica como trastorno del metabolismo del tensioactivo pulmonar, y es similar a la de los lactantes con mutaciones de SFTPB y SFTPC. En el estudio ultraestructural los cuerpos laminares son pequeños y contienen inclusiones electrondensas, hallazgo que puede ser característico de las mutaciones de ABCA3 y que indica que la función de ABCA3 es necesaria para la biogenia de los cuerpos laminares. Manifestaciones clínicas La enfermedad por mutaciones de ABCA3 se manifiesta de dos formas: una forma grave y mortal que se manifiesta en el período neonatal inmediato de forma muy similar a la deficiencia de PT-B, y una forma crónica que se manifiesta la mayoría de las veces durante el primer año de vida con una neumopatía intersticial similar a la enfermedad asociada a PT-C. Actualmente no hay ninguna correlación clara entre genotipo y fenotipo que permita predecir la gravedad y la evolución de la enfermedad de acuerdo con la localización o el funcionamiento previsto de las mutaciones individuales. Diagnóstico Se dispone del análisis de la secuencia de ABCA3 en laboratorios clínicos, y es el abordaje más definitivo para el diagnóstico. La elevada variación de ABCA3 exige una interpretación cuidadosa sobre la funcionalidad de una variante individual y su contribución a las manifestaciones clínicas. En esta situación, la biopsia pulmonar es un complemento útil al abordaje diagnóstico porque la presencia de inclusiones densas en los cuerpos laminares en la microscopia electrónica respalda el diagnóstico. No hay marcadores bioquímicos que permitan hacer el diagnóstico. Tratamiento No se dispone de ningún tratamiento específico para pacientes con mutaciones de ABCA3. Se han utilizado quinolonas y/o corticoides, aunque no se han evaluado sistemáticamente. Los lactantes con insuficiencia respiratoria progresiva pueden ser candidatos a trasplante pulmonar. El consejo genético es importante para definir el riesgo en gestaciones futuras. BIBLIOGRAFÍA Brasch F, Schimanski S, Muhlfeld C, et al: Alteration of the pulmonary surfactant system in full-term infants with hereditary ABCA3 deficiency, Am J Respir Crit Care Med 174:571-580, 2006. Bullard JE, Wert SE, Whitsett JA, et al: ABCA3 mutations associated with pediatric interstitial lung disease, Am J Respir Crit Care Med 172:1026-1031, 2005. Capítulo 399 Trastornos hereditarios del metabolismo del tensioactivo pulmonar & e399-3 © ELSEVIER. Fotocopiar sin autorización es un delito. Cameron HS, Somaschini M, Carrera P, et al: A common mutation in the surfactant protein C gene associated with lung disease, J Pediatr 146:370-375, 2005. Deutsch GH, Young LR, Deterding RR, et al: Diffuse lung disease in young children: application of a novel classification scheme, Am J Respir Crit Care Med 176:1120-1128, 2007. Dunbar AE, Wert SE, Hamvas A, et al: Prolonged survival in hereditary surfactant protein B (SP-B) deficiency associated with a novel splicing mutation, Pediatr Res 48:275-282, 2000. Garmany TH, Wambach JA, Heins HB, et al: Population and diseasebased prevalence of the common mutations associated with surfactant deficiency, Pediatr Res 63:645-649, 2008. Hamvas A, Nogee LM, Wegner DJ, et al: Inherited surfactant deficiency caused by uniparental disomy of rare mutations in the surfactant protein-B and ATP binding cassette, subfamily A, member 3 genes, J Pediatr 155:854-859, 2009. Matsumura Y, Ban N, Inagaki N: Aberrant catalytic cycle and impaired lipid transport into intracellular vesicles in ABCA3 mutants associ- ated with nonfatal pediatric interstitial lung disease, Am J Physiol Lung Cell Mol Physiol 295:698-707, 2008. Nogee LM, Dunbar AE III, Wert SE, et al: A mutation in the surfactant protein C gene associated with familial interstitial lung disease, N Engl J Med 344:573-579, 2001. Nogee LM, Wert SE, Proffit SA, et al: Allelic heterogeneity in hereditary surfactant protein B (SP-B) deficiency, Am J Respir Crit Care Med 161:973-981, 2000. Palomar LM, Nogee LM, Sweet SC, et al: Long-term outcomes after infant lung transplantation for surfactant protein B deficiency related to other causes of respiratory failure, J Pediatr 149:548-553, 2006. Shulenin S, Nogee LM, Annilo T, et al: ABCA3 gene mutations in newborns with fatal surfactant deficiency, N Engl J Med 350: 1296-1303, 2004. Wang Y, Kuan PJ, Xing C, et al: Genetic defects in surfactant protein A2 are associated with pulmonary fibrosis and lung cancer, Am J Hum Genet 84:52-59, 2009.




