capítulo 1 anatomía funcional de la superficie ocular
Anuncio

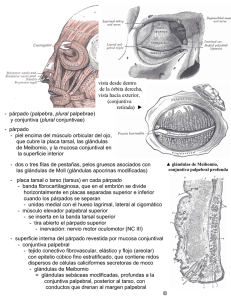
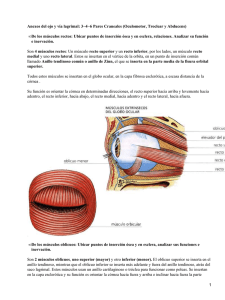
CAPÍTULO 1 ANATOMÍA FUNCIONAL DE LA SUPERFICIE OCULAR Alberto Arntz Bustos, Juan A. Durán de la Colina 1. INTRODUCCIÓN Entendemos por superficie ocular una unidad anátomofuncional de diversas estructuras del ojo y sus anejos, que permiten mantener la adecuada transparencia corneal, y proteger al ojo de la agresión externa. Bajo esta definición consideramos a la conjuntiva, membrana que reviste la superficie posterior de los párpados y la superficie anterior del globo ocular, el limbo esclerocorneal, el epitelio de la córnea y la película lagrimal (1). Los párpados, la glándula lagrimal principal y el sistema de drenaje lagrimal constituyen anejos esenciales para la adecuada homeostasis de la superficie ocular, contribuyendo a la humectación y eliminación de sustancias. Para el mantenimiento de esta homeostasis son también necesarias unas vías nerviosas aferentes y eferentes intactas. Las funciones necesarias para mantener la transparencia e integridad de la córnea, son: hidratación, oxigenación, nutrición, eliminación de materiales de desecho, estabilidad de la barrera inmunológica y capacidad de reparación. Para poder mantener el epitelio corneal íntegro es necesario un equilibrio anatómico y funcional entre todas las estructuras encargadas de este cometido. Se puede decir que todo el complejo sistema de la superficie ocular se centra en la creación y mantenimiento de una película lagrimal estable para proteger el epitelio corneal (fig. 1). En este capítulo realizaremos una descripción anatómica de cada uno de los componentes de la superficie ocular y la forma por la cual realizan las funciones antes mencionadas. edad, raza y constitución siendo de unos 10 a 12 mm en sentido vertical y de unos 30 mm en el horizontal. El cuerpo de los párpados lo constituye la placa tarsal, que está formada por tejido colágeno denso, y se mantiene sujeto al reborde orbitario por medio de ligamentos. El tarso está revestido por escaso tejido conectivo laxo y más superficialmente por el músculo orbicular. La superficie externa del párpado está cubierta por epidermis queratinizada, mientras que la superficie interna se reviste de epitelio conjuntival no queratinizado (fig. 2). Al conjunto de estructuras superficiales se le denomina lamela externa, incluyendo músculos y piel con sus glándulas, mientras que la lamela posterior está compuesta por el tarso, la conjuntiva y sus glándulas correspondientes. 2.1. Piel palpebral Se considera a la piel que reviste los párpados la más delgada de la superficie corporal (2) y además se encuentra laxamente adherida a las estructuras subyacentes. Por estas características su plegamiento puede ser muy rápido durante el parpadeo (1). En el párpado superior, el surco orbitopalpebral (línea de belleza) que discurre paralelo al borde libre palpebral a 4 mm de éste, divide la piel en una porción pretarsal adherida al tarso, y una porción preseptal más laxa y complaciente. El septum orbitario se torna laxo con la edad, 2. PÁRPADOS Los párpados constituyen la primera barrera mecánica de protección del globo ocular. Evitan la desecación de la córnea y conjuntiva, protegen la superficie ocular del traumatismo, y por medio del parpadeo es renovada la película lagrimal, eliminando sustancias tóxicas y de desecho. Se puede considerar a los párpados como las «cortinas» de los ojos, compuestos por piel, músculo, tejido fibroso y conjuntiva. La fisura interpalpebral es el espacio que define la apertura del ojo hacia el exterior y está delimitado por los bordes libres de ambos párpados. Sus dimensiones varían con la Figura 1: El epitelio corneal y la película lagrimal como elementos centrales de la superficie ocular. 2 Superficie ocular de la piel del organismo. Del mismo modo la piel palpebral puede afectarse en el contexto de enfermedades dermatológicas sistémicas (lupus eritematoso sistémico, dermatitis atópica, Stevens-Johnson, etc). El estroma o dermis es laxo y delgado, con escaso tejido adiposo, folículos pilosos y glándulas sudoríparas. Contiene fibras colágenas que discurren paralelas a la superficie ocular, unidas por reticulina, elastina y sustancia fundamental amorfa (1). Es muy complaciente, por lo que aumenta significativamente su volumen en procesos inflamatorios por el líquido transudado desde los capilares, y es fácilmente separable del músculo orbicular. 2.2. Músculo orbicular de los párpados Figura 2: Sección del párpado superior. La queratinización del epitelio tiene lugar inmediatamente por detrás de las glándulas de Meibomio. lo que condiciona la herniación de la grasa orbitaria hacia los párpados a través de su porción pre-septal. Se denomina blefarocalasia a la laxitud de la piel del párpado superior que cuelga sobre la hendidura palpebral, fenómeno degenerativo relacionado con la edad. La piel de los párpados se compone de dos capas: epidermis y estroma. La epidermis es un epitelio estratificado queratinizado que reposa sobre una gruesa membrana basal de colágeno tipo IV. Se distinguen cuatro capas celulares diferentes: una capa basal o germinal de queratinocitos columnares con capacidad mitótica, que generan la segunda capa de células poligonales del estrato espinoso. La tercera capa es el estrato granuloso, que recibe su nombre por la abundante cantidad de gránulos de queratohialina intracitoplasmáticos. Los estratos espinoso y granuloso presentan abundantes tonofilamentos intracitoplasmáticos que se anclan a desmosomas de la pared celular, por lo cual existe alta adherencia intercelular. La cuarta capa, y la más superficial, se conforma de células aplanadas carentes de núcleo y con gran concentración de queratina, denominada estrato córneo. Esta queratinización le confiere a la piel palpebral impermeabilidad al agua (2). Dispersos en la epidermis se encuentran melanocitos, que transfieren gránulos de melanina a las células epiteliales adyacentes, y células de Langerhans pertenecientes al complejo de histocompatibilidad mayor, que actúan como células presentadoras de antígenos en la respuesta inmune de la piel. La tonalidad de la piel depende de la cantidad de gránulos de melanina dispersos en el citoplasma de las células epiteliales, la cual está determinada genéticamente y es estimulada por la radiación ultravioleta, el edema recurrente y las inflamaciones crónicas. La membrana basal del epitelio de la piel de los párpados es blanco de enfermedades autoinmunes que afectan el resto La segunda capa de los párpados bajo la piel, está constituida por el músculo orbicular de los párpados. Es el músculo de la expresión facial y junto al elevador del párpado es el responsable de los movimientos palpebrales. Es un músculo plano, ancho y estriado, de disposición circular alrededor de la hendidura palpebral, actuando de este modo como un verdadero esfínter. Se reconocen en él tres porciones: una porción pretarsal encargada del parpadeo, y las porciones pre-septal y orbitaria, encargadas del cierre forzado del párpado y durante el sueño. Se describe como músculo de Riolano a la porción del músculo orbicular inmediatamente adyacente y paralelo al borde libre palpebral. El músculo orbicular es responsable de la tonicidad palpebral y participa del drenaje de la película lagrimal desde la superficie ocular a través de su extensión en los ligamentos cantales que rodean el saco lagrimal. En el cierre palpebral, la contracción del músculo orbicular provoca que el ligamento cantal comprima al saco, y en la apertura palpebral, el músculo orbicular se relaja, descomprimiendo al saco lagrima, lo que genera una presión negativa, que «aspira» el menisco lagrimal y llena al saco. Los ligamentos cantales lateral y medial son tendones del músculo orbicular que permiten la sujeción de los párpados al reborde de la órbita. Se ha de resaltar que el ligamento interno comprime el saco lagrimal con cada parpadeo, dando lugar a un mecanismo de succión de lágrima hacia los puntos. Una lesión del nervio facial (VII par) da lugar a la parálisis del músculo orbicular, con la consecuente pérdida de la tonicidad palpebral. El párpado laxo pierde su contacto con el globo ocular, separándose la conjuntiva tarsal inferior de la conjuntiva bulbar y se produce una eversión espontánea del borde libre palpebral. Esta condición se denomina ectropión paralítico. Del mismo modo, esta laxitud condiciona un cierre incompleto de la hendidura palpebral durante el parpadeo voluntario o involuntario, fenómeno conocido como lagoftalmos. Tanto el ectropión como el lagoftalmos llevan a desecación de la superficie ocular y desarrollo de queratopatía por exposición, cuya expresión más grave es la ulceración y perforación corneal. 2.3. Tarso La placa tarsal está constituida por tejido colágeno denso, compuesto por fibras de 600 a 700 Å, que se orientan tanto Capítulo 1. horizontal como verticalmente, con escaso tejido elástico entre ellas. Las glándulas de Meibomio se ubican entre la trama fibrilar tarsal. Cada placa tarsal tiene una dimensión aproximada de son 30 mm de longitud por 1 mm de grosor, siendo la placa tarsal superior más alta (11 mm) que la inferior (5 mm). Se insertan firmemente al periostio del reborde orbitario lateral y medial. A la placa tarsal se inserta en su borde superior el septum orbitario, y los músculos elevador palpebral y orbicular lo hacen en su cara externa. Se denomina tendones cantales a las condensaciones de tejido fibroso que insertan al músculo orbicular a los márgenes lateral y medial de la órbita. En su interior se encuentran las glándulas sebáceas de Meibomio (aproximadamente en número de 30 a 40 en el tarso superior y de 20 a 30 en el tarso inferior), cuya secreción forma la capa lipídica de la película lagrimal, que impide su evaporación y tiene una importante función defensiva, dada la presencia de ácidos grasos y ácido láctico que disminuyen el pH ambiental, inhibiendo la replicación bacteriana (3). Las glándulas de Meibomio, a diferencia de las glándulas sebáceas del resto del cuerpo, no drenan a un folículo piloso, sino directamente a la superficie ocular, y la composición de su secreción también es diferente. Cada glándula se compone de 10 a 15 alvéolos que drenan a un ducto de curso vertical. Como todas las glándulas sebáceas, las glándulas de Meibomio son de tipo holocrino, es decir su secreción se forma por la descomposición total de la célula. En la disfunción de las glándulas meibomianas asociada a blefaritis o a dermatitis rosácea, la composición lipídica de las glándulas de Meibomio se encuentra alterada, predominando ácidos grasos de cadena corta, más ácidos y de menor punto de fusión. Esta alteración determina una disminución de la tensión superficial de la película lagrimal y aumenta su tasa de evaporación. Por otro lado, son ácidos grasos tóxicos para el epitelio y estroma corneal, favoreciendo la aparición de erosiones epiteliales e infiltrados estromales periféricos. 2.4. Músculos elevadores El músculo elevador palpebral se origina en el ápex de la órbita desde el ala menor del esfenoides, cursa anteriormente sobre el recto superior para luego expandirse como abanico en múltiples fibras aponeuróticas que atraviesan el septum orbitario para insertarse difusamente en el tejido conectivo de la piel pretarsal y del músculo orbicular, situación que se reconoce externamente como la línea de belleza, y que se corresponde además con el límite de la placa tarsal. Otras fibras del músculo elevador se insertan en el límite superior del tarso y en las paredes medial y lateral del reborde orbitario. Algunas causas de ptosis (dehiscencia senil de la aponeurosis del elevador, miastenia, parálisis oculomotora), son corregidas quirúrgicamente por una resección de parte de la aponeurosis. El elevador palpebral recibe su inervación del III par craneal. El músculo de Müller es una pequeña porción del músculo elevador palpebral que se inserta en el borde superior de la placa tarsal. Las fibras se encuentran en la porción más profunda del estroma conjuntival de los fondos de saco y bajo la Anatomía funcional de la superficie ocular 3 aponeurosis del elevador del párpado, con cuyas fibras se funde hacia posterior. Recibe inervación simpática de fibras provenientes del plexo carotídeo interno, lo que explica la ptosis observada en lesiones del plexo nervioso simpático cervical (síndrome de Horner), del mismo modo que la retracción palpebral observada en el hipertiroidismo o inducida por la instilación de colirios agonistas adrenérgicos. Existen en el párpado inferior unos grupos de fibras musculares denominados retractores del párpado inferior, que se originan en las vainas de los músculos recto inferior y oblicuo inferior, para insertarse en la conjuntiva del fondo de saco inferior y placa tarsal inferior. 2.5. Conjuntiva palpebral La conjuntiva tarsal está firmemente adherida a la superficie posterior del tarso y posee escaso estroma. Paralelo al borde libre palpebral discurre un repliegue de la conjuntiva tarsal, de importancia en la eliminación de cuerpos extraños de la superficie ocular. La exploración clínica de la lámina posterior por eversión tarsal permite observar la formación de papilas y folículos, lo que tiene importancia en el diagnóstico diferencial de afecciones de la superficie ocular. Del mismo modo es posible observar las glándulas de Meibomio, especialmente en condiciones de ectasia glandular (chalazion, blefaritis). 2.6. Movimientos palpebrales 2.6.1. Apertura El movimiento contra la gravedad de la apertura palpebral es consecuencia de la contracción del músculo elevador palpebral. Por la relación anatómica e inervacional, este músculo participa de movimientos coordinados con el recto superior y de la ley de movimientos sinérgicos de Hering. El músculo de Müller también presenta una acción elevadora en un grado menor. Los principales receptores adrenérgicos del este músculo son α2 y parece que su función es el control de la posición tónica de los ojos. Los retractores del párpado inferior contribuyen a deprimir este párpado en la mirada hacia abajo y se encuentran en estrecha relación con los músculos oblicuo y recto inferiores. La debilidad o desinserción de estos retractores origina ectropión o entropión. 2.6.2. Parpadeo Las miofibras del orbicular pretarsal son las más finas de cualquier músculo esquelético y su contracción constituye el parpadeo. El cierre se produce desde el canto externo hacia el interno y es la respuesta a un variado tipo de estímulos. El parpadeo redistribuye la película lagrimal en una capa uniforme, promueve la secreción de las glándulas lagrimales accesorias, y bombea el exceso de lágrima hacia el saco 4 Superficie ocular lagrimal. La frecuencia normal de parpadeo es de 6 por minuto, que aumenta significativamente en condiciones de mayor evaporación, como la inducida por corrientes de aire y ambientes secos por aire acondicionado. En condiciones de atención visual (lectura, trabajo en ordenadores, conducción) la frecuencia de parpadeo disminuye a la mitad, aumentando la tasa de evaporación de la película lagrimal, lo que induce síntomas de ojo seco. El reflejo del parpadeo es inducido por estímulos mecánicos y dolorosos de la superficie ocular, cuya aferencia es el V par craneal hacia el núcleo sensitivo del trigémino y otras regiones supranucleares del sistema nervioso central. La eferencia del arco reflejo la constituye el VII par, que inerva al músculo orbicular para inducir parpadeo y a la glándula lagrimal principal para inducir lagrimeo. Ciertas alteraciones de la aferencia (queratitis herpética), del sistema nervioso central y de la eferencia (parálisis facial), se traducirán en un defecto de la mecánica del parpadeo, con alteración del aclaramiento lagrimal. El blefaroespasmo y parpadeo excesivo inducen un trauma mecánico de la superficie ocular, produciendo queratitis filamentosa, y por otro lado el parpadeo incompleto y menos frecuente inducen una mayor desecación de la superficie ocular, así como una deficiente eliminación de sustancias nocivas diluidas en la lágrima, produciendo ojo seco (4). 2.7. Borde libre palpebral El borde libre palpebral tiene aproximadamente 30 mm de longitud y 2 mm de ancho, con un perfil relativamente cuadrado en la mayoría de su extensión, excepto en su borde medial donde es redondeado y carece de pestañas. Constituye la zona de transición entre el epitelio estratificado queratinizado de la piel de los párpados y el epitelio columnar no queratinizado de la conjuntiva tarsal. Esta unión mucocutánea se localiza inmediatamente posterior a los orificios de salida de las glándulas de Meibomio. En la zona de transición, se aprecia un adelgazamiento progresivo del estrato superficial queratinizado de la piel, apareciendo células cuboideas nucleadas con microvellosidades en su superficie, características del epitelio conjuntival. Las células caliciformes también están presentes en el lado interno de la unión mucocutánea. La queratinización del epitelio conjuntival se observa en algunas enfermedades de superficie ocular, como el síndrome de Stevens-Johnson, penfigoide ocular cicatricial y déficit de vitamina A, y es clínicamente posible de reconocer por citología de impresión de la conjuntiva (4). La línea gris define externamente la separación entre el músculo orbicular y la cara anterior del tarso, siendo un importante punto de referencia en la cirugía de párpados. Se ubica anterior a los orificios de salida de las glándulas de Meibomio y posterior a la emergencia de las pestañas, las cuales en un número aproximado de 150 en el párpado superior y 75 en el párpado inferior, se organizan en dos a tres filas en el margen externo del borde libre palpebral. Los folículos de las pestañas se ubican adyacentes a la cara anterior de la placa tarsal. La vida media de una pestaña es aproximadamente de 5 meses, tardando más o menos 10 semanas en alcanzar su tamaño máximo (2). Los folículos de las pestañas se ubican profundo en la dermis, y carecen de músculo liso erector, a diferencia de los folículos pilosos ubicados en el resto de la superficie corporal. Poseen inervación sensitiva, capaz de detectar ligeros estímulos táctiles que desencadenan el reflejo del parpadeo. Las pestañas participan en la protección mecánica y lumínica de los ojos. En variadas alteraciones inflamatorias del borde libre palpebral, ocurren cambios degenerativos de las pestañas, como la depigmentación (poliosis), y pérdida de pestañas (madarosis). Asociado al folículo de las pestañas se encuentran las glándulas holocrinas sebáceas de Zeis y las glándulas apocrinas de Moll que vacían su secreción al lumen del folículo piloso. La secreción de las glándulas de Zeis contribuye a la lubricación del borde libre palpebral, poseen estructura unilobular, y están compuestas de células con citoplasma repleto de vacuolas lipídicas y un retículo endoplásmico liso bien desarrollado. Se denomina orzuelo a la inflamación de las glándulas de Zeis secundaria a infección bacteriana, frecuentemente de etiología estafilocócica. Las glándulas apocrinas de Moll vacían su contenido al folículo piloso a través de la decapitación del citoplasma apical. Se distinguen en estas células dos tipos de gránulos intracitoplasmáticos: gránulos claros con un contenido similar a crestas mitocondriales y gránulos oscuros probablemente lisosomales. Una capa de células mioepiteliales rodea a las células secretoras, y externamente a ellas se ubica la membrana basal. Se desconoce la función de las glándulas de Moll. La secreción grasa de las glándulas tarsales forma una barrera en el borde libre palpebral, que impide el rebase del menisco lagrimal. En algunos individuos, las glándulas tarsales pueden estar total o parcialmente ausentes, siendo reemplazadas por pestañas anómalas más finas, pequeñas y depigmentadas, que se incurvan hacia la córnea erosionándola. A este fenómeno se le denomina distiquiasis. La irrigación de la lámina anterior del párpado proviene de las arterias faciales superficiales y temporales, ramas de la arteria carótida externa. La irrigación de la lámina posterior proviene de las arterias palpebrales, ramas de la arteria oftálmica. El drenaje venoso de la lámina anterior se realiza a través de la vena facial anterior, tributaria de la vena yugular externa, y la vena temporal superior (tributaria de la vena yugular interna). El drenaje de la lámina posterior se realiza por venas orbitarias hacia el seno cavernoso y plexo pterigoideo. El drenaje linfático de la porción lateral de los párpados se realiza hacia los ganglios preauriculares, mientras que el drenaje de la porción medial se realiza hacia los grupos ganglionares submandibulares. La inervación sensitiva del párpado superior proviene de la rama oftálmica del trigémino (V par), mientras que la inervación del párpado inferior proviene de la rama maxilar del V par. Como hemos mencionado anteriormente, la inervación motora del músculo orbicular proviene del nervio facial (VII par) y el músculo de Müller posee inervación simpática. Capítulo 1. Anatomía funcional de la superficie ocular 5 3. CONJUNTIVA La conjuntiva es una membrana mucosa compuesta por un epitelio estratificado no queratinizado y un estroma laxo. Se distinguen tres porciones: la conjuntiva bulbar que reviste al globo ocular desde el limbo hasta los fondos de saco, la conjuntiva de los fondos de saco, y la conjuntiva tarsal que se extiende sobre la superficie tarsal hasta el borde libre de los párpados en la unión muco-cutánea (fig. 3). La conjuntiva es responsable de la producción de mucina, la cual es esencial para la estabilidad lagrimal y transparencia corneal. Posee además un enorme potencial de respuesta a la infección dada su alta vascularización, gran cantidad de células inmunitarias y secreción de inmunoglobulinas y enzimas bactericidas. El epitelio de la conjuntiva es capaz de absorber sustancias diluidas en la película lagrimal por fagocitosis o por difusión a través de las uniones intercelulares. Esta propiedad permite el afecto terapéutico de la instilación de colirios en los fondos de saco. 3.1. Epitelio conjuntival El epitelio conjuntival es de origen ectodérmico al igual que el epitelio de la piel, por lo que mantiene la capacidad de transformarse a epitelio queratinizado frente a determinados estímulos externos, como la hipolacrimia, inflamación crónica de la superficie ocular, y déficit de vitamina A (metaplasia escamosa). El epitelio conjuntival consta de 2 a 5 estratos celulares que aumentan a 6-8 en el limbo y borde libre palpebral. La capa basal se compone de células cuboideas, mientras que en los estratos superiores las células adoptan formas poliédricas. El estrato superficial se compone de células aplanadas hexagonales que presentan microvellosidades en su superficie y abundantes uniones estrechas intercelulares. Estas microvellosidades aumentan la superficie de absorción y favorecen el anclaje de la película lagrimal. Expresan glicoproteinas que forman un glicocálix altamente hidrofílico, al cual se adhiere la película lagrimal e impide a su vez la adherencia bacteriana. La capa basal epitelial se ancla a su membrana basal y al estroma subyacente a través de hemidesmosomas y tonofilamentos (4). En los espacios intercelulares del epitelio conjuntival existen compartimentos donde se albergan anticuerpos y células inmunológicas, que hacen a la conjuntiva especialmente sensible a patologías alérgicas e inmunológicas. El epitelio de la conjuntiva tarsal suele tener menos estratos celulares y la morfología tiende a ser de aspecto cuboideo, mientras que en los fondos de saco es de aspecto columnar. Se ha identificado una población de células madre del epitelio conjuntival, que se localizan en mayor cantidad en los fondos de saco. Las mucinas son glicoproteínas de alto peso molecular, con una alta proporción de carbohidratos y constituyen el principal componente de la capa más interna de la película lagrimal. Recientemente, se ha reconocido la participación del epitelio corneal y conjuntival en la síntesis de mucinas. La Figura 3: Conjuntivas bulbar y tarsal inferior. mucina MUC-1, es una glicoproteína de transmembrana presente en el epitelio corneal y conjuntival, cuya función es de anclaje de la película lagrimal y pareciera impedir la unión de bacterias patógenos a la superficie ocular (5). MUC-2 es producida por el epitelio corneal y conjuntival, y su función es desconocida. La MUC-4 es producida por el epitelio conjuntival, es una mucina de membrana que contribuye a disminuir la tensión superficial de la película lagrimal. MUC5AC es producida por las células caliciformes, es una mucina secretora formadora de gel (6). MUC-7 es una mucina soluble producida por las glándulas lagrimales. 3.1.1. Células caliciformes Las células caliciformes, intercaladas entre las células epiteliales, se distribuyen en toda la superficie conjuntival, alcanzando una mayor concentración en la carúncula, pliegue semilunar y fondos de saco, y la menor concentración de células caliciformes ocurre en el limbo esclerocorneal (4). Se estima que las células caliciformes constituyen el 5 a 10% de la población epitelial conjuntival. Su tamaño aproximado es de 25 µm, presentan un citoplasma con abundante gránulos electrondrensos de mucina, una aparato de Golgi prominente y un núcleo localizado en el citoplasma basal. Suelen encontrarse en la mitad externa del epitelio conjuntival, en ocasiones unidas por una extensión hacia la membrana basal, y conectadas a las células epiteliales adyacentes por medio de desmosomas. Es probable que las células madre del epitelio conjuntival sean las mismas de las células caliciformes, diferenciadas a través de un proceso aún no conocido. La mucina parece ser secretada en forma apocrina, en respuesta a la irritación de la superficie ocular por mediadores inflamatorios, trauma o toxinas. Existe evidencia de terminales nerviosas parasimpáticas y simpáticas adyacentes a las células caliciformes, pero no se ha demostrado inervación. La desepitelización corneal induce una mayor produc- 6 Superficie ocular ción de mucus, así como la aplicación tópica de péptido intestinal vasoactivo, serotonina, noradrenalina, dopamina y fenilefrina. La secreción mucosa de estas células permite la adherencia de la película lagrimal al epitelio corneal y se estima su producción en 2,2 µL al día. La mucina lubrica y protege las células epiteliales, reduce la tensión superficial de la película lagrimal asegurando su estabilidad y favorece la captura y arrastre de cuerpos extraños, detritus celulares y bacterias. La renovación y multiplicación del epitelio conjuntival y células caliciformes depende de vitamina A y retinoides, en cuya ausencia se producen las formas más graves de ojo seco. Se denomina metaplasia escamosa a la transformación del epitelio conjuntival secretor a un epitelio queratinizado no secretor, asociado a una disminución significativa de la densidad de las células caliciformes. La capa mucosa de la película lagrimal disminuye, la película lagrimal se torna inestable, y el epitelio conjuntival y corneal se lesionan.. Una disminución de la densidad de células caliciformes se ha observado en procesos inflamatorios crónicos cicatriciales, como quemaduras químicas, síndrome de Sjögren, hipovitaminosis A, penfigoide ocular cicatricial, Stevens-Johnson, usuarios de lentes de contacto blandas por tiempo prolongado, y tratamiento crónico con colirios de β-bloqueantes. Se observa un aumento de estas células en procesos inflamatorios conjuntivales agudos. Es posible encontrar en el epitelio conjuntival melanocitos y células dendríticas similares a las células de Langerhans de la piel, y que actúan como células presentadoras de antígenos a los linfocitos estromales. 3.1.2. Conjuntiva tarsal La conjuntiva tarsal es una zona donde clínicamente se observan reacciones de tipo folicular y papilar. Los folículos son acúmulos linfocitarios que se observan en respuesta a infecciones virales, clamidias y reacciones tóxicas a medicamentos. Las papilas se componen de células inflamatorias y plasmáticas, y se observan en infecciones bacterianas, conjuntivitis alérgicas, reacción a cuerpo extraño (lentes de contacto, suturas, prótesis), distinguiéndose macroscópicamente por la presencia de un vaso sanguíneo en el centro de la papila, a diferencia del folículo donde los vasos sanguíneos lo rodean. Se denomina conjuntivitis papilar gigante a la presencia de papilas de un tamaño superior a 1,5 mm, y que se producen por la confluencia de papilas adyacentes al romperse los tabiques fibrosos que las separan. Se observan en la queratoconjuntivitis vernal, en usuarios de lentes de contacto y en la reacción a cuerpo extraño. 3.1.3. Conjuntiva bulbar La conjuntiva bulbar se extiende desde el limbo esclerocorneal hasta los fondos de saco. Es laxa y transparente, observándose través de ella la esclera y epiesclera. En el limbo esclerocorneal se funde con la cápsula de Tenon y la esclera en un anillo de 2 mm de ancho, por lo que en esta zona no se observa la complacencia del resto de la conjuntiva bulbar, siendo en esta zona menos evidente los signos inflamatorios de afecciones de la superficie ocular, que son más manifiestos hacia los fondo de saco. Los músculos rectos emiten unas prolongaciones fibrosas que facilitan el desplazamiento de la conjuntiva con los movimientos del globo, sin redundancias. Se denomina conjuntivocalasia a la presencia de pliegues en la conjuntiva bulbar que protruyen por la hendidura palpebral durante el parpadeo y la infraversión. Se produce por una laxitud exagerada y poca adherencia a la epiesclera del estroma conjuntival, y suele ser secundaria a procesos inflamatorios (hipolacrimia, blefaritis, conjuntivitis alérgica) o más comúnmente a una degeneración del tejido conectivo por envejecimiento. Se manifiesta principalmente por síntomas de ojo seco de predominio vespertino, y que aumentan con el parpadeo y la infraversión, como consecuencia del roce mecánico de la conjuntiva laxa contra el borde libre palpebral. 3.2. Estroma El estroma conjuntival es un tejido conectivo laxo ricamente vascularizado y con abundante cantidad de células inmunitarias: linfocitos, plasmocitos y neutrófilos forman parte de la población celular normal del estroma. También se encuentra gran cantidad de inmunoglobulinas del tipo IgG, IgA e IgM. La porción más superficial del estroma, denominada capa linfoide, se adhiere a la membrana basal del epitelio y presenta gran cantidad de linfocitos que se disponen en acúmulos celulares sin llegar a constituir un ganglio linfático como tal. Esta población linfocitaria está ausente durante el primer año de vida post-natal, por lo que no es posible encontrar clínicamente conjuntivitis foliculares en bebés menores de un año. La porción más profunda del estroma conjuntival denominada capa fibrosa, está compuesta por tejido colágeno y elástico, se adhiere a la epiesclera y contiene vasos sanguíneos y terminales nerviosas. El estroma de la conjuntiva tarsal está firmemente adherido al tarso, por lo que este segmento de la conjuntiva tiene poca movilidad. El estroma de la conjuntiva bulbar por el contrario es muy laxo y permite la movilidad del globo ocular. Hacia el limbo se funde con la cápsula de Tenon (epiesclera). En el estroma de la conjuntiva tarsal se ubican las glándulas lagrimales accesorias de Wolfring. La conjuntiva en los fondos de saco es redundante, formando varios repliegues denominados criptas de Henle. Los fondos de saco superior e inferior se encuentran entre 8 a 10 mm desde el limbo, y el fondo de saco lateral es más profundo, ubicándose a 14 mm. Hacia medial no hay fondo de saco y es reemplazado por el pliegue semilunar y la carúncula. En los fondos de saco el estroma conjuntival se ve reforzado por expansiones fibrosas provenientes de los músculos elevador del párpado y músculo de Müller en el fondo de saco superior, y por expansiones fibrosas provenientes de la vaina del músculo recto inferior (4). Existe una mayor concentración de glándulas lagrimales accesorias de Krause, Capítulo 1. así como acúmulos linfocitarios y células plasmáticas productoras de IgA, la cual atraviesa el epitelio y se disuelve en la película lagrimal. La hiperplasia linfocitaria se manifiesta clínicamente como una foliculosis o conjuntivitis folicular. Esta condición puede producirse en conjuntivitis virales, tracoma, y conjuntivitis tóxicas por medicamentos. La mayor concentración de glándulas de Krause se encuentra en el fondo de saco superior (42 versus 8 en el fondo de saco inferior). La porción medial de la conjuntiva se diferencia en dos estructuras denominadas pliegue semilunar y carúncula. El pliegue semilunar representa un remanente de la membrana nictitante de algunos animales, tiene una alta concentración de células caliciformes, así como algunos folículos pilosos. La carúncula es un tejido de transición que guarda características de una mucosa y de piel. Contiene folículos pilosos con glándulas sebáceas asociadas, glándulas lagrimales, tejido adiposo, fibras de musculatura lisa, y ocasionalmente tejido cartilaginoso. Así como en el pliegue semilunar, es posible encontrar gran cantidad de células caliciformes. En condiciones normales, existe una colonización bacteriana saprofita de la conjuntiva que previene la invasión de gérmenes patógenos. Las especies más frecuentes de encontrar son estreptococos, estafilococos, difteroides y moraxella. 3.3. Vascularización La irrigación de la conjuntiva proviene de las arterias ciliares anteriores, y de ramas palpebrales de las arterias nasal y lagrimal, todas ellas provenientes de la arteria oftálmica. El drenaje venoso de la conjuntiva tarsal y bulbar discurre principalmente hacia las venas palpebrales. La inervación proviene de la rama oftálmica del nervio trigémino. 4. LIMBO El limbo constituye la zona de transición entre el epitelio conjuntival columnar y el epitelio corneal escamoso estratificado. Aunque macroscópicamente la línea de separación es evidente, desde el punto de vista histológico no es fácilmente distinguible. En el limbo se desarrollan múltiples funciones, dentro de las cuales cabe mencionar la nutrición de la córnea periférica, la cicatrización corneal, inmunovigilancia de la superficie ocular y respuestas de hipersensibilidad, siendo además el sitio de abordaje quirúrgico hacia la cámara anterior para la cirugía de glaucoma y de la catarata (3). A nivel del limbo, la conjuntiva adopta una disposición papilar con pliegues orientados radialmente por los cuales discurren vasos sanguíneos y fibras nerviosas, denominados empalizadas de Vogt, las cuales son más prominentes en el limbo superior e inferior. En relación al epitelio corneal, el grosor del epitelio limbar se reduce al disminuir el número de estratos celulares. En la capa basal pueden observarse gránulos intracitoplasmáticos de melanina, algunos melanocitos dendríticos y células de Langerhans aparecen intercaladas entre las célu- Anatomía funcional de la superficie ocular 7 las epiteliales del estrato basal. La membrana basal es delgada y el estroma laxo, apareciendo capilares, canales linfáticos, algunos grupos celulares de fibroblastos y mastocitos. Células madre limbares La evidencia actual sugiere fuertemente que las células madre (CM) del epitelio corneal («stem cells») se encuentran en el limbo. Dichas células, poseedoras de una alta actividad mitótica, carentes de marcadores de queratina y por lo tanto fenotípicamente indiferenciadas (7), serían las responsables de la repoblación centrípeta de la superficie corneal y, a su vez, impedirían el avance del epitelio conjuntival sobre la córnea central. El nicho en el cual las CM residen, tiene características especiales. Su ubicación entre las empalizadas de Vogt le confiere una protección mecánica frente a agresiones externas. En el mismo sentido, la presencia de melanocitos genera un entorno rico en pigmento que protege a las CM de los afectos nocivos de la radiación ultravioleta. El estroma limbar presenta un tejido conectivo laxo con colágeno tipo IV. La proliferación de las CM ocurre por dos vías (8): • La primera es por desplazamiento centrípeto de las CM desde el limbo hacia el centro de la cornea, que se diferencian a células amplificadoras transitorias (CAT). Estas células pasan a constituir el estrato basal del epitelio corneal, que proliferan para producir las células postmitóticas suprabasales, identificadas como las células alares del epitelio corneal. Las células madre tienen alta capacidad de diferenciación y las células CAT tienen alta capacidad de proliferación. • La segunda vía proliferativa seguiría una dirección vertical y estaría implicada en la función de barrera para prevenir el avance del epitelio conjuntival. La teoría X Y Z de Thoft resume el desplazamiento de las células epiteliales en tres fases, siendo X el desplazamiento centrípeto, Y el desplazamiento vertical, y Z la descamación de las células en la superficie (fig. 4). Figura 4: Desplazamiento en tres fases de las células epiteliales, desde las células madre del limbo corneal. 8 Superficie ocular A nivel limbar se forma un plexo vascular anastomótico entre los capilares superficiales provenientes de la circulación conjuntival, y capilares profundos provenientes de la circulación ciliar, lo que explica la hiperemia conjuntival periquerática observada con relación a procesos inflamatorios intraoculares. 5. EPITELIO CORNEAL Figura 5: Epitelio corneal y estroma superficial. Cuando ocurre una disminución de la población de CM, las células epiteliales de la conjuntiva invaden la córnea, acompañadas de tejido fibrovascular que altera la transparencia corneal, e induce un proceso inflamatorio crónico, con defectos epiteliales persistentes y cicatrización estromal. Este proceso se puede detectar precozmente por la presencia de células caliciformes en la citología de impresión de la superficie corneal. La deficiencia de CM puede ser una alteración primaria, como ocurre en la aniridia, la deficiencia endocrina múltiple y en la insuficiencia limbar idiopática. Hay enfermedades de la superficie ocular como las quemaduras térmicas y químicas, el síndrome de Stevens-Johnson, y las queratitis infecciosas que destruyen las CM. Es posible inducir un daño iatrogénico por múltiples cirugías intraoculares con abordaje limbar, la crioterapia y radiación, así como el uso crónico de lentes de contacto. La alta capacidad de proliferación de las CM del epitelio corneal las hace susceptible de sufrir mutaciones inducidas por la radiación ultravioleta u otros estímulos desconocidos. Esta teoría es reforzada por la existencia de carcinomas in situ (neoplasia intra-epitelial) localizados en el limbo, así como la evidencia de la mutación observada en las CM de ojos con pterigium, las que adquieren capacidad migratoria y expresan proteínas de membrana inexistentes en el epitelio corneal normal. Figura 6: Órganos de adherencia de la células basales del epitelio a la membrana basal. Es un epitelio estratificado no queratinizado, compuesto de aproximadamente de cinco capas de células (fig. 5). Tiene un grosor aproximado de 50-60 µ y se caracteriza por los abundantes desmosomas presentes en las uniones intercelulares y hemidesmosomas que anclan el epitelio a la membrana basal, confiriendo a este epitelio impermeabilidad y adherencia (fig. 6). En la capa más profunda se encuentran las células basales, de aspecto poligonal, de 10 µm de ancho y 20 de alto. Se anclan por medio de hemidesmosomas y tonofilamentos a su membrana basal. Es característica de estas células la gran cantidad de filamentos intracitoplasmáticos así como un núcleo prominente. Las células basales se originan de las células amplificadoras transitorias del limbo esclerocorneal que migran centrípetamente, tienen actividad mitótica y son las responsables de la regeneración y renovación del epitelio corneal. La membrana basal del epitelio corneal tiene un espesor aproximado de 75 nm, y se distinguen en ella una lámina lúcida de 25 nm, y una lámina densa de 50 nm La adherencia del epitelio corneal a la capa de Bowman se mantiene por medio de un complejo de membrana basal que incluye una compleja red de anclaje de fibras de colágeno tipo VII y placas de anclaje de colágeno tipo VI, que conectan la lámina densa de la membrana basal a las fibras colágenas de la capa de Bowman. Las células alares constituyen la segunda capa celular, y son producto de la mitosis de las células basales. Presentan formas poligonales diversas, un gran núcleo oval, y su diámetro aproximado es de 12 a 15 µm. Se distinguen en ellas abundantes uniones intercelulares desmosómicas, así como los tonofilamentos del citoplasma. Este estrato presenta numerosas interdigitaciones entre las paredes laterales de las células. Las células apicales conforman los estratos más superficiales. Estas células son anchas y aplanadas con un espesor de 4 a 5 µm y un diámetro de 40 a 50 µm. Su citoplasma es escaso en organelos y abundante en tonofilamentos. El núcleo suele estar disgregado o ausente. La capa celular más superficial presenta característicamente microvellosidades y micropliegues que expresan un glicocálix, que permiten la adherencia de la capa mucinosa de la película lagrimal. Este glicocálix tiene 300 nm de espesor y se compone de glicoproteínas y filamentos finos. Los márgenes de las células apicales presentan uniones estrechas que circunvalan el citoplasma apical, mientras que en las paredes laterales son abundantes los desmosomas y «gap-junctions». Los complejos de unión intercelulares confieren impermeabilidad a la capa externa del epitelio, impidiendo el paso de agua hacia el estroma corneal. La ausencia de queratinización del epitelio Capítulo 1. corneal lo hace susceptible a la desecación y traumatismos, por lo que la indemnidad de los párpados y del film lagrimal son esenciales para mantener la transparencia corneal. El epitelio corneal está siendo constantemente renovado por la actividad mitótica de la capa basal y la exfoliación de las células apicales, estimándose un recambio de 7 días. En condiciones normales, la exfoliación de las células superficiales ocurre una vez que el estrato subyacente ha establecido uniones intercelulares y las microvellosidades en la membrana apical están en condiciones de anclar la película lagrimal. El epitelio corneal posee una rápida respuesta frente a disrupciones, con rápido desplazamiento ameboideo de las células adyacentes al defecto hasta cubrirlo en pocas horas. Los hemidesmosomas y otras uniones intercelulares se reforman, y la monocapa celular es reemplazada por una capa de 6 células por la actividad mitótica de las células basales de la periferia del debridamiento. La matriz extracelular (colágenos, proteoglicanos y hialuronatos) juega un rol fundamental en los procesos de reepitelización secundarios a traumas, actuando como un entramado que permite la inserción y migración de las células epiteliales. La fibronectina presente en la película lagrimal o secretada por los queratocitos promueve la adherencia a la superficie corneal denudada. Por otro lado, las células epiteliales participan en el remodelamiento tisular por la degradación de la membrana basal mediante la activación y expresión del inhibidor tisular de la de las metaloproteinasas de matriz (9). No existen células de Langerhans ni melanocitos en el epitelio corneal central. Este hecho asociado a la ausencia de vasos sanguíneos, proporciona a la córnea un privilegio inmunológico sumamente importante para el éxito de los trasplantes corneales (3). El metabolismo de las células epiteliales de la córnea requiere de oxígeno, glucosa, aminoácidos y vitaminas. La glucosa, aminoácidos y vitaminas provienen principalmente desde el humor acuoso, mientras que el oxígeno se obtiene por difusión desde la película lagrimal. Con los párpados abiertos, la presión parcial de oxígeno en la lágrima es de 155 mmHg, que cae a un tercio de ese valor con los párpados cerrados, siendo entonces la difusión desde los vasos conjuntival el principal aporte de oxígeno. El uso de lentes de contacto determina una reducción del aporte de oxígeno al epitelio corneal, lo que induce la proliferación de tejido fibrovascular desde el limbo (pannus). Anatomía funcional de la superficie ocular 9 responden a estímulos térmicos, mecánicos y químicos (ácidos, acetilcolina, NaCl, PGE2). Estas fibras constituyen el arco aferente del reflejo de parpadeo y de secreción de lágrima, en respuesta a estímulos mecánicos, térmicos y químicos aplicados sobre la superficie ocular. Por otra parte despiertan la reacción sistémica de alarma frente a una agresión, e inician la fase aguda de la inflamación por medio de la liberación de sustancias vasodilatadoras que aumentan la permeabilidad vascular. Existe suficiente evidencia del trofismo ejercido por neurotrasmisores liberados desde estas terminales nerviosas, que regulan el metabolismo de las células epiteliales de la córnea. La denervación corneal determina una disminución de la acetil-colina intracelular en el epitelio, esto lleva a una disminución del GMPcíclico, con la consecuente alteración de la mitosis de las células basales del epitelio conjuntival. Este proceso condiciona un envejecimiento de la población epitelial, y disminución de las microvellosidades alterándose la adherencia de la película lagrimal a la superficie corneal. La mitosis está determinada por una balance adrenérgico «off» mediado por AMPcíclico, y un «on» colinérgico mediado por GMPcíclico. La queratopatía neurotrófica es la consecuencia de la denervación de la superficie corneal, con disminución del neurotrofismo epitelial, la secreción de lágrima y la frecuencia del parpadeo. La disminución del trofismo acelera la pérdida de células epiteliales, lo que se ve agravado por la hiposecreción lagrimal, la mayor evaporación del componente acuoso de la película lagrimal por disminución del parpadeo, que además favorece una mayor osmolaridad y concentración de sustancias tóxicas en la lágrima. La queratopatía neurotrófica se caracteriza por hipoestesia corneal, erosiones epiteliales recurrentes y úlceras del estroma corneal, que en casos graves evoluciona a destrucción tisular y perforación. Es una condición que se observa frecuentemente asociada a la infección corneal por virus herpes, así como a cirugía refractiva LASIK, en donde se seccionan las fibras nerviosas del estroma corneal al realizar un colgajo con el microqueratomo. En estos pacientes, la rei- 6. NEUROTROFISMO La inervación sensitiva de la córnea tiene lugar a través de fibras de los nervios ciliares largos, provenientes de la división oftálmica del trigémino, que penetran en el estroma corneal a nivel del limbo nasal y temporal, para seguir un curso radial hacia el centro y la superficie de la córnea, formando un plexo sub-epitelial, finalizando en terminales libres (botones dendríticos) entre las células epiteliales (fig. 7). Los receptores sensitivos son de tres tipos: mecanorreceptores, termo receptores, y receptores polimodales que Figura 7: Distribución de las terminaciones nerviosas en la superficie corneal. 10 Superficie ocular Figura 9: Capas de la película lagrimal. La mucínica (azul) permite la estabilidad de la acuosa, mientras que la lipídica (amarilla) retrasa la evaporación y mantiene la tensión superficial. Figura 8: Distribución de la película lagrimal en la superficie ocular. nervación puede tardar varios meses, por lo que frecuentemente presentan síntomas de sequedad ocular y erosiones del epitelio corneal por un periodo variable. La hipoestesia corneal se observa también en usuarios crónicos de lentes de contacto, posterior a trasplante corneal, pacientes diabéticos, secundaria a cirugías sobre el ganglio de Gasser, por toxicidad de gotas oftálmicas, así como en la esclerosis múltiple. 7. PELÍCULA LAGRIMAL 7.1. Propiedades La película lagrimal tiene un volumen de 6-9 µL, y está compuesta por agua en un 98%, el pH normal varía entre 6,5 y 7,6, y la osmolaridad entre 310-334 mOsm. Es la primera superficie refractiva del ojo al generar una interfase lisa entre el aire y el epitelio corneal. Constituye un agente esencial en la oxigenación e hidratación del epitelio corneal. Por otra parte actúa como un agente lubricante de la superficie ocular al disminuir el roce durante el parpadeo y los movimientos oculares (fig. 8). La película lagrimal juega un rol fundamental en la defensa frente a la invasión bacteriana. Tiene propiedades antiadherentes y posee además compuestos antibacterianos tales como la transferrina, lactoferrina, lizozima, beta-lisina, IgA, IgG, factores del complemento y leucocitos que aumentan en número especialmente cuando el párpado está cerrado. La lizozima es efectiva contra bacterias gram-negativas y ciertos hongos, mientras que la transferrina y lactoferrina por su propiedad de captar hierro, son efectivas contra bacerias gram-positivas. También se encuentran en el componente lipídico de la película lagrimal ácidos grasos de cadena corta y larga, siendo los primeros agentes desestabilizadores de la membrana celular bacteriana, y los últimos interfieren en el metabolismo bacteriano. Existen diluidas en la lágrima factores que favorecen el trofismo del epitelio corneal, tales como la lactoferrina y el factor de crecimiento epitelial (EGF). 7.2. Estructura La película lagrimal que reviste la superficie ocular tiene un espesor aproximado de 7-9 µ, y se compone de tres capas : una capa posterior mucínica rica en glicoproteínas producida por las células caliciformes conjuntivales, una capa acuosa intermedia producida por las glándulas lagrimales y una capa superficial lipídica producida por la secreción de las glándulas de Meibomio, Zeis y Moll (fig. 9). Es probable que in vivo esta estructura trilaminar no esté tan netamente diferenciada, existiendo un gradiente en los componentes de cada una de sus capas (10), del mismo modo que la estimación inicial de un componente acuoso de un 95% del espesor de la película lagrimal sea en realidad cercano a un 60% como ha sido evidenciado en estudios de microscopía confocal. La capa externa lipídica es muy delgada (0,1 µm de grosor) y está compuesta por una mezcla de lípidos hidrofílicos e hidrofóbicos en estado líquido a la temperatura existente en la superficie ocular. Los lípidos hidrofílicos están en contacto con la capa acuosa y los lípidos hidrofóbicos se disponen hacia la interfase aérea. La capa lipídica confiere tensión superficial a la película lagrimal, permitiendo su distribución homogénea sobre la superficie ocular, evita la evaporación excesiva de la capa acuosa e impide el rebosamiento, manteniendo un menisco lagrimal estable en contacto con el borde libre. Capítulo 1. La capa interna mucosa constituye un gel de 7 a 40 µm de espesor y está compuesta por el glicocálix de las microvellosidades de las células epiteliales superficiales de la cornea y por el mucus secretado desde las células caliciformes. Entendemos por mucus a la secreción completa de las células caliciformes, que incluye lipoproteínas, glicoproteínas y proteínas. La mucina es el componente glicoproteíco del mucus, y su principal característica es el comportamiento amfipático, es decir su capacidad de adherir a moléculas tanto hidrofóbicas (lípidos) como hidrofílicas (proteínas). La capa mucosa tiene una función adherente, manteniendo la película lagrimal adherida al epitelio corneal, y evitando su disgregación. Además constituye una barrera contra la invasión bacteriana y de células inflamatorias. La capa mucosa es removida sólo parcialmente durante el parpadeo, persistiendo un 30 a 40% de esta en contacto con el epitelio corneal. La presencia de mucina soluble y lípidos meibomianos en la capa acuosa le confiere mayor estabilidad a la película lagrimal disminuyendo la tensión superficial, y favoreciendo su «esparcimiento» sobre la superficie ocular durante el parpadeo. El tiempo de ruptura del film lagrimal representa el tiempo que tarda en evaporarse la capa acuosa y la capa lipídica toma contacto con el epitelio corneal hidrofóbico. La capa acuosa constituye en volumen el principal componente de la película lagrimal. La producción de lágrima en condiciones basales es de 1,2 µL/minuto, siendo vaciada en su mayoría a través del sistema de drenaje nasolagrimal, y una pequeña proporción (3 µL/hora) se pierde por evaporación. La secreción lagrimal basal es producida por las glándulas lagrimales accesorias de Wolfring localizadas en la conjuntiva tarsal, y por las glándulas lagrimales accesorias de Krause, ubicadas en la conjuntiva de los fondos de saco 7.3. Secreción lagrimal La secreción lagrimal refleja es producida por la glándula lagrimal principal. Es una glándula sebácea especializada, que secreta su producción a través de ductos que se vacían al fondo de saco conjuntival supero-temporal, respondiendo a estimulación nerviosa parasimpática del séptimo par. Se compone dos lóbulos separados por el septum orbitario, que vacían su contenido a los fondos de saco superotemporales a través de conductos independientes. Se encuentran en las glándulas lagrimales principales, numerosas células plasmáticas productoras de IgA, la cual es secretada en la lágrima. Por otra parte, las glándulas lagrimales producen TGF-β (11), que ha demostrado ser importante en la prevención de numerosas enfermedades de la superficie ocular (12). Anatomía funcional de la superficie ocular 11 Los puntos lagrimales son pequeñas aperturas localizadas en el extremo medial del borde libre palpebral superior e inferior, en el centro de las papilas lagrimales. En el ángulo medial del ojo no existen fondos de saco, lo que favorece el drenaje lagrimal a través de los puntos. A partir de los puntos lagrimales, los canalículos siguen un trayecto de 10 mm (2 mm vertical y 8 mm horizontal) por detrás del ligamento palpebral medial para formar un canalículo común que drena en el saco lagrimal. El canalículo lagrimal está delineado por un epitelio estratificado no queratinizado que se continúa con el epitelio conjuntival y su diámetro aproximado es de 0,5 mm. La dermis que lo rodea es rica en tejido elástico, lo que permite su dilatación. El diámetro aproximado del canalículo es de 0,5 mm. El saco lagrimal tiene una longitud de 12 mm, se ubica en la fosa lagrimal, y está por detrás del ligamento palpebral medial y algunas fibras del músculo orbicular le rodean por detrás. Las paredes del saco lagrimal están formadas por tejido fibroelástico cubierto por epitelio columnar estratificado. El conducto naso-lagrimal termina en la parte anterior del meato inferior en la cavidad nasal. Tiene una longitud de 12 mm, y reposa en el canal lagrimal del hueso maxilar, hueso lagrimal y cornete inferior. Está recubierto por un epitelio columnar estratificado ciliado que reposa en una lámina propia ricamente vascularizada (10). La fibrosis y obstrucción del conducto nasolagrimal es un proceso frecuente mujeres potmenopáusicas, lo que condiciona epífora y el acúmulo de detritus y proliferación bacteriana en el saco lagrimal, con el consiguiente riesgo de dacriocistitis. 7.5. Relación película lagrimal-epitelio La estrecha relación entre la película lagrimal y el epitelio de la superficie ocular (corneal y conjuntival) puede ser apreciado en la queratoconjuntivitis sicca, donde la deficiencia lagrimal induce cambios epiteliales. Estos cambios se caracterizan por metaplasia escamosa y queratinización (13), que asemejan al epitelio de la conjuntiva al de la piel. Una hipótesis formulada con relación a la metaplasia escamosa en la queratoconjuntivitis sicca sostiene que la presencia de factores moduladores epiteliales en la secreción lagrimal (vitamina A, factor de crecimiento epitelial, y transformadores del crecimiento TGF β-1 y TGF β–2) en condiciones normales inhibiría esta transformación, y que en presencia de una daño de la glándula lagrimal su déficit sería el desencadenante de esta transformación. 7.6. Aclaramiento lagrimal 7.4. Sistema de drenaje lagrimal El sistema de drenaje permite la eliminación de la película lagrimal que no se ha evaporado, junto con los elementos presentes en ella. Se compone de los puntos lagrimales, los canalículos lagrimales, el saco lagrimal y el conducto nasolagrimal. Se entiende por aclaramiento lagrimal el proceso de renovación de la película lagrimal, y comprende la producción de lágrima, su evaporación, redistribución por el parpadeo y drenaje. Este proceso puede ser evaluado mediante fluorofotometría o estimando el tiempo de desaparición de fluoresceína de la superficie ocular, y es posible determinar que en pacientes con ojo seco hiposecretor el aclaramiento 12 Superficie ocular se encuentra disminuido, del mismo modo que en pacientes con laxitud palpebral donde el mecanismo de bombeo sobre el saco lagrimal es defectuoso. Un aclaramiento lagrimal disminuido determina mayor concentración de citoquinas inflamatorias, así como una mayor toxicidad de los conservantes presentes en los colirios usados para el tratamiento de enfermedades oculares. 7.7. Mediadores en los procesos inflamatorios de la superficie ocular El conocimiento de los mecanismos fisiopatológicos de diversas afecciones de la superficie ocular como el ojo seco, la disfunción de las glándulas de meibomio, las erosiones corneales recidivantes, entre otros, ha establecido la existencia de mediadores inflamatorios comunes, lo que explica que las lesiones observadas en la superficie ocular sean similares, así como sus síntomas y manifestaciones clínicas. Las metaloproteinasas de matriz (MMP) son una familia de enzimas proteolíticas degradantes de la matriz extracelular y membranas basales, que participan en diversos procesos de la embriogénesis, y reparación de heridas. Existen alrededor de 20 tipos MMP, divididas en cuatro clases: colagenasas, gelatinasas, estromalisinas y MMP de membrana. Son producidas en forma inactiva, y son inhibidas por su contraparte natural: los inhibidores tisulares de metaloproteinasas (TIMP). Se han identificado en la superficie ocular las siguientes MMP: — Conjuntiva: MMP-1, 2 y 3. — Lágrima: MMP-1, 2, 8 y 9. — Epitelio corneal: MMP-1, 9, 10, 12, 13, 14. Se encuentran en concentraciones aumentadas en la película lagrimal en diversas enfermedades inflamatorias de la superficie ocular, y se han correlacionado con la severidad de úlceras y erosiones corneales. Además se han reconocido como activadoras de citoquinas inflamatorias (IL-1, TNFα). Tanto metaloproteinasas como citoquinas, inducen apoptosis de las células epiteliales de la superficie ocular, estimulan la síntesis de prostaglandinas y de factores quimiotácticos de macrófagos y neutrófilos. MMP-9 (gelatinasa-B) participa en la activación de IL1β producida en el epitelio conjuntival (14), y como enzima degrada colágeno IV, V, elastina y fibronectina. En condiciones normales se encuentra presente en la lágrima en forma inactiva, pero es activada por MMP-3 (estromalisina 1) que es liberada desde células epiteliales dañadas. Se encuentra en mayores concentraciones en la lágrima de pacientes con rosácea y ojo seco. La MMP-3 (estromalisina 1), degrada moléculas de fibronectina y laminina. La concentración en la película lagrimal de citoquinas inflamatorias (se encuentran aumentadas en la disfunción de las glándulas de Meibomio, así como en el síndrome de Sjögren y la rosácea ocular (15) y ambas citoquinas han sido asociadas a la epiteliopatía punteada superficial. La IL-1α estimula la producción por parte del epitelio corneal de MMP-9 (gelatinasa B), la que a su vez participa en la activación de IL-1β. En fibroblastos de conjuntiva en pacientes afectados de conjuntivocalasia, se encuentra una sobreexpresión de MMP-1 (colagenasa intersticial que degrada fibras colágenas tipo I, II y III) y MMP-3, aparentemente estimulados por IL-1β y TNF-α producidos por linfocitos y macrófagos (16). En ojos sometidos a cirugía refractiva existe sobre-expresión de MMP-2 y MMP-9 (17). BIBLIOGRAFÍA 1. Fine BS, Yanoff M. Ocular Histology. 2nd ed. Hagerstown. Harper & Row Publishers. 1979. 2. Kaufman PL, Alm A. Adler’s physiology of the eye. 10th ed. Mosby. 2003. 3. Forrester JV, Dick AD, McMenamin PG, Lee WR. The Eye. Basic Sciences in Practice. 2nd ed. WB Saunders . 2002. 4. Holland EJ, Mannis MJ. Ocular Surface Disease. New-York. Springer-Verlag. 2002. 5. Watanabe H. Significance of mucin on the ocular surface. Cornea 2002; 21(S): 17-22. 6. Jumblatt MM, McKenzie RW, Steele PS et al. MUC-7 expression in the human lacrimal gland and conjunctiva. Cornea 2003; 22: 41-5. 7. Schermer A, Galvin S, Sun T. Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells. J Cell Biol 1986; 103: 49-62. 8. Lehrer MS, Sun RR, Lavker RM. Strategies of epithelial repair: modulation of stem-cells and transit amplifying cell proliferation. J Cell Sci 1998; 111: 2867-75. 9. Saika SH, Ohnishi Y, Ooshima A, et al. Epithelial repair. Roles of extracelular matrix. Cornea 2002; 21(S): 23-9. 10. Prydal JI, Campbell FW. Study of precorneal tear film thickness and structure by interferometry and confocal microscopy. Invest Ophthalmol Vis Sci 1992; 33: 1996-2005. 11. Gupta A, Monroy D, Ji Z, et al. Transforming growth factor beta-1 and beta-2 in human tear fluid. Curr Eye Res 1996;15: 605-14. 12. Fox RI, Chan R, Michelson J, et al. Beneficial effect of artificial tears made with autologous serum in patients with keratoconjuntivitis sicca. Arthritis Rheum 1984; 29: 557-83. 13. Tseng SG. Staging of conjunctival squamous metaplasia by impression cytology. Ophthalmology 1985; 92: 728-33. 14. Solomon A, Dursun D, Liu Z, et al. Pro- and anti-inflammatory forms of IL-1 in tear fluid and conjunctiva of patients with dryeye disease. Invest Ophthalmol Vis Sci 2001; 42: 2283-92. 15. Alfonso A, Sobrin L, Monroy C, et al. Tear fluid gelatinase B activity correlates with IL-1a concentration and fluorescein clearance in ocular rosacea.. Invest Ophthalmol Vis Sci 1999; 40: 2506-12. 16. Li D, Meller D, Lui Y, et al. Overexpression of MMP-1 and MMP-3 by cultured conjunctivochalasis fibroblasts. Invest Ophthalmol Vis Sci 2000; 41: 404-10. 17. Azar DT, Hahn TW, Jain S, et al. Matrix metalloproteinases are expressed during wound healing after excimer laser keratectomy. Cornea 1996; 15: 18-24.