Cantidades Quimicas (2 parte)
Anuncio
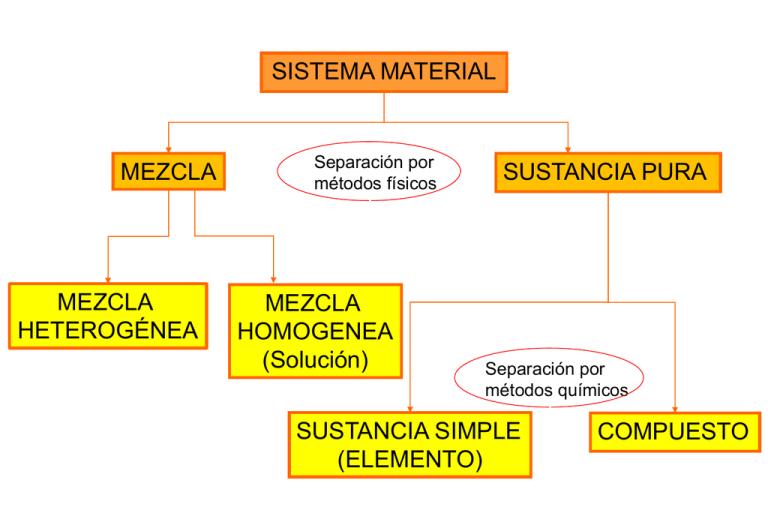
SISTEMA MATERIAL MEZCLA MEZCLA HETEROGÉNEA Separación por métodos físicos MEZCLA HOMOGENEA (Solución) SUSTANCIA PURA Separación por métodos químicos SUSTANCIA SIMPLE (ELEMENTO) COMPUESTO SUSTANCIA PURA sistema material formado por un único componente Las sustancias pueden ser elementos o compuestos. Los compuestos solo pueden separarse en sus componentes puros por métodos químicos. Un elemento no puede separarse en sustancias mas simples por métodos químicos. MEZCLAS sistema material formado por un mas de un componente Se pueden formar y volver a separar en sus componentes puros por medios físicos MEZCLA HOMOGENEA (Solución) MEZCLA HETEROGENEA La composición es la misma en todos sus puntos. No tienen la misma composición, propiedades y apariencia en todos sus puntos. •1 fase •2 o más componentes MEZCLA HOMOGENEA (Solución) •2 o más fases •2 o más componentes MEZCLA HETEROGENEA PROPIEDADES INTENSIVAS Y EXTENSIVAS PROPIEDADES EXTENSIVAS PROPIEDADES INTENSIVAS Depende de la cantidad de materia considerada. Los valores de una misma propiedad extensiva se pueden sumar. Masa Volumen Longitud No depende de cuanta materia se considere. No son aditivas. Densidad Temperatura FÓRMULA MÍNIMA (o empírica) Y FÓRMULA MOLECULAR Fórmula mínima (Fmin) muestra los números relativos de átomos de cada elemento presente en el compuesto CH2O Masa molar del compuesto Fórmula molecular (Fmolec) expresa los números reales de los átomos de cada elemento en una molécula. (Fmolec) = n (Fmin) 1x(CH2O): CH2O (formaldehído) 2x(CH2O): C2H4O2 (ácido acético) 3x(CH2O): C3H6O3 (ácido láctico) 4x(CH2O): C6H12O6 (glucosa) Composición porcentual en masa: masa de un elemento por cada 100 g de compuesto masa del elemento en la muestra % masa del elemento = x 100 masa total de la muestra Se puede conocer la fórmula molecular del compuesto sabiendo su composición porcentual y su MMR Ejemplo Determinar la fórmula molecular de la vitamina C sabiendo la composición de una muestra (40.92% C, 4.54% H y 54.50% O) y la masa molar (176.12 g mol-1). 1. Con la Composición porcentual en masa calcular los g de cada átomo en una muestra de 100g totales y dividir cada valor por el peso atómico correspondiente. 2. Dividir todos los valores por menor de ellos 3. Si queda algún número con decimales, multiplicar todos por un mismo coeficiente para que queden todos enteros y escribir la Fórmula mínima. 4. Dividir el peso molecular por el peso molar de la fórmula empírica. Redondear a un número entero n. 5. Escribir la Fórmula molecular multiplicando cada subíndice de la fórmula empírica por n