receptor para antigeno de linfocito b
Anuncio

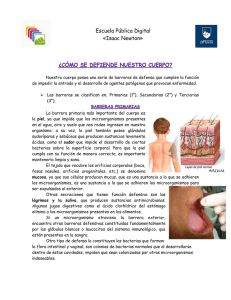
Inmunología General, 2º Medicina (2005-2006) TEMA 6 EL RECEPTOR PARA ANTÍGENO DEL LINFOCITO B. La Respuesta Inmune específica se basa en el reconocimiento específico de los antígenos, tanto en la respuesta de linfocitos B, como en la de los T. Para este reconocimiento específico hay unas proteínas fundamentales en cada tipo de linfocito, y las Inmunoglobulinas son las moléculas específicas para antígeno propias de las células B. Por tanto, el principal papel del linfocito B va a ser la síntesis de dichas moléculas. Las Inmunoglobulinas son un grupo grande de proteínas presentes en el suero y otros fluidos del organismo. Se pueden encontrar de 2 formas principales: forma soluble, entonces las denominamos anticuerpos, o ancladas en la membrana de los linfocitos B, formando parte del Receptor para antígeno (BcR) de dichas células. 6.1 Las inmunoglobulinas. Estructura básica proteíca: La estructura básica de una inmunoglobulina (Ig) consta de 4 cadenas polipeptídicas iguales dos a dos (diapositiva 6.3). Existen dos cadenas pesadas (H=heavy) y dos cadenas ligeras (L=light). El Pm de las cadenas H oscila entre 55 – 77 Kd y el Pm de las cadenas L es de 25 Kd. Las Igs son glicoproteínas. Las distintas cadenas se estabilizan con puentes disulfuro tanto entre dos cadenas pesadas como entre cada cadena pesada y otra ligera pero nunca entre dos cadenas ligeras. Tanto las cadenas pesadas como las ligeras presentan una unidad estructural básica de 110 / 120 aa cada una. Es el llamado dominio inmunoglobulina, que se repite 4-5 veces en las pesadas y 2 veces en las lígeras. Este dominio está constituido por dos láminas beta, cada una integrada por 3 –4 hélices antiparalelas, estabilizadas por interacciones hidrofóbicas y un puente disulfuro intracatenario entre dos cisteínas, cada una perteneciente a una de las hélices de cada lámina. Todas las proteínas que presentan este motivo en su estructura pertenecen a la denominada superfamilia de las inmunoglobulinas. Estos dominios tienen una nomenclatura (diapositiva 6.3 derecha): La porción más conservada de molécula a molécula, que es la zona carboxilo-terminal, se denomina región constante (C) y en el nombre del dominio se hace constar si es de la cadena pesada o ligera con un subíndice (H o L): así tenemos dominios CH y CL. En cada cadena, ya sea pesada o ligera, los extremos amino-terminales son los responsables del reconocimiento de antígeno, son los dominios variables (V); de nuevo, la pertenencia a cadenas pesadas o ligeras se hace constar con subíndices: VH y VL. Por último, sólo en el caso de las pesadas (ya que las ligeras tienen un único dominio constante), los dominios constantes se numeran: CH1, CH2, CH3. Entre el primer y segundo dominios constantes de la cadena pesada existe una zona bisagra de longitud variable (o no existente en algunos casos) que confiere flexibilidad a la Ig. Cuando se somete la molécula de Ig a la acción de proteasa vegetales (pepsina y papaína) se liberan diferentes fragmentos proteicos (diapositiva 6.3 izquierda, abajo): 1 Inmunología General, 2º Medicina (2005-2006) • • Papaína: se produce un corte por la zona bisagra . Obtenemos 3 fragmentos: uno con los 2-3 dominios constantes de cadenas pesadas o fragmento cristalizable (Fc) y 2 fragmentos que incluyen los dominios variables llamados Fab (antigen binding fragment) Pepsina: se dan distintos puntos de corte en las cadenas pesadas. Obtenemos un gran fragmento con los dos sitios de unión al antígeno unidos, denominado F´(ab)2 y diferentes fragmentos de la porción constante de las cadenas pesadas denominados pFc´. En las diapositivas 6.4 y 6.5 se aprecia el modelo molecular en 3-D de la estructura de la inmunoglobulina completa. Isotipos (clases) de Igs (diapositivas 6.6 y 6.7): Pequeñas variaciones en la secuencia de aminoácidos de las regiones constantes de las cadenas ligeras y pesadas (que afectan al tamaño, carga y solubilidad de la proteína) definen diferentes subtipos de las cadenas. a) Se conocen 5 “isotipos” o versiones de la cadena pesada: µ, δ, γ, α y ε β) Además hay 2 isotipos de cadenas ligeras: κ y λ. Las Igs toman su nombre de la cadena pesada, independientemente del tipo de cadena ligera que lleven. Así hay: IgM, IgD, IgG, IgA e IgE, respectivamente. Las cadenas κy λ son estructural y funcionalmente idénticas. Pero además, pequeñas variaciones dentro de las moléculas de los isotipos IgG e IgA permiten diferenciar cuatro subclases de IgG (IgG1, IgG2, IgG3 e IgG4; con cadenas pesadas γ1, γ2, γ3 y γ4, respectivamente) y dos subclases de inmunoglobulinas IgA (IgA1 e IgA2; cadenas α1 y α2). Por lo tanto, en conjunto hay nueve isotipos de Igs, cada uno de los cuales puede contener cadenas ligeras κ ó λ. Las moléculas Ig E y Ig M carecen de región bisagra y tienen un cuarto dominio constante. El resto de las Ig tienen región bisagra. Cada Ig tiene, además, puntos de glicosilación que se representan mediante hexágonos, la Ig menos glicosilada es la IgG. Para dos de los isotópos existen estructuras adicionales, debido a su carácter multimérico. Así, la Ig M se presenta habitualmente en pentámeros (5 unidades estructurales básicas), que en conjunto suman 10 cadenas pesadas y 10 ligeras. Las cinco Igs están unidas por una cadena J (join=unión). La IgA se presenta habitualmente en dímeros unidos por una cadena J. Además la IgA puede aparecer con otro péptido asociado (componente secretor) para formar IgA secretora (Igs) que tiene un papel importante en las mucosas. Variabilidad de las Inmunoglobulinas (diapositiva 6.8): Los dominios variables son los que reconocen específicamente el antígeno. En cada región variable la proteína se pliega: las regiones más variables (denominadas hipervariables) son las que apuntan al contacto con el antígeno, como si fueran los “dedos” de las inmunoglobulinas. Estas regiones se llaman HV (de hipervariable) o también CDR (regiones determinantes de la complementariedad con el antígeno). Las 2 Inmunología General, 2º Medicina (2005-2006) regiones, menos variables, que flanquean a las anteriores se denominan regiones flanqueantes (FR). En los dominios variables (tanto de las cadenas pesadas, como de las ligeras) existen tres regiones hipervariables: CDR1, CDR2 y CDR3. Alguno de los aminoácidos de estas regiones hipervariables pueden presentar un 100% de variabilidad de Ig a Ig. La zona de contacto íntimo con el antígeno (conjunción de las porciones CDR de cadenas pesadas y ligeras) se denomina parátopo. Organización genética (diapositiva 6.9): Cada cadena de la Ig (pesada o ligera) está codificada por un conjunto de genes. El dominio variable está codificado por genes V, D y J (en las pesadas) ó sólo V y J (en as ligeras). Los dominios constantes están codificados por un único gen (C). Hay un gen C para cada uno de los isotipos de cadena pesada: IgM – Cµ, existe sólo un gen para esta cadena. IgD – Cδ, existe 1 gen para esta cadena. IgG – Cγ, existen 4 genes: γ1, γ2, γ3 y γ4. IgE – Cε, existe 1 gen para esta cadena. IgA – Cα, existen 2 genes: α1 y α2. 6.2 Funciones de las Inmunoglobulinas: Características de los anticuerpos: La estructura mínima de un antígeno que es reconocida por un anticuerpo (diapositiva 6.10) y es capaz de generar una respuesta inmune se denomina epítopo. Estos epítopos pueden resultar de la consecución de aminoácidos en la estructura primaria (epítopos lineales) o pueden resultar del plegamiento (estructura terciaria) de la proteína (epítopos conformacionales). Las tres características fundamentales de un anticuerpo son la afinidad, la avidez y la especifidad (diapositiva 6.11). La especificidad para un antígeno determinado viene determinada por la secuencia de aminoácidos de sus dominios variables. La afinidad determina la rapidez con la que el Ac se une al Ag y viene determinada por la fuerza de la unión. Esta fuerza de unión, y por tanto la afinidad depende de los enlaces entre la Ig y el Ag. Estos enlaces pueden ser de varios tipos (diapositiva 6.12): • • • • Puentes de hidrógeno, iones de H compartidos por átomos del Ag y Ac. Enlaces electroestáticos, se dan cargas de polaridad opuesta entre Ac y Ag. Fuerzas de Van der Waals, existen nubes electrónicas polarizadas. Enlaces hidrófobos, grupos hidrofóbicos del Ac y del Ag se unen excluyendo moléculas de agua. Dependiendo del tipo y número de enlaces habrá mayor o menor afinidad de un anticuerpo por su antígeno. La avidez viene dada por el número de sitios de unión. Hay antígenos con secuencias repetitivas en su estructura. Estos antígenos se comportan de modo multivalente, y la fuerza de unión Ag-Ac es mayor que la simple suma de las afinidiades de cada uno de los sitios de unión del anticuerpo al antígeno. Así, a mayor número de sitios de unión, mayor avidez. Por ejemplo la Ig M pentamérica suele ser la más avida para un antígeno al presentar 10 sitios de unión. 3 Inmunología General, 2º Medicina (2005-2006) La especifidad, la avidez y la afinidad vienen determinadas por la región Fab del anticuerpo. La función es determinada por el fragmento Fc. Función de los anticuerpos: La función básica de los anticuerpos es unirse al antígeno. Consecuencia de esta unión Ac-Ag, se producirán diferentes funciones: I) Aglutinación-Neutralización del antígeno. Al ser los anticuerpos bi-valentes (2 lugares de reconocimiento de antígeno), pueden producir la aglutinación del mismo, para su mejor eliminación. Además, cuando se recubre toda la superficie del patógeno con moléculas de anticuerpos, estamos hablando de “neutralización” del mismo. Existen toxinas que atacan a las terminaciones nerviosas, al unirse los anticuerpos a ellas “neutralizan” su efecto. II) Opsonización – Fagocitosis. Pero este recubrimiento de la superficie, puede tener consecuencias posteriores. Así, los macrófagos, que tienen receptores para la porción cristalizable del anticuerpo (Fc) que se denominan FcR, pueden engullir los patógenos que han sido recubiertos por anticuerpo. En este caso, al recubrimiento se le reconoce con el nombre de opsonización. III) Inmovilización del patógeno. Si el anticuerpo se une a la parte móvil del patógeno (cilios, flagelos), va a producir una inmovilización del mismo, reduciendo su patogenicidad. IV) Activación del complemento. Al unirse un Ac a un Ag se produce un cambio conformacional en la región Fc del anticuerpo que induce la activación del sistema del complemento. V) Expulsión. Cuando las anticuerpos son del tipo IgE, y los antígenos son de parásitos, la unión IgE-Ag promueve la liberación de aminas vasoactivas que relajan la musculatura lisa y provocan diarrea en el intestino para expulsar al parásito. VI) Citolisis mediada por anticuerpos (ADDC). Otra función que viene mediada por receptores para la porción Fc del anticuerpo es la llamada citolisis mediada por anticuerpos (ADCC). Las células efectoras son mayoritariamente los linfocitos NK, que al reconocer el anticuerpo en una superficie del patógeno, liberan sustancias citotóxicas que atacan al antígeno. VII) Inmunidad en feto y neonato. En los primeros meses de vida las Igs maternas son el único mecanismo de defensa específica que tiene el recién nacido. Su sistema inmune no ha madurado aún, y no tiene modo de fabricar sus inmunoglobulinas propias en primera instancia. Cada isotipo de anticuerpo desarrolla más efectivamente alguna de estas funciones efectoras (se resumen para cada isotipo en la diapositiva 6.13 y 6.14). Así, con una misma región variable, diferentes regiones constantes van a llevar asociadas diferencias en la función efectora del anticuerpo. Sólo por citar algunos ejemplos: 4 Inmunología General, 2º Medicina (2005-2006) IgG, A y M: activan el complemento y neutralizan antígenos. IgA es el anticuerpo por excelencia de la inmunidad mucosa. IgM es el Ac responsable de las respuesta primaria en tanto que IgG es responsable de la respuesta secundaria y de la inmunidad neonatal. La IgD no tiene función aparente, en sangre está en bajas concentraciones. IgG1 es la más abundante en sangre. IgE es poco abundante, y es la especialista en la respuesta a parásitos. Salida de IgA a mucosas (diapositiva 6.15): La Inmunoglobulina A es el isotipo fundamental en las secreciones, especialmente en los epitelios de los tractos digestivo y respiratorio. Las células plasmáticas (estadío de diferenciación final de linfocitos B) productoras de IgA se encuentran predominantemente en el tejido conectivo (lamina propia) que subyace inmediatamente por debajo de muchas superficies epiteliales. La IgA sintetizada en la lámina propia se secreta como IgA dimérica asociada a una cadena de unión J. Esta forma polimérica de IgA se une selectivamente a un receptor de poli-inmunoglobulina (poli-Ig-R) que está presente en las superficies vasolaterales de las célu8las epiteliales. Una vez que la IgA dimérica se ha unido a dicho receptor, el complejo se internaliza en la célula y se transporta por el citoplasma de la célula epitelial en vesículas de transporte, hasta la porción apical de la célula. Este proceso se denomina transcitosis. Una vez en la zona apical de la célula epitelial el receptor de poli-Ig se fragmenta proteolíticamente, liberando la porción más externa del receptor todavía unida a la IgA dimérica. Este fragmento del receptor liberado junto a la IgA se denomina componente secretor, y parece que protege a la IgA dimérica de posibles degradaciones enzimáticas. Los tejidos con mayor síntesis de IgA son el intestino, el epitelio respiratorio, la mama (en épocas de lactancia) y otras glándulas exocrinas como las salivares y lacrimales. 6.3 Receptores para Inmunoglobulinas: Ya hemos visto en el apartado anterior, que muchas de las funciones efectoras de las Inmunoglobulinas están mediadas por su porción constante (fragmento cristalizable =Fc). Para que esto sea así, el sistema Inmune ha desarrollado una serie de receptores capaces de reconocer la porción Fc de los diferentes isotipos de Inmunoglobulinas, que se llaman de modo genérico Receptores para Fc (FcR) (diapositiva 6.16). Estos receptores se encuentran ampliamente expresados (diapositiva 6.17) en diferentes células del sistema inmune (leucocitos y plaquetas). Su nomenclatura va en función del isotipo de Inmunoglobulina que reconocen. Así, el receptor para Fc de la IgG se denomina FcγR, y el de la IgE FcεR. Posteriormente, según se fueron descubriendo diferentes tipos de receptor se les fue poniendo un número romano (I, II, III). Una característica importante de estos receptores es que sólo se unen a la Inmunoglobulina cuando esta, a su vez, se ha unido al antígeno. Sólo en estas circunstancias la porción constante de la Ig ha sufrido un cambio conformacional que la permite ser reconocida por el Receptor. Una excepción a esta regla, la constituyen algunos receptores para IgE, en particular FcεRI, que se expresa fundamentalmente en mastocitos. Es tan elevada la afinidad de estos receptores por la IgE, que es habitual que los mastocitos se encuentren “cargados” de IgE en su superficie, de modo que si esa IgE encuentra su antígeno específico, las consecuencias del reconocimiento son inmediatas. En la diapositiva 6.18 se muestran detalles de la estructura de los diferentes receptores para Fc de algunos isotipos de Inmunoglobulinas. Obsérvese que todos (exceptuando el FcεRII) tienen dominios tipo inmunoglobulina en su estructura, y pertenecen por lo tanto a la superfamilia de las Igs. Los receptores para las Igs poseen colas citoplasmáticas implicadas en transducción (envío) de seañ al interior celular (a 5 Inmunología General, 2º Medicina (2005-2006) través de motivos ITAM), o bien se asocian a otras proteínas especializadas en esta función. La naturaleza de la respuesta iniciada por la unión de la molécula de anticuerpo depende del isotipo de inmunoglobulina reconocido y del tipo de célula que expresa el receptor. En cualquier caso, es necesario el entrecruzamiento de receptores para que se inicien los procesos de señalización (ver diapositiva 6.21 arriba izquierda). Las respuestas inducidas por los receptores para Igs son variadas: endocitosis (fagocitosis de los patógenos para su destrucción o para la presentación de antígeno), exocitosis (secreción de sustancias líticas para destruir las células infectadas, o secreción de sustancias inflamatorias o de citocinas) 6.4 El Complejo BcR (Receptor de la célula B) Como comentábamos al principio del capítulo, la Inmunoglobulina se presenta en 2 formas diferentes: en solución (anticuerpo) o anclada en la membrana del linfocito B. En este último caso, forma parte de un complejo de proteínas que en su conjunto se denomina Receptor de la célula B (BcR). Estas dos formas alternativas de Ig, también se denominan sIg (soluble) y mIg (transmembranal). El que se expresen de un modo u otro depende del procesamiento del RNA mensajero de la cadena pesada (diapositiva 6.19) y se exprese o no el exón correspondiente a los aminoácidos transmembranales de la proteína. Cabe destacar, que las formas poliméricas de Ig (pentámeros de IgM y dímeros de IgA) sólo se van a expresar en su forma soluble. Todas las mIg van a ser, monoméricas. Estructura del BcR (diapositiva 6.20): La parte variable del BcR, entre diferentes linfocitos B, la constituye la molécula de Ig completa (2 cadenas pesadas y 2 ligeras) que se inserta en la membrana a través de las 2 cadenas pesadas. Pero además, forman parte del BcR 2 heterodímeros iguales, compuestos de 2 cadenas, denominadas Igα e Igβ. Más recientemente, estas dos moléculas se han denominado CD79−α y CD79−β. La cadena β es común para todas la inmunoglobulinas de superficie, en tanto que la cadena α varía según el isotipo de Ig, presentando además diferentes patrones de glicosilación. Ambas cadenas, pertenecen, no obstante a la superfamilia de las Igs, por presentar dominios básicos tipo Ig en su estructura. En el BcR, la Ig es la responsable del reconocimiento específico del Ag, en tanto que las proteínas CD79 median la posterior transducción de la señal hacia el núcleo celular. Sin embargo, hay otras proteínas implicadas en el proceso de transducción de señales, constituyen el complejo correceptor y las veremos más adelante. La mayor parte de los linfocitos B expresan BcR con IgM en superficie (muy a menudo, de modo simultáneo expresan IgD). Estos linfocitos B IgM+IgD+, son linfocitos maduros que aún no han sido estimulados por el Ag que reconocen. Una pequeña proporción de linfocitos B expresan sólo BcR con alguno de los otros isotipos (G1, G2, G3, G4, A1, A2, E, D); ya han reconocido su antígeno específico y se han especializado en la síntesis de un isotipo en concreto. Un tipo especial de linfocitos B, son aquellos que expresan CD5 en su membrana. Su Ig de superficie es siempre IgM (pero no IgD). Son minoritarios y su expresión parece restringida. Parecen ser menos evolucionados y ser capaces de reconocer muchos Ag diferentes (poli-especificos). Además, a diferencia de la mayoría de linfocitos B, estos linfocitos CD5 tienen capacidad de autorenovación. Debido a estas características diferenciales, y a su posible función primaria en la respuesta inmune, a los linfocitos B CD5 se les denomina B1, mientras que a los convencionales se les denomina B2. 6 Inmunología General, 2º Medicina (2005-2006) El Correceptor del BcR: Como ya hemos explicado, el BcR, es la única molécula capaz de reconocer específicamente el Ag, pero no es la única que participa en la activación del linfocito B. Hay una serie de moléculas accesorias que ayudan al linfocito B a activarse, entre las que desteca el complejo correceptor. Este complejo se compone de 3 moléculas asociadas de modo no covalente: CD19, CD21 y CD81 (diapositiva 6.21, imagen derecha).CD21 reconoce a la molécula CD23 de las células dendríticas foliculares, o alternativamente fragmentos del componente 3 del complemento (CD21 es también llamado CR2, o receptor de complemento 2). CD19 se expresa en todos los linfocitos B maduros y su activación activa a cinasas intracitoplasmáticas. La función de CD81 (TAPA-1) es hasta el momento desconocida. Además del complejo correceptor, hay otras moléculas accesorias importantes en la activación del linfocito B: CD45 (cuya porción intracelular tiene actividad fosfatasa), CD22, CD40, CD72 y los antígenos HLA de clase II, todas estas participando en el intercambio de señales entre linfocitos B y T, ya que sus ligandos más probables se encuentran en los linfocitos T (proteínas sializadas, CD40L, CD5 y TcR/CD4, respectivamente) Transducción de señales al interior celular (diapositivas 6.21 y 6.22): Para que la respuesta “humoral” (y producción de anticuerpos) se inicie, es necesario que los linfocitos B se activen. Para ello, tiene que haber contacto directo con el antígeno y entrecruzamiento de receptores (BcR). Como consecuencia de este entrecruzamiento, y de la activación del correceptor y otras moléculas accesorias, se concatenan una serie de procesos, que tienen como misión última mandar señales al núcleo de que hay que entrar en un proceso de activación: a) Hay una primera ronda de fosforilaciones y defosforilaciones, realizadas por enzimas cinasas (Fyn, Lyn, Lck, Btk, Syk, PI3K) y fosfatasas (CD45). El resultado final de esta etapa es la activación de la fosfolipasa C (PLC). b) La PLC hidroliza fosfolípidos de membrana, generando 2 segundos mensajeros fundamentales: Inositol trifosfato (IP3) y diacil-glicerol (DAG). c) El DAG activa a una cinasa nueva: la proteín cinasa-C (PKC) d) El IP3 se une a canales de calcio, activándolos, tanto en la membrana plasmática como en el retículo endoplásmico: el resultado final es el incremento del ión calcio en el citoplasma celular. Así se activan una serie de proteínas dependientes de Ca: calcineurina. e) Se produce una segunda ronda de fosforilaciones- defosforilaciones, producto de la activación cinasas (PKC, Raf, Ras, MAPK) y de fosfatasas (mediada por la calcineurina). El producto final es que determinados factores de transcripción que estaban inactivos, pasan a su forma activa. f) Los factores de transcripción activos se translocan al núcleo celular: lo que conduce finalmente a una modificación en los perfiles de expresión de varios genes celulares que permitirán al linfocito B desarrollar sus funciones efectoras. Entre los genes que se activarán, hay genes comunes a otros tipos celulares, necesarios para la mitosis, y genes específicos de linfocitos B: Inmunoglobulinas, citocinas y receptores de citocinas. Tipos de antígenos: Para la puesta en marcha de una respuesta inmune humoral, en la mayor parte de los casos no es suficiente la única participación de los linfocitos B. Los linfocitos T también juegan un papel determinante. A las células T que ayudan a los linfocitos B en su 7 Inmunología General, 2º Medicina (2005-2006) activación se les denomina células T cooperadoras, y proporcionan ayuda –una vez reconocido el antígeno presentado por la propia célula B-mediante moléculas de membrana que se unen a ligandos de los linfocitos B o mediante la liberación al medio de factores solubles (citocinas), que se unen a receptores en los linfocitos B. A este tipo de antígenos se les denomina T-dependientes (diapositiva 6.23). Pero no todos los Ag inducen respuestas B de tipo T-dependiente, hay algunos que pueden desencadenar dicha respuesta en ausencia de células T: son los denominados Ag T-independientes. 6.5 Diferenciación de linfocitos B: Los linfocitos B son generados por el organismo a lo largo de la vida, aunque cada vez en cantidades menores. Esta generación se inicia en el hígado fetal (a partir de células stem) y luego es continuada por la médula ósea, que es tras el nacimiento (y para toda la vida) el principal centro productor de células B. Las células stem de la médula ósea no tienen Ig en superficie, no han reordenados sus genes aún, y para diferenciarse requieren de la participación de células del estroma de la médula ósea (adiposctos, fibroblastos, reticulocitos, endoteliocitos, etc...) que participan en el proceso a 2 niveles: mediante contactos directos y mediante factores solubles (diapositivas 6.24 y 6.25). El proceso de diferenciación se inicia por la interacción del CD44 de la célula stem con ácido hialurónico de células del estroma. Esta interacción parece favorecer contactos entre el c-kit de la célula precursora con SCF (stem cell factor) de la célula del estroma o soluble. Así, la célula pro-B temprana se diferencia en célula pro-B tardía. La interacción c-kit-SCF favorece la proliferación de estos precursores. Posteriormente, en las células pro-B tardías y células pre-B es necesaria la participación de factores solubles de activación y en concreto de la IL-7. Esta citosina, producida por las células del estroma, induce proliferación de los precursores. En las últimas etapas de diferenciación, los contactos entre los precursores B (células pre-B y B inmaduras) con las células estromales parecen estar mediados por moléculas de adhesión. Las Igs de membrana no se expresan hasta la fase de células B inmaduras. En las células pre-B es posible encontrar la cadena pesada µ en superficie, formando parte de un pre-BcR, pero nunca inmunoglobulinas completas. La célula B inmadura ya expresa IgM en superficie, pero no es hasta la última etapa de célula B madura, que se expresa la IgD. Las células B inmaduras (con IgM sin IgD) son eliminadas o inactivadas si interaccionan con antígenos abundantes en el entorno con objeto de que respeten más tarde las moléculas propias. Este proceso se conoce como selección negativa de células B, y también juegan un papel importante los linfocitos T. Así, solo salen de la médula ósea, a la sangre periférica, las células B que no reconocen ningún antígeno propio durante la selección. Como la mayoría de los antígenos con los que están en contacto en la médula ósea son de origen propio, la posibilidad de encontrar células B autorreactivas en sangre periférica es muy remota. En el camino de la maduración, van encendiendo y apagando la expresión de ciertas proteínas de superficie (con diferente CD), que permiten determinar en que estado de diferenciación se encuentran las células. 8