http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm www
Anuncio

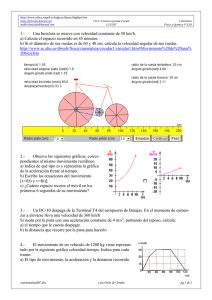
http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm www.lortizdeo.tk I.E.S. Francisco Grande Covián mailto:[email protected] 28/03/08 1.a) Modelo cinético de los gases, 5 ideas básicas acerca del comportamiento microscópico de un gas. Al calentar el gas que contiene el matraz erlenmeyer, el globo acoplado se hincha, según se representa en la siguiente figura: b) ¿Cuál es la interpretación del fenómeno indicado según la Teoría cinético molecular de la materia c) ¿Qué dibujo representa correctamente este fenómeno?:, Justificarlo. 3 Materia y partículas Física y Química 3º ESO http://www.youtube.com/watch?v=sBo_abem9XM 2.Las tres leyes acerca de las transformaciones que se pueden realizar con un gas A temperatura constante. A volumen constante A presión constante 3.Una bombona contiene 10 L de un gas a una presión de 2,5 atm y una temperatura de 20 ºC. a) Si la bombona puede soportar una presión máxima de 6 atm, ¿hasta qué temperatura se podrá calentar sin que estalle? (ten en cuenta que el volumen de la bombona no cambia); b) Explica por qué puede explotar, utilizando el modelo de partículas de la materia. 4.- a) Explica por qué hay que abrir los paraguas para que se sequen. b) La velocidad con que se evapora un líquido aumenta con la temperatura. Justifícalo mediante la teoría cinética. 5.Se representa a continuación la gráfica de calentamiento de un sólido. ¿Qué sucede a los 7 minutos? ¿En qué estado o estados físicos se encuentra la sustancia a los 15 minutos? ¿Qué proceso se realiza entre los 20 y los 55 minutos?. ¿Tienes alguna idea acerca de qué sustancia puede tratarse? Sustancia Agua Alcohol Hierro Cobre Aluminio Plomo Mercurio Punto de fusión ºC 0 -117 1539 1083 660 328 -39 Punto de ebullición ºC 100 78 2750 2600 2400 1750 357 http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia /curso/materiales/estados/estados.swf 6.El siguiente diagrama representa un recipiente metálico que contiene oxígeno gas a 25 °C y 1 atm de presión (los puntos representan la distribución de las moléculas de oxígeno). ¿Cuál de los siguientes diagramas representa la distribución de las moléculas de oxígeno en el mismo recipiente habiendo disminuido la temperatura a 20 K? Razona la respuesta (La temperatura de ebullición del oxígeno es –183ºC) http://www.youtube.com/watch?v=qTmsv-ws244 2exMateriaParticulasLeyesGasesModeloCinetico08.doc Luis Ortiz de Orruño pg 1 de 4 http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm www.lortizdeo.tk I.E.S. Francisco Grande Covián mailto:[email protected] 28/03/08 3 Materia y partículas Física y Química 3º ESO 7.a) Modelo cinético de los gases, 5 ideas básicas acerca del comportamiento microscópico de un gas b) ¿Cuál de los siguientes modelos representa un gas dentro de un matraz? Razona la respuesta 8.Las tres leyes acerca de las transformaciones que se pueden realizar con un gas A temperatura constante. A volumen constante A presión constante 9.- Una botella de plástico de 1,5 L está llena de aire a una temperatura de 300 K, la cerramos herméticamente y la colocamos en el congelador de la nevera a 10º bajo cero. a) Calcula el volumen final del gas encerrado en la botella b) ¿Qué magnitud de las usadas para describir un gas (P, V, T) se mantiene constante?. c) ¿Qué ley hemos aplicado para el cálculo del volumen del gas d) Dibuja el aspecto con el quedará la botella http://www.youtube.com/watch?v=qTmsv-ws244 10.- Dejamos caer dos globos desde una altura de 1 m. uno de ellos lleno de agua, golpea contra el suelo y se rompe el otro medio lleno de agua, y el resto es aire, golpea contra el suelo y no se rompe. Da explicación sencilla y razonada del diferente comportamiento de los globos. http://www.youtube.com/watch?v=qh7A-NLSGb0 11.- Un recipiente hermético de 2 litros contiene gas a 2,5 atmósferas de presión y 27ºC de temperatura. Si calientas el recipiente hasta 327 ºC ¿explotará el recipiente, sabiendo que aguanta como máximo una presión de 4 atmósferas? 12.- Se representa a continuación la gráfica de calentamiento de un sólido.¿Qué sucede entre los 6 y los 10 minutos? ¿Por qué no aumenta la temperatura en ese intervalo de tiempo? ¿Qué magnitud característica de la sustancia deduces de esa gráfica? ¿En qué estado físico se encuentra la sustancia a los 15 minutos? Sustancia Agua Alcohol Hierro Cobre Aluminio Plomo Mercurio Punto de fusión ºC 0 -117 1539 1083 660 328 -39 Punto de ebullición ºC 100 78 2750 2600 2400 1750 357 http://centros4.pntic.mec.es/%7Esierra8/cestado/He atingCurve.swf.- 2exMateriaParticulasLeyesGasesModeloCinetico08.doc Luis Ortiz de Orruño pg 2 de 4 http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm www.lortizdeo.tk I.E.S. Francisco Grande Covián mailto:[email protected] 28/03/08 3 Materia y partículas Física y Química 3º ESO CRITERIOS DE EVALUACIÓN Interpretar fenómenos relacionados con la existencia de la presión atmosférica. Describir las características y propiedades de los estados sólido, líquido y gaseoso. Interpretar cualitativamente la presión y la temperatura a partir de la teoría cinética para llegar a la comprensión del comportamiento de los gases. Interpretar las gráficas que relacionen las variables presión, volumen y temperatura. Utilizar las leyes de los gases para calcular el valor de una de las variables presión, volumen o temperatura conocido permaneciendo constante la tercera. Conocer los aspectos básicos de la teoría cinética de la materia. Utilizar el modelo cinético para justificar las características de los estados de agregación. Explicar los cambios de estado de acuerdo con la teoría cinética de la materia. Interpretar las gráficas de calentamiento y enfriamiento de la materia. Diferenciar la descripción macroscópica de las propiedades de su interpretación a nivel microscópico mediante modelos. 2exMateriaParticulasLeyesGasesModeloCinetico08.doc Luis Ortiz de Orruño pg 3 de 4