I. IONES MONOATÓMICOS: Conformados por uno o más átomos
Anuncio
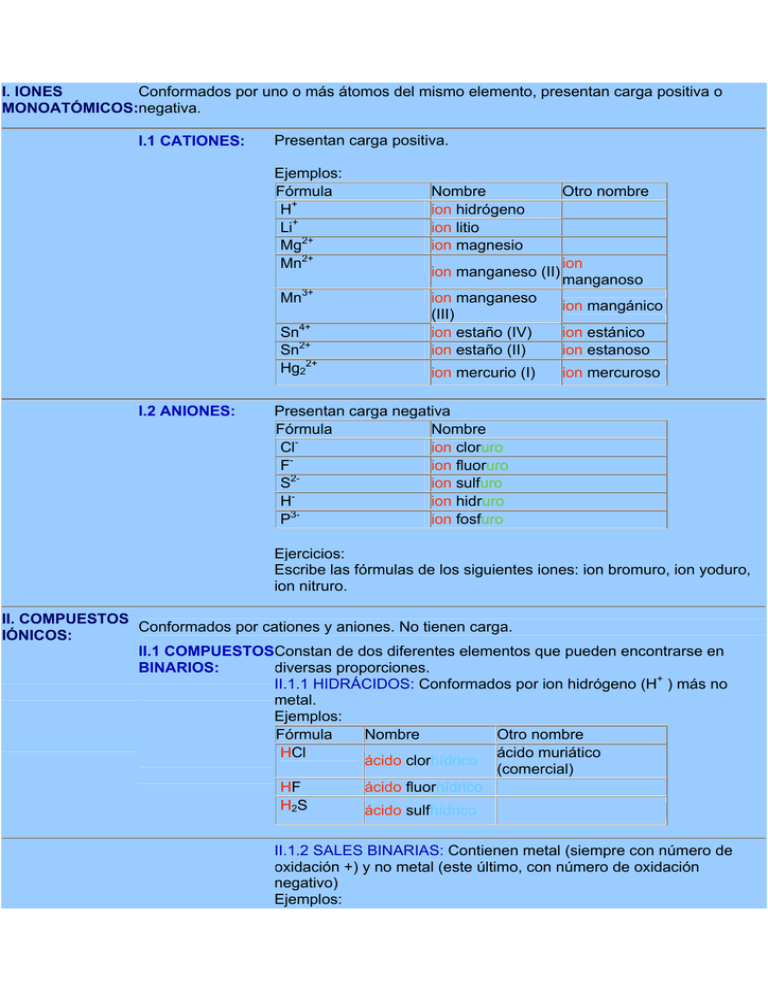
Conformados por uno o más átomos del mismo elemento, presentan carga positiva o I. IONES MONOATÓMICOS:negativa. I.1 CATIONES: Presentan carga positiva. Ejemplos: Fórmula H+ Li+ Mg2+ Mn2+ Mn3+ Sn4+ Sn2+ Hg22+ I.2 ANIONES: Nombre ion hidrógeno ion litio ion magnesio ion manganeso (II) ion manganeso (III) ion estaño (IV) ion estaño (II) ion mercurio (I) Otro nombre ion manganoso ion mangánico ion estánico ion estanoso ion mercuroso Presentan carga negativa Fórmula Nombre Cl ion cloruro F ion fluoruro 2S ion sulfuro H ion hidruro 3P ion fosfuro Ejercicios: Escribe las fórmulas de los siguientes iones: ion bromuro, ion yoduro, ion nitruro. II. COMPUESTOS Conformados por cationes y aniones. No tienen carga. IÓNICOS: II.1 COMPUESTOSConstan de dos diferentes elementos que pueden encontrarse en diversas proporciones. BINARIOS: II.1.1 HIDRÁCIDOS: Conformados por ion hidrógeno (H+ ) más no metal. Ejemplos: Fórmula Nombre Otro nombre HCl ácido muriático ácido clorhídrico (comercial) HF ácido fluorhídrico H2S ácido sulfhídrico II.1.2 SALES BINARIAS: Contienen metal (siempre con número de oxidación +) y no metal (este último, con número de oxidación negativo) Ejemplos: Fórmula NaCl KCl Co2S3 Fórmula Na2O Nombre Otro nombre cloruro de sodio sal fluoruro de potasio sulfuro de sulfuro cobáltico cobalto (III) II.1.3 ÓXIDOS METÁLICOS O BÁSICOS: Conformados por metal (siempre con número de oxidación +) y oxígeno (siempre con número de oxidación -2). Cuando reaccionan con agua producen bases. Ejemplos: Nombre Otro nombre óxido de sodio CaO Al2O3 óxido de calcio óxido de aluminio FeO óxido de fierro (II) óxido ferroso Fe2O3 óxido de fierro (III) óxido férrico As2O3 óxido de arsénico (III) óxido arsenioso As2O5 óxido de arsénico (V) óxido arsénico II.2 COMPUESTOSConstan de tres diferentes elementos que pueden encontrarse en diversas proporciones. TERNARIOS: II.2.1 SALES ÁCIDAS: Constan de metal, hidrógeno (con número de oxidación +1) y no metal (con número de oxidación negativo) Fórmula Nombre Otro nombre NaHS Sulfuro ácido de sodio bisulfuro de sodio Fórmula NaOH Ca(OH)2 II.2.2 HIDRÓXIDOS: Constan de metal, con número de oxidación +m, y ion hidróxido (OH -). Nombre Otro nombre hidróxido de sodio hidróxido de calcio Al(OH)3 hidróxido de aluminio Fe(OH)2 hidróxido de fierro (II) hidróxido ferroso Fe(OH)3 hidróxido de fierro (III) hidróxido férrico As(OH)3 hidróxido de arsénico (III) hidróxido arsenioso As(OH)5 hidróxido de arsénico (V) hidróxido arsénico II.2.3 OXIÁCIDOS: Contienen H, con número de oxidación (+1); metal o no metal, con número de oxidación (+ n); O con número de oxidación (-2). Ejemplos: Fórmula Nombre HClO ácido hipocloroso HClO2 ácido cloroso HClO3 ácido clórico HClO4 ácido perclórico HMnO4 ácido permangánico H2MnO4 ácido mangánico H2MnO3 ácido manganoso HNO3 ácido nítrico HNO2 ácido nitroso #oxidación Carga total metal o no del oxiácido metal +1 (+1) + (+1) + (-2) = 0 +3 (+1) + (+3) + 2(-2) = 0 +5 (+1) + (+5) + 3(-2) = 0 +7 (+1) + (+7) + 4(-2) = 0 +7 (+1) + (+7) + 4(-2) = 0 +6 2(+1) + (+6) + 4(-2) =0 +4 2(+1) + (+4) + 3(-2) =0 +5 (+1) + (+5) + 3(-2) = 0 +3 (+1) + (+3) + 2(-2) = 0 II.2.4 OXIANIONES: Resultan de eliminar uno o más hidrógenos a los oxiácidos Ejemplos: Fórmula Nombre #oxidación Carga total metal o no del oxianion metal +1 (+1) + (-2) = -1 +3 (+3) + 2(-2) = -1 ClOClO2- ion hipoclorito ion clorito ClO3- ion clorato +5 (+5) + 3(-2) = -1 ClO4- ion perclorato +7 (+7) + 4(-2) = -1 MnO4- ion permanganato +7 (+7) + 4(-2) = -1 HMnO4- ion manganato ácido +6 MnO4-2 ion manganato +6 (+1) + (+6) + 4(-2) = -1 (+6) + 4(-2) = -2 HMnO3- ion manganito ácido +4 MnO3-2 ion manganito +4 (+1) + (+4) + 3(-2) = -1 (+4) + 3(-2) = -2 NO2- ion nitrito +3 (+3) + 2(-2) = -1 II.2.5 OXISALES: Contienen metal, con número de oxidación (+m); metal o no metal, con número de oxidación (+n); O con número (2). Puede decirse que derivan de la combinación de un metal con un oxianión. Ejemplos: Fórmula Nombre #oxidación metal sustituto +1 Carga del oxianion Carga total de la oxisal -1 (+1) + (-1) = 0 (+1) + (-1) = 0 (+1) + (-1) = 0 (+1) + (-1) = 0 (+1) + (-1) = 0 2(+1) + (-2) = 0 (+2) + (-2) = 0 (+3) + 3(-1) =0 NaClO hipoclorito de sodio NaClO2 clorito de sodio +1 -1 NaClO3 clorato de sodio +1 -1 NaClO4 perclorato de sodio +1 -1 KMnO4 permanganato de potasio manganato de potasio Sulfato de calcio +1 -1 +1 -2 +2 -2 +3 -1 K2MnO4 CaSO4 Fe(NO3)3 Nitrato de fierro (III) o nitrato férrico II.3 COMPUESTOSConstan de cuatro diferentes elementos que pueden encontrarse en CUATERNARIOS. diversas proporciones. Fórmula KHMnO4 CoHAsO3 NaHCO3 Al(HCrO4)3 II.3.1. OXISALES ÁCIDAS: Contienen metal, con número de oxidación (+m); H con número de oxidación +1; metal o no metal, con número de oxidación (+n); O con número (-2). Puede decirse que derivan de la combinación de un metal con un oxianión ácido. #oxidación Carga del Carga total Nombre metal oxianion de la oxisal sustituto manganato ácido de +1 -1 (+1) + (-1) = 0 potasio ortoarsenito diácido de +2 -2 (+2) + (-2) = 0 cobalto (II) carbonato ácido de sodio o +1 -1 (+1) + (-1) = 0 bicarbonato de sodio cromato ácido de aluminio II.3 COMPUESTOS MOLECULARES +3 -1 (+3) + 3(-1) = 0 Especies II.3.1 ÓXIDOS NO METÁLICOS U ÓXIDOS ÁCIDOS O ANHIDRIDOS: Conformados por no metal (siempre con número de oxidación +) y oxígeno (siempre con número de oxidación -2). Cuando reaccionan con agua producen ácidos. Ejemplos: N2O3 trióxido dinitrógeno Fórmula H2O2 N2O5 pentóxido de dinitrógeno NO monóxido de nitrógeno CO monóxido de carbono CO2 bióxido de carbono As2O3 trióxido de diarsénico As2O5 pentóxido de diarsénico Nombre Otro nombre peróxido de hidrógeno agua oxigenada Na2O2 peróxido de sodio CaO2 peróxido de calcio Fórmula BaO2 Ejercicios: Nombre peróxido de rubidio oxilita Otro nombre

