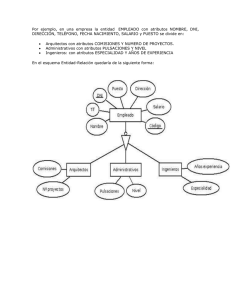
DESCRIPCIÓN MORFOLÓGICA Y PATRONES DE DISTRIBUCIÓN
Anuncio

UNIVERSIDAD AUTONOMA CHAPINGO DEPARTAMENTO DE SUELOS “CARACTERIZACIÓN MORFOLÓGICA Y PATRONES DE DISTRIBUCIÓN DE UNA POBLACIÓN NATIVA DE PITAYO [Stenocereus Griseus (HAWORTH)] EN EL MUNICIPIO DE SAN CIRO DE ACOSTA, S. L. P.” TESIS PROFESIONAL Que como requisito parcial para obtener el título de: INGENIERO EN RECURSOS NATURALES RENOVABLES PRESENTA: Gaspar Ramírez Herminio Francisco Pérez Alcázar Carlos Erminio Chapingo, México. Julio del 2009. CONTENIDO ÍNDICE DE CUADROS ....................................................................................................... I ÍNDICE DE FIGURAS ........................................................................................................ II RESUMEN............................................................................................................................ III SUMMARY ........................................................................................................................... IV I. INTRODUCCIÓN ................................................................................................................ 1 1.1. Objetivos ..................................................................................................................... 2 II. REVISIÓN DE LITERATURA ............................................................................................ 3 2.1. Tipos de vegetación xerófila ........................................................................................ 3 2.2. Características generales de las cactáceas ................................................................. 6 2.2.1. Origen y evolución de las cactáceas ..................................................................... 8 2.2.2. Características morfológicas de las cactáceas ...................................................... 9 2.2.3. Ecología de las cactáceas .................................................................................. 12 2.3. Características generales de Stenocereus ............................................................. 14 2.3.1 Origen y evolución de Stenocereus...................................................................... 15 2.3.2. Características morfológicas y fisiológicas de Stenocereus ................................ 16 2.3.3. Ecología de Stenocereus .................................................................................... 17 2.3. Importancia del género Stenocereus ......................................................................... 18 2.4. Patrones de distribución del pitayo ............................................................................ 20 III. MATERIALES Y MÉTODOS .......................................................................................... 22 3.1. Localización del área de estudio ............................................................................... 22 Figura 1. Localización geográfica y política de la zona de estudio.................................... 22 3.2. Trabajo de campo ..................................................................................................... 23 3.2.1. Determinación taxonómica de Stenocereus griseus Haworth.............................. 23 3.2.2. Descripción morfológica de S. griseus Haworth .................................................. 23 3.2.3. Muestreo de poblaciones nativas de S. griseus Haworth .................................... 23 3.4. Atributos considerados para la caracterización de la planta ...................................... 25 3.5. Análisis estadístico .................................................................................................... 26 IV. RESULTADOS Y DISCUSIÓN ....................................................................................... 28 4.1. Identificación taxonómica .......................................................................................... 28 4.2. Descripción morfológica ............................................................................................ 28 4.3. Análisis estadístico .................................................................................................... 31 4.3.1. Estadística básica ............................................................................................... 31 4.3.2. Análisis de correlación ........................................................................................ 31 4.3.3. Análisis de componentes principales de los atributos de la planta ...................... 33 4.3.4. Análisis de componentes principales de los atributos de la planta y fruto ........... 37 4.3.5 Análisis de conglomerados para los atributos de la planta. .................................. 39 4.3.6. Análisis de conglomerados para los atributos de la planta por transectos ........... 42 4.3.7. Análisis de conglomerados para los atributos de la planta y fruto en diez transectos ..................................................................................................................... 44 4.3.6. Análisis de conglomerados por transectos para los atributos de la planta y fruto 48 4.4. Patrones de distribución del pitayo en la superficie de muestreo ............................... 49 4.5 Patrones de distribución de los principales atributos del fruto por transecto ............... 54 V. CONCLUSIONES............................................................................................................ 57 VI. ANEXOS ........................................................................................................................ 59 Anexo I. Medias de los atributos morfológicos de la planta, obtenidos en el muestreo (2007)............................................................................................................................... 59 Anexo II. Medias de los atributos del fruto obtenidos en el muestreo (2007). ................... 60 Anexo III. Varianza los atributos morfológicos de la planta, obtenidos en el muestreo (2007)............................................................................................................................... 61 Anexo IV. Varianza de los atributos del fruto obtenidos en el muestreo (2007). ............... 62 Anexo V. Desviación estándar de los atributos morfológicos de la planta, obtenidos en el muestreo (2007). .............................................................................................................. 63 Anexo VI. Desviación estándar de los atributos del fruto obtenidos en el muestreo (2007). ......................................................................................................................................... 64 VII. LITERATURA CITADA ................................................................................................. 65 ÍNDICE DE CUADROS Cuadro 1. Composición porcentual del futo integro y de la pulpa de Stenocereus griseus. ............................................................................................................... 18 Cuadro 2. Correlaciones de los atributos de la planta de pitayo. ........................ 32 Cuadro 3. Correlaciones de los atributos de la planta y frutos del pitayo. .......... 33 Cuadro 4. Varianza explicada de los tres primeros componentes principales de los atributos de la planta. .................................................................................... 34 Cuadro 5. Pesos de los atributos de la planta en los componentes principales. . 35 Cuadro 6. Varianza explicada de los tres primeros componentes principales de los atributos de la planta y fruto. ......................................................................... 37 Cuadro 7. Peso de los componentes de los atributos de la planta y fruto. ......... 38 Cuadro 8. Distancias de unión de los atributos de la planta. .............................. 42 Cuadro 9. Distancias de unión entre los transectos muestreados. ..................... 44 Cuadro 10. Distancias de unión entre los atributos de la planta y fruto en los diez transectos de muestreo....................................................................................... 46 Cuadro 11. Distancias de unión entre transectos de muestreo de los atributos de la planta y fruto. .................................................................................................. 49 Cuadro 12. Atributos sobresalientes de la planta ordenados en tres intervalos, para definir patrones de distribución del pitayo. .................................................. 51 Cuadro 13. Atributos sobresalientes del fruto ordenados en tres intervalos, para definir patrones de comportamiento en los transectos. ....................................... 55 I ÍNDICE DE FIGURAS Figura 1. Localización geográfica y política de la zona de estudio ..................... 22 Figura 2. Área de trabajo y distribución de los sitios de muestreo. ..................... 24 Figura 3. Análisis de los componentes para los atributos de la planta. ............... 36 Figura 4. Análisis de componente para los atributos de la planta y fruto ........... 39 Figura 5. Dendrograma de los atributos de la planta. ......................................... 40 Figura 6. Dendrograma de los transectos para atributos de la planta. ................ 43 Figura 7. Dendrograma de los atributos de la planta y fruto. .............................. 45 Figura 8. Dendrograma de los transectos en los que se muestrearon los atributos de la planta y fruto. ............................................................................................. 49 Figura 9. Características sobresalientes de la planta por transectos. ................. 54 Figura 10. Características sobresalientes de los frutos por transecto. ................ 56 II RESUMEN Se caracterizó morfológicamente y se estudiaron los patrones de distribución de Stenocereus griseus en San Ciro de Acosta S. L. P., en 17 transectos de 1000 m2, en los que se registraron 364 individuos en 27.8 km2. De los atributos evaluados, la altura de planta fluctuó entre 1.6 y 9.6 m, el diámetro de copa promedio fue de 1.87 m y la base de 28 cm; se encontraron de seis a nueve costillas por rama, las aréolas presentaron de una a tres espinas centrales y hasta diez radiales; todos los frutos tuvieron forma oval, cuyo peso promedio fue de 54.96 g y volumen de 45.15 cm3. Las relaciones más estrechas de atributos del pitayo se encontraron entre la altura de la planta (AP), el diámetro de copa (DCP) y basal (DBP), y las del fruto entre el peso (PTF), volumen (VF) y diámetro ecuatorial (DEF). Se encontró homogeneidad morfológica y de distribución, pero en las zonas bajas y el extremo oriental del área de estudio el porte de la planta y la calidad de fruto fueron sobresalientes. Palabras clave: Stenocereus griseus, caracterización morfológica, patrones de distribución, muestreo por transectos. III SUMMARY In San Ciro de Acosta, S. L. P, the distribution patterns of Stenocereus griseus were studied and it was morphologically characterized. 364 individuals were recorded in 17 transects with a surface of 1000 m2 each, in a total of 27.8 km2. Of the attributes evaluated, the plant height ranged between 1.6 and 9.6 m, crown diameter averaged 1.87 m and the base diameter averaged 28 cm. From six to nine ribs were found per branch, the areolas showed one to three central spines, and up to ten radials were found. All fruits were oval shaped, weighing an average of 54.96 g and with an average volume of 45.15 cm3. The investigation showed there is a close relationship between the pitaya attributes of plant height (AP), crown (DCP) and basal diameter (DBP), and fruit weight (PTF), volume (VF) and equatorial diameter (DEF). Morphological and distribution homogeneity was also found, but in the lowland areas and the eastern end of study area the size of the plant and fruit quality were outstanding. Keywords: Stenocereus griseus, morphological characterization, distribution patterns, sampling transects. IV I. INTRODUCCIÓN En México la región árida y semiárida es la zona más extensa, ya que ocupa, aproximadamente el 50% del territorio nacional, distribuyéndose principalmente en el norte del país, aunque se extiende al sur como un fragmento aislado en la Mixteca Oaxaqueña y Poblana (Flores et al., 1974; Challenger y Caballero, 1998). Esta región comprende la vegetación clasificada por Rzedowski (1994) como matorral xerófilo compuesto de una gran riqueza de cactáceas, con altos índices de endemismo y con patrones de distribución muy peculiares determinados tanto por factores biológicos como ecológicos, además de las presiones antropogénicas a las que han estado sometidas sobre todo en las últimas décadas, mismas que afectan la fragilidad de sus poblaciones razón por la cual han tenido que desarrollar diversas estrategias de adaptación (Hernández y Godínez, 1994). En la zona media del estado de San Luis Potosí predomina el matorral xerófilo, el cual presenta las siguientes variantes, matorral micrófilo, rosetófilo, crassicaule, submontano, y chaparral. En ellas se presenta como componente común el pitayo (Stenocereus spp.), mismo que es aprovechado de forma tradicional en el municipio de San Ciro de Acosta. Por lo que entender los patrones de distribución de Stenocereus será de gran importancia en el estudio de las relaciones existentes entre los individuos de este género. Es importante tener conocimiento de este componente florístico para un adecuado manejo y conservación puesto que es predominante en esta zona (González y González 1993), permitiendo de este modo entender la especialización de la distribución de las poblaciones de Stenocereus, entendiendo ésta como el resultado de la combinación de diversos factores que se expresan de forma particular de acuerdo con la escala, tanto social como espacial, estableciendo así su importancia según la región y las características locales (Molinillo y Monasterio, 2002; Solís y Panseri, 2004; Arellano y Rangel 2008). 1 El conocimiento de los componentes y características de las poblaciones de Stenocereus spp. en esta zona de estudio es de gran importancia debido a que se trata de una especie predominante y un recurso desaprovechado; y donde se distribuye se utilizan principalmente como zonas de agostadero. Por lo cual, el estudio de sus patrones de distribución, mostrara las áreas con mejores condiciones para el desarrollo de las poblaciones de pitayo. Dentro las técnicas estadísticas que se utilizan para el estudio de la distribución de poblaciones vegetales están el análisis de componente principales, el cual permite entender las relaciones existentes entre las características morfológicas de las plantas que se evalúan en campo, y con el análisis de conglomerados se estudian los coeficientes de similaridad que existen entre los atributos de dichas poblaciones con el propósito de ubicar zonas homogéneas o heterogéneas de dichos conjuntos de plantas. Por lo que en el presente trabajo se utilizan estas herramientas para el análisis de las poblaciones de Stenocereus spp. Finalmente, considerando que son pocos los estudios referentes a los patrones de distribución de Stenocereus, y que en su mayoría se enfocan a la relación y asociación que guardan estas plantas con otros estratos dentro del ecosistema, principalmente a que no se han investigado las relaciones entre las características morfológicas de la planta y su distribución, es que en el presente trabajo se plantean los siguientes objetivos. 1.1. Objetivos Caracterizar morfológicamente las poblaciones nativas del pitayo [Stenocereus griseus (Haworth)] en la zona de estudio. Establecer las relaciones entre los atributos de la planta de pitayo (S. griseus). Determinar los patrones de distribución poblacional de pitayo en el área de interés. 2 II. REVISIÓN DE LITERATURA 2.1. Tipos de vegetación xerófila La flora de los matorrales xerófilos es rica en endemismos, en estas áreas las cactáceas encuentran su nicho ecológico preferido (Rzedowski, 1994). Este tipo de vegetación, se distribuye en la mayor parte de la Península de Baja California, grandes porciones de la zona costera y montañas bajas de Sonora; es muy característica del altiplano, y se extiende desde Chihuahua y Coahuila hasta Jalisco, Zacatecas, Guanajuato, San Luis Potosí, Querétaro, Hidalgo y el Estado de México, llegando incluso a la Mixteca Oaxaqueña y Poblana (Scheinvar, 2004). El clima de estas zonas es variable; presenta temperaturas frescas a los 3000 msnm, e inviernos rigurosos; aunque en las zonas bajas, la insolación es muy intensa y la humedad atmosférica disminuye, por lo que alcanzan valores de evaporación y transpiración muy altos (Flores et al., 1974; Rzedowski, 1994; Challenger y Caballero, 1998; Azcárraga y Arbiza, 2001). Este tipo de vegetación se desarrolla en suelos volcánicos, sedimentarios o metamórficos, desde someros hasta muy profundos, con drenaje deficiente y en ocasiones ciertos niveles de salinidad; se localiza entre los 600 a 2300 m de altitud y en algunas ocasiones hasta los 2500 m. Dentro de este tipo de vegetación Flores et al., (1974) y Rzedowski (1994), agrupan a los matorrales micrófilo, rosetófilo, crassicaule, submontano y chaparral o encinar arbustivo, a los que Scheinvar (2004) denomina comunidades vegetales. Las plantas que predominan en las zonas áridas y semiáridas, son las arbustivas de hasta 4 metros de altura; presentan tallos ramificados desde la base y tienen características morfológicas y fisiológicas que les permiten vivir en condiciones de escasez de agua, presentando para esto tallos y hojas crasos recubiertos de cera; muchas de estas plantas muestran espinas o acúleos; en ocasiones carecen de hojas, y cuando las presentan, están reducidas y coriáceas, pueden ser simples o estar compuestas de pequeños foliolos, los que caen en la época de sequía; los tallos, muchas veces verdes y globosos, presentan costillas o tubérculos; los estomas superficiales se mantienen cerrados durante el día y se 3 abren por las noches, acción que les ayuda a reducir el efecto de los rayos ultravioleta y la pérdida de agua (Scheinvar, 2004). Rzedowski (1994), señala que, en cuanto a fisionomía y estructura, existe una gran diversidad de plantas, dada la notable variedad de formas biológicas que interactúan y de las que dependen otras especies (Challenger y Caballero, 1998); otro hecho importante de este tipo de vegetación es su organización, que en ocasiones es muy sencilla y en otras reviste un notable grado de complejidad, pudiendo distinguirse hasta 5 estratos, con dominancia parcial de una especie; los numerosos tipos de organismos y formas biológicas muestran claras interdependencias entre especies, de modo que muchas plantas no están uniformemente repartidas y algunas tienden al gregarismo (Rzedowski, 1994). En el matorral micrófilo se agrupan las comunidades de plantas que tienen hojas o foliolos pequeños. De acuerdo con Rzedowski (1994), estas poblaciones de plantas ocupan la mayor parte del territorio árido de México; prospera principalmente sobre llanuras, las partes bajas de los abanicos aluviales y en laderas de los cerros; se extienden a las zonas más secas del país, con precipitaciones que no superan los 150 mm anuales, por lo que las plantas que allí prosperan son muy tolerantes al deficiente drenaje del suelo y ciertos niveles de salinidad. Las especies que componen este matorral son principalmente Larrea tridentata (Sessé & Moc.), Ambrosia dumosa (A. Gray ex Torr.), Ephedra spp., Dalea spp., Flourensia cernua DC, Mortonia spp., Fouqueria spp., Prosopis laevigata (Humb. et Bonpl. ex Willd) y Acacia spp. (Flores et al., 1974; Rzedowski, 1994). En el matorral crassicaule abundan plantas crasas y conspicuas, en las laderas y lomeríos, sobre suelos someros y pedregosos derivados de rocas ígneas, andesitas, riolitas y basaltos (Scheinvar, 2004). La precipitación anual en las zonas donde predomina esta comunidad vegetal, fluctúa de 300 a 600 mm anuales y la temperatura anual oscila de 16 a 22ºC. (Flores et al., 1974; Rzedowski, 1994). 4 El tipo de vegetación anteriormente mencionado es abierto o medianamente denso y florísticamente rico, presenta arbustos de 1 a 5 metros de altura, en los que predominan los nopales (Opuntia), cactáceas con tallo globoso y algunas especies pertenecientes a los géneros Agave, Mimosa, Zaluzamia, Karwinskia, Jatropha, Bursera, Coryphantha, Ferocactus, Mamillaria y Neolloydia; en el estrato superior, que va de 4 a 5 metros de altura, se observan las especies de los géneros Prosopis, Acacia y Yucca (Scheinvar, 2004); en algunas regiones del país predomina, Cercidium microphyllum (Torr.) Rose & Johnst., Pachicereus pringlei (S. Watson) Britton & Rose, Lophocereus schottii (Engelm) Britton and Rose, Machaerocereus gummosus (Engelm) Britton and Rose, Carnegiea gigantea (Engelm.) Britton & Rose y los géneros Lycium, Fouqueria, Larrea, Lysiloma, Acacia, Ambrosia; Myrtillocactus geometrizans (Mart.) DC. y Stenocereus spp. (Flores et al., 1974; Rzedowski, 1994) El matorral rosetófilo está constituido por arbustos cuyas hojas tienen forma de roseta, éstas son carnosas y coriáceas, de ápice y bordes espinosos, que prevalecen en grandes extensiones de suelos cerriles derivados de rocas ricas en carbonatos de calcio (Rzedowski, 1994); los principales géneros y especies que presenta esta comunidad vegetal son Agave spp., Dasylirion spp., Yuca filifera (Chabaud), Opuntia spp., Coriphantha erecta (Lem. ex Pfeiff.) Lem., Echinocactus platyacanthus (Link & Otto), Isolatocereus dumortieri (Scheidw.) Backeb., Lophophora williamsii (Lem. ex S.D.) Coult., Mammilaria elongata DC., Myrtillocactus geometrizans (Mart.) DC., Neolloydia conoidea (DC.) Britt. & Rose, Strombocactus disciformis (De Candolle) Britton & Rose, y Thelocactus spp. (Flores et al., 1974; Rzedowski, 1994; Scheinvar, 2004). El matorral submontano puede ser denso y alto, o bien, bajo y espaciado, y crece sobre suelos someros y pedregosos, en laderas y cañones; prospera en lugares menos áridos, sobre suelo mejor desarrollado donde la diversidad florística depende de la humedad, suelo y exposición de las plantas (Scheinvar, 2004). Su estrato más alto alcanza hasta los 4 metros, en él las plantas tienen hojas verdes y pequeñas, además son algo abundantes algunas especies de trepadoras, 5 aunque predominan algunas especies de Acacia, Bahuinia coulteri (Macbr.) Britton & Rose, Clematis pitcheri Torr. & Gray, Tournefortia volubilis L., Helietta parvifolia (Gray ex Hemsl.) Benth., Neopringlea integrifolia (Hemsl.) S. Wats., Gochnatia hypoleuca (DC.) Gray, Phithecellobium brevifolium A. Gray, Cordia boissieri A. DC. y algunas cactáceas como Ferocactus glaucensces (DC.) Britton & Rose, Stenocactus crispatus (DC.) A.Berger ex A.W.Hill, Thelocactus leucacanthus (Britton & Rose) y Turbinicarpus pseudomacrochele (Backeb.) Buxb. & Backeb. (Rzedowski, 1994, Scheinvar, 2004). 2.2. Características generales de las cactáceas Las cactáceas tienen las estructuras básicas de las demás plantas, pero se distinguen de ellas por las grandes modificaciones anatómicas que han desarrollado para adaptarse a las condiciones de aridez, lo que les facilita la acumulación del agua absorbida en los cortos periodos de lluvia, y les evita de manera significativa la evapotranspiración, de tal forma que el agua captada se almacena en los tejidos durante el periodo de estiaje (Bravo y Scheinvar, 1999). Scheinvar (2004) describe a las cactáceas como plantas perennes, suculentas, generalmente espinosas, terrestres o rupícolas en algunos casos, geófitas, rastreras, arbustivas, arborescentes o epifitas. Estas plantas presentan epidermis lisa o pubescente, las raíces en algunas especies son fibrosas y en otras tuberosas; el tallo es globoso en especies pequeñas, cilíndrico, columnar o aplanado en especies que llegan a medir más de 4 metros; las especies de tallo globoso exhiben tubérculos o mamilas dispuestas en series espiraladas con un número casi siempre constante para cada especie; en algunas ocasiones presentan tubérculos coalescentes que forman costillas, alas y en muchos casos son aplanados y verdes como en Opuntia spp. Las hojas de esta familia de plantas son laminares en los géneros considerados como primitivos, efímeras o ausentes en los demás géneros. Las aréolas tienen meristemos vegetativos y reproductivos equivalentes a las yemas axilares; presentan lana, fieltro, cerdas, pelos, espinas, glóquideas y glándulas, y pueden producir ramas y flores. Las flores son zoófilas, generalmente sésiles, solitarias y 6 raramente están agrupadas en inflorescencias, en panículas o racimos (Pereskia spp.), o terminales (Pterocactus spp.); generalmente son hermafroditas, aunque en muy raras ocasiones son unisexuales, y por lo general son actinomorfas (Scheinvar, 2004). En cuanto al pericarpelo, el tejido del tallo ubicado alrededor del ovario presenta un tubo receptacular, que en ocasiones está ausente, es glabro y está recubierto de aréolas dispuestas en series espiraladas sobre podarios más o menos marcados; está provisto de escamas basales que en la parte superior se integran con los segmentos exteriores del perianto. El pericarpelo presenta lana, glóquidas, cerdas y espinas. El perianto está constituido de segmentos petaloides (tépalos) exteriores e interiores, establecidos en series espiraladas, regularmente son numerosos. El ovario es súpero sólo en una especie (Pereskia aculeata P. Mill.), en el resto de las especies es ínfero o semiínfero, unilocular; el estilo es único y sobresale algo del conjunto de los estambres superiores. Los óvulos generalmente presentan largos funículos. El fruto es carnoso, semiseco o seco, indehiscente o dehiscente, en ocasiones liso o con aréolas provistas de escamas, pelos, espinas o cerdas; su suculencia es resultado de la acumulación de azucares en los funículos durante la maduración. Las semillas tienen perisperma y rara vez con restos del endospermo; y pueden ser de testa delgada o gruesa. (Bravo y Sánchez, 1978; Bravo y Scheinvar, 1999; Scheinvar, 2004). Las cactáceas se distinguen de las demás plantas porque presentan carboxilaciones separadas en el tiempo, es decir absorben el CO 2 durante la noche y realizan la fotosíntesis durante el día, por lo cual se les llama plantas con metabolismo CAM, o plantas CAM (crassulacean acid metabolism); ésta es una adaptación fisiológica y morfológica que evita la evapotranspiración al mantener cerrados los estomas durante el día lo que permite a estas especies habitar y competir en ambientes con limitaciones de agua, CO2, y temperaturas extremas (Fontúrbel, 2001; Geydan y Melgarejo, 2005), sin embargo, este metabolismo tiene como desventaja, que la tasa de crecimiento y la producción primaria durante el período más favorable del año, es baja en comparación con las demás plantas (Gibson, 1986). 7 2.2.1. Origen y evolución de las cactáceas Gibson (1986) asegura que las cactáceas se originaron hace 90 millones de años en las Antillas Mayores (Cuba, Jamaica, y Puerto Rico), que en ese momento conformaron una gran cadena montañosa que corría desde México hasta Colombia, y que tras los movimientos de las placas tectónicas y consecuentemente la modificación del continente lograron dispersarse desde Sudamérica hasta Norteamérica, principalmente las del género Pereskia, que evolucionaron después, según la región de establecimiento, hacia otros géneros y especies. De acuerdo con Bravo y Sánchez (1978), las cactáceas consideradas como autóctonas del Continente Americano y distribuidas en las zonas áridas y semiáridas, especialmente en el norte del país, se diversificaron y adaptaron a las diferentes situaciones de estrés que ofrecen estas zonas debido a sus peculiares condiciones de latitud, topografía y diversos tipos de clima. Benson (1969) señala que en el caso específico de la costa oeste de los Estados Unidos de Norteamérica, fueron graduales las adaptaciones de las Cactáceas, y de otros grupos de plantas durante el periodo cretácico, Entre las adaptaciones más notables que adquirió el tallo para soportar las condiciones de aridez, destaca la que le permitió almacenar y conservar el agua en sus tejidos; como consecuencia del gran desarrollo de los parénquimas, responsables de la suculencia; la reducción de la superficie transpiratoria al adquirir formas globosas; la atrofia hasta estados vestigiales del limbo de las hojas o su transformación en escamas, espinas o glóquideas; el engrosamiento de la cutícula y de las membranas celulósicas de los tegumentos; las excrecencias cerosas de las células epidérmicas; la disposición hundida de los estomas. Una de las características más importantes de esta familia es que sus raíces facilitan la absorción rápida y la conservación del agua, dada la gran longitud que adquieren algunas de ellas (Bravo y Sánchez, 1978). 8 La domesticación y los procesos de evolución, son el resultado de la manipulación de los organismos vivos, de los cuales se seleccionan fenotipos con características sobresalientes, de esta manera se originan plantas con mejores cualidades tanto desde el punto de vista alimenticio como del medicinal. Otra causa de la evolución es el aspecto genético, en él interviene la selección en poblaciones pequeñas o en una sola planta, como efecto de la perturbación y fragmentación natural del hábitat, y en muchos de los casos el traslado de individuos silvestres a los hábitats humanos. A través de la historia, con las migraciones humanas, comercio, cambios culturales, la conquista y colonización de nuevas áreas, se desplazaron poblaciones de plantas y animales, que iban adaptando su morfología o fisiología para prosperar en su nuevo hábitat (Casas y Caballero, 1996; Casas y Barbera, 2002). Actualmente las variaciones morfológicas y las características de los frutos de las especies del género Stenocereus, están influenciadas por condiciones ambientales, pero también son resultado de la manipulación humana. 2.2.2. Características morfológicas de las cactáceas Las raíces de las cactáceas algunas veces son adventicias, sus funciones son fijar la planta en el suelo, absorber sustancias nutritivas disueltas en el agua (Ramírez, 2007), y algunos géneros pueden almacenarla en sus tejidos. La raíz principal es el sistema de fijación debido a que se introduce y se desarrolla de forma proporcional al tamaño de la planta; las raíces secundarias por su parte, intervienen en la absorción, donde la longitud, profundidad y grado de ramificación están en función del factor humedad y demás características del suelo. En la época de lluvias se desarrollan numerosas raíces y pequeñas raicillas blancas que están provistas de pelos absorbentes y que normalmente son caducas ya que su vida útil se limita a la temporada de lluvias (Benson, 1969; Bravo y Sánchez, 1978, Gibson y Nobel 1986). Los tallos de las cactáceas tienen formas muy diversas, pero son constantes en cada entidad taxonómica; por ejemplo el género Mammilaria se caracteriza por presentar un tallo globoso, mientras que las plantas del género Pereskia poseen 9 un tronco bien definido del cual salen ramas de primer orden, que a su vez se ramifican hasta formar una amplia copa. Las ramas son sucesivamente más delgadas, algo suculentas, cilíndricas y están integradas por varios entrenudos y nudos. Las diferentes especies del género Opuntia, tienen tallos arbustivos y, generalmente poseen un tronco del que salen ramas cilíndricas o artículos provistos de series espiraladas de tubérculos que casi se tocan entre sí por el acortamiento de los entrenudos; el tronco es más o menos cilíndrico pero las ramas que de él se originan, son aplanadas y discoideas en forma de raqueta; en la subfamilia Cereoideae los tallos están más o menos ramificados, el tronco es arbustivo y las ramas delgadas, o están reducidos a un solo artículo, en el que el tallo y ramas son gruesos, y el tejido leñoso se desarrolla ampliamente (Bravo y Sánchez, 1978; Scheinvar, 2004). El número de costillas varía desde 2 en el género Epiphyllum, hasta 100 en Echinofossulocactus; el número de ellas va aumentando con la edad. En cuanto a forma, varía desde muy angosta y de aristas agudas hasta anchas y de aristas redondeadas; en ocasiones la profundidad de las costillas es muy marcada, también pueden presentarse aplanadas, plegadas y onduladas; en algunas especies las costillas rectas pueden tornarse espiraladas como en Ferocactus recurvus (C. Glass) G. Unger (Benson, 1969; Bravo y Sánchez, 1978). En este grupo de plantas sólo presentan hojas los géneros más primitivos, como Pereskia, Pereskiopsis y Quabentia (Britton y Rose, 1937; Benson, 1969; Bravo y Sánchez, 1978); en ellas el limbo es grueso, carnoso y de forma orbicular o elíptica; el peciolo es muy corto y en algunas ocasiones no se presenta. El parénquima en empalizada se encuentra en el haz del limbo; en las Opuntioideae la base de la hoja se transforma en un tubérculo poco prominente, el peciolo desaparece y el limbo se reduce adquiriendo forma cónica o cilíndrica y es generalmente caduco; a veces puede persistir transformado en espina. En la familia Cereoideae el limbo de las hojas se atrofia y sólo quedan vestigios primordiales de éste y la base se hipertrofia en un podario prominente que, de forma asilada, constituye el tubérculo, o asociado con otros en hileras longitudinales integra las costillas (Bravo y Sánchez, 1978). 10 Las aréolas son órganos peculiares y complejos de las cactáceas, situadas en las axilas de las hojas, (Britton y Rose 1937), de las que se forman hojas reducidas, flores, nuevos tallos, espinas glóquidas, cerdas, pelos y a veces raíces adventicias. En la mayoría de las especies, al centro de las aréolas presenta un meristemo de crecimiento, integrado por dos porciones la abaxial (externa) que forma espinas y la adaxial que origina las flores. La abaxial inicia su actividad, y una vez formadas las espinas se activa la parte adaxial para la formación de las flores. (Benson, 1969; Bravo y Sánchez, 1978). Las espinas son órganos muy característicos de las cactáceas, consideradas hojas modificadas, se presentan diferentes tipos de éstas; las gruesas o defensivas, las suaves y las glandulares; las cuales tienen diferentes tamaños, formas y colores (Britton y Rose, 1937). Dentro de la aréola se pueden observar comúnmente dos tipos de espinas: las radiales que son más cortas y delgadas, y que están dispuestas en la periferia, y las centrales, que a diferencia de las anteriores son más largas y gruesas. Sin embargo, en algunos géneros y especies no se presentan, como en Lophophora, Aztekium, Astrophytum myriostigma Lem., Astrophytum asterias (Zucc.) Lem., Epiphyllum, Opuntia y Rhipsalis (Bravo y Sánchez, 1978). La flor presenta caracteres típicos anatómicos determinados por la adaptación al medio seco y por las diferentes formas de polinización. La flor está conformada por la zona pedicular, el hipanto o pericarpelo, el tubo receptacular, los verticilos florales, androceo y gineceo. El eje floral de las cactáceas, presenta podarios, escamas y aréolas; que además de producir lana y espinas, pueden desarrollar ocasionalmente nuevos brotes (Gibson y Nobel, 1986). La flor se desarrolla a partir de una yema protegida por escamas dispuestas en espiral, y se localiza en el ápice de los tallos o lateralmente. El desarrollo de la flor, hasta la etapa adulta, es distinto en las tres subfamilias Pereskioidae, Opuntiodeae y Cereoideae (Bravo y Sánchez, 1978). El fruto es el resultado de la transformación del ovario después de la fecudación, en su desarrollo interviene el ovario y el pericarpelo; debido a las estructuras del 11 pericarpelo los frutos tienen diversos aspectos; asimismo, tienen coloraciones amarillentas, verdosas, rojas, o purpúreas muy intensas. Generalmente, los frutos son carnosos y comúnmente no se abren, pero existen excepciones como en el peyote (Lophophora williamsii Lemaire Coult), que son secos y dehiscentes. Los frutos pueden presentar de dos a tres semillas o más de 3000 (Bravo y Scheinvar, 1999). Las semillas de las cactáceas generalmente son pequeñas, de 1 a 2 mm de longitud, pero existen algunas que pueden llegar a medir hasta medio centímetro, como en Nyctocereus spp. ; además tienen distintas formas: globosas, discoides, reniformes y ovoides; su color puede variar desde el crema hasta el negro. Las semillas se integran por el embrión y los cotiledones, estos últimos presentan las cubiertas protectoras; una interna y delgada llamada tegmen y otra externa y gruesa provista de poros, verrugas o tubérculos (Gibson y Nobel, 1986; Bravo y Scheinvar, 1999). 2.2.3. Ecología de las cactáceas Las cactáceas interactúan con diversos organismos y elementos del ecosistema en que se desarrollan y prosperan; tal es la relación que guardan diversos individuos de cactos con árboles, arbustos y en algunas ocasiones con las rocas (Gutiérrez, 2001; 2004), pero algunas plantas modifican su entorno inmediato; al respecto se ha observado y documentado la presencia de asociaciones de plantas que se agrupan y desarrollan debajo del dosel, de los árboles y arbustos (Challenger y Caballero, 1998; Padilla y Pugnaire, 2006), A esta asociación se denomina nodrizaje o asociación con plantas nodrizas (Challenger y Caballero, 1998; Gutierrez, 2001; 2004; Novoa et al., 2005), la asociación entre los arbustos leñosos y las cactáceas, sirve para enfrentar las inclemencias del medio en las zonas áridas y semiáridas, las plantas nodrizas ofrecen condiciones de humedad y temperatura favorables tanto para la germinación y establecimiento de las nuevas plántulas (Padilla y Pugnaire, 2006). Uno de los mecanismos más importantes que las plantas nodrizas tienen para modificar el microambiente de los cactos es, que reducen la incidencia de la radiación solar y con ello se abate 12 la temperatura, de modo que la sombra que proporciona la planta nodriza a las plántulas, es de vital importancia para evitar daños tisulares sobrecalentamiento (Valiente-Banuet et al., 1991; Challenger por y Caballero, 1998). En este tipo de relación, las plantas nodrizas, no reciben nada a cambio; por el contrario cuando las plántulas crecen y son individuos mucho más grandes que éstas, comienza una competencia por agua y nutrientes, donde el cacto llega a desplazarla, debido a que sus raíces son extensas y superficiales, esto les permite captar mayor volumen del agua de lluvia lo que en algunas ocasiones provoca la muerte prematura de la planta nodriza, y aun después de muerta, el cacto sigue beneficiándose, pues deja de existir competencia y se incorporan al suelo los nutrientes mientras los restos de las nodrizas se van degradando. Por otro lado, si las plantas asociadas son relativamente pequeñas en la madurez, la competencia no es tan intensa, de modo que la asociación puede continuar hasta que alguna de ellas termine su ciclo de vida, como en el caso de los cactos globosos (Valiente-Banuet et al., 1991; Challenger y Caballero, 1998). Debido al calor intenso de las regiones donde esta familia de plantas se distribuye y prospera, son pocos los animales que permanecen activos durante el día, por lo que muchos polinizadores son nocturnos, es el caso de los murciélagos, principales polinizadores de muchas especies de cactos columnares y candelabriformes entre ellos Stenocereus spp.; aunque en menor cantidad, las palomillas y otros insectos participan en la polinización; la función de los murciélagos es tan indispensable, que la floración de varias especies de cactos columnares se sincroniza con la migración anual que varias especies de murciélagos realizan hacia los Estados Unidos de Norteamérica, provenientes de Centroamerica, beneficiando a los murciélagos con su abundante fuente de alimentos y garantizando así su propio éxito reproductivo. (Valiente-Banuet, 1996; Challenger y Caballero, 1998; Valiente-Banuet, 2002). El colibrí es otro polinizador importante de estas plantas, sobre todo en aquellas flores cuya morfología (tubulares con nectarios basales) complica la alimentación de los 13 murciélagos; en ellas los picos largos de estas aves son la adaptación perfecta para la polinización de las flores (Challenger y Caballero, 1998). Los frutos de muchas especies de cactáceas juegan un papel muy importante en el ecosistema, pues son el alimento de aves y murciélagos en las temporadas de fructificación, y en muchas ocasiones representan la vía de dispersión de las semillas (Soriano et al., 1999). 2.3. Características generales de Stenocereus El nombre proviene del griego “Stenos” que significa delgado y es relativo a las costillas delgadas de la planta (Scheinvar, 2004). Las plantas del género Stenocereus suelen ser grandes, pueden alcanzar hasta los 12 metros de altura, y la mayoría ramificada desde la base, cada rama puede presentar hasta 20 costillas; la base de las aréolas está cubierta con fieltro de color blanco, marrón o gris y con espinas, las que por lo general son robustas y cuyo número puede variar en cada una de las aréolas; muchas de las flores apicales son diurnas y en algunas especies nocturnas, tienen forma tubular, de embudo o campana (tubular infundibuliforme), el tubo receptacular es grueso, presenta numerosos estambres los cuales se insertan en él, y no son más largos que el perianto, presenta lóbulos papilosos. El fruto es carnoso y está cubierto con aréolas lanosas y espinas, que en el momento de la madurez son caducas; las semillas son muy pequeñas, numerosas y de color negro (Britton y Rose, 1937; Rivas, 1998). Todas las especies de Stenocereus presentan cristales (cuerpos de silicatos) en la piel (epidermis), y la corteza del tallo es altamente mucilaginosa. Estas especies están distribuidas en tres grupos; el primero, donde se ubica a Stenocereus stellatus (Pfeiffer) Riccobono y S. treleasei (Britton & Rose) Backeb., que se distribuyen principalmente en el sur del país, estas especies tienen gran similitud en hábito de crecimiento, flores y frutos, además la anatomía del tallo es casi idéntica (Gibson y Horak, 1978; Mercado y Granados, 1999). 14 El segundo grupo está integrado por Stenocereus griseus (Haworth), S. hystrix (Haw.) Buxbaum y S. longispinus (Britton & Rose) Buxb., estas especies presentan similitudes en las características externas del tallo, al igual que en sus estructuras reproductivas e incluso comparten conjuntos similares de triterpenos no comunes en el tallo; otra característica muy particular es la adaptación de sus flores, que les sirve para ser polinizadas por los murciélagos (Gibson y Horak, 1978; Mercado y Granados, 1999). El tercer grupo está conformado por Stenocereus beneckei (Ehrenb.) Berger & Buxbaum, S. martinezii (J.G.Ortega) Bravo, S. montanus Buxb., S. queretaroensis (Weber) Buxbaum, S. quevedonis (J.G.Ortega) Bravo y S. thurberi (Engelm.) Buxb.; estas especies presentan tricomas rojas en las aréolas de los tallos, son muy parecidos los rasgos externos de sus costillas: ya que éstas presentan márgenes pronunciadamente sinuosos; de las seis especies, cuatro tienen contenidos muy parecidos de ácido queretaroico triterpeno (Gibson y Horak, 1978; Mercado y Granados, 1999). 2.3.1 Origen y evolución de Stenocereus El género Stenocereus al igual que las demás cactáceas columnares derivaron de formas ya establecidas en la Antillas y norte de Sudamérica; el aislamiento geográfico permitió su posterior evolución de forma relativamente independiente; después del establecimiento de estas plantas en México se esparcieron líneas de especiación hacia el noreste del país (Gibson y Horack, 1978; SánchezMejorada, 1984; Mercado y Granados, 1999). El género Stenocereus ha ido evolucionando con el paso del tiempo, uno de sus principales cambios es quizá el de realizar la antesis de sus flores por la noche, fundamental para la polinización, pues de acuerdo con Casas y colaboradores (1999), la polinización nocturna que realizan los murciélagos le asegura un 75% de su producción de frutos, en comparación con la nula producción de frutos si ésta se efectuara durante el día (Casas et al., 1999); no obstante los frutos tuvieron que evolucionar para ser atractivos a los pájaros, los encargados de la dispersión de las semillas (Gibson y Horack, 1978, Mercado y Granados, 1999). 15 Por otra parte, Casas y Barbera (2002) señalan que las variaciones, principalmente morfológicas, que se tienen actualmente en los frutos y en la polinización, son consecuencia primeramente del control genético (manipulación humana), y en cierta medida influenciado por condiciones ambientales (Casas et al., 1999); el mismo autor establece que durante el manejo tradicional y proceso de domesticación de Stenocereus stellatus (Pfeiffer) Riccob, se van seleccionando los mejores individuos, hasta obtener frutos con características deseadas. 2.3.2. Características morfológicas y fisiológicas de Stenocereus Las plantas de este género pueden ser arbustivas o arborescentes, alcanzan hasta 12 m de altura; presentan un tallo columnar, tronco bien definido y candelabriforme; ramas numerosas, en las cuales se muestran tubérculos coalescentes, de 5 o más costillas que están pobladas de aréolas con pelos glandulares, los que varían del color blanco hasta el negro, pasando por el marrón, gris y café (Scheinvar, 2004). Su sistema radical es principalmente superficial y responde rápidamente a la presencia de humedad, iniciando la formación de raíces absorbentes pocas horas después de la lluvia, con lo que aprovecha al máximo la humedad. Sin embargo, es muy sensible a encharcamientos, los cuales provocan la putrefacción de la misma (Ramírez, 2007). Los tallos cuentan con una cutícula gruesa y cerosa que evita la pérdida de agua, presentan metabolismo CAM que contribuye al mismo propósito. En sustitución de las hojas, la planta cuenta con espinas que, entre sus diversas funciones, ayudan a disminuir la pérdida de agua y a proteger los tallos de las condiciones ambientales adversas y de los depredadores (Ramírez, 2007). Las flores son tubulares-infundibuliformes y emergen de las aréolas de crecimiento, presentándose una flor por aréola, la cual queda inactiva después de la floración; son nocturno-matutinas (cerrándose al medio día). Las flores pueden ser laterales o subapicales, presentan pericarpelo o tubo craso, 16 revestido de podarios más o menos prominentes y oblongos, sus aréolas tienen escamas basales reducidas, de cuyas axilas emerge lana corta y en la antesis pueden presentarse algunas espinas emergentes. Los estambres son muy numerosos, y se encuentran insertos en las paredes del tubo (Scheinvar, 2004; Ramírez, 2007). Los frutos son bayas constituidas por el desarrollo de los carpelos fusionados y el pericarpelo; son espinosos, carnosos y dehiscentes en la madurez; la pared externa o epicarpo presenta aréolas provistas de lana y espinas caducas en la madurez; tiene numerosas semillas de color negro, con testa brillante, y verrucosa (Gibson y Nobel, 1986); la pulpa se desarrolla a partir de los funículos de los óvulos fecundados (Scheinvar, 2004; Ramírez, 2007). Existe una gran variedad de frutos, de acuerdo con su forma pueden variar de esféricos hasta oblongos; el color de la pulpa varía desde el amarillo hasta el rojo púrpura. Esta coloración se debe a diversas sustancias entre las que sobresalen las betalainas, características de la familia y que fisiológicamente contribuyen a evitar la degradación de la clorofila en condiciones de temperatura y radiación solar extremas y, de la misma forma, ayudan a reducir los efectos oxidantes de los radicales libres. Otra característica sobresaliente de los frutos es su sabor dulce, ya que su concentración de azucares oscila entre los 15 y 19º Brix (Ramírez, 2007). 2.3.3. Ecología de Stenocereus Stenocereus es un género de gran importancia en los ecosistemas áridos, al respecto Soriano y colaboradores (1999), señalan que en Venezuela 19 especies de aves consumen los frutos de S. griseus Haworth; algunos mamíferos también incluyen en su dieta frutos de pitayos, es el caso del cacomixtle; Nava y colaboradores (1999) analizaron el excremento de este mamífero y encontraron que aproximadamente el 10 % de su dieta se compone de S. dumortieri (Scheidw.) Buxb.; indican también que en la época de secas (febrero a mayo) es cuando el consumo de Stenocereus se hace necesario. Por otra parte Valiente-Banuet (1996, 2002) menciona la importancia que tiene la 17 floración de Stenocereus y de otras plantas que sirven de alimento a los murciélagos que las polinizan, y consumen sus pitayas durante la migración que realizan hacia el norte del continente; Luna y colaboradores (2001), señalan que en condiciones de traspatio los tallos de Stenocereus son consumidos tanto por el ganado bovino como por el caprino y que los frutos son depredados por hormigas y aves. 2.3. Importancia del género Stenocereus El pitayo reviste gran importancia ya que tiene numerosos y variados usos; sin embargo se ha aprovechado principalmente como alimento, especialmente sus frutos, los cuales se consumen frescos o se pueden utilizar para la preparación de aguas frescas (combinando la pulpa con agua, jugo de limón y azúcar), ponche (se elabora mezclando frutos que no han madurado completamente, con mezcal y azúcar), helados y nieves; además, se utilizan como base para la elaboración de licores, concentrados de pitaya que se usan como base de productos de panificación y derivados lácteos, o bien como materia prima en la elaboración de mermeladas (Nobel, 1986; León y Domínguez, 1991; López, 1999; Luna y Aguirre, 2001; Luna et al., 2001; González, 2006 ). La pitaya tiene un valor nutricional importante, pues es rico en fibra cruda y en proteína, en comparación con otros frutos, como se indica en el Cuadro 1. Cuadro 1. Composición porcentual del futo integro y de la pulpa de Stenocereus griseus. Componente Fruto integro Pulpa 6.93 16.76 6.67 1.00 68.64 9.07 23.15 3.23 0.84 63.71 Proteína Fibra cruda Cenizas Grasas Extracto libre de nitrógeno (ELN) Fuente: González, 2006 Otro uso potencial que tiene el fruto del pitayo, es la extracción de colorantes, que van desde el rojo (betacianinas) hasta el amarillo (betaxantinas), las cuales están contenidas tanto en la cáscara como en la pulpa del fruto; el uso de estos 18 colorantes está aprobado por la FDA (Food and Drug Administration) de los Estados Unidos de Norteamérica, y en México por la Secretaria de Salud, por lo que se permite su utilización en cosméticos y alimentos. La pitaya tiene un importante potencial pigmentario, pues su colorante es altamente soluble en agua, y el fruto puede emplearse como materia prima para la extracción de pigmentos naturales y de ésta manera sustituir los colorantes artificiales usados actualmente en la elaboración de alimentos (Fuentes, 2005; Santacruz et al., 2006; Mandujano, 2006). Ingerir la pulpa de la pitaya funciona terapéuticamente para el control y cura de algunos malestares estomacales, gastritis, ulceras, reumatismo, disentería, diabetes, obesidad, enfermedades del corazón, y algunas especies son utilizadas como analgésicos, anti-inflamatorios o como agente diurético (Casas y Barbera, 2002; Ramírez, 2007). Aprovechando la facilidad con que el pitayo se reproduce de manera vegetativa, se utiliza en las parcelas y terrenos como cercos vivos o como barreras para evitar la erosión (León y Domínguez, 1991; López et al., 2000; Gutiérrez, 2001; Casas y Barbera, 2002). Los cercos no siempre se establecen sólo con la planta del pitayo, sino que en ocasiones se alternan con postes de madera dura y alambre. Las cactáceas, se plantan muy densamente, de modo que cuando se desarrollan constituyen una barrera infranqueable. Existe la costumbre de hacer podas periódicas para mantener los cercos entre 1.5 y 2.0 m de altura (Fuentes, 2005). Soriano y colaboradores (1999) mencionan que 19 especies de aves utilizan los frutos de Stenocereus griseus Haworth y S. repandus (L.) Mill. como alimento, al igual que algunos mamíferos como el cacomixtle, que en la temporada de estiaje (febrero a mayo) consumen frutos de Stenocereus dumortieri (Scheidw.) Buxb. (Nava et al., 1999); otra función de las plantas de este género, es brindar hábitat a las diferentes especies de aves que construyen sus nidos en ellas aunque algunas otras utilizan los huecos formados por pájaros carpinteros para colocar en ellos sus nidos (Whitacre y Vásquez, 1997). Por otra parte Valiente-Banuet 19 (1996; 2002) expone la importancia de la floración del género Stenocereus y otras especies que sirven de alimento a los murciélagos que polinizan las flores y consumen las pitayas durante la migración que realizan hacia el norte del continente; Luna y colaboradores (2001), señalan que en condiciones de traspatio los tallos de Stenocereus spp. son consumidos, en ocasiones, tanto por el ganado bovino como el caprino y que los frutos son depredados por hormigas y aves. 2.4. Patrones de distribución del pitayo El conocimiento de las unidades de vegetación y de los componentes florísticos en un área de estudio, constituye un instrumento indispensable para su adecuado manejo y conservación de los recursos naturales presentes en él (González y González, 1993). Al respecto Arellano y Rangel (2008), indican que el análisis de vegetación nos permite abordar la especialización de la distribución de las unidades de vegetación e igualmente, detectar factores importantes que influyen en la salud y en el estado de conservación de los variados ecosistemas. El análisis de los patrones de distribución de la vegetación constituye una herramienta muy valiosa para los estudios evolutivos, puesto que permite realizar inferencias acerca de los procesos que determinan dicha distribución, y que pueden conducir a la diversificación de las poblaciones. De hecho los patrones espaciales resultan de la acción combinada de diversos factores que se expresan de modo diferente a distintas escalas (Solís y Panseri, 2004); por ello las complejas interacciones que se establecen entre los patrones de vegetación están controladas por diversos factores ambientales y de manejo que varían su importancia según la región y las características locales (Molinillo y Monasterio, 2002). Para obtener la información a utilizarse en el análisis de vegetación y caracterización posterior de los patrones de distribución existentes, se utilizan diferentes métodos de muestreo; 1) transectos, 2) transectos variables, 3) cuadrantes, 4) punto centro cuadrado, 5) líneas de intercepción, y 6) puntos 20 de intercepción (Andersen 1993; Mostacedo y Fredericksen, 2000; Leis et al., 2003). El método de los transectos es ampliamente utilizado por la rapidez con que se mide, la obtención de datos es dinámica, es económico y además permite muestrear con mayor heterogeneidad la vegetación. Un transecto es un rectángulo situado en un lugar para medir ciertos parámetros de un determinado tipo de vegetación. El tamaño de los transectos puede ser variable y depende del grupo de plantas a medir, en las zonas en las que se muestrea vegetación arbórea con diámetros de 20 cm es recomendable utilizar transectos de 10 x 50 m o 10 x 100 metros, los datos que se obtendrán se definen previamente (Mostacedo y Fredericksen, 2000; Bautista, 2004). Hasta el momento se han realizado pocos estudios referentes a los patrones de distribución del género Stenocereus; y en su totalidad están enfocados básicamente a la relación y asociación del estrato que forman estas plantas con otros estratos dentro del ecosistema, y no se han considerado las relaciones existentes entre las características morfológicas de la planta (Luna et al., 2001). 21 III. MATERIALES Y MÉTODOS 3.1. Localización del área de estudio El municipio de San Ciro de Acosta, S. L. P. ,se encuentra localizado en la parte sureste del estado, entre las coordenadas 99º 49’ de longitud oeste y 21º 39’ de latitud norte, situado a una altura de 900 metros; ocupa una superficie de 614.73 km2, lo que representa el 1.02% del territorio estatal. Limita al norte y oeste con el municipio de Ríoverde, al noreste y al este con el municipio de Lagunillas y al sur con los estados de Guanajuato y Querétaro (Figura 1). Las regiones oeste y suroeste se encuentran en la zona montañosa con elevaciones de hasta 1,500 metros, destacando los cerros La Virgen, La Uva, El Sarro y El Pedregoso; hacia el sur, se presenta un área montañosa con alturas de hasta de 1500 metros, formada por los cerros Bola, Jalapa, Chontel y La Palma (INEGI, 2003). Figura 1. Localización geográfica y política de la zona de estudio De acuerdo con García (1981), el área de estudio presenta la fórmula climática (A)C(w’’o)a(e)g, que corresponde a un clima semiseco, el más seco de los subhúmedos; presenta una temperatura media anual de 21 ºC, teniéndose una temperatura máxima de 43 ºC y una mínima de 0 ºC., los meses más cálidos van de marzo a octubre y el periodo frío se extiende de noviembre a febrero. La precipitación media anual es de 789 mm. 22 3.2. Trabajo de campo 3.2.1. Determinación taxonómica de Stenocereus griseus Haworth La identificación taxonómica del género Stenocereus se basó en las claves y fichas descriptivas de Bravo y Sánchez (1978) y Scheinvar (2004); en ellas se observan la forma y características de la planta, número de costillas en las ramas, número y forma de las espinas centrales y radiales, además de las características físicas del fruto; este conjunto de caracteres son los que se utilizan para diferenciar las plantas hasta el nivel de especie. Sólo en el primer transecto se realizó la identificación taxonómica de los individuos muestreados, a fin de garantizar que en los siguientes transectos se estuviera trabajando con la misma especie. 3.2.2. Descripción morfológica de S. griseus Haworth La descripción morfológica del pitayo se realizó con base en los datos obtenidos de 364 individuos encontrados en 17 transectos elegidos para este propósito. Las características que se usaron para la descripción fueron las siguientes: altura de la planta, número de ramas, diámetro basal y de copa, número de flores, número de frutos; longitud y diámetro de la rama más grande (una por sitio de muestreo); número, grosor y profundidad de las costillas, color de la epidermis general y apical de la rama, distancia entre aréolas de la misma costilla y la distancia entre aréolas de costillas adyacentes; forma, longitud y amplitud de la aréola y su color en las etapas juvenil y adulta; número, anchura, longitud, forma, dirección, persistencia y color en etapa juvenil y adulta de las espinas radiales y centrales en una aréola. 3.2.3. Muestreo de poblaciones nativas de S. griseus Haworth Para el muestreo de las poblaciones de pitayo se utilizó el método de los transectos, el cual consiste de un rectángulo situado en un espacio, dentro del cual se miden ciertos parámetros de un determinado tipo de vegetación, en este caso las características morfológicas del pitayo (Mostacedo y 23 Fredericksen, 2000). Este método es el más recomendado para este tipo de estudios dada la rapidez con se mide, además de ser económico y que optimiza el tiempo de desplazamiento entre áreas de muestreo (Mostacedo y Fredericksen, 2000; Bautista, 2004). En este trabajo cada transecto abarcó una superficie de 1000 m2 (100 m de longitud por 10 m de ancho), y se realizaron 17 transectos para una superficie muestreada de 17,000 m2 dentro de un área de 27.8 km2. Los sitios de muestreo (transectos) se eligieron al azar; el primero se realizó en el extremo oriental del área de estudio (Figura 2), y los siguientes se fueron estableciendo en función de la facilidad de acceso, siempre considerando que la distancia entre transectos fuera lo más homogénea posible. Dentro de cada transecto se contaron y midieron sólo los individuos que tuvieran una altura mayor de 1.5 m. Figura 2. Área de trabajo y distribución de los sitios de muestreo. 24 3.4. Atributos considerados para la caracterización de la planta La altura de cada individuo fue el primer atributo evaluado al comenzar la toma de datos en cada transecto, para lo cual se utilizó la plancheta; el diámetro de copa se midió con un flexómetro, mientras que el diámetro basal se determinó con una cinta diamétrica; estos caracteres se registraron en todos los individuos de cada transecto, además se les contó el número de ramas, flores y frutos. En cada transecto se eligió al azar un ejemplar de pitayo al cual se midió la longitud de la rama más grande, esta operación se efectuó con la plancheta; el diámetro de la misma rama se midió con una cinta diamétrica, se le contó el número de costillas, el grosor y profundidad de éstas se determinó con una regla; se registró la distancia entre aréolas en la misma costilla y la distancia entre aréolas de costillas adyacentes; la longitud y amplitud (ancho) de la aréola se midieron con un vernier, se observó y registró la forma de la aréola, y su color en etapa juvenil y adulta; además se registró el color de la epidermis general y apical de la rama. De la rama más grande se eligió al azar una aréola, en la que además de contar las espinas centrales y radiales, se midieron los siguiente atributos: anchura, longitud, forma, color en etapa juvenil y adulta, dirección y persistencia de las espinas; los dos primeros atributos se midieron utilizando un vernier y los últimos se determinaron a nivel de observación. Los atributos evaluados en el fruto fueron: diámetro polar y ecuatorial, grosor de la cáscara, longitud de una de las espinas del fruto; estos parámetros se midieron con un vernier; el peso de la cáscara y el peso de cada fruto recolectado se registró con una balanza digital; el volumen se calculó utilizando la fórmula de la esfera; y también se contó el número de aréolas por fruto y el número de aréolas en una superficie de 4 cm2, asimismo se registró la forma del fruto y el color de la piel y de la pulpa. 25 3.5. Análisis estadístico Con el conjunto de datos de los diferentes atributos de la planta se efectuó el cálculo de las medidas de tendencia central (media aritmética, mediana y moda), así como las principales medidas de dispersión (desviación estándar y varianza). Los valores de la media aritmética se emplearon en el Análisis de Correlación, el cual permite identificar que atributos están más relacionados, lo que posibilita eliminar los que afectan de forma negativa los resultados, para que no se consideren en el análisis de componentes principales. Con la finalidad de determinar que variables se correlacionaban con un intervalo de confianza del 95% y una importancia estadística con coeficiente inferior a 0.05, puesto que los valores inferiores a éste indican mayor importancia estadística, se realizó una matriz de correlación; después de obtener los resultados se realizó el análisis de componentes principales, resultando de éste un conjunto de componentes y un porcentaje de varianzas para cada uno, posteriormente se eligieron los que reunieron una varianza acumulada superior al 50% y se analizaron las relaciones existentes entre los atributos estudiados de acuerdo con los gráficos de pesos de los componentes resultantes en este método. Antes de realizar la matriz de correlación, se estandarizaron las unidades, es decir, se transformaron los datos a centímetros, pues se tenía información en metros, centímetros y milímetros, las unidades de peso (gramos) se conservaron iguales. El Análisis de Componentes Principales es una técnica descriptiva que permite estudiar y entender las relaciones que existen entre variables cuantitativas sin considerar a priori, la estructura de éstas; este método transforma un conjunto de variables correlacionadas en no correlacionadas (Dallas, 2004). A través de este análisis se encontraron los tres componentes principales que reunieron el mayor porcentaje de varianza entre los atributos de la planta, determinando así la dependencia entre ellos. Con base en la metodología sugerida por Dallas (2004), se aplicó el Análisis de Conglomerados (clúster) a los datos usados en el análisis anterior; ésta técnica 26 sirve para clasificar los elementos de la muestra en grupos de datos, de tal manera que la distribución de los valores de las variables sea lo más homogénea, y entre conglomerados lo más distintos entre sí; de esta forma se agruparon conjuntos de transectos que presentaron similitudes entre ellos, los que sirvieron para definir los patrones de distribución de las poblaciones de pitayo. Asimismo se utilizó el método del vecino más cercano ya que éste tiende a maximizar las relaciones entre una pareja de agrupamientos y crea menos de éstos en comparación con otros métodos. La distancia métrica que se usó en la realización del dendrograma fue la euclidiana cuadrada, debido a que con ésta se diferencia mejor la separación entre conjuntos de datos, lo que permite distinguir los conglomerados con mayor facilidad. Con la finalidad de establecer que transectos presentaron las características más sobresalientes tanto en planta como en fruto y de forma adicional a los análisis anteriores, se ordenaron 5 atributos sobresalientes de la planta (altura de la planta, diámetro de copa, diámetro basal, longitud y diámetro de la rama más grande) y 3 del fruto (peso, volumen y peso de la cáscara), cuyos valores se ordenaron en forma decreciente, esta comparación sirvió como complemento del análisis de conglomerados para ampliar la información acerca los patrones de distribución del pitayo. Los análisis antes descritos se realizaron con el paquete estadístico Statgraphics Plus 5.1. 27 IV. RESULTADOS Y DISCUSIÓN 4.1. Identificación taxonómica En el muestreo realizado en una de las zonas pitayeras del municipio de San Ciro de Acosta, S. L. P., se identificó a Stenocereus griseus Haworth como la única especie en el área de estudio, en un espacio de 1000 m2, correspondiente a un muestreo preliminar en el que los 33 individuos muestreados pertenecían a esta especie. 4.2. Descripción morfológica Con base en los datos de las características morfológicas registradas a 364 individuos muestreados en 17 transectos que comprendió el presente estudio y que se distribuyeron aleatoriamente dentro de una superficie de 27.8 km 2, se encontró que la altura promedio de los ejemplares fue de 3.94 metros, y los valores extremos correspondieron a un individuo de 9.6 y otro de 1.6 metros de altura, respectivamente. Respecto a los diámetros de copa y basal, los pitayos mostraron en promedio 1.87 metros de copa y 28 centímetros de base; cabe señalar que el promedio del primer parámetro fue menor debido a que también se midieron individuos con una rama, dato que afectó negativamente dicho promedio, pues se encontraron individuos con diámetros de copa de hasta 6.2 metros y otros con 14 centímetros. Para evaluar el número de ramas de los pitayos, los datos se organizaron en tres categorías: (a) árboles con 1 a 10 ramas, (b) plantas con 10 a 20 ramas, y (c) individuos con más de 20 ramas. Al respecto 38.5% de los ejemplares presentó más de 20 ramas; la mayor cantidad de individuos de esta categoría se encontraron en el transecto 6; 35.4% de los individuos correspondió al intervalo (a), hallándose la mayor proporción en el transecto 9; y 26.1% de los ejemplares con 10 a 20 ramas, segunda categoría, se encontró también en el transecto 6. En relación con las características de la rama más grande de uno de los pitayos por transecto, se encontró que la longitud y diámetro promedio de ésta fue de 3.2 metros y 17.3 centímetros, respectivamente; el número de costillas de las 28 mismas ramas fluctuó de seis a nueve, aunque en más de la mitad fue de siete costillas (68%); el grosor de las costillas promedió 4.8 centímetros, mientras que la profundidad fue de 1.4 centímetros; 51.8% de las ramas presentó color verde oscuro, mientras que el verde claro se mostró en 38.8%; el resto manifestó un color verde combinado con tonalidades que variaron desde el morado, rosa y rojo. En el ápice de la rama predominó el color morado (71.8%), el verde se expresó en 23.5% y el resto presentó tonalidades de amarillo, gris o púrpura. Por otra parte, la distancia promedio entre aréolas de una misma costilla fue de 3.3 centímetros, y la distancia media entre aréolas de costillas adyacentes fue de 6.9 centímetros; aunque el 98.82% de las aréolas mostraron forma oval, y sólo una presentó forma redonda, la longitud promedio de las aréolas fue de 0.94 centímetros y la amplitud de 0.9 centímetros; la coloración que presentaron las aréolas varió según su edad, por lo que fue más común encontrar aréolas blancas y grises en su etapa juvenil, pues se registró 42.4% de aréolas grises y 41.2% de blancas, el resto fueron de color crema, y sólo se encontró una de color negro. Las espinas que se encuentran alrededor de la aréola (espinas radiales) tienen en promedio una anchura de base de 3.7 milímetros y una longitud de 3.25 centímetros; se registraron en promedio siete espinas por aréola, aunque pueden presentarse hasta 10; la base de estas espinas tiene forma oval; comúnmente presentan dos tonalidades, gris en la base con las puntas oscuras, o bien bases blancas con las puntas negras, aunque en ocasiones se presentan otras combinaciones de colores que van desde el amarillo, negro, rojo, café y rosa en su etapa juvenil, mientras que en la etapa adulta son principalmente de color gris oscuro y grises con puntas negras o incluso totalmente negras; éstas espinas están inclinadas y son muy persistentes en la aréola. Se pueden presentar de una a tres espinas centrales en la aréola, aunque en algunos ejemplares se observaron hasta cinco; tienen una longitud promedio de 3.5 centímetros; son más anchas en la base; estas espinas presentan muy comúnmente en su etapa juvenil una combinación de cuatro tonalidades a lo largo de ellas (rojo, negro, blanco y negro) y en ocasiones hasta 5 combinaciones (amarillo, café, gris, 29 blanco y negro), en cambio cuando adultas presentan en la base tonalidades que varían del gris claro hasta el oscuro con las puntas negras; estas espinas tienen dirección vertical y son persistentes en todas las etapas de vida del pitayo al igual que las radiales, encontrándose incluso en las plantas muertas. Otro atributo morfológico considerado en la descripción del pitayo fueron los frutos. La mayor cantidad de frutos se encontró en el transecto 1, es decir, 19.9 % de los 1314 registrados; mientras que en el transecto 7 se contabilizaron 247 frutos, que equivalen al 18.8% de la muestra; en tanto que en el transecto 8 se contaron 204 frutos, que representa 15.5%. Es pertinente aclarar que el muestreo de frutos sólo se realizó en los diez primeros transectos debido a que cuando se trabajó en los últimos siete, ya había terminado la época de fructificación del pitayo en la zona de estudio. Todos los frutos presentaron forma oval, con un diámetro ecuatorial y polar promedio de 4.38 y 4.86 centímetros, respectivamente; el peso promedio del fruto fue de 54.96 gramos, de donde se obtuvo una relación parte comestible-cáscara de 1.56% y 51% de pulpa; el volumen promedio del fruto fue de 45.15 cm3. El color de la cáscara varió del verde al rojo, pasando por un tono ligeramente morado, guinda o incluso púrpura y la cáscara presentó un grosor medio de 0.7 milímetros. Los frutos presentaron en promedio 51 aréolas, en las cuales crecen espinas con una longitud promedio de 0.72 centímetros. El color de la pulpa varía, según el estado de madurez del fruto; en este trabajo se encontraron frutos con cáscara verde que presentaban pulpa blanca, rosa e incluso roja (etapa de madurez avanzada); invariablemente en los frutos que presentaban cáscaras rojas, guindas o inclusive moradas se encontró pulpa roja; el sabor de la pulpa también depende de la madurez del fruto, por tal razón los frutos con pulpa blanca o rosa eran insípidos y ácidos, en cambio la gran mayoría de frutos con pulpa roja estaban dulces, aunque también se encontraron algunos con pulpas ácidas. 30 4.3. Análisis estadístico 4.3.1. Estadística básica Con el propósito de empezar a entender el comportamiento de las variables que se eligieron en el presente estudio, así como para explicar la distribución de los pitayos en el área de trabajo, con los datos de campo de los diferentes atributos tanto de la planta como del fruto, se realizó el análisis estadístico básico que consistió en el cálculo de las medidas de tendencia central (media aritmética, mediana, y moda) así como las principales medidas de dispersión (desviación estándar y varianza). Los resultados de los cálculos efectuados se encuentran en los anexos I al VI. 4.3.2. Análisis de correlación Para desarrollar la matriz de correlación se emplearon las medias aritméticas obtenidas con la estadística básica; las relaciones que se encontraron entre los atributos de la planta con un intervalo de confianza del 95% e importancia estadística menor al 0.05, se presentan en el Cuadro 2, cuya nomenclatura se encuentra en el anexo I de la página 59. En el Cuadro 2 se muestran las correlaciones que presentaron un intervalo de confianza del 95% y su importancia estadística menor a 0.05. Con base en este criterio algunos atributos como la distancia entre aréolas de la misma costilla (DAMC), número de costillas (NC), número de espinas centrales (NEC) y número de flores (NFL), fueron excluidos de los siguientes análisis. 31 Cuadro 2. Correlaciones de los atributos de la planta de pitayo. Relación Significancia Importancia estadística AA-LA 0.52 0.0311 AEC-LER 0.57 0.0169 AEC-NER 0.59 0.0122 AER-LEC 0.62 0.0081 AER-LER 0.74 0.0007 AER-PC 0.50 0.0398 AP-DBP 0.64 0.0060 AP-DCP 0.91 0.0000 AP-LRM 0.64 0.0056 AP-NFR 0.70 0.0019 DACA-DRM 0.55 0.0222 DBP-DCP 0.78 0.0002 DBP-NFR 0.69 0.0020 DCP-NFR 0.81 0.0001 GC-PC -0.69 0.0020 LEC-LER 0.48 0.0491 LER-PC 0.56 0.0191 Nota: la nomenclatura se encuentra en el anexo 1, en la pagina 59. El resultado del análisis de correlación efectuado a los atributos de la planta y de los frutos se presenta en el Cuadro 3. En el Cuadro 3 se muestran las correlaciones que presentan un intervalo de confianza del 95% y una importancia estadística inferior de 0.05. Con base en estos criterios los atributos como la distancia entre aréolas de la misma costilla (DAMC), el diámetro polar del fruto (DPF), el diámetro de la rama más grande (DRM), el grosor de la cáscara del fruto (GCF), y la longitud de las espinas centrales (LEC) se excluyeron en los análisis posteriores. 32 Cuadro 3. Correlaciones de los atributos de la planta y frutos del pitayo. Relación AA -LA AEC - LER AER - LER AP - DBP AP - DCP AP - LRM AP - NFR DACA - LEF DACA - NER DBP - DCP DBP - NAF DBP - PCF DCP - NFR DEF - NA4CM DEF - NAF DEF - PTF DEF - VF GC - NEC GC - PC LEF - NFL LEF - PC LER - VF LRM - NAF NA4CM - PTF NA4CM - VF NC - NEC PTF - VF Significancia 0.80 0.78 0.75 0.64 0.92 0.64 0.80 0.71 -0.74 0.69 -0.70 -0.73 0.82 -0.83 -0.66 0.93 0.99 -0.67 -0.68 0.66 -0.36 -0.34 -0.74 -0.90 -0.86 0.68 0.96 Importancia estadística 0.0050 0.0080 0.0123 0.0472 0.0001 0.0471 0.0052 0.0214 0.0143 0.0260 0.0247 0.0169 0.0034 0.0032 0.0386 0.0001 0.0000 0.0348 0.0314 0.0397 0.3000 0.3296 0.0147 0.0003 0.0013 0.0294 0.0000 Nota: la nomenclatura se encuentra en el anexo 2, en la pagina 60. 4.3.3. Análisis de componentes principales de los atributos de la planta La interpretación de la correlación entre las variables y los componentes se centra en los coeficientes, que mientras más altos sean, independientemente del signo, más significativas serán las relaciones entre las variables. Sobre este aspecto, se sabe que las cargas que se distribuyen en los componentes indican el peso de cada variable asociada o el grado de contribución al componente (Morejón y Díaz, 2005). 33 Del análisis de componentes principales (ACP) de los atributos de la planta, el Cuadro 4 muestra el autovalor, el porcentaje de varianza de los componentes y el porcentaje acumulado. En este análisis se decidió incluir los tres primeros componentes, los cuales reunieron más del 50% de la varianza total. Cuadro 4. Varianza explicada de los tres primeros componentes principales de los atributos de la planta. Componente 1 2 3 Autovalor 5.08233 2.77746 2.15382 Porcentaje de Varianza 31.765 17.359 13.461 Porcentaje Acumulado 31.765 49.124 62.585 El primer componente contribuyó con el 31.765% de la varianza total (Cuadro 4) explicado de forma positiva por las variables diámetro basal de la planta (DBP), el diámetro de copa de la planta (DCP), altura de la planta (AP) y el número de frutos (NFR), y de forma negativa se explica con la anchura de las espinas radiales (AER), la profundidad de las costillas (PC) y la longitud de las espinas radiales (LER) (Cuadro 5). El segundo componente aportó el 17.359% de la varianza total (Cuadro 4), en él las correlaciones de las variables indican que la altura de la planta (AP), el diámetro de copa de la planta (DCP), la longitud de las espinas centrales (LEC), la longitud de las espinas radiales (LER), el número de las espinas radiales (NER) y la anchura de las espinas centrales (AEC) fueron las variables que influyeron de forma positiva, mientras que la amplitud de la aréola (AA), la distancia entre las aréolas de costillas adyacentes (DACA) y el diámetro de la rama más grande (DRM) influyeron de manera negativa (Cuadro 5). 34 Cuadro 5. Pesos de los atributos de la planta en los componentes principales. Componentes 1 2 3 0.3403 0.1506 0.0070 0.3146 0.3720 0.0756 0.3100 0.3870 -0.0186 0.3005 0.2532 0.1706 0.2913 0.0316 -0.1751 0.2585 -0.0058 0.1266 0.2337 -0.0009 0.3988 0.1907 -0.2337 0.0455 Atributos Atributos Diámetro basal de la planta (DBP) Diámetro de copa de la planta (DCP) Altura de la planta (AP) Número de frutos (NFR) Longitud de la rama más grande (LRM) Grosor de las costilla (GC) Longitud de la aréola (LA) Amplitud de la aréola (AA) Distancia entre aréolas de costillas adyacentes (DACA) Diámetro de la rama más grande (DRM) Número de las espinas radiales (NER) Longitud de las espinas centrales (LEC) Anchura de las espinas centrales (AEC) Longitud de las espinas radiales (LER) Profundidad de las costillas (PC) Anchura de las espinas radiales (AER) 0.0974 -0.0506 -0.0771 -0.1526 -0.2179 -0.2886 -0.2993 -0.3075 -0.2056 -0.2039 0.3111 0.3646 0.3019 0.3567 0.0360 0.1902 0.5167 0.5288 -0.0910 0.2833 -0.0470 0.1191 0.0697 0.3172 El tercer componente contribuyó con el 13.461% de la varianza total (cuadro 4), la cual está determinada en forma positiva por el diámetro de la rama más grande (DRM), la distancia entre aréolas de costillas adyacentes (DACA), la longitud de la aréola (LA) y la anchura de las espinas radiales (AER), y de forma negativa por la longitud de la rama más grande (LRM) y el número de espinas radiales (NER) (Cuadro 5). Los resultados del ACP, muestran que los atributos de la planta (Figura 3) se separan de la siguiente manera, en el cuadrante I se localizan los atributos de la planta (AP, DCP, NFR, Y DBP), en el cuadrante II se encuentran los atributos de las espinas (AER, LER, AEC, LEC Y NER), en el cuadrante IV se distribuyen los atributos de la aréola (DACA, AA Y LA), mientras que los de la rama se encuentran dispersos en los 4 cuadrantes (LRM en el cuadrante I, PC en el cuadrante II, DRM en el cuadrante III, Y GC en el cuadrante IV), mostrando de 35 esta manera que los atributos de cada órgano de la planta, guardan una estrecha relación en cuanto a dimensiones, y por tanto, cierta dependencia entre ellas. La Figura 3 muestra también el grado de asociación entre las variables, el cual está determinado por la separación angular que forman sus proyecciones; además considera la distancia de cada variable a partir del origen, teniendo mayor contribución mientras más alejada se encuentre de éste. Figura 3. Análisis de los componentes para los atributos de la planta. De acuerdo con la separación angular, la mejor asociación está constituida por la longitud de la aréola (LA) y el grosor de la costilla (GC); otra relación estrecha se observa entre la altura de la planta (AP) y su diámetro de copa (DCP), esta relación se observó muy claramente en el trabajo de campo, ya que todos los individuos que presentaban las mayores alturas, también tenían diámetros de copa más grandes. De acuerdo con este mismo criterio, otra importante relación se establece entre la longitud de las espinas radiales (LER) con la anchura de las espinas centrales (AEC). 36 En cuanto a la distancia de separación de los atributos con relación al origen, los más importantes son la altura de la planta (AP), el diámetro de copa de la planta (DCP) y el diámetro basal de la planta (DBP), estos atributos se encuentran distribuidos en el cuadrante I (Figura 3), mientras que en el cuadrante II se puede observar que la longitud de las espinas radiales (LER) presenta un mayor grado de importancia si se compara con el resto de los atributos localizados en este cuadrante; finalmente en el cuadrante III el atributo de mayor importancia corresponde a la amplitud de aréolas (AA). La proyección opuesta del grosor de las costillas (GC), sobre el eje del primer componente, es la profundidad de éstas (PC), indicando una relación inversa, es decir, mientras mayor es el grosor de la costilla (GC), menor será su profundidad. Esta relación depende de la época del año en la que se evalúen estos atributos, puesto que en la época de estiaje el grosor de las costillas es menor y la profundidad es más pronunciada, en comparación con la que se presentan en la época de lluvias, debido a la capacidad que tienen estas plantas de almacenar agua en sus tejidos. 4.3.4. Análisis de componentes principales de los atributos de la planta y fruto De la misma forma que en el análisis anterior se decidió incluir sólo tres componentes principales, los que reunieron más de la mitad de la varianza total explicada (Cuadro 6). Cuadro 6. Varianza explicada de los tres primeros componentes principales de los atributos de la planta y fruto. Componente Autovalor 1 2 3 6.95064 4.32263 4.06033 Porcentaje de Varianza Porcentaje Acumulado 28.961 18.011 16.918 28.961 46.972 63.89 37 Cuadro 7. Peso de los componentes de los atributos de la planta y fruto. Atributos Longitud de la rama más grande (LRM) Volumen del fruto (VF) Diámetro ecuatorial del fruto (DEF) Peso total del fruto (PTF) Diámetro basal de la planta (DBP) Altura de la planta (AP)AP Longitud de espinas del fruto (LEF) Número de flores (NFL) Número de frutos (NFR) Diámetro de copa de la planta (DCP) Amplitud de la areola (AA) Grosor de las costillas (GC) Número de costillas (NC) Distancia entre aréolas de costillas adyacentes (DACA) Longitud de la aréola (LA) Número de espinas centrales (NEC) Número de espinas radiales (NER) Peso de la cáscara del fruto (PCF) Anchura de espinas centrales (AEC) Profundidad de costillas (PC) Número de aréolas en 4 cm2 (NA4CM) Anchura de espinas radiales (AER) Longitud de espinas radiales (LER) Número de aréolas del fruto (NAF) Componentes 1 2 3 0.2869 0.0462 0.1163 0.2717 -0.2140 0.2034 0.2707 -0.2208 0.1877 0.2592 -0.1777 0.2536 0.2547 0.2151 -0.1082 0.2331 0.2510 0.1404 0.2267 -0.1038 -0.1445 0.2205 -0.2866 -0.1677 0.1986 0.3030 -0.0083 0.1886 0.3372 0.0901 0.1482 0.1239 -0.0172 0.1303 0.0216 -0.3763 0.0711 0.0481 0.2512 0.0659 0.0471 0.0165 -0.0083 -0.1462 -0.1775 -0.1897 -0.2163 -0.2170 -0.2516 -0.3351 -0.3361 0.1612 -0.0688 0.3403 -0.2858 0.2327 -0.0573 0.1026 -0.1292 0.1375 -0.0349 -0.1553 -0.1440 0.2751 0.2529 0.2341 0.1116 0.3005 -0.3546 0.1381 0.2487 -0.0574 En cuanto a la distancia de separación de los atributos (vectores) respecto del origen, los más importantes son el número de aréolas del fruto (NAF), la altura de la planta (AP), el diámetro de copa de la planta (DCP), el diámetro basal de la planta (DBP), número de frutos (NFR), número de las espinas radiales (NER), número de flores (NFL), la longitud de las espinas del fruto (LEF), peso del fruto (PTF), el volumen del fruto (VF) y el diámetro ecuatorial del mismo (DEF) (Figura 4). Su importancia radica en que las variables más alejadas del origen 38 presentan un peso mayor a diferencia de los que se encuentran cercanos a éste, además le confieren una fuerte correlación con las demás variables. Figura 4. Análisis de componente para los atributos de la planta y fruto 4.3.5 Análisis de conglomerados para los atributos de la planta. Con base en el análisis de conglomerados o clúster, se clasificaron los atributos de la planta en grupos de datos, procurando que la distribución de valores de los atributos fuera lo más homogénea, y los conglomerados lo más diferentes entre sí, de esta manera se formaron conjuntos de atributos similares, con los que se determinaron los patrones de distribución del pitayo. Para hacer tal distribución se utilizó el Método del Vecino más Cercano y la distancia que se usó fue la Euclidiana Cuadrada. Del análisis realizado a 16 atributos de la planta se establecieron 3 conglomerados (Figura 5), el primero lo conforman los siguientes atributos: amplitud de la aréola (AA), longitud de la aréola (LA), distancia entre aréolas de costillas adyacentes (DACA) y diámetro de la rama más grande (DRM). 39 Figura 5. Dendrograma de los atributos de la planta. En la Figura 5 se observan uniones entre atributos, que en realidad muestran grados de similaridad entre éstas, lo que se representa por las distancias del eje vertical, que mientras más cercanas estén al eje horizontal, indican que el grado de relación entre atributos es mayor, por lo que las relaciones que se observan en la Figura 5, para el primer conglomerado de atributos están definidas de la siguiente manera: la amplitud de la aréola (AA) con la longitud de la aréola (LA); la distancia entre aréolas de costillas adyacentes (DACA) con el grosor de la costilla (GC) y la anchura de espinas centrales (AEC), a distancias de 15.25, 18.38, 18.76 y 23.4, respectivamente (Cuadro 8), estas relaciones muestran la asociación que se presenta entre las variables de los tres conglomerados. Las relaciones anteriores muestran una dependencia estrecha entre la longitud y la amplitud de la aréola, que le dan la forma final; por otra parte, la amplitud de la aréola (AA) depende del grosor de la costilla (GC), de esta manera, mientras más gruesa sea más amplia será la aréola; la amplitud de la aréola también afecta la anchura de las espinas centrales (AEC); esta especie presenta 3 espinas 40 centrales, y la anchura de éstas depende del tamaño de la aréola, pues en ésta se tienen de 7 a 9 espinas radiales y 3 centrales. La última relación que se encuentra en este conglomerado, se establece por la unión de las aréolas de costillas adyacentes (DACA) con el diámetro de la rama más grande (DRM), que se presenta a una distancia de 14.40; esto corrobora las observaciones de campo, en el sentido de que la distancia entre aréolas de costillas adyacentes (DACA) estará en función del diámetro de la rama. En el segundo conglomerado (Figura 5) se presentan las siguientes relaciones; la más estrecha se establece entre la altura de la planta (AP) y el diámetro de copa (DCP), a una distancia del origen de 2.96, que se observa tanto en la Figura 5 como en el Cuadro 8; la altura de la planta (AP) se asocia con el número de frutos (NFR), el diámetro basal de la planta (DBP), la longitud de la rama más grande (LRM) y con la amplitud de la aréola (AA), a distancias de 6.08, 7.05, 11.50 y 18.47, respectivamente (Cuadro 8). En el trabajo de campo estas relaciones fueron muy perceptibles en las plantas de pitayo, ya que los individuos más altos presentaban las copas más desarrolladas, lo que proporciona más espacio para el desarrollo de un mayor número de aréolas de crecimiento que a su vez son productoras de frutos; una planta con las características antes indicadas debe tener un diámetro basal (DBP) lo suficientemente grande para soportar su propia altura, la copa y los frutos. El tercer conglomerado está integrado por los atributos: anchura de las espinas centrales (AEC), número de las espinas radiales (NER), anchura de las espinas radiales (AER), longitud de las espinas radiales (LER), longitud de las espinas centrales (LEC) y profundidad de las costillas (PC) (Figura 5). Las principales relaciones que se presentan en este conglomerado están definidas por la anchura de las espinas radiales (AER) con la longitud de las espinas radiales (LER) y con la longitud de las espinas centrales (LEC), a distancias de 8.40 y 12.19, respectivamente (Cuadro 8); otras relaciones que se observan en este conglomerado son las que se establecen entre la anchura de las espinas centrales (AEC) con el número de las espinas radiales (NER) y la anchura de las 41 espinas radiales (AER), con la profundidad de las costillas (PC) a distancias de 13.04 y 13.76 en la primera relación, y de 14.05 en la segunda (Cuadro 8). Se puede observar que los principales atributos que componen este conglomerado corresponden a las características de las espinas. Cuadro 8. Distancias de unión de los atributos de la planta. Etapa Cluster 1 Cluster 2 Distancia 1 AP DCP 2.96 2 AP NFR 6.08 3 AP DBP 7.05 4 AER LER 8.40 5 AP LRM 11.50 6 AER LEC 12.19 7 AEC NER 13.04 8 AEC AER 13.76 9 AEC PC 14.05 10 DACA DRM 14.40 11 AA LA 15.25 12 AA DACA 18.38 13 AA AP 18.47 14 AA GC 18.76 15 AA AEC 23.41 4.3.6. Análisis de conglomerados para los atributos de la planta por transectos Con el propósito de conocer la variabilidad del pitayo y de establecer sus patrones de distribución de acuerdo con su localización en la superficie de muestreo y con base en los atributos de la planta antes analizados, en los que el parámetro fue la distancia con que se relacionan, y que representa el coeficiente de similaridad, se aplicó el análisis de conglomerados a los 17 transectos muestreados, los cuales se agruparon en dos agregados (Figura 6). 42 Figura 6. Dendrograma de los transectos para atributos de la planta. El primer agregado está conformado por los transectos 3 al 17, tal como se ilustra en la Figura 6; en ella, los transectos 6 y 10 son los que guardan la relación más estrecha pues se unen a una distancia de 7.94; además el transecto 6 se une con los transectos 17,14, 8, 7, 12 y 5 con distancias de 9.37, 9.61, 10.29, 10.42, 10.91 y 12.20, respectivamente; el conglomerado presenta otras uniones, la del transecto 3 con los sitios 5, 16 13 y 4, a distancias de 16.96, 17.68, 18.01 y 21.17, respectivamente (Cuadro 9). Este conglomerado está integrado por el 88.23% de los sitios, lo que significa que las características de las plantas de pitayo, en ellos distribuidas, son muy similares entre sí, por lo que en esos transectos Stenocereus griseus no presenta grandes diferencias morfológicas, aunque fueron particularmente semejantes las plantas de los transectos 6 y 10 (Figura 6), pues presentan menor variación de los atributos evaluados en comparación con el resto de los transectos, sobre todo en lo que se refiere a la altura de la planta. El segundo componente está integrado por los transectos 1 y 2 (Figura 6), los cuales se unen a una distancia de 30.39, aunque estadísticamente estos transectos se unen entre sí, su similitud no es muy estrecha con respecto a las 43 relaciones del conglomerado 1, lo que explica la mayor variación morfológica de la planta de pitayo. Cuadro 9. Distancias de unión entre los transectos muestreados. Etapa 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Cluster 1 Cluster 2 Distancia 6 6 6 6 6 6 5 9 9 5 3 3 3 3 1 1 10 17 14 8 7 12 6 15 11 9 5 16 13 4 3 2 7.94 9.37 9.61 10.29 10.42 10.91 12.20 13.41 13.86 15.19 16.96 17.68 18.01 21.17 28.32 30.39 4.3.7. Análisis de conglomerados para los atributos de la planta y fruto en diez transectos Este análisis se aplicó a los datos de diez transectos, en los cuales se evaluaron 9 atributos del fruto y 17 de la planta, el dendrograma muestra que se conformaron cuatro conglomerados (Figura 7), los cuales separan claramente los atributos de la planta y los del fruto. 44 Figura 7. Dendrograma de los atributos de la planta y fruto. En primer conglomerado se compone por los atributos ancho de la aréola (AA), la longitud de la aréola (LA), el número de costillas (NC), y el número de espinas centrales (NEC), en él se observa una estrecha relación entre la amplitud (AA) y la longitud de la aréola (LA), cuyo punto de intersección se ubica a una distancia de 3.52; también se presenta la unión de la amplitud de la aréola (AA) con el número de costillas (NC) a una distancia de 9.27; asimismo se observa la unión del número de costillas (NC) con el número de espinas centrales (NEC) cuyo punto de intersección se ubica a una distancia de 5.70 (Cuadro 10). Aunque no se puede ver una relación directa entre la mayoría de estos atributos, la longitud (LA) y amplitud de la aréola (AA), presentan una estrecha relación, de lo que se deduce que son proporcionales, ya que mientras más gruesa es la aréola tendrá mayor longitud, lo que confirma la proporción observada en campo. El segundo conglomerado está conformado por los siguientes atributos: el ancho de las espinas centrales (AEC), la longitud de las espinas radiales (LER), el ancho de las espinas radiales (AER), la profundidad de las costillas (PC), el número de las espinas radiales (NER), el número de aréolas del fruto (NAF), el número de aréolas en una superficie de 4 cm2 del fruto (NA4CM) y el peso de la 45 cáscara del fruto (PCF); variables cuya relación más estrecha se encuentra en la unión del ancho de las espinas centrales (AEC) con la longitud de las espinas radiales (LER) a una distancia de 3.99; la amplitud de las espinas centrales (AEC) también se relaciona con los siguientes atributos: el ancho de las espinas radiales (AER) a una distancia de 4.48, con la profundidad de las costillas a una distancia de 7.61, con el número de espinas radiales (NER) en el punto 7.71 y con el peso de la cáscara del fruto (PCF) a una distancia de 9.17; por otra parte, el número de aréolas en 4 cm2 de la cáscara del fruto (NA4CM) se relaciona con el número de aréolas del fruto a una distancia de 8.67(Cuadro 10). Cuadro 10. Distancias de unión entre los atributos de la planta y fruto en los diez transectos de muestreo. Etapa Cluster 1 Cluster 2 Distancia 1 DEF VF 0.19 2 DEF PTF 0.77 3 AP DCP 1.39 4 AP NFR 3.18 5 AA LA 3.52 6 AEC LER 3.99 7 AEC AER 4.48 8 DACA LEF 5.22 9 AP DBP 5.51 10 NC NEC 5.70 11 DACA NFL 6.20 12 AP LRM 6.51 13 DACA GC 7.09 14 AEC PC 7.61 15 AEC NER 7.71 16 DACA DEF 7.77 17 AP DACA 7.97 18 NA4CM NAF 8.10 19 AEC NA4CM 8.67 20 AEC PCF 9.17 21 AA NC 9.27 22 AEC AP 10.09 23 AA AEC 11.68 46 Puede notarse que en este conglomerado predominan los atributos de las espinas, y de ellas los que tienen mayor relación son la anchura de las espinas centrales (AEC) con la longitud de las espinas radiales (LER); esta relación se hizo evidente en campo debido a que todas las espinas que presentaron una longitud considerable también tenían bases más anchas en comparación con las espinas de menor longitud. El tercer conglomerado, integrado por la altura de la planta (AP), el diámetro de copa (DCP), número de frutos (NFR), diámetro basal de la planta (DBP), longitud de la rama más grande (LRM), distancia entre aréolas de costillas adyacentes (DACA), longitud de las espinas del fruto (LEF), número de flores (NFL) y grosor de las costillas (GC); la relación más estrecha se presenta entre la altura de la planta (AP) y el diámetro de copa de la misma (DCP), las cuales se interceptan a una distancia de 1.39 (Cuadro 10); este atributo también se relaciona de manera estrecha con el número de frutos (NFR), y está menos cercano al diámetro basal de la planta (DBP), longitud de la rama más grande (LRM) y la distancia entre aréolas de costillas adyacentes (DACA) con las que se intercepta a 3.18, 5.51, 6.51 y 7.97 de distancia, respectivamente. Por otra parte, las aréolas de costillas adyacentes (DACA) se une a una distancia de intersección de 5.22 con la longitud de espinas del fruto (LEF), también se interceptan con el número de flores (NFL) en el punto 6.20, con el grosor de costilla (GC) en 7.09 y finalmente con el diámetro ecuatorial del fruto (DEF) a una distancia de 7.77 (Cuadro 10). Los atributos que forman este conglomerado, básicamente características de la planta, guardan una relación cercana entre sí, tal como puede verse tanto en la Figura 7 como en el Cuadro 10. En el trabajo de campo pudo observarse que las plantas con mayores alturas presentaron copas de grandes dimensiones y mayores diámetros, lo que les proporciona mayor espacio para la producción de frutos en comparación con los individuos de tallas inferiores. El cuarto agregado conformado sólo por los atributos del fruto, el diámetro ecuatorial del fruto (DEF), el volumen del fruto (VF) y el peso del fruto (PTF) (Figura 7). En él, los dos primeros atributos presentan una relación muy estrecha 47 que se explica por la reducida distancia de intercepción, 0.19, además el diámetro del fruto (DEF) se une con el peso del fruto en el punto 0.77 (Cuadro 10). La relación del diámetro ecuatorial del fruto (DEF) y el volumen del fruto (VF), es directa y proporcional, ya que mientras más grande es la primera característica (DEF), mayor será el volumen del fruto (VF); asimismo ambos atributos guardan una relación directamente proporcional con el peso del fruto, lo que significa que este atributo está dado en función de su volumen. 4.3.6. Análisis de conglomerados por transectos para los atributos de la planta y fruto Como puede observarse en la Figura 8, los diez transectos analizados formaron un solo conglomerado, en él se observa una relación muy estrecha entre los transectos 6 y 9, los que se interceptan a una distancia de 19.52; el transecto 6 también se relaciona, aunque menos estrechamente, con los transectos 7 y 5, con los que se une en los puntos 27.16 y 28.81, respectivamente; por otra parte, el transecto 7 se une en las distancias de 20.29 y 23.15 con los transectos 8 y 10; de igual manera el transecto 3 se une con los transectos, 5, 4 y 1 en las distancias de 31.19, 34.90 y 36.14, correspondientemente. Los transectos 1 y 2 se interceptan a una distancia de 41.31 (Cuadro 11). En este análisis de conglomerados se observa que el coeficiente de similitud (distancia de separación) disminuye entre transectos; por lo que la zona de muestreo se torna más homogénea al agregar los atributos del fruto, pues en el análisis anterior donde sólo se consideraron los atributos de la planta se formaban dos agregados. Aunque el transecto 2 no es muy similar al resto de los transectos, presenta cierta relación con el transecto 1, en estos transectos se observó la mayor variación morfológica de la planta de pitayo en la época en la que no hay frutos, mientras que en la época de fructificación el coeficiente de similaridad se incrementó, razón por la cual las variables fueron más homogéneas y sólo se formó un conglomerado (Figura 8). 48 Figura 8. Dendrograma de los transectos en los que se muestrearon los atributos de la planta y fruto. Cuadro 11. Distancias de unión entre transectos de muestreo de los atributos de la planta y fruto. Etapa Cluster 1 Cluster 2 Distancia 1 6 9 19.52 2 7 8 20.29 3 7 10 23.15 4 6 7 27.16 5 5 6 28.81 6 3 5 31.19 7 3 4 34.90 8 1 3 36.14 9 1 2 41.31 4.4. Patrones de distribución del pitayo en la superficie de muestreo Con la finalidad de establecer algún patrón de distribución del pitayo en los sitios de muestreo, éstos se establecieron al azar, considerando siempre que la distancia entre ellos fuera lo más homogénea posible, lo que en gran medida dependió de la facilidad de acceso (Figura 2 de la pagina 24). 49 En varios transectos muestreados se observaron características morfológicas relevantes de las plantas, tales como altura (AP), el diámetro de copa (DCP) y basal (DCP), la longitud (LRM) y diámetro de la rama más grande (DRM); estas características influyen tanto en la cantidad como en la calidad del fruto, por lo que son importantes para definir los patrones de distribución o zonas en las que se presentan dentro de la zona de muestreo. Debido a que los promedios de los atributos fueron muy similares, la prueba de comparación de medias arrojó un solo intervalo, lo que es insuficiente desde el punto de vista estadístico para explicar la distribución de los pitayos, por lo que dichos atributos se clasificaron en 3 intervalos (a, b, c); a cada atributo se le calculó la diferencia de sus valores extremos tomados en campo y se dividió entre tres a fin de tener tres intervalos de igual dimensión de cada atributo elegido. Para el atributo altura de la planta (AP) el intervalo (a) que va de 2.26 a 3.19 metros de altura, se ubicaron los transectos 9, 11 y 15 (Cuadro 11), mismos que se distribuyeron aleatoriamente en la superficie de muestreo (Figura 2), el transecto 15 en el extremo occidental, el 11 en el extremo oriental y el 9 cercano a la zona agrícola. El intervalo (b) comprende alturas entre 3.20 y 4.12 metros, dentro del cual se localizaron los transectos 2, 6, 13, 16 y 17 (Cuadro 11); en esta categoría también se presentó una distribución aleatoria del pitayo en los sitios de muestreo, dado que estos transectos se encuentran dispersos en toda la zona de estudio; aunque los transectos 16 y 17 se encontraron relativamente próximos en comparación con el resto (Figura 2). 50 Cuadro 12. Atributos sobresalientes de la planta ordenados en tres intervalos, para definir patrones de distribución del pitayo. I T 7 3 12 4 c 8 14 1 10 5 6 2 b 16 13 17 11 a 15 9 AP 5.04 4.98 4.74 4.68 4.53 4.37 4.36 4.30 4.14 3.87 3.78 3.74 3.59 3.56 2.77 2.38 2.26 I c b a T 3 7 1 4 5 8 6 12 10 16 14 17 13 2 11 15 9 DCP 2.89 2.54 2.48 2.38 2.29 2.11 2.07 1.98 1.95 1.87 1.54 1.50 1.46 1.29 1.04 0.66 0.61 I c b a T 12 7 3 4 8 6 1 15 14 13 9 10 17 16 5 2 11 DBP 48.9 37.2 33.6 33.0 31.6 30.9 30.6 30.4 27.5 24.1 23.8 23.8 21.8 20.6 18.9 17.9 15.8 I T 1 2 14 7 13 c 8 12 10 3 17 5 b 4 6 15 11 a 16 9 LRM 4.19 4.07 3.96 3.80 3.68 3.64 3.53 3.49 3.40 3.39 2.92 2.73 2.54 2.54 2.43 2.39 1.70 I T DRM 2 18.4 c 8 18.0 7 17.2 9 16.8 5 16.6 4 16.6 14 16.5 6 16.2 b 1 16.2 11 16.2 3 16.1 13 16.0 10 15.7 17 15.6 16 15.6 a 12 14.8 15 14.1 Intervalo (I), número de transecto (T), Altura de la planta (AP), Diámetro de copa (DCP), Diámetro basal (DBP), diámetro de la rama más grande (LRM), Diámetro de la rama más grande DRM. El intervalo (c) incluyó los transectos cuyas alturas promedio del pitayo variaron de 4.13 a 5.04 metros; en esta categoría se ubicaron los transectos 1, 3, 4, 5, 7, 8, 10, 12 y 14 (Cuadro 12); como puede observarse en la Figura 2, los transectos 1, 4, 5 y 12 se situaron más próximos entre sí, en ellos se encontraron las mayores alturas de planta dentro de la zona de estudio, y el resto de los transectos se distribuyó de forma aleatoria. En cuanto a diámetros de copa de la planta (DCP), el intervalo (a) está conformado por plantas cuyos diámetros van de 0.61 a 1.37 metros, en él se incluyen los transectos 2, 9, 11 y 15 (Cuadro 12), de ellos, los más próximos son el 2 y el 15, los cuales se localizan en el extremo occidental, mientras que los transectos 9 y 11 se distribuyen de forma aleatoria en la zona de estudio (Figura 2); el intervalo (b) comprende diámetros de 1.38 a 2.13 metros, y se integró por los transectos 6, 8, 10, 12, 13, 14, 16 y 17 (Cuadro 12), de los cuales 51 el 6, 8, 10, 12, 16 y 17 se encuentran dispersos en toda el área de muestreo, mientras que el 12 y 13 están más cercanos (Figura 2); por último, el intervalo (c) formado por diámetros de copa de 2.14 a 2.89 metros, incluyó los transectos 1, 3, 4, 5 y 7 (Cuadro 12), de ellos el 1, 4 y 5 se encuentran próximos entre sí; este grupo de transectos se ubica en la periferia oriental de la zona de estudio (Figura 2). Ahora bien, para el diámetro basal de la planta (BP), el intervalo (a) corresponde a diámetros que van de 15.75 a 26.78 centímetros, en esta categoría se encontraron los transectos 2, 5, 9, 10, 11, 13, 16 y 17 (Cuadro 12), cuya distribución forma un grupo en la parte occidental de la zona de muestreo, el cual estuvo conformado por los transectos 2, 9 y 10, mientras que el resto de ellos se encontraron dispersos (Figura 2); el intervalo (b) se estableció con diámetros de entre 26.78 y 37.81 centímetros, los transectos cuyas plantas presentaron estas dimensiones fueron el 1, 3, 4, 6, 8, 14 y 15 (Cuadro 12); mismos que se distribuyeron de forma aleatoria; mientras que los transectos 1 y 4 se localizaron más próximos entre sí en el extremo oriental, al igual que el 14 y 15 aunque éstos últimos se ubicaron en el extremo occidental de la superficie muestreada (Figura 2); el intervalo (c) lo constituyó sólo el transecto 12 (Cuadro 12) cuyas plantas presentaron dimensiones de base dentro del rango de 37.81 a 48.85 centímetros. Respecto a la longitud de la rama más grande (LRM), el intervalo (a) se definió con longitudes de rama que variaron de 1.70 a 2.53 metros, los transectos donde se presentaron estas dimensiones de rama fueron el 9, 11 y 16 (Cuadro 12), mismos que presentaron una distribución aleatoria (Figura 2); el intervalo (b) se integró por los transectos 4, 5, 6 y 15 (Cuadro 12), donde las plantas presentaron longitudes de la rama más grande (LRM) de entre 2.53 y 3.36 metros, de los cuales los 3 primeros se localizaron en la periferia y parte oriental de la zona de estudio, mientras que el transecto 15 se ubicó en el extremo occidental (Figura 2); el intervalo (c) se conformó por los transectos 1, 2, 3, 7, 8, 10, 12, 13, 14, y 17 (Cuadro 12), en los cuales la longitud de la rama más grande (LRM) 52 varió de 3.36 a 4.19 metros; la distribución de estos intervalos presentó dos agregados, el primero se localiza en la parte oriental y se conformó por los transectos 1, 12, y 13; y el segundo localizado en la parte norte de la zona de estudio y a orillas de la laguna, se constituyó por los transectos 3, 7 y 8 (Figura 2). En cuanto al diámetro de la rama más grande (DRM), el intervalo (a) se formó con los transectos 12 y 15 que presentaron diámetros entre 14.1 y 15.53 centímetros (Cuadro 12), los cuales se localizan en los extremos oriental y occidental de la zona de estudio, respectivamente (Figura 2); y el intervalo (b) se conformó por pitayos cuyos diámetros estuvieron dentro del intervalo de 15.53 a 16.97 centímetros, donde se ubicaron los transectos 1, 3, 4, 5, 6, 9, 10, 11,13, 14, 16 y 17 (Cuadro 12), la mayor parte de éstos se localizó en la parte oriental y nororiental, con excepción de los puntos 9, 10 y 17 (Figura 2); el intervalo (c) comprende diámetros entre 17.2 y 18.4, estos transectos se encuentran distribuidos de la siguiente manera, el 2 se encontró aislado en el extremo occidental, mientras que los sitios 7 y 8 se localizaron a orillas de la laguna en el extremo norte de la zona de muestreo. Como puede observarse en la Figura 9, los transectos 7, 3, 12, 4 y 8 son los transectos en que se encontraron las mejores características morfológicas de las plantas, y cuya distribución se presenta de la siguiente manera, los transectos 7, 3 y 8 se ubican en la zona baja del área de muestreo muy cercanos a la laguna y a la zona de cultivo; y los transectos 4 y 12 se localizaron en el extremo oriental de la zona de muestreo; donde se presentan las mejores condiciones para el crecimiento de los pitayos, es decir, las áreas cercanas a la laguna y a los terrenos agrícolas, puesto que en éstas en la época de lluvias se presenta la sedimentación del suelo, la depositación de materia orgánica y de nutrientes; en tanto que en la parte oriental de la zona de estudio también se presentan buenas características de suelo para la producción del pitayo. 53 Diametro de copa de la planta (m) Diametro basal de la planta (cm) 5.5 5 4.5 4 3.5 3 2.5 2 1.5 1 0.5 60 50 40 30 20 10 Centímetros Metros Altura de la planta (m) Longitud de la rama mayor (m) Diametro de la rama mas grande(cm) 0 7 3 12 4 8 14 1 10 5 6 2 16 13 17 11 15 9 Transecto Figura 9. Características sobresalientes de la planta por transectos. 4.5 Patrones de distribución de los principales atributos del fruto por transecto Considerando el mismo método de análisis del apartado anterior se intentó establecer con base en tres características del fruto, algún patrón de distribución de éstos en los transectos muestreados. Los datos que sirvieron para el análisis se encuentran en el Cuadro 12. Para el volumen del fruto (VF) el intervalo (a) presentó valores que van de 36.27 a 40.92 cm3, los transectos donde se tuvieron estos datos del fruto fueron el 2, 3, 4 y 5 (Cuadro 12), mismos que tuvieron una distribución aleatoria en el área muestreada; sin embargo los transectos 4 y 5 se localizaron en la parte oriental, muy próximos entre sí (Figura 2); el intervalo (b) se conformó por puntos de muestreo que presentaron volumen de fruto de 40.92 a 47.57 cm3; dentro de este intervalo se encontraron los transectos 1, 7, 8 y 9 (Cuadro 12) los que se localizaron principalmente en la periferia de la laguna, a excepción del primer transecto que se ubicó en el extremo oriental de la zona de muestreo (Figura 2); por otra parte, el intervalo (c) estuvo integrado por los transectos 6 y 10 cuyo 54 volumen de fruto fue de 47.57 a 53.22 cm3 (Cuadro 12), que se encontraron muy separados en la zona norte del área de estudio (Figura 2). Cuadro 13. Atributos sobresalientes del fruto ordenados en tres intervalos, para definir patrones de comportamiento en los transectos. I c b a T 10 6 1 7 8 9 4 3 5 2 VF 53.22 51.06 49.85 49.17 49.07 44.27 40.82 40.37 37.37 36.27 I c b a T 10 6 8 1 7 4 9 3 5 2 PTF 64.76 62.42 59.98 59.36 58.06 54.34 51.08 50.7 46.62 42.26 I c b a T 8 5 6 7 10 4 2 1 9 3 PCF 28.96 28.76 26.82 26.46 25.12 24.96 24.4 24.18 19.98 18.32 Intervalo (I), Transecto (T), Volumen del fruto (VF), Peso del fruto (PTF), Peso de la cáscara (PCF). En cuanto al peso del fruto (PTF), el intervalo (a) se formó por los transectos 2 y 5 con frutos que pesaron entre 42.26 y 49.76 gramos (Cuadro 13), ubicados en los extremos occidental y oriental de la zona de muestreo (Figura 2); el intervalo (b) se integró por los transectos 3, 4 y 9 (Cuadro 13), cuyos frutos pesaron entre 49.76 a 57.26 gramos, dichas áreas tuvieron una distribución aleatoria; el intervalo (c) se conformó por los transectos 1, 6, 7, 8 y 10 (Cuadro 13), en ellos se encontraron frutos con pesos que oscilaron entre 57.26 y 64.76 gramos; estas áreas se localizaron en una zona baja, próxima a la laguna y a las áreas de cultivo, con excepción del transecto 1 que se ubicó en el extremo oriental de la zona de muestreo (Figura 2). Finalmente, y en relación al peso de la cáscara (PCF), el intervalo (a) se constituyó por los transectos 3 y 9 (Cuadro 13), con pesos de cáscara de 18.32 a 21.87 gramos; estos sitios se localizan cercanos a la laguna y a las zonas de cultivo, aunque entre ellos hay una gran distancia (Figura 2); el intervalo (b) lo integraron los transectos 1, 2, 4 y 10 (Cuadro 13), con pesos de cáscara de 21.87 55 a 25.12 gramos; de ellos los transectos 1 y 4 se localizan en el extremo oriental, mientras que el 2 y 10 en el noroeste (Figura 2); el intervalo (c) se formó por los transectos 5, 6, 7, y 8 (Cuadro 13), que presentaron pesos de cáscara de 25.41 a 28.96 gramos. Estos transectos también se encuentran cercanos a la laguna, salvo el transecto 5 que se encuentra más alejado de ésta, hacia el oriente (Figura 2). La Figura 10 muestra que los transectos 10, 6 y 8 presentaron los frutos con mejores características morfológicas, los cuales se ubicaron en la parte baja del área de muestreo y muy próximos a la laguna y al área de cultivo, zonas que por sus características de suelo, producen frutos más grandes, de buen peso y cáscaras delgadas; lo que indica que estas condiciones son aptas para la producción de pitayas de buena calidad; el resto de los transectos se encuentran dispersos en el área de estudio. Peso de la cáscara (g) Volumen (cm3) 70 60 60 50 50 40 40 30 30 20 20 10 10 0 10 6 8 1 7 4 9 3 5 2 Transectos Figura 10. Características sobresalientes de los frutos por transecto. 56 cm3 Gramos Peso total (g) V. CONCLUSIONES Se identificó a Stenocereus griseus Haworth, como la única especie en el área de estudio. La variabilidad morfológica de S. griseus está dada en función de la edad de la planta y de las condiciones ambientales donde se desarrolla, dicha variabilidad se presenta, principalmente, en los siguientes atributos, cuyo promedio e intervalos se muestran a continuación: altura de la planta (AP, 3.9 m; 1.6 – 9.6 m), diámetro de copa (DCP, 1.9 m; 0.14 - 6.2 m), diámetro basal (DBP, 0.3 m; 0.1 - 1.0 m), longitud de la rama más grande (LRM, 2.7 m; 1.12 – 6.70 m), número de frutos (NFR, 1.98; 0 - 97) y número de flores (NFL, 0.82; 0 - 43) y es homogénea en el resto de los atributos evaluados. El resultado del Análisis de Componentes Principales, indica que las relaciones más importantes de los atributos de la planta se establecieron entre la altura de la planta (AP), el diámetro de copa (DCP) y el diámetro basal de la planta (DBP), mientras que las del fruto se encontraron entre el diámetro ecuatorial (DEF), el peso (PTF), el volumen (VF) y la longitud de las espinas (LEF). El Análisis de Conglomerados de los atributos de la planta, agrupó tres conjuntos de datos, el primero constituido por las características de las aréolas, el segundo comprende el porte de la planta y el tercero conformado por cualidades de las espinas, de ellos el segundo grupo mostró los mayores coeficientes de similaridad. En el Análisis de Conglomerados para atributos de la planta y del fruto se obtuvieron cuatro agregados: aréola, espina, planta y fruto, éste último mostró mayor coeficiente de similaridad con respecto de los demás. Con el Análisis de Conglomerados aplicado a los transectos, en función de los atributos de la planta, se formaron dos agregados, en tanto que para los del fruto, sólo se formó uno; esto indica que la población del pitayo es morfológicamente muy homogénea. 57 Si bien, los resultados del análisis estadístico muestran homogeneidad, tanto morfológica como de distribución poblacional de Stenocereus griseus, los ejemplares encontrados en la parte baja de la zona de estudio (áreas cercanas a la laguna y tierras de cultivo) y el extremo oriental, presentaron como rasgos más sobresalientes el porte de la planta y la calidad del fruto, dadas las características del suelo, pendiente y exposición. 58 VI. ANEXOS Anexo I. Medias de los atributos morfológicos de la planta, obtenidos en el muestreo (2007). Transecto 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 AP 4.36 3.78 4.98 4.68 4.14 3.87 5.04 4.53 2.26 4.30 2.77 4.74 3.59 4.37 2.38 3.74 3.56 DCP 2.48 1.29 2.89 2.38 2.29 2.07 2.54 2.11 0.61 1.95 1.04 1.98 1.46 1.54 0.66 1.87 1.50 Planta DBP NFL 0.37 0.18 0.34 1.72 0.49 0.54 0.33 1.25 0.32 0.23 0.28 0.07 0.31 0.04 0.24 0.04 0.19 0.00 0.31 0.56 0.18 1.59 0.21 0.00 0.24 5.10 0.22 0.18 0.16 0.00 0.30 11.19 0.24 7.03 NFR 7.91 0.89 11.69 12.92 6.31 1.78 8.82 7.85 0.19 3.75 0.24 2.00 0.33 0.09 0.00 0.31 3.47 LRM 4.19 4.07 3.40 2.73 2.92 2.54 3.80 3.64 1.70 3.49 2.43 3.53 3.68 3.96 2.54 2.39 3.39 DRM 0.17 0.16 0.15 0.17 0.18 0.17 0.16 0.16 0.17 0.16 0.18 0.16 0.16 0.16 0.16 0.14 0.17 NC 7.2 7.0 7.0 6.6 7.4 6.6 7.0 7.4 7.0 6.8 7.2 7.0 7.4 7.2 7.0 7.4 6.6 GC 4.95 5.13 5.23 5.37 4.16 4.88 4.75 4.72 4.78 4.84 5.12 4.93 5.01 4.99 3.95 4.07 4.78 Rama Espinas PC DAMC DACA LA AA AER NER LER AEC NEC LEC 1.03 3.37 7.21 1.13 1.09 2.67 7.4 2.08 0.30 2.8 3.13 1.21 3.23 7.96 0.85 0.83 3.45 7.0 2.18 0.27 3.0 2.86 0.84 3.22 6.32 0.93 0.88 3.33 7.7 3.37 0.42 2.8 3.54 1.09 3.08 8.18 1.01 0.86 3.54 7.3 2.71 0.43 2.4 4.22 1.72 3.16 7.82 0.98 0.96 4.23 7.5 3.77 0.40 3.3 4.19 1.37 3.30 7.28 0.99 0.84 4.37 7.3 3.87 0.42 2.9 3.87 2.05 3.51 6.40 0.9 0.82 3.84 7.6 3.66 0.42 2.8 3.33 1.21 3.01 6.23 0.93 0.89 2.87 7.6 3.11 0.40 3.0 3.21 1.49 3.21 7.18 0.96 0.87 3.80 7.4 3.51 0.40 2.6 3.28 1.36 3.28 6.83 0.97 0.90 4.00 7.8 3.75 0.40 2.6 3.28 1.36 3.47 6.93 0.93 0.86 3.99 8.2 3.45 0.47 2.8 3.45 1.11 3.25 6.67 1.01 0.84 4.30 8.1 3.45 0.47 2.9 4.75 1.01 3.40 6.49 0.95 1.12 3.35 7.4 2.63 0.47 3.0 2.59 1.24 2.83 6.91 0.91 0.89 3.35 8.1 3.41 0.49 2.8 3.58 1.95 3.49 6.48 0.83 0.84 3.91 7.3 3.54 0.43 2.6 3.68 1.49 3.54 6.09 0.82 0.83 3.64 7.6 3.18 0.42 2.2 3.98 1.63 3.39 6.74 0.91 0.94 4.28 7.4 3.74 0.47 2.8 4.61 (AP*) Altura de la planta, (DCP*) Diámetro de copa de la planta, (DBP*) Diámetro basal de la planta, (NFL) Número de flores, (NFR) Número de frutos, (LRM*) Longitud de la rama mas grande, (DRM*) Diámetro de la rama mas grande, (NC) Número de costillas, (GC**) Grosor de las costillas, (PC**) Profundidad de las costillas, (DAMC**) Distancia entre aréolas en una misma costilla, (DACA**) Distancia entre aréolas de costillas adyacentes, (LA**) Longitud de la aréola, (AA**) Ancho de la areola, (AER***) Ancho de espinas radiales, (NER) Número de espinas radiales, (LER**) Longitud de espinas radiales, (AEC***) Ancho de espinas centrales, (NEC) Número de espinas centrales, (LEC**) Longitud de espinas centrales. * Metros, ** Centímetros, *** Milímetros 59 Anexo II. Medias de los atributos del fruto obtenidos en el muestreo (2007). Transecto 1 2 3 4 5 6 7 8 9 10 VF 44.268 51.056 40.365 49.855 49.170 37.371 40.820 49.065 36.268 53.224 DPF 4.718 5.212 4.614 4.900 4.674 4.702 5.292 4.840 4.684 4.930 DEF 4.374 4.564 4.248 4.548 4.518 4.120 4.174 4.508 4.058 4.652 PTF 51.08 62.42 50.70 59.36 58.06 46.62 54.34 59.98 42.26 64.76 PCF 19.98 26.82 18.32 24.18 26.46 28.76 24.96 28.96 24.40 25.12 NAF 46.6 48.8 48.8 52.2 49.8 56.0 53.2 53.0 57.0 47.6 NA4CM 3.6 3.4 3.6 3.4 3.2 3.8 3.4 3.4 3.8 3.2 LEF 0.762 1.004 0.862 1.270 1.106 0.500 0.440 0.420 0.440 0.400 GCF 0.402 0.354 0.356 0.416 0.228 1.268 0.960 1.080 0.864 1.108 RCCF 1.600 1.341 4.441 1.662 1.281 0.592 1.161 1.054 0.710 1.721 PP/PC 60.141 55.300 63.597 55.925 54.056 36.360 47.602 47.845 38.319 59.574 (VF*) Volumen del fruto, (DPF**) Diámetro polar del fruto, (DEF**) Diámetro ecuatorial del fruto, (PTF***) Peso total del fruto, (PCF***) Peso de la cáscara del fruto, (NAF) Número de aréolas del fruto, (NA4CM) Número de aréolas en 4 centímetros cuadrados, (LEF**) Longitud de una de las espinas del fruto, (GCF****) Grosor de la cáscara del fruto, (RCCF) Relación parte comestible-cáscara, (PP/PC) Porcentaje comestible. * Centímetros cúbicos, ** Centímetros, *** Gramos, **** Milímetros 60 Anexo III. Varianza los atributos morfológicos de la planta, obtenidos en el muestreo (2007). Transecto 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 AP 1.03 1.25 3.16 3.36 4.67 2.62 3.48 3.22 0.19 2.66 1.32 2.37 2.50 1.47 0.15 1.90 1.91 DCP 1.00 0.24 0.82 0.93 2.33 1.05 1.64 1.23 0.11 1.35 0.81 0.77 1.27 0.89 0.10 0.78 0.84 Planta DBP NFL 0.02 0.40 0.01 49.86 0.09 1.44 0.02 12.20 0.01 0.36 0.02 0.14 0.03 0.04 0.03 0.04 0.04 0.00 0.04 2.00 0.03 21.63 0.01 0.00 0.03 138.79 0.01 0.36 0.01 0.00 0.04 194.70 0.04 115.07 NFR 73.94 8.00 210.36 321.90 161.97 0.69 6.98 0.81 0.00 1.20 0.11 5.30 0.26 0.09 0.00 0.60 312.95 LRM 0.21 1.37 1.58 0.34 2.29 0.91 3.25 3.62 0.14 2.66 0.28 0.46 1.90 0.91 0.08 0.89 2.33 NC 0.20 0.50 0.00 0.30 0.30 0.30 0.50 0.30 0.20 0.20 0.20 0.50 0.80 0.20 0.50 1.30 0.30 GC 0.77 0.25 2.25 0.73 0.25 0.32 1.52 0.20 0.17 0.67 0.31 0.46 2.34 0.67 0.14 2.26 0.47 PC 0.24 0.14 0.11 0.29 0.62 0.25 0.43 0.03 0.12 0.61 0.22 0.20 0.05 0.13 0.18 0.27 0.02 Rama DAMC 0.62 0.19 1.20 0.08 0.71 0.12 0.23 1.33 0.09 0.11 0.13 0.18 0.20 0.54 0.06 0.49 0.54 DACA 1.45 0.58 0.84 9.02 3.29 1.05 1.41 0.66 0.08 0.82 0.56 1.02 1.12 0.22 0.13 1.13 0.64 LA 0.35 0.01 0.06 0.01 0.03 0.02 0.00 0.01 0.01 0.02 0.01 0.01 0.02 0.02 0.04 0.01 0.02 AA 0.74 0.03 0.06 0.00 0.01 0.02 0.01 0.00 0.04 0.03 0.03 0.03 0.18 0.02 0.01 0.01 0.02 (AP*) Altura de la planta, (DCP*) Diámetro de copa de la planta, (DBP*) Diámetro basal de la planta, (NFL) Número de flores, (NFR) Número de frutos, (LRM*) Longitud de la rama mas grande, (NC) Número de costillas, (GC**) Grosor de las costillas, (PC**) Profundidad de las costillas, (DAMC**) Distancia entre aréolas en una misma costilla, (DACA**) Distancia entre aréolas de costillas adyacentes, (LA**) Longitud de la aréola, (AA**) Ancho de la areola, (AER***) Ancho de espinas radiales, (NER) Número de espinas radiales, (LER**) Longitud de espinas radiales, (AEC***) Ancho de espinas centrales, (NEC) Número de espinas centrales, (LEC**) Longitud de espinas centrales. * Metros, ** Centímetros, *** Milímetros 61 Anexo IV. Varianza de los atributos del fruto obtenidos en el muestreo (2007). Transecto VF DPF DEF PTF PCF NAF NA4CM LEF GCF RCCF PP/PC 1 82.40 0.05 0.08 57.47 8.02 29.80 0.30 0.01 0.02 0.29 73.66 2 257.47 0.03 0.22 218.41 12.54 3.20 0.30 0.06 0.01 0.23 146.70 3 34.91 0.04 0.04 39.90 84.24 17.70 0.30 0.03 0.01 50.13 304.74 4 116.47 0.12 0.10 272.38 41.09 16.20 0.30 0.12 0.03 1.32 377.16 5 155.04 4.66 4.44 54.73 26.59 49.55 3.29 1.14 0.18 1.18 51.74 6 100.09 0.40 0.15 267.80 45.39 20.00 0.70 1.00 0.04 0.04 59.10 7 480.91 0.03 0.50 609.97 0.64 27.20 0.30 0.00 0.16 0.85 330.36 8 193.23 0.43 0.19 406.44 14.23 26.00 0.30 0.00 0.10 0.35 230.13 9 194.46 0.06 0.24 230.71 8.01 2.00 0.20 0.00 0.15 0.25 191.27 10 97.23 0.12 0.09 95.11 39.93 49.30 0.20 0.00 0.07 0.61 267.99 (VF*) Volumen del fruto, (DPF**) Diámetro polar del fruto, (DEF**) Diámetro ecuatorial del fruto, (PTF***) Peso total del fruto, (PCF***) Peso de la cáscara del fruto, (NAF) Número de aréolas del fruto, (NA4CM) Número de aréolas en 4 centímetros cuadrados, (LEF**) Longitud de una de las espinas del fruto, (GCF****) Grosor de la cáscara del fruto, (RCCF) Relación parte comestible-cáscara, (PP/PC) Porcentaje comestible. * Centímetros cúbicos, ** Centímetros, *** Gramos, **** Milímetros 62 Anexo V. Desviación estándar de los atributos morfológicos de la planta, obtenidos en el muestreo (2007). Planta Transecto AP Rama DCP DBP NFL NFR LRM DRM NC GC PC Espinas DAMC DACA LA AA AER NER LER AEC NEC LEC 1 1.02 1.00 0.14 0.64 8.60 0.46 0.02 0.45 0.88 0.49 0.79 1.20 0.59 0.86 1.02 0.89 1.73 0.07 0.45 0.77 2 1.12 0.49 0.12 7.06 2.83 1.17 0.01 0.71 0.50 0.38 0.43 0.76 0.08 0.16 0.52 0.00 0.55 0.12 0.00 0.68 3 1.78 0.90 0.30 1.20 14.50 1.26 0.02 0.00 1.50 0.33 1.09 0.92 0.24 0.24 1.74 0.67 0.77 0.13 0.45 0.58 4 1.83 0.96 0.14 3.49 17.94 0.59 0.02 0.55 0.86 0.54 0.29 3.00 0.10 0.05 1.26 0.45 0.83 0.12 0.55 1.49 5 2.16 1.53 0.12 0.60 12.73 1.51 0.02 0.55 0.50 0.79 0.84 1.81 0.18 0.10 0.89 1.12 1.07 0.11 0.67 1.45 6 1.62 1.02 0.13 0.38 0.83 0.96 0.01 0.55 0.57 0.50 0.34 1.02 0.15 0.13 0.98 0.45 0.88 0.05 0.22 0.93 7 1.87 1.28 0.17 0.19 2.64 1.80 0.02 0.71 1.23 0.65 0.48 1.19 0.05 0.11 1.77 0.22 1.93 0.12 0.45 1.42 8 1.79 1.11 0.16 0.20 0.90 1.90 0.01 0.55 0.45 0.16 1.15 0.81 0.09 0.05 1.28 0.42 0.87 0.07 0.00 1.03 9 0.43 0.33 0.20 0.00 0.00 0.37 0.01 0.45 0.42 0.35 0.30 0.28 0.11 0.20 0.76 0.55 0.69 0.05 0.82 0.73 10 1.63 1.16 0.19 1.41 1.09 1.63 0.01 0.45 0.82 0.78 0.33 0.91 0.14 0.18 1.34 0.45 1.17 0.05 0.82 0.73 11 1.15 0.90 0.18 4.65 0.33 0.53 0.02 0.45 0.56 0.47 0.36 0.75 0.11 0.16 1.06 0.91 0.97 0.05 0.45 0.97 12 1.54 0.88 0.08 0.00 2.30 0.68 0.02 0.71 0.68 0.45 0.43 1.01 0.08 0.16 1.68 0.74 1.17 0.13 0.55 1.41 13 1.58 1.12 0.16 11.78 0.51 1.38 0.02 0.89 1.53 0.23 0.45 1.06 0.13 0.43 0.55 0.89 0.50 0.03 0.00 1.33 14 1.21 0.94 0.08 0.60 0.30 0.95 0.02 0.45 0.82 0.36 0.73 0.47 0.12 0.13 0.42 0.89 0.78 0.03 0.57 1.01 15 0.39 0.32 0.10 0.00 0.00 0.29 0.02 0.71 0.37 0.42 0.25 0.36 0.19 0.07 0.58 0.76 0.88 0.11 0.42 0.27 16 1.38 0.88 0.20 13.95 0.77 0.94 0.02 1.14 1.50 0.52 0.70 1.06 0.11 0.12 0.62 0.95 0.21 0.10 0.57 1.28 17 1.38 0.92 0.19 10.73 17.69 1.53 0.02 0.55 0.69 0.14 0.73 0.80 0.13 0.13 1.68 0.55 1.25 0.08 0.45 1.56 (AP*) Altura de la planta, (DCP*) Diámetro de copa de la planta, (DBP*) Diámetro basal de la planta, (NFL) Número de flores, (NFR) Número de frutos, (LRM*) Longitud de la rama mas grande, (DRM*) Diámetro de la rama mas grande, (NC) Número de costillas, (GC**) Grosor de las costillas, (PC**) Profundidad de las costillas, (DAMC**) Distancia entre aréolas en una misma costilla, (DACA**) Distancia entre aréolas de costillas adyacentes, (LA**) Longitud de la aréola, (AA**) Ancho de la areola, (AER***) Ancho de espinas radiales, (NER) Número de espinas radiales, (LER**) Longitud de espinas radiales, (AEC***) Ancho de espinas centrales, (NEC) Número de espinas centrales, (LEC**) Longitud de espinas centrales. * Metros, ** Centímetros, *** Milímetros 63 Anexo VI. Desviación estándar de los atributos del fruto obtenidos en el muestreo (2007). Transecto VF DPF DEF PTF PCF NAF NA4CM LEF GCF RCCF PP/PC 1 9.08 0.22 0.28 7.58 2.83 5.46 0.55 0.07 0.12 0.54 8.58 2 16.05 0.18 0.47 14.78 3.54 1.79 0.55 0.24 0.08 0.48 12.11 3 5.91 0.20 0.21 6.32 9.18 4.21 0.55 0.16 0.10 7.08 17.46 4 10.79 0.34 0.32 16.50 6.41 4.02 0.55 0.34 0.17 1.15 19.42 5 12.45 4.71 4.53 58.11 26.39 50.96 3.24 1.13 0.19 1.31 54.14 6 10.00 0.63 0.38 16.36 6.74 4.47 0.84 1.00 0.20 0.21 7.69 7 21.93 0.18 0.71 24.70 0.80 5.22 0.55 0.05 0.40 0.92 18.18 8 13.90 0.66 0.44 20.16 3.77 5.10 0.55 0.04 0.32 0.59 15.17 9 13.94 0.24 0.49 15.19 2.83 1.41 0.45 0.05 0.39 0.50 13.83 10 9.86 0.35 0.30 9.75 6.32 7.02 0.45 0.00 0.26 0.78 16.37 (VF*) Volumen del fruto, (DPF**) Diámetro polar del fruto, (DEF**) Diámetro ecuatorial del fruto, (PTF***) Peso total del fruto, (PCF***) Peso de la cáscara del fruto, (NAF) Número de aréolas del fruto, (NA4CM) Número de aréolas en 4 centímetros cuadrados, (LEF**) Longitud de una de las espinas del fruto, (GCF****) Grosor de la cáscara del fruto, (RCCF) Relación parte comestible-cáscara, (PP/PC) Porcentaje comestible. * Centímetros cúbicos, ** Centímetros, *** Gramos, **** Milímetros 64 VII. LITERATURA CITADA Andersen, M. E. 1993. Estimating plant densities using transects In: Tested Studies for Laboratory Teaching. Editor C. A. Goldman. 14: 51-56. Arellano, P. H. y Rangel Ch. J. O. 2008. Patrones de distribución de la vegetación en áreas de paramo de Colombia: Heterogeneidad y Dependencia Espacial. Caldasia 30(2): 355-411. Azcárraga, R. R. y Arbiza A. S. I. 2001. El mundo de las plantas IV. [En línea]. Disponible en http://vwww.correodelmaestro.com/anteriores/2001/julio/2 anteaula62.htm. (Consultada el 30 de octubre de 2008). Bautista, Z. F. 2004. Técnicas de muestreo para manejadores de recursos naturales. Instituto Nacional de Ecología, México. 315 p. Benson, L. 1969. The native cacti of California. Stanford University Press. Stanford California. pp. 3-34, 73-74. Bravo, H, H. y Sánchez M. R. H. 1978. Las cactáceas de México. Instituto de Biología. UNAM. México. pp. 20. Bravo, H. H. y Scheinvar L.1999. El interesante mundo de las cactáceas. Fondo de Cultura Económica. México. pp. 86-95. Britton, N. L. y Rose J. N., 1937. The cactaceae: Descriptions and illustrations of plants of the cactus family. 2th. Ed. New York, USA. Vol II. pp. 85. Casas, A., Valiente-Banuet A., Rojas-Martínez A. y Dávila P. 1999. Reproductive biology and the process of domestication of the columnar cactus Stenocereus stellatus in Central Mexico. American Journal of Botany 86: 534-542 Casas, A. y Barbera G. 2002. Mesoamerican domestication and diffusion In: Cacti Biology and uses. Universidad de California, USA. 21 p. Casas, F. A., Caballero N. J. 1996. Diversidad morfológica y genética del xoconochtli Stenocereus stellatus (Pfeiffer) Riccob. (Cactaceae): conocimiento, uso y estrategias para su conservación. Instituto de Biología. UNAM. 271 p. Challenger, A. y Caballero J. 1998. Utilización y conservación de los ecosistemas terrestres de México. Pasado, presente y futuro. INE, CONABIO, Instituto 65 de Biología. UNAM, Agrupación Sierra Madre, S.C. México. pp. 621, 673699. Dallas, E. J. 2004. Métodos multivariados aplicados al análisis de datos. Internacional Thompson Editores. México. pp. 93-141. Flores, D. A., González Q. L., Álvarez T., De Lachica F. 1974. El escenario geográfico. Instituto Nacional de Antropología e Historia. Ed. Melo. México. pp. 197-212. Fontúrbel, R. F. 2001. Fotosíntesis CAM. Universidad Mayor de San Andrés. La Paz, Bolivia. La Revista 4: 6 Fuentes, V. R. 2005. Etnobotánica de Cactaceae en Cuba. Instituto de Investigaciones en Fruticultura Tropical, Ministerio de la Agricultura. La Habana, Cuba. 24 p. García, E. 1981. Modificación al sistema de clasificación climática de Köppen. Tercera edición. Ed. Offset Larios. México D. F. 87 p. Geydan, T. D. y Melgarejo L. M. 2005. Metabolismo ácido de las crasuláceas (Crassulacean Acid Metabolism). Acta biológica. Colombiana vol.10 no.2 Bogotá. [En línea]. Disponible en: www.scielo.org.co/pdf/abc/v10n2/v10 n2a01.pdf (consultado el 9 de noviembre de 2008). Gibson, A. C. y Horak. K. E. 1978. Systematic anatomy and phylogeny of mexican columnar cacti. Annals of the Missouri Botanical Garden. USA 65(4): 999-1057. Gibson, A. C. y Nobel P. S. 1986. The cactus primer. Eds. Harvard University Press; Cambridge, Masachusets. pp 1-23, 235-258. González, C. I. 2006. Desarrollo y aplicación de procesos tecnológicos para la elaboración de conservas a base de pitaya (Stenocereus spp.) de la región Mixteca. Tesis de Licenciatura. Universidad Tecnológica de la Mixteca. Oaxaca, Oax. 64 p. González, E. S. y González E. M. 1993. Vegetación de la reserva de la biosfera “La Michilia”, Durango, México. CIIDIR-IPN Unidad Durango. Acta Botánica Mexicana 22: 1-104. 66 Gutiérrez, J. R. 2001. Importancia de los Arbustos Leñosos en los Ecosistemas de la IV Región en: Libro Rojo de la Flora Nativa y de los Sitios Prioritarios para su Conservación: Región de Coquimbo. Ed. Universidad de La Serena, La Serena, Chile. pp. 253 – 260. Gutiérrez, J. R. y Squeo, F. A. 2004. Importancia de los arbustos leñosos en los ecosistemas semiáridos de Chile. [En línea]. Disponible en: http//www.aeet,org /ecosistemas/041/investigacion2.htm. (Consultado el 22 de noviembre de 2008). Hernández, H. M. y Godínez A. 1994. Contribución al conocimiento de las cactáceas mexicanas amenazadas. Acta Botánica Mexicana 26: 33-52 INEGI, 2003. Cuaderno Estadístico Municipal. [En línea]: Disponible en: http://www.inegi.gob.mx/prod_serv/contenidos/espanol/biblioteca/default.as p?accion=2&upc=702825000477&seccionB=bd. (Consultado el 13 de enero de 2009). Leis, S.A., Engle D. M., Leslie D. M. Jr., Fehmi J. S. and Kretzer J. 2003. Comparison of Vegetation Sampling Procedures in a Disturbed MixedGrass Prairie. Proc. Okla. Acad. Sci. 83: 7-15 León, D. L. L. y Domínguez C. R. 1991. Evaluación de la reproducción por semilla de la pitaya agria (Stenocereus gummosus) en Baja California Sur, México. Acta Botánica Mexicana 14: 75-87 López, G. R., Díaz P. J. C. y Flores M. G. 2000. Propagación vegetativa de tres especies de cactáceas: pitaya (Stenocereus griseus), tunillo (Stenocereus stellatus) y jiotilla (Escontria chiotilla). Agrociencia 34(3): 363-367 López, L. 1999. La pitaya: variedad de usos en: Ciencia y Tecnología Jalisco. Gaceta Universitaria. U. de G. Jalisco, México.1 p. Luna, M. C. del C. y Aguirre R. J. R. 2001. Clasificación tradicional, aprovechamiento y distribución ecológica de la pitaya mixteca en México. Interciencia 26(1): 18-24 Luna, M. C. del C., Aguirre R. J. R. y Peña V. C. B. 2001. Cultivares tradicionales mixtecos de Stenocereus pruinosus y S. stellatus (Cactaceae). Anales del Instituto de Biología, UNAM. Serie Botánica 72(2): 131-155 67 Luna, M. del C. y Aguirre R. J. R. 2001. Aspectos estructurales de conunidades vegetales con pitayos (Stenocereus spp.) en la Mixteca Baja y Valle de Tehuacán, México. [En línea]. Disponible en: http://www.articlearchives.com/environment-natural-resources/ecology/958 590-1.html (consultado el 1 de marzo de 2009). Mandujano, R. R. R. 2006. Estudio preliminar de los pigmentos presentes en cáscara de pitaya (Stenocereus stellatus) de la región mixteca. Tesis de Licenciatura. Universidad Tecnológica de la Mixteca. Oaxaca, Oax. 76 p. Mercado, B. A. y Granados S. D. 1999. La pitaya (Tribu Pachycereae). Biología, ecología, fisiología, sistemática y etnobotánica. Universidad Autónoma Chapingo. Chapingo, México. pp. 65-71. Molinillo, M. y Monasterio M. 2002. Patrones de vegetación y pastoreo en ambientes de paramo. Sociedad Venezolana de Ecología. Ecotrópicos 15(1): 19-34 Morejón, R. y Díaz S. H. 2005 Análisis de asociación de caracteres en el cultivo de arroz (Oryza sativa L.) empleando técnicas multivariadas. Cultivos Tropicales 26(1): 77 – 81. Mostacedo, B. y Fredericksen T. S. 2000. Manual de métodos básicos de muestreo y análisis de vegetación en ecología vegetal. BOLFOR. Santa Cruz, Bolivia. 92 p. Nava, V. V., Tejero J. D. y Chávez C. B. 1999. Hábitos alimentarios del cacomixtle Bassariscus astutus (Carnivora: Procyonidae) en un matorral xerófilo de Hidalgo, México. Anales del Instituto de Biología. Universidad Nacional Autónoma de México. Serie Zoología 70(1): 51-63 Novoa, S., Ceroni A. y Arellano C. 2005. Contribucion al conocimiento de la fenología del cactus Neoraimondia arequipensis subsp. roseiflora (Werdermann & Backeberg) Ostolaza (Cactaceae) en el valle del Río Chillón, Lima-Perú. Ecología Aplicada 4(1,2): 35-40 Padilla, F. M. y Pugnaire F. I. 2006. The role of nurse plants in the restoration of degraded environments. Estación Experimental de Zonas Áridas, Consejo Superior de Investigaciones Científicas. Almería, España. pp. 196-202. 68 Ramírez, M. F. J. 2007. Manual para la Producción y Paquete tecnológico de Pitaya en el Estado de Puebla. Secretaría de Desarrollo Rural del Estado de Puebla. 23 p. Rivas, R. M. 1998. Cactáceas de Costa Rica. Editorial Universitaria Estatal a Distancia. [En línea]. Disponible en: http://books.google.com.mx/books ?id=gBvonamTuloC&pg=PP7&source=gbs_selected_pages&cad=0_1. (Consultado el 22 de noviembre de 2008) Rzedowski, J. R. 1994. Vegetación de México. sexta reimp. Ed. Limusa. México, D.F. pp. 237-261. Sánchez-Mejorada, R. H. 1984. Origen, taxonomía y distribución de las pitayas en México. In: Aprovechamiento del pitayo. ITAO-Oaxaca, UAM, México, D.F. pp. 6-21. Santacruz, V. C., Santacruz V. V., Zayas V. P. y Pazos G. D. C. 2006. La pitaya (Stenocereus griseus), alternativa para la obtención de colorantes alimenticios de origen natural. Benemérita Universidad Autónoma de Puebla. Puebla. 4 p. Scheinvar, L. 2004. Flora cactológica del estado de Querétaro; Diversidad y riqueza. Fondo de Cultura Económica. México, D.F. 375 p. Solís, N. V. G. y Panseri A. F. 2004. Análisis de los patrones de distribución geográfica de las poblaciones del complejo Turnera sidoides L. Facultad de Ciencias Agrarias. Universidad Nacional Del Nordeste (UNNE), Comunicaciones Científicas y Tecnológicas. Argentina. 3 p. Soriano, P.J., Naranjo M. E., Rengifo C., Figuera M., Rondón M. y Ruiz R. L. 1999. Aves consumidoras de frutos de cactáceas columnares del enclave semiárido de Lagunillas, Mérida, Venezuela. Sociedad Venezolana de Ecología. Ecotrópicos 12(2): 91-100. Valiente-Banuet, A. 1996. Polinización biótica y dispersión de semillas de cactáceas columnares en el Valle de Tehuacán, Puebla. Centro de Ecología, UNAM. México. 43 p. 69 Valiente-Banuet, A. 2002. Vulnerabilidad de los sistemas de polinización de cactáceas columnares de México. Revista Chilena de Historia Natural 75: 99-104. Valiente-Banuet, A., Bolongaro-Crevenna, A., Briones, O., Ezcurra, E., Rosas, M., Nuñez, H., Barnard, G. and Vázquez, E. 1991. Spatial relationships between cacti and nurse shrubs in a semi-arid environment in central Mexico. Journal of Vegetation Science 2: 15-20 Whitacre, D. E. and Vásquez M. A. 1997. European starlings nesting in southern Baja California, Mexico. The Wilson Bulletin 109(3): 532-535 70