Fecha emisión: 01/06/2002 Revisión: 4 ENUMERACIÓN DE
Anuncio

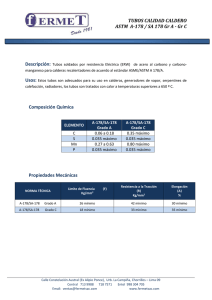
Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 1 de 6 PRT-712.03-046 1. OBJETIVO Estimar el número de Enterobactereaceas presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos que se sospeche un bajo contenido de microorganismos presentes (1 a 100 por gramo o mililitros de muestra). 3. FUNDAMENTO Esta metodología tiene una etapa presuntiva de siembra en caldo de enriquecimiento y una etapa confirmativa. 4. 4.1 REFERENCIAS General Guidance for the Enumeration of Enterobacteriaceae without resuscitation. –MPN technique and colony-count technique-ISO Número 7402/1993. 5. TERMINOLOGÍA No Aplica 6. MATERIALES, INSUMOS Y EQUIPOS 6.1 EQUIPOS 6.1.1 Baño de agua 48-50ºC 6.1.2 Incubadora 35 ºC ± 0,5 6.1.3 Vortex mixer Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 2 de 6 PRT-712.03-046 6.2 6.2.1 6.2.2 6.2.3 6.2.4 6.2.5 6.2.6 6.2.7 MATERIAL DE LABORATORIO Placas Petri de 15x100mm. Pipetas estériles de 1 y 5mL Asa de nicrón (aprox. de 3mm de diámetro). Tubos estériles de 16x160 mm. Mondadientes de madera o asa de vidrio Mecheros Bunsen Frascos de capacidad ± 160 mL. 6.3 6.3.1 MEDIOS DE CULTIVOS Y REACTIVOS Caldo de enriquecimiento Enterobacteriaceae (caldo EE) en tubos tapa rosca de 16x160mm con 10 mL de medio. (Almacenar hasta 1 semana 4ºC) Caldo de enriquecimiento Enterobacteriaceae doble concentración (caldo EE) en tubos tapa rosca de 18x180mm con 10 mL de medio. Agar VRBG, este debe ser preparado justo antes de usar. Agar nutritivo o agar BAB (en placa Petri con 15 a 18 mL). Agar glucosa Solución acuosa de dihidrocloruro de tetrametilparafenilendiamina al 1% Etanol 70% 6.3.2 6.3.3 6.3.4 6.3.5 6.3.6 6.3.7 7. DESARROLLO 7.1 Etapa presuntiva 7.1.1 Preparar diluciones decimales de la muestra de alimento (10-1 y 10-2). 7.1.2 Inocular 3 tubos de caldo de enriquecimiento Enterobacteriaceae doble concentración con 10 mL de muestra de muestra si el producto es líquido, o 10 mL de la suspensión inicial en el caso de los otros productos. 7.1.3 Inocular 3 tubos de caldo de enriquecimiento Enterobacteriaceae de caldo concentración simple con 1 mL de la muestra si el producto es líquido o con 1 mL de la suspensión inicial en el caso de los otros productos. 7.1.4 Inocular 3 tubos de caldo de enriquecimiento Enterobacteriaceae de caldo concentración simple con 1 mL de la dilución 10-1 si el producto es líquido o con 1 mL de la dilución 10-2 en el caso de los otros productos. 7.1.5 Agitar suavemente la gradilla para mezclar la muestra con el medio de cultivo. 7.1.6 Incubar los tubos a 35 ºC por 24 hrs. 7.1.7 Leer los tubos. Considerar positivos los tubos que presentan turbidez. 7.1.8 Registrar el resultado de cada tubo por dilución en registro RG-712.00-024 Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos 7.2 7.2.1 7.2.2 7.2.3 7.2.4 ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 3 de 6 PRT-712.03-046 Aislamiento De cada uno de los 9 tubos incubados en el punto anterior traspasar una asada en agar VRBG. Incubar las placas de VRBG entre 35 y 37 ºC por 24 horas. Seleccionar 5 colonia típicas para confirmación bioquímica. (Colonias típicas: colonias de color rosa a rojo con o sin halo de precipitación, o mucoides e incoloras). Inocular una placa con una cepa de E. coli, otra con S. aureus Anotar en el RG-712.00004. En paralelo incubar una placa sin inocular como control de esterilidad del medio, anotar en el RG-712.00-006. 7.3 Etapa confirmativa 7.3.1 Subcultivo 7.3.1.1 Repicar 5 colonias típicas en agar nutritivo en placa, para realizar pruebas bioquímicas confirmativas. 7.3.1.2 Incubar las placas a 35 a 37 º C por 24 ± 2 hrs. 7.3.1.3 Agregar control positivo E. coli y control negativo S. aureus. 7.3.1.4 Seleccionar una colonia aislada desde cada una de las placas incubadas, para la confirmación bioquímica. 7.3.2 Prueba de oxidasa 7.3.2.1 Usar asa de inoculación de platino/iridio o de vidrio, tomar una porción de cada colonia aislada y colocar en contacto con papel filtro recientemente humedecido con el reactivo de oxidasa. No se debe usar asa de inoculación de níquel /cromo. 7.3.2.2 Considerar que la prueba es negativa cuando el color del papel filtro no se ha tornado azul en 10 segundos. Las Enterobacterias son oxidasa negativa. Como control positivo de reacción se puede usar Pseudomona aeruginosa y como control negativo de reacción E.coli. 7.3.2.3 Anotar en el Registro RG-712.00-024. 7.3.3 Prueba de fermentación 7.3.3.1 Repicar en profundidad, usando un asa de inoculación, las mismas colonias seleccionadas para la prueba de oxidasa (7.3.2) en tubos de agar glucosa previamente aireado y enfriado. Incluir una cepa de E. coli como control positivo y una cepa Pseudomona aeruginosa como control negativo. 7.3.3.2 Incubar a 35 a 37 ºC por 24 ± 2 hrs. 7.3.3.3 Si se desarrolla un color amarillo a lo largo del contenido del tubo, la reacción se considera positiva. La mayoría de las cepas producen gas. 7.3.3.4 Anotar en el Registro RG-712.00-024 Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 4 de 6 PRT-712.03-046 7.4 EXPRESIÓN DE RESULTADOS 7.4.1 Contar el número de tubos que dan una reacción positiva para cada dilución. 7.4.2 Si una de las colonias seleccionadas es oxidasa negativa y glucosa positiva, el tubo del cual deriva el subcultivo es considerado positivo. 7.4.3 Usando la tabla de NMP, determinar el número de tubos positivos en las diferentes diluciones para calcular el índice de Número Mas Problable (NMP). 7.4.4 En el caso de productos líquidos, el número de Enterobacteriaceae por mL es calculado dividiendo el índice NMP por 10. 7.4.5 En caso de otros productos donde se prepara una suspensión inicial, el número por gramo es igual al índice NMP. 7.4.6 Expresar los resultados en gérmenes/ g o mL de muestra. 7.4.7 Es conocido que amplias variaciones pueden ocurrir en la técnica de NMP. Los resultados obtenidos por este método deberían ser usados con precaución. Los límites e confianza están dados en el anexo A de la norma (ISO 7402/1993). 8. REGISTROS Identificación del registro RG-712.00-004 Almacenamiento Protección Recuperación Tiempo retención y disposición Archivador rojo rotulado Acceso libre Papel Almacenar por 5 años Registro de Controles al personal y disponer en la basura laboratorio 348 del cortado en trozos. laboratorio 348. RG-712.00-006 Archivador rojo rotulado Acceso libre Papel Registro de Controles al personal laboratorio 348 del laboratorio 348. Almacenar por 5 años y disponer en la basura cortado en trozos. RG-712.00-024 Archivador azul rotulado Acceso libre Papel Registro de Lecturas de al personal Informe de Resultados del laboratorio de laboratorio enterobacterias 348. Almacenar por 5 años y disponer en la basura cortado en trozos. RG-712.00-050 Archivador rojo rotulado Acceso libre Papel Almacenar por 5 años Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos Identificación del registro 9. ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 5 de 6 PRT-712.03-046 Almacenamiento Protección Recuperación Tiempo retención y disposición Registro de Controles al personal y disponer en la basura laboratorio 348 del cortado en trozos. laboratorio 348. TABLA DE MODIFICACIONES Revisión Nº Pág. Modificada Página 2 punto 6.3.1 Página 2 punto 6.3.3 Página 2 punto 6.3.5 Página 3 Motivo del cambio Se incluye una recomendación del uso del medio de cultivo Se incluye una recomendación del uso del medio de cultivo El medio utilizado en la norma ISO 7402 es el agar glucosa Se incluyo etapa de aislamiento que no estaba considerada en el procedimiento Página 3 punto Se cambia la palabra 7.3.1.1 característica por la palabra típica Pagina 4 punto Se corrige un error en la 7.3.2 interpretación de resultados, dice “oxidasa positiva…..es considerado positivo” y lo correcto es “oxidasa negativa….es considerado positivo” Pagina 3 Punto Se incluye controles de calidad 7.2.4 Página 4 punto Se incluye los controles para las 7.3.3.1 y 7.3.2.2 pruebas confirmativas. Página 5 punto Indica que “Los límites de 7.4.7 confianza están dados en el anexo A”, se agrega las palabras (ISO 7402/1993). Fecha Aprobación 08/05/2008 08/05/2008 08/05/2008 08/05/2008 08/05/2008 08/05/2008 08/05/2008 08/05/2008 08/05/2008 Fecha emisión: 01/06/2002 Revisión: 4 Sección Microbiología de Alimentos ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TECNICA NUMERO MAS PROBABLE (NMP) Fecha revisión: 08/05/2008 Página 6 de 6 PRT-712.03-046 10. ANEXOS 10.1 Anexo Nº 1 RG-712.00-024, Registro de análisis de muestras de alimentos laboratorio Enterobacteria. 10.2 Anexo Nº 2 RG-712.00-050, Registro control de ambiente laboratorio Enterobacterias. 10.3 Anexo Nº 3 Anexo A General Guidance for the Enumeration of Enterobacteriaceae without resuscitation. –MPN technique and colony-count technique-ISO Número 7402/1993. 10.4 Anexo Nº 4 RG-712.00-004 Registro cepas control de Incubadoras. 10.5 Anexo Nº5 RG-712.00-006 Registro de Control de Esterilidad de Medios Cultivo utilizados en el Análisis de coliformes, coliformes fecales, E. coli y Enterobacterias